食源亚历山大藻核糖体DNA分子特征及其产毒特性的遗传差异
谷立慧,方 祥,钟青萍,廖振林,王 丽*
(华南农业大学食品学院,广东 广州 510642)
摘 要:亚历山大藻可代谢产生麻痹性贝毒素,对人类健康和食品安全造成严重威胁。以核糖体DNA为研究对象,利用生物信息学及计算机分析软件对食源亚历山大藻核糖体DNA的分子特征进行分析,并且对亚历山大藻的产毒特性进行遗传差异研究。聚合酶链式反应(polymerase chain reaction,PCR)扩增亚历山大藻核糖体18S rDNA-28S rDNA区域,利用DNAdist计算5.8S rDNA-ITS区域序列间距离值序数,同时,利用PCR-限制性片段长度多态性(restricted fragment length polymorphisms,RFLP)技术,对核糖体18S rDNA-28S rDNA进行测序分析,选择限制性内切酶MboⅡ绘制内切酶图谱。结果表明:亚历山大藻无毒株L35与产毒株在5.8S rDNA-ITS区域序列间核苷酸的差异值可达到0.201~0.488,与同属无毒亚历山大藻的核苷酸差异值<0.004;通过酶切图谱特征条带可以准确地将不同亚历山大藻种产毒类型分3 类,酶切图谱相似的藻种产生的毒素组分相同。因此,食源亚历山大藻产毒与否以及产毒类型体现为核糖体DNA遗传信息中存在显著差异。
关键词:亚历山大藻;核酸序列;毒素;分子生物学
谷立慧, 方祥, 钟青萍, 等. 食源亚历山大藻核糖体DNA分子特征及其产毒特性的遗传差异[J]. 食品科学, 2016, 37(15): 198-203. DOI:10.7506/spkx1002-6630-201615033. http://www.spkx.net.cn
GU Lihui, FANG Xiang, ZHONG Qingping, et al. Molecular characteristics of ribosome DNA and genetic difference of toxigenic characteristics of food-borne Alexandrium strains[J]. Food Science, 2016, 37(15): 198-203. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201615033. http://www.spkx.net.cn
当前,麻痹性贝毒素(paralytic shellfish poisoning,PSP)与人类健康和食品安全的关系受到越来越多的关注
[1]。亚历山大藻(Alexandrium)是一类在全世界海区都广泛分布的甲藻
[2-3],其中大部分种类都可以产生麻痹性贝毒素。在过去几十年中,亚历山大藻的爆发频率呈显著增加趋势,对海洋渔业、人类健康以及海洋食品的开发都造成严重危害,引起人们的日益重视
[4]。其中一个引起共同关注的理论问题是,亚历山大藻形态特征容易随环境变化而变化
[5],它们保守的形态学特征掩饰了其遗传上的多样性。因此,有必要在分子水平研究产毒藻种之间的遗传差异。核糖体DNA(ribosomal DNA,rDNA)普遍存在于所有的生物细胞中,并且具有相似的结构和功能,是目前可用于生物比较分析的指标
[6],并且rDNA基因已被证实是在不同系统水平上进行系统和进化分析的良好指标
[7-8]。综合众多的研究成果可知,在研究生物不同类群时,可采用rDNA序列中不同区域作为指标,核糖体小亚基rDNA基因、5.8S rDNA基因进化速率慢,常用于研究科级及以上遗传关系;28S rDNA的高变区和内源转录间隔区(internally transcribed spacer,ITS)进化速率比编码区快,一般用于属、种间甚至种群间的遗传关系。而包括5.8S rDNA在内的ITS区域既有保守区又有高变区,且长度适宜,成为目前对亚历山大藻进行遗传及分子特征差异分析的最为理想的研究区域。
不同有毒亚历山大藻产生的毒素种类不同。学者们对亚历山大藻毒素组成进行了大量研究
[9-10],发现不同藻种之间的毒素组成是不同的,不同株系的毒素组成也不一样。目前不同藻种之间藻毒素组成差异分析多采用高效液相色谱系统
[11]、反相色谱柱、二维蛋白电泳等
[12],还未发现在分子水平上研究鉴别亚历山大藻种之间产毒种类差别的报道。本实验将根据亚历山大藻核糖体5.8S rDNA-ITS区域序列信息,结合生物信息学知识和计算机分析软件,用分子生物学方法分析亚历山大藻的分子特征并讨论藻种在是否产毒的问题上的遗传差异。根据核糖体18S rDNA-28S rDNA序列信息,用限制性片段长度多态性聚合酶链反应(polymerase chain reactionrestriction fragment length polymorphism,PCR-RFLP)方法探讨亚历山大藻种的产毒种类与自身核糖体DNA的关系。研究结果将对亚历山大藻产毒特性的遗传信息研究提供一定的理论基础,同时对于保证海洋食品的安全开发和及时有效地监测贝类的生物污染提供有效的技术手段。
1 材料与方法
1.1 材料
实验所用藻种由暨南大学水生生物研究所和厦门大学近海海洋环境科学国家重点实验室提供,分离自近海鱼、贝类水产品,藻种信息见表1。
表1 藻种信息
Table 1 Information about algae tested in this study
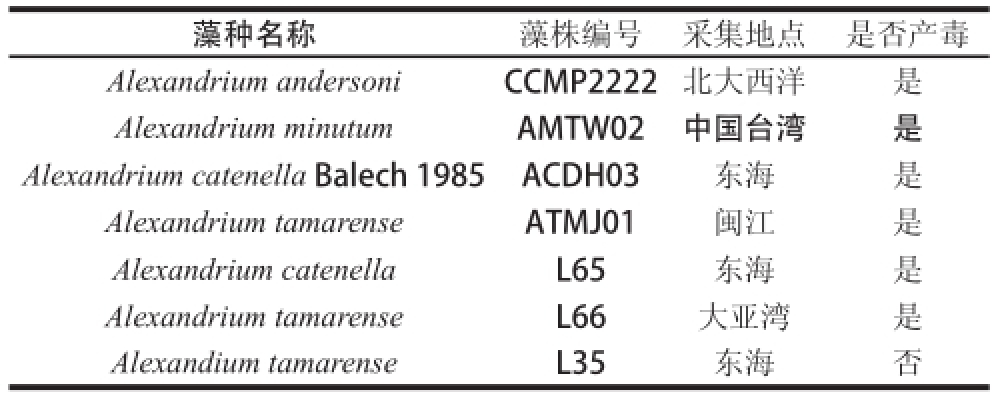
藻种名称藻株编号采集地点是否产毒Alexandrium andersoniCCMP2222北大西洋是Alexandrium minutumAMTW02中国台湾是Alexandrium catenella Balech 1985ACDH03东海是Alexandrium tamarenseATMJ01闽江是Alexandrium catenellaL65东海是Alexandrium tamarenseL66大亚湾是Alexandium tamarense L35东海否
藻种已通过光学显微镜及扫描电子显微镜形态观察,结合rDNA序列比较等方法鉴定其中6 株为产PSP藻种,而另一株塔玛亚历山大藻(Alexandrium tamarense)L35鉴定为无毒藻株。单藻种培养在含500 mL f/2培养液的1 000 mL锥形瓶中,接种密度约为160 个/mL,培养温度(20±1)℃,光照度为8 000 lx,由白色荧光灯供光,光/暗=12 h/12 h。每天定时晃动锥形瓶2 次,每周更换培养基1 次。每天早上09:00取藻液滴于浮游生物计数框上,在光学显微镜下镜检计数。
1.2 方法
1.2.1 藻基因组DNA的提取
藻种接种培养后,在每天早上09:00取样,镜检计数,作细胞生长曲线。根据亚历山大藻的生长曲线,设定在第7、12、19天用低温高速离心方法收集细胞。4 ℃、8 000 r/min离心收集100 mL稳定生长期亚历山大藻细胞,-80 ℃冷冻10 min,然后立即置于65 ℃温育10 min,反复冻融3 次。加入10%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)和蛋白酶K,37 ℃保温1 h,再用质量分数0.4%的β-巯基乙醇、0.8%的聚乙烯吡咯烷酮在65 ℃条件下保温1 h去除多酚,接着用溴化十六烷基三甲铵(cetyltrimethyl ammonium bromide,CTAB)-NaCl溶液将可溶性多糖成分分离,氯仿-异戊醇抽提蛋白质,最后用冰的无水乙醇洗涤沉淀DNA并除盐。提取后的DNA用紫外分光光度法测量浓度、纯度,并结合电泳分析观察基因组质量。
1.2.2 PCR扩增核糖体18S rDNA-28S rDNA区域及产物纯化、测序
1.2.2.1 引物设计
根据核糖体DNA的结构组成,分别在18S rDNA小亚基位置和28S rDNA大亚基位置设计一对引物,向5.8S方向扩增。引物a利用的是甲藻18S rDNA专一引物(5’-TGTCTCAAAGATTAAGCCATG-3’),引物b利用的是亚历山大藻属28S rDNA区域特异性引物(5’- CCTTGGTCCGTGTTTCAAGA-3’)
[13-14]。
1.2.2.2 PCR扩增及反应程序
50 μL PCR反应液组成:1 μL模板、30 pmol各引物、1.25 U Taq DNA聚合酶、2 μL脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(10 mmol/L)、5 μL l×ThermoPol Buffer。扩增循环条件为:94 ℃预变性5 min,之后94 ℃变性30 s;52 ℃退火1 min;72 ℃延伸2 min,共30 个循环,最后延伸7 min,扩增产物置于-20 ℃保存。取2 μL产物在1.2%琼脂糖凝胶电泳检测,溴化乙锭(ethidium bromide,EB)染色。电泳条件:100 V,30 min
[15]。
1.2.2.3 PCR产物纯化、测序
PCR扩增产物用DNA凝胶纯化试剂盒进行纯化,纯化后的DNA片段送上海英骏生物有限公司测序。
1.2.3 序列分析
在美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)服务器上(http://www. ncbi.nih.gov)用BLAST(Basic Local Alignment Search Tool)进行同源检测,证实所得序列为ITS1、ITS2、5.8S rDNA以及部分18S rDNA、28SrDNA区域。实验测得的序列和甲藻ITS序列(来自GenBank)用计算机软件进行序列对齐排序和比较、序列间距离值序数(K
nuc值)计算。以计算机分析软件包Phylip version 3.5中的DNAdist进行计算。
1.2.4 PCR-RFLP分析产毒株毒素组成与核糖体DNA的关系
PCR-RFLP分析方法是在RFLP分析方法的基础上发展建立的一种更为简便的DNA分型技术。该方法基本原理是利用PCR扩增出目的DNA,扩增产物再用特异性内切酶消化切割成不同大小和不同数量的片段,通过凝胶电泳分离,电泳图谱呈现多态性条型。将6 种产毒亚历山大藻核糖体18S rDNA-28S rDNA区域测序,所得序列用CLUSTALW软件进行多重比对,寻找保守序列。用Bioedit软件分析序列并找到能同时有5 个以上酶切位点的限制性内切酶,按照内切酶种类常见、价格低廉,酶切条带电泳位置差异明显的原则选择内切酶(具体软件操作:打开Bioedit软件系统,输入6 条序列,在sequence命令下打开Nucleic Acid项目,选择Restriction Map运行)。选定限制性内切酶后,进行内切酶消化反应:20 μL内切酶消化体系包括10×酶切反应缓冲液2 μL、PCR产物8 μL、限制性内切酶1 μL,无菌双蒸水补足至20 μL。在37 ℃条件下放置反应1 h后,加入2μL 10×Loading Buffer终止反应。酶切后的产物进行琼脂糖凝聚电泳分析:电压100 V,电泳25 min左右。
2 结果与分析
2.1 亚历山大藻核糖体18S rDNA-28S rDNA区域PCR扩增结果
7 株亚历山大藻核糖体片段18S rDNA-28S rDNA区域经PCR扩增反应成功获得,电泳结果见图1。

图1 7 株亚历山大藻核糖体DNA18S rDNA-28S rDNA片段的PCRR扩增结果
Fig. 1 PCR results of the fragments of 18S-28S ribosomal DNA region in seven Alexandrium strains
由图1可知,使用PCR技术可以成功地扩增出7 株亚历山大藻对应的DNA片段,测序结果经在NCBI上进行BLAST分析证实为亚历山大藻的rDNA片段。
2.2 亚历山大藻5.8S rDNA-ITS区序列分子特征分析结果
将7 株亚历山大藻的核糖体测序结果去掉18S rDNA和28S rDNA序列,得到这7 株亚历山大藻的5.8S rDNA-ITS区序列长度分别是:微小亚历山大藻A. minutum AMTW02,516 bp;链状亚历山大藻A. catenella ACDH03,515 bp;塔玛亚历山大藻A. tamarense ATMJ01,513 bp;链状亚历山大藻A. catenella L65,515 bp;塔玛亚历山大藻A. tamarense L66,516 bp;爱德森亚历山大藻A. andersoni CCMP2222,514 bp;塔玛亚历山大藻A. tamarense L35,513 bp。
再将亚历山大藻的5.8S rDNA-ITS区域与从GenBank获得的系统发育关系较近的甲藻序列进行比较。采用计算机分析软件包PCgene 6.0对所获得的亚历山大藻属7 种12 个株系的rDNA-ITS区全序列进行排列和比较。以计算机分析软件Phylip version 3.5的DNAdist计算K
nuc值(根据Kimura的two-parameter model)得出:1)同种有毒藻种A. tamarense或A. catenella,个体之间根据核苷酸差异计算得出K
nuc值很小(<0.01),但是种与种之间ITS区核苷酸差异较大,K
nuc值>0.2;2)初步鉴定为无毒的A. tamarense L35,其分子水平上表现出与有毒株系较大的差异,与有毒A. tamarense ATMJ01的核苷酸差异值达到0.221,与有毒A. catenella L65差异值达到0.365;而与无毒的A. tamarense WKS-1和A. tamarense CU-15的核苷酸差异较小,分别为0.003和0.004;3)A. pseudogonyaulax和A. insuetum为比较类群种变异相对较大的2 个种,与各个种的差异值分别为0.478~0.526和0.435~0.511。各序列之间序列比较结果见表2。
表2 亚历山大藻属不同种及不同株系rDNA ITS区序列(K
nnuucc)比较结果
Table 2 Distance values (K
nuc) between rDNA ITS sequences of 12 representative species or strains of Aeardrium

注:+. 有毒;-. 无毒。
种名株系毒性A. minutum AMTW02 A. catenella ACDH03 A. tamarense ATMJ01 A. catenella L65 A. tamarense L66 A. andersoni CCMP2222 A. tamarense WKS-1 A. tamarense CU-15 A. affi ne H1 A. insuetum S1 A. pseudogonyaulas H1 A. minutumAMTW02 A. catenellaACDH03+0.210 A. tamarenseATMJ01+0.2170.215 A. catenellaL65+0.2160.0050.215 A. tamarenseL66+0.2120.2110.0060.210 A. andersoniCCMP2222+0.2250.2360.2100.2240.233 A. tamarenseWKS-1-0.3600.2180.3520.3090.2860.397 A. tamarenseCU-15-0.2840.2300.3260.3780.2790.3850.005 A. affi neH1-0.2000.2450.2280.2670.2520.2360.4310.443 A. insuetumS1-0.4540.4870.4960.4780.4930.4760.5110.4980.435 A. pseudogonyaulasH1-0.5100.5010.4820.4930.5050.4870.5260.5230.4780.502 A. tamarenseL35-0.3820.2050.2210.3650.2010.3980.0030.0040.4190.4880.459
亚历山大藻其属下不仅包含一半以上的有毒藻种类,而且根据毒性大小差异,有的种类还可划分为有毒株和无毒株
[16]。那么,这些毒性不同但是形态上却相似的株系,其基因水平上是否存在差异呢?本实验所研究的对象无毒亚历山大藻L35株系,形态上鉴定为A. tamarense,与有毒的A. tamarense形态特征基本相同。但是,无毒亚历山大藻L35在5.8S rDNA-ITS区序列特征上却表现出与有毒的A. tamarense较大的差异,序列间核苷酸的差异值可达到0.201~0.488,与无毒的A. tamarense的核苷酸差异值<0.004。这些比较结果表明,Alexandrium有毒株和无毒株在核糖体DNA序列上存在显著的遗传差异。
2.3 核糖体18S rDNA-28S rDNA区域PCR-RFLP结果分析
为研究产毒藻的核糖体分子特征差异,对6 株产毒亚历山大藻核糖体DNA的扩增产物进行测序,得到6 株藻的18S rDNA-28S rDNA序列长度分别为:微小亚历山大藻A. minutum AMTW02,2 967 bp;链状亚历山大藻A. catenella ACDH03,3 018 bp;塔玛亚历山大藻A. tamarense ATMJ01,3 008 bp;链状亚历山大藻A. catenella L65,3 015 bp;塔玛亚历山大藻A. tamarense L66,3 016 bp;爱德森亚历山大藻A. andersoni CCMP2222,2 985 bp。
通过序列信息分析比较,选择MboⅡ限制性内切酶用于本次PCR产物酶切实验。由图2A(模拟图谱)可知,MboⅡ用于酶切核糖体扩增产物时,理论上可以切出3 种DNA条型,并且,酶切条带电泳位置差异明显。电泳实验结果见图2B,A. catenella ACDH03、A. tamarense ATMJ01、A. catenella L65和A. tamarense L66条型较为一致,并且与其他两种藻的图谱有明显差异。这4 株藻有3 条共同的DNA片段,大小分别为1 000 bp左右、640 bp和295 bp左右,与预测结果基本一致。另外,A. minutum AMTW02和A. andersoni CCMP2222的酶切图谱也基本与预测结果一致。A. minutum在865 bp左右有一条区别于A. tamarense、A. catenella的特征条带;A. andersoni在800 bp左右有一条特征条带,均与预计酶切片段大小相符。以上结果说明,本实验选择的限制性内切酶酶切位点合适,酶切片段大小分布合理。
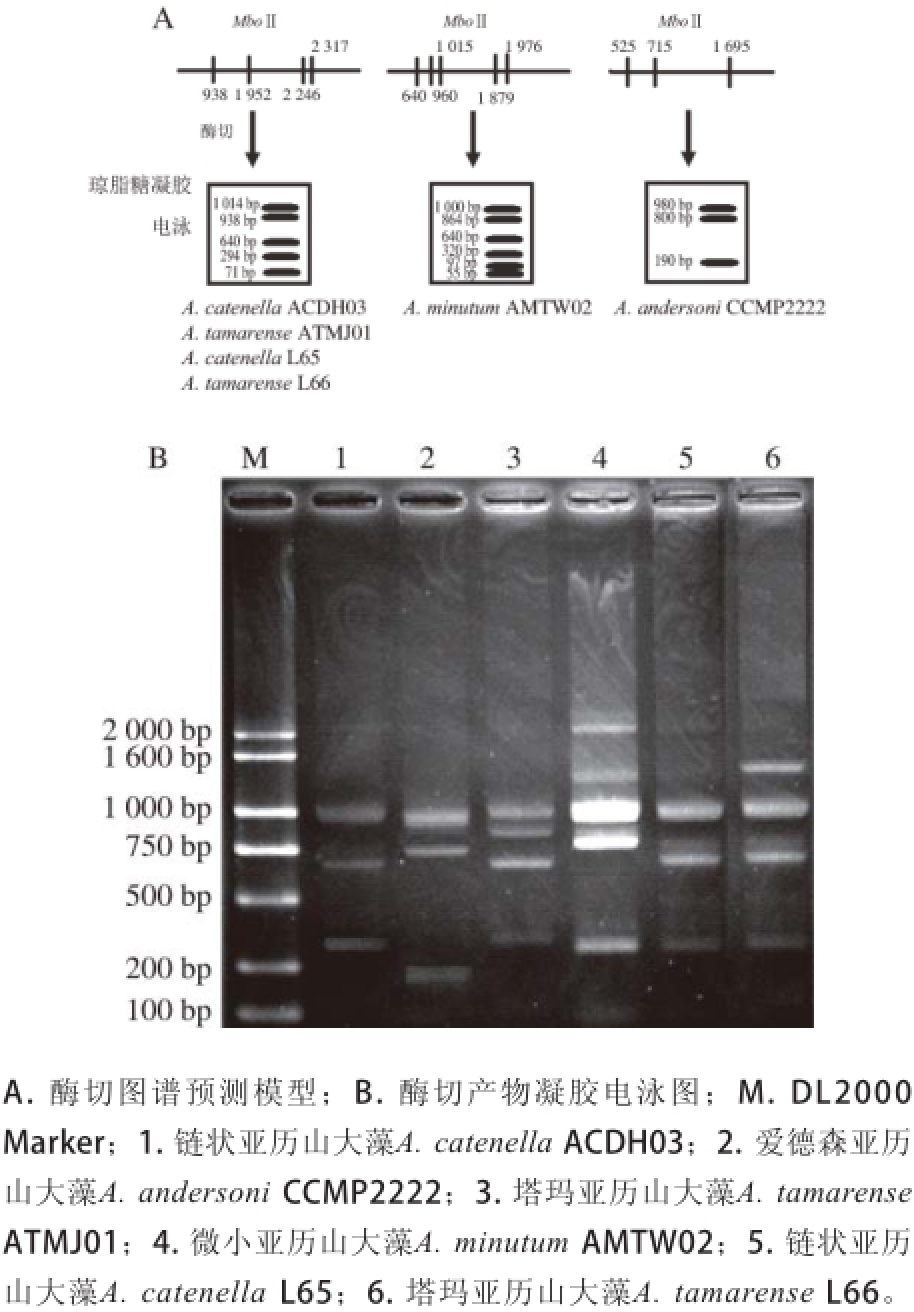
图2 产毒亚历山大藻限制性酶切图谱
Fig. 2 Restriction endonuclease maps of toxic Alexandrium
亚历山大藻产生的神经麻痹性贝毒素是由多种不同的组分组成的。根据PSP分子结构中R4基团的不同,毒素可分为4 类:1)氨基甲酸酯类毒素,包括石房蛤毒素(saxitoxin,STX)、新石房蛤毒素(neoSTX)、膝沟藻毒素(gonyautoxin,GTX)1~4;2)N-磺酰氨甲酰基类毒素(N-sulfocarbamoyl toxins),包括GTX5(B1)、GTX6(B2)、C1~4;3)脱氨甲酰基类毒素(decarbamoyl toxins),包括dcSTX、dcneoSTX、dcGTX1~4;4)脱氧脱氨甲酰基类毒素(deoxydecarbamoyl toxins),包括doSTX、doGTX2,3。研究资料表明,产毒亚历山大藻藻种之间产生毒素的组成成分差别很大
[9,17-18]。A. tamarense和A. catenella藻种产生毒素的成分主要以STX、C2、GTX毒素为主,3 种毒素含量占所含毒素总量的85%~90%以上。有研究表明
[19],A. tamarense ATHK中毒素的主要组分为GTX1、4、5、6及C毒素,其中毒素含量最高的为GTX。刘晓丽等
[20]对中国东海一株A. catenella进行分析表明,该藻的毒素成分主要为GTX5、GTX4和C2,其中GTX5含量达到了52%。A. catenella ACDH主要含有C毒素,同时含有GTX1、3、4毒素
[19]。A. minutum产生毒素成分主要有GTX-1、GTX-2、GTX-3,其含量占总量的75%~85%。A. minutum AM-1主要含有GTX1、2、3、4及少量的neoSTX毒素
[19]。卞中园等
[21]用高效液相色谱技术检测到A. minutum AMTW株系含有的毒素为GTX1-4。而A. andersoni产生毒素的组分主要以C1和C2为主,含量占毒素总量的65%~85%。从图2限制性内切酶图谱可看出,酶切类型分3 类,酶切图谱相似的藻种产生的毒素组分是相同的,利用PCR-RFLP方法,通过扩增产物的酶切图谱特征条带可以快速初筛亚历山大藻所产的麻痹性贝毒素类型。
3 结 论
针对亚历山大藻18S rDNA-28S rDNA核糖体DNA进行PCR扩增,对其中的5.8S rDNA-ITS区域序列信息利用计算机软件和生物信息学手段进行比较分析。通过计算遗传距离,发现无毒A. tamarense L35在系统发育关系上表现出与有毒亚历山大藻存在较大的差异,序列间核苷酸的差异值可达到0.201~0.488,系统发育关系远;与无毒亚历山大藻的核苷酸差异值<0.004,系统发育关系近。研究结果证明,亚历山大藻有毒株与无毒株在核糖体DNA信息上存在显著遗传差异。在今后的实验中,将增加标准菌株种类,更加深入地研究食源亚历山大藻DNA分子特征及其产毒特性的遗传差异。
有毒亚历山大藻不同藻种之间产生的毒素组分是不同的,目前毒素组分的鉴定手段还比较繁冗。基于此问题,本实验设计使用PCR-RFLP方法,针对亚历山大藻18S rDNA-28S rDNA扩增产物进行测序,并选择了合适的内切酶MboⅡ,通过酶切图谱特征条带可以准确地将不同亚历山大藻种产毒类型分3 类,酶切图谱相似的藻种产生的毒素组分是相同的,同时也证明产毒藻毒素的组成成分与rDNA遗传信息密切相关。
开发海洋藻类作为普通食品或者功能性食品是食品工业研究的热点
[22-23]。但是,海洋中广泛存在的产毒素藻类,如亚历山大藻及其产生的麻痹性贝毒素对食品的深度加工安全造成严重威胁,是人类健康面临的非常严峻的公共卫生问题
[24]。目前对亚历山大藻及其产生的麻痹性贝毒素的监测已有多种技术手段
[25],但是,对其个体产毒差异的分子基础研究还比较薄弱。而深层次的遗传特征分析、分子特征识别是精确、快速鉴定产毒素亚历山大藻的基础。因此,为有效防止麻痹性贝毒素对食品安全和公众健康的影响,今后应该在对产毒亚历山大藻进行深入的分子研究基础上,建立完善的监测体系,预防麻痹性贝毒素进入食物链,杜绝重大食品中毒事件的发生。
参考文献:
[1] SEPHTON D H, HAYA K, MARTIN J L, et al. Paralytic shellfish toxins in zooplankton, mussels, lobsters and caged Atlantic salmon,Salmo salar, during a bloom of Alexandrium fundyense off Grand Manan Island, in the Bay of Fundy[J]. Harmful Algae, 2007, 6(5): 745-758. DOI:10.1016/j.hal.2007.03.002.
[2] ANDERSON D M, KULIS D M, DOUCETTE G J, et al. Biogeography of toxic dinoflagellates in the genus Alexandrium from the northeastern United States and Canada[J]. Marine Biology, 1994,120: 467-468. DOI:10.1007/BF00680222.
[3] HALLEGRAEFF G M, MCCAUSLAND M A, BROWN R K. Early warning of toxic dinoflagellate blooms of Gymnodinium catenatum in southern Tasmanian waters[J]. Journal of Plankton Research, 1995,17: 1163-1176. DOI:10.1093/plankt/17.6.1163.
[4] 梁忠秀, 李健, 李吉涛, 等. 塔玛亚历山大藻毒素及其对中国对虾的急性毒性[J]. 中国水产科学, 2014, 21(6): 1260-1267. DOI:10.3724/ SP.J.1118.2014.01260.
[5] GU H F, ZENG N, LIU T T, et al. Morphology, toxicity, and phylogeny of Alexandrium (Dinophyceae) species along the coast of China[J]. Harmful Algae, 2013, 27: 68-81. DOI:10.1016/ j.hal.2013.05.008.
[6] LUCA G, ELENA B, ANTONELLA P, et al. Analysis of rRNA gene content in the Mediterranean dinoflagellate Alexandrium catenella and Alexandrium taylori: implications for the quantitative real-time PCR-based monitoring methods[J]. Journal of Applied Phycology, 2010,22(1): 1-9. DOI:10.1007/s10811-009-9411-3.
[7] LIM E L, AMARAL L A, CARON D A, et al. Application of rRNA-based probes for observing marine nanoplanktonic protists[J]. Applied and Environmental Microbiology, 1993, 59: 1647-1655.
[8] NAGAIS S, LIAN C, YAMAGUCHI S, et al. Microsatellite markers reveal population genetic structure of the toxic dinoflagellate Alexandrium tamarense (Dinophyceae) in Japanese coastal waters[J]. Journal of Phycology, 2007, 43: 43-54. DOI:10.1111/j.1529-8817.2006.00304.x.
[9] CIMINIELLO P, DELL’AVERSANO C, FATTORUSSO E, et al. Toxin profile of Alexandrium ostenfeldii (Dinophyceae) from the Northern Adriatic Sea revealed by liquid chromatography-mass spectrometry[J]. Toxicon, 2006, 47(5): 597-604. DOI:10.1016/ j.toxicon.2006.02.003.
[10] WANG D Z, HSIEH D P H, Growth and toxin production in batch cultures of a marine dinoflagellate Alexandrium tamarense HK9301 isolated from the South China Sea[J]. Harmful Algae, 2005, 4(2): 401-410. DOI:10.1016/j.hal.2004.07.002.
[11] 吴振兴, 鲍蕾, 雷质文, 等. 麻痹性贝毒毒素的高效液相色谱-串联质谱检测方法研究[J]. 海洋湖沼通报, 2013(4): 66-72. DOI:10.13984/ j.cnki.cn37-1141.2013.04.014.
[12] CHAN L L, HODGKISS I J, LAM P K S, et al. Use of twodimensional gel electrophoresis to differentiate morphospecies of Alexandrium minutum, a paralytic shellfish poisoning toxin-producing dinoflagellate of harmful algal blooms[J]. Proteomics, 2005, 5(6): 1580-1593. DOI:10.1002/pmic.200401020.
[13] CORDOVA J L, MULLER I. Use of PCR and partial sequencing of the large-subunit rRNA gene to identify Alexandrium catenella(Dinophyceae) from the South of Chile[J]. Harmful Algae, 2002, 1(4): 343-350. DOI:10.1016/S1568-9883(02)00066-5.
[14] 陈月琴, 屈良鹄, 邱小忠, 等. 甲藻单个细胞DNA的制备及在赤潮藻类分子鉴定中的应用[J]. 中山大学学报(自然科学版), 1997, 36(4): 66-69. DOI:10.3321/j.issn:0529-6579.1997.04.003.
[15] WANG L, LI L, ALAM M J, et al. Loop-mediated isothermal amplification method for rapid detection of the toxic dinoflagellate Alexandrium, which causes algal blooms and poisoning of shellfish[J]. FEMS Microbiology Letters, 2008, 282(1): 15-21. DOI:10.1111/ j.1574-6968.2008.01074.x.
[16] KIM C J, SAKO Y. Molecular identification of toxic Alexandrium tamiyavanichii (Dinophyceae) using two DNA probes[J]. Harmful Algae, 2005, 4(6): 984-991. DOI:10.1016/j.hal.2005.01.003.
[17] JOHN U, FENSOME R A, MEDLIN L K. The application of a molecular clock based on molecular sequences and the fossil record to explain biogeographic distributions within the Alexandrium tamarense“species complex” (Dinophyceae)[J]. Molecular Biology and Evolution, 2003, 20(7): 1015-1027. DOI:10.1093/molbev/msg105.
[18] ERDNER D L, ANDERSON D M. Global transcriptional profiling of the toxic dinoflagellate Alexandrium fundyense using massively parallel signature sequencing[J]. BMC Genomics, 2006, 7: 88. DOI:10.1186/1471-2164-7-88.
[19] 陈洋, 颜天, 谭志军, 等. 四种/株亚历山大藻(Alexandrium)毒性的比较研究[J]. 海洋与湖沼, 2007, 38(1): 55-61. DOI:10.3321/j.issn:0029-814X.2007.01.009.
[20] 刘晓丽, 章超桦, 解万翠, 等. 链状亚历山大藻的培养及麻痹性贝类毒素的提取和检测[J]. 水产学报, 2010, 34(11): 1783-1788. DOI:10.3724/SP.J.1231.2010.07036.
[21] 卞中园, 杨锡洪, 解万翠, 等. 初始密度对微小亚历山大藻生长及产麻痹性贝类毒素的影响[J]. 水产学报, 2013, 37(1): 78-85. DOI:10.3724/SP.J.1231.2013.38266.
[22] SUHAILA M, SITI N H, HAFEEDZA A R. Seaweeds: a sustainable functional food for complementary and alternative therapy[J]. Trends in Food Science & Technology, 2012, 23(2): 83-96. DOI:10.1016/ j.tifs.2011.09.001.
[23] 王冬琴, 谭瑜, 卢虹玉, 等. 微藻生物活性物质在食品工业中的应用进展[J]. 现代食品科技, 2013, 29(5): 1185-1191. DOI:10.13982/ j.mfst.1673-9078.2013.05.051.
[24] 黄根华, 彭燕超. 麻痹性贝毒毒素(PSP)及其产毒藻对海洋鱼类危害的研究[J]. 中国新技术新产品, 2010(8): 17-18. DOI:10.3969/ j.issn.1673-9957.2010.08.016.
[25] 李芳, 李雪梅, 李献刚, 等. 贝类毒素检测方法研究概况[J]. 食品研究与开发, 2015, 36(23): 184-186. DOI:10.3969/j.issn.1005-6521.2015.23.048.
Molecular Characteristics of Ribosome DNA and Genetic Difference of Toxigenic Characteristics of Food-Borne Alexandrium Strains
GU Lihui, FANG Xiang, ZHONG Qingping, LIAO Zhenlin, WANG Li
*
(College of Food Science, South China Agricultural University, Guangzhou 510642, China)
Abstract:Paralytic shellfish poisoning could be caused by the toxin produced by Alexandrium strains, which seriously threatens human health and food safety. Molecular characteristics of ribosome DNA and toxic characteristics of foodborne Alexandrium species were analyzed by bioinformatics and computer analysis software. The 18S rDNA-28S rDNA region was amplified by PCR method, and 5.8S rDNA-ITS region was calculated by using DNAdist program. Moreover, th e 18S rDNA-28S rDNA region was sequenced by PCR restricted fragment length polymorphisms (RFLP) method, and Mbo II was selected for restriction endonuclease mapping. The results showed that nucleotide sequence differences in the 5.8S rDNA-ITS region between non-toxic strain Alexandrium L35 and toxic strains could reach 0.201-0.448, while values < 0.004 were noted among non-toxin strains. T oxin could be distinguished into three types by the characteristic bands of endonuclease map, and toxin components were same if strains had similar endonuclease map. Hence toxin production ability and toxin types of Alexandrium strains reflected significant genetic differences in ribosome DNA.
Key words:Alexandrium; nucleic acid sequences; toxins; molecular biology
DOI:10.7506/spkx1002-6630-201615033
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2016)15-0198-06
收稿日期:2015-11-17
基金项目:广东省科技计划项目(2016A040403103);2015年度国家星火计划项目(2015GA780080);国家自然科学基金青年科学基金项目(31301445);华南农业大学精品资源共享课《食品微生物检验学》项目(bkjx2015058)
作者简介:谷立慧(1994—),女,硕士研究生,研究方向为食品、健康与系统生物学。E-mail:632716259@qq.com
*通信作者:王丽(1980—),女,副教授,博士,研究方向为食品、健康与系统生物学。E-mail:wangli_scau@scau.edu.cn
引文格式:



