方小明 1,2,田文礼 2,张晓琳 1,彭文君 2,肖红伟 1,高凌宇 2,王灿红 3,高振江 1,*
(1.中国农业大学工学院,北京 100083;2.中国农业科学院蜜蜂研究所,北京 100093;3.中国医学科学院 北京协和医学院药用植物研究所,北京 100193)
摘 要:目的:探讨不同干燥方法提取的荷花粉多糖(lotus bee pollen polysaccharides,LP)对5-氟尿嘧啶(5-fluorouracil,5-Fu)所致小鼠肠道黏膜损伤及功能失调的改善作用。方法:分别采用热风干燥与真空脉动干燥的方法对荷花粉进行干燥,并提取多糖。建立5-Fu小鼠肠黏膜炎模型,随机分组、给药。炭末推进法测定小鼠的肠推进率,并测量小鼠结肠长度;计算全肠道派氏集合淋巴结(Peyer’s patches,PPs)的面积;取小鼠结肠组织进行病理组织切片观察;生物化学方法检测PPs匀浆上清液中活性氧(reactive oxygen species,ROS)和谷胱甘肽(glutathione,GSH)含量、过氧化氢酶(catalase,CAT)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力;酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)法检测PPs匀浆上清中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的含量。结果:与正常组相比,5-Fu可显著抑制小鼠肠道的推进功能(P< 0.05)。热风干燥与真空脉动干燥样品中提取的LP能减缓5-Fu所致的结肠缩短(P<0.05),显著或极显著增加小鼠肠道PPs的面积(P<0.05或P<0.01);此外,与5-Fu组比较,LP与5-Fu联合应用能明显促进小鼠肠道的推进功能(P<0.05),升高GSH含量、CAT和GSH-Px活力(P<0.01或P<0.05),明显减少TNF-α含量(P<0.05或P<0.01);结肠病理组织切片显示LP能明显减轻5-Fu所致的小鼠结肠黏膜上皮杯状细胞丢失、隐窝深度变浅及炎症细胞浸润。结论:LP能够减轻5-Fu所致小鼠结肠黏膜炎,改善5-Fu所致的肠道传输功能失调,保护5-Fu对肠道的氧化损伤,其中真空脉动干燥样品中提取的花粉多糖效果更好。
关键词:荷花粉多糖;5-氟尿嘧啶;肠黏膜屏障;氧化损伤;干燥方式
方小明, 田文礼, 张晓琳, 等. 荷花粉多糖显著减轻氟尿嘧啶所致小鼠肠道黏膜屏障损伤[J]. 食品科学, 2016, 37(15): 209-214. DOI:10.7506/spkx1002-6630-201615035. http://www.spkx.net.cn
FANG Xiaoming, TIAN Wenli, ZHANG Xiaolin, et al. Lotus bee pollen polysaccharides significantly relieve intestinal mucosal barrier damage in mice caused by fluorouracil[J]. Food Science, 2016, 37(15): 209-214. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201615035. http://www.spkx.net.cn
多糖作为一类天然生物大分子,其来源丰富、成本低廉、无毒,且药理作用广泛,如杏鲍菇多糖、灵芝多糖、茯苓多糖、香菇多糖等,它们在抗肿瘤、抗病毒、抗炎、抗氧化等方面均取得了良好疗效 [1-5],其中抗肿瘤和免疫增强作用是其研究的热点,尤其与化疗药物合用的减毒增效作用受到了广泛关注。蜂花粉多糖是蜂花粉重要的有效成分之一,蜂花粉中糖类总含量约为25%~40%,糖类种类齐全,包括单糖(如葡萄糖、果糖等)、低聚糖和多糖 [6],其中最具有功效开发前景的是花粉多糖 [7-8]。大量研究表明,花粉多糖具有良好的免疫调节能力 [9]、抗炎 [10]及抗肿瘤活性 [11]。鲜花粉含水量高达20%~30%,不宜贮存。干燥能够使花粉含水率降低至安全贮藏水平,是蜂花粉加工的必要步骤,干燥后的花粉也是其商品化流通的基本形式 [12]。花粉多糖属于热敏性物质,因此选择适宜的干燥方法对于保证花粉品质至关重要。而目前不同干燥方式对花粉多糖活性的影响还未见报道。
化疗是恶性肿瘤患者常用且有效的治疗方法之一,但是化疗药物、特别是大剂量应用时常对机体正常生长旺盛的组织造成严重损伤。化疗导致的肠黏膜屏障功能障碍在全身感染、炎性反应综合征和多器官功能障碍综合征的发病中有着重要影响 [13]。5-氟尿嘧啶(5-f luorouracil,5-Fu)是临床上用于治疗消化道肿瘤和乳腺癌的基本药物 [14]。然而,临床应用发现5-Fu具有较强的毒副作用,如引起胃肠道黏膜炎并造成机体免疫功能及造血功能低下等 [15-16]。为观察荷花粉多糖是否能够改善5-Fu所致小鼠肠黏膜炎及具有肠道保护作用,本实验采用不同干燥方式加工荷花粉,并提取多糖,通过腹腔注射5-Fu建立小鼠肠黏膜炎模型,测定荷花粉多糖对小鼠肠道推进作用、派氏集合淋巴结(Peyer’s patches,PPs)面积、PPs匀浆上清液中脂质过氧化指标、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平及结肠病理、炎症相关指标的影响,探讨不同干燥方式下荷花粉多糖对5-Fu所致小鼠肠黏膜炎的改善及肠道功能的保护作用,以及可能作用机制,为荷花粉多糖的加工及深入开发提供理论依据。
1.1 动物、材料与试剂
无特定病原体(specifi c pathogen free,SPF)级雌性C57BL/6J小鼠,体质量(18±2) g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。按啮齿类动物饲养方法和条件饲养于SPF级动物房。
新鲜荷花粉,购于中国农业科学院蜜蜂研究所,初始湿基含水率为31%,置于冰柜((-10±1)℃)中密封保存。
5-氟尿嘧啶注射液 上海旭东海普药业有限公司;活性氧(reactive oxygen species,ROS)试剂盒、谷胱甘肽(glutathione,GSH)试剂盒、过氧化氢酶(catalase,CAT)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒 南京建成生物工程研究所;TNF-α酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)试剂盒 武汉华美生物工程有限公司;乙醚、氯仿、正丁醇、冰醋酸、甲醛及其他试剂均为国产分析纯。
1.2 仪器与设备
真空脉动干燥机 中国农业大学工学院农产品加工技术与装备实验室自制;WD101-2型电热鼓风干燥箱吴江万达电热设备有限公司;BCN-1360生物洁净工作台北京东联哈尔仪器制造有限公司;5410二氧化碳培养箱美国Napco公司;MQX 200酶标仪 美国Bio-Tek公司;CKX 41荧光倒置显微镜 日本Olympus公司;Labofuge 400R离心机 德国Heraeus公司。
1.3 方法
1.3.1 荷花粉干燥及多糖提取
分别采用热风干燥及真空脉动干燥方法处理新鲜荷花粉:热风干燥温度为60 ℃;脉动干燥温度60 ℃,真空保持时间12 min,常压保持时间3 min,两种方法均需将花粉干燥至目标含水率5%(湿基)。干燥完成后将样品封存于聚乙烯袋中,置于干燥皿中保存。
荷花粉多糖提取 [17]流程为:荷花粉→乙醚脱脂→超声热水浸提→加入果胶酶水提→离心取上清液→残渣重复浸提2 次→合并上清液→减压浓缩→乙醇沉淀→沉淀加水复溶→Sevag法除蛋白→透析(除盐及小分子杂质)→浓缩→冷冻干燥→荷花粉多糖。
1.3.2 动物分组及给药
健康雌性C57BL/6J小鼠32 只,随机分为4 组,每组8 只:正常组、5-Fu组(25 mg/kg)、热风LP组(热风干燥LP 200 mg/kg+5-Fu 25 mg/kg)、脉动LP组(真空脉动干燥LP 200 mg/kg+5-Fu 25 mg/kg)组。正常组灌胃给予蒸馏水,20 mL/kg;LP组灌胃给药,20 mL/kg;5-Fu组腹腔注射给药,10 mL/kg,1 次/2 d。各组均连续给药14 d。
1.3.3 LP对小鼠肠道功能的影响
给药最后一天,提前6 h禁食,正常饮水。末次给药1.5 h后,给每只小鼠灌胃炭末混悬液(阿拉伯胶10%、活性炭5%)0.2 mL。灌胃后20 min颈椎脱臼处死小鼠,剖腹取小肠,测量炭末推进前端的位置及小肠总长度,按照下式计算炭末推进率。
收集从幽门下端至回盲部的全部小肠组织,肉眼目测观察位于其肠系膜对侧的PPs,记录PPs个数并用尺测量计算其总面积。
剪取结肠,测量结肠长度,并将结肠部分组织置于10%甲醛中固定,进行组织病理切片观察及免疫组化检测。
1.3.4 LP对小鼠相关生化指标的影响
剪取并称取一定质量的1.3.3节中所述小肠外壁上隆起的PPs或结肠组织,按1∶9(m/m)加入生理盐水,冰浴、充分匀浆, 4 ℃、3 000 r/min离心15 min,取上清液-80 ℃保存,按照试剂盒说明书操作要求测定相应指标。
1.4 数据统计分析
采用SPSS 17.0统计软件进行单因素方差分析,比较组间差异性,实验数据用
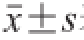 表示,P<0.05或P<0.01认为差异具有统计学意义。
表示,P<0.05或P<0.01认为差异具有统计学意义。
2.1 不同干燥方式提取的LP对小鼠小肠长度及推进功能的影响
表1 荷花粉多糖对5-Fu模型小鼠小肠长度及炭末推进率的影响
TTaabbllee 11 EEffffeecctt ooff LLPP oonn ssmmaallll iinntteessttiinnaall lleennggtthh aanndd ccaarrbboonn--pprrooppeelllliinngg rate in model mice induced by 5-Fu


注:*.与正常组相比,差异显著(P<0.05);#. 与5-Fu组相比,差异显著(P<0.05)。下同。
组别小肠全长/cm炭末推进长度/cm炭末推进率/%正常组52.09± 2.0629.87±2.9757.34±4.65 5-Fu组48.58±1.8124.64±1.36*49.67±5.01*热风LP组50.65±1.9730.45±3.6760.12±6.21 #脉动LP组51.26±2.3531.24±3.1160.94±5.04 #
如表1所示,与正常组比,各组小鼠的小肠总长度无明显变化,但5-Fu组小鼠的炭末推进长度明显低于正常组(P<0.05)。与正常组相比,5-Fu组小鼠的小肠炭末推进率最低(49.67%),并具有显著差异(P<0.05)。而荷花粉多糖与5-Fu联用后小鼠的小肠炭末推进率明显升高,与5-Fu组相比差异均有统计学意义(P<0.05)。
2.2 不同干燥方式提取的LP对小鼠结肠长度及PPs面积的影响
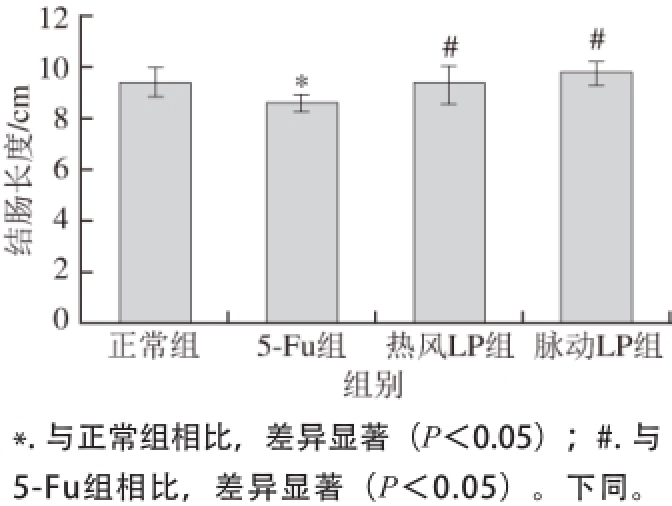
图1 荷花粉多糖对5-Fu模型小鼠结肠长度的影响(
Fig. 1 Effect of LP on the length of colon in model mice induced by 5-Fu
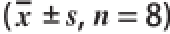
如图1所示,与正常组相比,5-Fu能显著缩短小鼠结肠的长度(P<0.05)。而与5-Fu组相比,联用LP与5-Fu后,热风LP组和脉动LP组小鼠的结肠长度显著增加(P<0.05)。
解剖过程中肉眼观察小鼠肠道及相关淋巴组织中的PPs,发现正常组小鼠的小肠肠壁较厚、较有韧性,PPs数量虽不均一但较多,突出肠壁较高且有光泽。而5-Fu组小鼠的小肠肠壁变薄,在肠壁外可明显观察到肠内容物,肠壁缺乏弹性、易断,PPs数量减少、直径明显减小,隆起不明显,甚至部分小鼠的肠壁上无肉眼可见的PPs结。热风LP组和脉动LP组小鼠的小肠肠壁厚度与正常组相比略薄,但仍存在一定弹性,PPs数量与正常组相比有所减少、直径变小,但仍然突出肠壁。对PPs面积进行统计,结果见表2。5-Fu组小鼠肠PPs的面积明显低于正常组,与正常组比较具有极显著差异(P<0.01),这表明化疗药物5-Fu抑制了小鼠肠道黏膜的免疫功能。而热风LP组与脉动LP组小鼠的PPs面积均明显高于5-Fu组,特别是脉动LP组,与5-Fu组相比差异达到极显著水平(P<0.01),这表明荷花粉多糖能够减缓5-Fu对小鼠黏膜免疫功能的抑制。
表2 荷花粉多糖对5-Fu模型小鼠小肠PPs面积的影响

T
Taabbllee 22 EEffffeecctt ooff LLPP oonn ssuurrffaaccee aarreeaa ooff PPPPss iinn mmooddeell mmiiccee iinndduucceedd bbyy 5--FFuu
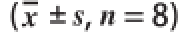

注:**. 与正常组相比,差异极显著(P<0.01);##. 与5-Fu组相比,差异极显著(P<0.01)。下同。
组别PPs个数PPs面积/m m 2正常组15±442.19±12.06 5-Fu组9±218.58±7.81**热风LP组11±327.65±5.97 #脉动LP组12±332.26±6.35 ##
2.3 不同干燥方式提取的LP对小鼠结肠病理组织学的影响
光学显微镜下观察小鼠结肠组织,正常组小鼠结肠肠黏膜绒毛表面完整,固有层可见小血管、毛细血管、淋巴管;黏膜下层的疏松结缔组织富有血管、淋巴管,肌层和浆膜层次清晰。与正常组相比,5-Fu组小鼠结肠肠黏膜表面不完整,上皮细胞排列不紧密, 杯状细胞丢失严重,炎症细胞浸润达黏膜肌层。相比于单一使用5-Fu,联合使用LP的热风LP组和脉动LP组小鼠的结肠黏膜组织病变、上皮杯状细胞丢失及炎症细胞浸润等现象均明显减轻,结肠黏膜表面相对完整(图2)。
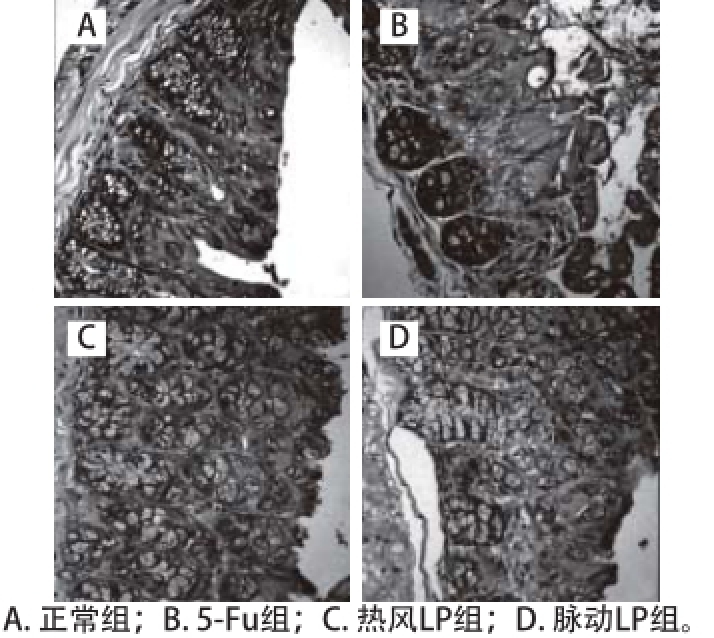
图2 小鼠结肠病理组织切片(苏木精-伊红,400×)
Fig. 2 Histological images of mouse colonic samples stained with hematoxylin and eosin (HE, 40 ×)
2.4 不同干燥方式提取的LP对小鼠PPs中脂质过氧化指标的影响
化疗药物可导致肠道黏膜发生氧化应激损伤,因此,测定小鼠肠道PPs中脂质过氧化指标即可表征损伤程度。如图3所示,与正常组比较,5-Fu组小鼠PPs中的ROS含量显著增加(P<0.05),GSH含量、CAT和GSH-Px活力均显著或极显著降低(P<0.05或P<0.01),这表明5-Fu导致小鼠发生了明显的脂质过氧化损伤;而与5-Fu组相比,脉动LP组小鼠PPs中的GSH含量显著升高(P<0.05),CAT和GSH-Px活力明显升高(P<0.01或P<0.05)。热风LP组小鼠PPs中的GSH-Px活力也明显升高(P<0.05)。以上结果表明,荷花粉多糖能够降低小鼠PPs中过氧化物ROS含量,增加抗氧化物GSH含量和抗氧化物酶CAT和GSH-Px的活性,并且真空脉动的干燥方式能更好地保护花粉多糖的抗氧化功能。

图3 荷花粉多糖对5-Fu模型小鼠PPs中脂质过氧化指标的影响
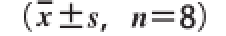
Fig. 3 Effect of LP on ROS (A), CAT (B), GSH (C) and GSH-Px (D)levels in supernatant of PPs in model mice induced by 5-Fu

2.5 不同干燥方式提取的LP对小鼠结肠组织中细胞因子TNF-α含量的影响
当机体组织受到外界刺激时,会产生一系列复杂的细胞生物学效应,包括应激信号的激活和传递、炎症反应发生、各种细胞因子的释放等。研究发现,当机体、组织发生炎症时,p38 MAPK通路被过度激活,进而促进炎症因子TNF-α、白细胞介素-1β(interleukin-1β,IL-1β)、IL-6等的合成、释放,且炎症因子释放与损伤程度成正相关。因此,本研究检测了小鼠结肠组织中细胞因子TNF-α的表达水平。如图4所示,与正常组比较,5-Fu组小鼠结肠组织中的TNF-α含量极显著增加(P<0.01),表明5-Fu对小鼠造成了炎症性损伤,这与临床化疗药物对患者肠道造成的损伤症状机理一致;此外,与5-Fu组相比,联用LP能够明显降低小鼠结肠组织中TNF-α的水平,特别是真空脉动干燥的荷花粉中提取的多糖,极显著降低了小鼠结肠组织中TNF-α含量(P<0.01)。以上结果表明,荷花粉多糖能够降低小鼠体内TNF-α的释放,进而对肠道黏膜起到保护作用,且真空脉动干燥技术能更好地保护多糖的这一活性。
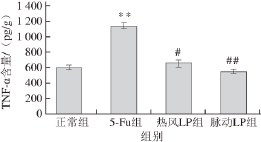
图4 荷花粉多糖对5-Fu模型小鼠结肠组织中细胞因子TNNFF--α含量的影响
Fig. 4 Effect of LP on TNF-α in colon tissue of model mice induced by 5-Fu

肠道不仅是重要的消化器官,而且是人体最大的免疫器官,在正常生理条件下,肠黏膜存在较完整的屏障功能,主要由机械屏障、生物屏障、免疫屏障、化学屏障四部分组成,这4 个组成部分各自具有不同的结构、分子调控机制和生物学功能,并通过各自的信号通路有机地结合在一起,共同防御外来抗原物质对机体的侵袭。化疗是恶性肿瘤治疗的重要方法之一,化疗药物在杀伤肿瘤细胞的同时对正常的组织器官也有不同程度的影响,其中肠黏膜损伤正是某些抗癌药物的毒性反应。5-Fu是治疗消化道肿瘤和乳腺癌的基本药物,但其有较严重的副作用,如引起骨髓抑制、皮炎、心脏毒性、腹泻、肝损伤和黏膜损伤,其中黏膜屏障损伤是化疗的主要毒副作用 [18]。化疗药物对肠黏膜屏障的损伤主要包括:直接损伤肠黏膜,绒毛萎缩,吸收、传递功能降低,出现腹泻;毛细血管组织缺血,释放 大量氧自由基ROS,损伤 膜结构,机体循环被破坏、清除自由基能力降低 [19]。化疗药物可导致细胞免疫和体液免疫功能的改变,影响CD4 +、CD8 +T淋巴细胞失调,造成肠黏膜免疫功能紊乱 [20]。缺血、缺氧引起的氧化应激反应和细胞凋亡均可促进TNF-α、IL-6、IL-8等炎性介质的分泌释放,引发炎症反应,从而导致肠道菌群失调、肠动力障碍等病理性改变。研究发现,5-Fu可通过p53机制引起大肠黏膜细胞凋亡 [21-22]。胃肠黏膜损伤是一种严重的化疗副作用,不仅增加患者的身心痛苦,降低患者生活质量,甚至使患者死亡率增加。
本研究结果显示,荷花粉多糖能改善5-Fu所致的小鼠小肠推进功能降低;减缓5-Fu所致的小鼠结肠缩短;明显减轻5-Fu所致结肠黏膜组织病变、上皮杯状细胞丢失及炎症细胞浸润等病理损伤,使结肠黏膜表面相对完整;这说明荷花粉多糖能够保护小鼠肠道黏膜,促进黏液分泌,增加小肠定向蠕动,提高肠道屏障的机械功能;荷花粉多糖还能增强化疗小鼠的抗氧化能力,这表明荷花粉多糖对化疗药物5-Fu所致的氧化应激损伤等肠黏膜屏障障碍起到了良好的保护作用,这可能与花粉多糖的抗氧化能力有关,前人的研究也表明花粉多糖有较强的清除羟自由基效果 [23]。TNF-α是最重要的炎症因子,具有广泛的生物学效应。TNF-α可通过激活炎症细胞,上调黏附因子、NO和氧自由基等损害组织,引起炎症反应 [24],而荷花粉多糖可降低TNF-α的释放,进一步抑制5-Fu所致的肠道黏膜氧化应激损伤。这些结果充分说明荷花粉多糖能够促进小鼠的肠道蠕动,减轻化疗药物所致的肠道黏膜免疫功能低下及病理损伤和炎症的发生,调节机体肠道免疫功能,起到保护肠道的作用。此外,研究结果还表明,干燥方式对荷花粉多糖功效的发挥产生了不同影响,其中真空脉动干燥能够更好地保护荷花粉多糖的活性。这可能是因为在真空脉动干燥的条件下,干燥温度更低,水分迁移更为均匀,使得花粉多糖的热敏性基团得到保护。
综上所述,荷花粉多糖能够改善临床常用化疗药物5-Fu造成的肠道不良反应,拮抗小鼠肠道传输功能失调;减轻5-Fu所致的肠道黏膜系统炎症及肠道形态学损伤,说明荷花粉多糖在化疗联合用药、提高机体免疫功能、改善患者生活质量等方面具有积极意义。
参考文献:
[1] 国家药典委员会. 中华人民共和国药典(一部)[M]. 北京: 化学工业出版社, 2005: 166.
[2] HAMURO J, MAEDA Y Y, ARAI Y, et al. The significance of the higher structure of the polysaccharides lentinan and pachymaran with regard to their antitumour activity[J]. Archives of Dermatology, 2007,24(5): 1623-1626. DOI:10.1016/0009-2797(71)90026-3.
[3] WANG Y, ZHANG L. Chain conformation of carboxymethylated derivatives of (1→3)-β-D-glucan from Poria cocos sclerotium[J]. Carbohydrate Polymers, 2006, 65(4): 504-509. DOI:10.1016/ j.carbpol.2006.02.014.
[4] 陈春霞. 羧甲基茯苓多糖的抗肿瘤活性与免疫效应[J]. 食用菌学报,2001, 8(3): 39-44. DOI:10.3969/j.issn.1005-9873.2001.03.008.
[5] 张秀军, 徐俭, 林志彬. 羧甲基茯苓多糖对小鼠免疫功能的影响[J]. 中国药学杂志, 2002, 37(12): 35-38. DOI:10.3321/ j.issn:1001-2494.2002.12.011.
[6] 任乃艳, 卢荣, 程妮, 等. 蜂花粉活性成分的研究进展[J]. 中国蜂业中旬刊(学术), 2011, 62(10): 76-78.
[7] LINSKENS H F, JORDE W. Pollen as food and medicine: a review[J]. Economic Botany, 1997, 51(1): 78-86. DOI:10.1007/BF02910407.
[8] SILVA T M S, CAMARA C A, LINS A C D S, et al. Chemical composition and free radical scavenging activity of pollen loads from stingless bee Melipona subnitida Ducke[J]. Journal of Food Composition & Analysis, 2006, 19(6/7): 507-511. DOI:10.1016/ j.jfca.2005.12.011.
[9] 刘铭, 李娜娜, 耿越. 硫酸酯化马尾松花粉多糖对小鼠脾脏B淋巴细胞免疫调节作用的研究[J]. 中国细胞生物学学报, 2014(4): 461-469. DOI:10.11844/cjcb.2014.04.0337.
[10] 平舜, 王凯, 张江临, 等. 茶蜂花粉提取物BPE对LPS诱导的Raw 264.7细胞的体外抗炎症作用[J]. 食品与生物技术学报, 2015,34(12): 1302-1307. DOI:10.3969/j.issn.1673-1689.2015.12.011.
[11] 杨晓萍, 罗祖友, 吴谋成. 油菜花粉多糖的制备及其对荷瘤小鼠的影响[J]. 食品科学, 2005, 26(12): 202-204. DOI:10.3321/ j.issn:1002-6630.2005.12.048.
[12] 方小明, 田文礼, 高凌宇, 等. 蜂花粉真空脉动干燥方法和使用该方法制得的蜂花粉: CN102488123A[P]. 2012-06-13.
[13] 蒙烨, 黄永坤. 化疗药物对肠黏膜屏障的损伤及其防治[J]. 医学综述, 2012(9): 1325-1327. DOI:10.3969/j.issn.1006-2084.2012.09.017.
[14] GRADISHAR W J, VOKES E E. 5-Fluorouracil cardiotoxicity: a critical review[J]. Annals of Oncology Offi cial Journal of the European Society for Medical Oncology, 1990, 1(6): 409-414.
[15] ABOU-ZEID N R A. Ameliorative effect of vitamin C against 5-fuorouracil-induced hepatotoxicity in mice: a light and electron microscope study[J]. Journal of Basic & Applied Zoology, 2014, 67(4): 109-118. DOI:10.1016/j.jobaz.2013.12.004.
[16] INNOCENTI F, DANESI R, BOCCI G, et al. 5-Fluorouracil catabolism to 5-fluoro-5,6-dihydrouracil is reduced by acute liver impairment in mice[J]. To xicology & Applied Pharmacology, 2005,203(2): 106-113. DOI:10.1016/j.taap.2004.08.018.
[17] 刘洁, 缪晓青. 响应面分析法优化莲花蜂花粉多糖提取工艺研究[J].食品科学, 2010, 31(14): 101-105.
[18] TSUYUKI S, KAWAGUCHI K, KAWATA Y, et al. Usefulness of antimycotic agents (it raconazole) in chemotherapy-induced mucositis of breast cancer patients[J]. Gan to Kagaku Ryoho Cancer & Chemotherapy, 2012, 39(9): 1369-1373.
[19] 徐智媛, 尧颖, 程宇, 等. 急性肝衰竭大鼠血浆D-乳酸二胺氧化酶和内毒素的变化及其意义[J]. 胃肠病学和肝病学杂志, 2011, 20(8): 736-738. DOI:10.3969/j.issn.1006-5709.2011.08.014.
[20] 刘端勇, 黄敏芳, 徐荣, 等. 黄芪多糖对结肠炎大鼠小肠PP结中T淋巴细胞亚群的调节作用[J]. 中国药理学通报, 2015(9): 1328-1329. DOI:10.3969/j.issn.1001-1978.2015.09.029.
[21] SHARIF O, BOLSHAKOV V N, RAINES S, et al. Transcriptional profiling of the LPS induced NF[J]. BMC Immunology, 2007, 8(1): 194-194. DOI:10.1186/1471-2172-8-1.
[22] 张安平, 刘宝华, 张连阳, 等. p53抑制剂PFT-α对热化疗诱导肠上皮细胞凋亡的保护作用[J]. 世界华人消化杂志, 2004, 12(10): 2353-2355. DOI:10.3969/j.issn.1009-3079.2004.10.021.
[23] 范三红, 周立波. 油松花粉多糖提取及其清除羟自由基活性研究[J]. 食品科学, 2008, 29(12): 274-277. DOI:10.3321/ j.issn:1002-6630.2008.12.059.
[24] 王琳琳, 韦巧珍, 连淑君, 等. 谷氨酰胺对内毒素血症幼鼠肠道核因子-B活化及肿瘤坏死因子-白介素-6表达的影响[J]. 实用儿科临床杂志, 2010, 10(19): 1479-1481.
Lotus Bee Pollen Polysaccharides Significantly Relieve Intestinal Mucosal Barrier Damage in Mice Caused by Fluorouracil
FANG Xiaoming
1,2, TIAN Wenli
2, ZHANG Xiaolin
1, PENG Wenjun
2, XIAO Hongwei
1, GAO Lingyu
2, WANG Canhong
3, GAO Zhenjiang
1,*
(1. College of Engineering, China Agricultur al University, Beijing 100 083, China; 2. Institute of Apicultural Research, Chinese Academy of Agricultural Sciences, Beijing 100093, China; 3. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100193, China)
Abstract:Objective: To investigate the protective effects of polysaccharides (LP) extracted from lotus bee pollen dried by different drying methods on intestinal mucosal inflammation and intestinal barrier dysfunctions in mice induced b y 5-fl uorouracil (5-Fu). Methods: Mouse models of intestinal mucosal infl ammation were established by induction with 5-Fu and the model mice were grouped randomly and subjected to drug administration. The carbon-propelling rate was tested,and colon length and Peyer’s patches (PPs) area were measured. The colon tissue was stained with hematoxylin-eosin (HE)for histological section observation. Reactive oxygen species (ROS) and glutathione (GSH) contents, and catalase (CAT) and GSH-Px activities in the supernatant of PPs homogenate were evaluated by biochemical assays. Tumor necrosis factor-α (TNF-α)in the supernatant of colon tissue homogenate was determined through ELISA. Results: Compared with the normal group,intraperitoneal injection of 5-Fu to mice signifi cantly inhibited small intestinal transit (P < 0.05). LP extracted from lotus bee pollen dried by hot air or vacuum pulsed drying improved colon shortening caused by 5-Fu (P < 0.05) and resulted in a signifi cant or highly signifi cant increase of PPs area (P < 0.05 or P < 0.01). Moreover, compared with the 5-Fu-induced model group, LP combined with5-Fu could signifi cantly promote intestinal transit (P < 0.05), increase GSH content, and CAT and GSH-Px activities (P < 0.01 or P < 0.05), and decrease obviously TNF-α contents (P < 0.05 or P < 0.01). HE staining results showed that LP could signifi cantly reduce the loss of colonic mucosa epithelium goblet cells, infl ammatory cell infi ltration and more shallow crypt depth induced by 5-Fu. Conclusion: LP could relieve intestinal mucosal damage, improve intestinal transit dysfunction and protect against intestinal oxidative damage in mice induced by 5-Fu. The polysaccharides extracted from lotus bee pollen subjected to vacuum pulsed dry ing exhibited better activity than the polysaccharides extracted from hot air dried lotus bee pollen.
Key words:lotus bee pollen polysaccharide; 5-fl uorouracil; intestinal mucosal barrier; oxida tive damage; drying method
收稿日期:2016-03-17
基金项目:国家自然科学基金青年科学基金项目(31501548);国家现代农业(蜜蜂)产业技术体系建设专项(NCYTI-43-KXJ17);中国农业科学院科技创新工程项目(CAAS-ASTIP-2015-IAR)
作者简介:方小明(1983—),男,博士研究生,主要从事蜂产品加工与功能评价研究。E-mail:153886891@qq.com
*通信作者:高振江(1958—),男,教授,博士,主要从事农产品(食品)加工技术与装备研究。E-mail:zjgao@cau.edu.cn
DOI:10.7506/spkx1002-6630-201615035
中图分类号:TS201
文献标志码:A
文章编号:1002-6630(2016)15-0209-06
引文格式: