王鸿超,刘 媛,顾震南,陈海琴,张 灏,陈 卫,陈永泉*
(江南大学食品学院,江苏 无锡 214122)
摘 要:采用四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)法、细胞形态分析法及诱导分化法结合油红O染色法研究叶酸代谢中二氢叶酸还原酶抑制剂甲氨喋呤(methotrexate,MTX)、甲氨苄啶(trimethoprim,TMP)和乙胺嘧啶(pyrimethamine,PTM)对OP9小鼠骨髓基质细胞增殖和分化的影响,探讨叶酸代谢与脂质合成的关系。MTT实验结果显示,在一定浓度范围内,3 种叶酸抑制剂均能抑制OP9细胞增殖,并呈现一定的剂量-效应依赖关系。且3 种叶酸抑制剂在高浓度时对OP9细胞有毒性作用。倒置显微镜观察和油红O染色检测结果显示,TMP在500~1 000 μmol/L浓度范围内对OP9细胞分化为脂肪细胞具有抑制作用。荧光定量聚合酶链式反应分析表明,TMP会使叶酸代谢途径中二氢叶酸还原酶和亚甲基四氢叶酸脱氢酶的转录水平发生下调,这可能是TMP抑制脂肪细胞诱导分化的原因。
关键词:二氢叶酸还原酶抑制剂;OP9小鼠骨髓基质细胞;脂质合成;增殖;分化
王鸿超, 刘媛, 顾震南, 等. 叶酸代谢抑制剂对小鼠骨髓基质细胞增殖和分化的影响[J]. 食品科学, 2016, 37(15): 215-220.
WANG Hongchao, LIU Yuan, GU Zhennan, et al. Effects of folate metabolism inhibitors on the proliferation and differentiation of OP9 mouse stromal cells[J]. Food Science, 2016, 37(15): 215-220. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201615036. http://www.spkx.net.cn
叶酸(蝶酰单谷氨酸)是指具有相关生物活性的一类水溶性B族维生素,其不同的辅酶形式可以作为一碳单位的供体或载体而发挥作用,主要参与以下几类反应:蛋氨酸合成、嘌呤和嘧啶的合成、丝氨酸和甘氨酸的相互转化、组氨酸的降解等 [1]。叶酸具有重要的营养生理功能,包括参与遗传物质和蛋白质代谢、影响胰腺分泌功能、促进机体生长、提高机体免疫能力 [2-5]、调控肥胖基因 [6-7]等。二氢叶酸(dihydrofolic acid,FH 2)和四氢叶酸(tetrahydrofolic acid,FH 4)是重要的叶酸化合物,二氢叶酸还原酶(dihydrofolate reductase,DHFR)是FH 4的唯一来源,对于维持细胞FH 4及其衍生物水平起核心作用 [8]。它可将FH 2转化为FH 4,从而将叶酸运送至细胞中,作为一碳基团的载体参与多种生物学反应 [2,9]。DHFR是抗生素和抗癌药物作用的重要靶点,可选择性地与DHFR结合,阻碍叶酸代谢,干扰肿瘤细胞DNA和蛋白质的合成,从而发挥其抗肿瘤作用 [10]。
依照其化学结构,DHFR抑制剂可分为经典抗叶酸剂和非经典抗叶酸剂,主要包括甲氨喋呤(methotrexate,MTX)、甲氨苄啶(trimethoprim,TMP)和乙胺嘧啶(pyrimethamine,PTM) [11-12]。近期研究表明,叶酸代谢还是脂肪合成所需还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate,NADPH)的重要来源 [13]途径 ,叶酸代谢途径中的亚甲基四氢叶酸脱氢酶(methylenetetrahydrofolate dehydrogenase,MTHFD)可将NADP +转化为NADPH [10]用于脂肪的合成。由于DHFR是叶酸代谢中的关键酶,对其进行抑制很可能会干扰细胞中叶酸的正常代谢,通过影响细胞NADPH的水平进而调控脂质合成。本实验采用可以分化为脂肪细胞 [14]的OP9小鼠骨髓基质细胞为模型 [15],利用四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)和比色分析法研究3 种叶酸代谢抑制剂对OP9细胞的增殖及分化为脂肪细胞的作用,探讨叶酸代谢与脂质合成的关系。
1.1 材料与试剂
OP9细胞购自于中科院上海细胞库。
胎牛血清(fetal bovine serum,FBS)、液体MEM-α培养基、胰蛋白酶消化液 美国HyClone公司;青-链霉素、二甲基亚砜(dimethylsulfoxide,DMSO)、胰岛素(insulin,INS)、地塞米松(dexamethasone,DEX)、3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine,IBMX) 美国Sigma公司;油红O干粉 苏州英杰有限公司;MTX、TMP、PTM 百灵威科技有限公司。
1.2 仪器与设备
倒置显微镜 日本尼康公司;细胞培养箱、台式离心机、酶标仪 美国热电公司;荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪、凝胶成像仪美国伯乐公司。
1.3 方法
1.3.1 OP9细胞培养
将OP9细胞置于含20%胎牛血清的MEM-α培养基(含100 μg/mL青霉素、100 μg/mL链霉素)中,于37 ℃、5% CO 2条件下培养,细胞贴壁呈梭状生长,按照细胞生长密度,每隔2~3 d换液一次,待细胞密度长到80%时传代并传板,以备实验所需。
1.3.2 MTT法检测叶酸抑制剂对OP9细胞增殖的影响
对于贴壁生长的OP9细胞,待细胞密度长到80%时,按照5×10 4个/孔将细胞接种到96 孔板中,每孔100 μL,培养1 d使其生长至贴壁后开始干预处理,并降低细胞培养的胎牛血清体积分数为5%。实验组分别设置为对照组(溶剂DMSO和培养基)和实验组(叶酸代谢抑制剂和培养基),其中实验组每孔加入叶酸抑制剂(MTX、TMP和PTM),使其终浓度为10~2 500 μmol/L。培养48 h后,每孔加入22 μL MTT,继续培养4 h,于490 nm波长处测得光密度(OD)值 [16],并用空白孔调零,按照下式计算细胞增殖率。
1.3.3 细胞形态学分析
对于贴壁生长的OP9细胞,待细胞密度长到80%时,传板至96 孔板中。待细胞贴壁生长1 d后,开始加药干预处理。分别设置对照组(溶剂DMSO和培养基)和实验组(药物和培养基)。实验组加入终浓度1.3.2节所述的叶酸抑制剂(MTX、TMP和PTM),继续培养72 h后用倒置显微镜观察细胞形态。
1.3.4 OP9细胞的诱导分化
1.3.4.1 诱导分化过程
参考Wolins等 [15]的方法,对于贴壁生长状态良好的OP9细胞,待细胞密度生长到80%时,接种到6 孔板,每孔2 mL,使其贴壁生长达到接触抑制2 d后,在DM1培养基(MEM-α培养基添加20% FBS、175 nmol/L INS、0.25 μmol/L DEX、0.5 mmol/L IBMX和1%青-链霉素)中继续培养2 d。随后更换培养基为DM2(MEM-α培养基添加20% FBS、175 nmol/L INS和1%青-链霉素)中继续培养,以使脂滴积累。
1.3.4.2 油红O染色
油红O储存液配制:称取0.5 g油红O干粉,溶于100 mL异丙醇中。棕色瓶密封,4 ℃保存备用。按照1.3.4.1节的诱导分化方法,在OP9细胞诱导分化第7天,开始对细胞进行染色。弃掉6 孔板中的培养基,每孔加入1 mL磷酸盐缓冲液(phosphate buffered saline,PBS)洗3 遍,然后用1 mL 10%多聚甲醛室温固定30 min。PBS清洗3 遍后,每孔加入1 mL油红O工作液(油红O储存液-水(V/V,3∶2))于50 ℃水浴中浸染40 min。弃掉油红O,每孔用1 mL PBS洗3 遍,细胞中加入1 mL的PBS在显微镜下观察并拍照。
1.3.5 叶酸代谢抑制剂对OP9细胞诱导分化的影响
1.3.5.1 叶酸代谢抑制剂对OP9细胞诱导分化后脂质积累的影响
在对OP9细胞进行诱导分化的同时,设置诱导对照组(简称对照组,加入诱导剂和溶剂DMSO)和实验组(加入诱导剂和叶酸代谢抑制剂)。其中实验组分别用培养基将MTX、TMP、PTM稀释成终浓度为50~1 000 μmol/L,并与诱导剂一同加入孔中。每孔加入2 mL培养液。诱导7 d后,按照1.3.4.2节方法对细胞进行染色并拍照。染色后弃掉6 孔板中的PBS,每孔加入1 mL异丙醇将油红O洗涤下来,转移到96 孔板中,于510 nm波长处测定OD值,按照下式计算相对分化率。
1.3.5.2 OP9细胞诱导分化过程中叶酸代谢关键酶的转录水平分析
在OP9细胞诱导分化为脂肪细胞后,弃掉培养基,每孔加入1 mL Trizol裂解细胞并收取样品。室温静置5 min后,加入200 μL预冷的三氯甲烷,颠倒振荡30 s,静置2 min,12 000×g离心15 min。将上清液转移到新的无酶EP管中,加入等体积预冷的异丙醇,轻柔颠倒30 s,室温静置20 min。12 000×g离心15 min,弃掉上清,加入1 mL预冷的70%乙醇,8 000×g离心5 min。重复洗涤一次后,室温晾干,加入20 μL无酶水回溶。采用TaKaRa的PrimeScript TMRT reagent Kit with gDNA Eraser进行反转录,构建cDNA文库。由美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)上查找DHFR、MTHFD1、MTHFD2、MTHFD2L基因的cDNA序列,利用Primer Premier 5设计符合要求的荧光定量PCR的引物,序列见表1。
表1 引物序列
Table 1 Primer sequenceess

基因引物序列(5’→3’)DHFR正向:CGCTCAGGAACGAGTTCAAGT反向:TGCCAATTCCGGTTGTTCAATAA MTHFD1正向:CCGAGAAGGATGTGGATGG反向:TGGCAGTCTTGGAGTGGCA MTHFD2正向:ACTCCCGTCCCTGGTGGT反向:CTCTTGGCCTGCTTAGCCT MTHFD2L正向:CGCACAGATACACCCCCA反向:GGTCTTTCCCGTCACAGG β-actin正向:CCCAGGCATTGCTGACAGG反向:TGGAAGGTGGACAGTGAGGC
1.4 数据统计
实验数据均采用
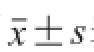 表示,n=3;运用GraphPad Prism 5软件进行数据分析。
表示,n=3;运用GraphPad Prism 5软件进行数据分析。
2.1 叶酸抑制剂对OP9细胞增殖和形态的影响
2.1.1 叶酸抑制剂对OP9细胞增殖的影响
如图1A所示,MTX对OP9细胞增殖有一定的抑制作用,与对照组相比,随着抑制剂浓度的升高,细胞的增殖率降低。MTX浓度≥200 μmol/L时,OP9细胞增殖率明显降低(P<0.001)。如图1B所示,PTM浓度≥50 μmol/L时,对OP9细胞有明显的抑制增殖作用(P<0.01或P<0.001),且随着PTM浓度的增加,抑制作用逐渐增强,剂量-效应关系明显。如图1C所示,当TMP浓度≥600 μmol/L时,其对OP9细胞增殖的抑制作用非常明显(P<0.001),且随着TMP浓度的增加,抑制作用逐步增强。
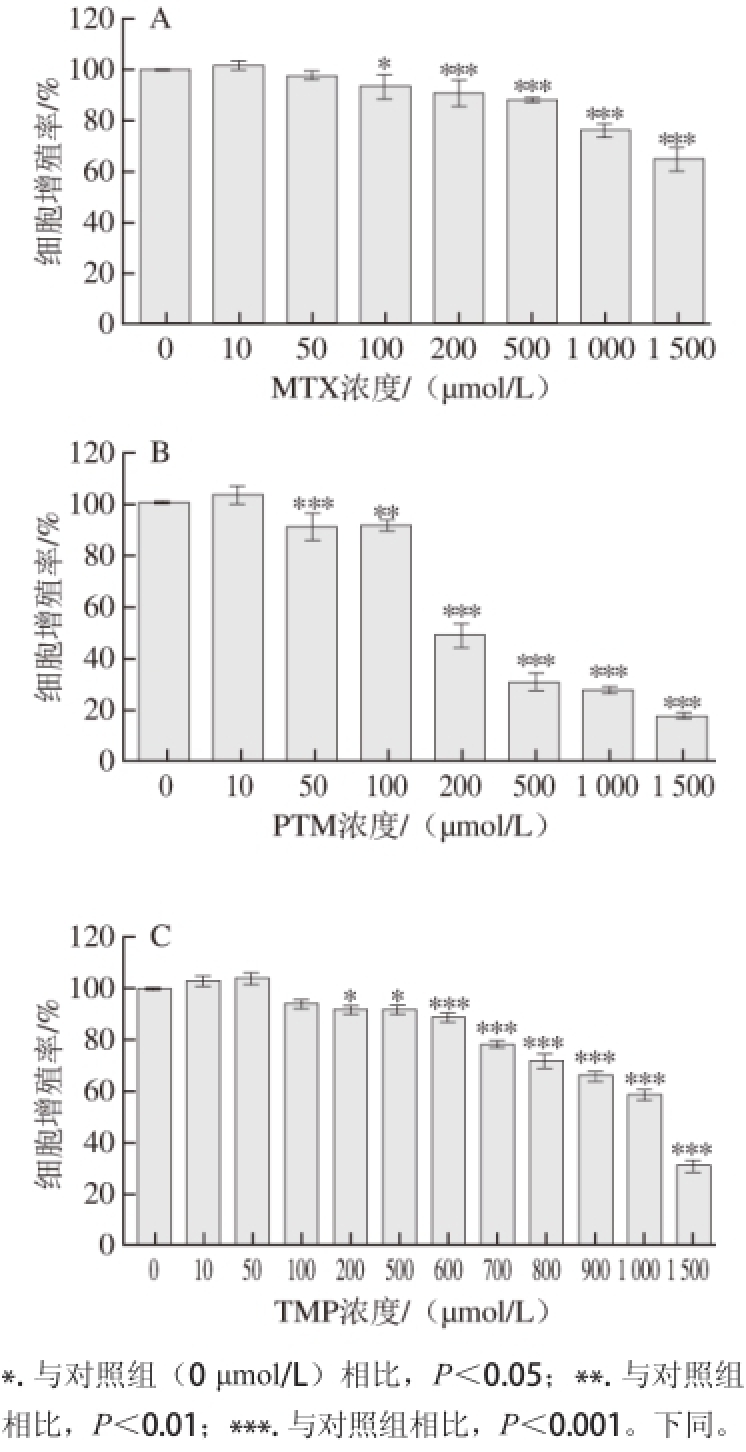
图1 不同浓度的MTX(A)、PTM(B)和TMP(CC)对OOPP99细胞增殖的影响
Fig. 1 Effects of different concentratins of MTX (A), PTM (B), and TMP (C) on the proliferation of OP9 cells
2.1.2 叶酸抑制剂对OP9细胞形态的影响

图2 不同浓度叶酸抑制剂对OP9OP9细胞形态的影响
Fig. 2 Effects of different concentrations of inhibitors on the morphology of OP9 cells
由图2可知,与对照组(0 μmol/L)相比,当MTX浓度≤500 μmol/L时,OP9细胞形态正常,表明MTX在该浓度下对细胞形态并未造成伤害。而当MTX浓度达到1 000 μmol/L时,细胞相对分散,数量减少,细胞很可能发生了凋亡。这表明MTX在200~1 000 μmol/L范围内既可以对细胞的增殖产生抑制作用,又对细胞的正常形态没有损害。PTM对细胞的杀伤作用非常大。在其浓度到达200 μmol/L时,细胞数量急剧减少,从图中可以看出,细胞已经失去原本长梭状的形态,变成长串珠状,细胞核固缩突出,并发生裂解碎片,可能发生了细胞凋亡。这表明PTM这种抑制剂对于OP9细胞的伤害是比较严重的,在浓度过高时细胞毒性作用较强。当TMP浓度达到1 000 μmol/L时,其对OP9细胞的毒害作用也显现出来。由图2可知,当OP9细胞受到损伤时,细胞由原本的长梭状变圆,细胞核突出,细胞也失去了正常的连接状态,可能发生了细胞凋亡。综合以上结果,TMP在500~1 000 μmol/L之间对细胞增殖的抑制作用较为明显,而且对细胞的正常形态没有损害。
2.2 叶酸抑制剂对OP9细胞分化的影响
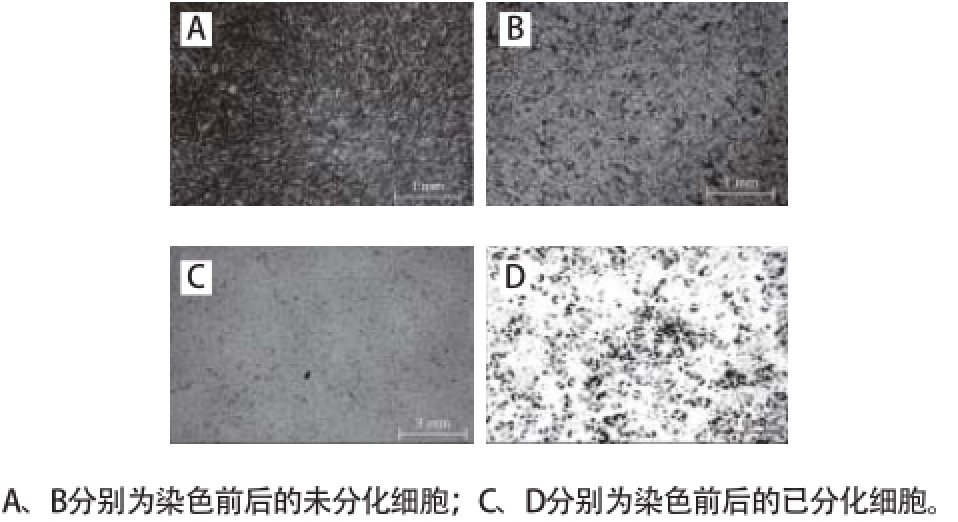
图3 3 OP9OP9分化前脂肪细胞与分化后脂肪细胞
Fig. 3 Morphological micrographs of OP9 pre-adipocytes and adipocytes
如图3A所示,诱导前OP9细胞为典型的梭状,细胞内无脂滴。当细胞生长至一定阶段后,完全融合产生接触抑制,此时细胞生长停滞。诱导后细胞由梭状变为圆形,胞内有脂滴出现,随着诱导时间的延长,脂滴逐渐增大(图3C)。油红O 是一种对油脂呈特异性的染料,OP9细胞被诱导分化成为脂肪细胞后,产生的油滴能与油红O结合呈现红色(图3D),而诱导前细胞则不能被染色(图3B)。

图4 不同浓度的MTX(A)、PTM(B)和TMP(CC)对OOPP99细胞分化的影响
Fig. 4 Effects of different concentrations of MTX(A), PTM(B), and TMP(C) on the differentiation of OP9
由图4A可知,MTX在800~1 000 μmol/L范围内对OP9细胞诱导分化的抑制作用比较明显(P<0.001);PTM在10~100 μmol/L范围内对OP9细胞的分化无抑制作用(图4B);TMP在500~1 000 μmol/L范围内对OP9细胞分化的影响显著(P<0.001)(图4C),随着浓度的升高,其抑制OP9细胞分化的作用逐渐加强。浓度为1 000 μmol/L的TMP对OP9细胞分化的抑制效果最为显著,此时OP9细胞的相对分化率下降达50%。综上所述,500~1 000 μmol/L的TMP既可以抑制OP9细胞的增殖,又可以对细胞分化产生影响,是良好的OP9细胞分化抑制剂。
2.3 TMP对OP9细胞分化过程中叶酸代谢关键基因转录水平的影响
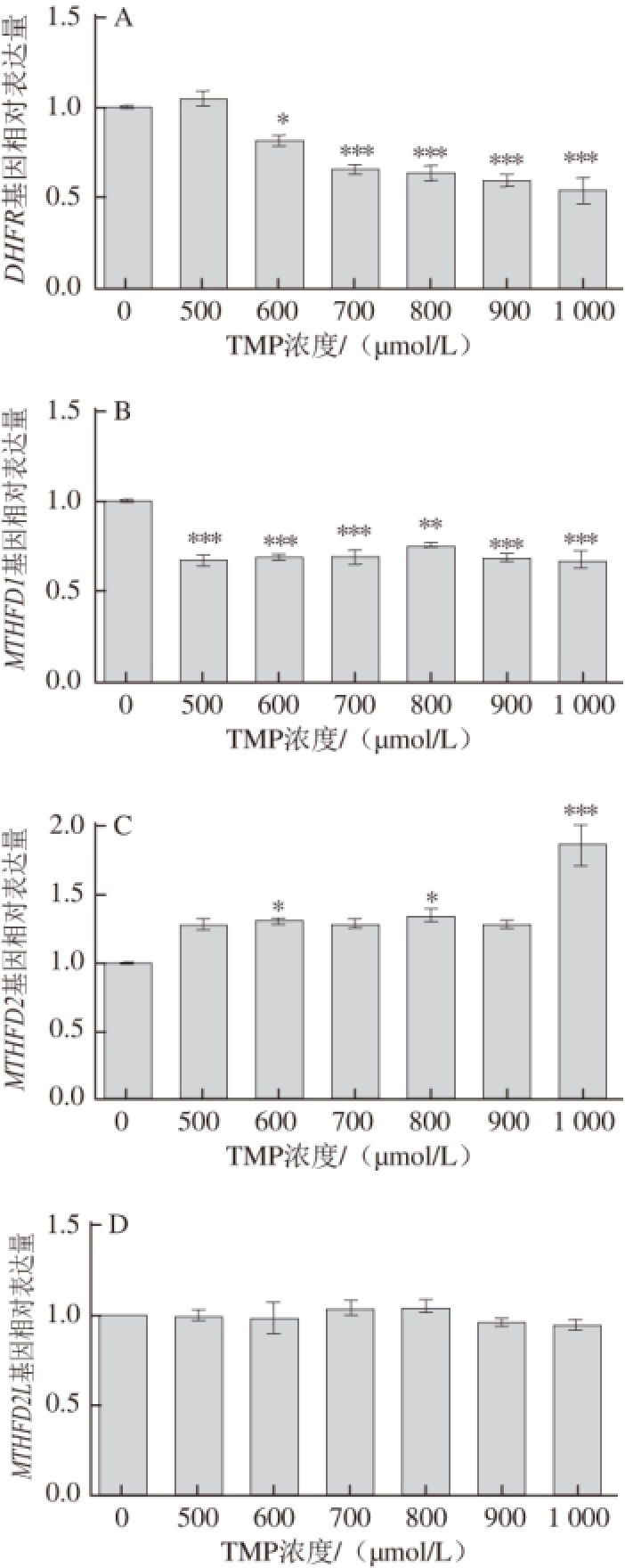
图5 5 DHFRDHFR(A)、AMTHFD1THFD1(B)、BMTHFD2THFD2(C)和CMTHFD2LHFD2L(D)D基因相对表达情况
Fig. 5 Relative expression levels of DHFR (A),MTHFD1 (B),MTHFD2 (C) and MTHFD2L (D) genes
分析TMP对OP9细胞分化过程中叶酸代谢关键基因转录水平的影响,结果见图5。当对OP9细胞进行诱导分化时,500~1 000 μmol/L的TMP对脂肪细胞的分化影响显著,并可明显下调DHFR基因和MTHFD1基因的转录水平(图5A、B)。这表明DHFR和MTHFD1在OP9细胞分化为脂肪细胞的过程中起到了重要作用,叶酸代谢提供的NADPH很可能是脂肪细胞形成的关键。而MTHFD2基因的转录水平发生了上调(图5C),这可能是由于MTHFD2提供的NADPH较少,该基因的调控难以对细胞的NADPH总量产生影响。MTHFD2L基因的转录水平没有发生变化(图5D),这可能是由于该基因不能提供NADPH,因此在OP9细胞的诱导分化过程中并没有发挥重要作用。
细胞增殖是生物体的重要生命特征,细胞增殖检测技术广泛应用于分子生物学、肿瘤生物学等研究领域 [17-18]。各种代谢抑制剂对细胞增殖的不同影响效果与细胞系种类、抑制剂种类及干预浓度和作用时间有重要关系。由于DHFR抑制剂的结构与DHFR的底物相似,故细胞快速增长过程中,DHFR抑制剂能选择性地与DHFR结合,阻止或抑制正常底物与酶的结合,抑制其催化还原活性,使FH 2不能转化为FH 4,阻碍叶酸代谢 [8]。通过MTT分析结合细胞形态学研究结果发现,3 种叶酸抑制剂MTX、PTM和TMP在一定浓度范围内都会对OP9细胞的增殖产生抑制作用,浓度增大达到一定程度之后则呈现出细胞毒性。后期实验可考虑进一步通过DAPI等DNA特异性染料对细胞核进行染色,通过荧光显微镜观察进一步确定细胞的凋亡情况 [19-20]。叶酸代谢抑制剂的干预效果与抑制剂的种类、浓度都有很大的关系。
常用的OP9细胞诱导分化为脂肪细胞的方法与3T3-L1细胞的诱导方法相近 [21],包括血清替代法,胰岛素油方法和成脂鸡尾酒方法 [15]。油红O染色法表明OP9诱导分化积累脂滴的效果较好 [21]。有研究表明该诱导方法可以激活细胞脂合成的关键基因过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor γ,PPARγ),促进OP9细胞分化成为脂肪细胞 [15]。然而这种方法诱导脂肪细胞的具体通路和途径并不清晰,因此需要进一步深入研究。
3 种叶酸代谢抑制剂中,只有TMP在500~1 000 μmol/L范围内可抑制OP9细胞的脂滴积累,对脂肪细胞的诱导分化产生显著影响。NADPH在脂肪的合成中具有关键作用——提供唯一的还原力。由于TMP会对DHFR的活性产生抑制,叶酸代谢受到阻碍,进而可能会对脂肪细胞的形成产生影响。叶酸代谢途径中的亚甲基四氢叶酸脱氢酶包括MTHFD1、MTHFD2和MTHFD2L,其中MTHFD1位于细胞质中,MTHFD2位于线粒体中,它们都以NADP +为底物,生成NADPH [22-23],而MTHFD2L以NAD +为底物,生成NADH [24-25]。添加TMP后,只有MEHFD1的转录水平发生下调,这表明MTHFD1很可能在叶酸代谢产NADPH过程中发挥重要作用,是OP9细胞诱导分化为脂肪细胞的关键调控基因。
本研究考察了3 种叶酸抑制剂对OP9细胞增殖和分化的影响,结果表明3 种叶酸抑制剂均能抑制OP9细胞的增殖,并在一定浓度范围内呈浓度-效应依赖关系,其中PTM的效果最强;但只有500~1 000 μmol/L的TMP会对OP9细胞诱导分化为脂肪细胞产生显著抑制作用;TMP通过下调DHFR和MTHFD1基因的转录水平进而影响细胞中NADPH的水平,可能是其通过抑制叶酸代谢影响脂质合成的作用机制。
参考文献:
[1] SHAH B K, GUPTA P. Weekly vs daily iron and folic acid supplementation in adolescent Nepalese girls[J]. Archives of Pediatrics & Adolescent Medicine, 2002, 156(2): 131-135. DOI:10.1001/ archpedi.156.2.131.
[2] BEAUDIN A E, STOVER P J. Folate-mediated one-carbon metabolism and neural tube defects: balancing genome synthesis and gene expression[J]. Birth Defects Research. Part C, Embryo Today: Reviews, 2007, 81(3): 183-203. DOI:10.1002/bdrc.20100.
[3] BEOPOULOS A, NICAUD J M, GAILLARDIN C. An overview of lipid metabolism in yeasts and its impact on biotechnological processes[J]. Applied Microbiology & Biotechnology, 2011, 90(4): 1193-1206. DOI:10.1007/s00253-011-3212-8.
[4] STOVER P J. One-carbon metabolism-genome interactions in folateassociated pathologies[J]. Journal of Nutrition, 2009, 139(12): 2402-2405. DOI:10.3945/jn.109.113670.
[5] WALLINGFORD J B, NISWANDER L A, SHAW G M, et al. The continuing challenge of understanding, preventing, and treating neural tube defects[J]. Science, 2013, 339: 1047. DOI:10.1126/ science.1222002.
[6] XIE R H, LIU Y J, RETNAKARAN R, et al. Maternal folate status and obesity/insulin resistance in the offspring: a systematic review[J]. International Journal of Obesity, 2005, 40(1): 1-9. DOI:10.1038/ ijo.2015.189.
[7] WANG Y, CAO Z, PENG Z, et al. Folic acid supplementation,preconception body mass index, and preterm delivery: findings from the preconception cohort data in a Chinese rural population[J]. BMC Pregnancy and Childbirth, 2015, 15(1): 1-9. DOI:10.1186/s12884-015-0766-y.
[8] SCHNELL J R, DYSON H J, WRIGHT P E. Structure, dynamics,and catalytic function of dihydrofolate reductase[J]. Annual Review of Biophysics and Biomolecular Structure, 2004, 33(1): 119-140. DOI:10.1146/annurev.biophys.33.110502.133613.
[9] FIELD M S, KAMYNINA E, AGUNLOYE O C, et al. Nuclear enrichment of folate cofactors and methylenetetrahydrofolate dehydrogenase 1 (MTHFD1) protect de novo thymidylate biosynthesis during folate deficiency[J]. Journal of Biological Chemistry, 2014,289(43): 29642-29650. DOI:10.1074/jbc.M114.599589.
[10] NILSSON R, JAIN M, MADHUSUDHAN N, et al. Metabolic enzyme expression highlights a key role for MTHFD2 and the mitochondrial folate pathway in cancer[J]. Nature Communications, 2014, 5(1): 155-164. DOI:10.1038/ncomms4128.
[11] GANGJEE A, LIN X, QUEENER S F. 7-Methyl trimethoprim analogues as inhibitors of the folate metabolizing enzymes[J]. Journal of Heterocyclic Chemistry, 2003, 40(3): 507-512. DOI:10.1002/ jhet.5570400315.
[12] GANGJEE A, LIN X, QUEENER S F, et al. 7-Methyl trimethoprim analogues as inhibitors of folate metabolizing enzymes[J]. Cheminform, 2003, 34(45): 507-512. DOI:10.1002/chin.200345133.[13] FAN J, YE J B, KAMPHORST J J, et al. Quantitative flux analysis reveals folate-dependent NADPH production[J]. Nature, 2014, 513: 298-302. DOI:10.1038/nature13675.
[14] AHDJOUDJ S, FROMIGUE O, MARIE P J. Plasticity and regulation of human bone marrow stromal osteoprogenitor cells: potential implication in the treatment of age-related bone loss[J]. Histology & Histopathology, 2004, 19(1): 151-157.
[15] WOLINS N E, QUAYNOR B K, SKINNER J R, et al. OP9 mouse stromal cells rapidly differentiate into adipocytes: characterization of a useful new model of adipogenesis[J]. Journal of Lipid Research, 2006,47(2): 450-460. DOI:10.1194/jlr.D500037-JLR200.
[16] TONDER A V, JOUBERT A M, CROMARTY A D. Limitations of the 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl-2H-tetrazolium bromide (MTT) assay when compared to three commonly used cell enumeration assays[J]. Bmc Research Notes, 2014, 8(1): 1-10. DOI:10.1186/s13104-015-1000-8.
[17] POULOS S P, DODSON M V, HAUSMAN G J. Cell line models for differentiation: preadipocytes and adipocytes[J]. Experimental Biology & Medicine, 2010, 235(10): 1185-1193. DOI:10.1258/ ebm.2010.010063.
[18] GREENBERGER J S. Sensitivity of corticosteroid-dependent insulinresistant lipogenesis in marrow preadipocytes of obese-diabetic (db/db)mice[J]. Nature, 1978, 275: 752-754.
[19] HE Y, MO Q, HU Y, et al. E. adenophorum induces cell cycle arrest and apoptosis of splenocytes t hrough the mitochondrial pathway and caspase activation in Saanen goats[J]. Scientific Reports, 2015, 5: 15967. DOI:10.1038/srep15967.
[20] TSENG S J, LIAO Z X, KAO S H, et al. Highly specific in vivo gene delivery for p53-mediated apoptosis and genetic photodynamic therapies of tumour[J]. Nature Communications, 2015, 6: 6456. DOI:10.1038/ncomms7456.
[21] STUDENT A K, HSU R Y, LANE M D. Induction of fatty acid synthetase synthesis in differentiating 3T3-L1 preadipocytes[J]. Journal of Biological Chemistry, 1980, 255(10): 4745-4750.
[22] PAWELEK P D, MACKENZIE R E. Methenyltetrahydrofolate cyclohydrolase is rate limiting for the enzymatic conversion of 10-formyltetrahydrofolate to 5,10-methylenetetrahydrofolate in bifunctional dehydrogenase-cyclohydrolase enzymes[J]. Biochemistry,1998, 37(4): 1109-1115. DOI:10.1021/bi971906t.
[23] PATEL H, di PIETRO E, MEJIA N, et al. NAD- and NADP-dependent mitochondrially targeted methylenetetrahydrofolate dehydrogenase-cyclohydrolases can rescue mthfd2 null fibroblasts[J]. Archives of Biochemistry & Biophysics, 2005, 442(1): 133-139. DOI:10.1016/j.abb.2005.07.022.
[24] SHIN M, BRYANT J D, MOMB J, et al. Mitochondrial MTHFD2L is a dual redox cofactor-specific methylenetetrahydrofolate dehydrogenase/methenyltetrahydrofolate cyclohydrolase expressed in both adult and embryonic tissues[J]. Journal of Biological Chemistry,2014, 289(22): 15507-15517. DOI:10.1074/jbc.M114.555573.
[25] M E J I A N R, M A C K E N Z I E R E. N A D-d e p e n d e n t methylenetetrahydrofolate dehydrogenase is expressed by immortal cells[J]. Journal of Biological Chemistry, 1985, 260(27): 14616-14620.
Effects of Folate Metabolism Inhibitors on the Proliferation and Differentiation of OP9 Mouse Stromal Cells
WANG Hongchao, LIU Yuan, GU Zhennan, CHEN Haiqin, ZHANG Hao, CHEN Wei, CHEN Yongquan
*
(School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
Abstract:Folate is a water-soluble vitamin B which has important physiological functions. The effects of methotrexate(MTX), trimethoprim (TMP), and pyrimethamine (PTM) on the proliferation and differentiation of OP9 mouse stromal cells were investigated by methyl thiazolyl tetrazolium (MTT) assay, cell morphology analysis and induced differentiation combined with oil red O staining. MTX, TMP and PTM significantly inhibited the proliferation of OP9 cells in a dosedependent manner within a certain concentration range. Cell morphology analysis showed that MTX, TMP and PTM were cytotoxic to OP9 cells at high concentration. The results of inverted electron microscopic observation and oil red staining showed that only TMP significantly inhibited the differentiation of OP9 cells in a dose-dependent manner in the range of 500-1 000 μmol/L. The transcription levels of DHFR and MTHFD1 were down-regulated by TMP, which may explain why the differentiation of OP9 cells was inhibited by TMP.
Key words:dihydrololate reductase inhibitors; OP9 mouse stromal cells; lipid synthesis; proliferation; differentiation
DOI:10.7506/spkx1002-6630-201615036
中图分类号:Q28
文献标志码:A
文章编号:1002-6630(2016)15-0215-06
DOI:10.7506/spkx1002-6630-201615036. http://www.spkx.net.cn
收稿日期:2016-04-11
基金项目:国家自然科学基金青年科学基金项目(31400038)
作者简介:王鸿超(1985—),男,讲师,博士,研究方向为食品生物技术。E-mail:hcwang@jiangnan.edu.cn
*通信作者:陈永泉(1961—),男,教授,博士,研究方向为营养因子与人体健康。E-mail:yqchen@jiangnan.edu.cn
引文格式: