周先艳,樊 建,唐远龙,庄永亮,孙丽平 *
(昆明理工大学 云南省食品安全研究院,云南 昆明 650500)
摘 要:对罗非鱼皮胶原蛋白水解制备水解产物(tilapia skin gelatin hydrolysate,TSGH),分离得到3 个肽组分(TSGH-1、TSGH-2和TSGH-3),分析肽组分氨基酸组成,并对TSGH-3的体外抗氧化活性和体内抗衰老能力进行评价。结果表明:TSGH-3的分子质量低,疏水性氨基酸含量高,从自由基清除和金属螯合两个方面证实了TSGH-3具有很好的体外抗氧化活性。TSGH-3能显著增加由D-半乳糖诱导衰老大鼠的血清、肝脏和肾脏组织的总抗氧化能力、超氧化物歧化酶和谷胱甘肽过氧化物酶活性,并且能显著降低丙二醛的含量。此外,TSGH-3的摄入可以保护大鼠的肝脏和肾脏指数。因此,TSGH-3在抗氧化、抗衰老方面具有较好的应用潜力。
关键词:罗非鱼皮胶原蛋白水解产物;氨基酸组成;抗氧化活性;抗衰老
周先艳, 樊建, 唐远龙, 等. 罗非鱼皮胶原蛋白水解产物的体外抗氧化活性和体内抗衰老作用[J]. 食品科学, 2016,37(15): 221-226. DOI:10.7506/spkx1002-6630-201615037. http://www.spkx.net.cn
ZHOU Xianyan, FAN Jian, TANG Yuanlong, et al. In vitro antioxidant activity and in vivo anti-aging effect of tilapia skin gelatin hydrolysates[J]. Food Science, 2016, 37(15): 221-226. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201615037. http://www.spkx.net.cn
自然衰老几乎存在于所有生物体中,是一个极其复杂的过程 [1],随着衰老程度的增加,会产生过多的活性氧(reactive oxygen species,ROS),并且减弱机体抗氧化防御系统。ROS的形成会引起细胞膜的损伤和DNA的氧化应激。氧化性损伤会造成细胞损伤和凋亡,导致一些与年龄相关的慢性疾病恶化,包括阿尔茨海默症、帕金森病、心脏病、动脉粥样硬化、糖尿病等 [2-3],还有一些其他相关疾病,如氧化反应导致老年痴呆患者大脑中生物小分子的积累 [4]。因此,随着世界老龄人口的增加,有关抗氧化和抗衰老的研究已经成为热点研究课题 [5]。
胶原蛋白及其水解产物作为医学和食品工业的原材料,由于其具有良好的生物活性、生物相容性和渗透性,并且对机体无刺激性,而被用作重要的活性成分 [6]。胶原蛋白含有丰富的疏水性氨基酸,这些氨基酸使其具有更高的抗氧化活性。因此,胶原蛋白能够用于提供天然的ROS清除肽 [6]。
近期研究表明,鱼皮具有易得到、污染少、无疾病传播的风险、无宗教障碍以及胶原蛋白产量高等特点,因而成为胶原蛋白的较好来源 [7-8]。罗非鱼(tilapia)属于鲈形目丽鱼科罗非鱼属,是世界上重要的淡水养殖鱼类 [9]。在过去的几年中,罗非鱼的生产量和加工量稳步增长,并已成为领先出口的水产品之一。为了有效提高罗非鱼皮的规模性应用以及证实其抗氧化和抗衰老活性,在本研究中评价了罗非鱼皮胶原蛋白水解产物(tilapia skin gelatin hydrolysate,TSGH)的体外抗氧化活性和体内抗衰老能力及作用机制。
1.1 材料与试剂
罗非鱼皮胶原蛋白水解产物(TSGH) 由昆明理工大学云南省食品安全研究院实验室制备 [10]。
Sephadex G-25 通用电气医疗集团;乙腈(色谱纯) 德国Merck KGaA公司;2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS) 美国Sigma公司;D-半乳糖 上海源聚生物科技有限公司;总抗氧化能力(total antioxidant capacity,T-AOC)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和丙二醛(malondialdehyde,MDA)试剂盒 南京建成生物技术研究所。
1.2 实验动物
50 只6 周龄昆明雄性大鼠,体质量为18~25 g,由安徽长临河医药科技有限公司提供。
1.3 仪器与设备
高效液相色谱仪(high performance liquid chromatograph,HPLC) 安捷伦科技有限公司;AL204型电子天平梅特勒-托利多(上海)有限公司;HH-4数显恒温水浴锅金坛市科析仪器有限公司;TU-1901紫外-可见分光光度计北京普析通用仪器有限公司;TGL-20B高速台式离心机上海安亭科学仪器厂。
1.4 实验方法
1.4.1 罗非鱼皮胶原蛋白水解产物的纯化
将冻干的TSGH粉末溶于蒸馏水中,使其质量浓度为300 mg/mL,然后用蒸馏水平衡过的Sephadex G-25凝胶柱(Ф1.6 cm×80 cm)进行分离,洗脱液为蒸馏水,流速为0.5 mL/min,每6 min收集1 管,在220 nm波长处检测吸光度。多次重复以上纯化步骤至收集到的肽足够进行后续实验。
1.4.2 氨基酸组成分析
将样品用6 mol/L HCl在110 ℃条件下水解24 h后,采用HPLC方法测定氨基酸组成。总的疏水性氨基酸(total hydrophobic amino acids,THAA)含量以Ala、Val、Leu、Ile、Phe、Pro、Cys和Met的总量进行计算。
1.4.3 体外抗氧化活性测定
1.4.3.1 羟自由基(·OH)清除能力的测定
采用莫开菊等 [11]的方法:吸取1.0 mL样品于10 mL离心管中,分别加入8.0 mmol/L FeSO 4溶液0.3 mL,3.0 mmol/L水杨酸溶液1.0 mL以及20 mmol/L H 2O 2溶液0.25 mL,37 ℃水浴30 min,取出用流水冷却至室温后,加入0.45 mL纯水,使最终体积为3.0 mL,3 000 r/min离心10 min,取上清液于510 nm波长处测吸光度,1 mL溶剂代替样品作为对照组。以GSH为对照,比较样品与其对·OH的清除效果。
式中:A 0为蒸馏水+FeSO 4+H 2O 2+水杨酸的吸光度;A 1为加入样品+FeSO 4+H 2O 2+水杨酸的吸光度;A 2为样品+FeSO 4+H 2O 2+水的吸光度。
1.4.3.2 ABTS +·清除能力的测定
根据Re等 [12]的方法进行测定。ABTS +·的制备方法为:5 mL 7 mmol/L ABTS与88 μL 40 mmol/L过硫酸钾混匀后,室温避光放置12~16 h,形成ABTS +·储备液,然后用乙醇稀释得到工作液,使得该工作液在30 ℃,734 nm波长处的吸光度为0.70±0.02(乙醇调零),然后将该工作液在30 ℃条件下保温备用。取0.5 mL样品与ABTS +·储备液混匀,10 s后30 ℃水浴6 min,于734 nm波长处测定吸光度。以水溶性维生素E(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox)为对照,比较样品与其对ABTS +·的清除效果。
式中:A 对照为0.5 mL乙醇+4.0 mL ABTS +·工作液(0 min时)的吸光度;A 样品对照为0.5 mL样品+4.0 mL乙醇的吸光度;A 样品为0.5 mL样品+4.0 mL ABTS +·工作液的吸光度。
1.4.3.3 Fe 2+螯合活性的测定
根据Torres-Fuentes等 [13]的方法进行测定,其方法为:3 mL样品与0.1 mL的2 mmol/L FeCl 2混匀,室温放置5 min后加入0.2 mL 5 mmol/L Ferrozine试剂,振荡混匀后室温下放置30 min,于561 nm波长处测定吸光度。Fe 2+螯合率计算见公式(3)。以乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)为对照,比较样品与其对Fe 2+的螯合效果。
式中:A 对照为3.0 mL水+0.1 mL FeCl 2+0.2 mL Ferrozine试剂的吸光度;A 样品对照为3.0 mL水+0.1 mL FeCl 2+0.2 mL水的吸光度;A 样品为3.0 mL样品+0.1 mL FeCl 2+0.2 mL Ferrozine试剂的吸光度。
1.4.4 体内抗衰老能力的测定
1.4.4.1 动物分组及处理
动物按标准认证的饮食和自来水进行饲养,并且在实验前让其有3 d时间适应新环境。在本研究中,所有动物在黑暗的动物房里饲养12 h,温度为18~21 ℃,相对湿度为45%~65%。为了减少污染,把大鼠饲养在干净的笼子里,适应环境3 d后,根据大鼠质量将其分为5 组,每组10 只:对照组(CG)、D-半乳糖模型组(DG)、TSGH-3高剂量组(HG)、TSGH-3中剂量组(MG)和TSGH-3低剂量组(LG)。向DG、HG、MG和LG组的大鼠经腹腔注射1 000 mg/(kg·d)的D-半乳糖,对照组(CG)腹腔注射相同体积的生理盐水(0.9%);LG、MG和HG组大鼠分别每天口腔灌喂50、100、150 mg/(kg·d)的TSGH-3(溶于2.0 mL蒸馏水中);对照组(CG)和D-半乳糖(MG)组的大鼠经口腔灌喂0.2 mL的生理盐水(0.9%)。每周对大鼠称质量1 次,并按其质量变化调整注射和灌喂的剂量。整个实验过程为期45 d。
1.4.4.2 不同组织抗氧化指数的测定
45 d后,对大鼠进行空腹处理,然后收集血液进行分离,并在5 ℃、2 000 r/min条件下离心血清15 min。收集肝脏和肾脏,用冰的生理盐水洗掉血液,然后用滤纸吸掉上面的水分。用相应的试剂盒测定血清、肝脏和肾脏的SOD和GSH-Px活性以及T-AOC和MDA水平。以牛血清白蛋白作为标准,按照试剂盒的操作说明,采用Lowry法测定蛋白浓度。
1.4.4.3 脏器指数的测定
收集肝脏和肾脏,其脏器指数按照下式进行计算。
1.5 数据分析
使用SPSS 16.0进行数据处理,数据表示为
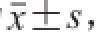 ,显著性差异为P<0.05。
,显著性差异为P<0.05。
2.1 纯化肽的特征
用Sephadex G-25凝胶柱分离纯化TSGH,收集到3 个主要的肽段,分别为TSGH-1、TSGH-2和TSGH-3,结果见图1。根据凝胶分离的原理可知,3 个肽段的分子质量大小为:TSGH-3<TSGH-2<TSGH-1。
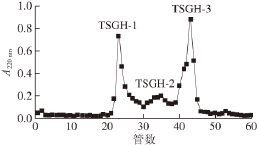
图1 Sephadex G-25凝胶柱分离活性组分的色谱图
Fig. 1 Chromatogram of bioactive fractions isolated by Sephadex G-25 gel column
每个肽段的氨基酸组成分析如表1所示,3 种肽段均富含Gly、Glu、Asp、Pro和Ala,而Cys、Met和Phe的含量较低,这和其他胶原蛋白水解产物类似。由表1可知,TSGH-3的疏水性氨基酸总量(32.09%)明显高于TSGH-1(28.16%)和TSGH-2 (30.22%),表明TSGH-3具有较高的抗氧化活性。因此选用TSGH-3进行后续的实验。
表1 TSGH肽段的氨基酸组成
Table 1 Amino acid compositions of the fractions of TSGH
‰
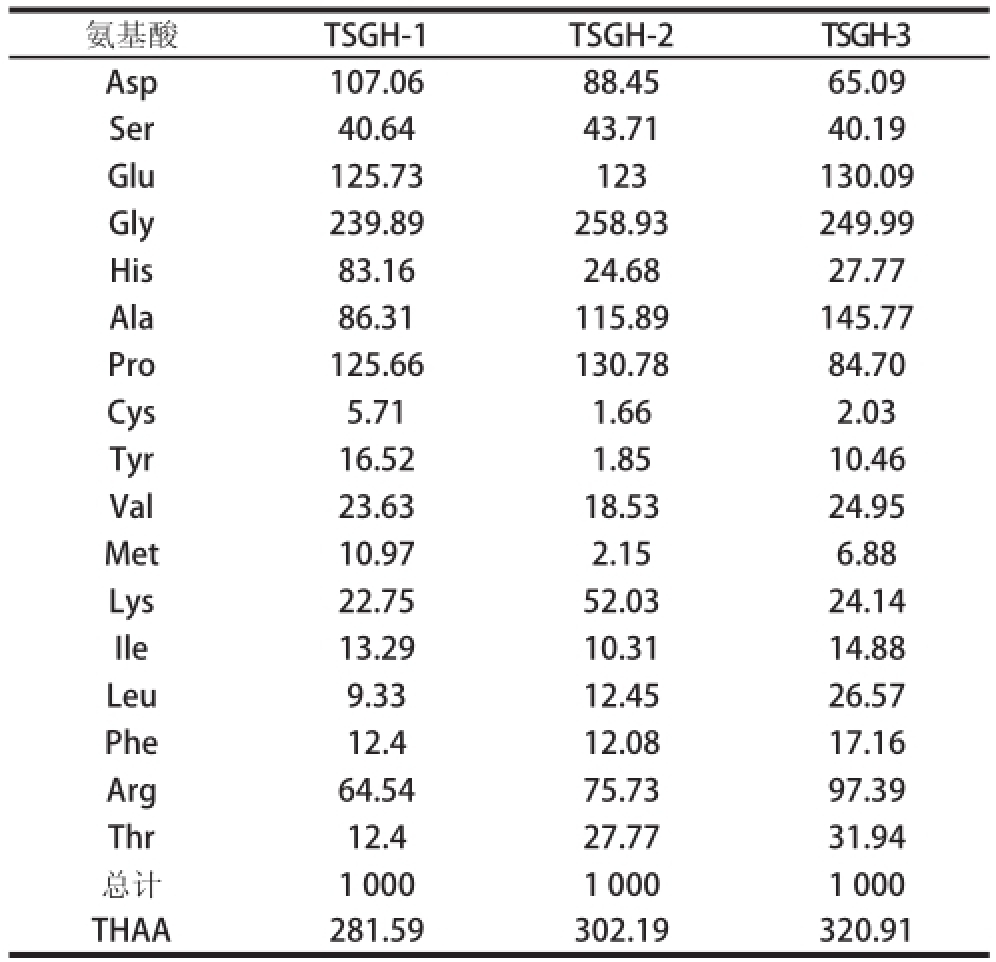
氨基酸TSGH-1TSGH-2TSGH-3 Asp107.0688.4565.09 Ser40.6443.7140.19 Glu125.73123130.09 Gly239.89258.93249.99 His83.1624.6827.77 Ala86.31115.89145.77 Pro125.66130.7884.70 Cys5.711.662.03 Tyr16.521.8510.46 Val23.6318.5324.95 Met10.972.156.88 Lys22.7552.0324.14 Ile13.2910.3114.88 Leu9.3312.4526.57 Phe12.412.0817.16 Arg64.5475.7397.39 Thr12.427.7731.94总计1 0001 0001 000 THAA281.59302.19320.91
2.2 体外抗氧化活性
2.2.1
 清除能力
清除能力
由图2可知,TSGH-3的·OH清除率随其质量浓度的增加而增大,其半抑制浓度(50% maximal inhibitory concentration,IC 50)值为383.5 μg/mL。在质量浓度为800 μg/mL时,TSGH-3和GSH的清除活性均达到最大,分别为74.8%和82.2%。
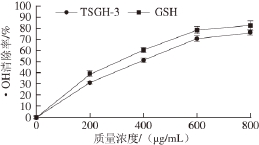
图2 不同质量浓度TSGH--33的·OHH清除活性
Fig. 2 Hydroxyl free radical scavenging activity of TSGH-3 at different concentrations in vitro
2.2.2 ABTS +·清除能力
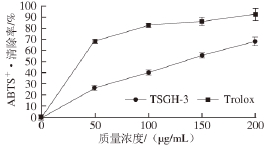
图3 TSGH-3在不同质量浓度下的ABBTTSS
+·清除能力
Fig. 3 ABTS free radical scavenging activity of TSGH-3 at different concentrations in vitro
由图3可知,与Trolox相比,不同质量浓度的TSGH-3的ABTS +·清除能力,TSGH-3的活性低于Trolox,其清除活性随样品质量浓度的增加而增大,成线性相关。TSGH-3对ABTS +·清除能力的IC 50为132.4 μg/mL。
2.2.3 Fe 2+螯合能力
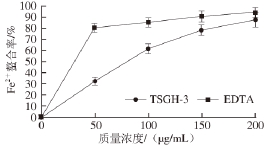
图4 TSGH-3在不同质量浓度下的FFee
2+螯合能力
Fig. 4 Fe
2+-chelating ability of TSGH-3 at different concentrations in vitro
由图4可知,随着样品质量浓度的增加,Fe 2+螯合能力增大。在质量浓度为200 μg/mL时,TSGH-3和EDTA的螯合能力分别为81.2%和94.8%,证明了TSGH-3具有Fe 2+螯合能力。
2.3 TSGH-3的体内抗氧化作用
2.3.1 TSGH-3对大鼠不同组织中T-AOC的影响
表2 TSGH-3对大鼠不同组织中T-AOC活力的影响
Table 2 Effect of TSGH-3 on T-AOC in different tissues of rats
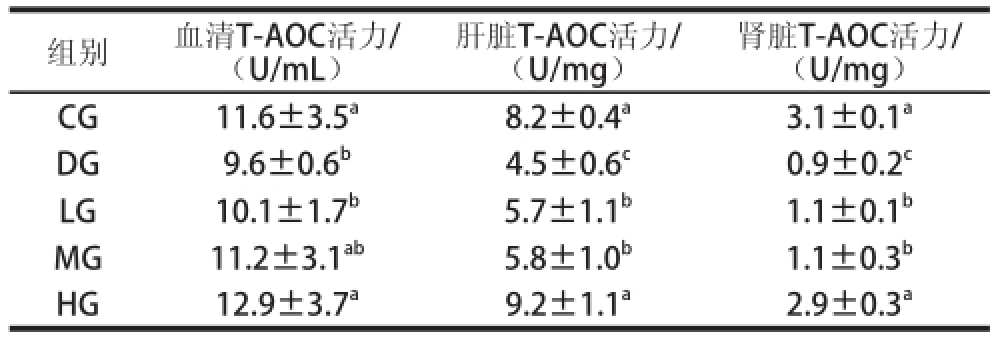
注:同列小写字母不同表示差异显著(P<0.05)。下同。
肾脏T-AOC活力/(U/mg)CG11.6±3.5 a8.2±0.4 a3.1±0.1 aDG9.6±0.6 b4.5±0.6 c0.9±0.2 cLG10.1±1.7 b5.7±1.1 b1.1±0.1 bMG11.2±3.1 ab5.8±1.0 b1.1±0.3 bHG12.9±3.7 a9.2±1.1 a2.9±0.3 a组别血清T-AOC活力/(U/mL)肝脏T-AOC活力/(U/mg)
如表2所示,不同组织中DG的T-AOC显著低于CG组(P<0.05),结果表明D-乳糖会破坏机体的抗氧化系统,加速衰老进程,随着TSGH-3质量浓度的增加T-AOC增大。在血清中,MG和HG组中的T-AOC显著高于DG组(P<0.05),HG与CG无显著性差异(P>0.05)。在肝脏中,TSGH-3的浓度非常重要,HG的T-AOC显著高于LG和MG组(P<0.05),而MG和LG没有显著性差异(P>0.05)。肾脏中的变化与肝脏中的类似,也就是说TSGH-3能够改善D-半乳糖诱导的衰老大鼠的抗氧化活性。
2.3.2 TSGH-3对大鼠不同组织中MDA含量的影响
表3 TSGH-3对大鼠不同组织中MDA含量的影响
Table 3 Effect of TSGH-3 on MDA contents in different tissues of rats
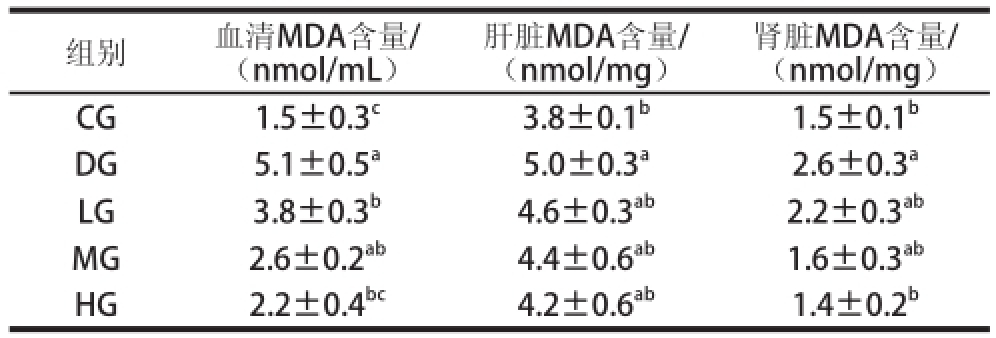
组别血清MDA含量/(nmol/mL)肾脏MDA含量/(nmol/mg)CG1.5±0.3 c3.8±0.1 b1.5±0.1 bDG5.1±0.5 a5.0±0.3 a2.6±0.3 aLG3.8±0.3 b4.6±0.3 ab2.2±0.3 abMG2.6±0.2 ab4.4±0.6 ab1.6±0.3 abHG2.2±0.4 bc4.2±0.6 ab1.4±0.2 b肝脏MDA含量/(nmol/mg)
由表3可知,在不同组织中,DG组的MDA含量显著高于CG组(P<0.05),进一步证明了用D-半乳糖处理大鼠能成功地重现动物衰老模型。TSGH-3能减少MDA含量,并且随着TSGH-3质量浓度的增加,MDA含量降低。然而,TSGH-3处理的3 个剂量组并没有显著性差异(P>0.05)。
2.3.3 TSGH-3对大鼠不同组织中SOD活性的影响
表4 TSGH-3对大鼠不同组织中SOD活性的影响
Table 4 Effect of TSGH-3 on SOD activity in different tissues of rats
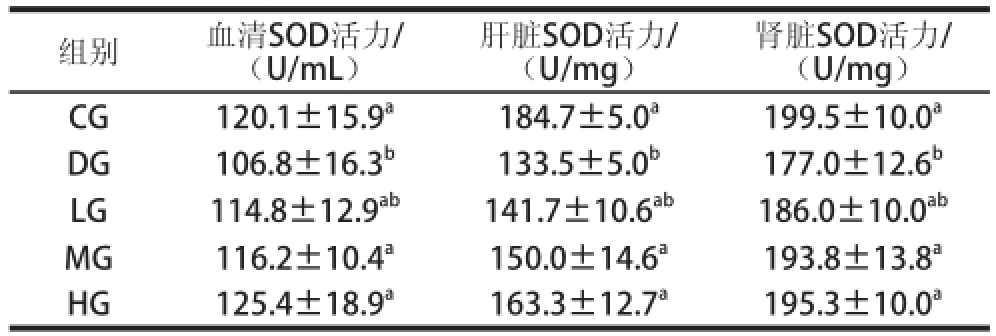
组别血清SOD活力/(U/mL)肾脏SOD活力/(U/mg)CG120.1±15.9 a184.7±5.0 a199.5±10.0 aDG106.8±16.3 b133.5±5.0 b177.0±12.6 bLG114.8±12.9 ab141.7±10.6 ab186.0±10.0 abMG116.2±10.4 a150.0±14.6 a193.8±13.8 aHG125.4±18.9 a163.3±12.7 a195.3±10.0 a肝脏SOD活力/(U/mg)
如表4所示,与CG组相比,DG组的SOD活性显著降低(P<0.05)。随着TSGH-3质量浓度的增加,可以有效地保护大鼠中SOD的活性,LG组的SOD活性与CG组无显著性差异(P>0.05)。以上结果均可表明TSGH-3能明显阻止由D-半乳糖诱导的超氧自由基对机体的损伤,并且在较低的质量浓度下就能改善SOD的产生。
2.3.4 TSGH-3对大鼠不同组织中GSH-Px活性的影响
表5 TSGH-3对大鼠不同组织中GSH-Px活性的影响
Table 5 Effect of TSGH-3 on GSH-Px activity in different tissues of rats
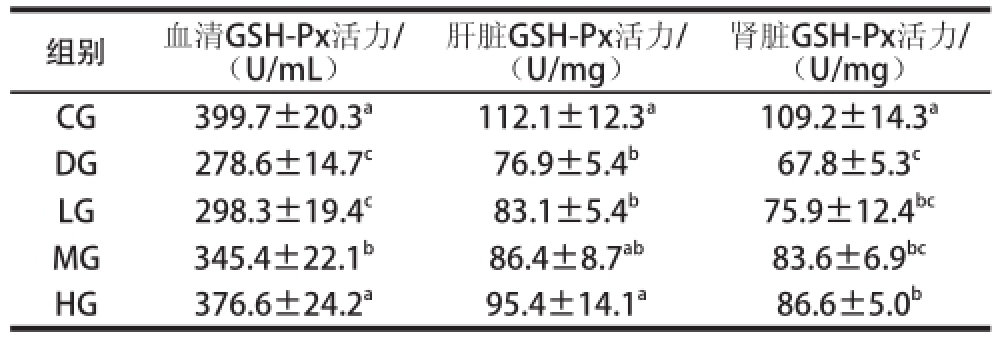
组别血清GSH-Px活力/(U/mL)肾脏GSH-Px活力/(U/mg)CG399.7±20.3 a112.1±12.3 a109.2±14.3 aDG278.6±14.7 c76.9±5.4 b67.8±5.3 cLG298.3±19.4 c83.1±5.4 b75.9±12.4 bcMG345.4±22.1 b86.4±8.7 ab83.6±6.9 bcHG376.6±24.2 a95.4±14.1 a86.6±5.0 b肝脏GSH-Px活力/(U/mg)
由表5可知,DG组中的血清、肝脏和肾脏组织的GSH-Px活性显著低于CG组(P<0.05),LG、MG和HG组的抗氧化活性均高于DG组。HG组血清和肝脏组织中的GSH-Px活性与CG组无显著性差异(P>0.05),肾脏中HG与DG组相比GSH-Px活性有显著性差异(P<0.05)。以上结果表明,TSGH-3对D-半乳糖诱导的衰老大鼠中GSH-Px活性的再生有一定的影响。
2.3.5 TSGH-3对大鼠内脏组织的影响
表6 TSGH-3对大鼠脏器指数的影响
Table 6 Effect of TSGH-3 on visceral indices of rats %
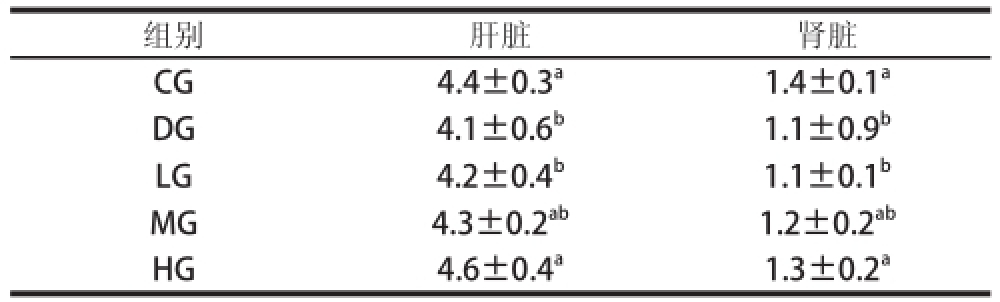
组别肝脏肾脏CG4.4±0.3 a1.4±0.1 aDG4.1±0.6 b1.1±0.9 bLG4.2±0.4 b1.1±0.1 bMG4.3±0.2 ab1.2±0.2 abHG4.6±0.4 a1.3±0.2 a
由表6可知,DG组的肝脏和肾脏指数显著低于CG组(P<0.05),初步表明衰老模型建立成功。TSGH-3的修复作用表明了剂量对衰老大鼠脏器指数的影响,HG组显著高于DG组(P<0.05),与CG组无显著性差异(P>0.05)。因此,推论出TSGH-3具有修复由D-半乳糖诱导的衰老大鼠的肝脏和肾脏功能。
在蛋白水解液的抗氧化活性中,分子质量的分布和氨基酸的组成起着很重要的作用 [14-15]。一般来说,分子质量和抗氧化活性之间没有直接的关系,然而,很多研究表明低分子质量的蛋白水解产物具有较高的抗氧化活性 [16]。此外,低分子质量的肽在肠道内易被吸收,到达血液和靶器官。在本研究中,TSGH-3是TSGH中分子质量较低的部分。此外,一些研究显示高含量的疏水性氨基酸可以增加胶原蛋白肽在油脂中的溶解度,进而提高抗氧化活性 [17]。TSGH-3的THAA含量高于TSGH-1和TSGH-2,因此,TSGH-3具有较高的抗氧化活性。
由于没有单一的抗氧化标准方法来测定抗氧化活性,因此推荐使用不同的方法来分析抗氧化能力的不同机理 [6,18]。在本次研究中,采用了3 种方法来评价TSGH-3的体外抗氧化活性,包括·OH和ABTS +·清除活性以及Fe 2+螯合能力,检测了自由基清除和金属螯合两种机制。结果表明TSGH-3具有很好的体外清除自由基和金属螯合活性。
目前,通过注射D-半乳糖的方式形成的自然衰老已经成为常用的实验模型,因为以这种方法处理的动物与自然衰老具有相同的特点,如随着抗氧化酶的活性降低,线粒体功能失调,以及产生神经毒素 [19]。此外,许多研究表明由于给药D-半乳糖,形成过多的ROS和积累过多的由美拉德反应产生的糖基化终末产物(advanced glycation end products,AGEs)会加速动物模型的衰老,其中ROS的关注度最高 [20]。因此在本研究中,选择这种模型来评价TSGH-3的抗衰老能力。
氧化应激是由于自由基的产生与抗氧化防御系统能力间失衡,从而产生大量的氧化中间产物 [21]。健康与否与体内防御系统的T-AOC紧密相关,在评价机体抗氧化能力时,T-AOC是一种很重要的指标。正如研究结果中描述,注射D-半乳糖后,衰老大鼠的T-AOC显著降低(P<0.05)。然而,由于TSGH-3具有抗氧化活性,能显著增加大鼠的抗氧化能力(P<0.05)。
过多活性氧自由基的产生会引起存在于生物膜上的多不饱和脂肪酸氧化,并且形成一系列脂质过氧化产物MDA,从而引起细胞损伤 [22]。许多研究表明,MDA含量的增加是机体衰老的信号,MDA的含量能间接地反映出细胞受到自由基攻击的严重程度 [23]。本研究表明,在摄入TSGH-3后,血清和其他组织中MDA含量下降,说明TSGH-3可能因其自由基清除活性和金属螯合能力,而具有抑制体内脂质过氧化物的能力。
在酶促防御系统中,SOD、过氧化氢酶(catalase,CAT)和GSH-Px等酶起着主要作用 [24],SOD可以将超氧自由基转变为过氧化氢,同时,CAT将过氧化氢分解为水和氧气。另一方面,GSH-Px将过氧化氢分解为谷胱甘肽中存在的其他化合物 [25]。在本研究中,衰老大鼠的SOD和GSH-Px活性在注射D-半乳糖后显著降低(P<0.05)。TSGH-3能增大血清、肝脏和肾脏的SOD和GSH-Px活性,并保护体内抗氧化防御系统,从而抑制器官老化。
脏器指数是实验动物脏器质量和体质量的比例,由于这种方法的简单和灵敏性,而被广泛用于毒理学实验中 [26]。肝脏指数和肾脏指数可以用作体内抗氧化能力的指标。在本研究中,TSGH-3能抑制肝脏和肾脏指数的降低,从而增加大鼠的体内抗氧化能力。
研究表明,TSGH-3具有较高的体外抗氧化活性,并且在大鼠体内能抑制由D-半乳糖诱导的衰老。体外抗氧化活性通过测定·OH和ABTS +·清除能力以及Fe 2+螯合能力进行评价。预防衰老的作用通过血清、肝脏和肾脏中T-AOC、SOD、GSH-Px和MDA的定量分析以及肝脏和肾脏的指数进行评价,这些活性与TSGH-3的分子质量和氨基酸组成有关。因此,可推测食品和营养物质中富含TSGH-3对人体衰老的预防有一定的作用。
参考文献:
[1] KAWAKAMI K, KADOTA J, IIDA K, et al. Reduced immune function and malnutrition in the elderly[J]. Tohoku Journal of Experimental Medicine,1999, 187(2): 157-171. DOI:10.1620/tjem.187.157.
[2] TENG D, FANG Y, SONG X Y, et al. Optimization of enzymatic hydrolysis parameters for antioxidant capacity of peptide from goat placenta[J]. Food and Bioproducts Processing, 2011, 89(3): 202-208. DOI:10.1016/j.fbp.2010.05.001.
[3] ABUJA P, ALBERTINI R. Methods for monitoring oxidative stress, lipid peroxidation and oxidation resistance of lipoproteins[J]. Clinica Chimica Acta, 2001, 306(1/2): 1-17. DOI:10.1016/S0009-8981(01)00393-X.
[4] LIU Q, RAINA A K, SMITH M A, et al. Hydroxynonenal, toxic carbonyls, and Alzheimer disease[J]. Molecular Aspects of Medicine,2003, 24(4/5): 305-313. DOI:10.1016/S0098-2997(03)00025-6.
[5] KARIM A A, BHAT R. Fish gelatin: properties, challenges,and prospects as an alternative to mammalian gelatins[J]. Food Hydrocolloids, 2009, 23(3): 563-576. DOI:10.1016/ j.foodhyd.2008.07.002.
[6] ZHUANG Y L, SUN L P, ZHAO X, et al. Investigation of gelatin polypeptides of jellyfish (Rhopilema esculentum) for their antioxidant activity in vitro[J]. Food Technology and Biotechnology, 2010, 48: 222-228.
[7] LI H, LIU B L, GAO L Z, et al. Studies on bullfrog skin collagen[J]. Food Chemistry, 2004, 84(1): 65-69. DOI:10.1016/S0308-8146(03)00167-5.
[8] SADOWSKA M, KOŁODZIEJSKA I, NIECIKOWSKA C. Isolation of collagen from the skins of Baltic cod (Gadus morhua)[J]. Food Chemistry, 2003, 81(2): 257-262. DOI:10.1016/S0308-8146(02)00420-X.
[9] ZENG S K, ZHANG C H, YANG P, et al. Isolation and characterisation of acid-solubilised collagen from the skin of Nile tilapia(Oreochromis niloticus)[J]. Food Chemistry, 2009, 116(4): 879-883. DOI:10.1016/j.foodchem.2009.03.038.
[10] ZHANG Y, DUAN X, ZHUANG Y. Purification and characterization of novel antioxidant peptides from enzymatic hydrolysates of Tilapia(Oreochromis niloticus) skin gelatin[J]. Peptides, 2012, 38(1): 13-21. DOI:10.1016/j.peptides.2012.08.014.
[11] 莫开菊, 柳圣, 程超, 等. 生姜黄酮的抗氧化活性研究[J]. 食品科学,2006, 27(9): 110-115. DOI:10.3321/j.issn:1002-6630.2006.09.022.
[12] RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine, 1999, 26(9/10): 1231-1237. DOI:10.1016/S0891-5849(98)00315-3.
[13] TORRES-FUENTES C, ALAIZ M, VIOQUE J. Iron-chelating activity of chickpea protein hydrolysate peptides[J]. Food Chemistry, 2012,134(3): 1585-1588. DOI:10.1016/j.foodchem.2012.03.112.
[14] ZHUANG Y L, SUN L P. Preparation of reactive oxygen scavenging peptides from tilapia (Oreochromis niloticus) skin gelatin: optimization using response surface methodology[J]. Journal of Food Science,2011, 76(3): C483-C489. DOI:10.1111/j.1750-3841. 2011.02108.x.
[15] ZHUANG Y L, ZHAO X, LI B F. Optimization of antioxidant activity by response surface methodology in hydrolysates of jellyfish (Rhopilema esculentum) umbrella collagen[J]. Journal of Zhejiang Universtiy-Science B,2009, 10(8): 572-579. DOI:10.1631/jzus.B0920081.
[16] MENDIS E, RAJAPAKSE N, BYUN H G, et al. Investigation of jumbo squid (Dosidicus gigas) skin gelatin peptides for their in vitro antioxidant effects[J]. Life Science, 2005, 77(17): 2166-2178. DOI:10.1016/j.lfs.2005.03.016.
[17] KIM S K, KIM Y T, BYUN H G, et al. Isolation and characterization of antioxidative peptides from gelatin hydrolysate of Alaska pollack skin[J]. Journal of Agricultural and Food Chemistry, 2001, 49(4): 1984-1989. DOI:10.1021/jf000494j.
[18] MOURE A, DOMNGUEZ H, PARAJO J C. Antioxidant properties of ultrafiltration-recovered soy protein fractions from industrial effluents and their hydrolysates[J]. Process Biochemistry, 2006, 41(2): 447-456. DOI:10.1016/j.procbio.2005.07.014.
[19] CHANG L, LIU X, LIU J, et al. D-Galactose induces a mitochondrial complex I deficiency in mouse skeletal muscle: potential benefits of nutrient combination in ameliorating muscle impairment[J]. Journal of Medicinal Food, 2014, 17(3): 357-364. DOI:10.1089/jmf.2013.2830.
[20] LIN N, ZHANG H, SU Q. Advanced glycation end-products induce injury to pancreatic beta cells through oxidative stress[J]. Diabetes & Metabolism, 2012, 38(3): 250-257. DOI:10.1016/j.diabet.2012.01.003.
[21] AUTEN R L, DAVIS J M. Oxygen toxicity and reactive oxygen species: the devil is in the details[J]. Pediatric Research, 2009, 66(2): 121-127. DOI:10.1203/PDR.0b013e3181a9eafb.
[22] HOU H, LI B F, ZHAO X, et al. The effect of pacific cod (Gadus macrocephalus) skin gelatin polypeptides on UV radiation induced skin photoaging in ICR mice[J]. Food Chemistry, 2009, 115(3): 945-950. DOI:10.1016/j.foodchem.2009.01.015.
[23] SUN L P, ZHANG Y F, ZHUANG Y L. Antiphotoaging effect and purification of an antioxidant peptide from tilapia (Oreochromis niloticus) gelatin peptides[J]. Journal of Functional Foods, 2013, 5(1): 154-162. DOI:10.1016/j.jff.2012.09.006.
[24] LIM☒N-PACHECO J, GONSEBATT M E. The role of antioxidants and antioxidant-related enzymes in protective responses to environmentally induced oxidative stress[J]. Mutation Research-Genetic Toxicology and Environmental Mutagenesis, 2009, 674(2): 137-147. DOI:10.1016/j.mrgentox.2008.09.015.
[25] GU☒RAUD F, ATALAY M, BRESGEN N, et al. Chemistry and biochemistry of lipid peroxidation products[J]. Free Radical Research,2010, 44(10): 1098-1124. DOI:10.1109/MCOM.2006.1580937.
[26] FAN J, ZHUANG Y L, LI B F. Effects of collagen and collagen hydrolysate from jellyfish umbrella on histological and immunity changes of mice photoaging[J]. Nutrients, 2013, 5(1): 223-233. DOI:10.3390/nu5010223.
In vitro Antioxidant Activity and in vivo Anti-Aging Effect of Tilapia Skin Gelatin Hydrolysates
ZHOU Xianyan, FAN Jian, TANG Yuanlong, ZHUANG Yongliang, SUN Liping
*
(Yunnan Institute of Food Safety, Kunming University of Science and Technology, Kunming 650500, China)
Abstract:The amino acid composition of three peptides fractions (TSGH-1, TSGH-2 and TSGH-3) separated from tilapia skin gel atin hydrolysate (TSGH) was measured. Additionally, the antioxidant activity in vitro and anti-aging capacity in vivo of TSGH-3 were evaluated. The results showed TSGH-3 had low molecular weight and high hydrophobic amino acid contents. TSGH-3 had high antioxidant activity in vitro in terms of free radical scavenging and metal chelating activity. Furthermore, the in vivo anti-aging activity in a D-galactose-induced aging mouse model indicated that TSGH-3 could significantly increase T-AOC, SOD and GSH-Px activities in serum, liver and kidney tissues of rats (P < 0.05), and significantly decreased MDA contents (P < 0.05). Besides, liver and kidney indices of rats could be also protected after the intake of TSGH-3. Therefore, TSGH-3 possesses high antioxidant activity and can be used as a natural anti-aging agent in the medicinal and food industries.
Key words:tilapia skin gelatin hydrolysates; amino acid composition; antioxidant activity; anti-aging
DOI:10.7506/spkx1002-6630-201615037
中图分类号:TS254.9
文献标志码:A
文章编号:1002-6630(2016)15-0221-06引文格式:
收稿日期:2015-09-17
基金项目:国家自然科学基金地区科学基金项目(31360381)
作者简介:周先艳(1990—),女,硕士研究生,研究方向为食品副产品高值化利用。E-mail:zas0418@163.com
*通信作者:孙丽平(1981—),女,教授,博士,研究方向为食品副产品高值化利用。E-mail:Kmlps@163.com