酵母源金属硫蛋白对慢性汞中毒小鼠氧化损伤的修复作用
王 颖
1,2,王欣卉
1,徐炳政
3,张东杰
1
(1.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2.国家杂粮工程技术研究中心,黑龙江 大庆 163319;3.青岛琅琊台集团股份有 限公司,山东 青岛 266400)
摘 要:探讨具有自主知识产权的两种酵母源金属硫蛋白(metallothionein,MT)亚型(MT-1和MT-2)对慢性汞中毒小鼠氧化损伤的修复作用。实验小鼠经氯化汞染毒,连续灌胃两种酵母源MT及二巯基丙磺酸钠(dimercaptopropansulfonate sodium,DMPS)28 d后测定小鼠体质量、全血汞含量及血清超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力,丙二醛(malondialdehyde,MDA)含量及机体总抗氧化能力(total antioxidative capacity,T-AOC)。与正常对照组小鼠相比,模型对照组小鼠体质量显著下降(P<0.05),灌胃给药28 d后,两种酵母源MT亚型高剂量组小鼠体质量显著升高( P<0.05);各给药组小鼠血液、肝脏及肾脏汞含量显著低于模型对照组(P<0.05),两种酵母源MT亚型高剂量组的排汞效果显著优于DMPS组(P<0.05);各给药组小鼠血清中GSH-Px、SOD活力和MDA水平及总抗氧化能力接近正常对照组小鼠水平(P>0.05),其中酵母源MT高剂量组的作用效果最佳,且在改善机体T-AOC方面的效果优于DMPS组(P<0.05),酵母源MT-1亚型升高小鼠血清SOD活力和降低血清MDA含量的作用效果明显好于酵母源MT-2亚型。两种酵母源MT对慢性汞中毒小鼠具有良好的氧化损伤保护作用及排汞效果。
关键词:酵母源金属硫蛋白;汞;氧化损伤;保护
王颖, 王欣卉, 徐炳政, 等. 酵母源金属硫蛋白对慢性汞中毒小鼠氧化损伤的修复作用[J]. 食品科学, 2016, 37(15): 242-246.
WANG Ying, WANG Xinhui, XU Bingzheng, et al. Metallothioneins from yeast expell mercury and protect against oxidative damage in mice chronically treated with mercury[J]. Food Science, 2016, 37(15): 242-246. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201615041. http://www.spkx.net.cn
汞作为一种毒性IIB族金属,广泛存在于自然和人类生活环境之中。汞通常可制成消毒剂、止痛剂和治疗疥疮的药膏,并可添加于化妆品祛斑霜中,用以对脸部遮瑕及达到祛斑的效果。同时汞可制成杀虫剂及触媒剂,被广泛应用于农业和工业生产当中
[1]。随着对汞制剂日常的接触,其慢性毒性作用随之暴露。研究表明,汞在机体内被转化为二价离子态(Hg
2+),可稳定存在于血液及机体肝、肾组织当中,通过与体内巯基(—SH)及膜表面蛋白结构结合,破坏细胞膜结构,引起细胞损伤及脂质过氧化产物增加,从而产生大量自由基,使机体氧化应激反应加剧
[2-4]。目前对于汞慢性毒性的治疗一般采用以二巯基丙磺酸钠(dimercaptopropansulfonate sodium,DMPS)为主的金属离子螯合剂类药物
[5-6],但此类药物在机体内结合Hg
2+的同时会结合Ca
2+、Zn
2+等有益金属离子,造成机体金属离子稳态失衡
[7],且其在体内存留的药物副作用毒性尚未明确,缺乏一定的安全性。
金属硫蛋白(metallothionein,MT)是一类富含巯基和半胱氨酸的小分子质量胞内功能性蛋白质
[8-10]。MT内含有大量巯基,在机体内的作用表现为螯合重金属离子、清除氧自由基及修复重金属离子致机体损伤等。常见MT一般是从动物肝脏中提取,生产周期长且价格高昂、利用范围较小。酵母源MT是由Zn
2+、Cu
2+等金属离子诱导酵母细胞所分泌的一类功能性蛋白质,其相对于动物源MT具有生产周期短、价格相对低廉且高效安全的特点,受到越来越多的学者关注。本实验探讨了具有自主知识产权的两种酵母源MT亚型(MT-1、MT-2)的排汞效果及其对汞中毒小鼠机体抗氧化损伤的修复作用,旨在为酵母源MT在排汞及修复机体氧化性损伤方面提供相关数据支持和理论参考。
1 材料与方法
1.1 动物
雄性昆明小鼠,体质量(18±2) g,许可证号:SCXK-(吉)2011-0003,长春生物制品研究所有限责任公司提供。
1.2 材料与试剂
酵母源金属硫蛋白亚型(MT-1、MT-2,纯度95%),黑龙江八一农垦大学食品学院实验室分离纯化所得。
DMPS 上海研臣实业有限公司;氯化汞(HgCl
2)上海抚生生物技术有限公司;肝素钠、总抗氧化能力(total antioxidative capacity,T-AOC)测试盒、超氧化物歧化酶(superoxide dismutase,SOD)测试盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测试盒、丙二醛(malondialdehyde,MDA)测试盒 南京建成生物工程研究所。
1.3 仪器与设备
YB-P50001型电子天平 北京长拓锐新科技发展有限公司;AFS-920双道原子荧光光度计 北京吉天仪器有限公司;Tecan Sunrise酶标仪 力臻卓越科学仪器有限公司。
1.4 方法
1.4.1 动物分组与饲养
取健康昆明小鼠90 只,适应性饲养1 周,称体质量。随机抽取10 只小鼠为正常对照组(NOR组),其余用于构建慢性汞中毒小鼠模型,分别为:模型对照组(MOD组)、阳性对照组(DMPS组)、酵母源MT-1型处理组(低、中、高剂量各1 组)、酵母源MT-2型处理组(低、中、高剂量各1 组),每组小鼠10 只。
小鼠均饲养在动物实验专用塑料鼠笼中,顶部配有钢丝网盖以及自动饮水器,每2 d更换一次无菌碎木屑垫料,室温(24±2)℃、相对湿度(45±3)%,每日光照12 h,摄食标准饲料、自由饮水。
1.4.2 给药剂量与方法
28 d实验期间,小鼠每日自由摄取实验基础饲料,正常对照组小鼠每日自由饮用去离子水,汞中毒小鼠每日自由饮用含50 nmol/L HgCl
2的去离子水溶液,各组小鼠每日在同一时间灌胃给药,各组小鼠具体灌胃剂量见表1。
表1 实验动物的药剂分配
Table 1 Agent administration to experimental animals

组别药物名称灌胃剂量/(mg/(kg·d))正常对照组(NOR组)生理盐水0.40模型对照组(MOD组)生理盐水0.40阳性对照组(DMPS组)DMPS0.80 MT-1低剂量组(MT-1-L组)MT-10.16 MT-1中剂量组(MT-1-M组)MT-10.40 MT-1高剂量组(MT-1-H组)MT-10.80 MT-2低剂量组(MT-2-L组)MT-20.16 MT-2中剂量组(MT-2-M组)MT-20.40 MT-2高剂量组(MT-2-H组)MT-20.80
1.4.3 相关指标测定
实验期间,每天观察并记录小鼠形态特征及体质量变化,末次给药24 h后,每组随机抽取5 只小鼠,摘除眼球取血,分离血清,实验室试剂盒法测定小鼠血清中MDA含量,SOD及GSH-Px活力及总抗氧化能力,其余小鼠保存全血(肝素钠抗凝),并摘除肝脏、肾脏,经双道原子荧光光度计测定血液、肝脏及肾脏汞含量。
1.5 数据统计分析
数据采用
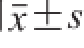 表示,采用SAS 9.1统计学软件进行统计分析,P<0.05表示具有统计学意义,Origin 8.5软件绘制相关图表。
表示,采用SAS 9.1统计学软件进行统计分析,P<0.05表示具有统计学意义,Origin 8.5软件绘制相关图表。
2 结果与分析
2.1 小鼠日常状况
实验期间观察小鼠,各慢性染毒小鼠均出现中毒症状,其中模型对照组和两种酵母源MT亚型低剂量组小鼠最为明显,其摄食量和饮水量明显减少,体毛干燥稀疏,皮肤颜色随染毒时间的增加出现青灰变色,模型对照组小鼠偶有眼睑处出现溃烂现象,个别小鼠出现中毒性震颤,对外界刺激的敏感性减弱。各组小鼠中撕咬现象随着染毒时间延长有所减少。经灌胃给药后,DMPS组小鼠和MT各剂量组小鼠的中毒症状均有不同程度缓解,且缓解程度与给药剂量大小相关。
2.2 小鼠体质量变化
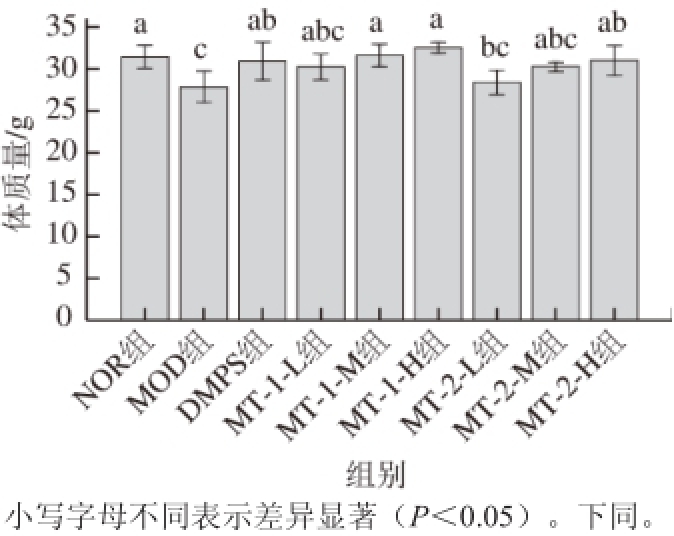
图1 实验小鼠体质量指标
Fig. 1 Body weights of experimental and control mice
实验期间小鼠体质量变化由如图1所示,小鼠经慢性染毒后,与正常对照组相比,模型对照组小鼠体质量显著降低(P<0.05),灌胃给药后,除酵母源MT-1-L组和MT-2-L、MT-2-M组外,其他给药组小鼠体质量与模型对照组相比均有不同程度改善(P<0.05),且与正常对照组小鼠无显著差异。汞进入人体内经消化道及小肠的吸收作用,引起消化道及肠胃的炎症反应,影响食物的吸收与利用
[11-12]。染毒组小鼠在经灌胃给药后,体质量降低状况有所改善。研究表明,MT与DMPS作为金属离子络合剂,对Hg
2+有明显的结合作用,在体内可结合Hg
2+而抑制其在消化道及小肠内的吸收作用,从而减轻其对消化道的损伤,并促进食物的吸收,使体质量趋于正常
[13-14]。
2.3 小鼠血清抗氧化酶系指标及总抗氧化能力
表2 小鼠血清GSH-Px、SOD活力,MDA含量及总抗氧化能力
Table 2 Serum GSH-Px, SOD, MDA levels and T-AOC in experimental animals
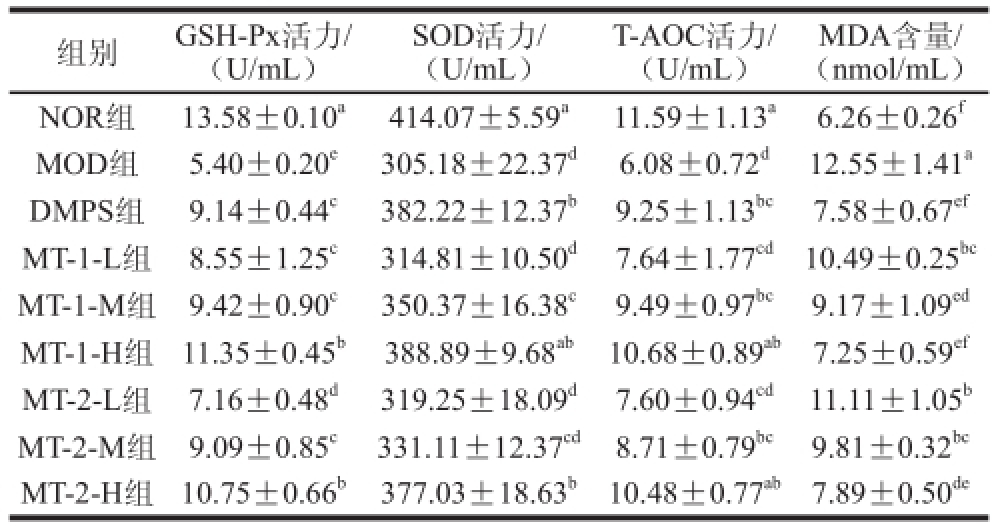
注:同列小写字母不同表示差异显著(P<0.05)。
MDA含量/(nmol/mL)NOR组13.58±0.10
a414.07±5.59
a11.59±1.13
a6.26±0.26
fMOD组5.40±0.20
e305.18±22.37
d6.08±0.72
d12.55±1.41
aDMPS组9.14±0.44
c382.22±12.37
b9.25±1.13
bc7.58±0.67
efMT-1-L组8.55±1.25
c314.81±10.50
d7.64±1.77
cd10.49±0.25
bcMT-1-M组9.42±0.90
c350.37±16.38
c9.49±0.97
bc9.17±1.09
edMT-1-H组11.35±0.45
b388.89±9.68
ab10.68±0.89
ab7.25±0.59
efMT-2-L组7.16±0.48
d319.25±18.09
d7.60±0.94
cd11.11±1.05
bMT-2-M组9.09±0.85
c331.11±12.37
cd8.71±0.79
bc9.81±0.32
bcMT-2-H组10.75±0.66
b377.03±18.63
b1 0.48±0.77
ab7.89±0.50
de组别GSH-Px活力/(U/mL)SOD活力/(U/mL)T-AOC活力/(U/mL)
由表2可知,相较于正常对照组小鼠,慢性HgCl
2染毒小鼠血清GSH-Px及SOD活力显著降低(P<0.05),总抗氧化能力也显著降低(P<0.05),而MDA水平则显著升高(P<0.05)。GSH-Px及SOD为富含巯基的一类抗氧化酶,研究表明,汞在机体内易与巯基结合,从而破坏抗氧化酶的活性位点,导致抗氧化酶失活,同时汞可破坏细胞膜表面蛋白结构,致机体内氧自由基水平升高,造成机体抗氧化体系失衡,从而产生脂质过氧化损伤
[15-16]。经灌胃给药28 d后,小鼠血清中抗氧化酶GSH-Px和SOD活力及总抗氧化能力均有所回升,脂质过氧化水平指标MDA含量也显著降低,其中,MT-2-H组与MT-1-M、MT-1-H组对GSH-Px及SOD活力升高的效果显著(P<0.05),总抗氧化能力也与正常对照组小鼠接近,且两种酵母源MT对小鼠机体抗氧化能力的提升及清除体内MDA效果与其剂量成正相关。
2.4 小鼠血液、肝脏及肾脏汞含量
小鼠血液、肝脏及肾脏汞含量测定结果如图2所示,相较于正常对照组,各染毒组小鼠经慢性HgCl
2染毒后,血液、肝脏及肾脏Hg
2+含量显著升高(P<0.05),表明汞在进入机体内可稳定存在于血液及肝肾组织当中,经连 续灌胃给药28 d后,各给药组小鼠血液及肝脏、肾脏中汞含量与模型对照组小鼠相比均显著降低(P<0.05),且两种酵母源MT对染毒小鼠血液及脏器汞含量的降低作用与给药剂量成正相关。DMPS组降低小鼠血液及肝脏、肾脏中汞含量的效果显著优于MT-2-L、MT-2-M组和MT-1-L组(P<0.05),两种酵母源MT低剂量组对染毒小鼠的血液及肝脏、肾脏中汞含量的降低效果无显著差异(P>0.05),MT-2-H组和MT-1-M、MT-1-H组的排汞效果显著优于其他MT剂量组(P<0.05)。以上结果表明,两种酵母源MT和DMPS对慢性汞染毒小鼠有较好的排汞效果,在0.16~0.80 mg/(kg•d)剂量范围内,灌胃给药高剂量的酵母源MT对小鼠的排汞效果最佳。

图2 小鼠血液、肝脏及肾脏汞含量
Fig. 2 Mercury levels in the blood, liver and kidney of mice
3 讨 论
本实验将具有自主知识产权的两种酵 母源MT亚型(MT-1、MT-2)
[17-19]应用于慢性汞中毒小鼠,得到了良好的修复抗氧化酶系、清除体内MDA及排汞效果。研究表明,汞可稳定存在于机体内,并在进入机体初期,随血液流动致全身各处,蓄积于肝脏、肾脏为主的靶器官当中,造成机体损伤
[20-22],汞对—SH具有强亲和性,可与体内含有—SH的蛋白质结合,从而使蛋白质结构发生改变,抑制蛋白质发挥其原本作用而失活,汞可与体内GSH-Px、SOD上的—SH位点结合,从而使两种抗氧化酶活性位点改变,失去原有的抗氧化活性;同时,汞可诱发机体产生大量的自由基,包括超氧阴离子自由基(O
2
-•)、羟自由基(•OH)及H
2O
2等
[23],自由基可对临近的DNA、分子基团及生物膜结构等进行攻击,夺取其离子或正电子基团,对机体造成氧化损伤,使脂质过氧化物和大量MDA积累
[24]。
本实验以慢性HgCl
2染毒小鼠作为载体,探讨了具有自主知识产权的两种酵母源MT亚型的排汞效果及修复机体氧化损伤的作用效果。结果显示,两种酵母源MT亚型可结合汞离子,降低小鼠消化道及胃肠道汞离子含量,减轻肠道内细胞损伤,提高机体食物营养素吸收及代谢能力,从而改善汞中毒小鼠体质量指标,使汞中毒小鼠体质量接近正常对照组小鼠。体内GSH-Px、SOD活性及总抗氧化能力是衡量机体抗氧化系统能力的重要检测指标,Hg
2+可结合GSH-Px及SOD的—SH位点,使之变性失活
[25],同时Hg
2+可致机体自由基增加,机体抗氧化体系失衡,从而又加剧了GSH-Px和SOD的消耗,最终导致机体总抗氧化能力降低和脂质过氧化损伤终产物MDA含量的增加。酵母源MT富含—SH,易与Hg
2+结合,且MT在机体内会释放自身所携带的Zn
2+,以提供激活GSH-Px及SOD所需要的离子基团,从而激活体内抗氧化酶系,并维持其在体内含量,另外MT在体内所暴露出的—SH易被自由基氧化,从而降低体内自由基含量,减少脂质过氧化损伤总产物MDA含量的增加,降低氧自由基对机体的损伤,提高了机体总抗氧化能力。本实验中,相较于模型对照组小鼠,两种酵母源MT亚型给药组均可明显提高小鼠血清中的GSH-Px、SOD活力,且呈一定的剂量-效应关系,并且在提升机体总抗氧化能力上,两种酵母源MT亚型效果甚至优于DMPS。酵母源MT-1亚型高剂量组对小鼠体内MDA含量的清除效果与DMPS作用无显著差异(P>0.05),总体来看,酵母源MT-1亚型清除小鼠体内MDA的效果优于酵母源MT-2亚型。
酵母源MT具有高效结合Hg
2+的能力,本实验结果显示,与模型对照组小鼠相比,经灌胃酵母源MT后,染毒小鼠血液及肝脏、肾脏汞含量显著下降(P<0.05),且与两种酵母源MT亚型呈一定的量效关系。酵母源MT富含的—SH可与Hg
2+特异性结合,形成可溶性Hg-MT络合物并通过代谢系统排出体外,降低血液及肝脏、肾脏汞含量,从而缓解汞对机体的损伤。酵母源MT由Cu
2+、Zn
2+等离子诱导合成
[26],在体内可与Hg
2+特异性结合,降低血液Hg
2+含量,同时亦可释放出自身携带的离子,激活金属类抗氧化酶活性,清除体内活性氧,修复机体抗氧化体系。
本实验中,两种酵母源MT亚型显示了优异的结合Hg
2+、修复抗氧化酶体系、提高机体总抗氧化能力水平及清除体内MDA含量的效果,为其在促进排出机体Hg
2+和提高机体抗氧化能力方面提供了数据支持,与本课题组研究酵母源MT促进排铅的作用效果相当
[27],以此表明,酵母源MT在重金属离子促排和修复重金属离子致机体氧化损伤修复方面的作用效果优异,并拥有广阔的发展前景。
参考文献:
[1] BRIDGES C C, ZALUPS R K. Transport of inorganic mercury and methylmercury in target tissues and organs[J]. Journal of Toxicology and Environmental Health. Part B, Critical Reviews, 2010, 13(5): 385-410. DOI:10.1080/10937401003673750.
[2] 许秀艳, 朱红霞, 于建钊, 等. 环境中汞化学形态分析研究进展[J]. 环境化学, 2015, 34(6): 1086-1094. DOI:10.7524/j.issn. 0254-6108.2015.06.2014102902.
[3] APAYDIN F G, BAS H, KALENDER S, et al. Subacute effects of low dose lead nitrate and mercury chloride exposure on kidney of rats[J]. Environmental Toxicology and Pharmacology, 2016, 41: 219-224. DOI:10.1016/j.etap.2015.12.003.
[4] KIM W, KIM D W, YOO D Y, et al. Antioxidant effects of Dendropanax morbifera Léveille extract in the hippocampus of mercury-exposed rats[J]. BMC Complementary and Alternative Medicine, 2015, 15(1): 247. DOI:10.1186/s12906-015-0786-1.
[5] MADRAKIAN T, ZADPOUR B, AHMADI M, et al. Selective extraction and sensitive determination of mercury (II) ions by flame atomic absorption spectrometry after preconcentration on an ionimprinted polymer-coated maghemite nanoparticles[J]. Journal of the Iranian Chemical Society, 2015, 12(7): 1235-1243. DOI:10.1007/ s13738-015-0587-y.
[6] 董建勋, 王乐平, 李建荣, 等. 朱红膏毒性靶器官及安全用药范围研究[J]. 中华中医药杂志, 2011, 26(6): 1293-1295; 1449.
[7] FLORA S J, PACHAURI V. Chelation in metalintoxication[J]. International Journal of Environmental Research & Public Health,2010, 7(7): 2745-2788. DOI:10.3390/ijerph7072745.
[8] RUTTKAY N B, NEJDL L, GUMMULEC J, et al. The role of metallothionein in oxidative stress[J]. International Journal of Molecular Sciences, 2013, 14(3): 6044-6066. DOI:10.3390/ ijms14036044.
[9] TRINCHELLA F, ESPOSITO M G, SCUDIERO R. Metallothionein pri mary structure in amphibians: insights from comparative evolutionary analysis in vertebrates[J]. Comptes Rendus Biologies,2012, 335(7): 480-487. DOI:10.1016/j.crvi.2012.05.003.
[10] 汤晓燕, 陈丽杰, 袁文杰. 金属硫蛋白应用于重金属吸附的研究进展[J]. 现代化工, 2014, 34(6): 32-36; 38.
[11] 钱海, 张凌飞, 仇广乐, 等. 天然植物提取物及其活性成分对甲基汞生物毒性的拮抗效应及其机制研究进展[J]. 卫生研究, 2013, 42(4): 712-717.
[12] 郑徽, 金银龙. 汞的毒性效应及作用机制研究进展[J]. 卫生研究,2006, 35(5): 663-666.
[13] 路文芳, 王秀琴, 姜霞, 等. 二巯基丙磺酸钠对氯化汞中毒大鼠肾脏基因表达的影响[J]. 环境与职业医学, 2012, 29(9): 583-585; 588.
[14] 赵之伟, 曹冠华, 李涛. 金属硫蛋白的研究进展[J]. 云南大学学报(自然科学版), 2013, 35(3): 390-398. DOI:10.7540/j.ynu.20130187.
[15] YANG C, SKAUG M A, ANDERSEN O, et al. Chelation therapy in intoxications with mercury, lead and copper[J]. Journal of Trace Elements in Medicine and Biology, 2015, 31(4): 188-192. DOI:10.1016/j.jtemb.2014.04.010.
[16] COBBINA S J, YAO C, ZHOU Z, et al. Toxicity assessment due to sub-chronic exposure to individual and mixtures of four toxic heavy metals[J]. Journal of Hazardous Materials, 2015, 294(3): 109-120. DOI:10.1016/j.jhazmat.2015.03.057.
[17] 李冰, 王颖, 徐炳政, 等. 超声波辅助提取酵母源类金属硫蛋白工艺的优化[J]. 食品与机械, 2014, 30(3): 194-197. DOI:10.3969/ j.issn.1003-5788.2014.03.047.
[18] 苗兰兰, 张东杰, 王颖. 复合诱变高产金属硫蛋白酵母菌株的筛选[J].食品科学, 2013, 34(19): 261-264. DOI:10.7506/spkx1002-6630-201319053.
[19] 李靖元, 张东杰, 王颖, 等. 高产类金属硫蛋白假丝酵母菌株的筛选[J].中国生物制品学杂志, 2013, 26(11): 1585-1587.
[20] FRANCISCATO C, MORAES S L, DUARTE F A, et al. Delayed biochemical changesinduced by mercury intoxication are prevented by zinc pre-exposure[J]. Ecotoxicology & Environmental Safety, 2011, 74(3): 480-486. DOI:10.1016/j.ecoenv.2010.11.011.
[21] 林含, 张旭辉, 董建勋, 等. 朱红膏对破损皮肤模型大鼠汞蓄积及肾组织形态的影响[J]. 中国中药杂志, 2012, 37(6): 739-743. DOI:10.4268/cjcmm20120610.
[22] 李海芳, 孙鹏, 迪丽努尔·沙比托夫, 等. 大鼠口服苏合香丸10天后对肝肾功能的影响及汞蓄积情况[J]. 中成药, 2012, 34(1): 145-148. DOI:10.3969/j.issn.1001-1528.2012.01.037.
[23] 朱泓, 杨祖菁, 惠宁, 等. 孕期补锌对母胎汞毒性的拮抗作用及其抗氧化损伤机制研究[J]. 上海交通大学学报(医学版), 2014, 34(2): 193-196; 200. DOI:10.3969/j.issn.1674-8115.2014.02.015.
[24] LIU P, HE K, LI Y, et al. Exposure to mercury causes formation of male-specificstructural deficits by inducing oxidative damage in nematodes[J]. Ecotoxicology & Environmental Safety, 2012, 79: 90-100. DOI:10.1016/j.ecoenv.2011.12.007.
[25] YALCIN C F, ERGIN E, GURGAN S, et al. Effect of bleaching on mercury release from amalgam fillings and antioxidant enzyme activities: a pilot study[J]. Journal of Esthetic and Restorative Dentistry, 2015, 27(1): 29-36. DOI:10.1111/jerd.12092.
[26] 王月, 张东杰, 王颖, 等. 响应面优化双水相萃取分离酵母源MT工艺[J]. 食品科学, 2015, 36(10): 54-58. DOI:10.7506/spkx1002-6630-201510011.
[27] 王颖, 徐炳政, 王欣卉, 等. 酵母源金属硫蛋白对慢性铅中毒小鼠排铅及肝脏保护作用[J]. 现代食品科技, 2015, 31(8): 12-17. DOI:10.13982/j.mfst.1673-9078.2015.8.003.
Metallothioneins from Yeast Expell Mercury and Protect against Oxidative Damage in Mice Chronically Treated with Mercury
WANG Ying
1,2, WANG Xinhui
1, XU Bingzheng
3, ZHANG Dongjie
1
(1. College of Food Science, Heilongjiang Bayi Agricultural University, Daqing 163319, China; 2. National Coarse Cereals Engineering Research Center, Daqing 163319, China; 3. Qingdao Langyatai Co. Ltd., Qingdao 266400, China)
Abstract:The intent of this research was to explore the effect of metallothioneins from yeast with self-owned intellectual property rights on protecting against oxidative damage and expelling mercury in mice with chronic mercury poisoning. The mice with mercuric chloride exposure were continuously lavaged with two types (MT-1 and MT-2) of metallothioneins from yeast and dimercaptopropansulfonate sodium (DMPS) for 28 days, respectively. Body weight, mercury level in the whole blood, SOD, GSH-Px and MDA levels in serum, and total antioxidative capacity (T-AOC) in the body were measured at the end of the administration period. Compared with the normal control group, body weight in the model control group significantly decreased (P < 0.05), while both high-dose MT treatment groups showed a significant increase in body weight after gavaging for 28 days (P < 0.05). The mercury levels in blood, liver and kidney in all drug treatment groups were decreased significantly when compared with the model control group (P < 0.05). The effects of two types of high-dose metallothioneins on expelling mercury were significantly better than that of DMPS (P < 0.05). SOD, GSH-Px, MDA levels in serum and T-AOC in the body in all administration groups were brought back to the levels of the normal group (P > 0.05). Two monomeric forms of MT at the high dose had significant impact on improving total antioxidant capacity in the body better than that of DMPS (P < 0.05). However, MT-1 was significantly superior to MT-2 in increasing serum SOD and reducing serum MDA. Both metallothioneins from yeast had an obvious effect on expelling mercury and protecting against oxidative damage.
Key words:metallothioneins from yeast; mercury; oxidative damage; protection
DOI:10.7506/spkx1002-6630-201615041
收稿日期:2016-04-07
基金项目:黑龙江省博士后资助项目(LBH-Z13168);黑龙江省自然科学基金项目(C201445);黑龙江省农垦总局“十二五”重点科技计划项目(HNK125B-13-05);黑龙江省新世纪优秀人才培养计划项目(2014-2016)
作者简介:王颖(1979—),女,副教授,博士,研究方向为农产品加工与贮藏工程及食品质量安全。E-mail:Wychen156@163.com
中图分类号:TS202.3
文献标志码:A
文章编号:1002-6630(2016)15-0242-05
DOI:10.7506/spkx1002-6630-201615041. http://www.spkx.net.cn
引文格式:

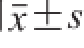 表示,采用SAS 9.1统计学软件进行统计分析,P<0.05表示具有统计学意义,Origin 8.5软件绘制相关图表。
表示,采用SAS 9.1统计学软件进行统计分析,P<0.05表示具有统计学意义,Origin 8.5软件绘制相关图表。


