
图1 葡萄PPO蛋白生物发生模型
[1100]
Fig. 1 Model for the biogenesis of PPO protein in grapes
[10]
董 喆 1,袁春龙 1,2,*,闫小宇 1,王沙沙 1,周亚丽 1,苏鹏飞 1
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.西北农林科技大学,合阳葡萄试验示范站,陕西 合阳 715300)
摘 要:在葡萄与葡萄酒的加工过程中,多酚氧化酶可以引起葡萄汁和葡萄酒的氧化,尤其是白葡萄酒,严重影响了葡萄酒的品质。本文总结了葡萄中多酚氧化酶的结构和功能及其在葡萄中的分布情况,并且揭示了在葡萄酒酿造工艺中其引起氧化褐变的机制,同时介绍了影响多酚氧化酶活性的因素和多酚氧化酶抑制剂应用等的研究进展,为进一步控制葡萄酒酿造过程中多酚氧化酶引起的氧化褐变提供参考。
关键词:多酚氧化酶;葡萄;葡萄酒;褐变机理;抑制剂
董喆, 袁春龙, 闫小宇, 等. 葡萄与葡萄酒中多酚氧化酶研究进展[J]. 食品科学, 2016, 37(15): 271-277. DOI:10.7506/ spkx1002-6630-201615046. http://www.spkx.net.cn
DONG Zhe, YUAN Chunlong, YAN Xiaoyu, et al. Progress in research on polyphenol oxidase in grapes and wine[J]. Food Science,2016, 37(15): 271-277. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201615046. http://www.spkx.net.cn
多酚氧化酶(polyphenol oxidase,PPO)是自然界广泛分布的一种氧化还原酶。1938年Mayer等 [1]从蘑菇中提取和纯化出了PPO并将其定义。由于PPO存在的广泛性并且是引起水果、蔬菜等农产品褐变的主要酶类 [2-3],因此PPO一直是近年来研究的热点。在植物中PPO的催化性质及活性抑制方面已经做了大量研究,但其结构(尤其是活性中心的结构)、添加剂的抑制机理以及氧化程度的控制一直未研究清楚,并且对葡萄中PPO的研究也比较少。在葡萄酒的酿造过程中,PPO可以引起葡萄汁和葡萄酒的氧化,使葡萄酒颜色异常,产生氧化味,严重影响葡萄酒的品质。所以研究葡萄中PPO的结构与酶学特性、褐变机理、抑制剂对PPO结构与活性的影响以及抑制机理等,对葡萄酒的酿造工艺有很大的借鉴作用。
在对PPO分类过程中,由 于其高级结构及作用机 理至今没有研究清楚,所以不同学者也有不同的观点。目前比较认同的是根据其所存在的生物类型及参与反应类型的不同将PPO分为单酚单氧化酶(如酪氨酸酶(tyrosinase)、甲酚酶(cresolase),EC 1.14.18.1)、双酚氧化酶(如儿茶酚氧化酶(catechol oxides),EC 1.10.3.2)和漆酶(laccase,EC 1.20.3.1)。这些酶由不同的基因编码产生,具有不同的活性 [4]。其中酪氨酸酶和甲酚酶是具有相同作用的酶,催化单体酚到邻苯二酚的羟基化并将其氧化成相应的半醌,但是其存在的生物类型不同:酪氨酸酶仅存在于动物中,而甲酚酶仅存在于植物中。很多研究者将酪氨酸酶和甲酚酶统称为酪氨酸酶,即存在于植物中的甲酚酶也称为酪氨酸酶。儿茶酚氧化酶主要分布于植物中,但是在其他生物体中也有分布,它的主要作用是将邻苯二酚氧化成醌。漆酶主要存在于致病性真菌中,但是在个别高等植物中也发现有漆酶的存在。漆酶不能氧化酪氨酸和对甲酚,但是氧化1,4-苯二酚和1,3-苯二酚,其氧化的底物类型更多。与此种分类方式不同的是,Claus等 [5]根据3 种Cu结合的不同形式将PPO分成酪氨酸酶和漆酶2 种。
许多植物的PPO是由多基因家族编码的,例如在马铃薯和番茄基因中,分别有6、7 个PPO基因 [6-7]。但是有研究者却发现在葡萄藤中只有1 种PPO基因,有几种基因在PPO的代谢途径中起关键作用 [1,8-9]。而且在葡萄植株生长发育期的浆果、枝叶和根部基因得到大量表达,在成熟生长期时只有少量表达,可能与它的功能有关 [10]。PPO在植物中亚细胞水平上的定位从被发现至今也一直众说纷纭,一般认为与葡萄品种、成熟度的不同而存在差异。在葡萄浆果中天然存在的酪氨酸酶是由核基因编码,在细胞质中合成,产生后并不溶解在细胞质中,而是与叶绿体等细胞器结合在一起 [11],存在于类囊体膜或叶绿体腔中 [1]。膜结合多酚氧化酶(membrane-bound polyphenol oxidase,mPPO)结合在类囊体膜上,而游离形式的多酚氧化酶(soluble polyphenol oxidase,sPPO)存在于类囊体腔中 [12]。mPPO在植物组织中的角色还不完全清楚,推测mPPO能很容易被活化,是促进褐变的重要因素 [13]。而发生氧化反应的酪氨酸酶的底物却存在于液泡中,这样在正常生理条件下,行使其抵抗病原菌等功能。将组织匀浆或者损伤后,细胞质中的酪氨酸酶和液泡中的酶底物接触,酪氨酸酶即被活化,表现出活性 [14]。
在葡萄浆果中还发现有儿茶酚氧化酶的存在,催化二酚底物,但是由于其存在多种亚型,可能具有不同的生理功能 [15-16]。在被灰霉菌侵染的葡萄表面发现有漆酶,漆酶不是葡萄浆果的自然产物,但是其催化的底物类型广泛,因此对葡萄原料的危害也是极严重的 [17-18]。
2.1 PPO的空间结构
在植物中PPO通常以无活性的前体形式——酶原存在 [19]。该酶原是由N端导肽、中间高度保守的Cu原子结合区和C端疏水区三部分组成。PPO分子由无活性转变为有活性的过程中需要经历肽链的加工。Dry等 [10]在研究葡萄藤中的PPO时,通过分析葡萄PPO的cDNA的开放读码框结构,证实葡萄PPO的前体是一个67.3 kD的蛋白质,该前体物质经进一步加工后形成40 kD的成熟蛋白质。据此,Dry等 [10]建立了葡萄PPO的生物发生模型(图1)。模型显示了PPO生物发生模型中的转化肽、催化单元(CuA和CuB)和C端延伸,两个箭头所指处为断裂位点,酶原的N端和C端肽键断裂形成成熟蛋白质。

图1 葡萄PPO蛋白生物发生模型
[1100]
Fig. 1 Model for the biogenesis of PPO protein in grapes
[10]
PPO的Cu原子结合区是酶的主要功能区,其他部分则对酶的构象、高级结构的形成和维持起作用 [19]。中间高度保守的Cu原子结合区富含组氨酸残基,每个Cu与3 个组氨酸残基以配位键相连,形成了有特定三维结构的活性部位 [1]。大多数植物的PPO与细菌、真菌和哺乳动物酪氨酸酶类似,具有2 个Cu原子结合区域(CuA和CuB),也有人提出了第3个Cu结合区域。各个Cu原子结合区域的结构相同,但是各个部分却有不同的功能 [20]。CuA可能与PPO的水溶性有关,CuB是底物的连接位置,CuC则与分子氧相连,CuA-CuB彼此相互影响,CuB-CuC在空间相连,从而使酶的功能得以实现 [21]。
Hemández-Romoero等 [22]描述了6 个铜原子与组氨酸残基组合的儿茶酚酶的基本结构,根据其描述Hemández-Romoero等构造如图2所示的结构。为进一步研究葡萄中PPO的活性中心结构,Fronk等 [23]从雷司令(Riesling)和丹菲特(Dornfelder)葡萄中提取PPO,进行分子动力学模拟分析之后发现,在其晶体结构中一个保守的苯丙氨酸占据着单体酚酶活性部位CuA的入口。如果催化底物是单体酚,单体酚的羟基通过快速复杂的空间位阻效应,苯丙氨酸259转动而连接到CuA上。刘芳等 [24]研究PPO的氨基酸序列发现,不同种植物,比如梨、桃、马铃薯、番茄、葡萄和苹果,它们的PPO氨基酸序列具有高度的相似性。
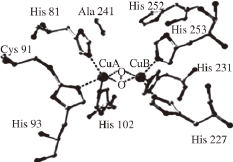
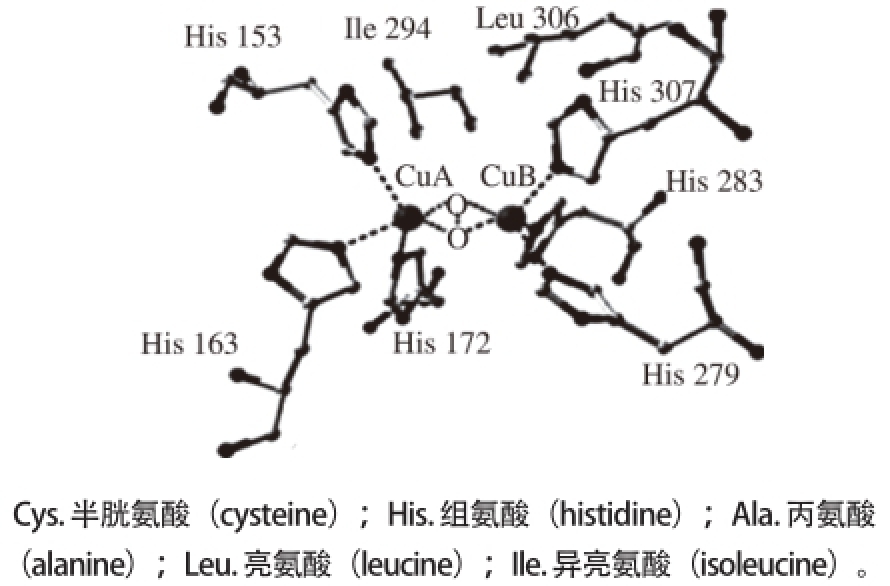
图2 两种PPO活性中心的构想
[2222]
Fig. 2 A plausible scheme for the conformation of the active site of two PPOs
[22]
从PPO高级结构来分析,PPO通常是一种由多个亚基组成的寡聚蛋白质,如大白菜、香草中是由3个亚基聚合形成;蘑菇的儿茶酚氧化酶则是一种多聚酶,分重链(4.3×10 4u)和轻链(1.34×10 4u) [25];从甜菜根和香蕉果肉中分离得到的PPO则以单体形式存在 [12],Fronk等 [23]从雷司令(Riesling)和丹菲特(Dornfelder)葡萄中提取PPO同样是单体。
2.2 PPO催化褐变的机制
目前主要有3 种假说解释褐变机理,分别是:酚酶区域分布假说、自由基伤害假说、保护酶系统假说。其中国内外普遍认可酚酶区域分布假说。酚酶区域分布假说主要内容是:PPO和多酚底物处于细胞中不同的区域。PPO有两种状态:一种是结合状态,束缚在细胞膜上,无活性的;一种是游离状态,存在于细胞质中 [26]。两种形态可以相互转化。当细胞膜系统被破坏后,结合状态PPO活性被激活,转化成游离状体,表现出催化活性,即区域化分布被打破,使酶和底物接触,在氧存在的条件下引起氧化褐变的发生 [27]。Mishra等 [12]利用扫描电子显微镜和荧光显微镜证实了这一假说。
在该理论的基础上,本课题组认为只有PPO、多酚类底物、氧3 个条件同时具备时才有可能发生酶促褐变。不同品种、不同成熟度植物的多酚类物质含量不同,PPO的含量、种类也不同,导致酶促褐变机制也会不同。图3为Gerdemann等 [28]提出的酶促褐变的反应机理。
在PPO酶促反应中,反应过程呈S型曲线。在反应开始的一段时间内,反应速率与酶的纯度、底物的浓度成正比,但是随着反应的进行,PPO缓慢朝着一个更适应于底物结合、有着更高催化活性结构的方向进行变构 [19],说明在反应过程中,PPO的结构尤其是活性中心并不是一成不变的。Matoba等 [29]也发现了这个现象,当邻苯二酚等作为底物时,酶与底物的接触过程中,多肽链和底物的空间构象发生改变,从而使底物与酶更好地契合,但是邻苯二酚基上的2 个羟基与多肽链上的氨基酸残基是以氢键相连,导致了酶与底物复合物的不稳定,多肽链构象发生扭曲时,氢键断裂,H被附着在多肽链上,酶与底物不再契合,两者都同时发生构象转变,导致产物脱离活性部位,成为邻醌。邻醌在一定条件下能够进一步发生一系列次生氧化作用,形成多种氧化产物。酶再通过脱氢作用,发生构象回转,恢复到之前的天然构象,重新成为具有催化能力的蛋白质 [30]。另外,PPO可通过与离子形成配体来调节自身的活性变化。
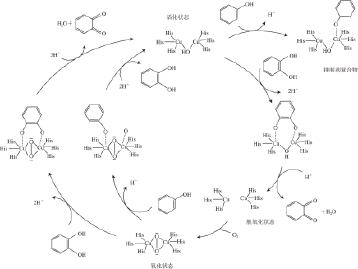
图3 甲酚酶以及儿茶酚氧化酶催化反应机理
[2288]
Fig. 3 Catalytic mechanisms of cresolase and catecholase
[28]
PPO在有氧条件下能催化单酚形成邻苯二酚,邻苯二酚氧化形成相应的邻醌、醌 [31-32]。形成的醌进一步经过复杂的反应形成黑色或褐色的沉积物 [33]。这一系列反应被认为是引起植物体发生酶促褐 变的主要原因,直接导致果蔬品质劣变和营养成分的破坏 [34-35]。但是,也有学者认为白葡萄汁中发生酶促氧化,并非一定会对葡萄酒产生不利的影响 [30]。在酶促氧化过程中,葡萄汁中存在的谷胱甘肽易于与醌式咖啡酰酒石酸反应生成2-S-谷胱甘酰咖啡酰酒石酸,该物质既不是儿茶酚酶的氧化底物,也不会通过其他方式促进氧化褐变,在一定程度上抑制了酶促氧化。同样酶促褐变的产物醌类物质能够杀死一些病原菌。适量地在葡萄汁中注入氧气促进氧化,之后将沉淀物分离澄清,明显减少了葡萄酒的苦涩味,增加了对氧气的敏感性。在红葡萄酒陈酿期间,适宜的微氧条件能促进花色素苷呈结合状态,使之更稳定,呈色强度更高。并且适宜的微氧条件能够避免葡萄酒中产生不良的氧化味,降低葡萄酒中的生青味、发酵味等,改善葡萄酒的香气特征。但是不同酒中的实验结果并不一致 [36]。
随着新型葡萄采收机械的广泛使用,葡萄原料遭到一定程度的破损,一些酿酒师提出了新的酿造技术:即葡萄汁过量氧化,通过人为促使葡萄汁过量氧化,利用其反应物的不溶性,经过澄清处理最大限度的除去葡萄汁中的类黄酮,从而提高白葡萄酒抗褐变能力及其香气品质的稳定性。但是适量的酶促氧化对葡萄酒的复杂风味和香气等的形成是否有益处、是否有利于陈酿的稳定性、什么程度是适量的酶促氧化等问题还需要进一步的探索研究。
在前期葡萄原料处理时,由于儿茶酚酶是质体酶,通常与果实的组织结合在一起,在澄清和转罐期间随着大部分果实组织的除去而流失,但是残存的酶还是会在后续加工过程中在一定程度上影响最终产品。
虽然漆酶由真菌产生,只存在于受真菌感染的果实中,但是其作用底物范围广,尤其是1,2-和1,4-二羟基酚,因此可造成更严重的危害。并且漆酶活性不容易被影响 [18]。还能在一定条件下促进谷胱甘肽参加褐变反应。葡萄醪中发生的氧化褐变主要就是以PPO为主引起的酶促反应,对葡萄汁发酵有很大的影响。
PPO的氧化作用在植物生化代谢中木质素、原花青素和黑色素等形成过程也发挥了重要作用 [37]。进一步研究发现,植物中的PPO可能还具有其他生理功能。PPO的氧化产物醌类物质,可以在一定程度上杀死病原菌,因此该酶也常作植株抗病性的指标之一。房玉林等 [38]也发现PPO酶活性与不同品种葡萄抗霜霉病有一定的相关性,可能与植物的抗病等方面相关。常小丽等 [39]研究白腐菌云芝漆酶对北美沙地葡萄白藜芦醇的催化作用,发现漆酶作为病原菌的致病物质基础,能够诱导抗病北美沙地葡萄合成反式白藜芦醇,并能迅速将其转化为抗病性更强的二聚体,认为漆酶可能与植物抗病信号的调控有关。在光合作用中,PPO可能在叶绿体内起着能量转换、传递光还原产生的分子氧等作用。
4.1 品种差异
不同品种苹果中PPO对不同底物的活性不同,即使是对于同一底物,不同品种间PPO活性也存在显著差异,乜兰春等 [40]以表儿茶素为底物,富士、乔纳金和王林中的PPO活性显著高于金冠和新红星,新红星最低。同样,不同葡萄品种的PPO活性也存在差异。苗则彦等 [41]在葡萄抗感白腐病品种苯丙氨酸解氨酶(phenylalanine ammoialyase,PAL)、PPO和超氧化物歧化酶(superoxide dismutase,SOD)活性比较实验中发现,选取的5 个葡萄品种中,对照组并没有做任何处理,但是贝达的PPO活性明显高于其他4 个品种20多倍。之后,王月晖等 [42]分析了27 种酿酒红葡萄品种PPO活性,发现不同酿酒红葡萄品种PPO活性之间存在显著差异,其中黑后的PPO活性最高,其次是佳丽酿和赫尔松。
4.2 温度
PPO的本质是蛋白质,适宜温度在30~50 ℃,且耐热性不强。一般经70~90 ℃处理3 min,PPO活性部位三维结构的完整性会被破坏,导致其部分或全部失活。低温条件同样能影响其活性。
Rapeanu等 [43]在研究维多利亚葡萄(Vitis vinifera ssp. Sativa)PPO活性时,观察酶在不同温度下的酶活性变化,随着温度的升高,PPO活性呈现先增大后降低的趋势,约在25 ℃酶活性达到最高,30~60 ℃能破坏其部分活性,当反应温度高于70 ℃时,酶催化活性几乎为零,但是在10~20 ℃酶表现为部分失活。Zheng Yongju等 [44]对Thompson无核葡萄的PPO活性研究中也得到类似的结论。用8804葡萄品系(欧亚种,西北农林科技大学葡萄酒学院选育)酿造干红葡萄酒过程中,在酿造工艺的不同阶段破碎,装罐,压榨,转罐后取酒样,共4 个酒样。在不同的温度下测PPO活性,观察到随着温度的变化PPO活性变化很大 [45]。最近用分形动力学的方法研究在褐变发生时不同的区域,发现褐变程度不同,可能与温度有关 [46]。
温度变化对于葡萄中PPO活性有很大影响,高温和低温都有利于抑制葡萄中PPO活性,从而减少褐变的发生。并且在较高温度下,PPO活性破坏较多甚至全部失活,但是高温时间过长会对酒中其他物质造成危害,因此在实际应用中,高温短时处理可能会是防止褐变处理的一个研究方向。
4.3 pH值
葡萄中PPO最适宜pH值在4~7之间,超出其范围酶活性迅速下降。这是由于PPO是含铜蛋白质,在pH<2的酸性环境中,酶中的铜被解离出来,并且蛋白质也容易变形,从而使酶失活;而在pH>9的碱性条件下铜会解离成氢氧化铜,使酶活性显著降低 [47]。
Rapeanu等 [43]观察不同pH值条件下维多利亚葡萄(Vitis vinifera ssp. Sativa)PPO活性,PPO活性呈现先增大后降低的趋势,约在pH 5.0酶活性达到最高,同其他水果类似。当pH 3.0~4.5,PPO仍保持一定的活性,只是部分失活,但是pH>6.0后,酶活性降低很快,在pH>8.0之后酶基本全部失活。这与Zheng Yongju等 [44]发现Thompson无核葡萄的PPO最适pH值为6.0有差距。可见不同葡萄PPO最适pH值也存在差异。
葡萄汁或葡萄酒中pH值约为3.0~4.0,在该条件下,PPO酶活性相对较稳定,并且pH值会影响酒中较多物质,因此在调节pH值角度控制酶促褐变有一定的难度。
除了上述提到的葡萄品种,温度和pH值对葡萄中PPO活性有影响之外,其他一些物理因素、化学因素以及其他物质的添加等都会在一定程度上对PPO的活性产生影响。如葡萄汁中离子种类、环境的压强大小、糖的含量、氨基酸的种类与浓度,酶抑制剂的添加等也对其活性有一定的影响 [48]。多种因素结合对PPO活性可能产生比单因素更复杂的影响 [49]。
在葡萄酒酿造过程中发生的氧化褐变作用,首先最直观的危害是对葡萄酒颜色的影响,尤其是白葡萄酒的颜色变褐,其次会使酒体浑浊,产生氧化异味,甚至会产生沉淀。其氧化褐变过程中涉及的物质流失还有可能对葡萄酒的风味和复杂香气的形成产生一定的影响。而氧化褐变反应中有相当一部分是由于PPO引起的酶促褐变。通过检测葡萄醪中氧气的消耗量发现,在一段时间内,氧气进入葡萄醪中直接被消耗掉,并没有溶解进醪中,由此可见酶促褐变是相当迅速的。因此本课题组要采取一定的措施控制酶促褐变,一个重要方面就是抑制PPO活性。目前,工艺中使用最多的是添加PPO抑制剂。5.1 SO 2
20世纪初就有SO 2直接与PPO作用而对其活性产生抑制的报道。Valero等 [50]发现SO 2能够不可逆地与氧化型和过渡型的PPO发生络合作用,从而抑制PPO活性。在HSO 3 -作用下,PPO活性中心的Cu 2+被还原成更易失去电子的Cu +形式,使酶受到不可逆抑制;在有氧条件下,SO 2还可能以自由基为中介对酶分子中组氨酸残基产生降解作用 [11]。吴振先等 [51]也证实了此观点。在实验中经过SO 2处理,龙眼果皮的PPO活性受到显著抑制,也改变了PPO同工酶谱,抑制了部分酶带,激活产生一些新的酶带,说明SO 2对PPO具有多方面的作用,总的结果是抑制了PPO活性。李青青等 [45]在用8804酿造葡萄酒过程中检测PPO的活性,验证了游离SO 2为抑制酶活性的主要 成分的观点。
最近人们注意到在葡萄酒酿造过程中较多SO 2的添加产生的一系列不利影响,因此探索新的添加剂以便在一定程度上代替其作用,但是目前的研究均显示其他的添加剂并不能完全代替SO 2的作用,尤其是其抑菌和对PPO的抑制作用。
5.2 有机酸
近几年,有机酸在酿酒工艺中使用增多,尤其是柠檬酸与抗坏血酸,原因是有机酸可能对PPO活性中心的铜离子位点具有较强的螯合作用 [34],另一方面可能是其对葡萄酒中pH值的影响,进而影响PPO的活性。李胜元等 [52]在研究抗坏血酸对玫瑰香干白葡萄酒的抗氧化作用中,在样品中加入抗坏血酸钠后,会引起葡萄酒中结合二氧化硫分解出更多的游离二氧化硫,因此D-异抗坏血酸钠在葡萄酒中辅助二氧化硫发挥效果,使酒体抗氧化效果倍增 [53]。同时抗坏血酸又是食品营养强化剂,在降低褐变的同时又补充了人们所需的营养物质。柠檬酸盐会使蘑菇PPO结构中的α螺旋减少,β折叠增加,芳香氨基酸残基暴露 [54]。
有研究认为抗坏血酸不能直接与PPO作用,而是通过减少被氧化底物来遏制褐变的发生,因为其对PPO抑制作用依赖其浓度,随着浓度的增加,对PPO抑制作用更明显,但是到达一定浓度后,它对PPO的抑制作用只能维持一段时间 [55]。同时对PPO进行分离纯化进而研究其活性中心的结构,有利于探究抗坏血酸、柠檬酸等的添加对PPO结构的影响。
5.3 乙二胺四乙酸
乙二胺四乙酸是一种合成氨基酸,为羧氨络合物的典型代表,性质极稳定。是目前广泛应用的食品金属鳌合剂,有抗氧化作用。其钠盐易溶于水,常温下可与PPO活性中心的铜离子形成稳定的水溶性络合体,与其他鳌合剂相比,具有更高的稳定系数 [56]。同时乙二胺四乙酸有一定的抑菌作用,对于防腐剂有增效作用,对于红葡萄酒的颜色也有增效作用。但是目前乙二胺四乙酸对于葡萄酒的抗氧化的报道并不一致,相关的研究还需进一步探索。
某些物质作为抑制剂并不是绝对的,抑制剂的浓度、添加时间也是影响酶活性的重要因素。单种处理手段对抑制酶的活性往往存在很大的局限性,为了更加有效地抑制PPO的酶活性,遏制酶促褐变的发生,采用多种方式结合并用的处理手段可能效果更佳。
从食品工业发展的角度来看,研究PPO具有极其重要的意义。目前关于葡萄酒氧化褐变的研究较多地关注于葡萄酒中氧化底物或加入抗氧化物质,由于在葡萄汁中的氧化褐变主要是以酶氧化为主 [57],所以研究氧化褐变反应中的重要物质——PPO有重要意义。并且现有的关于氧化酶的研究大多是经过粗提取之后,来研究该酶的基本特性:最适温度、最适pH值、最适底物、沉降速率和沉降平衡等,很少从分子水平研究其机构和作用机理等。
PPO分离纯化及结晶的难度较大,高级结构仍然需要进一步的研究。在酶的粗提取之后再进行纯化,对PPO结构尤其是活性中心的结构研究极其重要。在此基础上可深入探究其底物特异性、亚细胞定位以及PPO激活机制等。通过对PPO基因的研究,在基因水平上调节特定组织或者器官PPO基因的表达,从而减少PPO对果蔬的危害部分;在PPO对植物有利的区域更多地表达,从而充分发挥其有利作用,也是对葡萄中PPO研究的一个重要方向。
在葡萄酒工艺及贮藏过程中,采取相应的措施抑制PPO活性,减少对酒的危害。抑制剂的使用量、使用时间、抑制机理等也需要进一步探索。适量的PPO氧化是否对葡萄酒的香气口感有益?但是什么程度的氧化是合适的氧化水平,怎么控制这一程度,是否有指标可以作为其程度的信号等问题都有待解决。
参考文献:
[1] MAYER A M. Polyphenol oxidases in plants and fungi: going places?a review[J]. Phytochemistry, 2006, 67(21): 2318-2331. DOI:10.1016/ j.phytochem.2006.08.006.
[2] FALGUERA V, PAGAN J, GARZA S, et al. Inactivation of polyphenol oxidase by ultraviolet irradiation: protective effect of melanins[J]. Journal of Food Engineering, 2012, 110(2): 305-309. DOI:10.1016/j.jfoodeng.2011.04.005.
[3] SYUTO M, SHEN J, TANNO K, et al. Multi-input variable-threshold circuits for multi-valued logic functions[C]//International Symposium on Multiple-valued Logic. Oregon, U.S.A.: IEEE, 2000: 27-32. DOI:10.1109/ISMVL.2000.848596.
[4] ANISZEWSKI T, LIEBEREI R, GULEWICZ K. Research on catecholases, laccases and cresolases in plants. Recent progress and future needs[J]. A cta Biologica Cracoviensia Series Botanica, 2008, 50(1): 7-18.
[5] CLAUS H, DECKER H. Bacterial tyrosinases[J]. Systematic and Applied Microbiol ogy, 2006, 29(1): 3-14. DOI:10.1016/ j.syapm.2005.07.012.
[6] BEECHER B, SKINNER D Z. Molecular cloning and expression analysis of multiple polyphenol oxidase genes in developing wheat(Triticum aestivum) kernels[J]. Journal of Cereal Science, 2011, 53(3): 371-378. DOI:10.1016/j.jcs.2011.01.015.
[7] SHETTY S M, CHANDRASHEKAR A, VENKATESH Y P. Eggplant polyphenol oxidase multigene family: cloning, phylogeny,expression analyses and immunolocalization in response to wounding[J]. Phytochemistry, 2011, 72(18): 2275-2287. DOI:10.1016/ j.phytochem.2011.08.028.
[8] SUEHIRO Y, MOCHIDA K, ITAMURA H, et al. Skin browning and expression of PPO, STS, and CHS genes in the grape berries of ‘Shine Muscat’[J]. Journal of The Japanese Society for Horticultural Science,2014, 83(2): 122-132. DOI:10.2503/jjshs1.CH-095.
[9] VIRADOR V M, REYES G J P, BLANCO-LABRA A, et al. Cloning,sequencing, purification, and crystal structure of grenache (Vitis vinifera) polyphenol oxidase[J]. Journal of Agricultural and Food Chemistry, 2010, 58(2): 1189-1201. DOI:10.1021/jf902939q.
[10] DRY I B, ROBINSON S P. Molecular cloning and characterisation of grape berry polyphenol oxidase[J]. Plant Molecular Biology, 1994,26(1): 495-502. DOI:10.1007/BF00039560.
[11] COMUZZO P, ZIRONI R. Biotechnological strategies fo r controlling wine oxidation[J]. Food Engineering Reviews, 2013, 5(4): 217-229. D OI:10.1007/s12393-013-9071-6.
[12] MISHRA B B, GAUTAM S, SHARMA A. Purification an d characterisation of polyphenol oxidase (PPO) from eggplant(Solanum melo ngena)[J]. Food Chemistry, 2012, 134(4): 1855-1861. DOI:10.1016/j.foodchem.2012. 03.098.
[13] OEEN☒ES-PINERO E, GARC☒A-CARMONA F, S☒NCHEZFERRER A. Latent polyphenol oxidase from quince fruit pulp(Cydonia oblonga): purification, activation and some properties[J]. Journal of the Science of Food and Agriculture, 2006, 86(13): 2172-2178. DOI:10.1002/jsfa.2593.
[14] LIU Fang, ZHAO Jinhong, WEN Xin, et al. Purif ication and structural analysis of membrane-bound polyphenol oxidase from Fuji apple[J]. Food Chemistry, 2015, 183: 72-77. DOI:10.1016/ j.foodchem.2015.03.027.
[15] MARUSEK C M, TROBAUGH N M, FL URKEY W, et al. Comparative analysis of polyphenol oxidase from plant and fungal species[J]. Journal of Inorganic Biochemistry, 2006, 100(1): 108-123. DOI:10.1016/j.jinorgbio.2005.10.008.
[16] DIRKS-HOFMEISTER M E, INLOW J K, MOERSCHBACHER B M. Site-directed mutagenesis of a tetrameric dandelion polyphenol oxidase (PPO-6) reveals the site of subunit interaction[J]. Plant Molecular Biology, 2012, 80(2): 203-217. DOI:10.1007/s11103-012-9943-9.
[17] di FUSCO M, TORTOLINI C, DERIU D, et al. Laccase-based biosensor for the determination of polyphenol index in wine[J]. Talanta, 2010, 81(1): 235-240. DOI:10.1016/j.talanta.2009.11.063.
[18] MAYER A M, STAPLES R C. Laccase: new functions for an old enzyme[J]. Phytochemistry, 2002, 60(6): 551-565. DOI:10.1016/ S0031-9422(02)00171-1.
[19] 王曼玲, 胡中立, 周明全, 等. 植物多酚氧化酶的研究进展[J]. 植物学通报, 2005, 22(2): 215-222. DOI:10.3969/ j.issn.1674-3466.2005.02.013.
[20] MANDAL S, MUKHERJEE J, LLORET F, et al. Modeling tyrosinase and catecholase activity using new m-Xylyl-based ligands with bidentate alkylamine terminal coordination[J]. Inorganic Chemistry,2012, 51(24): 13148-13161. DOI:10.1021/ic3013848.
[21] SOMMER A, NE☒EMAN E, STEFFENS J, et al. Import, targeting,and processing of a plant polyphenol oxidase[J]. Plant Physiology,1994, 105(4): 1301-1311. DOI:10.1104/pp.105.4.1301.
[22] HEM☒NDEZ-ROMOERO D, SANCHEZ-AMAT A, SOLANO F. A tyrosinase with an abnormally high tyrosine hydroxylase/dopa oxidase ratio[J]. FEBS Journal, 2006, 273(2): 257-270. DOI:10.1111/ j.1742-4658.2005.05038.x.
[23] FRONK P, HARTMANN H, BAUER M, et al. Polyphenoloxidase from riesling and dornfelder wine grapes (Vitis vinifera) is a tyrosinase[J]. Food Chemistry, 2015, 183(2015): 49-57. DOI:10.1016/ j.foodchem.2015.03.016.
[24] 刘芳, 赵金红, 朱明慧, 等. 多酚氧化酶结构及褐变机理研究进展[J]. 食品研究与开发, 2015, 36(6): 113-119. DOI:10.3969/ j.issn.1005-6521.2015.06.032.
[25] JAENICKE E, DECKER H. Tyrosinases from crustaceans form hexamers[J]. Biochemical Journal, 2003, 371(2): 515-523. DOI:10.1042/BJ20021058.
[26] 弓志青, 王文亮. 果蔬采后酶促褐变机理及影响褐变的因素研究进展[J]. 中国食物与营养, 2012, 18(2): 30-33. DOI:10.3969/ j.issn.1006-9577.2012.02.008.
[27] SHIMIZU M M, MELO G A, dos SANTOS A B, et al. Enzyme characterisation, isolation and cDNA cloning of polyphenol oxidase in the hearts of palm of three commercially important species[J]. Plant Physiology and Biochemistry, 2011, 49(9): 970-977. DOI:10.1016/ j.plaphy.2011.04.006.
[28] GERDEMANN C, EICKEN C, KREBS B. The crystal structure of catechol oxidase: new insight into the function of type-3 copper proteins[J]. Accounts of Chemical Research, 2002, 35(3): 183-191. DOI:10.1021/ar990019a.
[29] MATOBA Y, KUMAGAI T, YAMAMOTO A, et al. Crystallographic evidence that the dinuclear copper center of tyrosinase is flexible during catalysis[J]. Journal of Biological Chemistry, 2006, 281(13): 8981-8990. DOI:10.1074/jbc.M509785200.
[30] TOIT W J, MARAIS J, PRETORIUS I S, et al. Oxygen in must and wine: a review[J]. South African Journal for Enology & Viticulture,2006, 27(1): 76-94.
[31] ROLFF M, SCHOTTENHEIM J, DECKER H, et al. Copper-O 2reactivity of tyrosinase models towards external monophenolic substrates: molecular mechanism and comparison with the enzyme[J]. Chemical Society Reviews, 2011, 40(7): 4077-4098. DOI:10.1039/ C0CS00202J.
[32] RAMSDEN C A, RILEY P A. Tyrosinase: the four oxidation states of the active site and their relevance to enzymatic activation, oxidation and inactivation[J]. Bioorganic & Medicinal Chemistry, 2014, 22(8): 2388-2395. DOI:10.1016/j.bmc.2014.02.048.
[33] L☒PEZ-MIRANDA S, HERN☒NDEZ-S☒NCHEZ P, SERRANOMART☒NEZ A, et al. Effect of ripening on protein content and enzymatic activity of Crimson seedless table grape[J]. Food Chemistry,2011, 127(2): 481-486. DOI:10.1016/j.foodchem.2011.01.027.
[34] MARTINEZ M V, WHITAKER J R. The biochemistry and control of enzymatic browning[J]. Trends in Food Science & Technology, 1995,6(6): 195-200. DOI:10.1016/S0924-2244(00)89054-8.
[35] 叶梅. 植物组织褐变的研究进展[J]. 重庆工商大学学报(自然科学版), 2005, 22(4): 326-329; 381. DOI:10.3969/j.issn.1672-058X.2005.04.004.
[36] GAMBUTI A, RINALDI A, UGLIANO M, et al. Evolution of phenolic compounds and astringency during aging of red wine: effect of oxygen exposure before and after bottling[J]. Journal of Agricultural and Food Chemistry, 2013, 61(8): 1618-1627. DOI:10.1021/ jf302822b.
[37] POURCEL L, ROUTABOUL J, CHEYNIER V, et al. Flavonoid oxidation in plants: from biochemical properties to physiological functions[J]. Trends in Plant Science, 2007, 12(1): 29-36. DOI:10.1016/j.tplants.2006.11.006.
[38] 房玉林, 宋士任, 张艳芳, 等. 不同品种葡萄抗霜霉病特性与叶片POD、PPO活性关系的研究[J]. 西北植物学报, 2007, 27(2): 392-395. DOI:10.3321/j.issn:1000-4025.2007.02.030.
[39] 常小丽, 龚国淑, 廖建霞, 等. 漆酶 诱导北美沙地葡萄抗毒素Res合成及代谢研究[J]. 西北农业学报, 2015, 24(4): 105-113. DOI:10.7606/j.issn.1004-1389.2015.04.018.
[40] 乜兰春, 孙建设, 辛蓓, 等. 苹果果实酶促褐变底物及多酚氧化酶活性的研究[J]. 园艺学报, 2004, 31(4): 502-504. DOI:10.3321/ j.issn:0513-353X.2004.04.017.
[41] 苗则彦, 赵奎华, 刘 长远, 等. 葡萄抗感白腐病品种PAL酶、PPO酶和SOD酶活性比较[J]. 沈阳农业大学学报, 2003, 34(3): 177-180. DOI:10.3969/j.issn.1000-1700.2003.03.005.
[42] 王月晖, 徐洪宇, 张京芳, 等. 酿酒红葡萄多酚氧化酶活力及总酚含量[J]. 食品科学, 2013, 34(9): 47-51. DOI:10.7506/spkx1002-6630-201309011.
[43] RAPEANU G, van LOEY A, SMOUT C, et al. Biochemical characterization and process stability of polyphenoloxidase extracted from Victoria grape (Vitis vinifera ssp. Sativa)[J]. Food Chemistry,2006, 94(2): 253-261. DOI:10.1016/j.foo dchem.2004.10.058.
[44] ZHENG Y ongju, SHI Junling, PAN Zhongli. Biochemical characteri stics and thermal inhibition kinet ics of polyphenol oxidase extracted from Thompson seedless grape[J]. European Food Research and Technology, 2012, 234(4): 607-616. DOI:10.1007/s00217-012-1664-4.
[45] 李青青, 何国庆, 张艳芳. 红葡萄酒酿造过程中多酚氧化酶的变化[J]. 科技通报, 2007, 23(5): 698-701. DOI:10.3 969/ j.issn.1001-7119.2007.05.017.
[46] QUEVEDO R, PEDRESCHI F, BASTIAS J M, et al. Correlation of the fractal enzymatic browning rate with the temperature in mushroom,pear and apple slices[J]. LWT-Food Science and Technology, 2016,65: 406-413. DOI:10.1016/j.lwt. 2015.08.052.
[47] 连毅, 乔旭光, 李燕, 等. 大蒜多酚 氧化酶特性的研究[J]. 食品科学,2007, 28(11): 290-293. DOI:10.3321/j.issn:1002-6630.2007.11.066.
[48] ALI H M, EL-GIZAWY A M, EL-BASSIOUNY R E I, et al. The role of various amino acids in enzymatic browning process in potato tubers,and identifying the browning products[J]. Food Chemistry, 2016, 192: 879-885. DOI:10.1016/j.foodchem.2015.07.100.
[49] RAPEANU G, van LOEY A, SMOUT C R, et al. Thermal and highpressure inactivation kinetics of polyphenol oxidase in Victoria grape must[J]. Journal of Agricultural and Food Chemistry, 2005, 53(8): 2988-2 994. DOI:10.1021/jf0482515.
[50] VALERO E, VARON R, GARCIA-CARMONA F. Kinetic study of the effect of metabisulfite on polyphenol oxi dase[J]. Journal of Agricultural and Food Chemistry, 1992, 40(5): 904-908. DOI:10.1021/ jf00017a042.
[51] 吴振先, 韩冬梅. SO 2对贮藏龙眼果皮酶促褐变的影响[J]. 园艺学报,1999, 26(2): 91-95. DOI:10.3321/j.issn:0513-353X.1999.02.005.
[52] 李胜元, 谷向春. 抗坏血酸对玫瑰香干白葡萄酒的抗氧化作用[J]. 酿酒科技, 2006, 2006(6): 65-66. DOI:10.3969/ j.issn.1001-9286.2006.06.016.
[53] BRADSHAW M P, BARRIL C, ANDREW C C, et al. Ascorbic acid: a review of its chemistry and reactivity in relation to a wine environment[J]. Critical Reviews in Food Science and Nutrition, 2011,51(6): 479-498. DOI:10.1080/10408391003690559.
[54] LIU Wei, ZOU Liqiang, LIU Junping, et al. The effect of citric acid on the activity, thermodynamics and conformation of mushroom polyphenoloxidase[J]. Food Chemistry, 2013, 140(1): 289-295. DOI:10.1016/j.foodchem.2013.02.028.
[55] 刘文山, 肖凯军, 郭祀远. 苹果多酚氧化酶的提取及其抑制作用的研究[J]. 现代食品科技, 2006, 22(4): 82-84; 155. DOI:10.3969/ j.issn.1673-9078.2006.04.025.
[56] 万素英. 食品抗氧化剂[M]. 北京: 中国轻工业出版社, 1998: 94-98.
[57] ES-SAFI N E, CHEYNIER V, MOUTOUNET M. Effec t of copper on oxidation of (+)-catechin in a model solution system[J]. International Journal of Food Science & Technology, 2003, 38(2): 153-163. DOI:10.1046/j.1365-2621.2003.00656.x.
Progress in Research on Polyphenol Oxidase in Grapes and Wine
DONG Zhe
1, YUAN Chunlong
1,2,*, YAN Xiaoyu
1, WANG Shasha
1, ZHOU Yali
1, SU Pengfei
1
(1. College of Enology, Northwest A&F University, Yangling 712100, China;2. Heyang Experimental Demonstration Station, Northwest A&F University, Heyang 715300, China)
Abstract:During the processing of grapes and wine, polyphenol oxidase (PPO) oxidizes grape juice and wine, particularly for white wine. PPO can seriously affect wine quality. The aims of this paper are to review the structure, functions and distribution of PPO in grapes, and to discuss its oxidation mechanisms during wine-making process. Moreover, the factors influencing PPO activity and PPO inhibitors are also discussed, providing a reference for controlling oxidative browning caused by PPO during the processing of grapes and wine.
Key words:polyphenol oxidase (PPO); grape; wine; browning mechanism; inhibitor
DOI:10.7506/spkx1002-6630-201615046
中图分类号:Q554.1
文献标志码:A
文章编号:1002-6630(2016)15-0271-07
收稿日期:2015-11-01
基金项目:陕西省农业攻关项目(2015NY131)
作者简介:董喆(1992—),女,硕士研究生,主要从事葡萄酒氧化机制及抑制研究。E-mail:dongzhefermentationengineerin@gmail.com
*通信作者:袁春龙(1969—),男,副教授,博士,主要从事葡萄酒化学及葡萄酿酒副产物加工利用研究。
E-mail:yuanchl69@nwsuaf.edu.cn
引文格式: