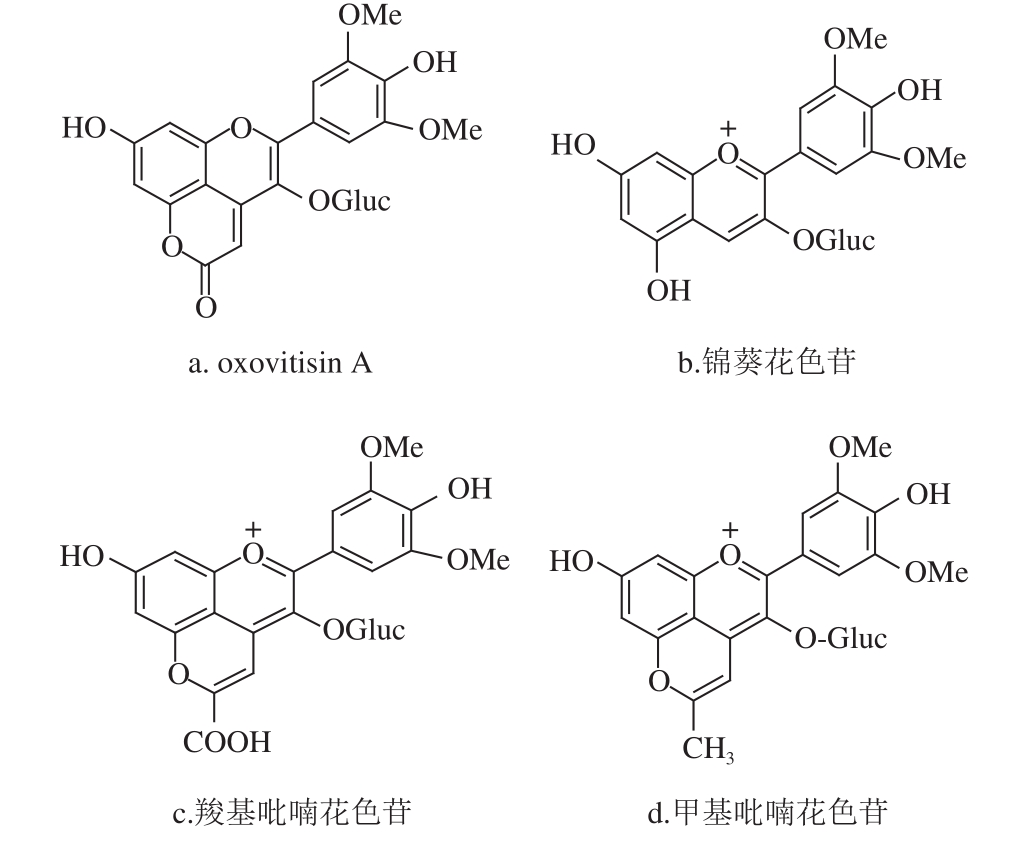
图1 oxovitisin A、锦葵花色苷、羧基吡喃花色苷和甲基吡喃花色苷的化学结构
Fig. 1 Structures of oxovitisin A, malvidin-3-O-glucoside, vitisin A and methyl-pyranoanthocyanin
吴 闹,王静祎,张 倩,郭 莹,李书艺,何 毅,祝振洲,何静仁*
(武汉轻工大学食品科学与工程学院,湖北 武汉 430023)
摘 要:以植物花色苷为原料,通过羧基吡喃花色苷形成及微氧化两步反应法制备出具有非氧鎓离子结构和内酯型吡喃环结构的吡喃酮型花色苷衍生物(oxovitisin A),进行了反应温度、pH值、反应介质乙醇体积分数和反应时间影响oxovitisin A生成量的单因素试验,正交试验优化得到oxovitisin A的最佳制备条件。高效液相色谱监测反应过程,高效液相色谱-二极管阵列检测-串联离子阱多级质谱法对反应产物进行定量和定性分析。利用“罗丹明B蛋白染色法”考察了oxovitisin A以及不同结构的吡喃花色苷衍生物(羧基吡喃花色苷、甲基吡喃花色苷)、前体花色苷(锦葵花色苷)的体外抗癌细胞增殖活性。结果表明:以1.0 mg/mL的羧基吡喃花色苷为原料,oxovitisin A的最佳制备条件是pH 3.6、反应温度45 ℃、乙醇体积分数20%、反应时间21 d,各因素对oxovitisin A得率影响的大小次序为pH值>反应温度>反应时间>乙醇体积分数。高效液相色谱-串联质谱结合多级质谱裂解分析表明,反应的主要产物是oxovitisin A,反应第21天得率为26.59%。抗癌细胞活性实验结果表明,oxovitisin A能显著抑制人肠癌细胞(Caco-2)和人乳腺癌细胞(MCF-7)细胞增殖,IC 50分别为(238.8±24.6)、(85.7±9)μg/mL,抑制作用明显强于羧基吡喃花色苷和甲基吡喃花色苷。
关键词:花色苷衍生物;oxovitisin A;正交试验;高效液相色谱-串联质谱法;抗肿瘤活性
花色苷是自然界中最常见的一种水溶性植物色素,具有抗氧化、清除自由基、降血脂、增强机体免疫力等生理功能 [1-4],近十年来,关于花色苷和花色苷提取物的抗肿瘤活性研究成为热点 [5-8]。
天然提取的花色苷色素很不稳定,极大地限制了其在产品加工和贮藏过程中的直接应用。花色苷衍生物是近些年发现于花色苷果蔬的加工产品如果酒和饮料或某些特殊类的植物中 [9-10],由花色苷在发酵和陈酿过程中形成的或在植物体内生物合成的一系列较稳定的花色苷天然衍生物。因此,花色苷衍生物家族的形成对花色苷类天然色素的重要性已越来越引起科研人员的兴趣和重视。吡喃酮型花色苷衍生物(oxovitisin)是2010年He等 [11]在陈酿葡萄酒中发现的一种新型的吡喃花色苷类多酚衍生物(图1)并命名,经质谱和核磁鉴定首次证实了oxovitisin A的结构形成机制。该类新型花色苷衍生物是以羧基吡喃花色苷为前体物质,吡喃环上的羧基经水合作用和微氧化转变为羰基而形成。这种第二代花色苷衍生物具有特殊的内酯型吡喃环和非氧鎓离子结构,比氧鎓离子的花色苷类物质更加稳定 [11]。oxovitisin A在陈酿葡萄酒中形成,这种自然发生的化学反应不需要酶的参与,反应十分缓慢,数年后才会达到一定的含量 [12]。oxovitisin A的光谱和结构具有黄酮类化合物的相似特征,在食品及医药行业将具有潜在的应用前景。最近,基于oxovitisin A结构的理论计算结果已经表明其抗氧化活性 [13],但有关该类化合物的生物活性及吸收利用等方面研究鲜少报道。
本实验首先研究了高效制备oxovitisin A过程中影响其反应生成量的主要因素pH值、反应温度、反应介质乙醇体积分数和反应时间,通过单因素试验及正交试验优化反应条件。高效液相色谱监测反应过程,高效液相色谱-二极管阵列检测-串联阱多级质谱法确认主要反应产物的结构和定量分析。经分离纯化后,进一步研究了oxovitisin A这种具有特殊结构的花色苷衍生物抑制人肠癌细胞(Caco-2)和乳腺癌细胞(MCF-7)增殖的活性,并比较分析其他不同结构的吡喃花色苷衍生物(羧基吡喃花色苷、甲基吡喃花色苷)、前体花色苷(锦葵花色苷)(图1)对癌细胞增殖的抑制作用,以探索影响其生物活性的构效关系。本研究为oxovitisin A这种花色苷衍生的新型多酚类化合物的高效制备、功能性质和生物活性的研究提供了理论依据。

图1 oxovitisin A、锦葵花色苷、羧基吡喃花色苷和甲基吡喃花色苷的化学结构
Fig. 1 Structures of oxovitisin A, malvidin-3-O-glucoside, vitisin A and methyl-pyranoanthocyanin
1.1 材料与试剂
葡萄皮红色素提取物(色价32.27) 云南通海杨氏天然产物有限公司;Caco-2、MCF-7 中国典型培养物保藏中心;锦葵花色苷、羧基吡喃花色苷、甲基吡喃花色苷、oxovitisin A标准品(纯度≥98%)为本实验室自制;磺酰罗丹明B 美国Sigma公司;聚酰胺树脂(80~100 目)、丙酮酸(生化试剂) 国药集团化学试剂有限公司;乙腈、甲醇、甲酸(均为色谱纯) 美国Tedia试剂公司;其余试剂均为国产分析纯。
1.2 仪器与设备
SSI Series1500高效液相色谱仪(配有二极管阵列检测器) 美国SSI公司;LTQ-XL超高效液相色谱-质谱联用仪(配有电喷雾离子源及Xcalibur数据处理系统)、Evolution 220紫外-可见分光光度计 美国Thermo公司;Hei-VAP Precision旋转蒸发仪 德国Heidolph公司;ALPHA 2-4冷冻干燥机 德国Christ公司;Milli-Q Reference超纯水机 美国Millipore公司;EnSpire™多模式微孔板检测仪 美国PerkinElmer公司。
1.3 方法
1.3.1 oxovitisin A的合成及形成机制
葡萄皮红色素提取物(主要是锦葵花色苷) [14-15]与丙酮酸在一定的酸性条件下,丙酮酸的羧基发生烯醇化,随后电负性的甲基与花色苷的C 4位(具正电性)发生加成缩合,随后经脱水和氧化形成一个具有吡喃环的羧基吡喃花色苷 [16]。
羧基吡喃花色苷具有亲电性质,其吡喃环上带正电的C 10位上会发生水化作用,由于水分子的亲核攻击在吡喃环C 10上形成半缩醛,在温和的条件下这种中间物会脱酸并且在半缩醛的羟基发生进一步的氧化作用形成吡喃-2-环,随后经氧化和脱水,生成一种中性的不饱和的α-吡喃酮或内酯,即具有吡喃酮结构的电中性新型花色苷衍生物 [11-12]。该反应中水分子的亲核进攻非常缓慢,是由vitisin A碳正离子不可逆形成中性吡喃花色苷的第一步 [17-18]。oxovitisin A形成机理如图2所示。
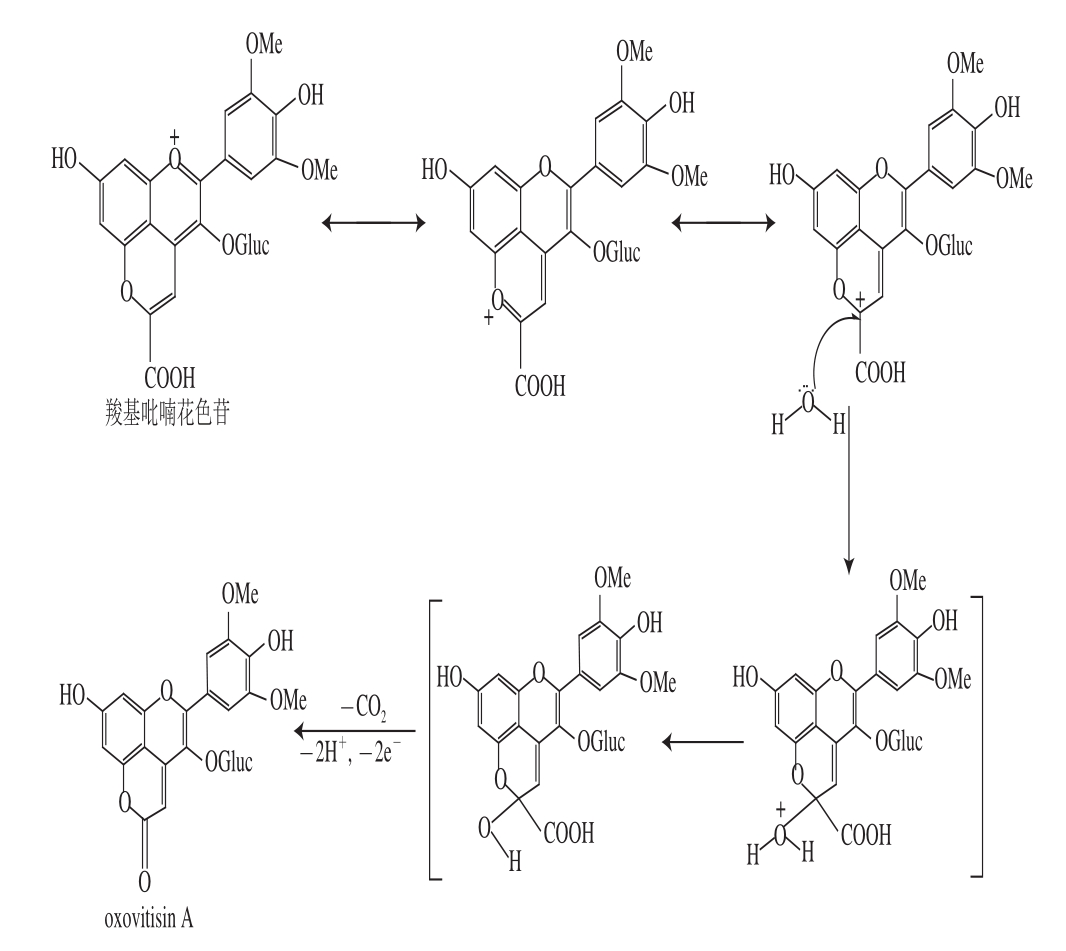
图2 oxovitisin A的形成机制
Fig. 2 Proposed formation mechanism of oxovitisin A
1.3.2 oxovitisin A的质量浓度及得率计算
采用高效液相色谱法测定制备出的oxovitisin A含量。计算如式(1)所示:
式中:X为样品中oxovitisin A的质量浓度/(mg/mL);S 1为样品峰面积;C为oxovitisin A标准品的质量浓度/ (mg/mL);S 2为oxovitisin A标准品的峰面积。
得率计算如式(2)所示:
式中:理论生成量指1.0 mg/mL的羧基吡喃花色苷完全反应生成的oxovitisin A质量。
1.3.3 oxovitisin A的合成工艺优化
1.3.3.1 羧基吡喃花色苷的制备及标准曲线的绘制
取一定质量的葡萄皮红色素提取物和丙酮酸溶于1 L的纯水中,控制丙酮酸和花色苷的物质的量比为50∶1,调节pH值为2.6,35 ℃反应5 d后,样品用80~100 目的聚酰胺树脂全部吸附,上样量为0.5 倍的柱体积,依次分别用体积分数为10%、20%的酸性乙醇溶液洗脱去杂和收集,收集的即为花色苷羧化产物溶液,旋转蒸发浓缩后冷冻干燥待用 [19-20]。
精确称取7.5 mg的羧基吡喃花色苷标品,用pH 3的磷酸氢二钠-柠檬酸缓冲液定容至5.0 mL,得到质量浓度为1.5 mg/mL的色素液,逐步稀释配制成各质量浓度,510 nm波长条件下测定吸光度,以质量浓度和吸光度进行回归分析 [21],得到回归方程y=8.954x+0.003 8,R 2=0.999 8,结果表明羧基吡喃花色苷在0.15~0.04 mg/mL范围内与吸光度呈良好的线性关系。
1.3.3.2 oxovitisin A制备的单因素试验
以花色苷羧化产物为原料,对照羧基吡喃花色苷标准曲线准确配制质量浓度为1.0 mg/mL的反应液,选择在oxovitisin A合成过程中比较重要的影响因素pH值、反应温度、乙醇体积分数和反应时间进行单因素试验,以其得率为考察指标。先固定3 个因素水平,考察另外1 个因素不同水平对oxovitisin A合成效果的影响,反应液每天补充氧气一次。固定pH 3.6、乙醇体积分数18%、反应时间19 d,考察不同反应温度35、40、45、50、55 ℃对oxovitisin A合成效果的影响;固定反应温度45 ℃、乙醇体积分数18%、反应时间19 d,考察不同pH 3.2、3.4、3.6、3.8、4.0对oxovitisin A合成效果的影响;固定反应温度45 ℃、pH 3.6、反应时间19 d,考察不同乙醇体积分数14%、16%、18%、20%、22%对oxovitisin A合成效果的影响;固定反应温度45 ℃、pH 3.6、乙醇体积分数20%,考察不同反应时间17、19、21、23、25 d对oxovitisin A合成效果的影响。
1.3.3.3 正交试验
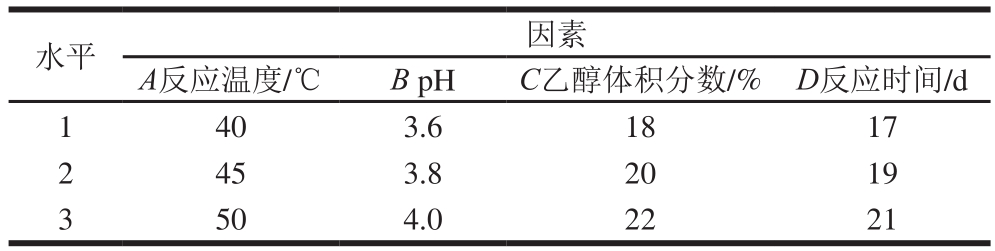
单因素试验的基础上,进行四因素三水平L 9(3 4)正交试验,因素水平设计见表1,每组设定3 个重复,优化生成oxovitisin A的参数。
表1 正交试验设计因素与水平
Table 1 Factors and their levels used for orthogonal array experiments
水平 因素A反应温度/℃ B pH C乙醇体积分数/% D反应时间/d 1 40 3.6 18 17 2 45 3.8 20 19 3 50 4.0 22 21
1.3.4 oxovitisin A的高效液相色谱分析
取oxovitisin A产物溶液通过SSI Series1500高效液相色谱进行监测,色谱条件:Lichrospher RP-C 18柱(250 mm×4.6 mm,5 μm),二极管阵列检测器。流动相A 为10%体积的甲酸溶液,B为甲酸-乙腈-水(1∶3∶6,V/V)。洗脱梯度:0~30 min,20%~40% B;30~35 min,40%~100% B,之后冲洗系统10 min。
1.3.5 oxovitisin A的高效液相色谱-串联质谱分析
oxovitisin A反应液经80~100 目聚酰胺树脂层析柱(40 mm×600 mm)初步纯化,上样量为0.5倍柱体积,上样流速为0.5 倍柱体积/h,待样品吸附完全后30%酸化甲醇溶液除去未反应的羧基吡喃花色苷,然后用40%酸化甲醇洗脱产物,洗脱流速为1 倍柱体积/h,收集的琥珀黄色样品即为oxovitisin A产物粗品,取适量浓缩后进行高效液相色谱-串联质谱测定 [14]。
色谱参数:T h e r m o C 1 8反相色谱柱(100 mm×2.1 mm,1.9 μm);二极管阵列检测器;流动相A为0.5%的甲酸溶液,B为甲酸-乙腈-水(0.5∶80∶19.5,V/V)。洗脱梯度:0 min,15% B;50 min,25% B;55 min,100% B;65 min,15% B。流速:0.15 mL/min;进样体积:10 μL;柱温:25 ℃;检测波长:373 nm。
质谱参数:电喷雾离子源;正离子模式;毛细管温度为350 ℃;毛细管电压47 V;N 2流速30 L/min,离子扫描范围m/z 100~1 500,目标离子m/z 533 [22-24]。
1.3.6 oxovitisin A的体外抗肿瘤活性
采用罗丹明B蛋白染色法考察oxovitisin A体外对Caco-2和MCF-7的抗增殖作用。取对数期生长的细胞,调整细胞数量浓度为1.5×10 5个/mL,按每孔100 μL加于96 孔板中,于生化培养箱中孵育24 h。细胞贴壁约80%,不同细胞模型中加入预先配制好的oxovitisin A溶液,双倍稀释成不同的质量浓度梯度(Caco-2细胞模型质量浓度为0.4、0.2、0.1、0.05、0.025 mg/mL,MCF-7细胞模型质量浓度为:0.2、0.1、0.05、0.025、0.012 5 mg/mL),空白对照组为等体积不含样品的培养基。继续培养48 h,50%三氯乙酸溶液于4 ℃条件下固定1 h,纯水洗涤后干燥,加入4%的磺基罗丹明B染液,静置30 min,1%的乙酸水溶液洗涤后干燥,每孔再加入100 μL的Tris缓冲液(10 mmol/L,pH 10.5),避光显色30 min后酶标仪于492 nm波长处检测各孔的吸光度。相同质量浓度梯度的锦葵花色苷、羧基吡喃花色苷和甲基吡喃花色苷为对照,实验中花色苷及其衍生物的质量浓度是依据人体在摄入一杯葡萄酒后(约100 mL),胃内容物中稀释后的质量浓度约为0.4 mg/mL所确定 [25]。同一细胞模型中各样品的质量浓度梯度一致,每个质量浓度设6 个复孔以便于比较。
1.4 数据分析
单因素试验和罗丹明B蛋白染色实验均设3 次重复取平均值,以SPSS 13.0进行数据统计分析,并进行差异显著性测定,P<0.05表示差异显著,P<0.01表示差异极显著。
2.1 单因素试验结果
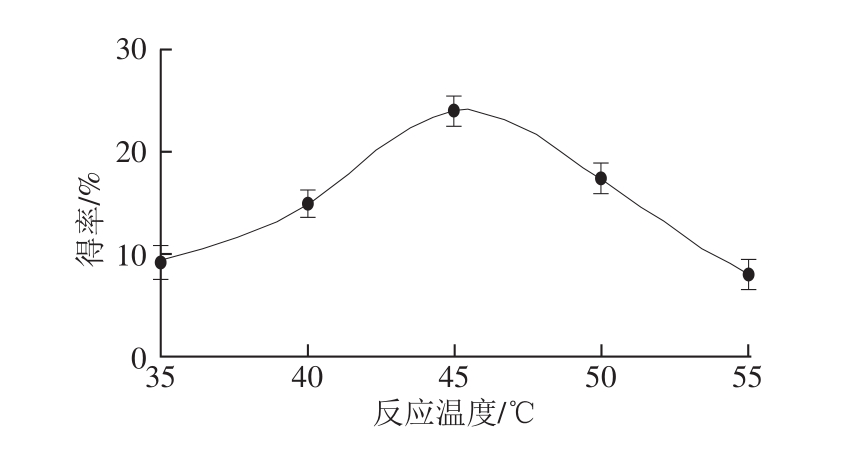
图3 反应温度对oxovitisin A得率的影响
Fig. 3 Effect of temperature on the yield of oxovitisin A
2.1.1 反应温度对oxovitisin A得率的影响由图3可知,不同反应温度对oxovitisin A得率的影响显著,随温度的升高,得率相应增加。当温度到达45 ℃时,oxovitisin A的得率最大,温度高于45 ℃时,产物得率逐渐减低。因温度较低时,水分子亲核攻击羧基吡喃花色苷C 10位羧基较慢,反应物形成半缩醛结构受到影响,进而影响微氧化形成oxovitisin A的进程。在较高温度条件下,分子运动和扩散速率加快,对反应起到正向促进作用;但若温度过高,oxovitiisn A产物容易部分降解、氧化、结构易破坏以及其他杂质沉淀生成,因此选取45 ℃为反应的最佳温度。
2.1.2 pH值对oxovitisin A得率的影响
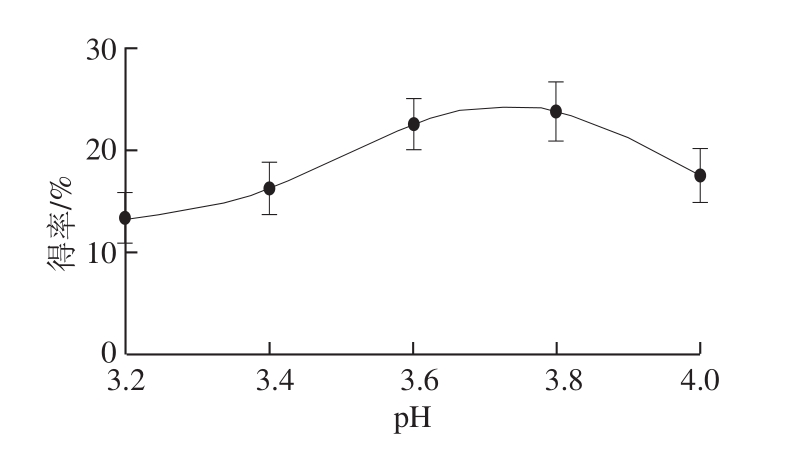
图4 pH值对oxovitisin A得率的影响
Fig. 4 Effect of pH value on the yield of oxovitisin A
由图4可知,pH值对oxovitisin A合成反应的影响非常显著,当pH值由3.2升高到3.8时,oxovitiisn A的得率随之增加,在pH 3.8时达到最大值。当pH值大于3.8时,反应得率随之降低。结果表明弱酸性条件下有利于oxovitisin A的生成,但酸性过强,则不利于oxovitisin A的生成。这可能由于在溶液介质中,花色苷随着pH值的变化而发生结构上的转变,这种转变影响到了吡喃环上脱酸和氧化等一系列的反应,并且影响到了水分子的亲核进攻。由此可知,pH值在3.8处最佳。
2.1.3 乙醇体积分数对oxovitisin A得率的影响
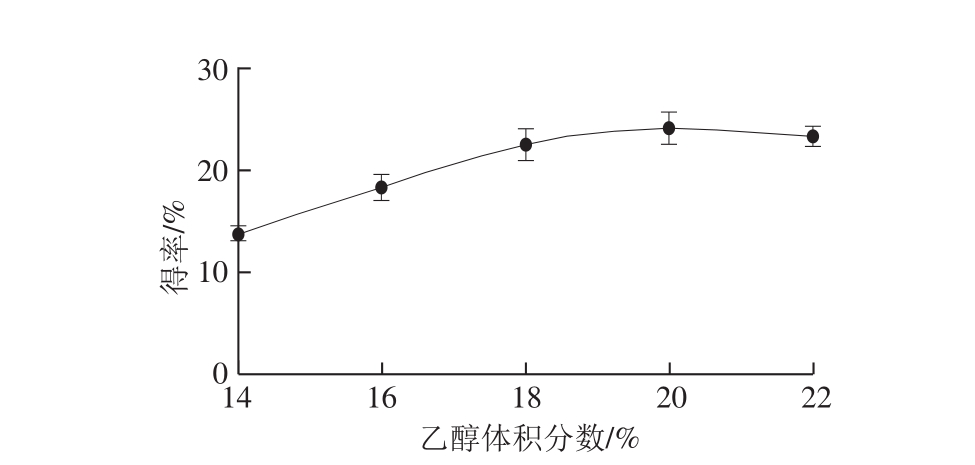
图5 乙醇体积分数对oxovitisin A得率的影响
Fig. 5 Effect of ethanol concentration on the yield of oxovitisin A
由图5可知,在乙醇体积分数由14%上升到20%时,oxovitisin A的得率不断增加,在20%达到最大,当乙醇体积分数大于20%时,反应得率随之减少。这可能是由于模拟酿造果酒反应体系中,乙醇体积分数的变化影响到了反应中花色苷的溶解性及缓慢氧化的环境,由此可知在乙醇体积分数为20%时,oxovitisin A的得率最高。
2.1.4 反应时间对oxovitisin A得率的影响
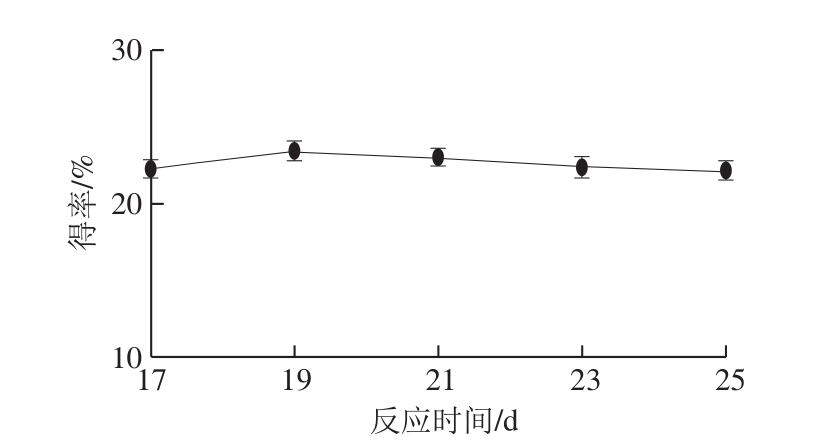
图6 反应时间对oxovitisin A得率的影响
Fig. 6 Effect of reaction time on the yield of oxovitisin A
由图6可知,随着反应时间的延长,oxovitisin A的得率随之上升,在19 d时达到最大值,随后oxovitisin A的得率开始下降。这是由于继续延长反应时间,羧基吡喃花色苷和oxovitisin A在较高温度条件下结构受到破坏,均开始降解。因此,最佳的反应时间为19 d。
2.2 正交试验结果
由表2可知,各因素影响oxovitisin A得率的主次顺序为pH值、反应温度、反应时间、乙醇体积分数,最优方案为A 2B 1C 2D 3,即以质量浓度为1.0 mg/mL的羧基吡喃花色苷为原料,反应温度45 ℃、pH 3.6、乙醇体积分数20%、反应时间21 d,该条件下oxovitisin A的得率最高,为26.59%。
表2 正交试验设计及结果
Table 2 Orthogonal array design with experimental results
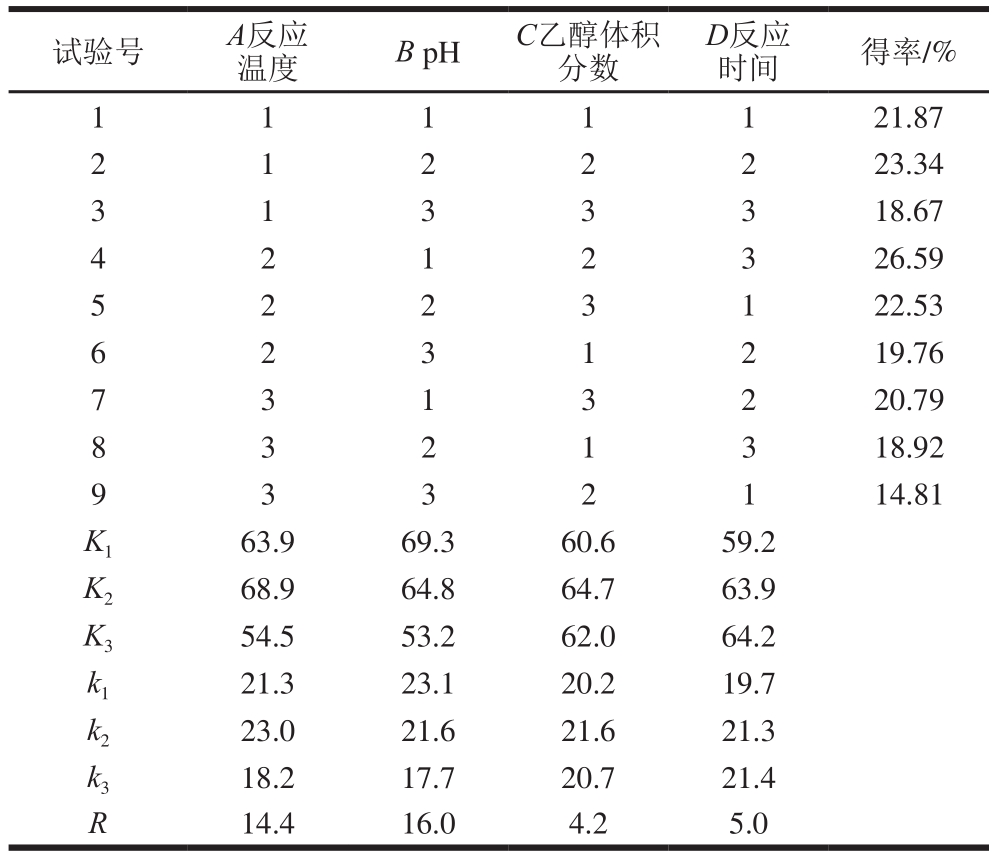
试验号 A反应温度 B pH C乙醇体积分数D反应时间 得率/% 1 1 21.87 2 1 2 2 2 23.34 1 1 1 3 3 18.67 4 2 1 2 3 26.59 1 3 3 5 1 22.53 6 2 3 1 2 19.76 2 2 3 7 2 20.79 8 3 2 1 3 18.92 3 1 3 1 14.81 K 1 63.9 69.3 60.6 59.2 K 2 68.9 64.8 64.7 63.9 K 3 54.5 53.2 62.0 64.2 k 1 21.3 23.1 20.2 19.7 k 2 23.0 21.6 21.6 21.3 k 3 18.2 17.7 20.7 21.4 R 14.4 16.0 4.2 5.0 9 3 3 2
2.3 反应产物的高效液相色谱分析
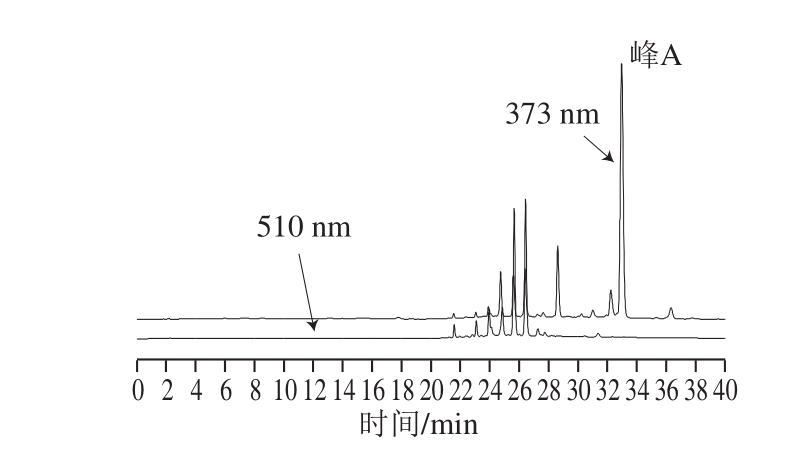
图7 oxovitisin A反应液(21 d后)在373 nm和510 nm波长条件下高效液相色谱图
Fig. 7 HPLC chromatograms recorded at 510 nm and 373 nm for the reaction mixture of the oxovitisin A adducts after 21 days
由图7可知,当检测波长从510 nm(羧基吡喃花色苷的特征吸收波长)变为373 nm时,保留时间33 min处出现一新色谱峰A,结合其特征吸收光谱的扫描结果,初步判定新生成的峰A为羧基吡喃花色苷微氧化生成的oxovitisin A。
2.4 反应主要产物的高效液相色谱-串联质谱分析
由图8可知,峰1的分子离子m/z为533,保留时间为23.04 min,其最大吸收波长为373 nm,明显不同于其他花色苷衍生物。二级质谱显示一个主要的碎片离子m/z 371,它是分子离子m/z 533失去一分子的葡萄糖[M—162] +获得。对分子离子m/z 533进行三级质谱分析,根据主要的碎片离子m/z 343所失去的原子质量28 u推断,它是分子离子继续失去吡喃环上的羰基(C=O)所获得。综上所述,与He等 [11-12]利用高效液相色谱-质谱及核磁共振等技术手段证实oxovitisin A分子结构的结果一致,根据特征吸收光谱表征和多级质谱结构分析,确认峰1化合物为oxovitisin A。
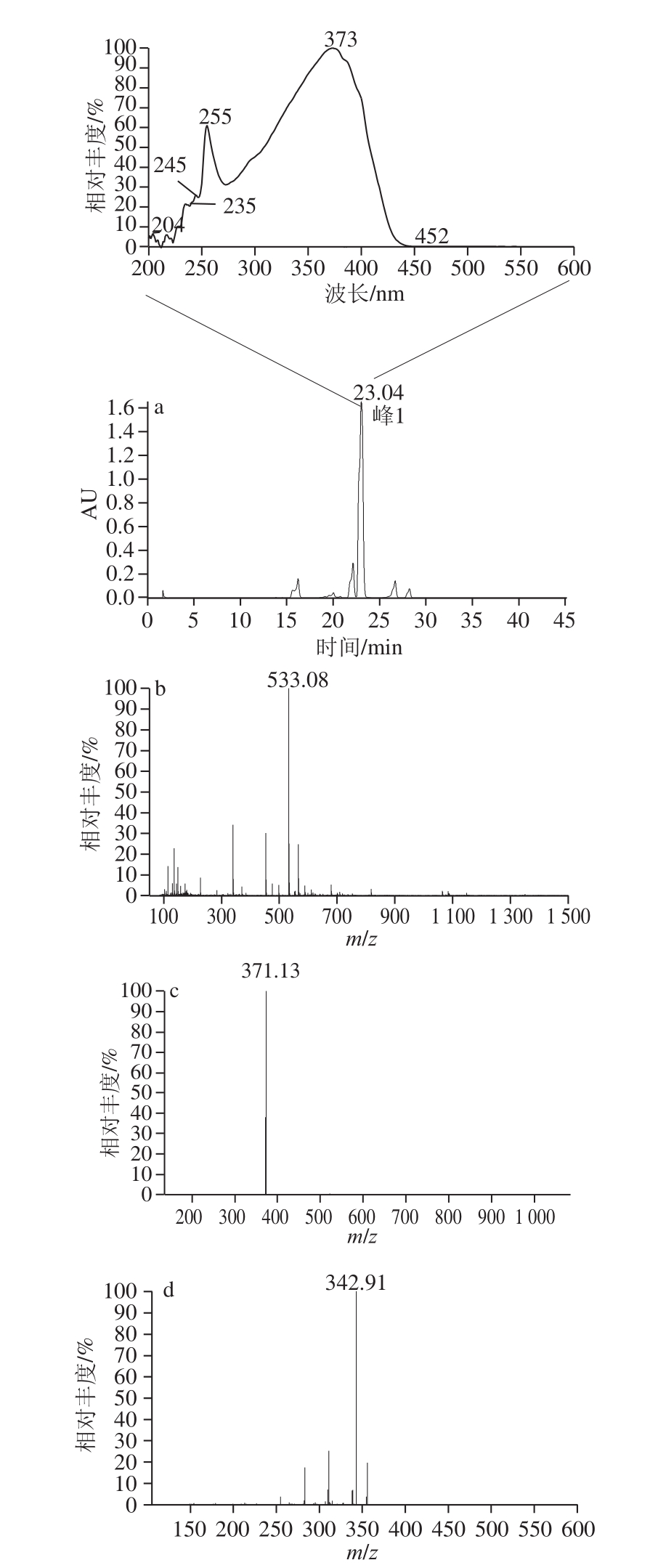
图8 oxovitisin A反应液的高效液相色谱-串联质谱(a)及其峰1的一级(b)、二级(c)和三级(d)质谱图
Fig. 8 HPLC-MS chromatograms of the oxovitisin A adducts and MS
1,MS
2and MS
3fragmentation scheme for peak 1
2.5 oxovitisin A抑制癌细胞Caco-2和MCF-7增殖活性
由图9可以看出,锦葵花色苷、oxovitisin A、羧基吡喃花色苷和甲基吡喃花色苷对C a c o-2和MCF-7细胞均有较好的抑制作用。对Caco-2细胞的半抑制浓度(50% inhibiting concentration,IC 50)分别为(131.2±59)、(238.8±24.6)、(316.7±29.7)μg/mL和(334.2±31.1)μg/mL,其中锦葵花色苷和oxovitisin A对Caco-2细胞的抑制作用最强,锦葵花色苷的抑制作用极显著强于羧基吡喃花色苷和甲基吡喃花色苷(P<0.01),oxovitisin A对Caco-2的抑制作用显著强于甲基吡喃花色苷(P<0.05)。4 种化合物对MCF-7细胞的IC 50分别为(54±9.3)、(85.7±9)、(135±27.8)μg/mL和(175±17)μg/mL,结果与对Caco-2的抑制作用类似,但IC 50值明显降低,说明MCF-7细胞对这4 种花色苷及其衍生物的作用更加敏感。
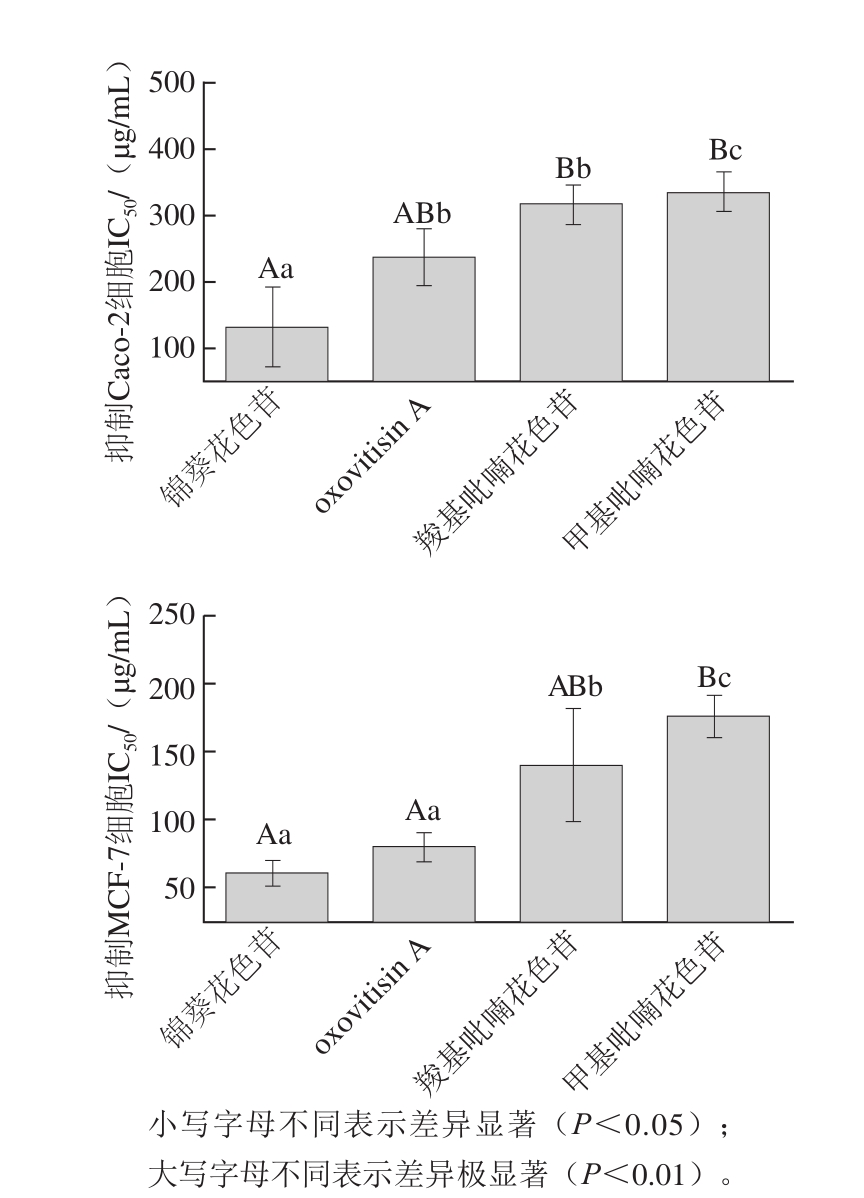
图9 锦葵花色苷、oxovitisin A、羧基吡喃花色苷和甲基吡喃花色苷对Caco-2和MCF-7细胞的抑制作用
Fig. 9 Antiproliferative activities of malvidin-3-O-glucoside, oxovitisin A,vitisin A and methyl-pyranoanthocyanin against Caco-2 and MCF-7 cell lines in vitro
在oxovitisin A、羧基吡喃花色苷和甲基吡喃花色苷3种花色苷衍生物中,oxovitisin A对MCF-7和Caco-2细胞增殖的抑制作用最强。这种抗肿瘤活性的差异与化合物结构密切相关,由于oxovitisin A本身不带电荷,这样就比较容易避免小分子的亲核进攻,吡喃环结构的存在也使其共轭结构更稳定;同时花色苷衍生物D环上的取代基不同,对3种化合物的抗肿瘤活性有直接影响,oxovitisin A上的羰基最活跃,其次是羧基吡喃花色苷上的羧基和甲基吡喃花色苷上连接的甲基。锦葵花色苷作为母体花色苷对MCF-7和Caco-2细胞的抑制作用要高于3种花色苷衍生物,这可能是因为锦葵花色苷的分子结构最小,更容易在细胞中扩散,并且A环上直接连接的羟基具有更强的生物活性。
正交试验得到oxovitisin A这种非氧鎓离子结构的吡喃酮型花色苷衍生物的最佳制备条件:以1.0 mg/mL羧基吡喃花色苷溶液为反应体系,乙醇体积分数20%、反应温度45 ℃、pH 3.6、反应时间21 d。该反应体系下oxovitisin A产物得率为26.59%。影响产物得率的主要因素依次是pH值、反应温度、反应时间和乙醇体积分数。高效液相色谱-串联离子阱多级质谱结合特征吸收光谱分析鉴定了主要产物为oxovitisin A。Caco-2和MCF-7细胞增殖实验研究表明,oxovitisin A能显著抑制Caco-2和MCF-7细胞增殖,IC 50值分别为(238.8±24.6)μg/mL和(85.7±9)μg/mL,且MCF-7细胞对oxovitisin A的作用最为敏感,抑制效果明显强于羧基吡喃花色苷和甲基吡喃花色苷,可能与其内酯型吡喃环(羰基)结构及非氧鎓离子的独特结构特征有关。oxovitisin A具有更稳定和独特化学结构的同时更好保留了母体花色苷的某些生物活性,值得进一步深入研究。
参考文献:
[1] HOSSEINIAN F S, LI Wende, TRUST B. Measurement of anthocyanins and other phytochemicals in purple wheat[J]. Food Chemistry, 2008,109(47): 916-924. DOI:10.1016/j.foodchem.2007.12.083.
[2] 李次力. 黑芸豆中花色苷色素的微波提取及功能特性研究[J]. 食品科学, 2008, 29(9): 299-302. DOI:10.3321/j.issn:1002-6630.2008.09.066.
[3] 聂芊, 廖顺雯, 刘涛. 四种粮豆作物的花色苷抗氧化性能比较[J]. 食品科学, 2007, 28(9): 46-48. DOI:10.3321/j.issn:1002-6630.2007.09.004.
[4] 焦岩, 王振宇. 蓝靛果花色苷超声波辅助提取优化及其降血脂作用[J]. 中国食品学报, 2010, 10(2): 52-59. DOI:10.3969/ j.issn.1009-7848.2010.02.008.
[5] FARIA A, PESTANA D, TEIXEIRA D, et al. Blueberry anthocyanins and pyruvic acid adducts: anticancer properties in breast cancer cell lines[J]. Phytotherapy Research, 2010, 24(12): 1862-1869. DOI:10.1002/ptr.3213.
[6] FERANADES I, FARIA A, AZEVEDO J, et al. Influence of anthocyanins, derivative pigments and other catechol and pyrogalloltype phenolics on breast cancer cell proliferation[J]. Journal of Agricultural and Food Chemistry, 2010, 58(6): 3785-3792. DOI:10.1021/jf903714z.
[7] LI T, ZHU J, GUO L, et al. Differential effects of polyphenols-enriched extracts from hawthorn fruit peels and fleshes on cell cycle and apoptosis in human MCF-7 breast carcinoma cells[J]. Food Chemistry, 2013,141(2): 1008-1018. DOI:10.1016/j.foodchem.2013.04.050.
[8] ZHANG Y J, VAREED S K, NAIR M G. Human tumor cell growth inhibition by nontoxic anthocyanidins, the pigments in fruits and vegetables[J]. Life Sciences, 2005, 76(13): 1465-1472. DOI:10.1016/ j.lfs.2004.08.025.
[9] REIN M J, OLLILAINEN V, VAHERMO M, et al. Identification of novel pyranoanthocyanins in berry juices[J]. European Food Research and Technology, 2005, 202(3): 239-244. DOI:10.1007/s00217-004-1063-6.
[10] FREITAS V, MATEUS N. Formation of pyranonathocyanins in red wines: a new and diverse class of anthocyanin derivatives[J]. Analytical and Bioanalytical Chemistry, 2011, 401(5): 1463-1473. DOI:10.1007/s00216-010-4479-9.
[11] HE J R, OLIVEIRA J, SILVA A M, et al. Oxovitisins: a new class of neutral pyranone-anthocyanin derivatives in red wines[J]. Journal of Agricultural and Food Chemistry, 2010, 58(15): 8814-8819. DOI:10.1021/jf101408q.
[12] HE J R, SILVA A M, MATEUS N, et al. Oxidative formation and structural characterisation of new alpha-pyranone (lactone) compounds of non-oxonium nature originated from fruit anthocyanins[J]. Food Chemistry, 2011, 127(3): 984-992. DOI:10.1016/ j.foodchem.2011.01.069.
[13] STEFANO A, SANDRO G C, MONICA L, et al. Antioxidant efficiency of oxovitisin, a new class of red wine pyranoanthocyanins,revealed through quantum mechanical investigations[J]. Journal of Chemical Information and Modeling, 2013, 53(1): 66-75. DOI:10.1021/ci300354s.
[14] 邝敏杰, 吴闹, 齐敏玉, 等. 甲基吡喃花色苷的制备优化及HPLC-MS/MS分析[J]. 食品工业科技, 2014, 35(20): 257-262. DOI:10.13386/j.issn1002-0306.2014.20.048.
[15] ZHU Z Z, WU N, KUANG M J, et al. Preparation and toxicological evaluation of methyl pyranoanthocyanin[J]. Food and Chemical Toxicology, 2015, 83: 125-132. DOI:10.1016/j.fct.2015.05.004.
[16] FULCRAND H, BENABDELJALIL C, RIGAUD J, et al. A new class of wine pigments generated by reaction between pyruvic acid and grape anthocyanins[J]. Phytochemistry, 1998, 47(7): 1401-1407. DOI:10.1016/S0031-9422(97)00772-3.
[17] OLIVEIRAL J, MATEUSL N, SILVA M S, et al. Equilibrium forms of vitisin B pigments in an aqueous system studied by NMR and visible spectroscopy[J]. Journal of Physical Chemistry B, 2009,113(32): 11352-11358. DOI:10.1021/jp904776k.
[18] DORA B V, FRANCISCO J L, JOSMARA A R, et al. HPLC-DADESI-MS/MS characterization of pyranoanthocyanins pigments formed in model wine[J]. Journal of Agricultural and Food Chemistry, 2011,59(17): 9523-9531. DOI:10.1021/jf201546j.
[19] OLIVEIRAL J, FERNANDES V, MIRANDA C, et al. Color properties of four Cyanidin-pyruvic acid adducts[J]. Journal of Agricultural and Food Chemistry, 2006, 54(18): 6894-6903. DOI:10.1021/jf061085b.
[20] QUINTANA A M, BUELGA C, ARICHA E, et al. Formation of anthocyanin-derived pigment in experimental red wines[J]. Food Science and Technology International, 1999, 5(4): 347-352. DOI:10.1177/108201329900500407.
[21] GIUSTI M M, WROLSTED R E. Characterization and measurement of anthocyanins by UV-visible spectroscopy[J]. Current Protocols in Food Analytical Chemistry, 2001, 8: 1-13. DOI:10.1002/0471142913. faf0102s00.
[22] 杨少娟, 赵海燕, 马永平, 等. 聚酰胺树脂层析纯化甘草黄酮的研究[J]. 广东农业科学, 2011, 38(16): 85-87. DOI:10.3969/j.issn.1004-874X.2011.16.032.
[23] HE J R, CELESTINO S B, MATEUS N. Isolation and quantification of oligomeric pyranoanthocyanin-flavanol pigments from red wines by combination of column chromatographic techniques[J]. Journal of Chromatography, 2006, 1134(1/2): 215-225. DOI:10.1016/ j.chroma.2006.09.011.
[24] HE J R, CELESTINO S B, ARTUR M S, et al. Isolation and structural characterization of new anthocyanin-derived yellow pigments in aged red wines[J]. Journal of Agricultural and Food Chemistry, 2006,54(25): 9598-9603. DOI:10.1021/jf062325q.
[25] OLIVEIRA H, FERNANDES I, DE F V, et al. Ageing impact on the antioxidant and antiproliferative properties of port wines[J]. Food Research International, 2015, 67: 199-205. DOI:10.1016/ j.foodres.2014.10.034.
Optimized Preparation of New Anthocyanin Derivative Oxovitisin A and Its Antiproliferation Effect on Cancer Cells in vitro
WU Nao, WANG Jingyi, ZHANG Qian, GUO Ying, LI Shuyi, HE Yi, ZHU Zhenzhou, HE Jingren*
(College of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430023, China)
Abstract:A novel polyphenolic compound, named oxovitisin, with unique lactone pyranone ring and non-oxonium structures was prepared. In this study, oxovitisin A was synthesized by two-step reactions in micro-oxygenation system by using carboxypyranoanthocyanins (vitisin A) as a precursor, which was formed from pyruvic acid and anthocyanins. The preparation conditions of oxovitisin A, namely temperature, pH, ethanol and reaction time, were optimized using combination of single factor and orthogonal array experiments. High performance liquid chromatography-with diodearray detection (HPLC-DAD) was used to monitor the reaction process and the main adduct was qualitatively and quantitatively analyzed by HPLC-DAD combined with electron ionization tandem mass spectrometry (HPLC-DAD-EIMS/MS). The sulforhodamine B (SRB) assay was employed to evaluate the anti-tumor effects of oxovitisin A, vitisin A,methyl-pyranoanthocyanin and malvidin-3-O-glucoside against Caco-2 and MCF-7 cells in vitro. The results showed that the optimal preparation conditions were found to be reaction at 45 ℃ for 21 d with 20% ethanol acidified to pH 3.6 using 1.0 mg/mL of vitisin A. The effects of four important variables on oxovitisin A yield followed the decreasing order: pH >reaction temperature > reaction duration > ethanol concentration. The main reaction product was confirmed by HPLCMS/MS to be oxovitisin A with a yield of 26.59% after 21 d. The SRB assay showed that oxovitisin A displayed obvious inhibitory effect on the proliferation of Caco-2 and MCF-7 cells with an IC 50value of (238.8 ± 24.6) and (85.7 ± 9) μg/mL,respectively, obviously stronger than that of vitisin A and methyl-pyranoanthocyanin.
Key words:anthocyanin derivatives; oxovitisin A; orthogonal array experiment; HPLC-MS/MS; anti-tumor effect
DOI:10.7506/spkx1002-6630-201616001
中图分类号:TS255.1;O658.1
文献标志码:A
文章编号:1002-6630(2016)16-0001-07
引文格式:
吴闹, 王静祎, 张倩, 等. 新型花色苷衍生物oxovitisin A制备条件优化及其体外抑制癌细胞增殖活性[J]. 食品科学,2016, 37(16): 1-7. DOI:10.7506/spkx1002-6630-201616001. http://www.spkx.net.cn
WU Nao, WANG Jingyi, ZHANG Qian, et al. Optimized preparation of new anthocyanin derivative oxovitisin a and its antiproliferation effect on cancer cells in vitro[J]. Food Science, 2016, 37(16): 1-7. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201616001. http://www.spkx.net.cn
收稿日期:2016-01-24
基金项目:国家自然科学基金面上项目(31371727);国际科技合作与交流专项(2014DFG32310);
湖北省自然科学基金项目(2014CFB891);湖北省科技支撑计划项目(2015BHE015)
作者简介:吴闹(1991—),男,硕士,研究方向为农产品加工化学与食品营养。E-mail:wu_nao@sina.com
*通信作者:何静仁(1974—),男,教授,博士,研究方向为膳食功效物质基础与分子营养。E-mail:jingren.he@whpu.edu.cn