康怀彬,尤晓颜*,肖天天,张晓宇,刘朝建
(河南科技大学食品与生物工程学院,河南省食品原料工程技术研究中心,河南 洛阳 471023)
摘 要:以玉米淀粉为原料,采用嗜冷普鲁兰酶脱支处理和压热处理相结合的方式制备玉米抗性淀粉,考察了玉米淀粉乳质量分数、耐高温α-淀粉酶添加量、嗜冷普鲁兰酶添加量、嗜冷普鲁兰酶作用时间对抗性淀粉得率的影响,采用正交试验对压热-酶解法制备玉米抗性淀粉的工艺参数进行了优化。采用扫描电子显微镜、X-射线衍射和差示扫描量热仪对玉米抗性淀粉形貌、晶体结构、热特性进行了观察与分析。结果表明,制备玉米抗性淀粉的最佳工艺条件为:玉米淀粉乳质量分数18%、耐高温α-淀粉酶添加量7 U/g、嗜冷普鲁兰酶添加量10 U/g、嗜冷普鲁兰酶作用时间9 h。在最佳条件下,玉米抗性淀粉得率为16.84%。玉米淀粉经复合酶法处理后,抗性淀粉形成了致密的层状晶体结构,表面形态结构呈现出不同于玉米原淀粉A型晶体结构的V型晶体结构;玉米抗性淀粉的起始温度、峰值温度、终止温度和相变焓值分别为117.07、140.69、153.03 ℃和1 858.12 J/g,均高于玉米原淀粉。
关键词:淀粉;普鲁兰酶;优化;抗性淀粉;晶体结构
自20世纪80年代发现以来,抗性淀粉凭借其能够控制血糖、调节血脂、增加肠道的有益菌、增加排泄物、促进矿物质的吸收等生理功效,已经被广泛应用于食品工业中 [1-8]。抗性淀粉与可溶性膳食纤维性质相近,一般将其分为4 类:即物理包埋淀粉、抗性淀粉颗粒、回生淀粉、化学改性淀粉 [9],其中回生淀粉对热稳定且抗酶解能力强,具有重要的商业价值,被用于多种传统食品的生产 [10-11]。回生淀粉可以采用压热法、酶解法、压热-酶解法、微波-酶解法等方法进行制备 [12-18]。压热-酶解法制备RS 3是近年来常采用的一种方式,它结合了压热法和酶解法的优点,可以有效提高抗性淀粉的得率,已经成功应用于绿豆、玉米等抗性淀粉的制备 [14,19]工艺中。压热-酶解法制备回生淀粉主要采用普鲁兰酶进行脱支,即利用普鲁兰酶特异性地水解淀粉中支链淀粉的α-1,6-糖苷键,增加直链淀粉分子的含量,从而促进淀粉回生过程中回生淀粉结晶的形成,所使用的普鲁兰酶多为嗜热普鲁兰酶 [14,20]。
普鲁兰酶Pul NX-1是从假交替单胞菌NX-1中分离得到的一种嗜冷普鲁兰酶,该酶最适作用温度为20 ℃,能够在低温条件下水解支链淀粉中的α-1,6-糖苷键。康怀彬等 [21]对该酶的产酶条件进行了优化,优化后嗜冷普鲁兰酶的产量可达25.172 U/mL。嗜冷普鲁兰酶是国内外近期研究普鲁兰酶的一个主要发展方向 [21-23],而利用嗜冷普鲁兰酶来生产抗性淀粉的工艺目前还鲜有相关报道。嗜冷普鲁兰酶制备抗性淀粉在工艺上是否可行,与中、高温普鲁兰酶相比所制备的抗性淀粉的结构和性质如何,是否会赋予抗性淀粉新的特征,这些科学问题的解答还需要进行相关的研究,特别是在淀粉工业节能降耗的背景下,开展嗜冷普鲁兰酶相关应用的研究更具有重要的价值。基于此,本研究选用我国的优势淀粉资源玉米淀粉为原料,采用压热-酶解法制备玉米抗性淀粉,探索嗜冷普鲁兰酶Pul NX-1制备玉米抗性淀粉的工艺条件,并通过扫描电子显微镜、X-射线衍射和差示扫描量热仪检测所制备玉米抗性淀粉的晶体结构和热力学特性,旨在为开展嗜冷普鲁兰酶工业化生产抗性淀粉提供理论依据。
1.1 材料与试剂
玉米淀粉 南京甘汁园糖业有限公司;普鲁兰酶Pul CA(酶活力4 000 U/g,最适温度55~60 ℃,pH 4.2~4.8) 上海生工生物工程股份有限公司;嗜冷普鲁兰酶Pul NX-1(酶活力25.17 U/mL,最适温度20 ℃,pH 7) 自制;耐高温α-淀粉酶(酶活力40 000 U/g,最适温度90 ℃以上,pH 5.5~7.0)、葡萄糖淀粉酶(酶活力100 000 U/g,最适温度60~65 ℃,pH 4.0~4.5) 江苏锐阳生物科技有限公司;胃蛋白酶(酶活力3 000 U/g,适用温度小于70 ℃,最适pH 2.0~4.0) 上海源叶生物科技有限公司。
1.2 仪器与设备
822型差示扫描量热仪 瑞士Mettler-Toledo公司;ESEM XL-3型环境扫描电子显微镜 荷兰Philips公司;BDX3300型X射线衍射仪 北京大学仪器厂。
1.3 方法
1.3.1 玉米抗性淀粉的制备工艺流程
将市售玉米淀粉配制成一定质量分数的淀粉乳,调pH值,加入一定量的耐高温α-淀粉酶,将其置于高压蒸汽灭菌锅内进行压热处理,自然冷却至室温;调pH值,加入一定量的嗜冷普鲁兰酶进行脱支处理,然后在100 ℃沸水浴中灭酶处理10 min,自然冷却至室温;将灭酶后的样品置于4 ℃冰箱中老化处理一段时间,之后在干燥箱中干燥;干燥后的样品经粉碎后过60 目筛即为玉米抗性淀粉样品,将玉米抗性淀粉样品置于干燥器中进行保藏。
1.3.2 工艺优化试验设计
在上述制备工艺的基础上相应地改变某个因素的水平进行单因素试验:玉米淀粉乳质量分数选取5%、10%、15%、20%、25%、30%,固定耐高温α-淀粉酶添加量10 U/g、嗜冷普鲁兰酶添加量10 U/g、嗜冷普鲁兰酶作用时间12 h;耐高温α-淀粉酶添加量选取0、6、8、10、12、14 U/g,固定玉米淀粉乳质量分数15%、嗜冷普鲁兰酶添加量10 U/g、嗜冷普鲁兰酶作用时间12 h;嗜冷普鲁兰酶添加量分别选取4、6、8、10、12、14 U/g,固定玉米淀粉乳质量分数15%、耐高温α-淀粉酶添加量10 U/g、嗜冷普鲁兰酶作用时间12 h;嗜冷普鲁兰酶作用时间分别选取2、4、6、8、10、12、24 h,固定玉米淀粉乳质量分数15%、嗜冷普鲁兰酶添加量10 U/g、耐高温α-淀粉酶添加量10 U/g。
以玉米淀粉乳质量分数、耐高温α-淀粉酶添加量、嗜冷普鲁兰酶添加量、嗜冷普鲁兰酶作用时间为因素,在每个因素的最适条件附近选取3 个水平,进行L 9(3 4)正交试验设计。
1.3.3 抗性淀粉得率的测定
玉米抗性淀粉得率的测定参照刘树兴等 [24]所述方法并做适当修改:准确称取1.00 g样品,依次加入10 mL pH 5.8的磷酸盐缓冲液和一定量耐高温α-淀粉酶,在沸水浴中煮沸30 min,冷却、离心、弃上清液;在沉淀物中再依次加入0.2 mol/L pH 1.7的HCl-KCl缓冲液和一定量胃蛋白酶,之后在40 ℃水浴中放置1 h,取出,冷却、离心、弃上清液;再次在沉淀物中依次加入pH 4.6的乙酸-乙酸钠缓冲液10 mL和一定量的葡萄糖淀粉酶,60 ℃水浴30 min后冷却,离心,弃上清液,水洗,重复3 次;在沉淀中加入10 mL 2 mol/L的KOH溶液,静置30 min,然后加入5 mL pH 5.8的磷酸盐缓冲液和一定量的耐高温α-淀粉酶,沸水浴30 min,冷却至室温后调pH 4.6,接着加入葡萄糖淀粉酶,再在60 ℃水浴中放置30 min,冷却、离心,收集上清液,水洗,如此反复3 次,合并上清液后用蒸馏水定容至100 mL。所得溶液用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定其中还原糖的含量,结果乘以0.9,即为抗性淀粉的得率,重复3 次测定样品中抗性淀粉的得率。计算如下式所示:
式中:M为DNS法测得的还原糖质量/mg;V为样品提取液的体积/mL;m为抗性淀粉样品质量/g;V 1为显色用样品液体积/mL;0.9为修正值。
1.3.4 扫描电子显微镜分析
将待测淀粉样品置于105 ℃烘箱中干燥4~5 h,称取5 mg淀粉样品于1 mL 50%乙醇溶液中,超声匀化成淀粉悬浊液。将洁净的铝箔片黏附在样品台上,将上述淀粉悬浊液滴于洁净铝箔片上,在红外灯下烘干液体后,置于离子溅射仪的样品舱中,在15 mA的电流条件下喷金90 s。样品取出后,在扫描电子显微镜下观察并拍摄淀粉颗粒形貌的照片。
1.3.5 X-射线衍射分析
将测试样品在相对湿度为100%的干燥器中放置5~7 d后进行测定,样品X-射线衍射测定条件为:起始角5 ˚,终止角35 ˚,扫描速率4 ˚/min,靶型Cu,电压36 kV,电流20 mA,数据采集步宽为0.02 ˚,所用射线的波长为0.154 2 nm,扫描方式为连续扫描。
1.3.6 差示扫描量热分析
热特性采用差示扫描量热仪进行测定:称取一定量待测的淀粉样品,制备成8%的淀粉乳,用移液枪吸取18~24 mg的淀粉乳于坩埚中并加盖密封,用空坩埚做为对照,从50 ℃升温至180 ℃,升温速率为10 ℃/min。
2.1 单因素试验结果
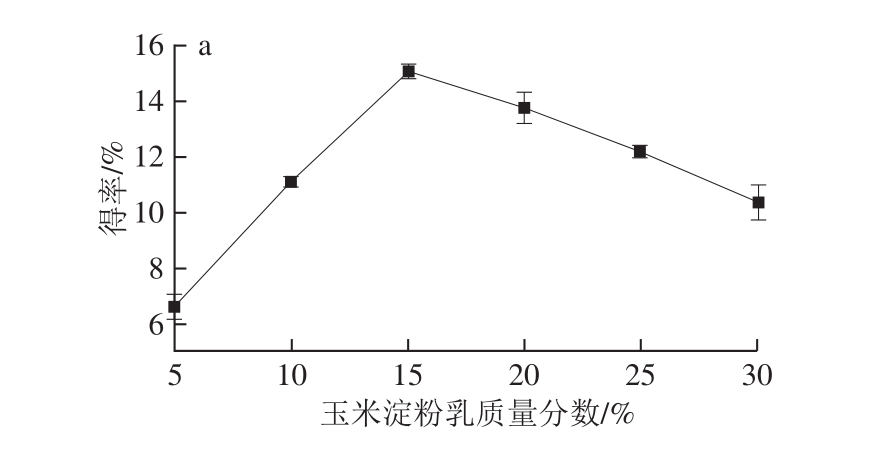

图1 玉米淀粉乳质量分数(a)、耐高温α-淀粉酶添加量(b)、嗜冷普鲁兰酶添加量(c)、嗜冷普鲁兰酶作用时间(d)对抗性淀粉得率的影响
Fig. 1 Effects of starch slurry content, starch slurry content,the amounts of heat α-amylase and psychrophilic pullulanase, and psychrophilic pullulanase reaction time on resistant starch yield
由图1a可知,玉米淀粉乳质量分数过高或者过低都将不利于抗性淀粉的形成。当玉米淀粉乳质量分数为5%时,抗性淀粉得率较低,随着玉米淀粉乳质量分数的增大,抗性淀粉得率迅速提高。当玉米淀粉乳质量分数达到15%时,抗性淀粉得率最高(15.07%),之后抗性淀粉得率开始呈下降趋势。这主要是由于淀粉乳质量分数过高时,淀粉粒难以充分的膨胀、糊化,同时淀粉糊黏度增大不利于直链淀粉分子之间的相互作用形成抗性淀粉晶体。
耐高温α-淀粉酶可以将淀粉分子的α-1,4-葡萄糖苷键从内部随机切开,迅速地降低淀粉糊的黏度,因此耐高温α-淀粉酶的添加量直接关系到抗性淀粉的得率。在较低添加量时,随着耐高温α-淀粉酶添加量的增加,抗性淀粉的得率呈迅速增加趋势,当添加量为8 U/g时,抗性淀粉得率最高(15.13%),之后随着添加量的增加呈下降趋势(图1b)。
如图1c所示,随着嗜冷普鲁兰酶添加量的增多,得率呈现出先缓慢增加后逐渐下降的趋势,在嗜冷普鲁兰酶添加量为10 U/g时抗性淀粉得率达到最高(14.77%),随着嗜冷普鲁兰酶添加量继续增加,抗性淀粉得率开始下降。
嗜冷普鲁兰酶作用时间对抗性淀粉得率的影响趋势与嗜冷普鲁兰酶添加量相似(图1d),呈先升后降的状态,在嗜冷普鲁兰酶作用10 h时抗性淀粉得率最高,为15.23%。
2.2 抗性淀粉制备工艺参数的优化
表1 正交试验设计与结果
Table 1 Orthogonal array design with experimental results

试验号 A玉米淀粉乳质量分数/%抗性淀粉得率/% 1 12 7 9 9 12.21 2 12 8 10 10 12.94 3 12 9 11 11 6.65 4 15 7 10 11 16.55 5 15 8 13 9 10.16 6 15 9 9 10 8.43 7 18 7 11 10 11.99 8 18 8 9 11 12.60 9 18 9 10 9 15.37 k 1 10.60 13.58 11.08 12.58 k 2 11.71 11.90 14.95 11.12 k 3 13.32 10.15 9.60 11.93 R 2.72 3.43 5.35 1.46 B耐高温α-淀粉酶添加量/(U/g)C嗜冷普鲁兰酶添加量/(U/g)D嗜冷普鲁兰酶作用时间/h
由表1可知,各个因素对玉米抗性淀粉得率的影响顺序为:嗜冷普鲁兰酶添加量>耐高温α-淀粉酶添加量>玉米淀粉乳质量分数>嗜冷普鲁兰酶作用时间;由极差分析得出的制备玉米抗性淀粉最优工艺参数组合为A 3B 1C 2D 1,该组合在正交试验表中未出现,经验证实验,A 3B 1C 2D 1组合制备的抗性淀粉得率为16.84%,抗性淀粉得率高于表1中抗性淀粉得率最高的组合A 2B 1C 2D 3,因此确定制备抗性淀粉最优的工艺参数为:玉米淀粉乳质量分数18%、耐高温α-淀粉酶添加量7 U/g、嗜冷普鲁兰酶添加量10 U/g、嗜冷普鲁兰酶作用时间9 h。
2.3 颗粒形态分析

图2 玉米原淀粉与抗性淀粉扫描电子显微镜照片
Fig. 2 Scanning electron micrographs of corn native starch and resistant starch
电子显微镜照片结果显示,玉米原淀粉与抗性淀粉在颗粒形态上存在着明显的差异,玉米原淀粉颗粒呈椭圆形或者多边形,大小不一,表面较为光滑平整(图2a、b),而由嗜冷普鲁兰酶和市售普鲁兰酶所制备的玉米抗性淀粉颗粒则多为不规则的团块状,不仅失去了原有颗粒的形状、表面光滑性,而且形成了明显的致密的层状结构(图2c~e)。出现这一现象的原因可能是在制备抗性淀粉的过程中,α-淀粉酶与普鲁兰酶共同作用,使得玉米原淀粉分子中的α-1,4糖苷键和α-1,6糖苷键不断被水解,淀粉颗粒结构遭到破坏,产生了更多易于结晶的直链淀粉分子,这些直链淀粉分子在后续的老化过程中不断靠近、相互交联,最终形成了致密的团块状颗粒结构。结果与Zhang Huanxin等 [25]的观测结果相一致。与市售普鲁兰酶制备的抗性淀粉相比,由嗜冷普鲁兰酶制备的玉米抗性淀粉颗粒结构与之相似。
2.4 X-射线衍射分析
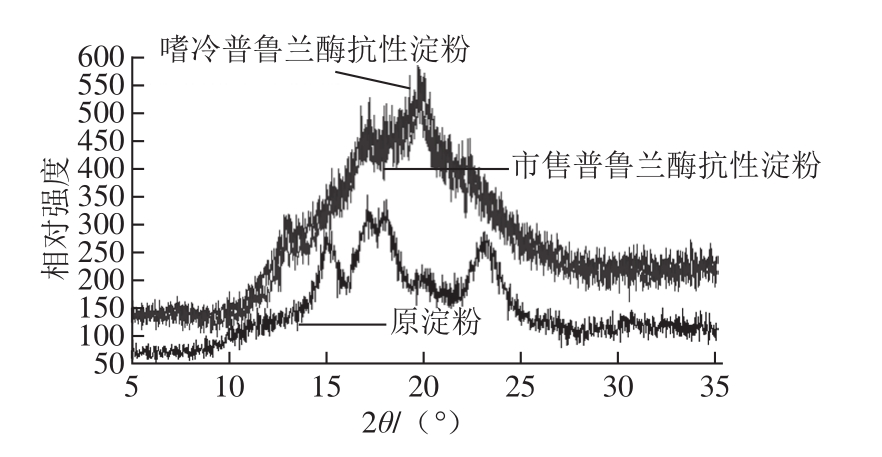
图3 玉米原淀粉与抗性淀粉X-射线衍射图
Fig. 3 XRD patterns of corn native starch and resistant starch
如图3所示,与玉米原淀粉相比,由嗜冷普鲁兰酶和市售普鲁兰酶所制备的玉米抗性淀粉的X-射线衍射图谱均发生了明显的变化。玉米原淀粉在15.08 ˚、17.1 ˚、18.1 ˚、23.5 ˚处具有特征衍射峰,属于A型淀粉晶体结构,当经过经压热-酶解处理后,特征衍射峰完全消失,由嗜冷普鲁兰酶和市售普鲁兰酶所制备的玉米抗性淀粉在17 ˚和22 ˚处附近出现了新的特征衍射峰,这表明玉米原淀粉在制备抗性淀粉的过程中晶体结构被完全破坏,产生了新的晶体结构。嗜冷普鲁兰酶抗性淀粉的特征衍射峰在17.34 ˚和22.32 ˚处,而市售普鲁兰酶抗性淀粉的特征衍射峰在17.44 ˚和22.3 ˚处,两者峰形相似,均属于V型淀粉晶体结构。在A、B、C、V 4 类淀粉晶体结构中,V型晶体结构抗酶解性能最强,A型最弱 [26],因此,X-射线衍射结果表明,嗜冷普鲁兰酶抗性淀粉和市售普鲁兰酶制备抗性淀粉晶体结构相似,相对于玉米原淀粉均具有较强的抗酶解性能。
2.5 差示扫描量热分析
由图4可以看到,玉米原淀粉有2 个吸热峰,第1个吸热峰是糊化吸热峰,第2个吸热峰为相变吸热峰。这是因为淀粉颗粒在糊化前,体系中含有较多水分,升温使得淀粉颗粒吸水发生膨胀,由于淀粉颗粒中的结晶区和无定形区是相连接的,在淀粉发生溶胀的过程中微晶也发生融化,因而出现了第1个吸热峰;随着体系升温、水分减少,剩余微晶在高温条件下继续熔化,产生第2个吸热峰。而嗜冷普鲁兰酶抗性淀粉和市售普鲁兰酶抗性淀粉曲线峰形相似,只有1个相变吸热峰,主要是因为抗性淀粉颗粒的晶体结构比较致密,淀粉颗粒与极性水分子之间的亲和力小,糊化过程中不易发生吸水膨胀形成糊化吸热峰。
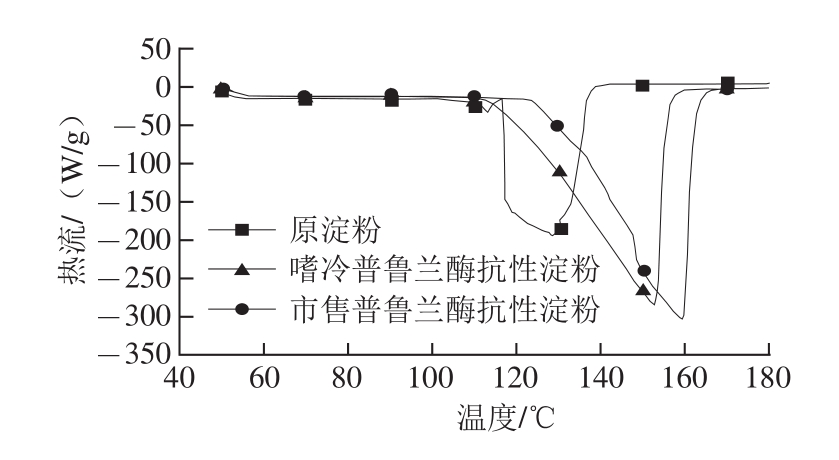
图4 玉米原淀粉与抗性淀粉的差示扫描量热值曲线
Fig. 4 DSC curves of corn native starch and resistant starch
表2 起始温度、峰值温度、终止温度和相变焓值比较
Table 2 Onset temperature, peak temperature, end temperature and phase change enthalpy of corn native and resistant starch

样品 起始温度/℃ 峰值温度/℃ 终止温度/℃ 相变焓/(J/g)玉米原淀粉 115.78 120.75 136.19 1 193.63嗜冷普鲁兰酶抗性淀粉 117.07 140.69 153.03 1 858.12市售普鲁兰酶抗性淀粉 136.06 146.18 159.48 1 926.08
如表2所示,与玉米原淀粉相比,抗性淀粉的相变起始温度、峰值温度、终止温度均有一定提高,其中市售普鲁兰酶抗性淀粉提升幅度最高,分别为20.28、25.43 ℃和23.29 ℃。这主要是因为玉米原淀粉颗粒经压热-酶解处理后淀粉分子发生了定向重排进和交联,使得淀粉内部的结构变得坚固紧密,形成了热稳定性更好的V型结构的淀粉晶型,而要打破这种结构需要提供更多的能量,表现在相变焓值升高。与市售普鲁兰酶抗性淀粉相比,嗜冷普鲁兰酶抗性淀粉相变起始温度较低(117.07℃),而其余差示扫描量热参数则与市售普鲁兰酶抗性淀粉相近,说明尽管不同普鲁兰酶制得的玉米抗性淀粉抗性淀粉在晶体结构方面相似(均为V型),但两者之间的热力学性质还是存在着一定差异,从差示扫描量热曲线中也可以观察到这种差异(图2)。
正交试验结果表明,采用嗜冷普鲁兰酶脱支处理和压热处理相结合的方式制备玉米抗性淀粉的最优工艺参数为玉米淀粉乳质量分数18%、耐高温α-淀粉酶添加量7 U/g、嗜冷普鲁兰酶添加量10 U/g、嗜冷普鲁兰酶作用时间9 h,该条件下的抗性淀粉得率为16.84%。
扫描电子显微镜观察结果显示,嗜冷普鲁兰酶制备的玉米抗性淀粉颗粒形貌呈现出不规则的块状结构,玉米原淀粉的颗粒形貌遭到破坏。X-射线衍射测定结果表明,嗜冷普鲁兰酶制备的玉米抗性淀粉呈现出V型晶体结构,不同于玉米淀粉的A型结晶结构。差示量热扫描结果表明,嗜冷普鲁兰酶制备的玉米抗性淀粉,其起始温度、峰值温度、终止温度和相变焓值均高于玉米原淀粉,说明抗性淀粉的热稳定性更好。
参考文献:
[1] 付蕾, 田纪春, 汪浩. 抗性淀粉理化特性研究[J]. 中国粮油学报,2009, 24(5): 58-62.
[2] AZIZ H, AMIR A, ATA K K, et al. Resistant starch in food industry: a changing outlook for consumer and producer[J]. Starch-Stärke,66(1/2): 102-114. DOI:10.1002/star.201300110.
[3] FUENTES-ZARAGOZA E, RIQUELME-NAVARRETE M J, SANCHEZ-ZAPATA E, et al. Resistant starch as functional ingredient: a review[J]. Food Research International, 2010, 43(4): 931-942. DOI:10.1016/j.foodres.2010.02.004.
[4] 于淼, 邬应龙. 甘薯抗性淀粉对高脂血症大鼠降脂利肝作用研究[J].食品科学, 2012, 33(1): 244-247.
[5] 冯铄涵, 骞宇, 张璐, 等. 抗性淀粉种类对大鼠肠道代谢产物和血脂的影响[J]. 食品科学, 2012, 33(19): 289-294.
[6] 郝征红, 张炳文, 郭珊珊, 等. 超微粉碎-微波联用技术制备绿豆抗性淀粉条件优化[J]. 食品科学, 2014, 35(24): 69-73. DOI:10.7506/ spkx1002-6630-201424013.
[7] 李敏, 杨晓光, 朴建华. 抗性淀粉生理功能的研究进展[J]. 卫生研究,2008, 37(5): 640-643. DOI:10.3969/j.issn.1000-8020.2008.05.045.
[8] 朱平, 孔祥礼, 包劲松. 抗性淀粉在食品中的应用及功效研究进展[J]. 核农学报, 2015, 29(2): 327-336. DOI:10.11869/ j.issn.100-8551.2015.02.0327.
[9] ZHAO Xinhuai, LIN Yang. The impact of coupled acid or pullulanase debranching on the formation of resistant starch from maize starch with autoclaving-cooling cycles[J]. European Food Research and Technology,2009, 230(1): 179-184. DOI:10.1007/s00217-009-1151-8.
[10] HARALAMPU S G. Resistant starch: a review of the physical properties and biological impact of RS 3[J]. Carbohydrate Polymers,2000, 41(3): 285-292. DOI:10.1016/S0144-8617(99)00147-2.
[11] FUENTES-ZARAGOZA E, SANCHEZ-ZAPATA E, SENDRA E,et al. Resistant starch as prebiotic: a review[J]. Starch-Stärke, 2011,63(7): 406-415. DOI:10.1002/star.201000099.
[12] 赵力超, 于荣, 刘欣, 等. 大米抗性淀粉制备工艺优化及特性分析[J]. 农业工程学报, 2013, 29(12): 277-285. DOI:10.3969/ j.issn.1002-6819.2013.12.035.
[13] 田芳, 肖新龙, 李海侠, 等. 酶解法制备荞麦抗性淀粉的工艺优化[J]. 粮食加工, 2012, 37(4): 53-56. DOI:10.3969/ j.issn.1007-6395.2012.04.021.
[14] 高群玉, 李素玲. 绿豆抗性淀粉的制备及特性[J]. 华南理工大学学报(自然科学版), 2011, 39(4): 88-93. DOI:10.3969/j.issn.1000-565X.2011.04.016.
[15] 李周勇, 韩育梅, 高宇萍, 等. 微波-酶法制备马铃薯抗性淀粉工艺参数的优化[J]. 中国粮油学报, 2012, 27(6): 46-50. DOI:10.3969/ j.issn.1003-0174.2012.06.010.
[16] 吴红引, 王泽南, 张秋子, 等. 压热-酶法制备碎米抗性淀粉的工艺及其结构特性研究[J]. 现代食品科技, 2011, 27(2): 166-169.
DOI:10.3969/j.issn.1673-9078.2011.02.012.
[17] 别同玉, 许加生, 别同德. 我国抗性淀粉制备工艺研究进展[J]. 高分子通报, 2011(5): 34-38.
[18] 申瑞玲, 刘晓芸, 董吉林, 等. 抗性淀粉制备及性质和结构研究进展[J]. 粮食与油脂, 2013, 26(1): 5-8. DOI:10.3969/ j.issn.1008-9578.2013.01.004.
[19] 胡晓彤, 张文. 压热-酶解法制备玉米抗性淀粉新工艺的研究[J].食品与发酵科技, 2010, 46(5): 58-61. DOI:10.3969/j.issn.1674-506X.2010.05-015.
[20] 史苗苗, 高群玉, 郑琳, 等. 普鲁兰酶加酶量对蜡质玉米抗性淀粉影响及性质研究[J]. 粮食与油脂, 2012(4): 16-19. DOI:10.3969/ j.issn.1008-9578.2012.04.005.
[21] 康怀彬, 肖天天, 李净净, 等. 嗜冷普鲁兰酶产生菌NX-1的筛选及产酶条件优化[J]. 食品科学, 2015, 36(1): 46-51. DOI:10.7506/ spkx1002-6630-201501023.
[22] QOURA F, ELLEUCHE S, BRUECK T, et al. Purification and characterization of a cold-adapted pullulanase from a psychrophilic bacterial isolate[J]. Extremophiles, 2014, 18(6): 1095-1102.
DOI:10.1007/s00792-014-0678-1.
[23] RAJAEI S, HEIDARI R, SHAHBANI Z H, et al. A novel cold-adapted pullulanase from Exiguobacterium sp. SH3: production optimization,purification, and characterization[J]. Starch-Stärke, 2014, 66(3/4): 225-234. DOI:10.1002/star.201300030.
[24] 刘树兴, 问燕梅, 常大伟. 超声波-酶法制备小麦RS 3型抗性淀粉工业参数的优化[J]. 中国食品添加剂, 2013(6): 113-118.
[25] ZHANG Huanxin, JIN Zhengyu. Preparation of products rich in resistant starch from maize starch by an enzy matic method[J]. Carbohydrate Polymers, 2011, 86: 1610-1614. DOI:10.1016/ j.carbpol.2011.06.070.
[26] BULEON A, COLONNA P, PLANCHOT V, et al. Starch granules: structure and biosynthesis[J]. International Journal of Biological Macromolecules,1998, 23(2): 85-112. DOI:10.1016/S0141-8130(98)00040-3.
Optimization of Preparation Process for Corn Resistant Starch with Psychrophilic Pullulanase and Analysis of Its Properties
KANG Huaibin, YOU Xiaoyan*, XIAO Tiantian, ZHANG Xiaoyu, LIU Chaojian
(Henan Engineering Research Center of Food Material, College of Food and Bioengineering,Henan University of Science and Technology, Luoyang 471023, China)
Abstract:In this research, corn resistant starch was produced by autoclaving treatment combined with psychrophilic pullulanase hydrolysis, and starch slurry content, the amounts of heat α-amylase and psychrophilic pullulanase, and psychrophilic pullulanase reaction time were optimized for the enhanced production of corn resistant starch through orthogonal array experiments. Then, the crystal structure characterization and formation mechanisms of resistant starch were investigated by using the scanning electron microscope (SEM), X-ray diffraction (XRD) and differential scanning calorimeter (DSC). It was found that the optimum parameters for resistant starch preparation were as follows: corn starch slurry concentration, 18%; thermostable alpha-amylase dosage, 7 U/g; psychrophilic-pullulanase dosage, 10 U/g; and reaction time, 9 h. The yield of resistant starch was 16.84% under these conditions. The crystal structure of resistant starch belonged to the V-type, which was different from that the A-type crystal structure of raw starch. Compared to raw starch,the resistant starch showed higher phase onset temperature (117.07 ℃), peak temperature (140.69 ℃), end temperature (153.03 ℃) and phase change enthalpy (1 858.12 J/g), respectively, resulting in better thermo stability.
Key words:starch; pullulanase; optimization; resistant starch; crystal structure
DOI:10.7506/spkx1002-6630-201616002
中图分类号:TS235.1
文献标志码:A
文章编号:1002-6630(2016)16-0008-06
引文格式:
康怀彬, 尤晓颜, 肖天天, 等. 嗜冷普鲁兰酶制备玉米抗性淀粉工艺优化及其表征[J]. 食品科学, 2016, 37(16): 8-13.
DOI:10.7506/spkx1002-6630-201616002. http://www.spkx.net.cn
KANG Huaibin, YOU Xiaoyan, XIAO Tiantian, et al. Optimization of preparation process for corn resistant starch with psychrophilic pullulanase and analysis of its properties[J]. Food Science, 2016, 37(16): 8-13. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201616002. http://www.spkx.net.cn
收稿日期:2016-02-25
基金项目:国家自然科学基金青年科学基金项目(31200035)
作者简介:康怀彬(1963—),男,教授,硕士,研究方向为农产品加工及质量控制。E-mail:khbin001@163.com
*通信作者:尤晓颜(1979—),男,副教授,博士,研究方向为食品生物技术。E-mail:xiaoyanyou@hasust.edu.cn