 /Fe
2O
3/γ-Al
2O
3负载型固体酸催化剂。利用固体酸催化剂催化玉米皮半纤维素水解,以水解液中戊糖收率作为考察指标,根据Box-Behnken试验设计原理,采用响应面分析法,确定玉米皮水解最佳工艺条件。
/Fe
2O
3/γ-Al
2O
3负载型固体酸催化剂。利用固体酸催化剂催化玉米皮半纤维素水解,以水解液中戊糖收率作为考察指标,根据Box-Behnken试验设计原理,采用响应面分析法,确定玉米皮水解最佳工艺条件。
赵 玮,周瑾琨,王大为*
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
摘 要:采用SO 4 2-/Fe 2O 3/γ-Al 2O 3负载型固体酸催化剂,催化玉米皮半纤维素水解,对反应工艺条件进行研究。选择催化剂用量、水解温度、水解时间、料液比进行单因素试验,在此基础上采用Box-Behnken试验设计,以戊糖收率为响应值进行响应面分析试验,确定最优工艺参数。结果表明:各因素对戊糖收率的影响主次顺序为:催化剂用量>水解温度>水解时间>料液比;通过响应面法优化并修正得最佳工艺条件为催化剂用量12 mL/10 g玉米皮、水解温度120 ℃、水解时间4 h、料液比1∶10,在此条件下戊糖最高收率为22.45%,与理论预测值基本一致。高效液相色谱分析结果表明,玉米皮水解液主要由葡萄糖、木糖、阿拉伯糖3 种单糖组成,比例为葡萄糖4.99%、木糖34.78%、阿拉伯糖55.90%;玉米皮及其水解后残渣红外光谱分析表明,半纤维素中木糖基和阿拉伯糖基结构均发生了变化,说明半纤维素发生了降解。
关键词:玉米皮;半纤维素;水解;固体酸催化剂;响应面分析法
玉米皮是湿磨法生产淀粉的主要副产物,约占玉米原料的10%~14%(干基)。目前主要应用于饲料行业,造成了资源的极度浪费,附加值比较低。玉米皮作为玉米非淀粉组分,亦被称为玉米纤维,是玉米籽粒的表皮部分,主要由纤维素、半纤维素、蛋白质、脂肪以及少量的灰分和其他微量成分组成 [1]。玉米皮中含有两大类生理活性物质,分别为活性多糖和酚类化合物。玉米皮中半纤维素含量为43.8%,纤维素含量为14.7%,木质素含量为1.0%。目前,玉米皮的加工利用主要集中在玉米膳食纤维、阿拉伯木聚糖、阿魏酸、玉米黄色素等产品的研发方向,玉米皮半纤维素的水解研究较少 [2]。
半纤维素是玉米皮的主要成分,是由几种不同类型的单糖构成的异构多聚体,可溶于碱溶液,遇酸后远较纤维素易于水解。半纤维素水解液主要由五碳糖和六碳糖组成,包括木糖、阿拉伯糖、葡萄糖和少量的甘露糖和半乳糖,它们通常不能被酒精酵母所发酵,可用于生产饲料酵母、制备糠醛及木糖醇等,具有极高的附加价值和广阔的应用前景 [3]。目前,玉米皮半纤维素水解主要使用无机酸(硫酸、盐酸、草酸等),价格便宜,催化效果好,但是容易造成环境污染而且催化剂无法回收重复利用。
固体酸是近年来研究与开发的一种新型酸催化剂,主要种类有沸石分子筛、杂多酸、阳离子交换树脂、固体超强酸等,具有对环境友好、可重复利用等优点,具有广泛的工业应用前景 [4-5]。负载型固体酸催化剂是固体酸催化剂中较为重要的一类,是将活性组分负载于载体上制得,活性组分主要有液体酸、杂多酸、金属盐等 [6-7]。利用固体酸催化剂催化玉米皮半纤维素水解,大大克服了其他水解方法的缺点。
Fe
2(SO
4)
3是一种具有酸性的金属盐,本研究将Fe
2(SO
4)
3作为前驱体,将高温焙烧后制得的γ-Al
2O
3小球作为载体,制备SO
 /Fe
2O
3/γ-Al
2O
3负载型固体酸催化剂。利用固体酸催化剂催化玉米皮半纤维素水解,以水解液中戊糖收率作为考察指标,根据Box-Behnken试验设计原理,采用响应面分析法,确定玉米皮水解最佳工艺条件。
/Fe
2O
3/γ-Al
2O
3负载型固体酸催化剂。利用固体酸催化剂催化玉米皮半纤维素水解,以水解液中戊糖收率作为考察指标,根据Box-Behnken试验设计原理,采用响应面分析法,确定玉米皮水解最佳工艺条件。
1.1 材料与试剂
γ-Al 2O 3小球(粒度3~5 mm) 天津市科密欧化学试剂有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)试剂配制:量取750 mL去离子水,加热至微热后,顺序加入10.00 g DNS、16.00 g NaOH、5.00 g亚硫酸钠和300.00 g酒石酸钾钠,溶解后定容至1 000 mL,贮存于棕色瓶中放置1周后备用 [8]。其他试剂均为分析纯。
1.2 仪器与设备
SX-8-10型箱式电阻炉、FZ102型微型植物粉碎机 天津市泰斯特仪器有限公司;JJ-1型精密增力电动搅拌器 金坛市江南仪器厂;101A-2E型数显式电热鼓风干燥箱 上海实验仪器厂有限公司;HH-2数显恒温水浴锅 常州澳华仪器有限公司;DL-5-B型高速离心机上海安亭科学仪器厂;TV1901型双光束紫外-可见分光光度计 北京普析通用仪器有限公司;600型高效液相色谱仪 美国Waters公司;FTIR-8900型傅里叶红外光谱仪 日本岛津公司。
1.3 方法
1.3.1 SO
 /Fe
2O
3/γ-Al
2O
3催化剂制备工艺
/Fe
2O
3/γ-Al
2O
3催化剂制备工艺
将活性氧化铝小球置于高温炉中,于400 ℃条件下加热焙烧4 h后待用。用量筒准确量取一定体积处理后Al
2O
3小球称质量。按Al
2O
3小球的质量,计算Fe
3+质量分数为6%时,需要Fe
2(SO
4)
3的质量。取Fe
2(SO
4)
3粉末于小烧杯中,加适量去离子水,于恒温水浴中加热溶解,制得Fe
2(SO
4)
3溶液。将溶液与等体积Al
2O
3小球混合均匀,超声波处理一定时间后,于60 ℃恒温水浴加热振荡3 h,静置过夜;抽滤得催化剂小球,将催化剂置于恒温干燥箱内105 ℃干燥后,将催化剂小球置于1 mol/L H
2SO
4溶液中浸泡2 h,置于恒温干燥箱内105 ℃干燥,于500 ℃高温炉中焙烧4 h后制得SO
 /Fe
2O
3/γ-Al
2O
3催化剂。
/Fe
2O
3/γ-Al
2O
3催化剂。
1.3.2 玉米皮预处理
用清水充分清洗玉米皮,去除杂质、离心脱水。在温度40~60 ℃条件下烘干至水分含量低于8%,粉碎过40 目筛。采用CO 2超临界流体萃取对玉米皮进行脱脂、脱色及脱除异味处理,萃取压力30 MPa、萃取温度50 ℃、萃取时间100 min、CO 2流量23 L/h。用碱性蛋白酶处理玉米皮,酶解条件:pH 8.5、酶解温度55~60 ℃、酶解时间2 h、底物质量分数20%、酶质量分数2.5%,将酶解物煮沸灭酶,离心分离。
1.3.3 玉米皮半纤维素水解工艺流程
将10 g玉米皮及去离子水按一定料液比加入容积为500 mL三颈瓶中,加入一定量固体酸催化剂,搅拌均匀。安装三颈瓶、电动搅拌器、温度计及冷凝回流装置,常压条件下在油浴锅中进行水解反应。反应结束后,抽滤分离玉米皮残渣及水解液,将玉米皮残渣于105 ℃条件下烘干待测,水解液用活性炭脱色后待测。
1.3.4 木糖标准曲线的绘制
取干燥后木糖1.000 0 g,定容至100 mL,得质量分数为1%木糖标准溶液。精确吸取0、0.5、1.0、1.5、2.0、2.5 mL的木糖标准溶液于25 mL比色管中,定容得系列木糖标准溶液,质量浓度为0、200、400、600、800、1 000 μg/mL。分取上述木糖标准溶液1.0 mL于具塞比色管中,各加2 mL DNS溶液;另取2 mL DNS溶液于一比色管中,作为空白溶液。将以上比色管于沸水浴中加热5 min进行显色处理,后迅速冷却,定容至25 mL。利用紫外-可见分光光度计,以DNS溶液为空白校准基线后,在400~700 nm波长范围内对木糖-DNS标准溶液进行扫描。结果表明,木糖在波长489 nm处有最强吸收峰(图1)。在489 nm波长条件下测定上述木糖-DNS标准溶液,记录各质量浓度木糖溶液相应吸光度做标准曲线,所得回归方程为Y=0.025 64X-0.540 48,R 2=0.997 87。

图1 木糖标准溶液紫外-可见吸收光谱扫描图
Fig. 1 Ultraviolet-visible absorption spectra of xylose standard solution
1.3.5 玉米皮水解产物高效液相色谱分析
色谱条件:色谱柱为氨基柱(5 nm、100 A,4.6 mm×250 mm),检测器为蒸发光检测器,柱温85 ℃,流动相为乙腈-水(85∶15,V/V),流速0.6 mL/min,进样量5 μL。
标准溶液的配制:准确称取一定量的岩藻糖、木糖、葡萄糖、葡萄糖醛酸、鼠李糖及阿拉伯糖,用超纯水混合并定容,配制成己知质量浓度的混糖标准液。混合糖液稀释4 倍,备用。
标准曲线的制作:准确吸取混糖标准溶液5、10、15、20、25 μL分5 次进样,以混糖标准溶液中单糖组分含量(μg)的对数值为横坐标(X),以相应峰面积的对数值为纵坐标(Y),制作标准曲线并计算线性回归方程 [9],见表1。
表1 单糖标准品的线性回归方程及相关系数
Table 1 Linear equations with correlation coefficient and linear range for seven standard monosaccharides

种类 线性方程 相关系数鼠李糖 Y=1.653 2X+5.520 9 1.000 0葡萄糖 Y=1.497 4X+5.931 4 0.997 2木糖 Y=1.450 8X+6.115 0.999 8阿拉伯糖 Y=1.286 6X+5.573 5 0.991 6甘露糖 Y=1.258 9X+5.841 1 0.999 9岩藻糖 Y=1.303 7X+5.603 1 0.997 5葡萄糖醛酸 Y=1.396 7X+6.213 5 0.999 0
1.3.6 红外光谱分析
采用KBr压片法,在0~4 500 cm -1范围内对玉米皮水解残渣进行红外光谱分析。
1.3.7 指标测定
1.3.7.1 戊糖收率
将玉米皮水解液于13 000 r/min条件下离心10 min,收集上清液过0.22 μm滤膜,得待测样品溶液。重复进样3 次,每次5 μL。将水解液进行高效液相色谱分析,读取木糖、阿拉伯糖对应峰面积,取对数处理,通过标准曲线方程计算出水解液中木糖及阿拉伯糖的质量,按下式计算戊糖收率:
1.3.7.2 总糖含量
利用紫外-可见分光光度计测定水解液吸光度,通过木糖溶液标准曲线回归方程确定总糖含量,结果以木糖计。
1.3.8 玉米皮半纤维素水解工艺优化的试验设计
利用单因素试验分别考察催化剂用量、水解温度、水解时间及料液比对玉米皮半纤维素水解的影响。在单因素试验的基础上,利用Design-Expert 8.0软件的Box-Behnken设计,以催化剂用量、水解温度、水解时间、料液比为自变量,以戊糖收率为响应值,进行响应面试验,对玉米皮水解工艺条件进行优化。响应面试验因素与水平设计见表2。
表2 玉米皮半纤维素水解响应面试验因素与水平
Table 2 Factors and their coded levels used in response surface design

因素A催化剂用量/ (mL/10 g玉米皮)D料液比(g/mL)-1 10 110 3 1∶8 0 12 120 4 1∶10 1 14 130 5 1∶12水平B水解温度/℃C水解时间/h
2.1 单因素试验结果
2.1.1 催化剂用量对玉米皮半纤维素水解的影响
按1.3.3节工艺流程,固定水解温度100 ℃、水解时间3 h、料液比1∶10,改变催化剂用量,所得结果见图2。
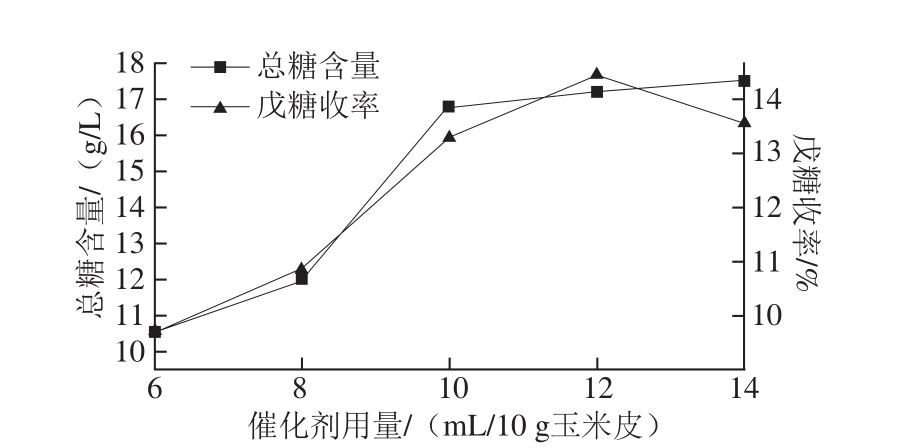
图2 催化剂用量对总糖含量及戊糖收率的影响
Fig. 2 Effect of catalyst amount on total sugar content and pentose yield
由图2可知,催化剂用量小于10 mL/10 g玉米皮时,随着催化剂用量的增加,总糖含量及戊糖收率都逐渐增大;催化剂用量大于10 mL/10 g玉米皮,总糖含量增加趋势变缓,增幅不明显;催化剂用量为12 mL/10 g玉米皮时,戊糖收率达到最大值,随后呈下降趋势。分析原因,固体酸催化剂表面分布着酸强度不同的酸中心,在一定范围内催化剂用量越多,酸中心的数量越多,催化剂的酸强度也就越大,有利于半纤维素的水解;当催化剂用量超过10 mL/10 g玉米皮后,大部分戊聚糖水解完全,总糖含量增加不明显 [10-13];另外由于催化剂固体小球数量过多,导致搅拌不均匀,料液混合不充分,不利于单糖的生成,所以戊糖收率下降。综上所述,本研究催化剂用量选定为12 mL/10 g玉米皮。
2.1.2 水解温度对玉米皮半纤维素水解的影响
按1.3.3节工艺流程,固定催化剂用量10 mL/10 g玉米皮、水解时间3 h、料液比1∶10,改变水解温度,所得结果见图3。
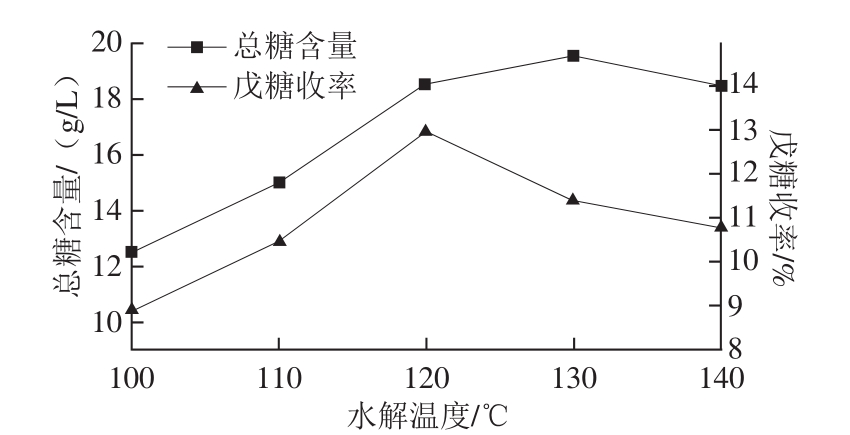
图3 水解温度对总糖含量和戊糖收率的影响
Fig. 3 Effect of hydrolysis temperature on total sugar content and pentose yield
由图3可知,当水解温度低于120 ℃时,总糖含量和戊糖收率均随水解温度的升高而增加;总糖含量在130 ℃后,有缓慢下降的趋势,戊糖收率在120 ℃达到最大值后下降明显。分析原因,水解温度的升高,有利于提高反应速率,促进半纤维素水解完全,故总糖含量与水解温度呈正比。在半纤维素组织中,聚木糖结合在纤维素的表面,聚木糖水解需要较高温度,而L-阿拉伯糖作为支链连接在聚木糖主链上,稍低的温度即可以使阿拉伯糖水解完全,即高温有利于聚木糖充分水解,从而使总糖含量增加;但过高的温度也促进单糖的降解,木糖120 ℃以上就可以转变为糠醛,致使戊糖收率下降;另单糖在较高的温度易发生美拉德反应,焦化而加深水解液的颜色,影响总糖含量的测定 [11-14]。综上所述,本研究水解温度选定为120 ℃。
2.1.3 水解时间对玉米皮半纤维素水解的影响
按1.3.3节工艺流程,固定催化剂用量10 mL/10 g玉米皮、水解温度100 ℃、料液比1∶10,改变水解时间,所得结果见图4。
由图4可知,水解时间在1~4 h时,总糖含量及戊糖收率均随水解时间的延长而升高,水解时间大于4 h后,两指标均显示出不同程度下降。分析原因,在一定范围内,水解时间越长,水解反应越充分,总糖含量及戊糖收率均呈上升趋势;随着水解时间的延长,木糖等单糖的质量浓度增加,单糖的降解反应速率也不断加快,当单糖降解速率超过半纤维素水解速率时,单糖含量及戊糖收率均呈下降趋势 [15-16]。综上所述,本研究水解时间选为4 h。
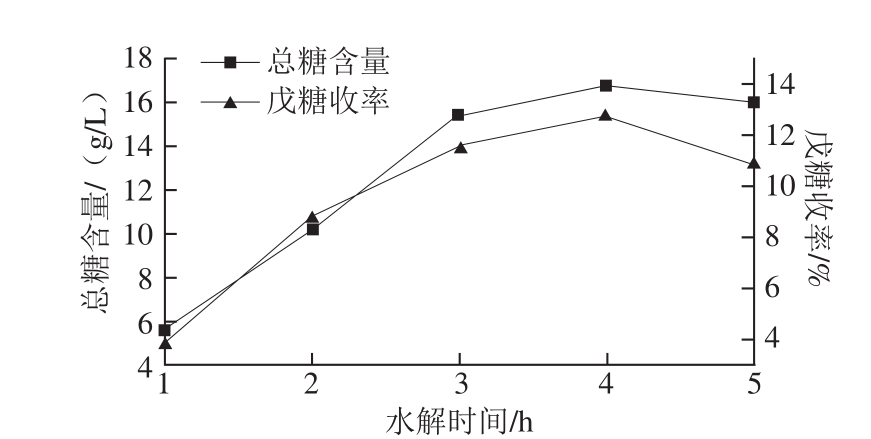
图4 水解时间对总糖含量和戊糖收率的影响
Fig. 4 Effect of hydrolysis time on total sugar content and pentose yield
2.1.4 料液比对玉米皮半纤维素水解的影响
按1.3.3节工艺流程,固定催化剂用量10 mL/10 g玉米皮、水解温度100 ℃、水解时间3 h,改变料液比,所得结果见图5。

图5 料液比对总糖含量和戊糖收率的影响
Fig. 5 Effect of solid-to-liquid ratio on total sugar content and pentose yield
由图5可知,总糖含量随着水溶液体积的增大而下降,分析原因为水溶液体积的加大,稀释了总糖溶液,因此总糖含量逐渐下降;戊糖收率随着水溶液体积的增大呈现下降趋势,当料液比在1∶10后下降明显。分析原因,水溶液体积加大有利于料液混合充分,使戊糖收率增加,所以戊糖收率下降不明显;当水溶液体积超过一定范围,溶液逐渐被稀释,原料与催化剂活性表面接触逐渐减少,戊糖收率下降 [17-18]。综上所述,本研究料液比选为1∶10。
2.2 响应面试验结果
2.2.1 Box-Behnken试验结果与方差分析
如表3所示,本次Box-Behnken设计共有29 个试验点,其中24 个为析因试验,其余5 个为中心试验,析因点为自变量取值所构成的三维定点,零点区域为中心点,零点区域重复5 次,用于估计试验误差。将表3的试验数据进行多元回归分析,结果见表4。
由表4可以看出,A、B、A 2、B 2、C 2对戊糖收率的影响高度显著(P<0.001),C、AC、D 2对戊糖收率的影响显著(P<0.05);残差、纯误差都非常小,决定系数R 2=0.956 4,信噪比为16.951,表明方程的拟合度和可信度均很高;变异系数为6.34%,说明试验操作可信度高,精确性较好,具有一定的实践意义。各因素对戊糖收率的影响程度强弱的次序为催化剂用量>水解温度>水解时间>料液比。
表3 Box-Behnken试验设计及结果
Table 3 Results of Box-Behnken experimental design

试验号 A催化剂用量 B水解温度 C水解时间 D料液比 戊糖收率/% 1 1 -1 0 0 13.83 2 0 0 -1 -1 18.82 3 -1 0 -1 0 13.23 4 1 0 0 -1 16.78 5 0 21.95 6 1 0 0 -1 13.98 0 0 0 7 0 22.03 8 0 0 0 0 21.55 0 0 0 0 -1 0 -1 16.25 10 -1 0 0 1 12.12 11 -1 -1 0 0 9.98 12 0 -1 0 1 13.45 13 1 0 -1 0 13.98 14 0 1 0 -1 18.27 15 -1 1 0 0 13.03 16 0 1 1 0 19.23 17 0 0 -1 1 17.29 18 0 0 0 0 20.98 19 0 0 0 0 22.45 20 0 1 0 1 18.28 21 0 -1 -1 0 12.98 22 0 1 -1 0 17.99 23 -1 0 1 0 10.23 24 1 0 1 0 16.23 25 1 0 0 1 18.24 26 0 0 1 -1 21.08 27 0 -1 1 0 16.38 28 0 0 1 1 19.87 29 1 1 0 0 15.55 9
表4 方差分析表
Table 4 Results of variance analysis

注:**.差异高度显著(P<0.001);*.差异显著(P<0.05)。
0.912 9信噪比 16.951变异系数/% 6.34来源 平方和 自由度 均方 F值 P值模型 347.23 14 24.80 21.96 <0.000 1** A催化剂用量 40.48 1 40.48 35.84 <0.000 1** B水解温度 31.62 1 31.62 27.99 0.000 1** C水解时间 6.35 1 6.35 5.62 0.032 6* D料液比 2.93 1 2.93 2.59 0.129 6 AB 0.44 1 0.44 0.39 0.541 6 AC 6.89 1 6.89 6.10 0.027 0* AD 2.76 1 2.76 2.44 0.140 6 BC 1.17 1 1.17 1.03 0.326 8 BD 1.97 1 1.97 1.75 0.207 4 CD 0.026 1 0.026 0.023 0.882 5 A 2 211.47 1 211.47 187.20 <0.000 1** B 2 77.42 1 77.42 68.53 <0.000 1** C 2 24.50 1 24.50 21.69 0.000 4** D 2 7.20 1 7.20 6.37 0.024 3*残差 15.81 14 1.13失拟 14.58 10 1.46 4.73 0.073 8纯误差 1.23 4 0.31总和 363.04 28 R2 0.956 4 R2 Adj
各试验因素对响应值的影响不是简单的线性关系,试验因素对响应值影响的回归方程为:
Y=21.79+1.84A+1.62B+0.73C-0.49D-0.33AB+ 0.83AD-0.54BC+0.70BD+0.080CD-5.71A 2-3.45B 2-1.94C 2-1.05D 2
2.2.2 响应面分析与优化



图6 各因素交互作用对戊糖收率影响的响应面和等高线
Fig. 6 Response surface and contour plots showing the interactive effects of four factors on pentose yield
由图6可知,催化剂用量对戊糖收率的影响最为显著,表现为曲线较陡,沿催化剂用量轴向,戊糖收率响应值变化较大;水解温度对戊糖收率的影响也极为显著;水解时间对戊糖收率的影响较为显著,料液比对对戊糖收率的影响最弱,表现为曲线较平滑,沿料液比轴向,响应值变化较小。图6b、c高线的形状呈椭圆形,表明催化剂用量和水解时间、料液比两因素之间的交互效应极显著,图6e中等高线的形状也呈现椭圆形,表明料液比和水解温度之间的交互效应也极显著;图6d中等高线图也呈现一定椭圆形,表明水解温度和水解时间两因素间的交互也较显著;图6a、f中等高线趋于圆形,表明催化剂用量和水解温度、水解时间和料液化等因素间的交互作用不显著,以上结果与方差分析的结果一致。由图6可知,在两两因素交互作用的响应面图中,每两种因素交互的响应面均存在最高点,也是等高线最小椭圆的中心点,即戊糖收率在所选范围内均存在最大值 [19-20]。回归模型预测的玉米皮水解的最佳工艺条件为:催化剂用量12.34 mL/10 g玉米皮、水解温度122 ℃、水解时间4.21 h、料液比1∶9.82,戊糖收率的最高理论值为22.214 8%。将工艺条件修正为催化剂用量为12 mL/10 g玉米皮、水解温度120 ℃、水解时间4 h、料液比1∶10,得出戊糖收率为22.45%,与理论预测值基本一致。因此,基于响应面法分析所得的优化提取工艺参数准确可靠,具有实用价值 [21-22]。
2.3 高效液相色谱分析

图7 混糖标准溶液(A)和玉米皮水解液(B)单糖高效液相色谱图
Fig. 7 Chromatogram of mixed monosaccharide standards and corn bran hydrolysate
对比图7A、B可知,玉米皮水解液主要由葡萄糖、木糖、阿拉伯糖3 种单糖组成,通过计算得出各单糖占总糖比例为葡萄糖4.99%、木糖34.78%、阿拉伯糖55.90%。
2.4 红外光谱分析
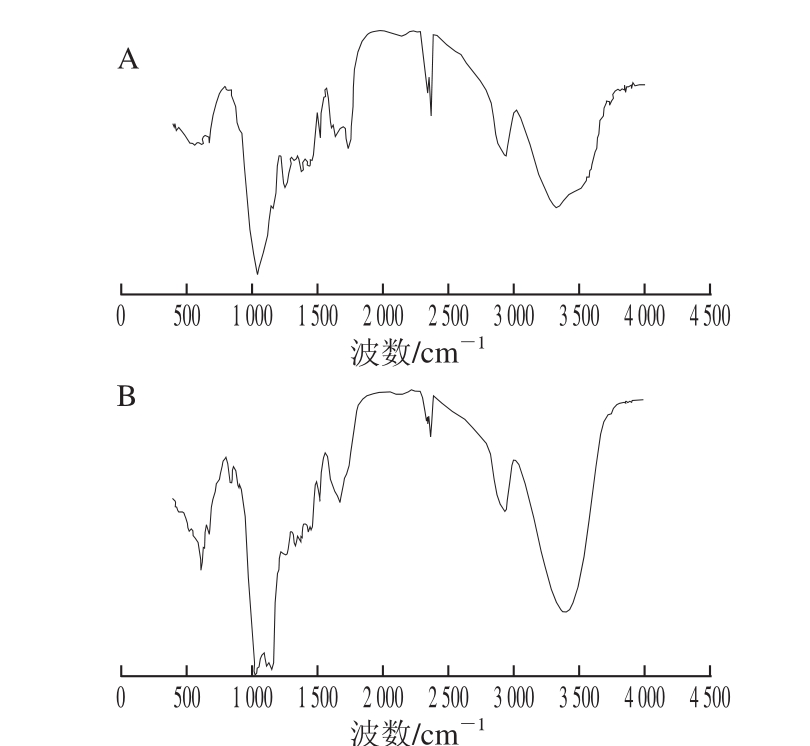
图8 玉米皮(A)和玉米皮水解后残渣(B)红外光谱图
Fig. 8 IR spectra of corn bran (A) and hydrolysis residues (B)
利用红外光谱对原料玉米皮及水解后残渣进行表征,图8A、B具有典型的木质纤维素结构。3 430 cm -1的吸收峰是多糖单元中羟基和醚键C—O—C伸缩振动引起的,是典型的木质纤维素结构特征吸收峰 [21]。1 057 cm -1是由木聚糖中C—O—C键上的C—O伸缩振动引起的,是β-D-木糖的特征结构,属于半纤维的特征吸收峰,该吸收峰在图8B中变化明显,说明水解反应使木聚糖发生降解。1 613 cm -1和1 628 cm -1是水分子的吸收峰,在两图中均有存在。1 252~1 461 cm -1是C—H和C—O弯曲或拉伸振动吸收峰。987~1 250 cm -1之间的谱带是阿拉伯聚糖的吸收峰。图8A中987 cm -1和1 160 cm -1是阿拉伯糖基戊聚糖基侧链振动引起的弱吸收峰,这两个峰在图8B中未有显现,说明阿拉伯聚糖水解较完全。1 560~1 610 cm -1的吸收峰是由于木质素中苯环骨架振动产生的,在两图中均有存在,说明反应前后木质素结构没有变化。比较两图可以发现,水解前后原料红外谱图中各峰的位置几乎不变,一些代表戊聚糖结构的特征峰被破坏,说明半纤维素发生了降解 [23-25]。
通过单因素试验和响应面优化分析,影响戊糖收率的主次顺序为:催化剂用量>水解温度>水解时间>料液比;通过响应面法优化得到最佳工艺条件为:催化剂用量12 mL/10 g玉米皮、水解温度120 ℃、水解时间4 h、料液比1∶10。最优条件下戊糖最高收率为22.45%,与理论预测值基本一致。高效液相色谱分析结果表明,玉米皮水解液主要由葡萄糖、木糖、阿拉伯糖3 种单糖组成,各单糖占总糖比例为葡萄糖4.99%、木糖34.78%、阿拉伯糖55.90%;对原料玉米皮及水解后残渣进行红外光谱分析表明,半纤维素主要成分聚戊糖中木糖基和阿拉伯糖基结构均发生了变化,说明半纤维素发生了降解。本研究采用SO 4 2-/Fe 2O 3/γ-Al 2O 3负载型固体酸催化剂催化玉米皮半纤维素水解。与传统液体酸催化性能相比,戊糖收率相差不大,说明该催化剂酸性很强,用其代替液体酸催化半纤维素水解具有一定研究价值。
参考文献:
[1] 代养勇, 董海洲, 王志刚, 等. 我国玉米深加工产业现状及发展趋势[J].中国食物与营养, 2011, 17(4): 37-39.
[2] 张艳荣, 王大为, 祝威. 高品质玉米膳食纤维生产工艺的研究[J]. 食品科学, 2004, 25(9): 213-217. DOI:10.3321/ j.issn:1002-6630.2004.09.049.
[3] 张毅民, 梁莹, 吕学斌, 等. 玉米秸秆中半纤维素水解条件的优化[J]. 天津大学学报, 2007, 40(4): 432-447. DOI:10.3969/ j.issn.0493-2137.2007.04.010.
[4] 成战胜, 行春丽, 田京城, 等. 固体超强酸催化剂的研究进展[J]. 应用化工, 2004, 33(6): 5-8.
[5] 毛东森, 卢冠忠, 陈庆龄, 等. 负载型氧化物固体超强酸催化剂的制备及应用[J]. 化学通报, 2000(5): 278-284. DOI:10.3969/ j.issn.0441-3776.2001.05.004.
[6] 雷霆, 华伟明. γ-Al
2O
3负载Cr促进SO
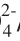 /ZrO
2固体超强酸研究[J]. 高等学校化学学报, 2000, 21(11): 1697-1702.
/ZrO
2固体超强酸研究[J]. 高等学校化学学报, 2000, 21(11): 1697-1702.
[7] 张翠仙. 负载型固体酸催化剂的制备及性能研究[D]. 石家庄: 河北师范大学, 2002.
[8] 北京大学生物化学教研室. 生物化学实验指导[M]. 北京: 高等教育出版社, 1990: 23-26.
[9] 戴军, 朱松, 汤坚, 等. PMP柱前衍生高效液相色谱法分析杜氏盐藻多糖的单糖组成[J]. 分析测试学报, 2007, 26(2): 206-210.
DOI:10.3969/j.issn.1004-4957.2007.02.015.
[10] ELIASSON A, CHRISTEN C, WAHLBOM C, et al. Anaerobic xylose fermentation by recombinant Saccharomyces cerevisiae carrying XYL1, XYL2, and XKS1 in mineral medium chemostat cultures[J]. Applied and Environmental Microbiology, 2000, 66(8): 3381-3386.
DOI:10.1128/aem.66.8.3381-3386.2000.
[11] 宋丽岩. 木糖脱水制备糠醛的工艺研究[D]. 长春: 吉林大学, 2013.
[12] AVCI A, SAHA B, KENNEDY G, et al. High temperature dilute phosphoric acid pretreatment of corn stoverfor furfural and ethanol production[J]. Industrial Crops and Products, 2013, 50: 478-484.
[13] 戴春爱, 刘博, 颜鲁婷, 等. 固体酸催化剂SO
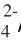 /ZrO
2催化木糖制备呋喃甲醛的研究[J]. 林产化学与工业, 2012, 32(3): 43-46.
/ZrO
2催化木糖制备呋喃甲醛的研究[J]. 林产化学与工业, 2012, 32(3): 43-46.
[14] 金强, 张红漫, 严立石, 等. 生物质半纤维素稀酸水解反应[J]. 化学进展, 2010, 22(4): 654-661.
[15] PARAJO J C, DOMINGUEZ H, DOMINGUEZ J M. Charcoal adsorption of wood hydrolysates for improving their fermentability: influence of the operational conditions[J]. Bioresource Technology,1996, 57: 179-185. DOI:10.1016/0960-8524(96)00066-1.
[16] 张扬. 木糖醇发酵稻秸半纤维素水解液制备的研究[D]. 北京: 北京化工大学, 2005.
[17] 盖伟东, 杜丽平, 肖冬光, 等. 玉米皮水解液生产单细胞蛋白与L-阿拉伯糖[J]. 食品与发酵工业, 2011, 37(1): 98-101.
[18] 王远魁. 固体酸催化木糖水溶液制备糠醛的工艺研究[D]. 北京: 北京理工大学, 2014.
[19] CHUNDAWAT S P S, VENKATESH B, DALE B E. Effect of particle size based separation of milled corn stover on AFEX pretreatment and enzymatic digestibility[J]. Biotechnology and Bioengineering, 2007,96(2): 219-231.
[20] 杨柳. 固体催化剂催化葡萄糖制备5-羟甲基糠醛[D]. 南昌: 南昌大学, 2012.
[21] GUO Feng, FANG Zhen, ZHOU Tiejun. Conversion of fructose and glucose into 5-hydroxymethylfurfural with lignin-derived carbonaceous catalyst under microwave irradiation in dimethyl sulfoxide-ionic liquid mixtures[J]. Bioresourse Technology, 2012, 112: 313-318. DOI:10.1016/j.biortech.2012.02.108.
[22] 袁传勋, 刘小芳, 金日生. 响应面试验优化茶多酚-Zn络合物制备工艺[J]. 食品科学, 2015, 36(16): 1-6. DOI:10.7506/spkx1002-6630-201516001.
[23] 赵能, 罗安伟, 姚婕, 等. 响应面试验优化胡萝卜浆复合酶解工艺[J]. 食品科学, 2015, 36(16): 83-87. DOI:10.7506/spkx1002-6630-201516015.
[24] 任俊莉, 彭锋, 彭新文, 等. 农业秸秆半纤维素分离及纯化技术研究进展[J]. 纤维素科学与技术, 2010, 18(3): 56-67. DOI:10.3969/ j.issn.1004-8405.2010.03.010.
[25] 黄曹兴, 何娟, 闵斗勇, 等. 毛竹竹青和竹黄半纤维素的提取与结构表征[J]. 林产化学与工业, 2015, 35(5): 29-35. DOI:10.3969/ j.issn.0253-2417.2015.05.006.
Optimization of Hydrolysis Conditions of Corn Bran Hemicellulose by Supported Solid Acid Catalyst with Response Surface Methodology
ZHAO Wei, ZHOU Jinkun, WANG Dawei*
(College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
Abstract:This work reports on the optimization of hydrolysis conditions of corn bran hemicellulose by a supported solid acid catalyst, SO 4 2-/Fe 2O 3/γ-Al 2O 3. First of all, the one factor-at-a-time method was used to examine the effects of catalyst dosage, hydrolysis temperature, time and material-to-solvent ratio on total sugar content and pentose yield. Subsequently,optimization of the four reaction conditions was performed using response surface methodology based on Box-Behnken experimental design. Results indicated that the optimal conditions for hydrolysis of corn bran hemicellulose were determined as follows: catalyst amount, 12 mL/10 g corn bran; hydrolysis temperature, 120 ℃; hydrolysis time, 4 h; and solid-toliquid ratio, 1:10. The maximum pentose yield of 22.45%, which was close to the predicted value, was obtained under these conditions. Monosaccharide composition and contents of the hydrolysate, as analyzed by HPLC, showed that the relative contents of three main monosaccharides were glucose 4.99%, xylose 34.78%, and arabinose 55.90%, respectively. Infrared (IR) spectra of corn bran and its hydrolysis residues showed that the structure of xylose and arabinose changed, indicating that hemicellulose is degraded.
Key words:corn bran; hemicellulose; hydrolysis; solid acid catalyst; response surface methodology
DOI:10.7506/spkx1002-6630-201616003
中图分类号:TQ656.1
文献标志码:A
文章编号:1002-6630(2016)16-0014-08
引文格式:
赵玮, 周瑾琨, 王大为. 响应面试验优化固体酸催化剂催化玉米皮半纤维素水解工艺[J]. 食品科学, 2016, 37(16): 14-21.
DOI:10.7506/spkx1002-6630-201616003. http://www.spkx.net.cn
ZHAO Wei, ZHOU Jinkun, WANG Dawei. Optimization of hydrolysis conditions of corn bran hemicellulose by supported solid acid catalyst with response surface methodology[J]. Food Science, 2016, 37(16): 14-21. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201616003. http://www.spkx.net.cn
收稿日期:2016-03-29
基金项目:国家高技术研究发展计划(863计划)项目(2011AA100805);吉林省青年科研基金项目(20140520181JH)
作者简介:赵玮(1977—),女,副教授,博士研究生,研究方向为粮油化工产品研究与开发。E-mail:zhaow1229@163.com
*通信作者:王大为(1960—),男,教授,博士,研究方向为粮食、油脂与植物蛋白工程。E-mail:xcpyfzx@163.com