赵 月,李 荣,姜子涛*
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
摘 要:通过响应面法确定超声-微波协同萃取栽培菊苣籽总黄酮的最佳条件为:液料比40∶1(mL/g)、乙醇体积分数71%、提取温度65 ℃、微波功率400 W、超声功率50 W、提取时间6 min。在此条件下,测得栽培菊苣籽中黄酮的含量为93.23 mg/g。通过动态纯化的方式确定AB-8大孔树脂纯化菊苣籽总黄酮的条件为:上样液pH 4、上样液和洗脱液流速2 BV/h、洗脱液乙醇体积分数70%。高效液相色谱(high performance liquid chromatography,HPLC)分析结果显示,栽培菊苣籽总黄酮主要是由绿原酸和洋蓟素两种化合物构成。离线1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)-HPLC法显示,洋蓟素比绿原酸对DPPH自由基具有更强的抗氧化活性,二者对游离基的清除率分别为64.11%和61.65%。
关键词:栽培菊苣籽;黄酮;响应面法;DPPH;洋蓟素;识别
栽培菊苣(Cichorium endivia L.)是一种以生食为主的绿叶蔬菜 [1],具有轻微的苦味,主要用于制作沙拉和凉拌,别名苦菊、苦细叶生菜、苦苣等,为菊科菊苣属草本植物。关于该蔬菜茎叶中黄酮类化学成分的研究已有一些报道。研究 [2-3]显示,栽培菊苣茎叶中含有绿原酸和洋蓟素,因此其乙醇提取物具有较强的清除游离基和抗氧化活性 [4-8]。此外,El-Shafey等 [9]还从埃及生长的栽培菊苣茎叶中发现了木犀草素的存在。但目前鲜见关于栽培菊苣籽化学成分的研究报道。
黄酮提取物抗氧化活性的大小,在某种意义上决定了其在食品中的应用价值。目前,普遍采用通过测定提取物清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、O 2 -·、·OH活性等方式来评价黄酮提取物抗氧化活性的大小 [10-12],其中最为经典的当属DPPH自由基清除活性的测定。虽然这些方法仅通过测定吸光度就能够简便地得出提取物的总抗氧化活性,但却无法确定黄酮提取物中每一种化合物的抗氧化活性的大小。若要对黄酮提取物中活性单体进行筛选与评价,通常需先对提取物进行纯化、分离、成分鉴定后,才能够进行活性测定及评价 [13],而这样的方法不但过程繁琐,而且费时费力。随着色谱技术及检测手段的发展,利用高效液相色谱(high performance liquid chromatography,HPLC)结合自由基在线联用技术对复杂混合物中活性成分的识别,提供了可行性 [14-20]。此外,离线方式的HPLC法 [21-22]也可以实现从混合物识别抗氧化活性物质的目的,与在线的HPLC法相比,具有快捷、仪器简单的优势。
本实验采用超声-微波协同萃取技术 [23-24]结合响应面设计优化了栽培菊苣籽总黄酮提取工艺,利用标准品比对的HPLC法对栽培菊苣籽中黄酮类化合物的成分进行了鉴定,应用离线的HPLC-DPPH法,对栽培菊苣籽中黄酮类成分的抗氧化活性进行了研究,为栽培菊苣籽在食品工业中的利用提供了理论参考。
1.1 材料与试剂
栽培菊苣籽购自天津市蓟县,粉碎后过40 目筛备用。
AB-8大孔树脂 天津南开大学化工厂;芦丁标准品(分析纯) 北京化学试剂公司;绿原酸(色谱级)成都德天生物科技有限公司;洋蓟素(色谱级) 阿拉丁试剂公司;甲醇(色谱纯) 德国Merck公司;DPPH自由基 美国Sigma试剂公司;无水乙醇、石油醚(30~60 ℃) 天津市风船化学试剂科技有限公司;硝酸铝、亚硝酸钠 天津金汇太亚化学试剂有限公司;氢氧化钠、冰乙酸(分析纯) 天津市凯通试剂有限公司;超纯水,实验室自制。
1.2 仪器与设备
1200 Series HPLC仪(色谱柱Zorbax Eclipse Plus-C 18(250 mm×4.6 mm,5 μm)) 美国Agilent公司;CW-2000超声微波协同萃取仪 上海新拓分析仪器科技有限公司;Alpha-1500紫外-可见分光光度计 上海谱元仪器有限公司;FD-5冷冻干燥机 北京博医康实验仪器有限公司;FW100高速万能粉碎机 天津市泰斯特仪器有限公司;AUW120D十万分之一天平 日本岛津公司。
1.3 方法
1.3.1 标准曲线的制作
依据文献[25]的方法并作改进,于10 mL比色管中分别加入0.1 mg/mL的芦丁标准储备液0.0、1.0、2.0、3.0、4.0 mL和5.0 mL,用30%乙醇溶液定容至10 mL,摇匀静置片刻,在325 nm波长处测定其吸光度,以质量浓度(mg/mL)为横坐标,吸光度为纵坐标绘制出芦丁标准曲线。当芦丁质量浓度在0~0.05 mg/mL范围内时,其吸光度与质量浓度有着良好的线性关系,且芦丁质量浓度X与吸光度Y的线性回归方程为:Y=15.617X+ 0.001 6,相关系数R 2=0.999 7。
1.3.2 栽培菊苣籽总黄酮的超声-微波协同萃取
称取1.0 g栽培菊苣籽粉末,置于超声微波协同萃取仪的样品瓶中,以一定体积分数的乙醇溶液为溶剂,选择超声功率50 W(仪器固定),设置一定的微波功率、萃取温度、萃取时间,在超声-微波协同萃取仪中萃取。减压过滤冷却的提取液并将滤液用石油醚萃取3 次以除去脂溶性成分,弃除石油醚层,水定容至50 mL,作为栽培菊苣籽总黄酮提取液。
1.3.3 栽培菊苣籽总黄酮含量的测定
依据文献[25]的方法并适当改进,准确移取1.0 mL提取液,水稀释50 倍,以蒸馏水为空白对照,在波长325 nm处测定吸光度,根据芦丁标准曲线计算出总黄酮的质量浓度,按公式(1)计算总黄酮提取率:
式中:C为提取液由标准曲线计算出的总黄酮质量浓度/(mg/mL);V为提取液体积/mL;N为稀释倍数;m为称取的栽培菊苣籽粉末的质量/g。
1.3.4 栽培菊苣籽总黄酮提取工艺的响应面优化设计
参考天然植物总黄酮提取的相关研究 [23,25-27],选取液料比、乙醇体积分数、提取温度作为响应面设计的考察因素并选取较优水平范围,以栽培菊苣籽总黄酮在波长325 nm处的吸光度为响应值,按照Box-Behnken原理,用Design-Expert 8.0设计优化试验。其中,每个因素3 个水平,中心试验重复3 次,因素水平设计如表1所示。
表1 Box-Behnken试验因素与水平
Table 1 Factors and levels used in Box-Behnken design
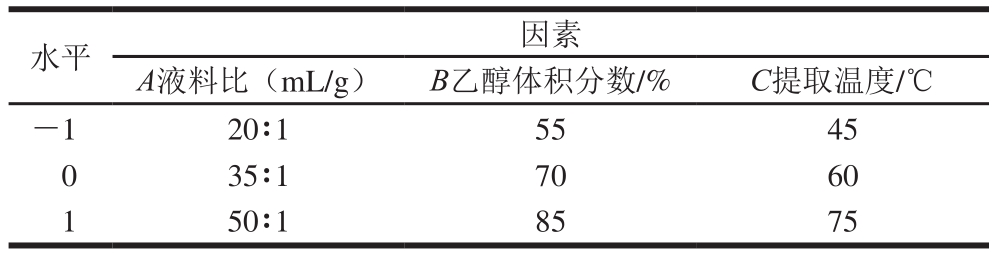
水平 因素A液料比(mL/g) B乙醇体积分数/% C提取温度/℃-1 20∶1 55 45 0 35∶1 70 60 1 50∶1 85 75
1.3.5 栽培菊苣籽总黄酮提纯条件的确定
1.3.5.1 大孔树脂的预处理
参考文献:[28]方法稍作修改。将新树脂用体积分数为95%的乙醇浸泡24 h,装柱,用蒸馏水洗至流出液无乙醇味。然后用5% HCl溶液浸泡3 h,装柱并用蒸馏水洗至流出液pH值呈中性;再用5% NaOH溶液浸泡3 h,装柱并用蒸馏水洗至流出液pH值呈中性。将处理好的大孔树脂浸泡在蒸馏水中,备用。
1.3.5.2 栽培菊苣籽粗黄酮样品溶液的制备
准确称取1.00 g菊苣籽粗黄酮粉末,用少量无水乙醇溶解,再用蒸馏水定容于1 L的容量瓶中,得到质量浓度为1.0 mg/mL的菊苣籽粗黄酮样品液,备用。
1.3.5.3 上样液pH值的确定
称取60 g处理后的AB-8大孔树脂,湿法装入玻璃柱中,将质量浓度为1.0 mg/mL,pH值分别为2、4、6的菊苣籽粗黄酮样品液以流速2 BV/h加入树脂柱,每8 mL收集一次黄酮流出液,并测定吸光度,以泄漏点出现最晚为宜(泄漏点即该处流出液的吸光度为样品液吸光度的1/10),研究大孔树脂对不同pH值条件下菊苣籽粗黄酮样品液吸附量的影响。
1.3.5.4 洗脱液乙醇体积分数的确定
将质量浓度为1.0 mg/mL的样品液调pH值为4,以2 BV/h的流速上样,然后以2 BV/h的流速分别用体积分数60%、70%、80%的乙醇溶液进行洗脱,收集不同体积分数乙醇溶液洗脱下来的菊苣籽黄酮流出液,并扫描各洗脱液在200~700 nm波长范围内的吸收曲线。
1.3.5.5 HPLC检测AB-8大孔树脂对菊苣籽总黄酮的纯化效果
将菊苣籽粗黄酮提取液和经AB-8大孔树脂纯化后的样品液用旋转蒸发器减压浓缩并冷冻干燥成粉末后,分别用色谱级甲醇溶解,配制成质量浓度为1.0 mg/mL的溶液,各取100 µL,用30%的甲醇溶液稀释5 倍,进行HPLC分析。色谱条件:流动相:甲醇(A)、超纯水(B)和1%乙酸溶液(C);流速:0.8 mL/min;进样量:15 μL;梯度洗脱条件:0~25 min,30%~80% A,1%乙酸溶液(C)始终保持10%;检测波长:325 nm;柱温:30 ℃。
1.3.6 鉴定栽培菊苣籽总黄酮的成分
准确称取0.005 00 g经大孔树脂纯化后的栽培菊苣籽总黄酮冻干粉末,用甲醇溶解并配成1.0 mg/mL的样品储备液。另外,准确称取绿原酸和洋蓟素(1,3-二咖啡酰基奎宁酸)标准品各0.010 00 g,用50 mL甲醇溶解于50 mL棕色容量瓶中,即得200 µg/mL的标准品储备液。
取样品储备液及标准品储备液各100 μL,均用30%甲醇稀释5倍,过0.45 µm有机膜,进HPLC分析。色谱条件:流动相:甲醇(A)、超纯水(B)和1%乙酸溶液(C);流速:0.8 mL/min;进样量:10 μL;洗脱条件:0~25 min,30%~80% A,1%乙酸溶液(C)始终保持10%;检测波长:325 nm;柱温:30 ℃。
1.3.7 DPPH-HPLC法筛选栽培菊苣籽总黄酮的抗氧化活性成分
准确称取0.400 0 g DPPH于烧杯中,用甲醇溶解并转移至100 mL棕色容量瓶中定容,即得4.0 mg/mL的DPPH自由基储备液,放置于4 ℃冰箱中保存,用时再稀释。
实验组为1.0 mL栽培菊苣籽总黄酮溶液和等体积200 µg/mL DPPH自由基溶液,室温条件下避光反应30 min,过0.45 µm有机滤膜,进行HPLC分析。另外,以甲醇代替DPPH自由基溶液作为对照组,进行HPLC分析(色谱条件见1.3.6节)。以各成分峰面积变化来表征其对DPPH自由基的清除活性(清除率)强弱。
2.1 响应面设计优化栽培菊苣籽总黄酮的提取
在黄酮的提取过程中,液料比、乙醇体积分数、提取温度是影响有效成分得率的3 个最主要因素,而微波温度、微波功率及提取时间三者之间是协同的。本研究利用超声-微波协同萃取的方式来提取黄酮,是利用超声波对物质分子的机械振动及空化作用,加速物料细胞的破坏,以提高有效成分的溶出速度,且仪器固定的超声功率为50 W,即超声波所起的作用相当于对物料与溶液进行搅拌,影响栽培菊苣籽有效成分的提取效率。超声振动结合微波对物料细胞的高穿透能力,设定的微波功率越大,达到所需温度的时间越短。同时,当仪器达到设定温度后,仪器会自动根据设定温度调整微波功率以维持设定温度。因此,在下一步利用响应面进行分析时,设定仪器固定超声功率50 W、微波功率400 W、提取时间6 min,按照Box-Behnken试验设计原理,选择液料比、乙醇体积分数、提取温度3 个最主要因素进行组合试验,其结果见表2。
表2 响应面试验方案及结果
Table 2 Response surface design with experimental results

试验号 A液料比 B乙醇体积分数 C提取温度 Y吸光度1 -1 1 0 0.492 2 0 0 0 0.568 3 -1 1 0.469 4 0 -1 -1 0.386 0 5 0.496 6 1 -1 0 0.474 0 1 1 7 0.566 8 0 0 0 0.584 1 0 1 -1 0.426 10 -1 -1 0 0.354 11 0 0 0 0.565 12 -1 0 1 0.386 13 1 1 0 0.468 14 1 0 -1 0.394 15 -1 0 -1 0.351 16 0 0 0 0.569 17 0 0 0 0.563 9 0 1
2.2 回归方程的建立及方差分析
用Design-Expert 8.0对表2中的数据进行回归分析。对结果进行拟合,得到以吸光度Y为响应值,以因素液料比A、乙醇体积分数B、提取温度C为自变量的回归方程为:Y=0.57+0.040A+0.025B+0.045C-0.036AB+ 0.034AC-3.250×10 -3BC-0.073A 2-0.053B 2-0.075C 2,回归模型的方差分析见表3。
表3 回归模型的方差分析
Table 3 Analysis of variance (ANOVA) for the regression model

注:*.显著(P<0.05);**.极显著(P<0.01)。
方差来源 平方和 自由度 均方 F值 P值 显著性回归模型 0.088 9 9.779×10 -3 15.68 0.003 7 ** A液料比 0.013 1 0.013 20.40 0.006 3 ** B乙醇体积分数 4.950×10 -3 1 4.950×10 -3 7.94 0.037 2 * C提取温度 0.016 1 0.016 25.98 0.003 8 ** AB 5.184×10 -3 1 5.184×10 -3 8.31 0.034 4 * AC 4.692×10 -3 1 4.692×10 -3 7.53 0.040 6 * BC 4.225×10 -5 1 4.225×10 -5 0.068 0.805 0 不显著A 2 0.019 1 0.019 31.27 0.002 5 ** B 2 0.010 1 0.010 16.43 0.009 8 ** C 2 0.021 1 0.021 33.68 0.002 1 **残差 3.117×10 -3 5 6.235×10 -4失拟项 2.909×10 -3 3 9.696×10 -4 9.29 0.098 7 不显著纯误差 2.087×10 -4 2 1.043×10 -4总误差 0.091 14 R 2=0.965 8 R 2 Adj=0.904 2
对表3中的数据进行分析可以看出,整个回归模型极显著(P<0.01),R 2=0.965 8,失拟性检验不显著(P=0.098 7>0.05),说明该模型的拟合性较好,用于栽培菊苣籽总黄酮提取的试验预测是可靠的。一次项、二次项及交互项AB、AC对响应值吸光度的影响均显著,交互项BC影响不显著,即方程拟合较好。各因素对吸光度值影响的顺序为:提取温度>液料比>乙醇体积分数。
2.3 响应面分析
响应曲面图是响应值(吸光度Y)对各个试验因素A、B、C所构成的三维空间曲面图形,从响应面图中可以直观地看出各个试验因素及两两因素之间的交互作用对响应值的影响。根据所得回归方程,以波长325 nm处的吸光度Y作为响应值,液料比、乙醇体积分数、提取温度作为0水平,绘制出三维响应曲面图及相应等高线,如图1所示。

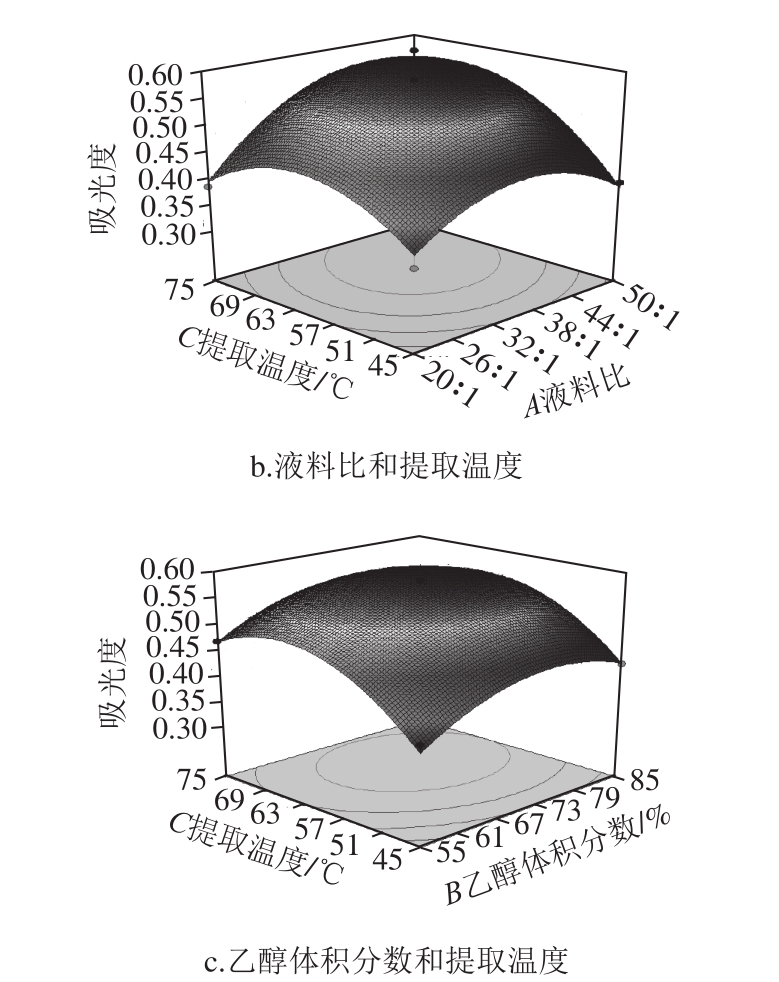
图1 各因素交互作用对吸光度影响的响应曲面图和等高线图
Fig. 1 Response surface and contour plots showing the interactive effects of various factors on absorbance
由图1a可以看出,液料比和乙醇体积分数对吸光度的交互影响显著。随着溶剂用量的增大,吸光度增大,当液料比达到40∶1附近时,吸光度达到最大。液料比在栽培菊苣籽总黄酮提取过程中起着重要作用。溶剂用量的多少会影响到有效成分的溶出以及后续分离纯化的效果与效率。当液料比达到某一定比例后,响应值增加趋于平稳,此时,目标物质已达到最大程度的溶出,再增加溶剂用量会溶出更多的杂质,为后续纯化带来一定的困难。所以,要综合考虑总黄酮提取率及成本等因素来确定合适的液料比。
随着乙醇体积分数的增大,吸光度不断增大,当乙醇体积分数达到70%左右时,吸光度达到最大。极性较弱的黄酮类物质需要在较高体积分数的乙醇中才能被溶出,当乙醇体积分数较低时,溶液的极性较大,会溶出一些非目标物质。所以,提取天然植物中富含的黄酮类物质需要选择合适的乙醇体积分数。
由图1b可以看出,提取温度在65 ℃附近时,吸光度达到最大。此后,若再升高温度,吸光度会有所下降,所以,合适的提取温度对总黄酮的提取率有着重要作用。同理,液料比在38∶1附近时,吸光度达到峰值。从两者的交互作用等高线中可以看出,等高线沿着液料比轴向的密集程度与沿着提取温度轴向的变化相当,说明液料比和提取温度对吸光度的影响程度相当。
由图1c可以看出,乙醇体积分数与提取温度的交互作用等高线中,在吸光度为最大处的提取温度及乙醇体积分数附近,等高线沿着提取温度轴向变化比沿着乙醇体积分数轴向变化更密集,说明提取温度对响应值的影响比乙醇体积分数大。
2.4 总黄酮优化提取工艺的验证结果
在微波功率400 W、超声功率50 W和提取时间6 min的条件下,在选取的其他三因素的范围内,响应面分析优化出栽培菊苣籽总黄酮提取的最佳工艺条件为:液料比40∶1、乙醇体积分数为71.65%、提取温度65.5 ℃。该模型在这种条件下,吸光度的预测值为0.588,总黄酮提取得率为93.8 mg/g。但考虑到试验实际操作的可行性,将栽培菊苣籽总黄酮提取的最佳工艺修正为:液料比40∶1、乙醇体积分数71%、提取温度65 ℃。对修正的最佳工艺做验证实验,重复做3 次,吸光度平均值为0.584,总黄酮提取得率为93.23 mg/g,说明实际值与预测值接近。由此可见,超声-微波协同提取菊苣籽总黄酮的时间大大缩短,由文献[29]中报道的回流提取新疆药用菊苣籽总黄酮所需的2 h缩短至6 min,提取效率有了很大的提高。这说明用该优化条件提取栽培菊苣籽总黄酮是可靠的。
2.5 栽培菊苣籽总黄酮的提纯
2.5.1 菊苣籽黄酮样品液pH值对大孔树脂吸附量的影响
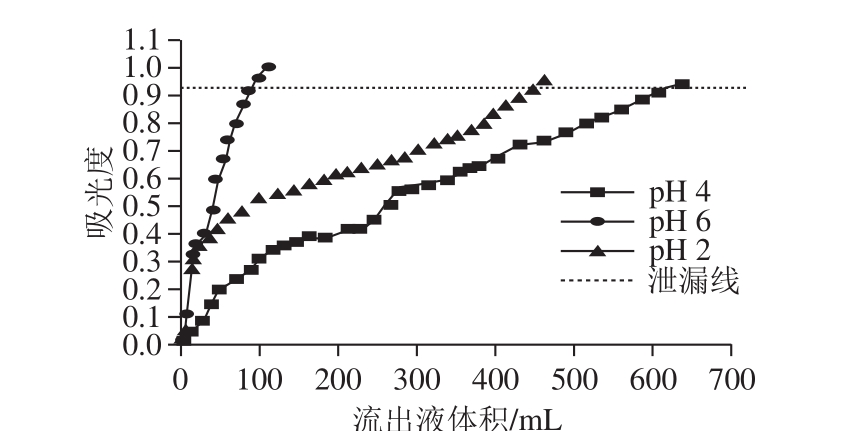
图2 样品液pH值对AB-8大孔树脂吸附效果的影响
Fig. 2 Effect of sample pH on the adsorption efficiency of AB-8 resin
由图2可以看出,AB-8大孔树脂对pH值为4的菊苣籽总黄酮样品液吸附能力最强;当样品液pH值为6时,吸附效果最差;当样品液pH值为2时,大孔树脂对菊苣籽总黄酮的吸附效果稍次于pH值为4时的吸附效果。这可以从黄酮类化合物的结构方面进行分析,黄酮类化合物因其结构中带有酚羟基而呈一定的酸性,且酸性强弱与酚羟基的数目和位置有关 [30]。样品液在pH值为4的弱酸性条件下,黄酮类化合物会以分子形式存在而易于被大孔树脂吸附。因此,样品液pH值为4时,大孔树脂对菊苣籽总黄酮的吸附效果最佳。
2.5.2 乙醇体积分数对栽培菊苣籽总黄酮洗脱的影响
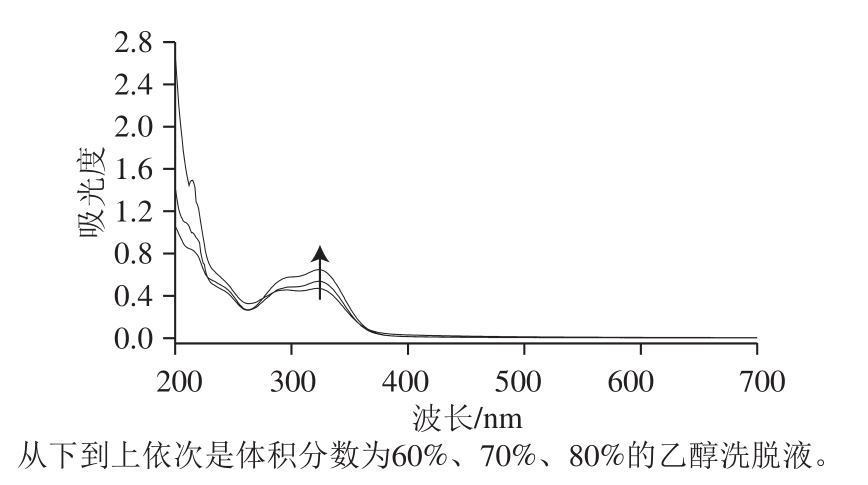
图3 不同体积分数乙醇洗脱液的紫外吸收吸收曲线
Fig. 3 UV adsorption spectra of ethanol eluates at different concentrations
从图3可以看出,乙醇体积分数为80%时,解吸下的黄酮最多,但是在210~225 nm波长范围内80%的乙醇溶液洗脱下来的物质含有一定的杂质,而且紫外吸收峰的形态发生了变化。当乙醇体积分数为60%时,洗脱下的有效成分较少。所以,选择乙醇体积分数为70%对菊苣籽总黄酮进行洗脱。
2.5.3 纯化效果的检测结果
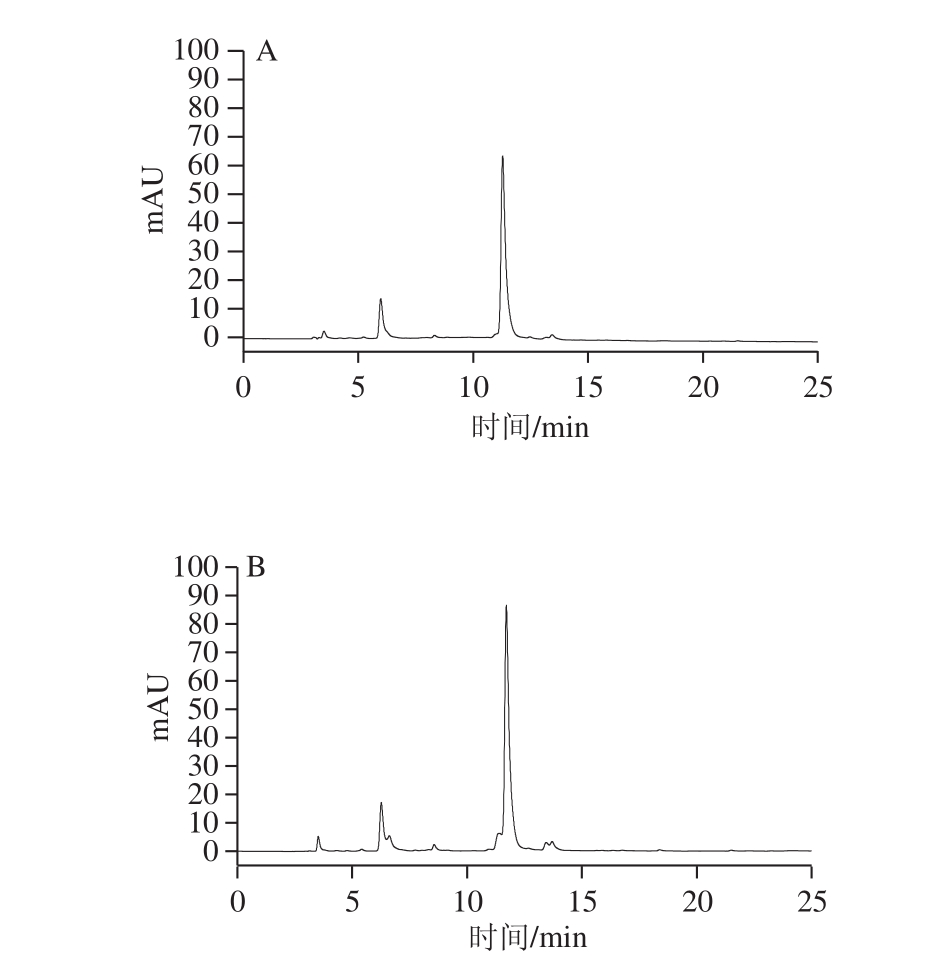
图4 AB-8大孔树脂纯化前(A)和纯化后(B)菊苣籽总黄酮在325 nm波长处HPLC图
Fig. 4 HPLC profiles of crude and purified total flavonoids from Cichorium endivia L. seeds monitored at 325 nm
图4为经AB-8大孔树脂纯化前后的菊苣籽总黄酮样品液在325 nm波长处的色谱图。可以看出,栽培菊苣籽总黄酮经AB-8大孔树脂纯化后的响应值比同浓度下纯化前的有明显增大。在8.5、11.5 min处,经大孔树脂纯化后的物质的响应值明显升高;在13.5 min处,纯化前的物质只是一个小山包状的峰,而纯化后变成两个较明显分开的峰。由此可知,AB-8大孔树脂对菊苣籽黄酮类化合物能起到较好的纯化作用。
在选定的纯化条件下,经AB-8大孔树脂纯化后栽培菊苣籽总黄酮的纯度由纯化前的21.5%增加到49.5%,纯度提升了2.3 倍,即大孔树脂纯化菊苣籽总黄酮的效果较好。
2.6 栽培菊苣籽总黄酮中主要成分的鉴定
从图5可以看出,栽培菊苣籽总黄酮主要是由2 个化合物构成的(含量>95%),这2 个化合物的保留时间分别为6.5 min(峰1)和12.1 min(峰2)。二者与绿原酸和洋蓟素标准品HPLC图比对,出峰时间吻合。说明栽培菊苣籽中的主要黄酮成分是绿原酸和洋蓟素。
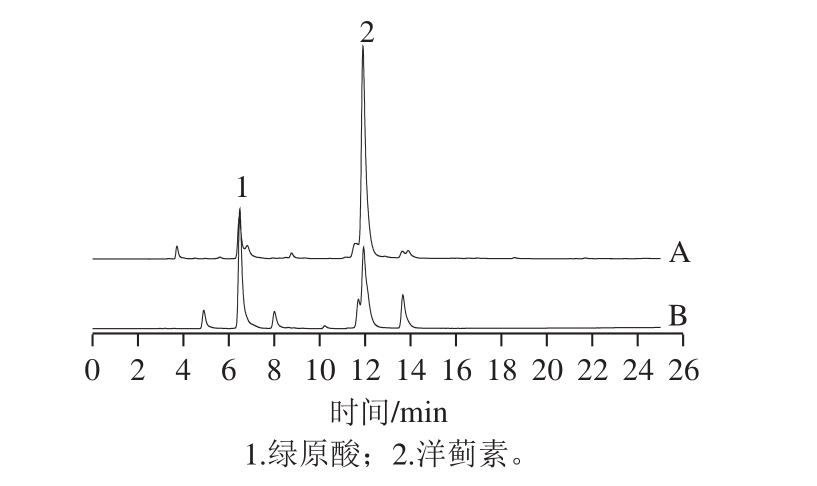
图5 栽培菊苣籽总黄酮样品(A)和混合标准品(B)的HPLC图
Fig. 5 HPLC chromatograms of total flavonoids from Cichorium endivia L. seeds (A) and mixed standards (B)
2.7 栽培菊苣籽总黄酮中抗氧化活性成分的筛选
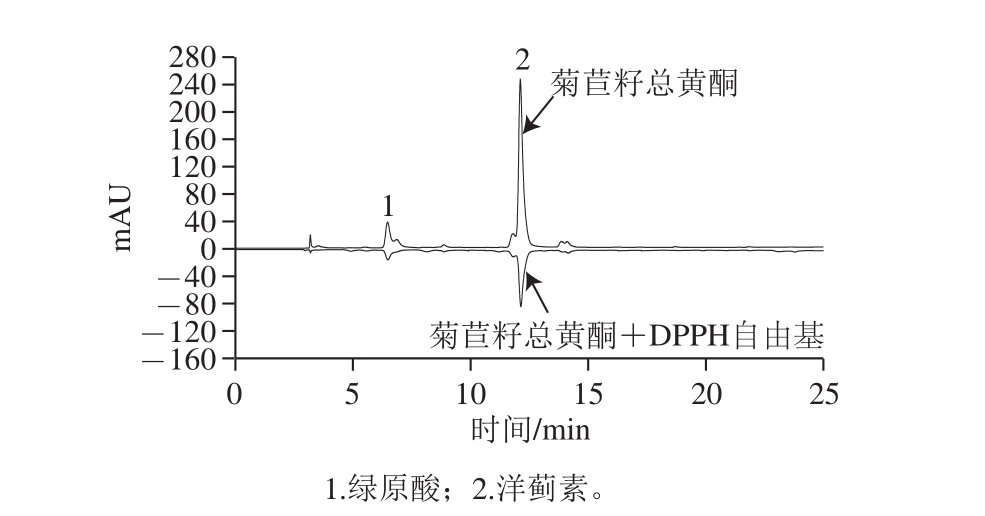
图6 栽培菊苣籽总黄酮清除DPPH自由基的HPLC图
Fig. 6 HPLC chromatogram displaying DPPH free radical scavenging capacity of total flavonoids from Cichorium endivia L. seeds
表4 栽培菊苣籽总黄酮对DPPH自由基的清除活性
Table 4 DPPH free radical scavenging activities of two main flavonoids from Cichorium endivia L. seeds

峰号 化合物 A 0 A 1 清除率/% 1绿原酸 755.7 289.8 61.65 2洋蓟素 3 649.0 1 309.7 64.11
从图6和表4可看出,栽培菊苣籽中的绿原酸和洋蓟素两个黄酮成分对DPPH自由基均具有较好的清除活性,且洋蓟素对DPPH自由基的清除能力略大。从化合物的结构上看,二者均为咖啡酰基奎宁酸的异构体,只是洋蓟素在结构上比绿原酸多了一分子咖啡酰基,使得它的酚羟基比绿原酸多,这可能是洋蓟素清除DPPH自由基的活性强于绿原酸的原因,这与乔丽萍等 [31]综述的结果是一致的。
本研究利用响应面法优化,得到栽培菊苣籽总黄酮的超声-微波协同萃取工艺条件为:液料比40∶1、乙醇体积分数71%、提取温度65 ℃、微波功率400 W、超声功率50 W、提取时间6 min。通过动态纯化的方式确定了AB-8大孔树脂纯化菊苣籽总黄酮的条件:上样液pH 4、上样液和洗脱液流速2 BV/h、洗脱液乙醇体积分数70%。利用HPLC法,通过将样品与标准品HPLC图的出峰保留时间进行比对,初步鉴定出了栽培菊苣籽黄酮中的两种主要成分洋蓟素和绿原酸。并利用离线DPPH-HPLC法评价了两种成分清除DPPH自由基的能力,研究结果表明,栽培菊苣籽黄酮的两种主要成分中洋蓟素对DPPH自由基的清除能力略大。所优化提出的方法可简单、快速地评价黄酮类化合物对DPPH自由基清除活性和抗氧化活性的强弱,为实现复杂混合物中抗氧化活性成分的快速筛选提供了可行性。
参考文献:
[1] 中国在线植物志. http://www. eflora.cn/sp/栽培菊苣[EB/OL].
[2] MASCHERPA D, CARAZZONE C, MARRUBINI G, et al. Identification of phenolic constituents in Cichorium endivia var. crispum and var. latifolium salads by high-performance liquid chromatography with diode array detection and electrospray ioniziation tandem mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2012, 60(49): 12142-12150. DOI:10.1021/jf3034754.
[3] DUPONT M S, MONDIN Z, WILLAMSON G, et al. Effect of variety, processing, and storage on the flavonoid glycoside content and composition of lettuce and endive[J]. Journal of Agricultural and Food Chemistry, 2000, 48(9): 3957-3964. DOI:10.1021/jf0002387.
[4] KANG H W. Antioxidative activity of extracts from Cichorium endivia L.[J]. Journal of the Korean Society of Food Science and Nutrition,2012, 41(11): 1487-1492. DOI:10.3746/jkfn.2012.41.11.1487.
[5] 陈超杰, 秦海林, 邓安珺, 等. 苦菊提取物的抗氧化活性研究[J].食品与药品, 2011, 13(3): 93-96. DOI:10.3969/j.issn.1672-979X.2011.02.005.
[6] 陈超杰, 展丽娟, 魏金锋, 等. 苦菊提取物对HepG2细胞的抗氧化作用及其机制研究[J]. 中国中药杂志, 2014, 39(14): 2716-2720.
DOI:10.4268/cjcmm20141424.
[7] 陈超杰, 李万芳, 秦海林, 等. 苦菊乙酸乙酯提取物的体外抗氧化活性研究[J]. 中国药房, 2011, 22(15): 1347-1350.
[8] HEGAZY A K, EZZAT S M, QASEM I B, et al. Diversity of active constituents in Cichorium endivia and Cynara cornigera extracts[J]. Acta Biologica Hungarica, 2015, 66(1): 103-118. DOI:10.1556/ ABiol.66.2015.1.9.
[9] El-SHAFEY N M, ABDELGAWAD H. Luteolin, a bioactive flavone compound extracted from Cichorium endivia L. subsp. divaricatum alleviates the harmful effect of salinity on maize[J]. Acta Physiologiae Plantarum, 2012, 34(6): 2165-2177. DOI:10.1007/s11738-012-1017-8.
[10] YANG L C, LI R, TAN J, et al. Polyphenolics composition of the leaves of Zanthoxylum bungeanum Maxim. grown in Hebei, China,and their radical scavenging activities[J]. Journal Agricultural and Food Chemistry, 2013, 61(8): 1772-1778. DOI:10.1021/jf3042825.
[11] WU P P, MA G Z, LI N H, et al. Investigation of in vitro and in vivo antioxidant activities of flavonoids rich extract from the berries of Rhodomyrtus tomentosa(Ait.) Hassk.[J]. Food Chemistry, 2015, 173: 194-202. DOI:10.1016/j.foodchem.2014.10.023.
[12] HU YJ, DENG L Q, CHEN J W, et al. An analytical pipeline to compare and characterise the anthocyanin antioxidant activities of purple sweet potato cultivars[J]. Food Chemistry, 2016, 194: 46-54.
DOI:10.1016/j.foodchem.2015.07.133.
[13] 杨华, 韩坤, 苑晓春, 等. 野葛异黄酮糖苷的分离纯化及体外清除自由基活性的研究[J]. 安徽农业大学学报, 2011, 38(2): 151-155.
DOI:10.13610/j.cnki.1672-352x.2011.02.017.
[14] ZHANG H, XI W P, YANG Y F, et al. An on-line HPLC-FRSD system for rapid evaluation of the total antioxidant capacity of Citrus fruits[J]. Food Chemistry, 2015, 172: 622-629. DOI:10.1016/ j.foodchem.2014.09.121.
[15] XIN X Y, FAN R, GONG Y, et al. On-line HPLC-ABTS +· evaluation and HPLC-MS nidentification of bioactive compounds in hot pepper peel residues[J]. European Food Research and Technology, 2014,238(5): 837-844. DOI:10.1007/s00217-014-2153-8.
[16] NUENGCHAMNONG N, INGKANINAN K. On-line HPLC-MSDPPH assay for the analysis of phenolic antioxidant compounds in fruit wine: Antidesma thwaitesianum Muell.[J]. Food Chemistry, 2010,118(1): 147-152. DOI:10.1016/j.foodchem.2009.04.069.
[17] FAN R, LI N, JIANG X X, et al. HPLC-DAD-MS/MS identification and HPLC-ABTS +· on-line antioxidant activity evaluation of bioactive compounds in liquorice (Glycyrrhiza uralensis Fisch.) extract[J]. European Food Research and Technology, 2015, 240(5): 1035-1048.
DOI:10.1007/s00217-014-2407-5.
[18] DING X P, WANG X T, CHEN L L, et al. On-line high-performance liquid chromatography-diode array detection-electrospray ionizationmass spectrometry-chemiluminescence assay of radical scavengers in Epimedium[J]. Journal of Chromatography A, 2011, 1218(9): 1227-1235. DOI:10.1016/j.chroma.2011.01.001.
[19] 邢航, 张媛婷, 鲁雪峰, 等. 高效液相色谱-二苯基三硝基苯肼在线检测葡萄酒中抗氧化活性成分[J]. 中国实验方剂学杂志, 2013,19(21): 127-131. DOI:10.11653/syfj2013150127.
[20] GENG D D, CHI X F, DONG Q, et al. Antioxidants screening in Limonium aureum by optimized on-line HPLC-DPPH assay[J]. Industrial Crops and Products, 2015, 67: 492-497. DOI:10.1016/ j.indcrop.2015.01.063.
[21] 赵恒强, 陈军辉, 耿岩玲, 等. 基于DPPH-HPLC技术的马粪海胆抗氧化活性指纹图谱初步研究[J]. 山东科学, 2014, 27(3): 7-11.
DOI:10.3976/j.issn.1002-4026.2014.03.002.
[22] 周艳林, 闵建国, 邹准, 等. HPLC-DPPH评价剑叶龙血树中抗氧化活性成分及构效关系[J]. 中草药, 2015, 46(12): 1797-1799.
DOI:10.7501/j.issn.0253-2670.2015.12.016.
[23] CHENG X L, WAN J Y, LI P, et al. Ultrasonic/microwave assisted extraction and diagnostic ion filtering strategy by liquid chromatography-quadrupole time-of-flight mass spectrometry for rapid characterization of flavonoids in Spatholobus suberectus[J]. Journal of Chromatography A, 2011, 1218(34): 5774-5786. DOI:10.1016/ j.chroma.2011.06.091.
[24] LIU Z Z, GU H Y, YANG L. An approach of ionic liquids/lithium salts based microwave irradiation pretreatment followed by ultrasoundmicrowave synergistic extraction for two coumarins preparation from Cortex fraxini[J]. Journal of Chromatography A, 2015, 1417: 8-20.
DOI:10.1016/j.chroma.2015.09.037.
[25] 刘韬, 李荣, 张禄捷, 等. 八角茴香叶中黄酮的微波提取及纯化[J].食品科学, 2015, 36(2): 30-35. DOI:10.7506/spkx1002-6630-201502006.
[26] CUI Q, PENG X, YAO X H, et al. Deep eutectic solvent-based microwave-assisted extraction of genistin, genistein and apigenin from pigeon pea roots[J]. Separation and Purification Technology, 2015,150: 63-72. DOI:10.1016/j.seppur.2015.06.026.
[27] SHAO P, ZHANG J F, CHEN X X, et al. Microwave-assisted extraction and purification of chlorogenic acid from by-products of Eucommia ulmoides oliver and its potential anti-tumor activity[J]. Journal of Food Science and Technology, 2015, 52(8): 4925-4934.
DOI:10.1007/s13197-014-1571-8.
[28] 赵明慧, 姜子涛, 李荣. 榛子叶中黄酮类化合物微波提取及纯化的研究[J]. 食品工业科技, 2013, 34(19): 196-200. DOI:10.13386/ j.issn1002-0306.2013.19.046.
[29] 毛琼玲, 艾来提·苏里坦, 夏热帕提·吐孙, 等. 新疆菊苣籽中总黄酮提取工艺研究[J]. 生物技术, 2009, 19(3): 78-80.
[30] CHO Y J, HWANG J K. Modeling the yield and intrinsic viscosity of pectin in acidic solubilization of apple pomace[J]. Journal of Food Engineering, 2000, 44(2): 85-89. DOI:10.1016/S0260-8774(99)00169-7.
[31] 乔丽萍, 傅瑜, 叶兴乾, 等. 酚酸生物活性研究进展[J]. 中国食品学报, 2013, 13(10): 144-152.
Extraction, Identification and Screening for Antioxidant Activity of Total Flavonoids from Cichorium endivia L. Seeds
ZHAO Yue, LI Rong, JIANG Zitao*
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science,Tianjin University of Commerce, Tianjin 300134, China)
Abstract:The ultrasonic-microwave synergistic extraction of total flavonoids from Cichorium endivia L. seeds was optimized by response surface methodology. The optimum conditions were determined as follows: ratio of liquid to solid,40:1(mL/g); ethanol concentration, 71%; extraction temperature, 65 ℃; microwave power, 400 W; ultrasonic power,50 W; and extraction time, 6 min. Under these extraction conditions, the content of total flavonoids in C. endivia seeds was 93.23 mg/g. The optimum dynamic adsorption and desorption conditions for purification of the crude extract obtained with AB-8 macroporous resin were established as follows: sample pH, 4; sample flow rate, 2 BV/h; and 70% alcohol as eluant at a flow rate of 2 BV/h. HPLC analysis results showed that total flavonoids from C. endivia seeds were mainly composed of chlorogenic acid and cynarin. Off-line DPPH-HPLC assays showed that antioxidant activity of cynarin was stronger than that of chlorogenic acid, which could scavenge 64.11% and 61.65% DPPH free radical, respectively.
Key words:Cichorium endivia L. seeds; flavonoids; response surface methodology; DPPH; cynarin; recognition
DOI:10.7506/spkx1002-6630-201616006
中图分类号:
文献标志码:A
文章编号:1002-6630(2016)16-0036-07
引文格式:
赵月, 李荣, 姜子涛. 栽培菊苣籽总黄酮的提取、成分鉴定及抗氧化活性成分的识别[J]. 食品科学, 2016, 37(16): 36-42.
DOI:10.7506/spkx1002-6630-201616006. http://www.spkx.net.cn
ZHAO Yue, LI Rong, JIANG Zitao. Extraction, identification and screening for antioxidant activity of total flavonoids from Cichorium endivia L. seeds[J]. Food Science, 2016, 37(16): 36-42. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201616006. http://www.spkx.net.cn
收稿日期:2015-11-17
基金项目:天津市自然科学基金重点项目(12JCZDJC34100);天津市高等学校创新团队培养计划项目(TD12-5049)
作者简介:赵月(1989—),女,硕士研究生,研究方向为食品添加剂。E-mail:1187649318@qq.com
*通信作者:姜子涛(1956—),男,教授,博士,研究方向为食品添加剂。E-mail:ztjiang@tjcu.edu.cn