王 警,吴妮妮,黄 静,韦毅铭,杨艳芳,李雪华*,罗海鲜,覃安妮,甘日植
(广西医科大学药学院,广西 南宁 530021)
摘 要:对龙眼肉多糖进行乙酰化修饰最佳工艺研究,采用乙酸酐法制备乙酰化龙眼肉多糖,以取代度为指标,采用响应面法对工艺条件进行优化,并研究乙酰化龙眼肉多糖的体外抗氧化活性。结果显示,龙眼肉多糖的最佳乙酰化条件为:乙酸酐-多糖物质的量比(投料比)10.2∶1、反应温度42 ℃、反应时间30 min。该工艺条件下龙眼肉多糖乙酰化取代度达到0.443。乙酰化龙眼肉多糖能够清除羟自由基、抑制脂质过氧化以及H 2O 2诱导的红细胞溶血,半数抑制浓度(IC 50)分别为702.41、646.04 μg/mL和380.11 μg/mL,表现出比未修饰龙眼肉多糖更强的抗氧化活性。
关键词:龙眼肉多糖;乙酰化;取代度;响应面法;抗氧化活性
龙眼(Dimocarpus longan Lour.)俗称“桂圆”,系无患子科龙眼属植物,始载于《神农本草经》,为我国南方地区的重要经济作物之一。龙眼肉具有补心益脾、养血安神、强魄健体、润肤美容的功效,主要用于心血不足、心悸怔忡、失眠多梦、贫血、健忘、神经衰弱、身体虚弱等症的治疗。现代研究表明,龙眼肉多糖是龙眼肉中主要的活性成分之一,具有抗氧化活性、免疫调节和改善记忆力的作用 [1-3]。龙眼肉多糖不仅具有广泛的生物活性,并且毒副作用极小,已成为医药领域的研究热点。目前研究了龙眼肉多糖在分离、纯化、药品和保健品等方面的应用,而对其进行结构修饰以及修饰后的活性研究鲜有报道。
多糖的生物活性与其化学结构密切相关,尤其经过结构修饰后,多糖的一级结构发生了改变,大分子的舒展性得到改善,释放出更多的极性基团,如羟基、羧基等,使其空间结构随之发生了改变,并在构象上发生变化,同时伴随着其物理化学性质、生物、药理活性的改变 [4-7],因此对多糖进行结构修饰已经成为多糖构效关系研究的重要手段之一。多糖分子修饰的方法主要包括物理法、化学法及生物法等,利用化学的方法对多糖的分子结构进行修饰主要包括硫酸化、磷酸化、乙酰化、羧甲基化、烷基化和磺酰化等修饰方法 [8-10];本研究前期已对龙眼肉多糖进行硫酸酯化、磷酸酯化以及降解制备不同分子质量片段的修饰,发现龙眼肉多糖经上述结构修饰后在抗氧化、抗肿瘤以及免疫活性方面均得到了极大改善 [11-14]。
乙酰化修饰是在多糖的支链上加入乙酰基,使多糖的支链充分展开,暴露出更多糖内固有的糖羟基或羧基,从而改善了其水溶性,更利于活性的发挥 [15-18]。基于此,本研究在前期对龙眼肉多糖分离、提取、纯化及结构解析的研究基础之上,利用响应面分析法对龙眼肉多糖乙酰化合成条件进行优化,采用Design-Expert 8.05软件进行试验设计和统计分析,确定最佳工艺,并研究龙眼肉多糖乙酰化前后的体外抗氧化活性,为开发龙眼肉药用与保健深加工产品提供一定的理论依据。
1.1 材料、试剂与实验动物
龙眼干果购自广西南宁交易市场,经广西中医药研究所严克俭检验员鉴定为石硖龙眼(Dimocarpus longan Lour.);乙酸酐、盐酸羟胺、三氯化铁、氢氧化钠、无水乙醇、30%过氧化氢、木瓜蛋白酶、葡萄糖、苯酚、浓硫酸、盐酸、β-D-五乙酰葡萄糖标准品、硫酸亚铁、水杨酸、铁氰化钾、三氯乙酸、硫代巴比妥酸、VC等试剂均为国产分析纯。
SPF级昆明小鼠,体质量(20±2)g,周龄6~8周,均由广西医科大学实验动物中心提供(实验动物使用许可证号:SYXK桂2014-0001;实验动物生产许可证号:SCXK桂2014-0002)。
1.2 仪器与设备
Lambda650型紫外-可见光分光光度计、Spectrum100型傅里叶变换红外光谱仪 美国PerkinElmer仪器有限公司;HH-6型数显恒温水浴锅 国华电器有限公司;TDL-5A型低速台式离心机 上海菲恰尔分析仪器有限公司;AL204型电子天平 梅特勒-托利多公司;FD-1D-50型真空冷冻干燥机 北京博医康实验仪器有限公司;G1362A型高效液相色谱仪 美国Agilent公司。
1.3 方法
1.3.1 龙眼肉多糖的制备
龙眼干果剥壳去核后,称取1.5 kg龙眼肉于4 倍质量水中,控制水浴温度为90 ℃,每次提取4 h,提取次数3次。滤液浓缩后醇沉,干燥得龙眼肉粗多糖。龙眼肉粗多糖经酶法脱蛋白、过氧化氢脱色,再经透析处理后冻干得到龙眼肉精制多糖。采用纤维素DE-52层析柱(2.5 cm×80 cm)分级纯化龙眼肉精制多糖,依次用水、0.125 mol/L NaCl溶液、0.30 mol/L NaOH溶液进行洗脱,选取NaCl流分,采用Sephacryl S-300 HR柱(2.0 cm×40 cm)进行进一步分离,用水洗脱,收集最大富集峰浓缩后冷冻干燥,即得主要成分龙眼肉多糖。
1.3.2 龙眼肉多糖的乙酰化修饰
准确称取龙眼肉多糖样品0.250 0 g置于三角锥瓶中,加入10 mL超纯水,超声助溶。用氢氧化钠调节溶液pH 9.0。在一定温度条件下交替加入氢氧化钠溶液和乙酸酐,使反应体系的pH值始终保持在8.0~10.0范围内,直至乙酸酐加完,搅拌反应一段时间后用盐酸溶液调至中性,将反应液置于截留相对分子质量为3 500的透析袋中透析48 h,透析液经浓缩、醇沉和冷冻干燥后即得乙酰化龙眼肉多糖 [19]。
1.3.3 龙眼肉多糖的乙酰化鉴定
采用苯酚-硫酸法测定龙眼肉多糖和乙酰化龙眼肉多糖的多糖含量 [20];使用傅里叶变换红外光谱仪对乙酰化龙眼肉多糖和龙眼肉多糖进行结构鉴定 [21],高效凝胶渗透色谱法测定乙酰化龙眼肉多糖和龙眼肉多糖的相对分子质量 [22]。
1.3.4 乙酰化取代度的测定
采用羟胺比色法 [23]测定乙酰化取代度,计算如式(1)所示:
式中:ω为乙酰化龙眼肉多糖中乙酰基的百分含量/%;43为乙酰基相对分子质量。
1.3.5 龙眼肉多糖乙酰化工艺优化
本研究按照Box-Behnken设计原理,在单因素试验的基础之上,以乙酰化取代度为响应值,选取反应时间、反应温度和投料比(乙酸酐-多糖物质的量比)3 个单因素进行响应面试验,优化龙眼肉多糖乙酰化的工艺条件。因素与水平设计如表1所示。
表1 响应面试验因素与水平
Table 1 Factors and levels used for Box-Behnken design
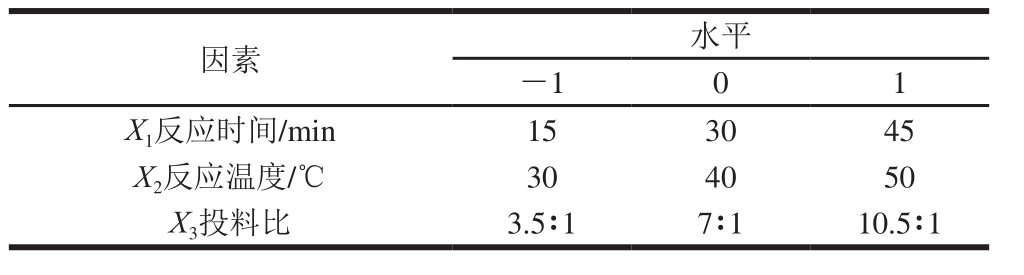
因素 水平-1 0 1 X 1反应时间/min 15 30 45 X 2反应温度/℃ 30 40 50 X 3投料比 3.5∶1 7∶1 10.5∶1
1.3.6 体外抗氧化能力测定
1.3.6.1 对羟自由基清除能力的测定
移取不同质量浓度的供试液1 mL,依次加入1 mL 9 mmol/L FeSO 4溶液、1 mL 9 mmol/L水杨酸-乙醇溶液、6 mL蒸馏水,摇匀。以等体积的蒸馏水代替样品溶液作空白对照(A 0),以蒸馏水代替水杨酸测得吸光度(A c)。最后加入1 mL 8.82 mmol/L H 2O 2溶液启动反应,37 ℃恒温水浴1 h,在510 nm波长处测定吸光度(A x)。实验结果用清除率(I)表示,I的计算如式(2)所示。以I为纵坐标,多糖或VC对数质量浓度为横坐标作图,建立回归方程,计算IC 50。
1.3.6.2 对小鼠肝匀浆自发性脂质过氧化的影响
昆明小鼠((20±2)g,雌雄各半)断颈处死,迅速取肝脏,置冰冷生理盐水中洗净表面残血,去除胆囊,用滤纸吸干水分,称质量。以4 ℃生理盐水在冰浴条件下制成10%小鼠肝组织匀浆,4 ℃ 4 000 r/min离心15 min,取上清液供实验用。取10%肝匀浆1.0 mL于试管中,加入不同质量浓度供试液1.0 mL混匀,于37 ℃水浴温孵1.5 h后,加入10%三氯乙酸溶液2 mL、0.67%硫代巴比妥酸溶液2 mL,混匀,沸水浴中反应15 min后取出,流水冷却,4 000 r/min离心15 min,取上清液,以生理盐水调零点,并在532 nm波长处测定吸光度(A x)。模型对照组(A 0)用生理盐水1 mL代替供试液,样本对照组(A c)用生理盐水1 mL代替10%肝匀浆。每个质量浓度组平行测定5 份。抑制率和IC 50的计算方法同1.3.6.1节。1.3.6.3 对H 2O 2诱导红细胞溶血的影响
昆明小鼠((20±2)g,雌雄各半)眼球取血,置于含有肝素钠的离心管中,1 500 r/min离心10 min,弃掉上清液得到淡黄色红细胞,用冰冷生理盐水清洗3 次,1 500 r/min离心5 min,制成体积分数0.5%的红细胞悬液。取1 mL红细胞悬液,加入不同质量浓度的供试液1 mL,再加入0.2 mL 50 mmol/L H 2O 2,在37℃条件下水浴温孵1 h后,加5 mL生理盐水稀释,3 000 r/min离心10 min,取上清液,以生理盐水为空白,在415 nm波长处测定吸光度(A x)。模型对照组(A 0)用生理盐水1 mL代替供试液,样本对照组(A c)用生理盐水1 mL代替0.5%红细胞悬浮液。每个质量浓度组平行测定5 份。抑制率和IC 50的计算方法同1.3.6.1节。
2.1 多糖结构表征
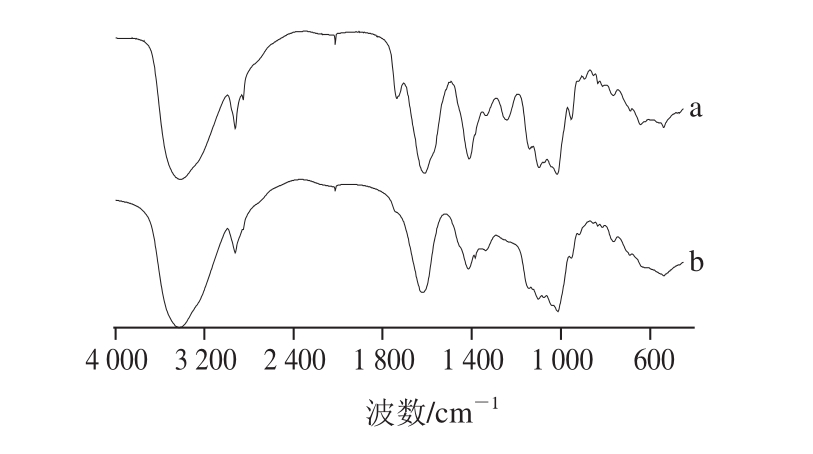
图1 乙酰化龙眼肉多糖(a)和龙眼肉多糖(b)红外图谱
Fig. 1 Infrared spectra of LYP2 and Ac-LYP2
由图1可知,3 430 cm -1处的宽吸收峰表示O—H的伸缩振动,2 927 cm -1处的弱吸收表示C—H的特征峰。龙眼肉多糖经乙酰化修饰后出现了两个特征吸收峰:1 740 cm -1左右出现的峰,推断为乙酰酯基C=O的伸缩振动峰;1 245 cm -1左右出现的弱峰,推断为酯基的C—O伸缩振动峰。以上结果证实乙酰基团的存在。此外,两红外吸收光谱非常接近,这说明乙酰化修饰并未改变龙眼肉多糖的大体结构。乙酰化龙眼肉多糖和龙眼肉多糖高效凝胶色谱如图2所示,经测定,龙眼肉多糖乙酰化修饰前后的多糖含量分别为96.7%和95.2%,分子质量分别为1.18×10 5D和1.29×10 5D,乙酰化修饰后分子质量有一定程度的增加也间接表明乙酰化修饰成功。
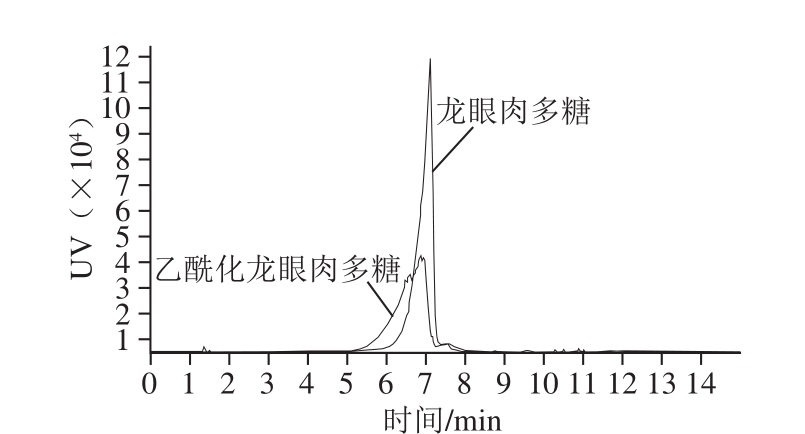
图2 乙酰化龙眼肉多糖和龙眼肉多糖高效凝胶色谱图
Fig. 2 HPGPC profiles of LYP2 and Ac-LYP2
2.2 龙眼肉多糖乙酰化修饰工艺优化
2.2.1 单因素试验结果
2.2.1.1 反应时间对乙酰化取代度的影响
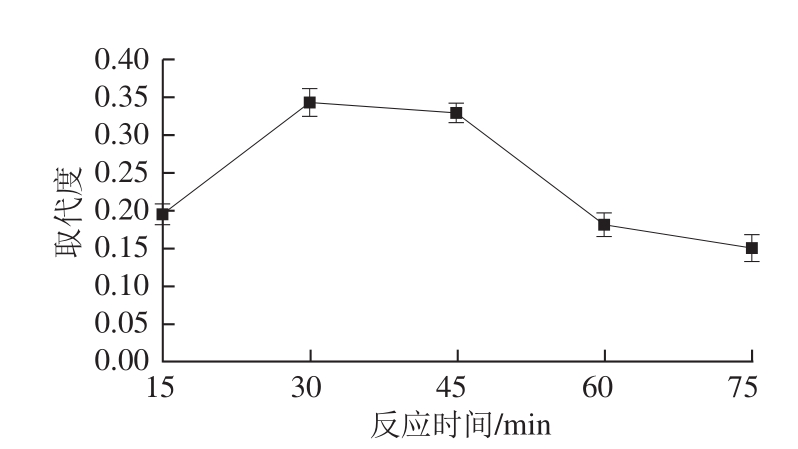
图3 反应时间对乙酰化取代度的影响
Fig. 3 Effect of reaction time on DS
固定反应温度30 ℃、投料比7.0∶1,研究反应时间对乙酰化取代度的影响,结果如图3所示。龙眼肉多糖乙酰化反应速率很快,30 min乙酰化取代度最高,反应时间低于或超过30 min取代度均有不同程度下降。因此选取30 min作为最佳反应时间。
2.2.1.2 反应温度对乙酰化取代度的影响
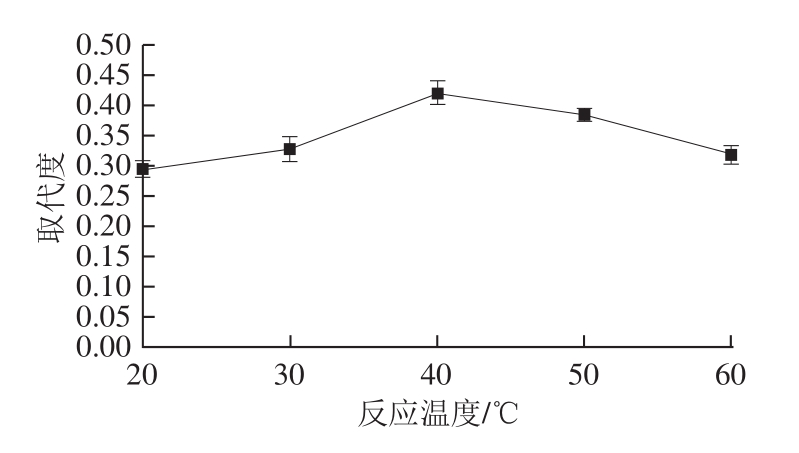
图4 反应温度对乙酰化取代度的影响
Fig. 4 Effect of reaction temperature on DS
固定反应时间30 min、投料比7.0∶1,研究反应温度对乙酰化取代度的影响,结果如图4所示。反应温度低于40 ℃时,多糖乙酰化取代随温度的升高呈现上升趋势,而温度超过40 ℃时取代度出现了下降。因此选取40 ℃作为最佳反应温度。
2.2.1.3 投料比对乙酰化取代度的影响
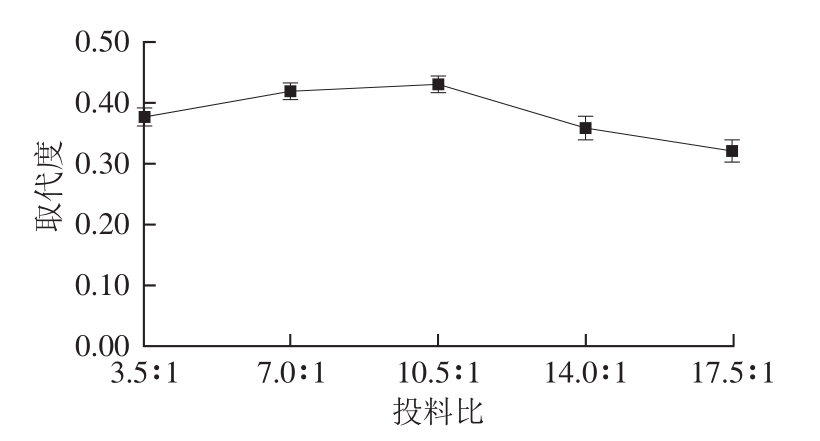
图5 投料比对乙酰化取代度的影响
Fig. 5 Effect of ratio of reactants on DS
固定反应温度40 ℃、反应时间30 min,研究投料比对乙酰化取代度的影响,结果如图5所示。投料比在3.5∶1~10.5∶1范围内,取代度呈现上升趋势。而当投料比超过10.5∶1时,取代度开始出现下降。因此选取10.5∶1作为最佳投料比。
2.2.2 龙眼肉多糖乙酰化修饰工艺条件优化
选取反应时间、反应温度和投料比为因素,以乙酰化取代度为指标,使用统计分析软件Design-Expert 8.05建立三因素三水平共17 个试验点的响应面试验,以优化乙酰化龙眼肉多糖合成条件,响应面试验及方差分析结果如表2、3所示。
表2 响应面试验方案及结果
Table 2 Program and experimental results of RSM
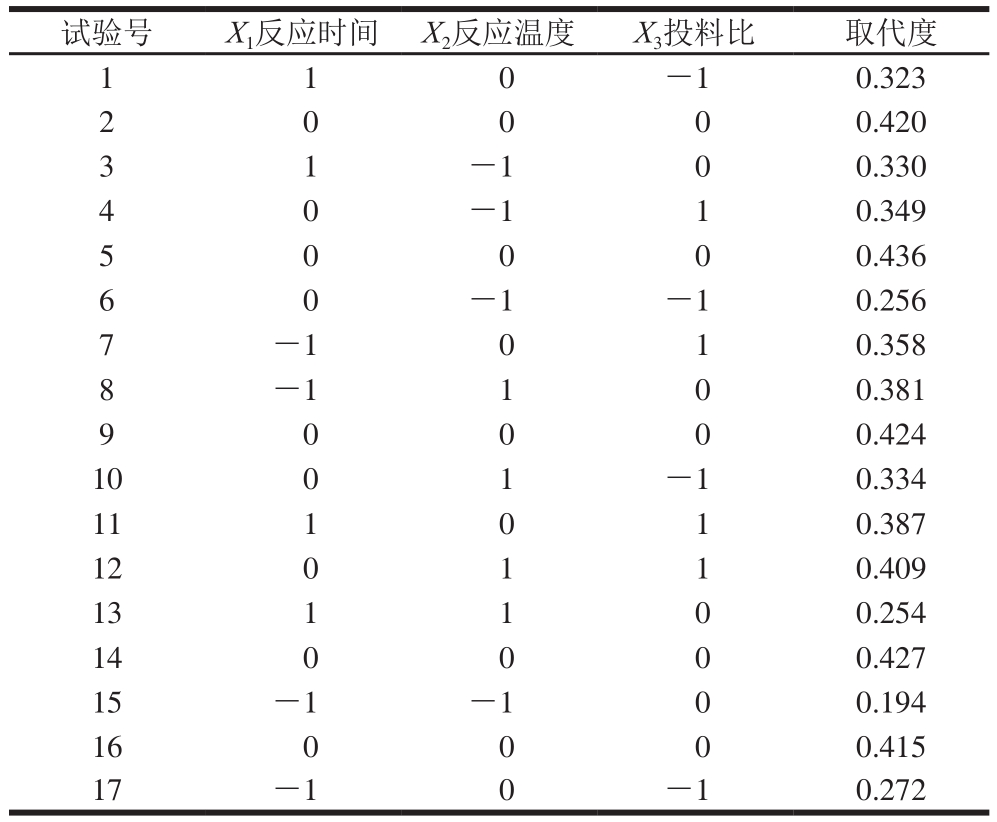
试验号 X 1反应时间 X 2反应温度 X 3投料比 取代度1 1 0 -1 0.323 2 0.420 3 1 -1 0 0.330 0 0 0 4 -1 1 0.349 5 0 0 0 0.436 0 6 -1 -1 0.256 7 -1 0 1 0.358 8 -1 1 0 0.381 9 0 0 0 0.424 0 10 0 1 -1 0.334 11 1 0 1 0.387 12 0 1 1 0.409 13 1 1 0 0.254 14 0 0 0 0.427 15 -1 -1 0 0.194 16 0 0 0 0.415 17 -1 0 -1 0.272
表3 方差分析表
Table 3 Analysis of variance
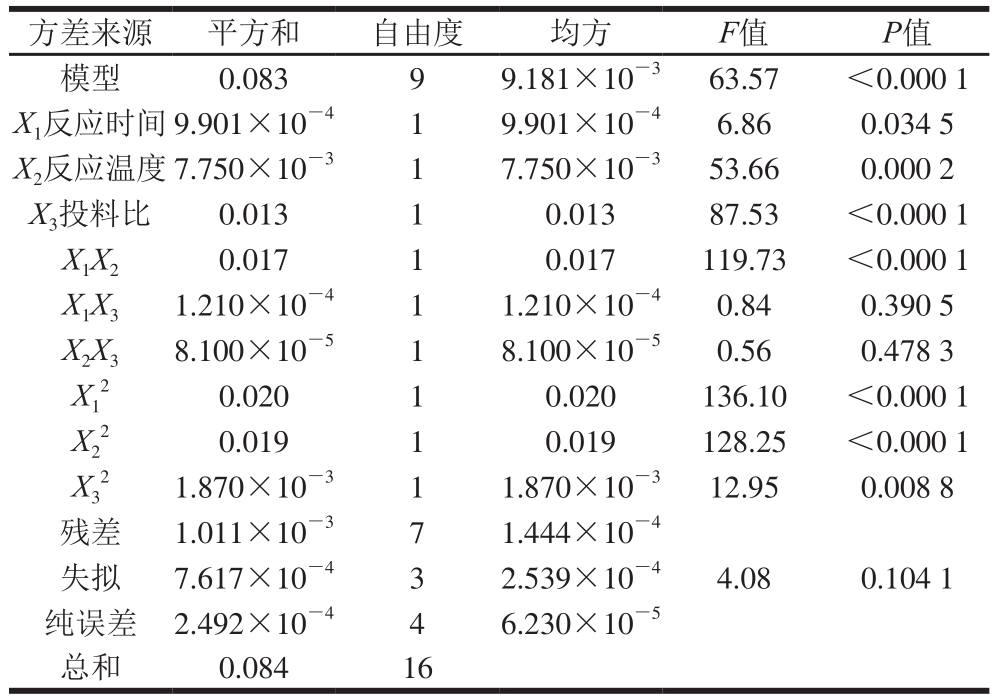
注:P<0.01,差异极显著;P<0.05,差异显著。
方差来源 平方和 自由度 均方 F值 P值模型 0.083 9 9.181×10 -3 63.57 <0.000 1 X 1反应时间9.901×10 -4 1 9.901×10 -4 6.86 0.034 5 X 2反应温度7.750×10 -3 1 7.750×10 -3 53.66 0.000 2 X 3投料比 0.013 1 0.013 87.53 <0.000 1 X 1X 2 0.017 1 0.017 119.73 <0.000 1 X 1X 3 1.210×10 -4 1 1.210×10 -4 0.84 0.390 5 X 2X 3 8.100×10 -5 1 8.100×10 -5 0.56 0.478 3 X1 0.019 1 0.019 128.25 <0.000 1 X3 2 1.870×10 -3 1 1.870×10 -3 12.95 0.008 8残差 1.011×10 -3 7 1.444×10 -4失拟 7.617×10 -4 3 2.539×10 -4 4.08 0.104 1纯误差 2.492×10 -4 4 6.230×10 -5总和 0.084 16 0.020 1 0.020 136.10 <0.000 1 X2 22
经回归拟合,乙酰化取代度(Y)对各因素的二次回归方程如下所示:
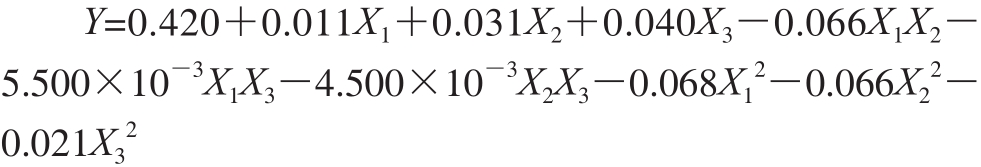
如表3所示,P值小于0.000 1说明试验模型拟合显著,具有统计学意义。相关系数r=0.083/0.084=0.988 1,表明响应值与各单因素之间的线性关系良好。此外,失拟项P=0.104 1>0.05,说明未知因素对试验结果干扰很小。因此,可以使用该模型方程替代真实试验点对实验结果进行分析和预测。由表3可以看出,一次项中X 1、X 2和X 3均为差异显著(P<0.05),说明反应时间、反应温度和投料比对乙酰化取代度有显著的影响,影响程序大小顺序为:投料比>反应温度>反应时间。交互影响因素中,反应时间与反应温度之间的交互作用差异极显著(P<0.01)。
2.2.3 响应面分析
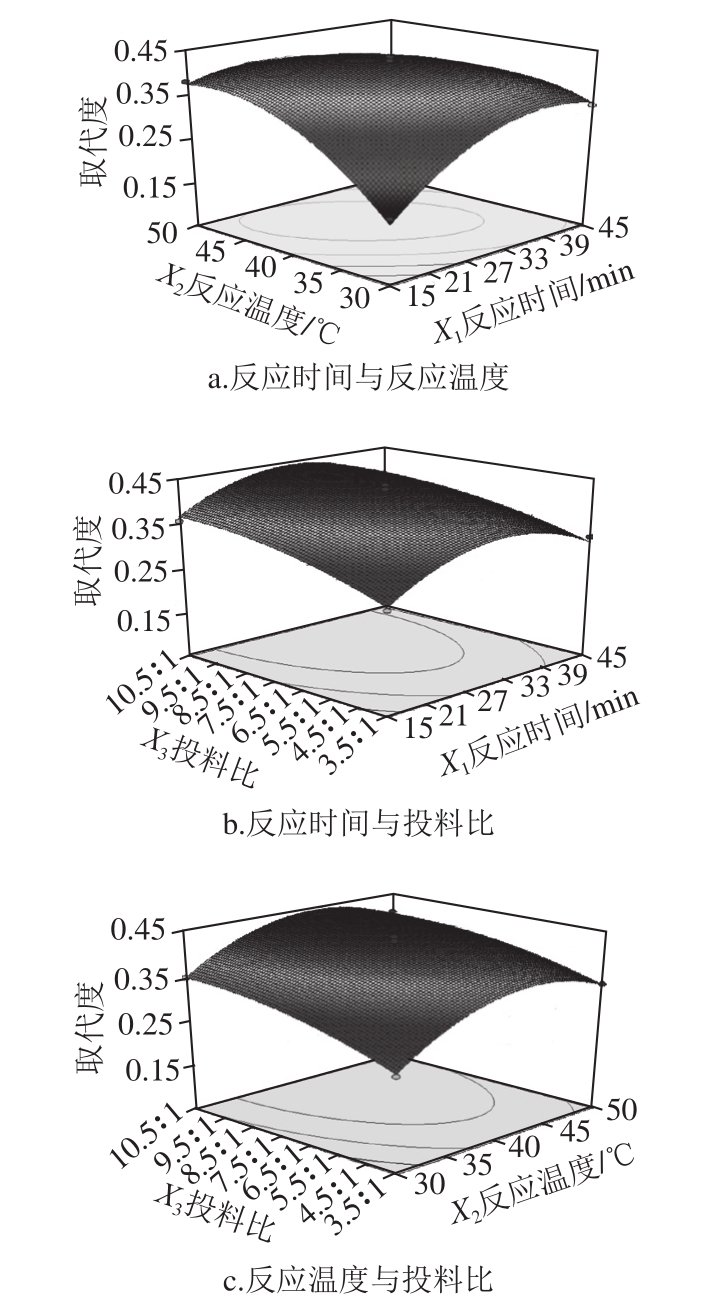
图6 各因素交互作用对乙酰化取代度的影响
Fig. 6 Effects of interactions among reaction conditions on DS
如图6所示,对响应面图进行岭脊分析,得出最佳工艺条件为反应时间28.94 min、投料比10.24∶1、反应温度42.39 ℃,此时乙酰化龙眼肉多糖的取代度达到0.446 135。
2.2.4 模型验证
从实际应用角度考虑,将反应条件修改为反应时间30 min、投料比10.2∶1、反应温度42 ℃。此工艺条件下3 次重复验证实验得到乙酰化取代度为0.440、0.448、0.442,平均取代度为0.443,与预测值相对标准偏差为0.67%,说明可以采用响应面法来优化龙眼肉多糖乙酰化工艺。
2.3 体外抗氧化活性测定结果
2.3.1 清除羟自由基能力
如表4所示,乙酰化前后的龙眼肉多糖均有清除羟自由基的能力,且呈现剂量依赖关系。当质量浓度相同时,乙酰化后的龙眼肉多糖的清除能力高于未修饰的龙眼肉多糖。龙眼肉多糖乙酰化前后的IC 50分别是5 507.67 μg/mL和702.41 μg/mL,其相应的浓度分别为4.67×10 -5mol/L和5.45×10 -6mol/L,说明乙酰基团的引入可以提高龙眼肉多糖对羟自由基的清除能力。从质量浓度的角度考虑,乙酰化龙眼肉多糖清除羟自由基能力与VC相比较存在一定差距,这是乙酰化龙眼肉多糖属于高分子化合物造成的。若从浓度出发,乙酰化龙眼肉多糖的IC 50仅为VC的1/88。
表4 龙眼肉多糖乙酰化前后对清除羟自由基的影响(
 ±s,n=5)
±s,n=5)
Table 4 Hydroxyl radical scavenging effects of LYP2 and Ac-LYP2 (
 ±s, n= 5)
±s, n= 5)
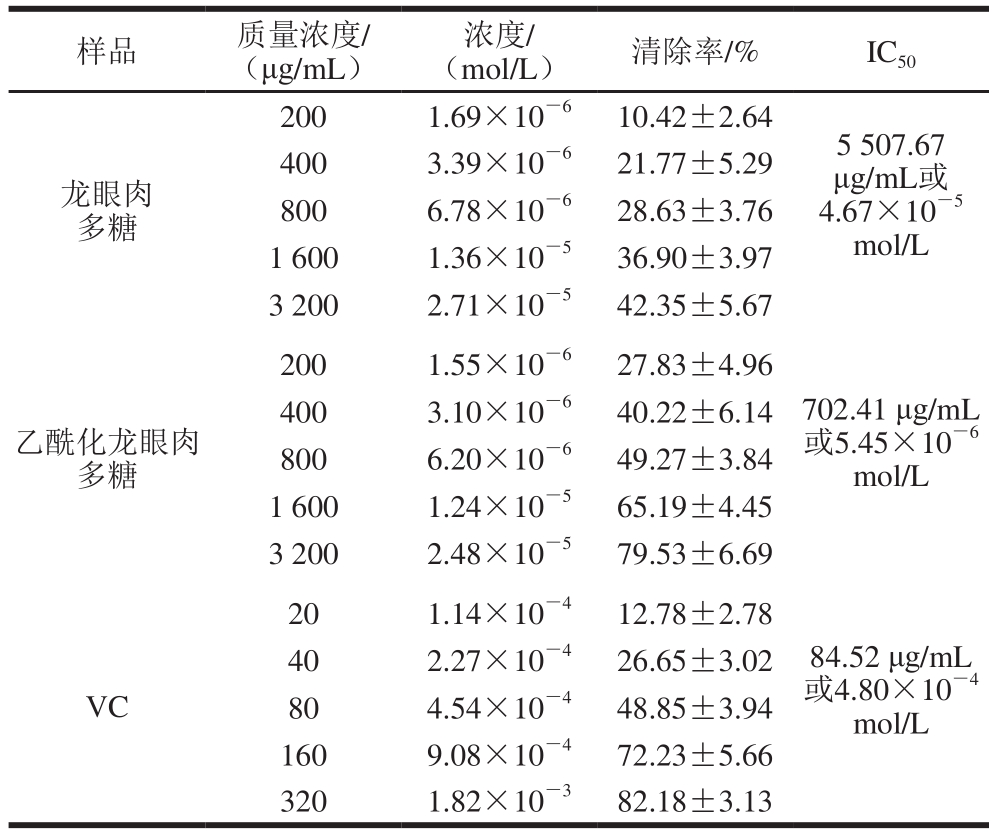
样品 质量浓度/ (μg/mL)浓度/ (mol/L) 清除率/% IC 50龙眼肉多糖400 3.39×10 -6 21.77±5.29 800 6.78×10 -6 28.63±3.76 1 600 1.36×10 -5 36.90±3.97 3 200 2.71×10 -5 42.35±5.67 200 1.69×10 -6 10.42±2.64 5 507.67 μg/mL或4.67×10 -5mol/L 200 1.55×10 -6 27.83±4.96乙酰化龙眼肉多糖400 3.10×10 -6 40.22±6.14 800 6.20×10 -6 49.27±3.84 1 600 1.24×10 -5 65.19±4.45 3 200 2.48×10 -5 79.53±6.69 702.41 μg/mL 或5.45×10 -6mol/L 20 1.14×10 -4 12.78±2.78 VC 40 2.27×10 -4 26.65±3.02 80 4.54×10 -4 48.85±3.94 160 9.08×10 -4 72.23±5.66 320 1.82×10 -3 82.18±3.13 84.52 μg/mL 或4.80×10 -4mol/L
2.3.2 龙眼肉多糖乙酰化前后对小鼠肝匀浆自发性脂质过氧化的影响
表5 龙眼肉多糖乙酰化前后对脂质过氧化的影响(
 ±s,n=5)
±s,n=5)
Table 5 Inhibitory effects of LYP2 and Ac-LYP2 on lipid peroxidation (
 ±s, n= 5)
±s, n= 5)
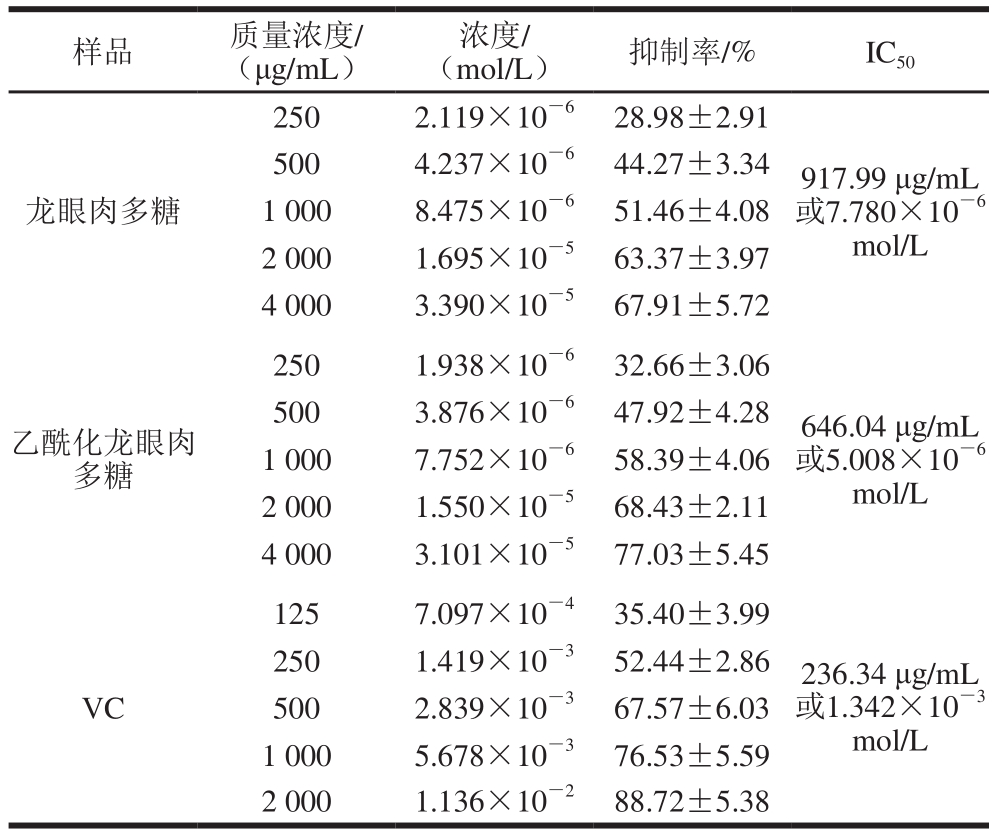
样品 质量浓度/ (μg/mL)浓度/ (mol/L) 抑制率/% IC 50250 2.119×10 -6 28.98±2.91龙眼肉多糖500 4.237×10 -6 44.27±3.34 1 000 8.475×10 -6 51.46±4.08 2 000 1.695×10 -5 63.37±3.97 4 000 3.390×10 -5 67.91±5.72 917.99 μg/mL 或7.780×10 -6mol/L 250 1.938×10 -6 32.66±3.06乙酰化龙眼肉多糖500 3.876×10 -6 47.92±4.28 1 000 7.752×10 -6 58.39±4.06 2 000 1.550×10 -5 68.43±2.11 4 000 3.101×10 -5 77.03±5.45 125 7.097×10 -4 35.40±3.99 646.04 μg/mL 或5.008×10 -6mol/L 250 1.419×10 -3 52.44±2.86 VC 500 2.839×10 -3 67.57±6.03 1 000 5.678×10 -3 76.53±5.59 2 000 1.136×10 -2 88.72±5.38 236.34 μg/mL 或1.342×10 -3mol/L
如表5所示,龙眼肉多糖和乙酰化龙眼肉多糖在一定范围内均可有效抑制小鼠肝匀浆自发性脂质过氧化反应,且随添加剂量的增加,抑制效果越好。龙眼肉多糖乙酰化前后的IC 50分别是917.99 μg/mL和646.04 μg/mL,乙酰化龙眼肉多糖抑制脂质过氧化效应更强。从浓度角度考虑,乙酰化龙眼肉多糖的IC 50是VC的1/268,达到相同效应时前者需要的分子数更少。
2.3.3 龙眼肉多糖乙酰化前后对H 2O 2诱导红细胞溶血的影响
表6 龙眼肉多糖乙酰化前后对H
2O
2诱导红细胞溶血的影响(
 ±s,n=5)
±s,n=5)
Table 6 Inhibitory effects of LYP2 and Ac-LYP2 on red cell hemolysis induced by H
2O
2(
 ±s, n= 5)
±s, n= 5)
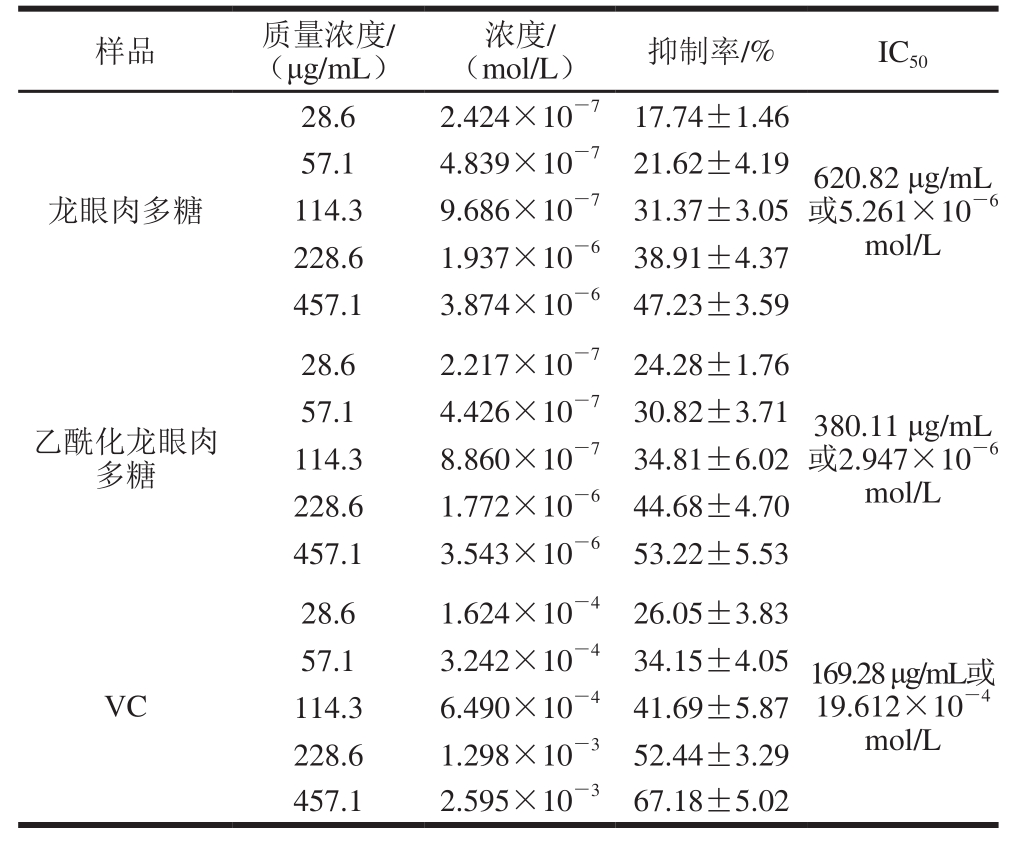
样品 质量浓度/ (μg/mL)浓度/ (mol/L) 抑制率/% IC 5028.6 2.424×10 -7 17.74±1.46龙眼肉多糖57.1 4.839×10 -7 21.62±4.19 114.3 9.686×10 -7 31.37±3.05 228.6 1.937×10 -6 38.91±4.37 457.1 3.874×10 -6 47.23±3.59 620.82 μg/mL 或5.261×10 -6mol/L 28.6 2.217×10 -7 24.28±1.76乙酰化龙眼肉多糖57.1 4.426×10 -7 30.82±3.71 114.3 8.860×10 -7 34.81±6.02 228.6 1.772×10 -6 44.68±4.70 457.1 3.543×10 -6 53.22±5.53 380.11 μg/mL 或2.947×10 -6mol/L 28.6 1.624×10 -4 26.05±3.83 VC 57.1 3.242×10 -4 34.15±4.05 114.3 6.490×10 -4 41.69±5.87 228.6 1.298×10 -3 52.44±3.29 457.1 2.595×10 -3 67.18±5.02 169.28 μg/mL或19.612×10 -4mol/L
如表6所示,在一定检测范围内,随着样品质量浓度的增加,溶血抑制率逐渐加强,表明多糖或VC抑制H 2O 2诱导红细胞溶血的能力与其质量浓度呈现一定的剂量效应。龙眼肉多糖和乙酰化龙眼肉多糖的IC 50分别为620.82 μg/mL 和380.11 μg/mL,后者抑制H 2O 2诱导红细胞溶血的能力更出色。从浓度出发,乙酰化龙眼肉多糖IC 50仅为VC的1/326,前者抑制H 2O 2诱导的红细胞溶血效果更优。
采用乙酸酐法对龙眼肉多糖乙酰化工艺进行探索,考察投料比、反应时间和反应温度对乙酰化取代度的影响。通过响应面优化研究,建立乙酰化取代度与各影响因素之间的回归模型,得到最佳的乙酰化工艺条件是:投料比10.2∶1、反应温度42 ℃、反应时间30 min。该条件下制备的乙酰化龙眼肉多糖的取代度达到0.443。
活性氧自由基属于高活性分子,包括超氧阴离子自由基、羟自由基和H 2O 2等,它们可以造成生物膜系统损伤以及细胞内氧化磷酸化障碍,是人体疾病、衰老和死亡的直接参与者,对人体的健康和寿命危害较大 [24-26]。实验结果表明,乙酰化龙眼肉多糖在体外能抑制小鼠肝脏脂质过氧化,对羟自由基具有直接清除作用,对H 2O 2诱导红细胞溶血抑制效果显著,表现出比龙眼肉多糖更强的抗氧化活性。这可能是乙酰化修饰促使龙眼肉多糖更多糖羟基暴露在外而增强其抗氧化活性造成的。本研究表明乙酰化修饰适用于龙眼肉多糖的分子结构改性,为其构效关系研究提供新的思路。
参考文献:
[1] 王玲, 籍保平. 龙眼多糖结构和性质的研究[J]. 食品研究与开发,2006, 27(10): 21-25.
[2] 陈冠敏, 陈润, 张荣标. 龙眼多糖口服液增强免疫功能的研究[J]. 毒理学杂志, 2005, 19(3): 283.
[3] PARK S J, PARK D H, KIM D H, et al. The memory-enhancing effects of Euphoria longan fruit extract in mice[J]. Journal of Ethnopharmacology, 2010, 128(1): 160-165. DOI:10.1016/ j.jep.2010.01.001.
[4] CHEN Tong, ZHU Ling, LIU Xiaoyan, et al. Synthesis and antioxidant activity of phosphorylated polysaccharide from Portulaca oleracea L. with H 3PW 12O 40immobilized on polyamine functionalized polystyrene bead as catalyst[J]. Journal of Molecular Catalysis A: Chemical, 2011,342: 74-82. DOI:10.1016/j.molcata.2011.04.014.
[5] 高贵珍, 陈雷, 李绪亮. 硫酸化茯苓多糖急性毒性实验研究[J]. 生物学杂志, 2004, 21(1): 34-37.
[6] 杨小军, 王思宇, 姚军虎, 等. 羧甲基化分子修饰制备高效低聚黄芪多糖的方法: 中国, 103030704A[P]. 2013-04-10.
[7] JAMAS S, EASSON D D, OSTROFF G R, et al. PGG-Glucans: a novel class of macrophage activity inmuno modulator[J]. ACS Symposium Series, 1991, 469(1): 44-51. DOI:10.1021/bk-1991-0469.ch005.
[8] 吴琼, 代永刚. 磷酸酯化修饰碱溶性银耳多糖的研究[J]. 食品科技,2010, 35(3): 75-81. DOI:10.13684/j.cnki.spkj.2010.03.059.
[9] 宋逍, 辛亚洲, 赵鹏, 等. 响应面法优化金银花多糖乙酰化工艺[J]. 食品工业科技, 2014, 35(17): 262-265. DOI:10.13386/ j.issn1002-0306.2014.17.049.
[10] HUANG Xiaoyan, WANG Deyun, HU Yuanliang, et al. Effect of sulfated astragalus polysaccharide on cellular infectivity of infectious bursal disease virus[J]. International Journal of Biological Macromolecules, 2008, 42(2): 166-171. DOI:10.1016/ j.ijbiomac.2007.10.019.
[11] 黄雪芳. 龙眼肉多糖硫酸酯化修饰及修饰前后体外抗肿瘤活性初步研究[D]. 南宁: 广西医科大学, 2011.
[12] 宁苑灵, 蒙法艳, 蒋洁, 等. 响应面法优化磷酸酯化龙眼肉多糖的制备工艺[J]. 中国实验方剂学杂志, 2013, 19(6): 50-53. DOI:10.13422/ j.cnki.syfjx.2013.06.005.
[13] 宁苑灵. 磷酸酯化和不同分子量片断龙眼肉多糖的制备及其免疫调节作用和抗氧化作用的研究[D]. 南宁: 广西医科大学, 2013.
[14] JIANG Jie, MENG Fayan, HE Zhou, et al. Sulfated modification of longan polysaccharide and its immunomodulatory and antitumor activity in vitro[J]. International Journal of Biological Macromolecules,2014, 67: 323-329. DOI:10.1016/j.ijbiomac.2014.03.030.
[15] 梁进, 张剑韵, 崔莹莹, 等. 茶多糖的化学修饰及体外抗凝血作用研究[J]. 茶叶科学, 2008, 28(3): 166-171. DOI:10.13305/j.cnki. jts.2008.03.010.
[16] QI Huimin, ZHANG Quanbin, ZHAO Tingting, et al. In vitro antioxidant activity of acetylated and benzoylated derivatives of polysaccharide extracted from Ulva pertusa (Chlorophyta)[J]. Bioorganic and Medicinal Chemistry Letters, 2006, 16(9): 2441-2445.
DOI:10.1016/j.bmcl.2006.01.076.
[17] 黄丹菲, 聂少平, 江乐明, 等. 乙酰化大粒车前子多糖的制备及其活性初探[J]. 食品科学, 2013, 34(22): 1-4. DOI:10.7506/spkx1002-6630-201322001.
[18] CHEN Yi, ZHANG Hui, WANG Yuanxing, et al. Acetylation and carboxymethylation of the polysaccharide from Ganoderma atrum and their antioxidant and immunomodulating activities[J]. Food Chemistry,2014, 156: 279-288. DOI:10.1016/j.foodchem.2014.01.111.
[19] 张磊, 熊柳, 孙庆杰. 乙酰化对红薯淀粉性质的影响[J]. 中国食品学报, 2011, 11(8): 53-58.
[20] 麻景梅, 宋新波, 张丽娟. 肉苁蓉多糖含量测定[J]. 辽宁中医药大学学报, 2012, 14(8): 100-101. DOI:10.13194/j.jlunivtcm.2012.08.102. majm.095.
[21] WANG Junlong, YANG Ting, TIAN Jia, et al. Synthesis and characterization of phosphorylated galactomannan: the effect of DS on solution conformation and antioxidant activities[J]. Carbohydrate Polymers, 2014, 113: 325-335. DOI:10.1016/j.carbpol.2014.07.028.
[22] MENG Fayan, NING Yuanling, JIA Qi, et al. Structure and antitumor and immunomodulatory activities of a water-soluble polysaccharide from Dimocarpus longan Pulp[J]. International Journal of Molecular Sciences, 2014, 15: 5140-5162. DOI:10.3390/ijms15035140.
[23] 殷殷, 张燕, 彭芳, 等. 紫外分光光度法测定魔芋多糖中乙酰取代度[J]. 药物分析杂志, 2010, 30(5): 919-921. DOI:10.16155/j.0254-1793.2010.05.005.
[24] 苟三玉, 顾玉海. 氧自由基在部分肺部疾病发病中的作用[J]. 当代医学, 2016, 22(4): 14-15. DOI:10.3969/j.issn.1009-4393.2016.4.008.
[25] 殷晓煌. 活性氧自由基与老年疾病代谢的关系[J]. 药物生物技术,2013, 20(2): 183-185.
[26] 张翠利, 付丽娜, 杨小云, 等. 活性氧自由基与细胞衰老关系的研究进展[J]. 广州化工, 2015, 43(19): 5-7.
Optimization of Preparation of Acetylated Polysaccharides from Longan (Dimocarpus longan) Pulp by Response Surface Methodology and Its Antioxidant Ability
WANG Jing, WU Nini, HUANG Jing, WEI Yiming, YANG Yanfang, LI Xuehua*, LUO Haixian, QIN Anni, GAN Rizhi
(Pharmaceutical College, Guangxi Medical University, Nanning 530021, China)
Abstract:In this study, the synthesis of acetylated polysaccharides extracted from longan (Dimocarpus longan) pulp was investigated using acetic anhydride. The influences of reaction time, reaction temperature and polysaccharides-to-acetic anhydride ratio on the degree of substitution (DS) of the synthesized derivatives were examined to select and optimize important reaction conditions by response surface methodology. The antioxidant activity of acetylated polysaccharides in vitro was determined. The optimized conditions that provided the maximum DS of 0.443 were determined as follows: reaction time, 30 min; polysaccharides-to-acetic anhydride ratio, 10.21:1; and reaction temperature, 42 ℃. The acetylated derivatives could scavenge hydroxyl free radical, and inhibit lipid peroxidation and red cell hemolysis induced by H 2O 2, with 50% inhibition concentrations (IC 50) of 702.41, 646.04 μg/mL and 380.11 μg/mL, respectively. The antioxidant ability of the synthesized acetylated derivatives was improved as compared to the native polysaccharides.
Key words:longan pulp polysaccharides; acetylation; degree of substitution; response surface methodology (RSM);antioxidant ability
DOI:10.7506/spkx1002-6630-201616010
中图分类号:R284.3
文献标志码:A
文章编号:1002-6630(2016)16-0063-06
引文格式:
王警, 吴妮妮, 黄静, 等. 响应面试验优化龙眼肉多糖乙酰化工艺及其抗氧化活性[J]. 食品科学, 2016, 37(16): 63-68.
DOI:10.7506/spkx1002-6630-201616010. http://www.spkx.net.cn
WANG Jing, WU Nini, HUANG Jing, et al. Optimization of preparation of acetylated polysaccharides from longan (Dimocarpus longan) pulp by response surface methodology and its antioxidant ability[J]. Food Science, 2016, 37(16): 63-68. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201616010. http://www.spkx.net.cn
收稿日期:2016-01-21
基金项目:广西科学研究与技术开发计划项目(桂科重12118005-1-2);广西教育厅专利资助项目(KY2015ZL020)
作者简介:王警(1988—),男,硕士研究生,主要从事天然产物化学研究。E-mail:wangjinglls99@163.com
*通信作者:李雪华(1963—),女,教授,硕士,主要从事天然产物活性物质提取与活性研究。
E-mail:onlythankforyou@163.com