李 斌 1,高凝轩 1,刘 辉 2,孟宪军 1,张 琦 1,矫馨瑶 1,李恩惠 1,丑述睿 1,张 野 1,陈世富 3
(1.沈阳农业大学食品学院,辽宁 沈阳 110161;2.沈阳综合保税区出入境检验检疫局,辽宁 沈阳 110169;3.辽宁富康源黑果腺肋花楸科技开发有限公司,辽宁 海城 114200)
摘 要:以黑果腺肋花楸为原料,采用大孔树脂纯化黑果腺肋花楸中多酚类物质。通过对比6 种大孔树脂对黑果腺肋花楸多酚吸附-解吸效果,筛选出XAD-7大孔树脂作为最佳纯化材料,并通过单因素试验确定XAD-7大孔树脂纯化黑果腺肋花楸多酚的静态吸附-解吸最佳工艺条件为:吸附时间4 h、解吸时间2 h、上样液质量浓度3.6 mg/mL、上样液pH 4、乙醇体积分数95%、乙醇溶液pH 7;其对黑果腺肋花楸多酚动态吸附-解吸最佳工艺条件为:上样流速2 mL/min、上样量560 mL、蒸馏水洗脱用量350 mL、洗脱流速2 mL/min、洗脱体积300 mL。在此条件下,黑果腺肋花楸多酚纯度由11.62%提高到64.37%,表明XAD-7大孔树脂对于黑果腺肋花楸多酚具有较好的纯化效果。
关键词:黑果腺肋花楸;多酚;大孔树脂;纯化
黑果腺肋花楸,又名野樱莓、不老莓,属蔷薇科,原产于北美地区,果实为深蓝色小浆果,呈圆形,可用于加工果汁、果酒、果酱、罐头、果脯等食品和饮料,是一种具有极高营养价值与经济价值的新兴小浆果。国内外研究结果表明,黑果腺肋花楸果实中富含黄酮、花青素和酚酸等多酚类物质,且多酚含量是目前已知植物果实中含量最高的,每100 g黑果腺肋花楸鲜果中所含多酚可达到2 050~2 560 mg没食子酸当量。Kim等 [1]通过对黑果腺肋花楸与9 种黑莓、3 种树莓、9 种黑加仑、4 种红加仑等浆果进行比较发现,黑果腺肋花楸中总酚的含量是其他浆果的数倍,而花青素含量也明显高于以上几种浆果。黑果腺肋花楸多酚组成主要为原花青素聚合物及花青素,分别占总酚含量的66%和25%,绿原酸与新绿原酸含量占总酚含量的7.5%。研究 [2-6]表明,其多酚具有很强的清除自由基、降血脂、降血糖和调节免疫系统等功能。
大孔吸附树脂是一种应用十分广泛的吸附分离介质,其具有较高的稳定性以及独特的吸附选择性,此外由于大孔树脂富集效果明显、解吸条件温和、不受无机物影响、可多次再生、使用周期长,大量用于药物及功能性成分的纯化 [7]。黑果腺肋花楸为我国新选育的品种,种植面积逐年递增,产量巨大。国外对于黑果腺肋花楸的研究主要集中在其提取物对人体机能的改善,以及加工对其多酚类物质稳定性的影响。而国内对于黑果腺肋花楸的食用研究正处于起步阶段,对其中多酚类物质的纯化工艺鲜见报道,本实验以黑果腺肋花楸冻果多酚提取液为原材料,对其多酚类物质纯化工艺进行研究,旨为其多酚类物质的进一步研究以及工业化生产提供方法及理论依据。
1.1 材料与试剂
黑果腺肋花楸冻果来自辽宁省海城富康源黑果腺肋花楸科技开发有限公司,挑选出无病虫害和机械损伤、且成熟度一致的黑果腺肋花楸‘富康源1号’果实,清洗沥干后速冻,并于-80 ℃超低温冰箱中冻藏。
福林-酚、没食子酸标准品、蒽酮、XAD-7型大孔树脂美国Sigma公司;D1400、S-8、D101、X-5型大孔树脂安徽三星树脂科技有限公司;AB-8型大孔树脂 沧州宝恩吸附材料科技有限公司;无水碳酸钠、无水乙醇、95%乙醇溶液、盐酸、氢氧化钠均为分析纯。
1.2 仪器与设备
PHS-25酸度计 上海理达仪器厂;SB25-12DTN超声波清洗机 宁波新芝生物科技股份有限公司;BSA224S分析天平 北京赛多利斯科学仪器有限公司;JYL-C012料理机 九阳股份有限公司;RE-52AA旋转蒸发器、紫外分光光度计、层析柱(1.8 cm×30 cm) 上海亚荣生化仪器厂;SHZ-D(Ⅲ)循环水式真空泵 巩义市予华仪器有限责任公司;HL-2恒流泵、BS-100A自动部分收集器 上海沪西分析仪器厂有限公司;FD5-3P型真空冷冻干燥机 西盟公司。
1.3 方法
1.3.1 原料处理
将黑果腺肋花楸冻果于常温条件下解冻,蒸馏水清洗后使用料理机打成果浆。使用超声波辅助提取,称取一定量黑果腺肋花楸果浆按1∶44料液比,加入55%乙醇溶液搅匀,在提取温度45 ℃、超声功率500 W条件下提取90 min。真空抽滤,滤渣在相同条件下提取2 次,合并滤液,使用旋转蒸发仪于45 ℃条件下减压浓缩除去乙醇,将水溶液放入真空冷冻干燥机中干燥,得黑果腺肋花楸多酚粗提物冻干粉,测定粗提物冻干粉中多酚含量,使用时按需要配制成不同质量浓度水溶液备用 [8-9]。
1.3.2 多酚含量测定及标准曲线绘制
采用福林-酚比色法测定多酚含量,使用移液枪准确加入1 mL待测样品溶液于25 mL试管内,同时依次加入1 mL 50%福林-酚显色剂、3 mL 7.5%碳酸钠溶液和5 mL蒸馏水,振荡摇匀,避光显色2 h后于765 nm波长条件下测定吸光度,使用没食子酸作为标准品。以吸光度(y)为纵坐标,质量浓度(x)为横坐标,绘制标准曲线 [10-11]。得线性回归方程:y=0.081 05+5.011 43x (R 2=0.998)。利用公式(1)计算样品中多酚含量。
式中:C为黑果腺肋花楸多酚含量/(mg/mL);A为吸光度;N为提取液稀释倍数。
1.3.3 多酚纯度的测定
取黑果腺肋花楸多酚粗提液和XAD-7大孔树脂纯化后的多酚洗脱液,使用旋转蒸发仪除去乙醇后,真空冷冻干燥,得粗多酚和纯化后多酚冻干粉,并按公式(2)计算多酚纯度 [12]。
式中:C 0为多酚质量浓度/(mg/mL);V为溶液体积/mL;m为冻干粉质量/mg。
1.3.4 大孔树脂预处理
将AB-8、D101、D1400、S-8、X-5、XAD-7大孔树脂分别至于无水乙醇中活化,不断搅拌除去气泡,静置24 h,充分溶胀后,使用蒸馏水至无醇味。先后使用2% NaOH溶液及5% HCl溶液洗涤,再用蒸馏水清洗至中性,备用 [13]。
1.3.5 大孔树脂的筛选
准确称取预处理好的6 种大孔树脂各5.0 g,分别放入100 mL锥形瓶中,加入50 mL一定质量浓度的黑果腺肋花楸多酚粗提液,于振荡器中静态吸附24 h。取上清液测定总多酚含量,并按公式(3)、(4)计算吸附量及吸附率。
使用蒸馏水清洗吸附后的大孔树脂,至表面无多酚粗提液残留后,加入50 mL 70%乙醇溶液。放入振荡器中静态解吸24 h,取上清液测定多酚含量,并按公式(5)计算解吸率 [14]。

式中:Q为吸附量/(mg/g);C 0为起始质量浓度/ (mg/mL);C 1为平衡质量浓度/(mg/mL);V 1为吸附溶液体积/mL;m为树脂质量/g;C为解吸后溶液中多酚质量浓度/(mg/mL);V为解吸液体积/mL。
1.3.6 XAD-7大孔树脂静态吸附-解吸动力学曲线
准确称取已活化的XAD-7大孔树脂5.0 g,放入100 mL锥形瓶中,加入50 mL黑果腺肋花楸多酚粗提液,于振荡器中静态吸附,每2 h取1.0 mL上清液测定多酚含量,并绘制静态吸附动力学曲线。使用蒸馏水将已充分吸附黑果腺肋花楸多酚的XAD-7大孔树脂清洗至表面无多酚溶液残留,取5.0 g放入锥形瓶中,加入70%乙醇溶液50 mL,于振荡器中静态解吸,每2 h取1.0 mL上清液测定多酚含量,并绘制静态解吸动力学曲线。
1.3.7 大孔树脂静态吸附-解吸条件优化
静态吸附实验各取已活化的XAD-7大孔树脂5.0 g分别放入100 mL锥形瓶中,加入50 mL多酚提取液,于振荡器中静态吸附,吸附完全后取上清液测定多酚含量,并计算多酚吸附量。分别考察不同上样液质量浓度(0.1、0.2、0.4、0.9、1.8、3.6、7.2 mg/mL)和不同上样液pH值(2、3、4、5、6、7)对XAD-7大孔树脂静态吸附效果的影响 [15-16]。
静态解吸实验使用蒸馏水将充分吸附黑果腺肋花楸多酚的XAD-7大孔树脂清洗至表面无残留,分别称取5.0 g于锥形瓶中,并加入乙醇溶液50 mL,于振荡器中静态解吸完全后,取上清液测定其多酚质量浓度,并计算多酚解吸率。分别考察不同体积分数(30%、40%、50%、60%、70%、80%、90%、95%)乙醇溶液和不同乙醇溶液pH值(2、3、4、5、6、7、8、9、10)对XAD-7大孔树脂静态解吸效果的影响。
1.3.8 XAD-7大孔树脂动态吸附-解吸条件优化
大孔树脂对多酚的实际纯化是一个动态的吸附-解吸过程。因此不能单纯地通过静态实验来确定其对黑果腺肋花楸多酚的吸附、解吸能力。有必要通过动态实验进一步优化吸附-解吸条件。取已处理好的XAD-7型大孔树脂,采用湿法装柱于1.8 cm×30 cm玻璃层析柱中,柱床体积60 mL。先将黑果腺肋花楸多酚粗提液用恒流泵导入层析柱中进行动态吸附,之后导入蒸馏水除去可溶性糖、蛋白质等可溶性杂质。最后导入洗脱剂对所吸附的多酚进行动态解吸并收集洗脱液。实验过程中同时使用自动收集器分别收集上样和洗脱过程中流出液,测定其中多酚含量,并绘多酚泄漏曲线。收集蒸馏水洗脱除杂过程中流出液,采用蒽酮比色法测定其中总糖含量,并绘制糖分洗脱曲线。分别研究不同上样流速(1、2、3、4、5 mL/min)和洗脱流速(1、2、3、4、5 mL/min)对XAD-7大孔树脂动态吸附、解吸效果的影响,以及确定最佳上样量和蒸馏水洗脱用量 [17-20]。
1.4 统计分析
每个结果重复处理3 次,实验数据采用SPSS 19.0软件处理,其中P<0.05表示存在显著性差异。
2.1 大孔树脂的筛选
表1 6 种大孔树脂对样液中黑果腺肋花楸多酚的静态吸附及解吸结果
Table 1 Adsorption and desorption rates of six types of macroporous resins for total polyphenols
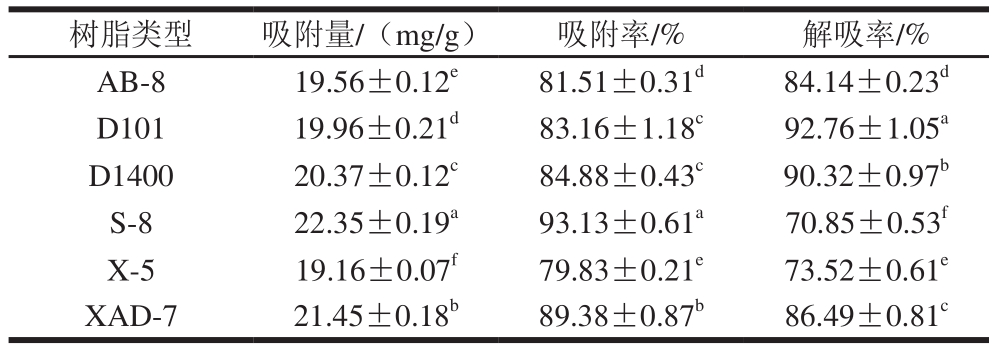
注:同列肩标字母不同表示差异显著(P<0.05)。
树脂类型 吸附量/(mg/g) 吸附率/% 解吸率/% AB-8 19.56±0.12 e 81.51±0.31 d 84.14±0.23 dD101 19.96±0.21 d 83.16±1.18 c 92.76±1.05 aD1400 20.37±0.12 c 84.88±0.43 c 90.32±0.97 bS-8 22.35±0.19 a 93.13±0.61 a 70.85±0.53 fX-5 19.16±0.07 f 79.83±0.21 e 73.52±0.61 eXAD-7 21.45±0.18 b 89.38±0.87 b 86.49±0.81 c
由表1可以看出,S-8、XAD-7大孔树脂对于黑果腺肋花楸多酚的吸附能力较强,D101、D1400、XAD-7大孔树脂的解吸性能较强。但由于D101和D1400大孔树脂的吸附率较低,综合考虑,选择XAD-7大孔树脂作为黑果腺肋花楸多酚的纯化材料。
2.2 XAD-7大孔树脂静态吸附-解吸动力学曲线
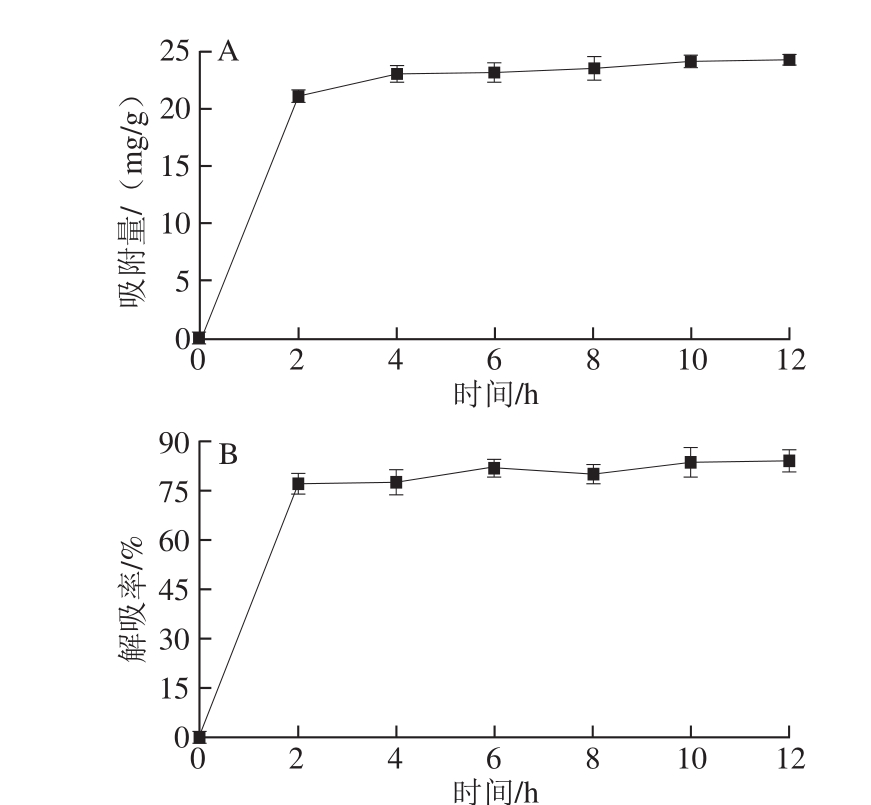
图1 多酚静态吸附(A)-解吸(B)动力学曲线
Fig. 1 Static adsorption-desorption curve of polyphenols
由图1A可知,XAD-7大孔树脂在吸附黑果腺肋花楸多酚的过程中,吸附速率逐渐放缓,到达4 h后,由于大孔树脂已接近吸附平衡,随着时间的延长,吸附量的增加十分有限,所以多酚静态吸附时间选为4 h。由图1B可以看出,在解吸前2 h,绝大部分黑果腺肋花楸多酚与XAD-7大孔树脂分离,溶于乙醇溶液当中。在达到2 h后,解吸率趋于平衡。这表明XAD-7大孔树脂可以快速地对黑果腺肋花楸多酚进行吸附及解吸。
2.3 XAD-7大孔树脂静态吸附-解吸条件优化
2.3.1 上样液质量浓度对大孔树脂静态吸附效果的影响

图2 上样液质量浓度对吸附量的影响
Fig. 2 Effect of sample concentration on adsorption quantity
由图2可知,随上样液质量浓度增加,XAD-7大孔树脂对多酚的吸附量也随之增加。当上样液质量浓度小于3.6 mg/mL时,吸附量急剧下降。造成这种显现可能是由于当上样液质量浓度高于3.6 mg/mL时,其中杂质含量随之增高,会与多酚争夺XAD-7大孔树脂的活性位点,造成多酚吸附量的下降;当上样液质量浓度低于3.6 mg/mL时,由于上样液被稀释造成多酚含量的降低,减小吸附动力,从而降低吸附量。因此,上样液质量浓度选为3.6 mg/mL左右为佳。
2.3.2 上样液pH值对大孔树脂静态吸附效果的影响

图3 上样液pH值对吸附量的影响
Fig. 3 Effect of pH value on adsorption quantity
如图3所示,pH值小于4时,XAD-7大孔树脂多黑果腺肋花楸多酚的吸附量与样液pH值呈正相关;在pH值为4时吸附量达到最大值;而上样液pH值大于4时,随pH值升高,多酚吸附量略有降低。黑果腺肋花楸多酚中主要为黄酮类化合物,其中含有大量酚羟基,呈弱酸性,在酸性条件下溶解度降低,从而利于大孔树脂对多酚的吸附 [21]。此外,不同pH值上样液极性会发生改变,从而影响XAD-7大孔树脂与黑果腺肋花楸多酚之间的作用力。
2.3.3 乙醇体积分数对大孔树脂静态解吸效果的影响

图4 乙醇体积分数对树脂解吸率的影响
Fig. 4 Effect of ethanol concentration on desorption rate
由图4可以看出,随着乙醇体积分数的增大,解吸率也随之提高,当乙醇体积分数达到95%时,解吸率最高。这是由于XAD-7大孔树脂属于弱极性大孔树脂,随着乙醇体积分数的增大,极性逐渐接近XAD-7大孔树脂,使得洗脱效果随之增强 [22]。
2.3.4 乙醇溶液pH值对大孔树脂静态解吸效果的影响
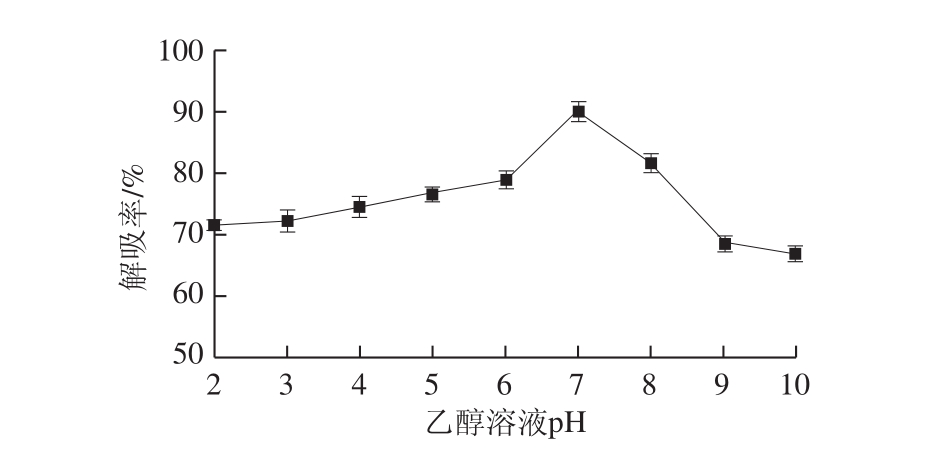
图5 乙醇溶液pH值对解吸率的影响
Fig. 5 Effect of pH of aqueous ethanol solution on desorption rate
使用体积分数为95%的乙醇溶液作为洗脱剂,分别在不同pH值条件下对充分吸附黑果腺肋花楸多酚的XAD-7大孔树脂进行静态解吸。由图5可知,pH值在2~7的范围内,随pH值的升高黑果腺肋花楸多酚解吸效果明显增强,并在pH 7时达到最大值;当pH值大于7时,黑果腺肋花楸多酚解吸效果随pH值增加而减弱。因此,洗脱剂最佳pH值选为7。
2.4 XAD-7大孔树脂动态吸附-解吸条件优化
2.4.1 上样流速和上样量对大孔树脂动态吸附效果的影响
当流出液中多酚质量浓度达到原液中多酚质量浓度的10%时,即为泄漏点 [23]。如图6所示,将流速分别设为1、2、3、4、5 mL/min,其泄漏点分别出现在600、560、370、290、250 mL附近。随着上样流速的增加,到达泄漏点时的上样量逐渐减小。由于流速过快,会使得黑果腺肋花楸多酚分子没有足够的时间被大孔树脂内表面吸附,导致吸附效果降低 [24]。而流速过低,会延长实验周期。综合考虑,选择2 mL/min作为最佳上样流速。根据图6,参照上样流速为2 mL/min的吸附曲线,可以确定,此流速条件下最佳上样量应为560 mL。

图6 不同流速的动态吸附曲线
Fig. 6 Dynamic adsorption curves at different flow rates
2.4.2 蒸馏水洗脱用量对大孔树脂动态解吸效果的影响
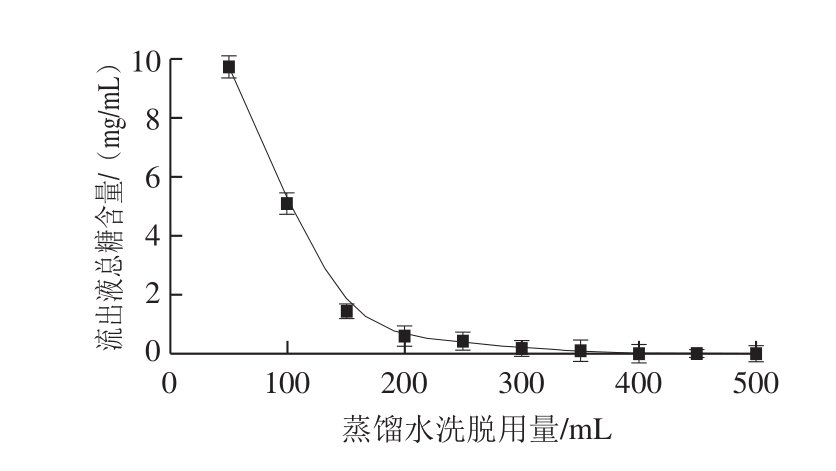
图7 水洗曲线
Fig. 7 Water flushing curve
由图7所示,随着蒸馏水洗脱用量的增加,流出液中总糖的含量显著降低。当蒸馏水洗脱用量达到250 mL时,层析柱中多糖等杂质基本被完全洗脱。此时流出液已无颜色,说明未被吸附的多酚类物质已被洗脱干净。为彻底洗脱层析柱中杂质及未被吸附的多酚类物质,将蒸馏水洗脱用量定为350 mL。
2.4.3 洗脱流速及洗脱体积对大孔树脂动态解吸效果的影响
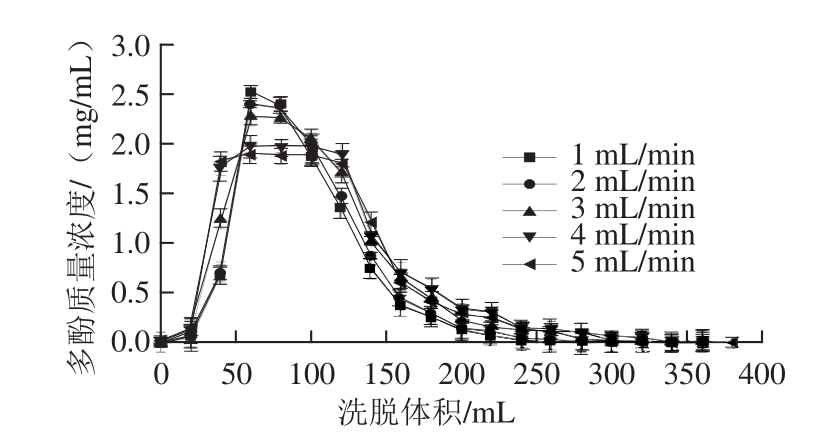
图8 洗脱流速及洗脱体积对洗脱效果的影响
Fig. 8 Effect of desorption flow rate on desorption efficiency
在相同吸附条件下,考察不同洗脱流速对XAD-7大孔树脂洗脱效果的影响,由图8可以看出,黑果腺肋花楸多酚洗脱液流速越快,其多酚峰形越宽,且拖尾现象越明显,从而导致洗脱体积增加。而洗脱流速过慢则会相应延长洗脱时间,综合考虑,选择最佳洗脱流速为2 mL/min [25]。根据图8,参照洗脱流速为2 mL/min的解吸曲线,可以确定,此流速条件下最佳洗脱体积应为300 mL。
2.5 黑果腺肋花楸多酚纯度的测定结果
使用福林-酚比色法,分别对黑果腺肋花楸多酚粗提物和XAD-7大孔树脂纯化后多酚进行测定。结果表明,经过XAD-7大孔树脂动态吸附-解吸纯化后,多酚纯度由11.62%提高到64.37%,表明XAD-7大孔树脂对于黑果腺肋花楸多酚纯化效果较好。
通过对比AB-8、D101、D1400、S-8、X-5、XAD-7大孔树脂对黑果腺肋花楸多酚吸附-解吸的效果发现,XAD-7大孔树脂对于黑果腺肋花楸多酚粗提物能够较好地纯化其中多酚类物质,其静态最佳吸附-解吸工艺条件为:吸附时间4 h、解吸时间2 h、上样液质量浓度3.6 mg/mL、上样液pH 4、乙醇体积分数95%、乙醇溶液pH 7;XAD-7大孔树脂对黑果腺肋花楸多酚动态吸附-解吸最佳工艺条件为:上样流速2 mL/min、上样量560 mL、蒸馏水洗脱用量350 mL、洗脱流速2 mL/min、洗脱体积300 mL。在此条件下,黑果腺肋花楸多酚纯度由11.62%提高到64.37%,表明XAD-7大孔树脂对于黑果腺肋花楸多酚具有较好的纯化效果。此外XAD-7大孔树脂在经过多次吸附-解吸,其纯化效果依然良好。说明本方法制得的黑果腺肋花楸多酚产品纯度较高,可为工业化的实际生产以及对于黑果腺肋花楸多酚的进一步研究提供理论依据。
参考文献:
[1] KIM B, KU C S, PHAM T X, et al. Aronia melanocarpa (chokeberry)polyphenol-rich extract improves antioxidant function and reduces total plasma cholesterol in apolipoprotein E knockout mice[J]. Nutrition Research, 2013, 33: 406-413. DOI:10.1016/j.nutres.2013.03.001.
[2] JAN O, ANETA W. Aronia melanocarpa phenolics and their antioxidant activity[J]. European Food Research and Technology. 2005, 221: 809-813. DOI:10.1007/s00217-005-0002-5.
[3] HELLE W, MARIE B U, VIKTORIA N, et al. Anthocyanins,proanthocyanidins and total phenolics in four cultivars of aronia: antioxidant and enzyme inhibitory effects[J]. Journal of Functional Foods, 2014, 7: 746-752. DOI:10.1016/j.jff.2014.02.006.
[4] SEOK J H, WON B Y, LEE O, et al. Radical-scavenging-linked antioxidant activities of extracts from black chokeberry and blueberry cultivated in Korea[J]. Food Chemistry, 2014, 146: 71-77.
DOI:10.1016/j.foodchem.2013.09.035.
[5] BENYENUTI S, PELLATL F, MELEGARI M, et al. Polyphenols,anthocyanins, ascorbic acid, and radical scavenging activity of Rubus,Ribes, and Aronia[J]. Journa of Food Science, 2004, 69(3): 164-169.
DOI:10.1111/j.1365-2621.2004.tb13352.x.
[6] LEE J E, KIM G S, PARK S, et al. Determination of chokeberry (Aronia melanocarpa) polyphenol components using liquid chromatography-tandem mass spectrometry: overall contribution to antioxidant activity[J]. Food Chemistry, 2014, 146: 1-5. DOI:10.1016/ j.foodchem.2013.09.029.
[7] 骆党委, 叶静, 黄雅燕, 等. AB-8大孔吸附树脂精制芦柑皮总黄酮及黄酮类化合物的分离[J]. 食品科学, 2014, 35(6): 30-35.
DOI:10.7506/spkx1002-6630-201406006.
[8] 李斌, 雷月, 孟宪军, 等. 响应面试验优化超声波辅助提取蓝靛果多酚工艺及其抗氧化活性[J]. 食品科学, 2015, 36(22): 33-39.
DOI:10.7506/spkx1002-6630-201522006.
[9] 令博, 王捷, 吴洪斌, 等. 葡萄皮渣多酚超声波辅助提取工艺响应面法优化及抗氧化活性研究[J]. 食品科学, 2011, 32(18): 24-29.
[10] 冯进, 曾晓雄, 李春阳. 响应面法优化蓝莓叶多酚提取工艺[J]. 食品科学, 2013, 34(4): 59-64.
[11] SILVA E M, ROGEZ H, LARONDELLE Y. Optimization of extraction of phenolics from Ingae dulis leaves using response surface methodology[J]. Separation and Purification Technology, 2007, 55(3): 381-387. DOI:10.1016/j.seppur.2007.01.008.
[12] 王旭苹, 杨磊, 杨小兰, 等. 大孔树脂纯化酒花多酚及其组成分析[J]. 食品科学, 2013, 34(22): 15-20. DOI:10.7506/spkx1002-6630-201322004.
[13] 唐丽丽, 刘邻渭, 孙丽芳, 等. 大孔树脂对石榴皮中多酚物质的吸附研究[J]. 食品研究与开发, 2011, 32(5): 48-51.
[14] 冯进, 李敏, 曾晓雄, 等. 大孔树脂纯化蓝莓叶多酚及其组成分析[J]. 食品科学, 2013, 34(10): 86-91. DOI:10.7506/spkx1002-6630-201310019.
[15] 安晓婷, 周涛, 李春阳, 等. 大孔树脂纯化蓝莓果渣多酚及其组成分析[J]. 食品科学, 2013, 34(20): 1-6. DOI:10.7506/spkx1002-6630-201320001.
[16] 王晓林, 薛健飞, 陈帅, 等. 大孔树脂法纯化锦灯笼宿萼总黄酮的工艺[J]. 食品科学, 2014, 35(14): 58-61. DOI:10.7506/spkx1002-6630-201414011.
[17] 库咏峰, 黄品鲜, 刘雄民, 等. 大孔吸附树脂法分离纯化肉桂总黄酮的工艺优化[J]. 食品科学, 2013, 34(24): 19-24. DOI:10.7506/ spkx1002-6630-201324004.
[18] 张桂, 赵国群. 超声波萃取植物多糖的研究[J]. 食品科学, 2005,26(9): 302-305.
[19] 毕洁, 杨庆利, 于丽娜, 等. 大孔树脂纯化碱提花生壳总黄酮[J]. 食品科学, 2011, 36(2): 197-202.
[20] 胡志军, 郝利君, 王南溪, 等. D-101大孔吸附树脂分离纯化橘皮中的黄酮类物质[J]. 食品科学, 2010, 31(8): 65-69.
[21] 徐青, 卢莹莹, 辛建美, 等. 大孔树脂吸附分离海芦笋中黄酮类化合物工艺[J]. 食品科学, 2011, 32(2): 115-119.
[22] 吕春茂, 包静, 孟宪军, 等. HPD-700型大孔树脂对野生越橘花色苷分离的研究[J]. 食品科学, 2012, 33(10): 78-83.
[23] 刘长江, 栾云峰, 王菲, 等. 大孔吸附树脂分离纯化软枣猕猴桃总黄酮[J]. 食品科学, 2011, 32(12): 145-149.
[24] 董琦, 高珊, 曹龙奎. 大孔树脂纯化桦褐孔菌多酚及其成分分析[J].食品科学, 2015, 36(22): 131-136. DOI:10.7506/spkx1002-6630-201522024.
[25] 顾采琴, 谢琳琳, 张织芬, 等. 香蕉皮黄酮的分离纯化及抑菌活性研究[J]. 食品科学, 2013, 34(16): 98-102. DOI:10.7506/spkx1002-6630-201316020.
Macroporous Adsorption Resin for the Purification of Polyphenols from Aronia melanocarpa Berries
LI Bin
1, GAO Ningxuan
1, LIU Hui
2, MENG Xianjun
1, ZHANG Qi
1, JIAO Xinyao
1, LI Enhui
1, CHOU Shurui
1, ZHANG Ye
1, CHEN Shifu
3
(1. College of Food Science, Shenyang Agricultural University, Shenyang 110161, China;2. Shenyang Free Trade Zone Entry-Exit Inspection and Quarantine Bureau, Shenyang 110169, China;3. Liaoning Fukangyuan Aroniamelanocarpa Technology Development Co. Ltd., Haicheng 114200, China)
Abstract:In this study, six different macroporous adsorption resins were evaluated for their use to purify polyphenols from Aronia melanocarpa berries. Macroporous resin XAD-7 was selected as the most suitable one. The purification parameters optimized by static adsorption and desorption tests were as follows: adsorption and desorption time, 4 and 2 h, respectively;sample concentration, 3.6 mg/mL; sample pH, 4; and desorption solvent, 95% ethanol (pH 7). The best purification parameters optimized by dynamic adsorption and desorption tests were as follows: sample loading amount, 560 mL; flow rate, 2 mL/min; washing the column with 350 mL of water; and subsequent elution with an eluent volume of 300 mL at 2 mL/min flow rate. Under these conditions, the purity of polyphenols from A. melanocarpa was improved from 11.62% to 64.37%, indicating that macroporous resin XAD-7 has a better effect in purifying polyphenols from A. melancarpa.
Key words:Aronia melanocarpa; polyphenols; macroporous resin; purification
DOI:10.7506/spkx1002-6630-201616011
中图分类号:TS209
文献标志码:A
文章编号:1002-6630(2016)16-0069-06
引文格式:
李斌, 高凝轩, 刘辉, 等. 大孔树脂纯化黑果腺肋花楸多酚的工艺优化[J]. 食品科学, 2016, 37(16): 69-74. DOI:10.7506/ spkx1002-6630-201616011. http://www.spkx.net.cn
LI Bin, GAO Ningxuan, LIU Hui, et al. Macroporous adsorption resin for the purification of polyphenols from Aronia melanocarpa berries[J]. Food Science, 2016, 37(16): 69-74. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201616011. http://www.spkx.net.cn
收稿日期:2016-03-22
基金项目:辽宁省高等学校优秀人才支持计划项目(2014108);公益性行业(农业)科研专项(201303073-04);沈阳农业大学天柱山英才计划项目(2014)
作者简介:李斌(1979—),男,副教授,博士,研究方向为浆果深加工及功能性成分。E-mail:libinsyau@163.com