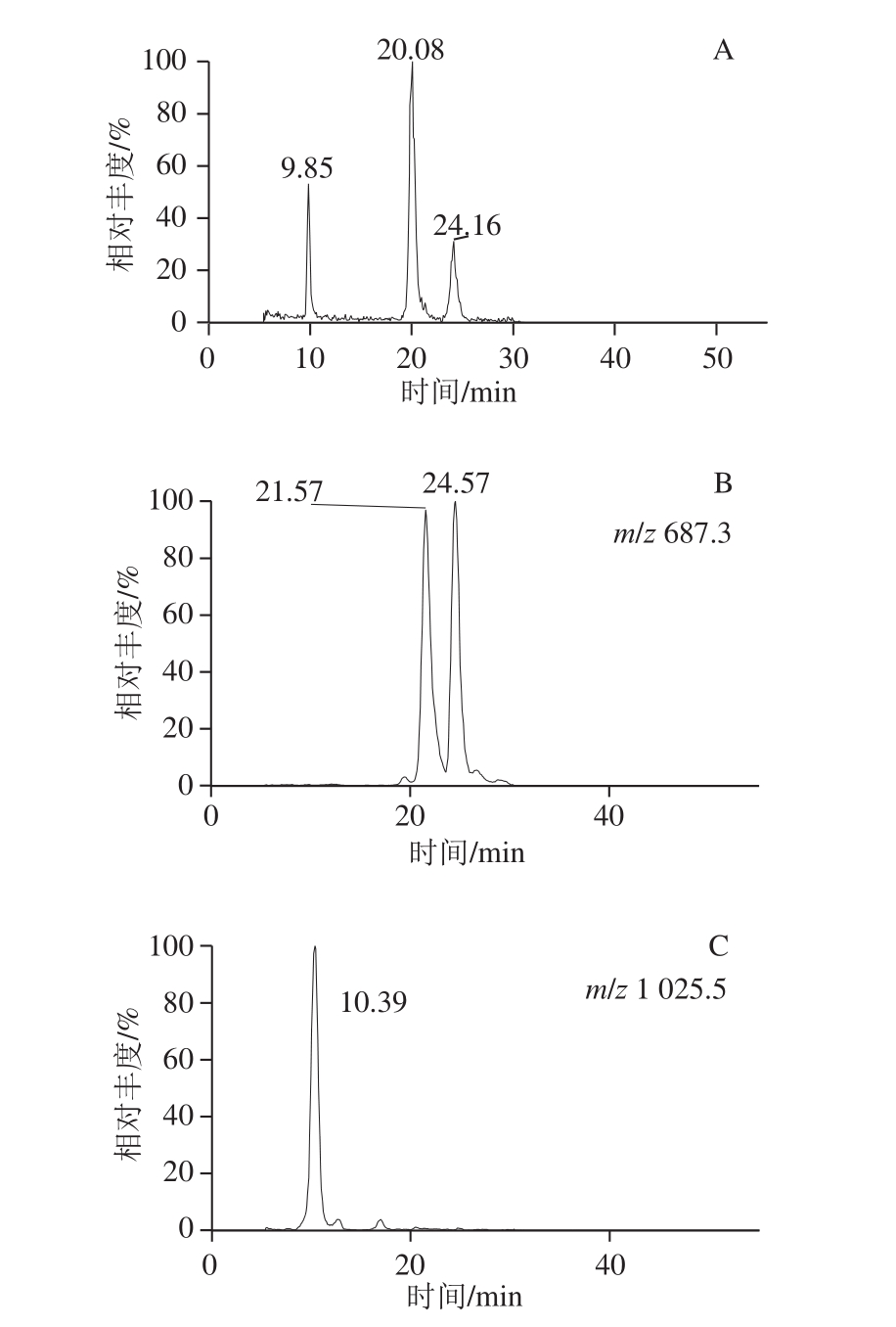
图1 AGSP对照品的二糖和四糖PMP衍生物(A)、AGSP样品降解产物的二糖PMP衍生物(B)和四糖PMP衍生物(C)选择离子色谱图
Fig. 1 Chromatograms of PMP-labeled disaccharides (A), PMP-labeled tetrasaccharide (B) and PMP-TS tetrasaccharide (C) in AGSP hydrolysate
鲁姣姣 1,2,3,艾春青 1,2,3,温成荣 1,2,3,徐 鑫 1,张 豹 1,宋 爽 1,2,3,*
(1.大连工业大学食品学院,辽宁 大连 116034;2.国家海洋食品工程技术研究中心,辽宁 大连 116034;3.海洋活性多糖开发应用技术国家地方联合工程实验室,辽宁 大连 116034)
摘 要:为考察鲍鱼性腺硫酸多糖(abalone gonad sulfated polysaccharide,AGSP)在弱酸降解过程中产生的寡糖,对不同酸浓度的降解产物1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)衍生化后,进行高效液相色谱-质谱(high performance liquid chromatography-mass spectrometry,HPLC-MS n)法检测。在AGSP的弱酸降解产物中发现了2 种二糖(disaccharides,DS1、DS2)和1 种四糖(tetrasaccharide,TS)。2 种二糖均是由己糖醛酸通过糖苷键连于己糖,其中DS2的结构确定为β-GlcA(1→2)-Man,而TS是由2 个DS2连接而成。在100 ℃加热1 h的条件下,在0.1~2.0 mol/L的三氟乙酸浓度范围内,这3 种寡糖的产率都随着酸浓度的增加呈升高趋势。
关键词:鲍鱼;多糖;酸降解;质谱;寡糖
近些年来,随着国内外学者对多糖研究的不断深入,发现多糖具有抗肿瘤、提高免疫力、降血糖、抗衰老等多种功效 [1-4]。但由于多糖分子质量大、分子体积大、水溶性差,这些缺点极大地限制了多糖生物活性的发挥 [5]。而大量研究 [6-7]表明,当采用降解的手段有效降低功能多糖的分子质量后,生物活性常常有显著提升。弱酸降解法是制备低分子质量多糖的常用手段 [8-11],但需要注意的是,在制备低分子质量多糖产物的同时,还可能产生小分子寡糖。寡糖由于分子质量小,更易吸收,生物利用度更高,所以可能具有更为显著的生理活性,包括抗病毒、抗氧化、抗血栓和抗凝血活性 [12-15]等。但是在以往的报道中,研究者们往往只关注于弱酸降解产生的低分子质量多糖,而忽略了同时产生的小分子寡糖副产物。为了保证多糖经弱酸降解处理的产品的品质和安全,本研究将考察弱酸降解时产生的小分子寡糖。
多糖降解产生的寡糖可能存在多种同分异构体,而且缺乏生色团或荧光团,直接检测较为困难,常常采用柱前或柱后衍生化色谱法分离和检测,以改善其分离选择性和提高检测灵敏度。1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)柱前衍生化法因反应条件较温和、产物无立体异构、紫外和质谱检测灵敏度较高,得到较为广泛的应用 [16-19]。对于寡糖链的结构分析,质谱具有灵敏度高、可获得多种结构信息和适于分析混合物等优点,通过与衍生化方法及色谱分离技术联用,成为水解产物中寡糖定性定量的理想手段 [20]。
鲍鱼性腺多糖具有抗凝血 [21]、抗氧化 [22]、增强免疫力 [23]、抗癌 [24]等多种活性。本研究分析一种鲍鱼性腺硫酸多糖(abalone gonad sulfated polysaccharide,AGSP)在弱酸降解过程中产生的寡糖,考察酸降解条件对寡糖产率的影响,为鲍鱼性腺多糖的高效合理利用提供科学依据。
1.1 材料与试剂
AGSP由本实验前期提取制备自鲍鱼性腺 [25]。
1-苯基-3-甲基-5-吡唑啉酮(化学纯) 国药集团化学试剂有限公司;三氟乙酸(分析纯)、乙酸铵(色谱纯) 美国阿拉丁公司;氨水、氯仿(均为分析纯)天津市石英钟厂霸州市化工分厂;甲醇、乙腈(均为色谱纯) 美国Specturm Chemical MFG公司。
1.2 仪器与设备
AL204型电子天平 梅特勒-托利多仪器(上海)有限责任公司;电热鼓风干燥箱、HH-S型水浴锅 巩义市予华仪器有限责任公司;XW-80型旋涡混合器 上海精科实业有限公司;LXQ型液相色谱-线性离子阱质谱仪(配有电喷雾离子源及Xcalibur数据处理系统) 美国Thermo Scientific公司;CoolSafe 110-4/Scan Speed 40冻干浓缩一体机 丹麦Labogene公司。
1.3 方法
1.3.1 酸水解
称取AGSP样品15 mg,用1.00 mL水溶解。8 个5 mL具塞水解管中各加入100 μL AGSP溶液,然后再分别加入25、50、125、200、275、350、425、500 μL 4 mol/L三氟乙酸溶液,最后均补水至1.00 mL,使三氟乙酸的最终浓度分别为0.1、0.2、0.5、0.8、1.1、1.4、1.7、2.0 mol/L。并称取AGSP标准品5 mg于5 mL具塞水解管中,加入1.00 mL 2 mol/L三氟乙酸溶液。密封后,在100 ℃烘箱中水解1 h。冷却至室温后采用冻干浓缩一体机除去溶剂,然后加入0.5 mL水再次冷冻浓缩除去溶剂,重复3 次,以除去三氟乙酸。
1.3.2 PMP柱前衍生化
加入400 μL的氨水溶解水解管中的残渣,再加入400 μL 0.3 mol/L PMP甲醇溶液,70 ℃水浴30 min,完成衍生化反应。然后加入1 mL甲醇,离心浓缩除去溶剂,重复3 次,以除去氨水。加入1 mL水溶解残渣,再加入1 mL氯仿,振荡后静置,除去氯仿,重复萃取3 次以除去多余的PMP,水层作为供试液。经0.22 μm微孔滤膜过滤后,进行高效液相色谱-质谱(high performance liquid chromatography-mass spectrometry,HPLC-MS n)分析。
1.3.3 HPLC-MS n分析
HPLC条件:Silgreen ODS C 18色谱柱(250 mm× 4.6 mm,5 μm);柱温30 ℃;流动相20 mmol/L乙酸铵-乙腈(78∶22,V/V)溶液;流速1 mL/min。
MS条件:电喷雾离子源;喷雾电压4.5 kV;毛细管温度275 ℃;毛细管电压37 V;鞘气压力40 arb;辅助气压力10 arb;正离子模式检测;扫描方式为全扫描;质量扫描范围m/z 100~2 000。
2.1 寡糖的鉴定
虽然酸降解特异性差,但不同单糖的糖苷键水解的难易程度还是存在差异,其中糖醛酸的糖苷键最难水解 [26],所以在含糖醛酸多糖的水解过程中能够大量生成非还原端为糖醛酸的二糖,同时生成四糖等偶数寡糖的几率也相对增加。本实验通过对降解产物PMP衍生化后,HPLC-离子阱-MS检测,从AGSP的酸降解产物中共发现了2 种二糖和1 种四糖。
2 种二糖PMP衍生物准分子离子均为m/z 687[己糖+己糖醛酸+2PMP-2H 2O+H] +,保留时间分别在21 min 和24 min左右,如图1所示,相应二糖命名为DS1和DS2。如图2所示,DS1和DS2的PMP衍生物的质谱裂解模式基本一致,m/z 687的分子离子峰在二级质谱产生m/z 511[己糖+2PMP-H 2O+H] +的子离子,而m/z 511的离子在三级质谱裂解出m/z 175[PMP+H] +的子离子。所以推断DS1和DS2均为己糖醛酸连于己糖形成的二糖。另外,通过与前期已鉴定的二糖衍生物 [25]的保留时间比对,确定DS2为β-GlcA(1→2)-Man,是AGSP主链裂解的二糖,结构如图3所示。

图1 AGSP对照品的二糖和四糖PMP衍生物(A)、AGSP样品降解产物的二糖PMP衍生物(B)和四糖PMP衍生物(C)选择离子色谱图
Fig. 1 Chromatograms of PMP-labeled disaccharides (A), PMP-labeled tetrasaccharide (B) and PMP-TS tetrasaccharide (C) in AGSP hydrolysate

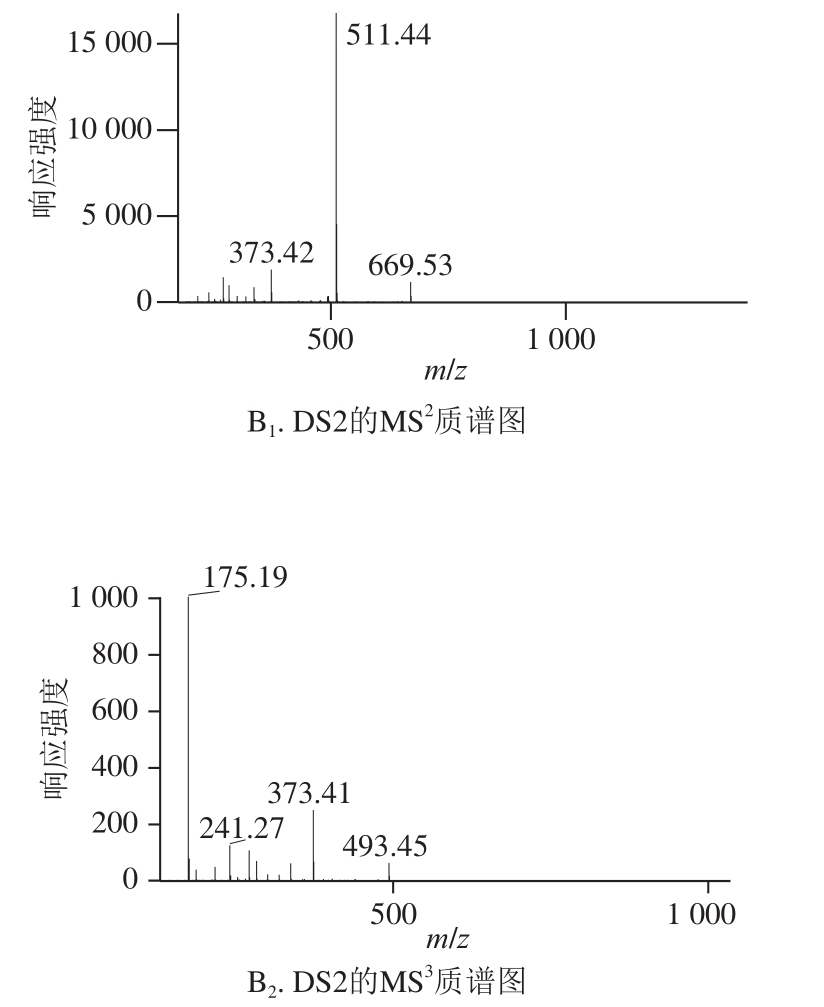
图2 DS1和DS2的MS
2和MS
3质谱图
Fig. 2 MS spectra of DS1 and DS2
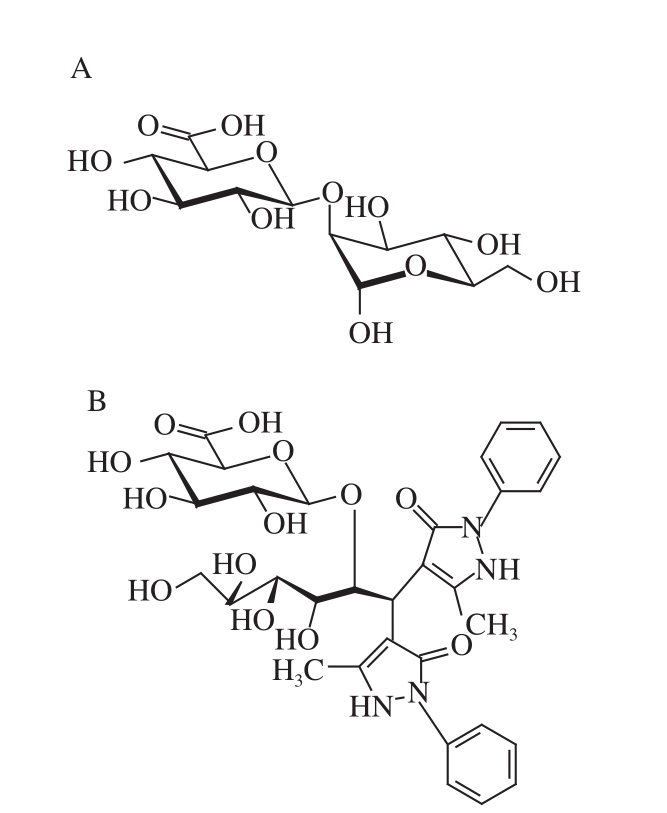
图3 DS2(A)和DS2的PMP衍生物(B)结构
Fig. 3 Structures of DS2 (A) and PMP-labeled DS2 (B)
在AGSP酸降解产物中发现的四糖命名为TS,它的PMP衍生物的质荷比为1 025.5[2己糖+2葡萄糖醛酸+ 2PMP-4H 2O+H] +,其在二级质谱中裂解出了m/z 849、687和511的子离子,而m/z 687的离子在三级质谱也裂解得到了m/z 511离子,如图4所示。由这些质谱信息可以推断出该四糖是由糖醛酸、己糖、糖醛酸、己糖依次连接而成,而进一步与前期已鉴定的四糖衍生物 [25]的保留时间的对比,可以确定其结构为β-GlcA(1→2)-α-Man (1→4)-β-GlcA(1→2)-α-Man,如图5所示,是由2 个DS2连接而成。本研究中,还对HPLC-MS n中的其他信号较强离子进行了分析,发现了一些单糖PMP衍生物,但并未发现其他寡糖衍生物。由于糖醛酸的糖苷键不易被断裂,所以AGSP降解产生的寡糖含偶数单糖,除了二糖、四糖,还可能有六糖、八糖等,但可能由于聚合度较大的寡糖结构中存在的己糖糖苷键较多,易被酸进一步降解,所以产率很低,故未被检测出。另外,在弱酸降解条件下AGSP能够生成一些低分子质量多糖 [25],但由于它们分子质量大,难溶于甲醇溶液,在PMP衍生化中发生沉降,所以未显示出信号。

图4 TS PMP衍生物的质谱图
Fig. 4 MS spectra of PMP-labeled TS
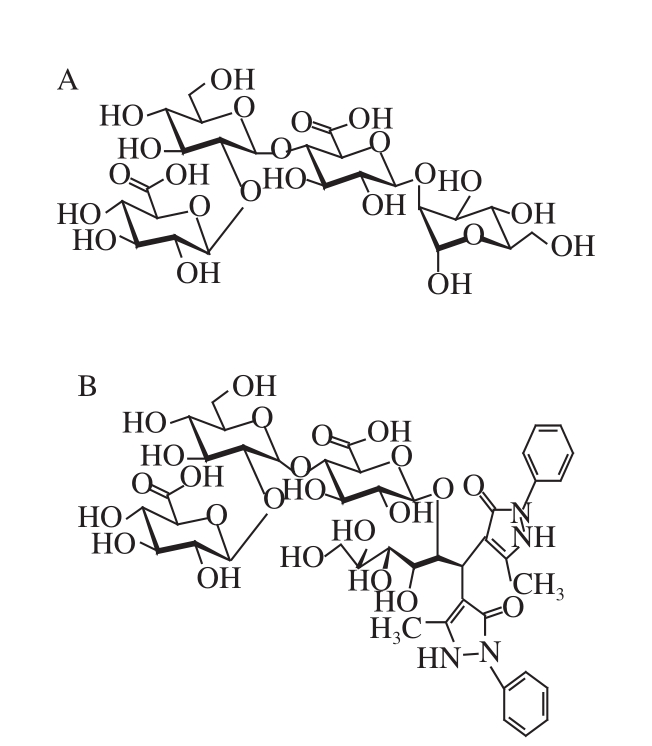
图5 TS1(A)及其PMP衍生物(B)的结构
Fig. 5 Structures of TS1 (A) and PMP-labeled TS1 (B)
2.2 酸浓度对寡糖产率的影响
因为二糖和四糖的生成需要糖醛酸的糖苷键保持而非糖醛酸的糖苷键全部或部分断裂,所以二糖和四糖的产率与酸浓度并不一定呈正相关。本研究考察在较弱的酸降解条件范围内,二糖和四糖的产率的变化情况。
AGSP经不同浓度的三氟乙酸降解获得的产物,经PMP-HPLC-MS n检测后,分别从总离子流中提取二糖和四糖PMP衍生物的准分子离子m/z 687.3和m/z 1 025.5,对相应色谱峰进行积分,根据峰面积比较各寡糖在不同酸浓度降解时的产率。如图6所示,3 种寡糖均是在最低实验酸浓度为0.1 mol/L时产率最少,随着酸浓度的增加产率有明显的升高趋势,在最高实验浓度为2.0 mol/L时达到最高。其中,DS1产率随酸浓度变化最为敏感,这可能与它的糖苷键的特性有关。DS2和TS产率的变化趋势相似,由于TS是由2 个DS2连接而成,对GlcA和Man的糖苷键的裂解情况影响着这2 种寡糖的产率。
由以上结果可知,在弱酸降解的条件下能够产生二糖和四糖寡糖片段,而且在实验的条件范围内,产量随酸浓度的增加呈升高趋势。弱酸降解法常应用于降低多糖分子质量,本研究结果说明产物中除了低分子质量多糖,还可能产生一些小分子寡糖。由于小分子寡糖易吸收、生物利用度高 [27-28],而且可能具有更高的生物活性 [29-30],所以不能被忽视。
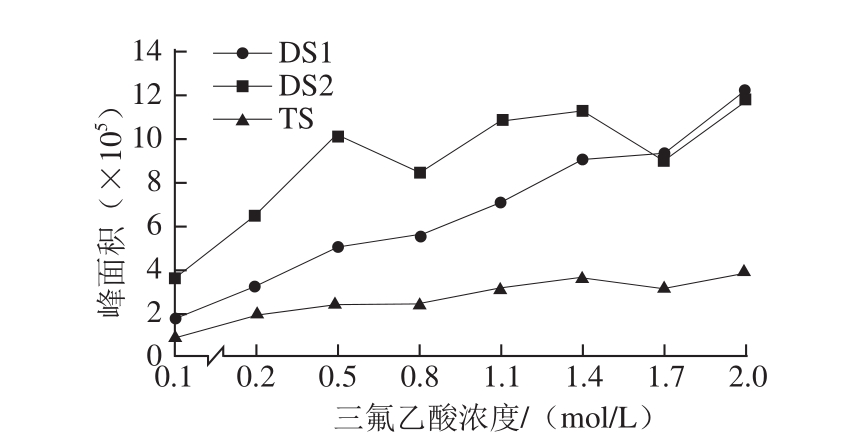
图6 三氟乙酸浓度对DS1、DS2和TS产率的影响
Fig. 6 Effects of trifluoroacetic acid concentration on the yields of DS1, DS2 and TS
通过PMP-HPLC-MS n检测发现,AGSP在弱酸降解时能够产生2 种二糖(DS1和DS2)和1 种四糖(TS),2 种二糖均是由己糖醛酸通过糖苷键连于己糖,其中DS2结构为β-GlcA(1→2)-Man,TS为β-GlcA (1→2)-α-Man(1→4)-β-GlcA(1→2)-α-Man。而且,在100 ℃加热1 h条件下,在0.1~2.0 mol/L的三氟乙酸浓度范围内,这3 种寡糖的产率都随酸浓度的增加呈升高趋势。本研究的结果说明,在采用弱酸降解AGSP制备低分子质量多糖时,产物中同时还会有一些小分子的寡糖,在开发利用鲍鱼性腺多糖时应予以考虑。对这些寡糖的功能活性还有待进一步研究。
参考文献:
[1] HUANG T T, LIN J, CAO J F, et al. An exopolysacchaide from Trichoderma pseudokoningii and its apoptosis activity on human leukemia K562 cells[J]. Carbohydrate Polymers, 2012, 89(2): 701-702. DOI:10.1016/j.carbpol.2012.03.079.
[2] CHENG H R, LI S S, FAN Y Y, et al. Comparative studies of the antiproliferative effects of ginseng polysaccharides on HT-29 human colon cancer cells[J]. Medical Oncology, 2011, 28(1): 175-181.
DOI:10.1007/s12032-010-9449-810.
[3] REN C J, ZHANG Y, CUI W Z, et al. A polysaccharide extract of mulberry leaf ameliorates hepatic glucose metabolism and insulin signaling in rats with type 2 diabetes induced by high fat-diet and streptozotocin[J]. International Journal of Biological Macromolecules,2014, 72: 951-959. DOI:10.1016/j.ijbiomac.2014.09.060.
[4] ZENG W C, ZHANG Z, JIA L R. Antioxidant activity and characterization of antioxidant polysaccharides from pine needle (Cedrus deodara)[J]. Carbohydrate Polymers, 2014, 108: 58-64.
DOI:10.1016/j.carbpol.2014.03.022.
[5] 陈蕾, 吴皓. 多糖降解方法的研究进展[J]. 中华中医药学刊, 2008,26(1): 133-135.
[6] 郭峰君, 胡靖, 赵雪. 海带岩藻聚糖硫酸酯降解及基本结构分析[J]. 食品工业科技, 2014, 35(18): 93-97. DOI:10.13386/ j.issn1002-0306.2014.18.011.
[7] ZHANG Z S, WANG X M, ZHAO M X, et al. Free-radical degradation by Fe 2+/Vc/H 2O 2and antioxidant activity of polysaccharide from Tremella fuciformis[J]. Carbohydrate Polymers, 2014, 112: 578-582. DOI:10.1016/j.carbpol.2014.06.030.
[8] LI H Y, MAO W J, HOU Y J, et al. Preparation, structure and anticoagulant activity of a low molecular weight fraction produced by mild acid hydrolysis of sulfated rhamnan from Monostroma latissimum[J]. Bioresource Technology, 2012, 114: 414-418.
DOI:10.1016/j.biortech.2012.03.025.
[9] YAMADA T, OGAMO A, SAITO T, et al. Preparation and anti-HIV activity of low-molecular-weight carrageenans and their sulfated derivatives[J]. Carbohydrate Polymers, 1997, 32(1): 51-55.
[10] WU M Y, HUANG R, WEN D D. Structure and effect of sulfated fucose branches on anticoagulant activity of the fucosylated chondroitin sulfate from sea cucumber Thelenata ananas[J]. Carbohydrate Polymers, 2012, 87(1): 862-868. DOI:10.1016/ j.carbpol.2011.08.082.
[11] LI B, LIU S, XING R G, et al. Degradation of sulfated polysaccharides from Enteromorpha prolifera and their antioxidant activities[J]. Carbohydrate Polymers, 2013, 92(2): 1991-1996. DOI:10.1016/ j.carbpol.2012.11.088
[12] KATSURAYA K, NAKASHIMA H. Synthesis of sulfated oligosaccharide glycosides having high anti-HIV activity and the relationship between activity and chemical structure[J]. Carbohydrate Research, 1999, 315(3/4): 234-242.
[13] YUAN H M , ZHANG W W, LI X, et al. Preparation and in vitro antioxidant activity of κ-carrageenan oligosaccharides and their oversulfated, acetylated and phosphorylated derivatives[J]. Carbohydrate Research, 2005, 340(4): 685-692. DOI:10.1016/ j.carres.2004.12.026.
[14] CHEVOLOT L, MULLOY B, RATISKOL J, et al. A disaccharide repeat unit is the major structure in fucoidans from two species of brown algae[J]. Carbohydrate Research, 2001, 330(4): 529-535.
[15] 李红燕. 宽礁膜抗凝血活性多糖及其寡糖的制备和结构研究[D]. 青岛: 中国海洋大学, 2011.
[16] HONDA S, SUZUKI S, TAGA A. Analysis of carbohydrates as 1-phenyl-3-methyl-5-pyrazolonederivatives by capillary/microchip electrophoresis and capillary electrochromatography[J]. Journal of Pharmaceutical and Biomedical Analysis, 2003, 30: 1689-1714.
[17] 王仲孚, 张英, 林雪, 等. 1-苯基-3-甲基-5-吡唑啉酮(PMP)柱前衍生化寡糖链的HPLC分离及其激光解吸电离质谱分析[J]. 化学学报,2007, 65(23): 2761-2764.
[18] WU X D, JIANG W, LU J J, et al. Analysis of the monosaccharide composition of water-soluble polysaccharides from Sargassum fusiforme by high performance liquid chromatography/electrospray ionisation mass spectrometry[J]. Food Chemistry, 2014, 145: 976-983.
DOI:10.1016/j.foodchem.2013.09.019.
[19] CAO J L, WEN C R, LU J J, et al. Characterization of acidic polysaccharides from the mollusks through acid hydrolysis[J]. Carbohydrate Polymers, 2015, 130: 268-274. DOI:10.1016/ j.carbpol.2015.05.006
[20] 王承健, 王仲孚. 糖链的生物质谱分析[J]. 生命科学, 2011, 23(6): 569-576. DOI:10.13376/j.cbls/2011.06.008.
[21] 徐美玲, 孙黎明, 周大勇, 等. 皱纹盘鲍性腺多糖体外免疫活性和抗凝血活性的研究[J]. 水产科学, 2009, 28(9): 498-500.
[22] ZHU B W, YANG J F, LI D M, et al. Structure investigation of polysaccharide from abalone, Haliotis discus hannai ino viscera[J]. Journal of Biotechnology, 2008, 136: 591-592. DOI:10.1016/ j.jbiotec.2008.07.1193.
[23] 沈鸣, 陈建伟. 氨基多糖的药理研究进展[J]. 上海医药, 2001, 22(6): 268-269.
[24] 朱莉莉, 孙黎明. 鲍鱼内脏蛋白多糖体内对H22肝癌的抑制作用[J].营养学报, 2009, 31(5): 478-485. DOI:10.13325/j.cnki.acta.nutr. sin.2009.05.027.
[25] WANG H X, ZHAO J, LI D M, et al. Structural investigation of an uronic acid-containing polysaccharide from abalone by graded acid hydrolysis followed by PMP-HPLC-MS nand NMR analysis[J]. Carbohydrate Research, 2015, 402: 95-101. DOI:10.1016/ j.carres.2014.10.010.
[26] DE K K, TIMELL T E. The acid hydrolysis of glycosides: Ⅳ. Hydrolysis of aldobiouronic acids[J]. Carbohydrate Research, 1967,4(2): 177-181.
[27] WANG W, ZHANG P, YU G L, et al. Preparation and anti-influenza a virus activity of κ-carrageenan oligosaccharide and its sulphated derivatives[J]. Food Chemistry, 2012, 133(3): 880-888. DOI:10.1016/ j.foodchem.2012.01.108.
[28] 牟海津. 酶法制备新κ-卡拉四、六糖的化学及生物学研究[D]. 青岛: 中国海洋大学, 2003.
[29] 卢穹宇. 两种方法降解的肝素寡糖的制备及其对HUVEC细胞因子分泌的影响[D]. 青岛: 山东大学, 2009.
[30] 张真庆, 江晓路, 管华诗. 寡糖的生物活性及海洋性寡糖的潜在应用价值[J]. 中国海洋药物, 2003, 22(3): 51-56.
Analysis of Oligosaccharides Released from Weak Acid Hydrolysis of Abalone Gonad Polysaccharide Using PMP-HPLC-MS n
LU Jiaojiao
1,2,3, AI Chunqing
1,2,3, WEN Chengrong
1,2,3, XU Xin
1, ZHANG Bao
1, SONG Shuang
1,2,3,*
(1. School of Food Science and Technology, Dalian Polytechnic University, Dalian 116034, China; 2. National Engineering Research Center of Seafood, Dalian 116034, China; 3. National and Local Joint Engineering Laboratory for Marine Bioactive Polysaccharide Development and Application, Dalian 116034, China)
Abstract:In order to investigate oligosaccharides released from abalone gonad sulfated polysaccharide (AGSP) through weak acid hydrolysis, hydrolysates obtained at different acid concentrations were labeled with 1-phenyl-3-methyl-5-pyrazolone (PMP), and then analyzed by high performance liquid chromatograph-mass spectrometry (HPLC-MS n). Two disaccharides (DS1 and DS2) and one tetrasaccharide (TS) were found in the AGSP hydrolysates. The two disaccharides were composed of a hexuronic acid linked to a hexose through a glucosidic bond. DS2 was deduced as β-GlcA(1→2)-Man,and TS was proposed as a dimer of DS2. In hydrolysis reaction with 0.1–2.0 mol/L trifluoroacetic acid at 100 ℃ for 1 h, the yields of the three oligosaccharides all increased with increasing acid concentration.
Key words:abalone; polysaccharide; acid hydrolysis; mass spectrometry; oligosaccharide
DOI:10.7506/spkx1002-6630-201616018
中图分类号:R931.77
文献标志码:A
文章编号:1002-6630(2016)16-0112-05
引文格式:
鲁姣姣, 艾春青, 温成荣, 等. PMP-HPLC-MS n法分析弱酸降解鲍鱼性腺多糖产生的寡糖[J]. 食品科学, 2016, 37(16): 112-116. DOI:10.7506/spkx1002-6630-201616018. http://www.spkx.net.cn
LU Jiaojiao, AI Chunqing, WEN Chengrong, et al. Analysis of oligosaccharides released from weak acid hydrolysis of abalone gonad polysaccharide using PMP-HPLC-MS n[J]. Food Science, 2016, 37(16): 112-116. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201616018. http://www.spkx.net.cn
收稿日期:2016-01-22
基金项目:国家自然科学基金青年科学基金项目(31301431;31501439);
辽宁省农业领域青年科技创新人才培养计划项目(2014002);辽宁省教育厅一般项目(L2014222)
作者简介:鲁姣姣(1992—),女,硕士研究生,研究方向为食品资源与综合利用。E-mail:angela2j@qq.com
*通信作者:宋爽(1981—),女,副教授,博士,研究方向为海洋活性多糖。E-mail:songs1008@163.com