利用DAD-HPLC和LC-MS法检测金丝小枣中黄酮类化合物
师仁丽
1,翟龙飞
1,于文龙
1,梁 娜
1,龚正斯
1,王向红
1,2,*
(1.河北农业大学食品科技学院,河北 保定 071001;2.河北省农产品加工工程技术研究中心,河北 保定 071001)
摘 要:采用二极管阵列高效液相色谱分离技术和液相色谱-质谱联用技术对金丝小枣中黄酮类物质进行分析和鉴别。液相色谱条件为:色谱柱为Hypersil BDS-C
18(250 mm×4.6 mm,5 μm),柱温30 ℃,甲醇-0.1%甲酸溶液为流动相,梯度洗脱,流速0.8 mL/min,进样量10 μL,采用270 nm和370 nm双波长检测。结果表明:金丝小枣中含有杨梅素、芦丁、槲皮素、异鼠李素4 种黄酮类物质,含量分别为40.90、8.40、32.60 μg/g和12.56 μg/g。并且在5~125 μg/mL范围内,该方法显示良好的线性关系和重复性,当信噪比为3时,检出限为1.23~1.73 ng/L。精密度实验的相对标准偏差为1.10%~4.31%,加标回收率为93.50%~106.70%(相对标准偏差为0.68%~2.90%)。由此可以看出:该方法样品前处理简单、回收率较高、精密度良好,是一种便捷且精确的分析方法,适用于金丝小枣中黄酮类化合物的检测。
关键词:高效液相色谱法;液相色谱-质谱联用;金丝小枣;黄酮
枣是鼠李科(Rhamnaceae)枣属(Ziziphus jujuba Mill.)植物的成熟果实,原产于中国,栽培已有4 000 a的历史
[1]。红枣营养价值高,且有很高的药用价值,是很重要的食用材料和经济产品,享有“营养保健丸、木本粮食”的美誉
[2]。由于其具有益心润肺、和脾健胃、益气生津、补血养颜之功能
[3]以及抗氧化、抗炎、抗癌、保护心肌
[4]的作用而被用作营养食品和传统药品。
大枣中化学成分复杂,自20世纪80年代以来,从大枣中发现的化合物已有70多种,主要有三萜酸、皂苷、生物碱、黄酮及糖苷类成分
[5]。李进伟等
[6]对5 种枣果进行了基本营养成分测定,结果表明5 种枣果中的还原糖、粗纤维、多酚含量均存在显著差异,矿物质、维生素含量也不同。王向红等
[7]对尖枣等9 种枣进行了基本营养成分测定,发现不同枣品种间各种营养成分差异显著。金丝小枣是众多枣品种中的一大类,河北省沧州市被命名为“中国金丝小枣之乡”
[8],金丝小枣具有果核细小、可食率达97%、可溶性固形物40%~45%、制干率55%左右、质脆细嫩、品质优良
[9]等特点。
黄酮类化合物是植物产生的一类次生代谢产物,是一类重要的天然化合物,对人体健康起着重要的作用。大量研究表明黄酮类物质具有降血压、降血脂、增大心脏血流量、增强心脏收缩、减少心脏搏动数、止咳祛痰、抗菌消炎的功效
[10]。对枣中黄酮类化合物的研究表明它具有清除超氧阴离子自由基、羟自由基、1,1-二苯基-2-三硝基苯肼自由基的能力
[11-12],金银花的花茎中黄酮类化合物能抑制猪油氧化,清除超氧阴离子自由基、羟自由基
[13]。Georgetti等
[14]用化学荧光法分析测定了不同的黄酮类化合物,并确定了它们具有较强的抗氧化性。有研究
[15]表明,查尔酮、光果定对金黄色葡萄球菌、大肠杆菌、黑曲霉、毛霉有抑制作用。王尊民等
[16]采用培养基打孔法研究了梧桐花总黄酮的体外抗菌、抗病毒作用。郭芳彬
[17]在对蜂产品中的黄酮类化合物研究中得出槲皮素、芹菜素、山奈酚、木犀草素、鼠李素等物质具有抗癌作用。
以往较多的文献报道了枣中的黄酮类化合物,Li Jinwei等
[18]对金丝小枣的多糖进行了纯化以及对其免疫活性进行研究。Liu Jingjing等
[19]报道了酸枣中含有当药黄素。Pawlowska等
[20]报道了叙利亚枣果中含有槲皮素和山奈酚。顾利红等
[21]应用高效液相色谱(high-performance liquid chromatography,HPLC)法对7 种枣中芦丁含量进行了比较。本实验通过二极管阵列检测器-HPLC(diode array detector-HPLC,DAD-HPLC)法和液相色谱-质谱(liquid chromatography-mass spectrometry,LC-MS)法对金丝小枣中黄酮类化合物进行分离鉴定和分析,建立一种同时检测不同种黄酮类物质的快速、准确、灵敏的分析方法,为金丝小枣黄酮的开发和利用提供理论依据。
1 材料与方法
1.1 材料、试剂与仪器
金丝小枣 市购;8 种黄酮对照品 上海源叶生物科技有限公司;纯净水 乐百氏公司;甲醇(色谱纯) 美国Dikma公司;甲酸(色谱纯) 天津市标准科技有限公司。
BS-214D型电子分析天平 美国Sartorius公司;TGL-16G快速离心机 金坛市杰瑞尔电器有限公司;1200型HPLC仪、6420型HPLC-MS联用仪 美国安捷伦有限公司;RE-52A型旋转蒸发仪 上海亚荣生化仪器厂;KQ500DE型超声波清洗仪 昆山市超声仪器有限公司。
1.2 方法
1.2.1 金丝小枣样品溶液的制备
精密称取5 g干燥粉碎过40 目筛的金丝小枣粉,加入50 mL甲醇溶液,超声提取30 min,重复超声1 次。超声完毕后将滤液合并,3 500 r/min离心5 min,将离心后的上清液移入梨形瓶中,将离心液旋转蒸发至干,加入1 mL纯甲醇回溶,用有机微孔滤膜(0.45 μm)过滤,作为供试品溶液,储存在4 ℃条件下备用。
1.2.2 对照品溶液的配制
对照品储备液配制:分别精密称取2 mg芦丁、槲皮素、山奈酚、没食子酸、异鼠李素、木犀草素、儿茶素、杨梅素,用甲醇溶液定容至1 mL,配制成2 000 μg/mL对照品储备液。
混合对照品溶液配制:将配制好的8 种混合对照品溶液混合均匀,用移液管和移液枪分别吸取混合液0.02、0.10、0.20、0.25、0.50、1、2、2.50 mL,用甲醇定容至5 mL容量瓶中,配制成质量浓度1、5、10、12.5、25、50、100、125 μg/mL的混合对照品溶液,储存在4 ℃条件下,供HPLC分析。
1.2.3 DAD-HPLC和LC-MS检测
1.2.3.1 DAD-HPLC条件
色谱条件:Hypersil BDS-C
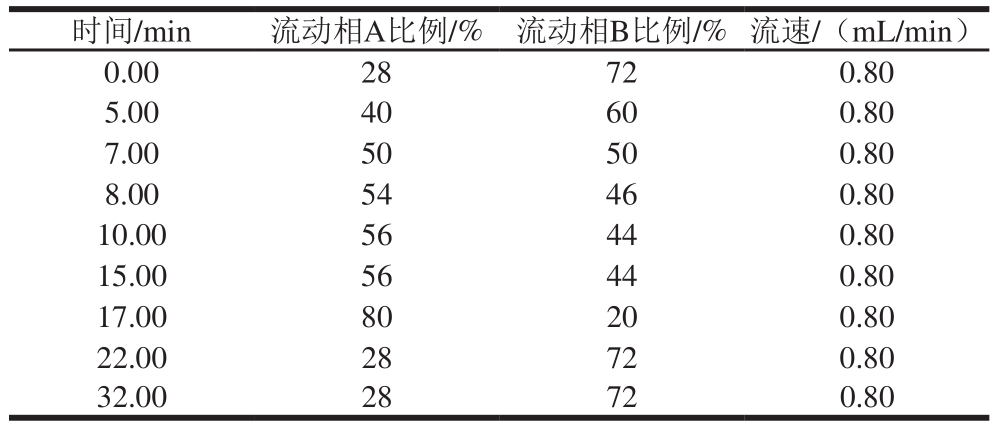
18色谱柱(250 mm×4.6 mm,5 μm);流动相:流动相A为甲醇、流动相B为0.1%甲酸溶液,采用梯度洗脱程序,如表1所示;流速0.80 mL/min;检测波长270、370 nm;柱温30 ℃;进样量10 μL。
表1 DAD-HPLC流动相梯度洗脱程序
Table 1 Mobile phase gradient elution program for DAD-HPLC
时间/min 流动相A比例/% 流动相B比例/% 流速/(mL/min)0.00 28 72 0.80 5.00 40 60 0.80 7.00 50 50 0.80 8.00 54 46 0.80 10.00 56 44 0.80 15.00 56 44 0.80 17.00 80 20 0.80 22.00 28 72 0.80 32.00 28 72 0.80
1.2.3.2 LC-MS分析
LC条件:Hypersil BDS-C
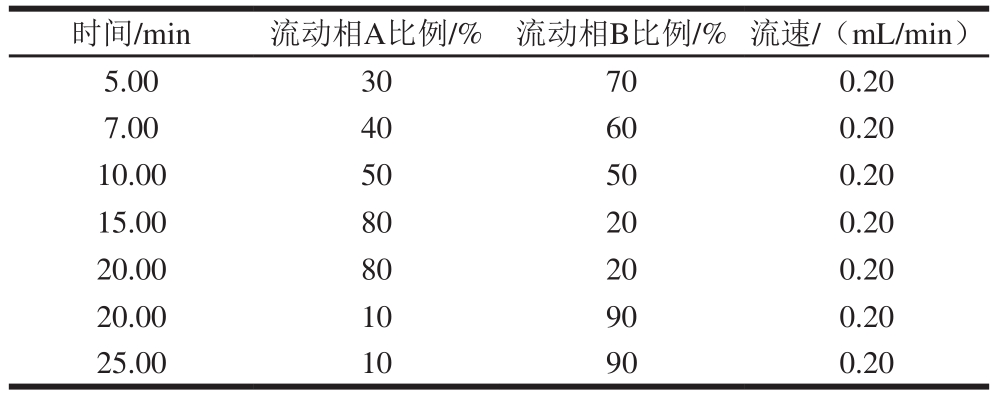
18色谱柱(250 mm× 4.6 mm,5 μm);流动相:流动相A为甲醇、流动相B为0.1%甲酸溶液,梯度洗脱程序见表2;流速0.20 mL/min;柱温30 ℃;进样量5 μL;采样时间25 min。
表2 LC-MS流动相梯度洗脱程序
Table 2 Mobile phase gradient elution program for LC-MS
时间/min 流动相A比例/% 流动相B比例/% 流速/(mL/min)5.00 30 70 0.20 7.00 40 60 0.20 10.00 50 50 0.20 15.00 80 20 0.20 20.00 80 20 0.20 20.00 10 90 0.20 25.00 10 90 0.20
MS条件:电喷雾离子源;采用负电子电离方式;离子源温度200 ℃;雾化气体流速1.5 L/min;脱溶温度200 ℃;质量扫描范围m/z 100~1 000;扫描时间30 min。
1.3 数据处理
采用SPSS 17.0统计学软件对本次研究所得数据进行统计分析。每次测定均做3 个平行,实验数据表示为 ±s。
2 结果与分析
2.1 HPLC条件的优化
为了同时检测8 种黄酮类成分,并获得较好的分离效果,考察乙腈-0.1%磷酸溶液、乙腈-0.1%甲酸溶液、甲醇-0.1%磷酸溶液和甲醇-0.1%甲酸溶液4 种流动相系统。在前3 种流动相条件下,8 种黄酮类化合物分离所需时间长,且效果不佳。在采用甲醇(A)-0.1%甲酸溶液(B)作流动相洗脱时,选择不同的梯度条件进行分离,8 种黄酮类化合物分离效果较好,梯度洗脱条件见表1。
考察0.6、0.8、1 mL/min流速条件下对分离效果的影响。流速为1 mL/min时,8种黄酮类化合物所需的分析时间最短,但不同峰之间有叠加现象;流速为0.6 mL/min时,8 种黄酮类化合物所需的分析时间过长,且峰形不好;当流速为0.8 mL/min时,分离效果以及峰形最佳,故0.8 mL/min为最佳流速。
考察波长270、280、350、370、375、402 nm条件下测定8 种黄酮类化合物,单一波长均不能检测出所有8 种黄酮类物质,波长270 nm可以很好地检测出没食子酸、儿茶素、杨梅素;波长370 nm可以很好地检测出芦丁、槲皮素、木犀草素、山奈酚、异鼠李素,故选择270、370 nm双波长检测。改变柱温可以明显地优化峰的分离度,经过不同温度的测定,在柱温为30 ℃时各峰得到了较好的分离,故选择30 ℃为分析柱温。
2.2 HPLC-DAD和LC-MS分析黄酮对照品

图1 8 种黄酮混合对照品(A)和金丝小枣黄酮提取物(B)的HPLC图
Fig. 1 HPLC chromatograms of mixture of flavonoid standards (A)and flavonoids extracted from Ziziphus jujuba Mill. cv. Jinsixiaozao (B)
采用优化的HPLC条件,整个分离过程几乎在25 min后结束。如图1所示,8 种黄酮类化合物得到了完全分离,并且峰形良好,无拖尾等现象。
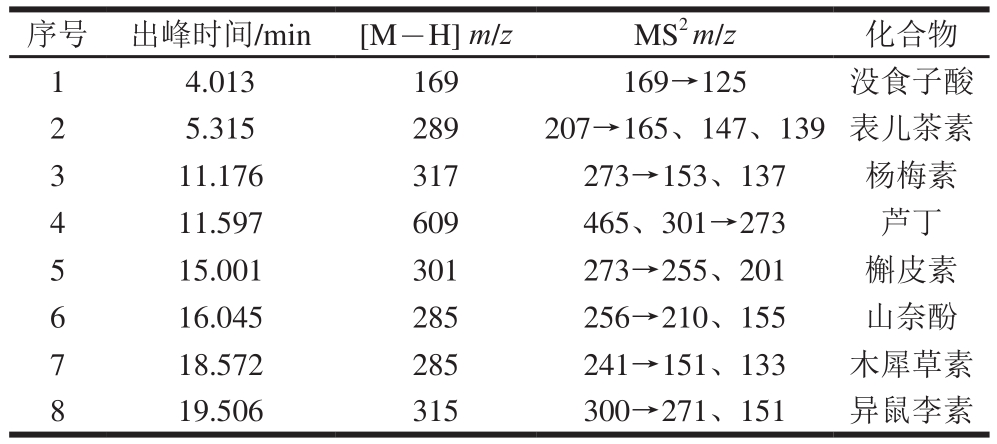
在负离子电离模式下,对黄酮类化合物的电离碎片进行研究。8 种标准黄酮类化合物在MS离子流的峰保留时间与HPLC峰一致。通过色谱峰的MS数据与相关文献报道进行比较分析,初步鉴定8 种黄酮对照品,依次是没食子酸、表儿茶素、杨梅素、芦丁、槲皮素、木犀草素、山奈酚、异鼠李素。表3列出了各化合物的出峰时间和MS数据。
通过将样品的HPLC图与对照标准品的LC图进行比较,如图1B所示,以保留时间为依据,化合物在3、4、5、8的位置出现了与对照标准品时间一致的色谱峰,结合MS数据的分析,确定该4 种物质分别为杨梅素、芦丁、槲皮素、山奈酚。而其他4 种黄酮类物质均未检测到。
表3 各黄酮对照品的HPLC出峰时间及各级质谱数据
Table 3 HPLC peak times and mass spectral data of flavonoid standards
序号 出峰时间/min [M-H] m/z MS
2m/z 化合物1 4.013 169 169→125 没食子酸2 5.315 289 207→165、147、139表儿茶素3 11.176 317 273→153、137 杨梅素4 11.597 609 465、301→273 芦丁5 15.001 301 273→255、201 槲皮素6 16.045 285 256→210、155 山奈酚7 18.572 285 241→151、133 木犀草素8 19.506 315 300→271、151 异鼠李素
化合物1的分子离子峰[M-H]
-m/z为169,说明它的相对分子质量为170,与没食子酸的相对分子质量一致,因此化合物1可能是没食子酸。化合物2的分子离子峰[M-H]
-m/z为289,所以得出其相对分子质量为290。并且有m/z 579的耦合离子[2M-H],与文献[22]报道表儿茶素一致。由此可以初推测该化合物是表儿茶素。
化合物3的准分子离子峰[M-H]
-的m/z是317,故相对分子质量为318。m/z 465可能是该化合物结合鼠李糖碎片生成的离子峰,由此可以初步假设该化合物是杨梅素。化合物4的准分子离子峰[M-H]
-是m/z 609,说明该化合物的相对分子质量为610,与芦丁的相对分子质量相同。MS
2有m/z 465和m/z 301碎片,说明分别裂解脱去1分子葡萄糖和1分子鼠李糖,与文献[23]报道的芦丁一致。由此可以推测该化合物是芦丁。化合物5的准分子离子峰[M-H]
-为m/z 301,故相对分子质量为302,符合槲皮素的相对分子质量。且产生的二级质谱图中,出现了m/z 273、255,与文献[24]报道的槲皮素裂解特征一致,因此初步推断该化合物为槲皮素。化合物6的准分子离子峰[M-H]
-是m/z 285,相对分子质量为286,二级质谱图中碎片有m/z 256、210,与文献[25]报道的山奈酚的特征峰一致,所以该化合物可能是山奈酚。化合物7的准分子离子峰[M-H]
-是m/z 285,相对分子质量为286,二级碎片中有133的峰,符合文献[26]报道的木犀草素对照品的裂解峰,所以将此化合物初步假设为木犀草素。化合物8的准分子离子峰[M-H]
-是m/z 315,相对分子质量为316,与异鼠李素的相对分子质量一致。主要的碎片离子m/z为271、151,应该是异鼠李素苷元C环裂解产生的碎片,因此该化合物可能是异鼠李素。
2.3 方法验证结果
2.3.1 线性关系以及检出限的确定
以1.2.2节方法配制的对照品溶液,按上述LC条件分别取10 μL进行LC测定,以峰面积(Y)为纵坐标,对照品溶液的质量浓度(X)为横坐标做线性回归,测得8 种黄酮类化合物的回归方程、相关系数、线性范围和检出限(信噪比为3),结果见表4。
表4 线性关系、检出限结果(n= 6)
Table 4 Linear relationships and limits of detection (n= 6)

化合物 回归方程 相关系数 线性范围/ (μg/mL)检出限/ (ng/L)没食子酸 Y=51.509X-36.09 0.999 6 5~125 1.25儿茶素 Y=6.094 9X-28.869 0.999 2 5~125 1.73杨梅素 Y=3.642 3X-3.529 0.999 7 5~100 1.71芦丁 Y=5.79X-2.345 0.999 7 5~100 1.38槲皮素 Y=16.087X-43.716 0.999 1 5~125 1.23木犀草素 Y=7.374 8-8.731 5 0.999 6 5~100 1.40山奈酚 Y=14.317X+0.795 7 0.998 7 5~125 1.63异鼠李素 Y=12.337X-15.223 0.999 9 5~100 1.52
由表4可知,该方法在测定8 种黄酮类化合物时,在5~125 μg/mL的范围内,8 种黄酮类物质经过线性分析之后,得出的线性回归方程中相关系数r
2均达到0.999 0以上,表明线性关系良好。在进样量为10 μL,信噪比为3时,得出各黄酮类物质的检出限范围为1.23~1.73 ng/L,表明该方法可行,结果真实可靠。
2.3.2 精密度和加标回收率
准确吸取100 μg/mL质量浓度的8 种对照品混合溶液10 μL,一日内重复进样6 次,记录各黄酮化合物的峰面积,从而计算各化合物的精密度及相对标准偏差(relative standard deviation,RSD)。
精密称取已知黄酮含量的样品1 g,精密加入对照品溶液适量,在1.2.3.1节的色谱条件下进行测定,做6 次平行实验,计算平均回收率。
表5 精密度、平均回收率与稳定性实验结果
Table 5 Average recovery, precision (RSD) and stability (RSD) for 8 flavonoid components

稳定性RSD/%没食子酸 100 105.70±1.21 1.10 105.70 2.59 1.45儿茶素 100 93.50±4.02 4.31 93.50 1.54 1.25杨梅素 100 96.70±1.33 1.30 96.70 2.79 2.01芦丁 100 102.90±1.81 1.73 102.90 0.68 1.67槲皮素 100 105.10±1.60 1.52 105.10 1.14 1.55木犀草素 100 96.90±1.20 1.28 96.90 0.86 1.89山奈酚 100 106.70±2.44 2.26 106.70 1.17 1.35异鼠李素 100 96.10±2.32 2.37 96.10 2.90 0.69化合物 质量浓度/ (μg/mL)测量值/ (μg/mL)精密度RSD/%平均回收率/%回收率RSD/%
如表5所示,根据峰面积得出测量值及RSD,测量值与实际值几乎一致,并且RSD较小,RSD为1.10%~4.31%,表明该仪器测定此8 种黄酮类物质准确度和精密度良好。回收率实验的测定结果显示,回收率范围在93.50%~106.70%之间(RSD为0.68%~2.90%),均较高,进一步证明了方法测定结果真实,可靠。
2.3.3 稳定性实验结果
取同一样品溶液,按上述色谱条件,每隔4 h进一次样,共进4 次样,进样量10 μL。记录峰面积考察其稳定性,并计算各化合物峰面积的RSD,结果见表5,表明样品溶液在24 h内稳定。
2.4 样品中黄酮类物质分析结果
在1.2节HPLC方法条件下对黄酮类化合物进行分析,根据与对照品的保留时间和质谱数据进行比较,从而识别样品中的类黄酮物质。根据线性回归方程对金丝小枣中的黄酮类物质进行定量分析。
利用线性回归方程对该4 种物质进行定量计算,结果测得杨梅素、芦丁、槲皮素、异鼠李素含量分别为40.90、8.40、32.60、12.56 μg/g。
3 结 论
本实验成功建立了一种运用DAD-HPLC和LC-MS联用技术的分析方法对金丝小枣中黄酮类化合物进行定性定量检测。研究表明,在负离子模式下对黄酮类化合物进行质谱分析是可行的。LC-MS联用技术适用于化合物的鉴定及定量分析,方法简便、可靠。通过对该方法的线性、精密度、稳定性、加标回收率进行验证,结果表明精密度和稳定性的RSD均较小,在5~125 μg/mL的范围内,相关系数(r
2)均大于0.999 0,表明线性关系良好,回收率范围在93.50%~106.70%之间,较高,说明该检测方法真实有效,并且能提供较高的灵敏度和重复性。
参考文献:
[1] KOU Xiaohong, CHEN Qiong, LI Xianhua, et al. Quantitative assessment of bioactive compounds and the antioxidant activity of 15 jujube cultivars[J]. Food Chemistry, 2015, 173: 1037-1044.
DOI:10.1016/j.foodchem.2014.10.110.
[2] 杨永祥, 陈锦屏, 吴曼. 红枣营养保健价值及其加工利用的研究进展[J]. 农产品加工, 2009(1): 52-53; 56. DOI:10.3969/j.issn.1671-9646-C.2009.01.035.
[3] LI Jinwei, LIU Pingfan, SHAO Dongding, et al. Nutritional composition of five cultivars of Chinese jujube[J]. Food Chemistry,2007, 103(2): 454-460. DOI:10.1016/j.foodchem.2006.08.016.
[4] GAO Qinghan, WU Pute, LIU Jiaren, et al. Physico-chemical properties and antioxidant capacity of different jujube (Ziziphus jujuba Mill.) cultivars grown in loess plateau of China[J]. Scientia Horticulturae, 2011, 30: 67-72. DOI:10.1016/j.scienta.2011.06.005.
[5] 郭盛. 中国大枣资源化学研究[M]. 南京: 南京中医药大学, 2009.
[6] 李进伟, 丁绍东, 李苹苹, 等. 五种枣成分及功能研究[J]. 食品工业科技, 2009, 30(7): 294-296.
[7] 王向红, 崔同, 刘孟军, 等. 不同品种枣的营养成分分析[J]. 营养学报, 2002, 24(2): 206-208. DOI:10.3321/j.issn:0512-7955.2002.02.026.
[8] 河北省沧州金丝小枣创四个“全国之最”[J]. 中国乡镇企业, 2004(8): 64.
[9] 张平平, 李黎, 张冬冬, 等. 金丝新4号枣果中黄酮类物质提取及纯化工艺的研究[J]. 食品与机械, 2009, 25(6): 75-79.
[10] 孙智敏, 李发堂, 殷蓉, 等. 黄酮类化合物提取工艺研究进展[J]. 河北化工, 2005, 15(7): 7-9. DOI:10.3969/j.issn.1007-7871.2012.07.002.
[11] 袁亚娜, 张平平, 何庆峰, 等. 冬枣黄酮的分析及体外抗氧化活性[J].食品科学, 2013, 34(17): 70-73. DOI:10.7506/spkx1002-6630-201317016.
[12] 王迎进, 闫瑾璠, 赵雅琴, 等. 壶瓶枣总黄酮抗氧化性研究[J]. 食品研究与开发, 2012, 33(11): 39-41.
[13] 李志洲. 金银花花茎中黄酮的提取及抗氧化性的研究[J]. 宝鸡文理学院学报(自然科学版), 2006, 26(2): 131-134. DOI:10.3969/ j.issn.1007-1261.2006.02.015.
[14] GEORGETTI S R, CASAGRANDE R, MAMBRO M V D, et al. Evaluation of the antioxidant activity of different flavonoids by the chemiluminescence method[J]. Aaps Pharmsci, 2003, 5(2): 1-5.
DOI:10.1208/ps050220.
[15] NKENGFACK A E, VOUFFO T W, FOMUM Z T, et al. Prenylated isoflavanone from the roots of erythrina-sigmoidea[J]. Phytochemistry,1994, 36(4): 1047-1051. DOI:10.1016/S0031-9422(00)90489-8.
[16] 王尊民, 高秀妹, 赵庆友, 等. 梧桐花黄酮的提取及其抑菌、抗病毒效果[J]. 中国兽医学报, 2013, 33(2): 272-276.
[17] 郭芳彬. 蜂产品中黄酮类化合物的保健作用[J]. 养蜂科技, 2005(2): 28-31.
[18] LI Jinwei, LIANG Shan, LIU Yuanfa, et al. Screening of a functional polysaccharide from Zizyphus jujuba cv. Jinsixiaozao and its property[J]. International Journal of Biological Macromolecules, 2011,49: 255-259. DOI:10.1016/j.ijbiomac.2011.04.006.
[19] LIU Jingjing, CHEN Bo, YAO Shouzhuo. Simultaneous analysis and identification of main bioactive constituents in extract of Zizyphus jujuba var. sapinosa (Zizyphi spinosi semen) by high-performance liquid chromatography-photodiode array detection-electrospray mass spectrometry[J]. Talanta, 2007, 71: 668-675. DOI:10.1016/ j.talanta.2006.05.014.
[20] PAWLOWSKA A M, CAMANGI F, BADER A, et al. Flavonoids of Zizyphus jujuba L. and Zizyphus spina-christi (L.) Willd (Rhamnaceae)fruits[J]. Food Chemistry, 2009, 112: 858-862. DOI:10.1016/ j.foodchem.2008.06.053.
[21] 顾利红, 李环. 不同枣类商品中芦丁成分的含量研究[J]. 食品与机械, 2007, 18(6): 465-468. DOI:10.3321/j.issn:1003-9783.2007.06.016. [22] 任其龙, 魏冠红, 金米聪, 等. 反相高效液相色谱电喷雾质谱法鉴定葡萄籽低聚原花青素[J]. 食品与发酵工业, 2006, 22(3): 79-82; 85.
[23] LOUATI S, SIMMONDS M S J, GRAYER R J. Flavonoids from Eriobotrya japonica (Rosaceae) growing in Tunisia[J]. Biochemical Systematics and Ecology, 2003, 31(1): 99-101. DOI:10.1016/S0305-1978(02)00072-8.
[24] 李宇航, 戴海学, 汪明明, 等. 槲皮素的电喷雾离子阱质谱分析[J].质谱学报, 2009, 30(6): 374-378.
[25] 梁艳, 于世锋, 陈卫军, 等. 山奈酚的电喷雾质谱裂解途径[J]. 应用化学, 2009, 26(10): 1250-1252.
[26] 刁海鹏, 杜艳, 丁红, 等. 水蔓菁滴丸中总黄酮和木犀草素的含量测定[J]. 中成药, 2010, 32(7): 1263-1265. DOI:10.3969/ j.issn.1001-1528.2010.07.056.
Determination of Flavonoid in Ziziphus jujuba Mill. cv. Jinsixiaozao Fruits by DAD-HPLC and LC-MS
SHI Renli
1, ZHAI Longfei
1, YU Wenlong
1, LIANG Na
1, GONG Zhengsi
1, WANG Xianghong
1,2,*
(1. College of Food Science and Technology, Hebei Agricultural University, Baoding 071001, China;2. Agricultural Product Processing Engineering Technology Research Center of Hebei, Baoding 071001, China)
Abstract:In this study, the flavonoids in Ziziphus jujuba Mill. cv. Jinsixiaozao fruits were analyzed by using high performance liquid chromatography with diode array detector (DAD-HPLC) and liquid chromatography-mass spectrometry (LC-MS). The chromatographic separation was achieved on a Hypersil BDS-C
18column (250 mm × 4.6 mm, 5 μm) using a mobile phase consisting of methanol and 0.1% formic acid aqueous solution at 0.8 mL/min flow rate by gradient elution. The column temperature was set at 30 ℃, and the injection volume was 10 μL. Dual-wavelength detection was carried out at 270 and 370 nm. Then LC-MS was employed to determine the flavonoids. Results demonstrated that Jinsixiaozao jujube contained four flavonoids, myricetin, rutin, quercetin, and isorhamnetin and their contents were 40.90, 8.40, 32.60 and 12.56 μg/g,respectively. In the range of 5–125 μg/mL, the method exhibited a good linear relationship and repeatability. The limits of detection (LODs) were in the range of 1.23–1.73 ng/L at a signal-to-noise ratio of 3. The relative standard deviation (RSD)values for precision were 1.10%–4.31%. The recoveries from spiked samples were 93.50%–106.70% (RSD = 0.68%–2.90%). Conclusively, this method had the advantages of simple pretreatment, high recovery rate and good precision, and it could provide a convenient and precise method for the analysis of flavonoids in Ziziphus jujuba Mill. cv. Jinsixiaoza fruits.
Key words:high performance liquid chromatography (HPLC); liquid chromatography-mass spectrometry (LC-MS);Ziziphus jujuba Mill. cv. Jinsixiaozao; flavonoids
DOI:10.7506/spkx1002-6630-201616020
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2016)16-0123-05
引文格式:
师仁丽, 翟龙飞, 于文龙, 等. 利用DAD-HPLC和LC-MS法检测金丝小枣中黄酮类化合物[J]. 食品科学, 2016, 37(16): 123-127. DOI:10.7506/spkx1002-6630-201616020. http://www.spkx.net.cn
SHI Renli, ZHAI Longfei, YU Wenlong, et al. Determination of flavonoid in Ziziphus jujuba Mill. cv. Jinsixiaozao fruits by DAD-HPLC and LC-MS[J]. Food Science, 2016, 37(16): 123-127. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201616020. http://www.spkx.net.cn
收稿日期:2016-02-18
基金项目:公益性行业(林业)科研专项(201304708)
作者简介:师仁丽(1990—),女,硕士研究生,研究方向为食品工程。E-mail:15231228206@163.com
*通信作者:王向红(1973—),女,教授,博士,研究方向为食品营养与安全。E-mail:wangxianghong73@sina.com





