金黄色葡萄球菌新型肠毒素I双抗夹心-酶联免疫检测方法的建立
朱安妮,唐俊妮*,赵燕英,汤 承,陈 娟,刘 骥
(西南民族大学生命科学与技术学院,四川 成都 610041)
摘 要:目的:建立简便、灵敏检测金黄色葡萄球菌肠毒素I(staphylococcal enterotoxin I,SEI)的双抗夹心酶联免疫吸附方法(double-antibody sandwich-enzyme linked immunosorbent assay,DAS-ELISA)。方法:利用DAS-ELISA检测程序确定单克隆抗体、抗血清、辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔IgG(IgG/ HRP)的最佳稀释度,再通过检测不同包被缓冲液、封闭时间、抗原包被时间、IgG/HRP作用时间以及四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,TMB)显色时间条件下的OD
450 nm值对实验条件进行优化,最后用灵敏度、批内变异、批间变异和加标回收率指标对方法进行评价。结果:抗SEI单克隆抗体的最佳稀释质量浓度为2.89 mg/L,抗SEI兔血清稀释度1∶2 000,酶标二抗稀释度1∶6 000;1×磷酸缓冲盐溶液(pH 7.4)为最佳包被缓冲液;最佳封闭时间、抗原孵育时间、酶标二抗孵育时间和TMB显色时间分别为60、90、30 min和15 min。该方法的回归方程为y=0.040 9x+0.042 9,R
2=0.993 3;灵敏度为0.5 μg/L,精密度批内变异低于10%,批间变异低于15%,除巴氏杀菌牛乳外,对生理盐水、熟牦牛肉糜、大米饭和超高温瞬时灭菌牛乳回收率达90%以上。结论:本研究建立了一种快速检测SEI的双抗夹心方法。
关键词:双抗夹心酶联免疫吸附;金黄色葡萄球菌;金黄色葡萄球菌肠毒素I;检测方法
金黄色葡萄球菌肠毒素(staphylococcal enterotoxins,SEs)主要是由血浆凝固酶和耐热核酸酶阳性的葡萄球菌分泌的胞外毒素,其会导致中毒休克、食物中毒等疾病
[1-4]。目前已发现的肠毒素有23 种血清型,其中SEA~SEE称为传统肠毒素,SEG~SElX为新型肠毒素
[1,5-6]。人类对于各型SEs最低耐受剂量不一,目前已经证明能引起食物中毒的肠毒素主要包括金黄色葡萄球菌肠毒素A、B、C、D、E、H、G和I(SEA、SEB、SEC、SED、SEE、SEH、SEG和SEI)
[7-8],其中A型肠毒素毒力最强,摄入1 μg即能引起食物中毒
[9]。
SEI属于新型肠毒素系列,它是由sei基因编码,共有729 个核苷酸构成,能表达一个具有242 个氨基酸残基的成熟蛋白质,理论分子质量为24.928 kD
[10]。现有研究
[11-13]表明,金黄色葡萄球菌肠毒素基因的各型分布中,肠毒素sei基因分布较广。如Kolawole等
[11]在研究非洲殖民病人体中分离的61 株金黄色葡萄球菌中,发现seg/sei基因检出率高达41%;von Eiff等
[12]研究从患者鼻腔和血液分离的429 株金黄色葡萄球菌中,疑似携带seg/sei基因的菌株高达89.5%;Akineden等
[13]从山羊乳酪分离的64 株金黄色葡萄球菌中,其中14 株携带seg、sei、selm、seln以及selo基因簇。基于sei基因流行的广泛性,新型肠毒素SEI潜在威胁人类健康。开展食品及其原料中肠毒素SEI的检出,对控制SEI引起的食源性疾病具有实际意义。
目前,关于肠毒素的检测方法主要有免疫学法、分子生物学法和生物传感器法。国内外的研究
[14-17]大多是利用聚合酶链式反应(polymerase chain reaction,PCR)方法对肠毒素基因进行快速检测和分型。PCR技术从基因水平进行诊断,具有同时检测大量样品、灵敏度和特异性高的特点,但PCR方法只能判断携带肠毒素的基因类型,而肠毒素蛋白的表达往往受时间、水分活度(a
w0.85~0.99)、酸碱度(pH 4.0~7.0)和温度(8~30 ℃)等因素的影响
[18-19]。采用普通PCR方法很难准确检测食品或临床样本中肠毒素的含量。新开发的生物传感器技术因其具有自动化、检样量少、分析速度快、生物功能膜可多次使用等优点受到国内学者的亲睐。如Wu Longyun等
[20]研发的电化学免疫传感器用来检测食物中的SEB,其最低检出限可达0.017 μg/L。但该方法也存在一些缺点,主要体现在检测成本高、检测稳定性较差,使该方法的发展受到一定限制。酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)依靠抗原决定簇与抗体结合位点之间特异性,两者在化学结构和空间构型上呈互补关系,具有高度特异性。在此基础上发展的双抗夹心(double-antibody sandwich,DAS)-ELISA检测传统肠毒素的技术较为成熟。如Kuang Hua等
[21]利用DAS-ELISA检测食物样本中的SEA,其灵敏度为0.028 2 μg/L。但利用DAS-ELISA法检测新型肠毒素的报道较少。因此,本研究拟开发新型肠毒素SEI定量分析的DAS-ELISA技术,为SEI蛋白的快速检测提供技术支持。
1 材料与方法
1.1 材料、试剂与仪器
SEI蛋白纯品(1 mg/mL)、抗SEI兔血清(效价>512 000)、SEI单克隆抗体(含50%甘油,质量浓度为0.867 g/L) 本实验室自制;辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔IgG(IgG/HRP) 北京博奥森生物技术有限公司;脱脂奶粉 英国Oxoid公司;四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,TMB) 上海泸宇生物科技有限公司;Tween-20、二甲基亚砜、磷酸二氢钾、氯化钾、氯化钠、磷酸氢二钠、浓硫酸均为分析纯。
96 孔聚苯乙烯酶标板 美国Costar公司;Elx-808型酶标仪 美国Bio-Tek公司。
1.2 方法
1.2.1 SEI的DAS-ELISA检测方法的建立与优化
1.2.1.1 DAS-ELISA基本检测程序
以一定质量浓度的SEI单克隆抗体包被酶标板,100 μL/孔,4 ℃过夜;以5%脱脂乳磷酸缓冲液(phosphate buffer saline,PBS)为封闭液200 μL/孔,37 ℃封闭1 h;加入SEI纯品(30 μg/L),100 μL/孔,37 ℃孵育1 h;以抗SEI免血清为一抗,37 ℃反应1 h;以羊抗兔IgG/HRP为二抗,37 ℃孵育45 min;底物溶液37 ℃避光显色15 min;在每次更换反应液前采用PBST洗涤板3 次,最后以2 mol/L的硫酸终止反应,测定OD
450 nm值。计算P/N值(其中P为阳性样品OD
450 nm值;N为阴性对照OD
450 nm值)。
1.2.1.2 最佳检测抗体工作质量浓度的选择
在相同的反应条件下,采用1.2.1.1节的步骤分别对抗SEI单克隆抗体的包被质量浓度(2.18、2.89、4.34、8.67 mg/L)、抗SEI兔血清稀释度(1∶1 200、1∶1 400、1∶1 600、1∶1 800、1∶2 000、1∶3 000、1∶4 000)、IgG/HRP稀释度(1∶4 000、1∶6 000、1∶8 000)进行检测,采用已知30 μg/L的SEI纯品为阳性,PBS代替抗原为阴性,测定OD
450 nm值,并计算P/N值,确定抗SEI单克隆抗体、抗SEI兔血清以及IgG/HRP的最佳稀释度。
1.2.1.3 最佳检测条件优化
按照1.2.1.1节的步骤,在相同抗体最佳工作质量浓度条件下,对包被缓冲液(0.1 mol/L,pH 9.2碳酸盐;1×PBS(pH 7.4)、封闭时间(1、1.5、2 h)、抗原包被时间(45、60、90 min)、酶标二抗作用时间(37 ℃、30 min,37 ℃、45 min,37 ℃、60 min)、TMB显色时间(5、10、15 min)进行ELISA实验。检测同一阳性样品和阴性样品,选择P/N值最大为最佳条件。1.2.1.4 制备检测抗原标准曲线
按照1.2.1.1节的步骤,用DAS-ELISA法检测不同质量浓度SEI抗原(0.5~30 μg/L),记录OD
450 nm值并绘制标准曲线。
1.2.2 方法学评价与应用
1.2.2.1 精密度实验
[22]
批内变异将阳性对照组(30、15、5 μg/L),阴性对照组分别作5 个重复孔于同一板上,同时检测其OD
450 nm;批间变异连续5 次检测上述相同标本的OD
450 nm。
1.2.2.2 灵敏度实验
利用DAS-ELISA法检测不同质量浓度SEI(1.0、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2、0.1 μg/L),确定DAS-ELISA方法的灵敏度。阳性判断:P/N>2.0为阳性结果。
1.2.2.3 DAS-ELISA方法的应用与特异性分析
利用DAS-ELISA对3 株金黄色葡萄球菌食物中毒患者临床分离株(SA-H3、H4和H7);2 株动物性食品源金黄色葡萄球菌分离株(SA-G3和G13);SEB、SEI蛋白纯品(1 μg/mL);大肠杆菌O157;单核增生李斯特菌、志贺氏菌、沙门氏菌进行检测。阳性判断:P/N>2.0为阳性结果。
1.2.2.4 测定人工污染样品中SEI的回收率以及不同食物样品对方法影响的评价
[23]
SEI人工污染食物的制备:食物基质分别选择巴氏杀菌鲜牛乳、超高温瞬时灭菌(ultra high temperaturetreated,UHT)牛乳、熟牦牛肉糜和熟米饭。用SEI纯品配制不同质量浓度的SEI生理盐水(20、10、5、2.5、1.0 μg/L)。同样,通过添加使不同食物SEI样品的终质量浓度也分别为20、10、5、2.5 μg/L和1.0 μg/L几个梯度。采用建立的DAS-ELISA方法,分别测待检样品和阴性对照的OD
450 nm,每个梯度重复3 次,计算样品的回收率并进行评价。
2 结果与分析
2.1 SEI的DAS-ELISA检测方法的建立与优化
2.1.1 最佳抗体包被质量浓度的确定
2.1.1.1 最佳单抗包被稀释度的确定
为了确定单抗的最佳包被质量浓度,先将抗血清的稀释度分为两组,第1组抗血清稀释度定为1∶1 000;第2组抗血清稀释度定为1∶2 000。测得各孔OD
450 nm。由表1所示,当抗血清稀释度为1∶2 000,单抗质量浓度为2.89 mg/L时,P/N值最大。因此,确定最佳单抗包被质量浓度为2.89 mg/L。
表1 单克隆抗体不同包被质量浓度条件下的OD
450 nm
Table 1 OD
450 nmvalues at different dilution ratios of coating monoclonal antibody (McAb)

注:P/N.阳性对照OD
450 nm/阴性对照OD
450 nm。
单抗包被质量浓度/(mg/L)8.67 4.34 2.89 2.18 OD
450 nm P/N OD
450 nm P/N OD
450 nm P/N OD
450 nm P/N 1∶1 000 阳性对照1.366±0.02011.67 1.289±0.04912.39 1.386±0.033 13.86 1.300±0.02613.13阴性样品 0.117 0.104 0.100 0.099 1∶2 000 阳性对照1.270±0.02113.51 1.20±0.01411.88 1.276±0.022 15.75 1.101±0.03714.68阴性样品 0.094 0.101 0.081 0.075抗血清稀释度 组别
2.1.1.2 最佳抗血清稀释度的确定
确立最佳单抗包被质量浓度后,不同抗血清稀释倍数下对应的阳性对照和阴性对照的OD
450 nm如图1所示,当抗SEI兔血清稀释倍数为2 000时,P/N最大。故最佳抗SEI兔血清稀释度定为1∶2 000。
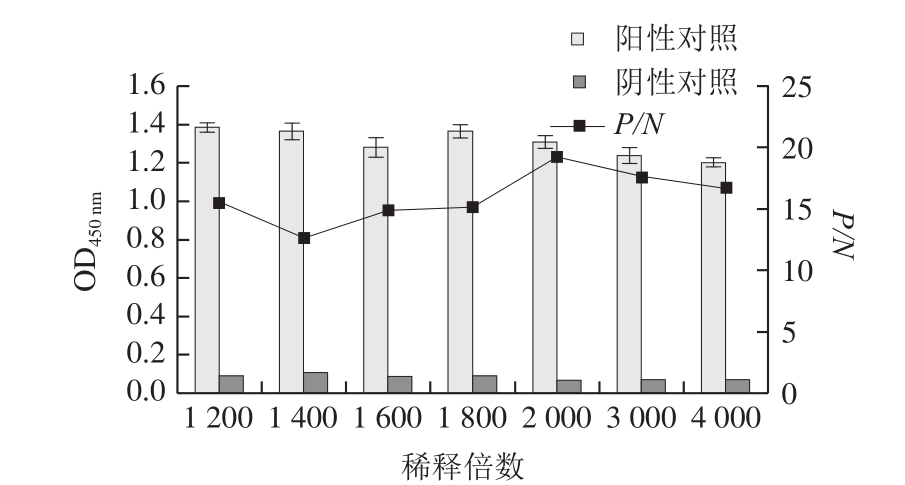
图1 不同稀释倍数条件下SEI抗血清的OD
450 nm和P/N值
Fig. 1 OD
450 nmvalues and P/N ratios at different dilutions of SEI antiserum
2.1.1.3 最佳IgG/HRP稀释度的确定
以2.89 mg/L单抗为最佳包被质量浓度,1∶2 000抗SEI兔血清为最佳一抗稀释度。在不同稀释度条件下羊抗兔IgG/HRP对应的OD
450 nm值见表2,当IgG/HRP稀释倍数为6 000时,P/N值最大,故最佳IgG/HRP稀释度为1∶6 000。
表2 不同稀释倍数条件下羊抗兔IgG/HRP的OD
450 nm值
Table 2 OD
450 nmvalues at different dilutions of goat anti-rabbit IgG/HRP

酶标羊抗兔IgG/HRP的稀释度1∶4 000 1∶6 000 1∶8 000 OD
450 nm P/N OD
450 nm P/N OD
450 nm P/N阳性对照 1.273±0.043 14.80 1.218±0.036 17.4 0.956±0.039 13.28阴性对照 0.086 0.70 0.72组别
2.1.2 条件优化
以2.89 mg/L单抗为最佳包被质量浓度,1∶2 000抗SEI兔血清为最佳一抗稀释度,1∶6 000为最佳IgG/HRP稀释度,分别对包被缓冲液,封闭时间,抗原孵育时间,酶标二抗孵育时间以及TMB显色时间进行优化,结果见表3。最终选择1×PBS(pH 7.4)为最佳包被缓冲液;最佳封闭时间、抗原孵育时间、酶标二抗孵育时间和TMB显色时间分别为60、90、30 min和15 min。
表3 最佳实验条件的选择
Table 3 Determination of optimal experimental conditions
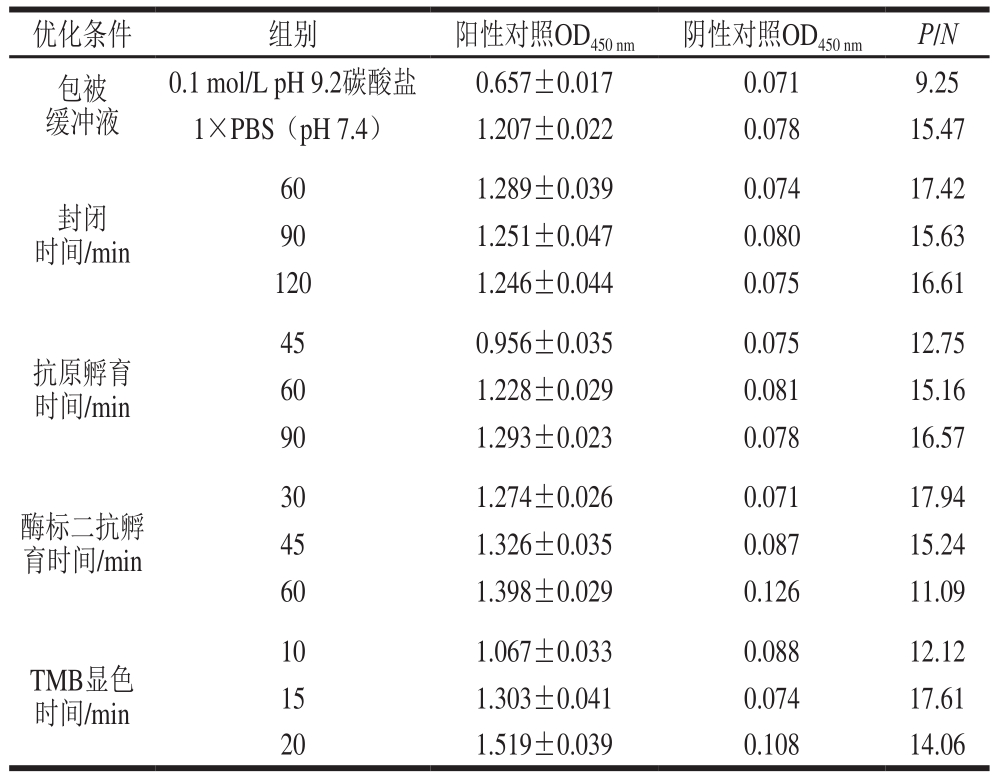
优化条件 组别 阳性对照OD
450 nm 阴性对照OD
450 nm P/N包被缓冲液0.1 mol/L pH 9.2碳酸盐 0.657±0.017 0.071 9.25 1×PBS(pH 7.4) 1.207±0.022 0.078 15.47封闭时间/min 60 1.289±0.039 0.074 17.42 90 1.251±0.047 0.080 15.63 120 1.246±0.044 0.075 16.61抗原孵育时间/min 45 0.956±0.035 0.075 12.75 60 1.228±0.029 0.081 15.16 90 1.293±0.023 0.078 16.57酶标二抗孵育时间/min 30 1.274±0.026 0.071 17.94 45 1.326±0.035 0.087 15.24 60 1.398±0.029 0.126 11.09 TMB显色时间/min 10 1.067±0.033 0.088 12.12 15 1.303±0.041 0.074 17.61 20 1.519±0.039 0.108 14.06
2.1.3 SEI的检测标准曲线
在上述最适反应条件下制作标准曲线,并进行线性回归分析,SEI双抗夹心法在0.5~30 μg/L回归方程为y=0.040 9x+0.042 9,R
2=0.993 3。
2.2 DAS-ELISA方法的评价
2.2.1 精密度实验结果
精密度实验结果如表4所示,方法的批内变异系数低于10%,批间变异系数低于15%,说明该方法具有较高的精密度。
表4 采用DAS-ELISA检测样品OD
450 nm和变异系数
Table 4 Coefficient variations of DAS-ELISA method for detecting samples

s 变异系数/% 30 μg/L 5 1.258 0.021 1.7 1.279 0.053 4.1 15 μg/L 5 0.79 0.044 5.6 0.801 0.047 5.8 5 μg/L 5 0.445 0.019 4.2 0.455 0.050 10.9阴性对照 5 0.067 0.006 2 9.2 0.076 0.010 13.2样品 检测次数批内 批间s 变异系数/%
2.2.2 灵敏度实验结果
利用DAS-ELISA法检测不同质量浓度SEI标准品结果如表5所示,在SEI质量浓度为0.5 μg/L及其以上时,P/N值均大于2.0。因此,本实验建立的DAS-ELISA灵敏度为0.5 μg/L。
2.2.3 DAS-ELISA特异性分析
表5 DAS-ELISA灵敏度结果
Table 5 Sensitivity of DAS-ELISA method

抗原质量浓度/ (μg/L) 1.0 0.9 0.8 0.7 0.6 0.5 0.4 0.3 0.2 0.1 阴性对照OD
450 nm 0.197±0.043 0.183±0.032 0.177±0.052 0.173±0.037 0.162±0.041 0.144±0.030 0.130±0.048 0.115±0.029 0.099±0.047 0.087±0.016 0.067 P/N 2.94 2.73 2.64 2.58 2.41 2.15 1.94 1.72 1.48 1.30
表6 DAS-ELISA特异性鉴定结果
Table 6 Specificity of DAS-ELISA

序列 菌株/蛋白 OD
450 nm P/N 1 SA-G3(不含sei基因) 0.126±0.024 1.88 2 SA-G13(不含sei基因) 0.112±0.025 1.67 3 SA-H3(含sei基因) 0.321±0.044 4.79 4 SA-H4(含sei基因) 0.572±0.053 8.54 5 SA-H7(含sei基因) 1.003±0.023 14.97 6 SEB蛋白 0.103±0.043 1.84 7 SElM蛋白 0.097±0.034 1.75 8单增李斯特菌 0.094±0.012 1.40 9志贺氏菌 0.085±0.027 1.27 10 沙门氏菌 0.096±0.022 1.43 11 大肠杆菌O157 0.102±0.017 1.52 12 阴性对照 0.067
利用DAS-ELISA对5 株已知基因型的金黄色葡萄球菌分离菌株进行检测。结果如表6所示,3 株含sei基因的金黄色葡萄球菌分离株结果为阳性;2 株不含sei基因的金黄色葡萄球菌分离株、SEB蛋白纯品、SElM蛋白纯品、大肠杆菌O157、单核增生李斯特菌、志贺氏菌、沙门氏菌检测结果均为阴性。
2.2.4 人工污染样品中SEI的加标回收率以及食物样品对方法影响的评价
由表7可以看出,5 种污染样品随着SEI质量浓度增加,回收率增加,样品检测准确度增高。生理盐水样品在SEI含量1.0 μg/L及其以上时,样品检测的准确度较高,回收率均达90%以上;UHT牛乳在SEI含量2.5 μg/L及其以上时,样品检测的准确度较高,回收率达90%以上;牦牛肉和米饭在SEI质量浓度达到5 μg/L以上时能够准确检测;对于巴氏杀菌乳SEI的回收率较低,当SEI质量浓度达到20 μg/L以上时,才能够准确检测。不同食物基质对检测方法的影响较大。
表7 DAS-ELISA检测污染样品SEI的回收率
Table 7 Recovery of SEI in spiked samples by using DAS-ELISA

注:—.未检出。
样品 SEI质量浓度/(μg/L) 回收率/% 变异系数/%实际值 检测值生理盐水20 19.97±0.62 99.8 3.1 10 10.12±1.12 101.2 11.1 5 4.99±0.41 99.8 8.2 2.5 2.52±0.24 100.8 9.5 1 1.03±0.099 103.0 9.6巴氏杀菌牛乳20 19.36±1.08 96.8 5.6 10 6.26±0.36 62.6 5.8 5 1.76±0.26 35.2 14.7 2.5 — — —1——UHT牛乳20 19.94±0.87 99.7 4.4 10 9.32±0.54 93.2 5.8 5 4.72±0.34 94.4 7.2 2.5 2.26±0.17 90.4 7.5 1 0.75±0.077 75.0 10.2熟牦牛肉糜20 19.72±0.56 98.6 2.8 10 10.52±0.59 105.2 5.6 5 4.62±0.46 92.3 9.9 2.5 1.57±0.17 62.8 10.8 1 0.67±0.10 52.5 14.9 20 20.32±0.56 101.6 2.7 10 9.86±0.65 98.6 6.6 5 4.99±0.39 99.8 7.8 2.5 2.04±0.21 81.7 10.3 1 0.87±0.15 87.0 17.2熟米饭
3 讨 论
本研究建立了一种金黄色葡萄球菌新型肠毒素SEI的DAS-ELISA检测方法,该方法的标准曲线y=0.040 9x+ 0.042 9,在0.5~30 μg/L范围内线性关系良好,灵敏度可达0.5 μg/L,重复性、稳定性较好、精密度高、回收率也较好。可以实现对肠毒素SEI的初步定量,适用于金黄色葡萄球菌SEI的检测和流行病学调查,具有良好的应用前景。
实验中采用单克隆抗体作为包被抗体,原因是抗血清中存在非特异性蛋白,很难达到较高的特异性,易造成假阳性,而通常认为SEI单克隆抗体仅针对一种抗原决定簇,具有高特异性、高亲和力等优点,能增加体系的特异性,是包被抗体的最佳选择
[24-25]。从本研究特异性实验结果可以看出,SEI与存在于同一基因簇(egc)上的SElM
[26]无交叉反应,说明该方法与其他肠毒素发生交叉反应的可能性较低,由于肠毒素的种类繁多,肠毒素纯品的获得比较困难,本实验的局限是只针对了实验室纯化的两种蛋白SEB和SElM进行了验证,在今后的研究中还将进一步扩大验证范围。此外,本研究利用重组蛋白SEI作为免疫原制备的抗体所建立的DAS-ELISA能成功检测到携带sei基因的金黄色葡萄球菌分泌的内源性肠毒素蛋白,说明该方法能应用于金黄色葡萄球菌样本的检测。
实验所用96 孔酶标板为聚苯乙烯,通常认为聚苯乙烯仅在碱性环境下与抗体蛋白质进行非特异性结合,因此,常规ELISA方法以0.1 mol/L pH 9.2碳酸盐为包被缓冲液。但本实验通过优化,认为采用1×PBS(pH 7.4)的包被缓冲液效果更好,其原因可能是蛋白质与聚苯乙烯的固相载体是通过分子结构上的疏水基团间相互作用结合,这种非特异性吸附受蛋白质的分子质量、等电点和浓度等的影响
[27];推测SEI单克隆抗体的蛋白质等电点可能偏低,所以在pH 7.4附近包被效果最佳。当利用双抗夹心法测定抗原时,应使反应系统中有足够的抗体量,否则测得值会小于实际含量,甚至出现假阴性;但是,若抗体浓度过剩,不仅会增加了体系中非特异性结合,而且还会因蛋白浓度过高,封闭SEI单克隆抗体分子的抗原表位,导致抗原抗体复合物形成量降低,从而影响OD值
[28]。因此,在确定抗体最佳质量浓度时,在相同反应条件下,OD
450 nm值并没有随着抗体的增加而增加。抗原孵育时间、IgG/HRP孵育时间和TMB显色时间也关系到弱阳性样品的检出率,一般而言,在一定时间内,阴性孔可保持无色,而阳性孔则随时间的延长呈色加强,适当的延长时间,可以提高反应灵敏度;但IgG/HRP孵育时间和TMB显色时间过长,会使阴性孔的OD值增加,增加假阳性率。因此,本实验利用P/N法,筛选IgG/HRP孵育时间和TMB显色时间的最大值,既提高了反应体系的灵敏度,又减少假阳性率。此外,实验过程还要注意每个步骤都应按要求充分洗涤,每次洗板应把孔内水甩干;洗涤和加样过程中,需排除气泡。
目前,商品化的ELISA检测试剂盒因其使用方便、操作简单、检测快速,已广泛应用于科研和样品的检测中,然而却少有学者探究ELISA方法在食物样本中的实际检测情况。笔者通过加标回收率实验发现,对于单一环境,本实验建立的DAS-ELISA法准确度较高,但样品环境越复杂,阴性样本的OD
450 nm值则会偏高,采用DASELISA方法的检测准确度就会偏低。本研究中,巴氏杀菌乳的OD
450 nm阴性值最高,在SEI含量达20 μg/L以上才能准确检测,但同样是牛乳的UHT牛乳的准确度却较高,在2.5 μg/L以上能准确检测,其原因可能是巴氏杀菌乳杀菌效果不如UHT牛乳,里面可能存在金黄色葡萄球菌或其他外源抗体蛋白与体系中的抗体结合,导致阴性OD
450 nm升高。在以后的研究中,将进一步加大样品的检测范围,及时开发该方法,使之应用于实际生产和生活中。
综上所述,本实验初步建立了金黄色葡萄球菌新型肠毒素蛋白SEI的双抗夹心ELISA方法,并验证了该方法的性能。可作为食物中毒样品的快速检测和筛选,并具有一定的临床应用前景。
参考文献:
[1] NAOMI B, AVRAHAM R. Staphylococcal enterotoxins[J]. International Journal of Food Microbiology, 2000, 61(1): 1-10.
DOI:10.1016/S0168-1605(00)00377-9.
[2] 唐俊妮, 史贤明, 张荣, 等. 不同条件对金黄色葡萄球菌耐热核酸酶活性影响的研究[J]. 西南民族大学(自然科学版), 2010, 36(4): 589-592. DOI:10.3969/j.issn.1003-2843. 2010.04.021.
[3] LINA G, BOHACH G A, NAIR S P, et al. Standard nomenclature for the superantigens expressed by Staphylococcus[J]. The Journal of Infectious Diseases, 2004, 189(12): 2334-2336. DOI:10.1086/420852.
[4] 王琼, 唐俊妮, 汤承, 等. 针对不同来源金黄色葡萄球菌分离菌株的agrr I-IV分型初探[J]. 西南民族大学(自然科学版), 2014, 40(3): 354-357. DOI:10.3969/j.issn.1003-4271.2014.03.06.
[5] DINGES M M, ORWIN P M, SCHLIEVERT P M. Exotoxins of Staphylococcus aureus[J]. Clinical Microbiology Reviews, 2000,13(1): 16-34. DOI:10.1128/CMR.13.1.16-34.2000.
[6] BERGDOLL M S, CRASS B A, REISER R F, et al. A new Staphylococcal enterotoxin F associated with toxic-shock-syndrome Staphylococcus aureu isolates[J]. Lancet, 1981, 1: 1017-1021.
DOI:10.1016/S0140-6736(81)92186-3.
[7] LETERTRE C, PERELLE S, DILASSER F, et al. Identification of a new putative enterotoxin SEU encoded by the egc cluster of Staphylococcus aureus[J]. Journal of Applied Microbiology, 2003,95(1): 38-43. DOI:10.1046/j.1365-2672.2003.01957.x.
[8] JARRAUD S, PEYRAT M A, LIM A, et al. Egc, a highly prevalent operon of enterotoxin gene, forms a putative nursery of superantigens in Staphylococcus aureus[J]. Journal of Immunology, 2001, 166(1): 669-677. DOI:10.4049/jimmunol.166.1.669.
[9] SMITH J L, BUCHANAN R L, PALUMBO S A. Effect of food environment on staphylococcal enterotoxin synthesis: a review[J]. Journal of Food Protection, 1983, 46: 545-555. DOI:10.1111/j.1745-4565.1986.tb00559.x.
[10] MUNSON S H, TREMAINE M T, BETLEY M J, et al. Identification and characterization of staphylococcal enterotoxin type G and I from Staphylococcus aureus[J]. Infection and Immunity, 1998, 66(7): 3337-3348.
[11] KOLAWOLE D O, ADEYANJU A, SCHAUMBURG F, et al. Characterization of colonizing Staphylococcus aureus isolated from surgical wards’ patients in a Nigerian university hospital[J]. PLoS One, 2013, 8(7): e68721. DOI:10.1371/journal.pone.0068721.
[12] von EIFF C, FRIEDRICH A W, PETERS G, et al. Prevalence of genes encoding for members of the staphylococcal leukotoxin family among clinical isolates of Staphylococcus aureus[J]. Diagnostic microbiology and Infectious Disease, 2004, 49(3): 157-162. DOI:10.1016/ j.diagmicrobio.2004.03.009.
[13] AKINEDEN O, HASSAN A A, SCHNEIDER E, et al. Enterotoxigenic properties of Staphylococcus aureus isolated from goats’ milk cheese[J]. International Journal of Food Microbiology, 2008, 124(2): 211-216. DOI:10.1016/j.ijfoodmicro.2008.03.027.
[14] THOMAS L C, GIDDING H F, GINN A N, et al. Development of a real-time Staphylococcus aureus and MRSA (SAM-) PCR for routine blood culture[J]. Journal of Microbiological Methods, 2007, 68(2): 296-302. DOI:10.1016/j.mimet.2006.09.003.
[15] 李荔枝, 张军, 胡萍, 等. 多重PCR方法快速检测牛乳中金黄色葡萄球菌及其肠毒素基因型[J]. 中国乳品工业, 2013, 41(12): 34-39.
DOI:10.3969/j.issn.1001-2230.2013.12.008.
[16] ALIBAYOV B, ZDENKOVA K, SYKOROVA H, et al. Molecular analysis of Staphylococcus aureus pathogenicity islands (SaPI)and their superantigens combination of food samples[J]. Journal of Microbiological Methods, 2014, 107: 197-204. DOI:10.1016/ j.mimet.2014.10.014.
[17] SADLER C W, NAYYAR V, STACHOWSKI E R, et al. Rapid,highly discriminatory binary genotyping to demonstrate methicillinresistant Staphylococcus aureus transmission in a tertiary care intensive care unit[J]. Infection Control and Hospital Epidemiology,2015, 36(2): 160-168. DOI:10.1017/ice.2014.26.
[18] MORSE S A, MAH R A, DOBROGOSZ W. Regulation of staphylococcal enterotoxin B[J]. Journal of Bacteriology, 1969, 98(1): 4-9. [19] BLAIOTTA G, ERCOLINI D, PENNACCHIA C, et al. PCR detection of staphylococcal enterotoxin genes in Staphylococcus spp. strains isolated from meat and dairy products. Evidence for new variants of SEG and SEI in S. aureus AB-8802[J]. Journal of Applied Microbiology,2004, 97(4): 719-730. DOI:10.1111/j.1365-2672.2004.02349.x.
[20] WU L, GAO B, ZHANG F, et al. A novel electrochemical immunosensor based on magnetosomes for detection of staphylococcal enterotoxin B in milk[J]. Talanta, 2013, 106: 360-366. DOI:10.1016/ j.talanta.2012.12.053.
[21] KUANG H, WANG W, XU L, et al. Monoclonal antibody-based sandwich ELISA for the detection of staphylococcal enterotoxin A[J]. International Journal of Environmental Research and Public Health,2013, 10(4): 1598-1608. DOI:10.3390/ijerph10041598.
[22] 黄艺婧, 刘赛, 徐平, 等. 检测BDV抗原的双抗夹心ELISA法的建立[J]. 免疫学杂志, 2013, 29(5): 430-433. DOI:10.13431/j.cnki. immunol.j.20130093.
[23] SPARDING N, SLOTVED H C, NICOLAISEN G M, et al. Development of an ELISA for evaluation of swab recovery efficiencies of bovine serum albumin[J]. PLoS One, 2014, 9(11): e112876.
DOI:10.1371/journal.pone.0112876.eCollection2014.
[24] 吕娜, 殷晓平, 孙强, 等. 柱状黄杆菌双抗体夹心ELISA检测方法的建立[J]. 中国畜牧兽医, 2014, 41(3): 19-23.
[25] 宋宏新, 赵晓红. 食品免疫学[M]. 北京: 中国轻工业出版社, 2009: 205-211.
[26] COLLERY M M, SMYTH D, TWOHIG J M, et al. Molecular typing of nasal carriage isolates of Staphylococcus aureus from an Irish university student population based on toxin gene PCR, agr locus types and multiple locus, variable number tandemrepeat analysis[J]. Journal of Medical Microbiology, 2008, 57(3): 348-358. DOI:10.1099/ jmm.0.47734-0.
[27] 范祚舟, 徐加发, 沈萍萍. 酶联免疫分析技术研究进展[J]. 分析科学学报, 2011, 27(1): 113-118.
[28] 焦奎, 张书圣. 酶联免疫分析技术及应用[M]. 北京: 化学工业出版社, 2004: 17-56.
Development of a Double-Antibody Sandwich Enzyme Linked Immunosorbent Assay for Detection of Staphylococcal Enterotoxin I (SEI)
ZHU Anni, TANG Junni*, ZHAO Yanying, TANG Cheng, CHEN Juan, LIU Ji
(College of Life Science and Technology, Southwest University for Nationalities, Chengdu 610041, China)
Abstract:Objective: To establish a simple and sensitive double-antibody sandwich enzyme linked immunosorbent assay (DAS-ELISA) for the detection of a newly identified Staphylococcal aureus enterotoxin, SEI. Methods: Different combinations of coating antibody, polyclonal antibody and goat anti-rabbit IgG/HRP were tested through square matrix titration. The experimental conditions were optimized such as buffer, blocking time, antigen incubation time, goat antirabbit IgG/HRP incubation time, and chromogenic time of 3,3’,5,5’-tetramethylbenzidine (TMB). Further, the developed method was analyzed and evaluated by sensitivity, intra/inter-batch coefficients of variation and recovery of spiked samples. Results: The optimum experimental conditions were determined as follows: anti-SEI monoclonal antibody concentration,2.89 mg/L; dilution ratio of polyclonal antibody, 1:2 000; and dilution ratio of goat anti-rabbit IgG/HRP, 1:6 000,respectively. Moreover, 1 × PBS (pH 7.4) buffer solution was the optimal coating buffer, and the optimal blocking time,antigen incubation time, goat anti-rabbit IgG/HRP incubation time, and TMB chromogenic time were 60, 90, 30, and 15 min, respectively. The equation between SEI concentration and optical density at 450 nm (OD
450 nm) was fitted as follows: y = 0.040 9 x + 0.042 9 (R
2= 0.993 3). The sensitivity of the developed method was 0.5 μg/L, with intra-batch coefficient of variation < 10% and inter-batch variation < 15%. The recoveries for spiked saline, minced yak meat, steamed rice and UHT milk were all above 90%, except for pasteurized milk. Conclusion: This study has established a DAS-ELISA method for detecting newly identified staphylococcal enterotoxin I (SEI).
Key words:DAS-ELISA; Staphylococcus aureus; staphylococcal enterotoxin I (SEI); detection method
DOI:10.7506/spkx1002-6630-201616031
中图分类号:R378.1
文献标志码:A
文章编号:1002-6630(2016)16-0193-06
引文格式:
朱安妮, 唐俊妮, 赵燕英, 等. 金黄色葡萄球菌新型肠毒素I双抗夹心-酶联免疫检测方法的建立[J]. 食品科学, 2016,37(16): 193-198. DOI:10.7506/spkx1002-6630-201616031. http://www.spkx.net.cn
ZHU Anni, TANG Junni, ZHAO Yanying, et al. Development of a double-antibody sandwich enzyme linked immunosorbent assay for detection of staphylococcal enterotoxin I (SEI)[J]. Food Science, 2016, 37(16): 193-198. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201616031. http://www.spkx.net.cn
收稿日期:2015-10-03
基金项目:国家自然科学基金面上项目(31371781);四川省应用基础项目(2014JY0253);
教育部回国留学启动项目;西南民族大学研究生创新项目(CX2015SZ096)
作者简介:朱安妮(1992—),女,硕士研究生,研究方向为食品安全与加工。E-mail:zhuanni0421@163.com
*通信作者:唐俊妮(1971—),女,教授,博士,研究方向为食品安全与食品微生物。E-mail:junneytang@aliyun.com







