方 勇 1,夏 季 1,李红梅 2,陈 悦 1,裴 斐 1,孔令艳 1,杨佩玲 1,胡秋辉 1
(1.南京财经大学食品科学与工程学院,江苏省粮油品质控制及加工技术重点实验室,江苏省现代粮食流通与安全协同创新中心,江苏 南京 210023;2.国家有机食品质量监督检验中心,江苏 宝应 225800)
摘 要:为考察铅污染大米对人体的潜在健康风险,研究建立体外模拟消化/Caco-2细胞模型来测定大米中铅的生物有效性。结果表明:在模拟大米中铅的胃肠消化过程中,生米和熟米在胃消化阶段铅的生物利用率为61.34%~70.59%和39.69%~47.48%,肠消化阶段分别为24.39%~41.79%和13.57%~15.13%,经胃肠消化后籼米中铅的生物利用率均高于粳米,生米经胃、肠消化生物有效性程度均高于蒸煮后的大米。建立并利用成熟Caco-2细胞模型对大米中铅的生物有效性进行测定,使用四乙基铅与无机铅对大米加标,生米的生物有效性为3.32%和7.0%,熟米的生物有效性为2.65%和5.7%。体外模拟消化/Caco-2细胞模型是一种评价大米中铅生物有效性的有效手段。
关键词:铅;大米;体外消化;Caco-2细胞;生物有效性
铅是一种常见的重金属,随着现代工业的发展,工业“三废”以及汽车尾气的过度排放,导致铅对环境的污染日益严重,铅的多亲和性和蓄积性使得铅极易随食物链进入人体,影响神经、免疫、消化、生殖等系统的正常运转,同时对人体的造血、发育等机能构成严重威胁 [1-3]。水稻是世界上许多国家和地区的主要粮食作物,超过60%的中国居民以其为主食,大米的安全问题不容忽视。相较其他粮食作物,水稻更易从外界环境中吸收并积累铅等重金属 [4],Fang Yong等 [5]对中国市场92 种大米中的重金属含量进行了研究,发现有4.3%的大米铅含量超过其最高允许浓度,金亮等 [6]对苏北6 个县市98 个水稻样品中重金属含量进行了测定,铅的超标率达到了30%。铅的毒性评价不仅与铅摄入的绝对量有关,更与实际被吸收而发挥作用的铅的含量密切相关,因此需要用生物利用率和生物有效性来评价铅的毒性。生物有效性指环境介质中的某一种物质能够被生物体吸收的多少 [7],重金属的生物有效性可分为两部分,相对生物有效性和绝对生物有效性 [8],其中相对生物有效性又称为生物利用率,主要是指由肠内消化过程中被吸收的比例,描述摄入的食物和其基质进入消化液时污染物的百分数。生物有效性一般指绝对生物有效性,代表摄取食物中由肠道吸收的污染物的比例。
重金属的生物有效性测定中最有效的手段是动物实验,但是动物实验复杂繁琐、实验周期长、费用高,逐渐被体外模拟实验所替代,体外模拟实验成本低,变量因素少,实验结果可重复性好,因此被广泛应用于铅等重金属的毒性评价 [9-10]。常见的模拟体外消化方法是模拟胃、肠消化的二步消化法,Aziz等 [11]通过体外模拟消化/ Caco-2细胞模型来研究镉超标大米的生物利用率,生物有效性规律并利用HL-7702细胞模型研究其对人体的毒性,Fu Jin等 [12]通过体外消化/Caco-2细胞模型测定烹调条件和添加剂对青菜和波菜中铅和镉的生物有效性的影响,用来评估蔬菜中铅和镉的潜在健康风险,Omar等 [13]研究了等重金属污染大米消化后生物有效性及其可能存在的健康风险。Caco-2细胞来自人体结肠癌细胞,将其培养于醋酸纤维酯膜上,可用于构建肠道转运模型,并且由于其高通量、低成本、最接近人体反应而被广泛应用 [14-16]。近年来,对大米中生物有效性的研究主要集中在砷、镉等元素 [17-18],然而大米中铅生物有效性的研究鲜见报道,因此迫切需要建立一种测定大米中铅的生物有效性的方法,以科学评估污染大米对人体健康的危害。
本实验通过二步体外模拟胃肠消化法测定大米中铅的生物利用率,并以细胞OD值、碱性磷酸酶(alkaline phosphatase,AKP) 活力、跨膜电阻值、表面微绒毛结构为指标,建立完整的Caco-2细胞模型,同时应用建立的体外模拟消化/Caco-2细胞模型来测定大米中铅的生物有效性。
1.1 材料与试剂
高铅大米源于课题组研究样品 [5];人结肠腺癌细胞系Caco-2由中国药科大学赠送;3635型标准96 孔紫外微孔板、12 孔聚碳酯膜Transwell细胞培养板 美国康宁公司;血球计数板 盐城市丽帆玻线有限公司。
猪胃蛋白酶(1∶10 000)、二甲基亚砜 美国Sigma公司;柠檬酸钠、氯化钠、冰醋酸、乳酸、盐酸(优级纯);胎牛血清 浙江天航生物科技有限公司;杜尔伯科极限必需培养基(dulbecco minimum essential medium,DMEM)、青链霉素、pH 7.2的1×磷酸缓冲盐溶液(phosphate buffer saline,PBS)、Hank’s平衡盐溶液(Hank’s balanced salt solution,HBSS) 北京索莱宝科技有限公司;0.25%胰蛋白酶、噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT) 国药集团化学试剂有限公司;碱性磷性酶试剂盒、BCA蛋白浓度测定试剂盒 南京建成生物工程公司。
1.2 仪器与设备
8000系列二氧化碳细胞培养箱、Sorvall Stratos冷冻高速离心机 赛默飞世尔科技公司;i-mark酶标仪美国伯乐公司;倒置显微镜 卡尔•蔡司股份公司;上皮跨膜细胞电阻仪 密理博(中国)有限公司;7700x电感耦合等离子体质谱(inductively coupled plasma mass spectrometry,ICP-MS)仪 美国安捷伦公司;JEM-100CXII透射电子显微镜 日本日立公司。
1.3 方法
1.3.1 体外模拟胃肠消化
选用Raffaniello等 [19]方法进行体外消化实验,在原方法基础上稍做改进。
1.3.1.1 胃消化液的配制
取柠檬酸钠0.5 g于烧杯中,加入乳酸0.42 mL,冰醋酸0.5 mL,用0.15 mol/L NaCl 溶液溶解,定容到1 L。调pH值至1.5。称取2.5 g胃蛋白酶,用上述混合溶液溶解。
1.3.1.2 肠消化液的配制
配制饱和碳酸氢钠溶液,调节上述胃液pH值至7.0,每100 mL加入175 mg胆汁盐,50 mg胰液素,充分溶解后,静置、保存备用。
1.3.1.3 大米样品的熟制
取大米样品0.5 g于小烧杯中,加入3 mL超纯水,封口后将上述烧杯置于80 ℃水浴中加热30 min。
1.3.1.4 体外消化
将上述熟制大米样品转移至锥形瓶中,加入胃消化液50 mL,恒温水浴锅振荡离心,取上清液1 mL并重新溶解,按1.3.1.1节配制成模拟胃液,充分搅拌使混合均匀。仍将上述溶液置于37 ℃水浴中,继续振荡提取4 h,振荡并离心。取上清液1 mL,与前述胃消化阶段的上清液分别过0.22 μm滤膜,待引入ICP-MS定量分析。
1.3.1.5 生物利用率的测定
大米中铅的生物利用率由式(1)计算:
式中:D IV为消化液中铅的质量浓度/(mg/L);V IV为反应溶液体积/mL;T s为稻米中总铅含量/(mg/kg);M s为稻米的称样量/g。
1.3.2 基于Caco-2细胞模型的体外消化
1.3.2.1 Caco-2细胞培养及生长曲线测定
取对数期生长的Caco-2细胞分别接种于培养瓶及转运培养板,于37 ℃、体积分数5% CO 2、相对湿度90%的恒温培养箱中培养。转运培养板需连续培养21 d,隔天换液。分别在第2、4、6、8、10、12、14、16、18、20、21天以MTT实验测定活细胞相对数量。
1.3.2.2 细胞形态观察
另取对数期生长的细胞接种于12 孔板中,通过倒置显微镜(×20)观察不同生长期细胞形态及密集程度。1.3.2.3 跨膜电阻(transepithelial electrical resistance,TEER)值
自培养箱中取出转运细胞培养孔板,室温条件下平衡0.5 h,将用培养液平衡过的电极垂直插入细胞培养小室内,待示数稳定时记录读数。
1.3.2.4 AKP活力
本实验采用AKP试剂盒法,分别吸取细胞模型中肠腔侧(apical,AP)和基底侧(basolateral,BL)的培养液,测定AKP含量,以两侧(AP/BL)的AKP活力比值作为AKP评价的依据。
1.3.2.5 透射电子显微镜观察
采用戊二醛固定细胞,乙醇梯度脱水后,使用透射电子显微镜观察细胞表面微绒毛结构。
1.3.3 不同形态铅的IC 50值
取对数期细胞,加入不同浓度的Pb(Ⅱ)、TML、TEL、TTEL标液100 μL,通过MTT实验分别得出不同铅化合物的IC 50值。
1.3.4 生物有效性的测定
将上述肠消化液置于90 ℃水浴中10 min,过0.22 μm滤膜后作为样品。分别于大米消化液基体中添加0.25 μmol/L的Pb(Ⅱ)、TTEL,吸弃转运板中的培养液,加入HBSS缓冲液后培养0.5 h。取出后吸弃HBSS溶液,上室分别加入含有0.25 μmol/L Pb(Ⅱ)、TTEL加标的胃肠消化液,下室加入HBSS 1.5 mL。将转运板培养2 h。吸出培养液过膜后引入ICP-MS分析。大米中铅的生物有效性由式(2)计算:
生物有效性
![]()
式中:U IV为Caco-2细胞洗脱液中铅的质量浓度/(mg/L);V IV为洗脱溶液体积/mL;T s为稻米中总铅含量/(mg/kg);M s为稻米的称样量/g。
1.4 统计分析方法
实验数据采用SPSS(version 17.0)Duncan’s新复极差检数据的差异性(P<0.05)。
2.1 籼米、粳米铅的生物利用率
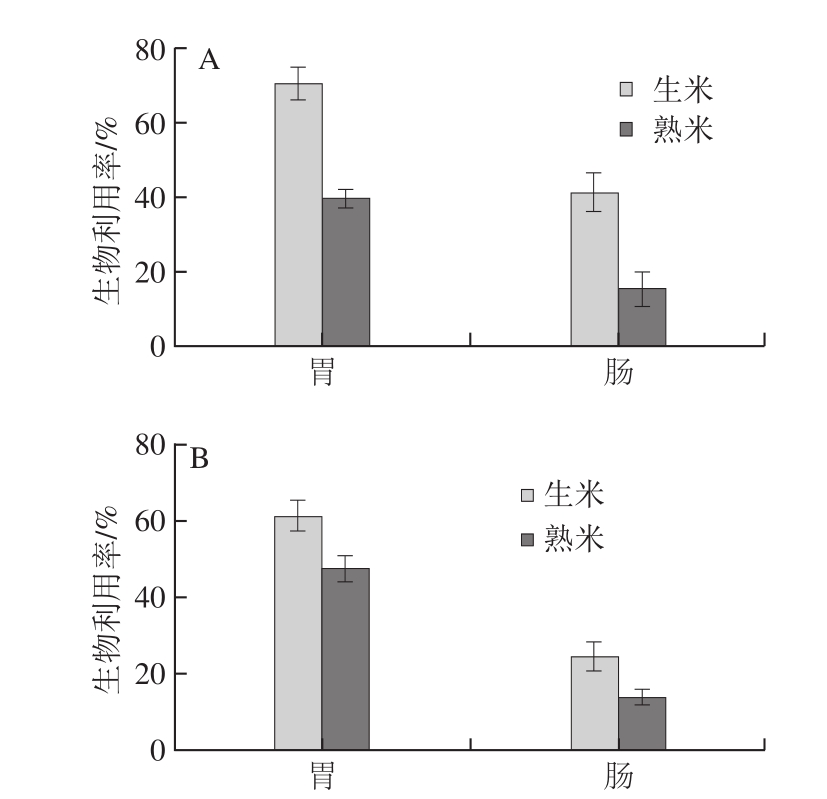
图1 生、熟处理的籼米(A)和粳米(B)中铅的生物利用率
Fig. 1 Bioaccessibility of lead in raw/cooked indica rice (A) and japonica rice (B)
由于食物在口腔的停留时间很短,唾液对食物蛋白几乎没有消化作用,故本研究选用了胃-肠二步消化法评价大米中铅的生物利用率。籼米和粳米在体外消化过程中铅的生物利用率规律相似:生米的生物利用率高于熟米,胃阶段消化后铅的生物利用率高于肠阶段。由图1可知,未经熟制的籼米在胃和肠消化阶段铅的生物利用率为70.59%和41.79%;熟制后的籼米胃和肠消化阶段铅的生物利用率为39.69%和15.13%。未经熟制的粳米在胃和肠消化阶段铅的生物利用率为61.34%和24.39%;熟制后的粳米在胃和肠消化阶段铅的生物利用率为47.48%和13.57%。
2.2 Caco-2细胞模型的建立
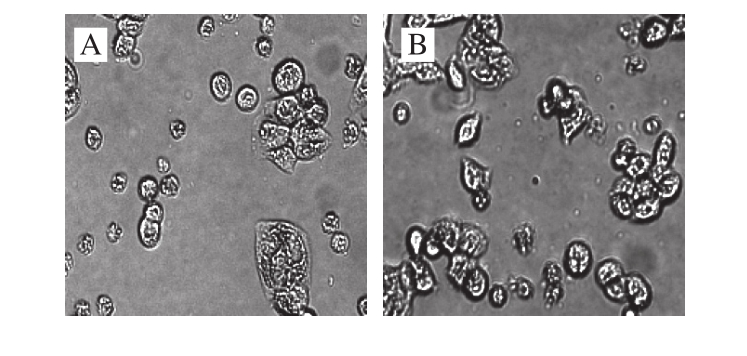
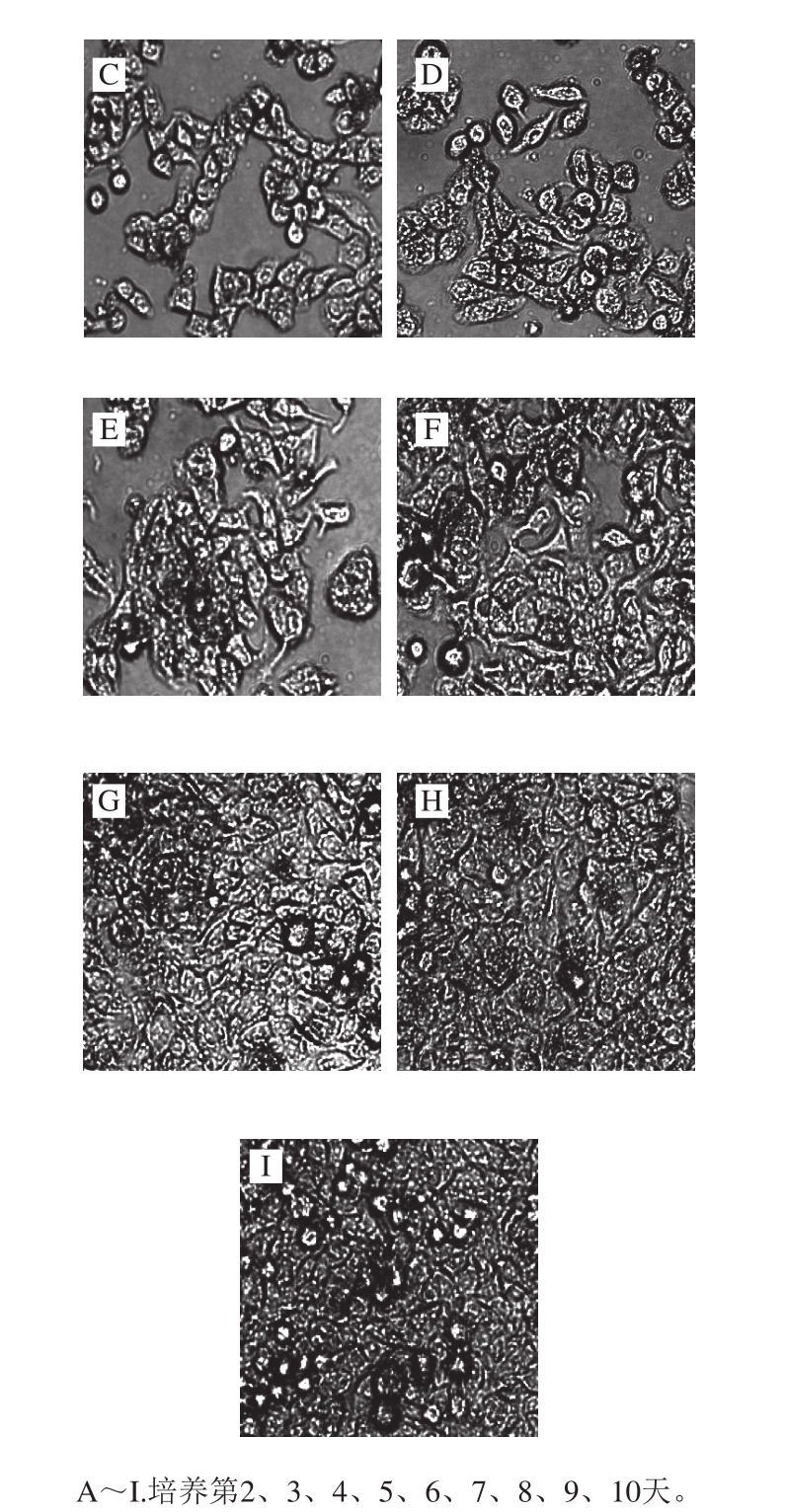
图2 Caco-2细胞培养第2~10天形态图(×20)
Fig. 2 Cellular morphologies of Caco-2 from day 2 to day 10 of culture (× 20)
图2显示,接种后的细胞于孔板底部贴壁生长。随着培养时间的推移,细胞分裂,倒置显微镜下可观察到细胞呈多角形,边缘清晰且连接紧密,至第8天时细胞已基本铺满孔底。Caco-2细胞长满孔底时在显微镜下呈铺路石状 [20]。
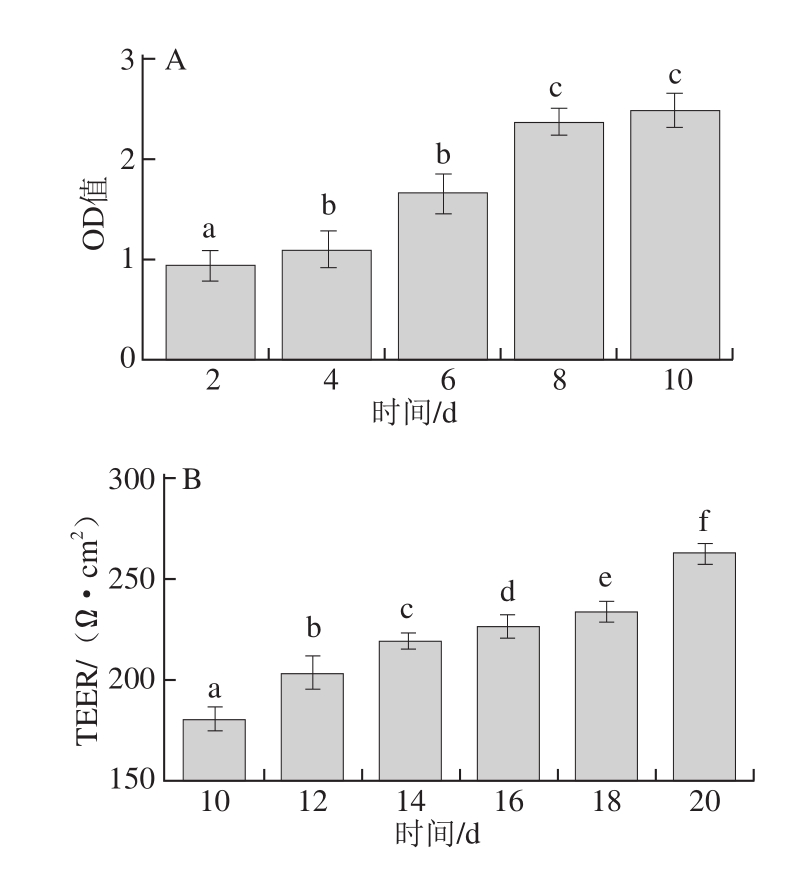
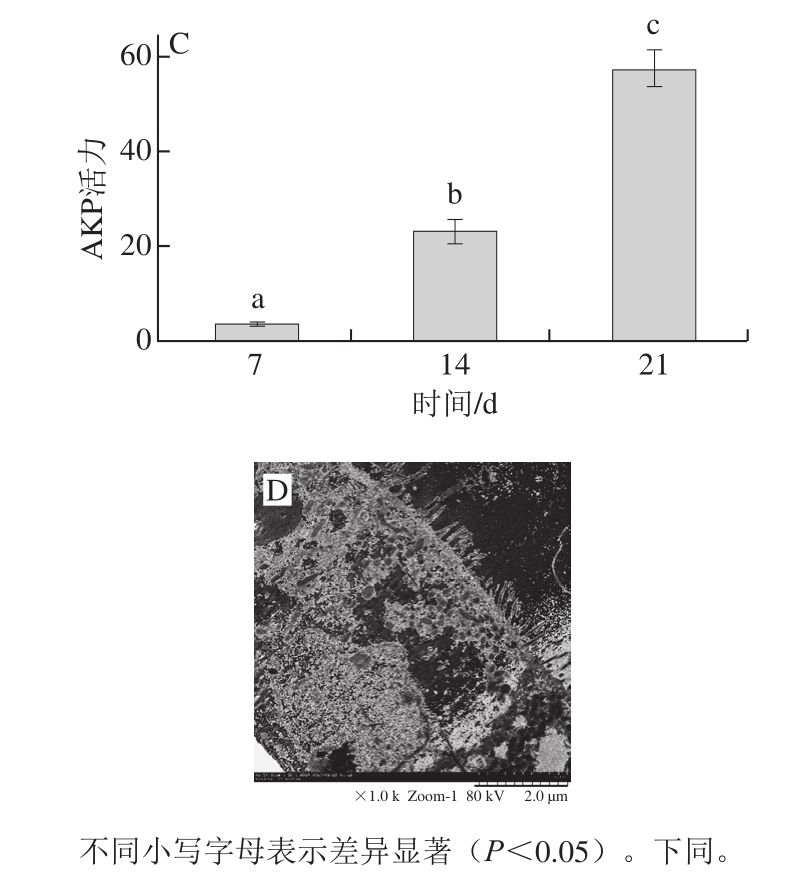
图3 Caco-2细胞模型建立中细胞生长OD值(A)、跨膜电阻值(B)、AKP活力(C)及表面微绒毛结构(D)
Fig. 3 OD value of cell growth (A), transmembrane resistance (B),alkaline phosphatase activities (C) and minute hair-like structures (D) of Caco-2 cell models
如图3所示,随着培养时间的延长,图3A中OD值不断增大,表明细胞数量在逐渐增加,自第8天起,细胞增殖速率开始减缓,8~10 d细胞的OD值变化不大。此时细胞已经基本长满孔底,细胞单层开始形成。细胞生长由增殖转为形态学上的分化。在图3B中,当细胞单层培养至第14天时,TEER值达到219 Ω·cm 2,此时在20 倍显微镜下可看到成片生长的细胞间存在细微的缝隙,细胞单层尚未均匀长满。随着培养时间的延长,TEER值不断增加,第18天开始,显微镜下观察到均匀密铺的细胞单层,此后TEER值增长迅速,细胞处在对数期,活力较高。至第20天时,TEER值达到276 Ω•cm 2,ΔR(与空白的差值)为169 Ω•cm 2,可用于转运实验。由图3C可知,当培养第17天时,AKP活力达到23.18,此时AP侧与BL侧的AKP含量已经有了较为明显的差别,细胞仍处在分化过程中。21 d时,AKP活力为57.33,是第14天的2 倍之多,此时细胞的刷状缘特征已较为完整,可以用于转运实验。培养21 d的Caco-2细胞单层表面,会出现图3D中明显的刷状缘微绒毛结构,经过培养的细胞分化出小肠肠腔侧微绒毛结构,通过AKP的测定,表明与小肠刷状缘相关的酶系已经产生,其具备人体小肠上皮细胞的形态学特征 [21-22]。
2.3 加标大米中的铅生物有效性
2.3.1 大米样品中加标铅形态的筛选
铅污染大米中铅的含量为0.36 mg/kg,Caco-2细胞转运后铅的含量较低,为了能够科学地表征铅的生物有效性,本研究拟在大米基质中加标。铅的毒性不仅与其总量有关,更与其形态息息相关,不同形态的铅的毒性各不相同 [23]。为了筛选出常见及毒性差异明显的铅形态,首先需要测定不同形态铅的Caco-2细胞毒性。由表1可知,4 种不同形态的铅化合物的毒性存在显著差异。其中有机铅的毒性均显著高于无机铅,无机铅Pb(Ⅱ)的IC 50值为4 160.2 μmol/L,有机铅的毒性由大到小为TTEL(2.0 μmol/L)>TEL(47.1 μmol/L)>TML (123.0 μmol/L),以TTEL的毒性最强。此外,食物中的铅形态为Pb(Ⅱ),是无机铅的代表,因此选择TTEL 与Pb(Ⅱ)对大米基质进行加标。
表1 不同形态铅的Caco-2细胞IC
50值(n=3)
Table 1 IC
50values of different lead speciations (n= 3)
注:不同小写字母表示Duncan’s新复极差检验差异显著(P<0.05)。
铅的形态 Pb(Ⅱ) TML TEL TTEL IC 50/(μmol/L) 4 160.2±83.2 a123.0±2.46 b47.1±0.94 c2.0±0.1 d
2.3.2 Pb(Ⅱ)和TTEL加标大米中铅的生物有效性
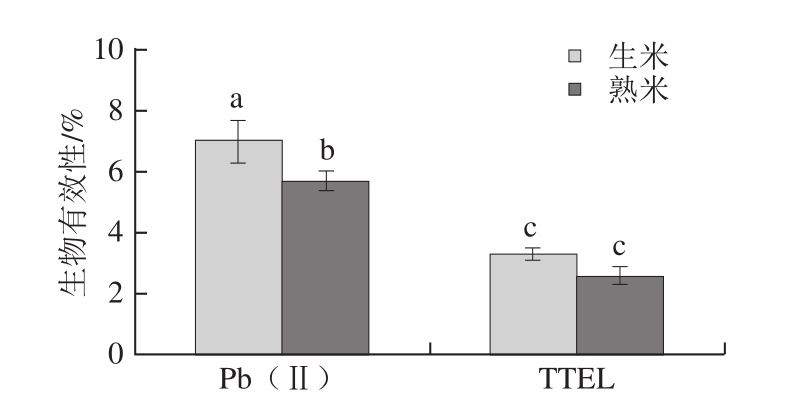
图4 Pb(Ⅱ)和TTEL加标大米中铅的生物有效性
Fig. 4 Bioavailability of lead in rice with addition of Pb (Ⅱ) and TTEL
铅主要随食物和饮水进入人体的消化道内,但铅的吸收主要是在十二指肠。食物中的铅约有5%~10%经由肠道吸收进入人体组织。由图4可以看出,模拟胃肠消化后含Pb(Ⅱ)的大米消化液,经Caco-2细胞单层转运,蒸煮前大米中铅在消化液中的生物有效性为7.0%,蒸煮后为5.7%,不经蒸煮的大米铅的生物有效性更高。TTEL加标组为经蒸煮的大米铅的生物有效性为3.32%,蒸煮后的为2.65%,未经蒸煮的大米具有更高的生物有效性,与Pb(Ⅱ)的规律一致,未经蒸煮的大米Pb(Ⅱ)的生物有效性是TTEL的2.1 倍,蒸煮后Pb(Ⅱ)的生物有效性是TTEL的2.2 倍。
本研究建立了一种体外模拟消化/Caco-2细胞模型测定大米中铅的生物有效性的方法,通过胃-肠二步体外消化法来测定大米中铅的生物利用率,并构建完整的Caco-2细胞模型测定大米中的生物有效性。在体外消化过程中,影响消化实验的因素有很多,一种广为接受的观点是,pH值与固液比是影响实验结果最关键的两个因素 [24-25]。在对籼米和粳米的研究中发现,其铅的生物利用率规律相似,生米高于熟米,胃阶段消化高于肠消化阶段。胃液以及胃蛋白酶消化在胃的蠕动作用下将大米消化为浑浊的糜状物,经肠消化后已基本没有颗粒状物质存在。大米作为食物,通常需经过蒸煮,蒸煮过程的高温使吸水后的大米开始溶胀,分裂发生糊化作用。蒸煮不仅改变了大米的食用品质,也改变了大米中淀粉与蛋白的存在状态。肠消化阶段的生物利用率较低,虽然经过了肠液中胆盐、胰酶等消化素的作用,食物被更充分地消化,重金属铅可以充分地从大米溶出到消化液,但是,肠消化阶段的pH值接近中性,在酸性胃消化阶段溶解的铅由于pH值的改变重新被固定,使得在肠液中测得的铅含量降低。无论熟制与否,胃、肠消化阶段的生物利用率均籼米均高于粳米。粳米内部存在高比例的支链淀粉,包裹米蛋白形成致密的结构,使得蛋白中的铅不宜溶出到消化液,此外粳米蛋白的铅含量显著低于籼米,使得蒸煮后粳米中铅的生物利用率低于粳米。
通过测定细胞OD值、AKP活力、跨膜电阻值及观察表面微绒毛结构构建完整的Caco-2细胞模型,使用MTT法测定细胞的OD值来反映细胞数,在第8天以后细胞基本铺满转运板,细胞分裂增殖接近饱和。
TEER值是反映细胞单层完整性的重要指标,通常认为只有当电阻值大于200 Ω·cm 2时,才能进行物质转运实验 [26-27],当细胞单层培养至14 d以后,TTER值已经超过了200 Ω·cm 2,经过21 d的培养分化,TTER值可达到接近300 Ω·cm 2,可以用于转运实验。AKP是小肠上皮细胞刷状缘的标志酶,它含量的多少能反映出小肠上皮细胞的分化程度及生长状态 [28]。本实验在第7、14、21天分别测定了AP侧和BL侧AKP活力的比值,随着时间的延长,其活力比值不断增加,表明Caco-2单层细胞的膜的极化性也在逐渐增强。在运用Caco-2细胞模型测定大米中铅的生物有效性时,对大米样品进行了加标处理,测得其生物有效性低于10%,与蒸煮之前相比,蒸熟后的大米在肠道的吸收过程中,有害重金属铅的生物有效性明显降低。此结果与Fu Jin [12]、Wang Chao [18]等的研究一致。加标处理组中TTEL加标的生和熟处理没有显著差异,这可能是因为TTEL毒性较大,对细胞有一定的损伤,影响了Caco-2细胞的转运。
本研究建立了体外模拟消化/Caco-2细胞模型,是测定大米中铅生物有效性的一种有效的手段,可为研究铅的毒性提供一种新思路和方法,在后续研究中,拟采用动物实验进一步研究大米中铅的吸收转运机理。
参考文献:
[1] 崔岩山, 陈晓晨, 付瑾. 污染土壤中铅、砷的生物可给性研究进展[J]. 生态环境学报, 2010, 19(2): 480-486. DOI:10.3969/j.is sn.1674-5906.2010.02.042.
[2] 李敏, 高俊全, 李筱薇. 硒对铅毒性的拮抗作用[J]. 卫生研究, 2005,34(3): 375-377. DOI:10.3969/j.issn.1000-8020.2005.03.043.
[3] 游勇, 鞠荣. 重金属对食品的污染及其危害[J]. 环境, 2007(2):102-103.
[4] 兰砥中, 雷鸣, 周爽, 等. 体外模拟实验法评价湘南某矿区大米中重金属的人体健康风险[J]. 农业环境科学学报, 2014, 33(10): 1897-1903. DOI:10.11654/jaes.2014.10.004.
[5] FANG Yong, SUN Xinyang, YANG Wenjian, et al. Concentrations and health risks of lead, cadmium, arsenic, and mercury in rice and edible mushrooms in China[J]. Food Chemistry, 2014, 147(6): 147-151. DOI:10.1016/j.foodchem.2013.11.078.
[6] 金亮, 李恋卿, 潘根兴, 等. 苏北地区土壤-水稻系统重金属分布及其食物安全风险评价[J]. 生态与农村环境学报, 2007, 23(1): 33-39. DOI:10.3969/j.issn.1673-4831.2007.01.008.
[7] 李仪, 章明奎. 三种模拟消化液对土壤重金属的提取性比较[J].中国环境科学, 2012, 32(10): 1807-1813. DOI:10.3969/ j.issn.1000-6923.2012.10.012.
[8] RUBY M V, SCHOOF R, BRATTIN W, et al. Advances in evaluating the oral bioavailability of inorganics in soil for use in human health risk assessment[J]. Environmental Science and Technology, 1999,33(21): 3697-3705. DOI:10.1021/es990479z.
[9] 李仪. 土壤和灰尘中铜锌铅生物利用率的体外消化方法研究[D]. 杭州: 浙江大学, 2013.
[10] LEE S J, LEE S Y, CHUNG M S, et al. Development of novel in vitro human digestion systems for screening the bioavailability and digestibility of foods[J]. Journal of Functional Foods, 2016, 22: 113-121. DOI:10.1016/j.jff.2016.01.005.
[11] AZIZ R, RAFIQ M T, LI T, et al. Uptake of cadmium by rice grown on contaminated soils and its bioavailability/toxicity in human cell lines (Caco-2/HL-7702)[J]. Journal of Agricultural and Food Chemistry,2015, 63(13): 3599-3608. DOI:10.1021/jf505557g.
[12] FU Jin, CUI Yansha. In vitro digestion/Caco-2 cell model to estimate cadmium and lead bioaccessibility/bioavailability in two vegetables:the influence of cooking and additive[J]. Food and Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association, 2013, 59(9): 215-221. DOI:10.1016/j.fct.2013.06.014.
[13] OMAR N A, PRAVEENA S M, ARIS A Z, et al. Health risk assessment using in vitro, digestion model in assessing bioavailability of heavy metal in rice: a preliminary study[J]. Food Chemistry, 2015,188: 46-50. DOI:10.1016/j.foodchem.2015.04.087.
[14] ARTURSSON P, PALM K, LUTHMAN K. Caco-2 monolayers in experimental and theoretical predictions of drug transport[J]. Advanced Drug Delivery Reviews, 2001, 46: 27-43. DOI:10.1016/ S0169-409X(96)00415-2.
[15] VÁZQUEZ M, DEVESA V, VÉLEZ D. Characterization of the intestinal absorption of inorganic mercury in Caco-2 cells[J]. Toxicology in Vitro, 2015, 29: 93-102. DOI:10.1016/j.tiv.2014.09.013.
[16] CALATATYD M, DEVESA V, MONTORO R, et al. In vitro study of intestinal transport of arsenite, monomethylarsonous acid, and dimethylarsinous acid by Caco-2 cell line[J]. Toxicology Letters, 2011,204(2/3): 127-133. DOI:10.1016/j.toxlet.2011.04.023.
[17] 孙国新, LAING G D, van de WIELE T, 等. 砷污染大米中砷的生物有效性[C]//第六届全国环境化学学术大会会议论文集. 上海: 中国化学会, 2011.
[18] WANG Chao, DUAN Hanying, TENG Jiuwei. Assessment of microwave cooking on the bioaccessibility of cadmium from various food matrices using an in vitro digestion model[J]. Biological Trace Element Research, 2014, 160(2): 276-284. DOI:10.1007/s12011-014-0047-z.
[19] RAFFANIELLO R D, LEE S Y, TEICHBERG S, et al. Distinct mechanisms of zinc uptake at the apical and basolateral membranes of Caco-2 cells[J]. Journal of Cellular Physiology, 1992, 152(2): 356-361. DOI:10.1002/jcp.1041520217.
[20] 杨芳, 金永国, 蔡朝霞, 等. Caco-2细胞体外吸收模型的建立、评价及其在营养素吸收研究中的应用[C]//中国蛋品科技大会会议论文集. 长春: 中国畜产品加工研究会, 2010.
[21] SAMBUY Y, ANGELIS I D, RANALDI G, et al. The Caco-2 cell line as a model of the intestinal barrier: influence of cell and culture-related factors on Caco-2 cell functional characteristics[J]. Cell Biology and Toxicology, 2005, 21(1): 1-26. DOI:10.1007/s10565-005-0085-6.
[22] 王德庆, 余应新, 钟玉芳, 等. Caco-2细胞模型用于毒害污染物转运与吸收研究[J]. 化学进展, 2010, 22(4): 740-747.
[23] EBDON L, HILL S J, RIVAS C. Lead speciation in rainwater by isotope dilution-high performance liquid chromatography-inductively coupled plasma-mass spectrometry[J]. Spectrochimica Acta Part B:Atomic Spectroscopy, 1998, 53(2): 289-297. DOI:10.1016/S0584-8547(97)00138-9.
[24] FLORES S R L, DOBBS J, DUNN M A. Mineral nutrient content and iron bioavailability in common and Hawaiian seaweeds assessed by an in vitro, digestion/Caco-2 cell model[J]. Journal of Food Composition and Analysis, 2015, 43: 185-193. DOI:10.1016/j.jfca.2015.06.008.
[25] CELEP E, CHAREHSAZ M, AKYÜZ S, et al. Effect of in vitro gastrointestinal digestion on the bioavailability of phenolic components and the antioxidant potentials of some Turkish fruit wines[J]. Food Research International, 2015, 78: 209-215. DOI:10.1016/ j.foodres.2015.10.009.
[26] BHUSHANI J A, KARTHIK P, ANANDHARAMAKRISHNAN C. Nanoemulsion based delivery system for improved bioaccessibility and Caco-2 cell monolayer permeability of green tea catechins[J]. Food Hydrocolloids, 2016, 56: 372-382. DOI:10.1016/ j.foodhyd.2015.12.035.
[27] 左克源. Caco-2细胞模型的建立及在口服药物吸收中的应用[D]. 武汉: 华中科技大学, 2007.
[28] DING L, WANG L, ZHANG Y, et al. Transport of antihypertensive peptide RVPSL, ovotransferrin 328-332, in human intestinal Caco-2 cell monolayers[J]. Journal of Agricultural and Food Chemistry, 2015,63(37): 8143-8150. DOI:10.1021/acs.jafc.5b01824.
Determination of the Bioavailability of Lead in Rice by in vitro Simulate Digestion/Caco-2 Cell Model
FANG Yong
1, XIA Ji
1, LI Hongmei
2, CHEN Yue
1, PEI Fei
1, KONG Lingyan
1, YANG Peiling
1, HU Qiuhui
1
(1. Key Laboratory of Grains and Oils Quality Control and Processing, Cooperative Innovation Center for Modern Grain Circulation and Security of Jiangsu Province, College of Food Science and Engineering, Nanjing University of Finance and Economic,Nanjing 210023, China; 2. National Organic Food Quality Supervision and Inspection Institute, Baoying 225800, China)
Abstract:A method to determine both the bioaccessibility and bioavailability of lead in rice grains using in vitro digestion/ Caco-2 cell model was established. The results indicated that the bioaccessibility of lead in uncooked rice and cooked rice in simulated gastric digestion were 61.34%–70.59% and 39.69%–47.48%, as well as 24.39%–41.79% and 13.57%–15.13% in simulated intestinal digestion, respectively. The lead bioaccessibility of indica rice was higher than that of japonica rice,and uncooked rice was higher than cooked rice. A Caco-2 cell model was established to evaluate the bioavailability of lead in rice. The bioavailability of tetraethyl lead (TTEL) and inorganic lead spiked in cooked rice were 3.32% and 7.0%, while those in spiked uncooked rice were 2.65% and 5.7%, respectively. In vitro digestion/Caco-2 cell model can be used as an effective method to evaluate the bioavailability of lead in rice.
Key words:lead; rice; in vitro digestion; Caco-2 cell; bioavailability
DOI:10.7506/spkx1002-6630-201616032
中图分类号:TS213.3
文献标志码:A
文章编号:1002-6630(2016)16-0199-06
引文格式:
方勇, 夏季, 李红梅, 等. 基于体外模拟消化/Caco-2细胞模型测定大米中铅的生物有效性[J]. 食品科学, 2016, 37(16): 199-204. DOI:10.7506/spkx1002-6630-201616032. http://www.spkx.net.cn
FANG Yong, XIA Ji, LI Hongmei, et al. Determination of the bioavailability of lead in rice by in vitro simulate digestion/ Caco-2 cell model[J]. Food Science, 2016, 37(16): 199-204. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201616032. http://www.spkx.net.cn
收稿日期:2016-04-08
基金项目:国家自然科学基金面上项目(31471680);江苏省自然科学基金项目(BK20131006);
江苏省高校优势学科建设工程资助项目(PAPD)
作者简介:方勇(1982—),男,副教授,博士,研究方向为食品安全与营养。E-mail:fangyong10@njue.edu.com