基于HPLC-QqQ-MS/MS技术的坛紫菜中植物激素分析
赵佳丽,徐盼盼,陈娟娟*,骆其君,杨 锐,陈海敏,严小军
(宁波大学海洋学院,浙江 宁波 315211)
摘 要:利用高效液相色谱-质谱联用技术对不同时期和不同品种坛紫菜中的植物激素进行分析研究。通过优化植物激素的提取方法,最终确定采用甲醇-水-甲酸(15∶4∶1,V/V)作为提取溶剂超声提取坛紫菜中的9 种植物激素,选用10 mmol/L乙酸铵的甲醇-水-乙酸(90∶10∶0.05,V/V)作为复溶溶剂。此外经过流动相、固定相、复溶试剂等方面的条件选择,确定采用Thermo Hypersil Gold C
18色谱柱(100 mm×2.1 mm,3 μm)为固定相,以含10 mmol/L乙酸铵溶液-甲醇为流动相,在选择反应监测模式下对吲哚乙酸、异戊烯腺苷、异戊烯腺嘌呤、反式玉米素核苷、玉米素、脱落酸、芸苔素内酯、水杨酸和赤霉素进行含量分析。结果表明,9种激素标准品线性关系良好,相关系数(R
2)均高于0.991,紫菜内主要激素(除赤霉素)回收率均在71%以上;方法的检出限均低于3 μg/L,定量限在0.45~5.0 μg/L之间。利用该方法对坛紫菜进行激素含量分析,比较分析了不同品种坛紫菜的激素分布以及不同时期(一水、二水和三水)坛紫菜中9 种植物激素的变化规律,分析了激素含量与坛紫菜形态学相关性,了解坛紫菜的激素分布情况。
关键词:坛紫菜;植物激素;高效液相色谱-三重四极杆-串联质谱联用技术;定量分析
植物激素由植物自身代谢产生,以痕量形式存在于植物体内,在极低的浓度条件下便可引发各种生理反应。各种激素相互协同连锁,对植物的生长发育和代谢进行调控,对植物生命活动和农作物生产等领域的研究具有重要意义。植物激素结构和性质迥异,且激素在植物中是微量存在的,因此亟需寻找一种高灵敏、高选择性的定性定量分析方法。目前植物激素的检测方法主要包括光谱法
[1-2]、毛细管电泳法
[3-6]、电化学生物传感器检测法
[7-10]、气相色谱法
[11-12]、高效液相色谱法
[13-18]、液相色谱-质谱联用法
[19-23]、气相色谱-质谱联用法
[24-25]。质谱的选择反应离子模式(selective reaction mode,SRM)具有特异性强、灵敏度高、准确度高、重现性好、线性动态范围宽、自动化高通量的突出优点,结合该技术的液相色谱-质谱联用技术已成为微量复杂成分的主流分析技术。
紫菜不仅具有很高的营养价值,而且是良好的保健品以及重要的工业原料。坛紫菜(Porphyra haitanensis)是中国南方最主要的栽培品种
[26],但是不同品种和时期的坛紫菜生长状态呈现不同,可能与其体内植物激素的分布相关。因此本实验对不同品种和生长周期坛紫菜的植物激素成分含量进行分析,有助于了解坛紫菜体内激素情况和坛紫菜生长过程。采用高效液相色谱-质谱联用法,建立9 种植物激素吲哚乙酸、玉米素、反式玉米素核苷、脱落酸、异戊烯腺苷、异戊烯腺嘌呤、芸苔素内酯、水杨酸、赤霉素的定量分析方法,并利用该方法检测了不同品种和不同时期坛紫菜中的激素含量情况。
1 材料与方法
1.1 材料、试剂与仪器
实验采用的浙东1号、浙东2号、苏研1号、苏研2号、闽丰1号及本地种均于2014年11月28日采自浙江象山港。浙东1号F0代(由丝状体直接养出)及当地传统栽培种的一水、二水和三水紫菜均采自象山港,其中一水采集时间为2014年10月30日、二水采集时间为2014年11月19日以及三水采集时间为2014年12月02日。所有坛紫菜样品均随机采集,且样品量均不少于50 g(以湿质量计算)。
标准品吲哚乙酸、异戊烯腺苷、异戊烯腺嘌呤、反式玉米素核苷、玉米素、脱落酸、水杨酸、赤霉素、芸苔素内酯、甲醇、乙酸(色谱纯) 美国Sigma-Aldrich公司;纯水由超纯水系统制备;其余试剂均为国产分析纯。
TSQ Quantum Access高效液相色谱-三重四极杆-串联质谱联用分析系统 美国Thermo Fisher Scientific公司;C
18固相萃取小柱(200 mg,3 cm
3)、Oasis HLB固相萃取小柱(60 mg,3 cm
3) 美国Waters公司;XS105分析天平 瑞士Mettler Toledo公司;3-8K台式高速冷冻离心机德国Sigma公司;超纯水系统 美国Pall公司。
1.2 方法
1.2.1 标准品溶液制备
准确称取吲哚乙酸、异戊烯腺苷、异戊烯腺嘌呤、反式玉米素核苷、玉米素、脱落酸、芸苔素内酯的标准品各(2±0.1) mg,用含10 mmol/L乙酸铵的甲醇-水-乙酸(90∶10∶0.05,V/V)溶解并定容至1 mL,充分摇匀,配制成2 g/L的混合标品储备液。
准确称取水杨酸和赤霉素的标准品(2±0.1) mg,用含10 mmol/L乙酸铵的甲醇-水-乙酸(90∶10∶0.05,V/V)溶解并定容至1 mL,充分摇匀,配制成2 g/L的混合标品储备液。
1.2.2 紫菜激素提取方法
参照文献[27]样品处理方法,准确称取冷冻干燥样品(2±0.001) g,液氮冰浴研磨后,用甲醇-水-甲酸(15∶4∶1,V/V)20 mL超声10 min后放入-20 ℃冰箱内避光16 h,再在4 ℃、10 000 r/min离心10 min,吸取上清液;剩余残渣再用15 mL的甲醇-水-甲酸(15∶4∶1,V/V)超声提取2次。合并上清液,35 ℃减压蒸发至干,用1 mL含10 mmol/L乙酸铵的甲醇-水-乙酸(90∶10∶0.05,V/V)复溶,将复溶液在4 ℃下10 000 r/min离心10 min,取上清液经0.22 μm有机滤膜过滤,上机分析,每个样品平行处理3 次。
1.2.3 高效液相色谱-质谱条件
高效液相色谱条件:分别采用Thermo Hypersil Gold C
18色谱柱(100 mm×2.1 mm,3 μm)为固定相;流动相为含10 mmol/L乙酸铵溶液(A)-甲醇(B),洗脱梯度为:在10 min内流动相B从15%升到95%,保持1 min后在1 min内降到15%,保持3 min;流速0.3 mL/min,柱温30 ℃,进样量10 μL。
质谱条件:分别采用电喷雾电离源正、负离子电离模式,喷雾电压分别为3 kV和2.5 kV,鞘气流量20 L/min,辅助气流量10 L/min,离子传输管温度270 ℃,Q2碰撞室碰撞诱导解离电压1.5 V,采用SRM扫描模式,碰撞气采用氩气,碰撞气压力0.199 5 Pa,Q1和Q3分辨率均设定为半峰宽0.7 D。在正离子模式下,吲哚乙酸、异戊烯腺苷、异戊烯腺嘌呤、反式玉米素核苷、玉米素、脱落酸、芸苔素内酯的离子峰强度最高;在负离子模式下,水杨酸和赤霉素的离子峰强度最高,植物激素标准品在SRM模式下的离子通道和碰撞能量见表1。
表1 植物激素标准品在SRM模式下获得的特征碎片离子
Table 1 Characteristic ion fragmentations of authentic phytohormones obtained by QqQ MS with SRM mode
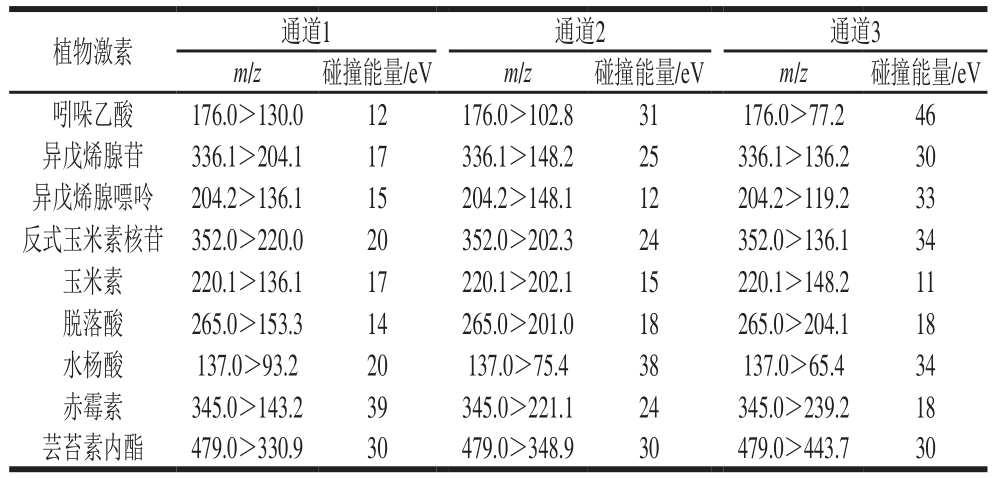
植物激素 通道1 通道2 通道3 m/z 碰撞能量/eV m/z 碰撞能量/eV m/z 碰撞能量/eV吲哚乙酸 176.0>130.0 12 176.0>102.8 31 176.0>77.2 46异戊烯腺苷 336.1>204.1 17 336.1>148.2 25 336.1>136.2 30异戊烯腺嘌呤 204.2>136.1 15 204.2>148.1 12 204.2>119.2 33反式玉米素核苷 352.0>220.0 20 352.0>202.3 24 352.0>136.1 34玉米素 220.1>136.1 17 220.1>202.1 15 220.1>148.2 11脱落酸 265.0>153.3 14 265.0>201.0 18 265.0>204.1 18水杨酸 137.0>93.2 20 137.0>75.4 38 137.0>65.4 34赤霉素 345.0>143.2 39 345.0>221.1 24 345.0>239.2 18芸苔素内酯 479.0>330.9 30 479.0>348.9 30 479.0>443.7 30
1.2.4 离子抑制率的测定
为了考察复杂基质对激素的离子化能力影响,将干质量(2±0.001)g的坛紫菜按照方法一进行提取。复溶后取800 μL提取液,提取液一分为二,一份添加400 μL流动相,另一份则添加400 μL,0.1 μg/mL的混合标准溶液。将添加流动相和添加标准液的提取液分别上机分析,并计算出各个激素的含量分别为m
1和m
2,按下式计算各个激素的离子抑制率。
抑制率
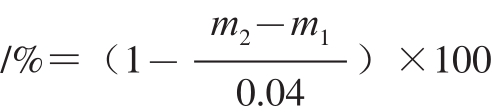
2 结果与分析
2.1 色谱条件优化
选取Thermo Hypersil Gold C
18(150 mm×4.6 mm,3 μm)、Thermo Hypersil Gold C
18(100 mm×2.1 mm,3 μm)、Thermo C
8(100 mm×2.1 mm,3 μm)、Kinetex phenomenex C
18(50 mm×2.1 mm,3 μm)色谱柱,各个柱子分别对质量浓度为1 μg/mL的混合标准品进行分离,考虑不同色谱柱的分离效果、保留时间及峰形,最终选择Hypersil Gold C
18(100 mm×2.1 mm,3 μm)为激素最佳色谱柱,分离效果如图1所示,其中吲哚乙酸、异戊烯腺苷、异戊烯腺嘌呤、反式玉米素核苷、玉米素、脱落酸和芸苔素内酯在正离子模式下定量分析,水杨酸和赤霉素在负离子模式下定量分析。
流动相以甲醇作为有机相,并分别采用10 mmol/L乙酸铵溶液、10 mmol/L的甲酸铵溶液和纯水作为水相,结果发现当水相10 mmol/L乙酸铵溶液和10 mmol/L的甲酸铵溶液时,各个激素的分离效果区别不大,有较强的响应值,且峰形较好;但是以纯水作为水相时,其信号响应值和峰形较差。因此,最终选择甲醇和10 mmol/L乙酸铵溶液作为流动相。

图1 9 种植物激素的质谱总离子流图
Fig. 1 Total ioncurrent chromatograms of nine phytohormones
2.2 复溶试剂的优化
以往使用的复溶试剂虽能溶解要检测的激素,但该上机溶液过夜则会出现絮状沉淀,在进样过程中会堵住喷雾针。为了选择最合适的复溶试剂,通过查阅,最终选择甲醇-水-乙酸(90∶10∶0.05,V/V)、含10 mmol/L乙酸铵的甲醇-水(9∶1,V/V)、含10 mmol/L乙酸铵的甲醇-水-乙酸(90∶10∶0.05,V/V)、纯甲醇以及甲醇-水(9∶1,V/V)5 种复溶试剂
[27-28]。等量标准品分别用纯甲醇和甲醇-水(9∶1,V/V)溶解时振荡后仍有不溶解,超声过后溶解,其他3 种振荡后溶解。将5 种标准品溶液过膜上机,其峰形没有太大差异。但是样品分别用甲醇-水-乙酸(90∶10∶0.05,V/V)、含10 mmol/L乙酸铵的甲醇-水(9∶1,V/V)和含10 mmol/L乙酸铵的甲醇-水-乙酸(90∶10∶0.05,V/V)复溶后,-20 ℃条件下过夜,三者出现沉淀情况最轻的为10 mmol/L乙酸铵的甲醇-水-乙酸(90∶10∶0.05,V/V)溶剂。由于标准品在10 mmol/L乙酸铵的甲醇-水-乙酸(90∶10∶0.05,V/V)溶液中不出现沉淀现象,因此可以认为样品中的絮状沉淀为杂质,并不会影响定量结果。且为了避免出现沉淀堵塞喷雾针,选择在上机分析前进行第2次过滤,且滤液不出现沉淀。此外,所有标准品和样品经10 mmol/L乙酸铵的甲醇-水-乙酸(90∶10∶0.05,V/V)复溶后,均在6 h完成液质定量分析。
2.3 提取方法的优化
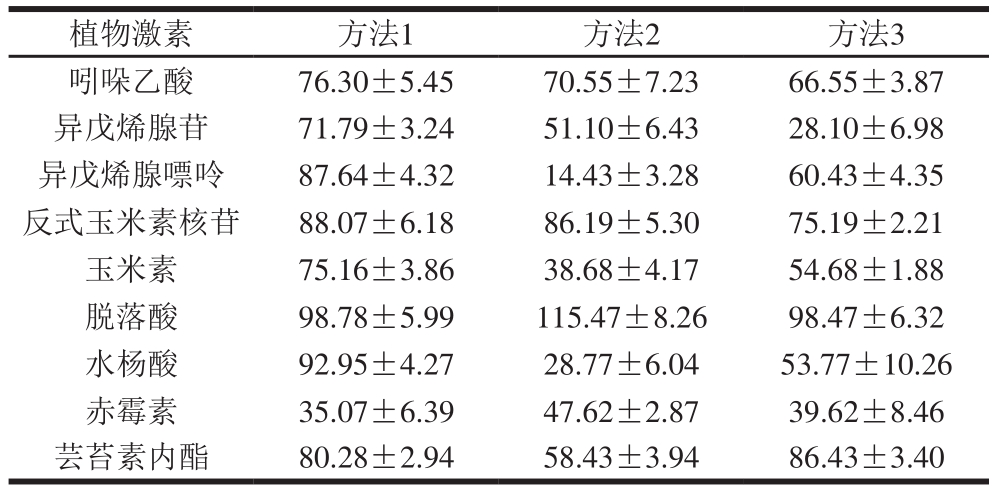
表2 9 种植物激素的3 种提取方法回收率
Table 2 Recoveries of 9 phytohormones with three extraction methods %
注:表中数据为
 ±s。表4同。
±s。表4同。
植物激素 方法1 方法2 方法3吲哚乙酸 76.30±5.45 70.55±7.23 66.55±3.87异戊烯腺苷 71.79±3.24 51.10±6.43 28.10±6.98异戊烯腺嘌呤 87.64±4.32 14.43±3.28 60.43±4.35反式玉米素核苷 88.07±6.18 86.19±5.30 75.19±2.21玉米素 75.16±3.86 38.68±4.17 54.68±1.88脱落酸 98.78±5.99 115.47±8.26 98.47±6.32水杨酸 92.95±4.27 28.77±6.04 53.77±10.26赤霉素 35.07±6.39 47.62±2.87 39.62±8.46芸苔素内酯 80.28±2.94 58.43±3.94 86.43±3.40
本实验中比较了3 种不同的样品预处理方法
[27-29]:方法1:参见1.2.2节藻样激素提取方法。方法2:准确称取冷冻干燥样品(2±0.001) g,液氮冰浴研磨,加10 mL含1%甲酸的甲醇溶液,振荡,超声30 min,15 ℃、3 000 r/min离心10 min,上清液加90 mL超纯水使得含10%甲醇,该溶液、5 mL超纯水按顺序以1~2 滴/s的速率过Oasis HLB固相小柱,最后用6 mL含1%甲酸的甲醇溶液洗脱,洗脱液在40 ℃水浴中N
2吹干,1 mL含10 mmol/L乙酸铵的甲醇-水-乙酸(90∶10∶0.05,V/V)复溶,4 ℃、10 000 r/min离心10 min,过0.22 μm有机滤膜,上机分析。方法3:准确称取冷冻干燥样品(2±0.001) g,液氮冰浴研磨,加15 mL甲醇-乙酸(100∶1,V/V),振荡,超声20 min,4 ℃、10 000 r/min离心10 min,上清液加15 mL水-乙酸(100∶1,V/V)使得甲醇-水-乙酸(5∶5∶1,V/V),再加水-乙酸(100∶1,V/V)20 mL,使得甲醇-水-乙酸(3∶7∶1,V/V),得到的50 mL溶液过C
18固相小柱,再用10 mL水洗柱子,最后用5 mL甲醇-水-乙酸(80∶20∶1,V/V)洗脱,洗脱液室温下真空旋蒸干,用1 mL含10 mmol/L乙酸铵的甲醇-水-乙酸(90∶10∶0.05,V/V)复溶,4 ℃、10 000 r/min离心10 min,过0.22 μm有机滤膜,上机分析。在空白藻体中添加分别添加1 mL 1 µg/mL标准溶液进行加标回收实验,每个质量浓度点平行3 次。3 种方法9 种植物激素的回收率经计算,如表2所示。针对3 种提取方法,方法2、3均过了固相小柱,使得检测到的杂质减少,但回收率降低,而方法1的回收率最高,操作过程最为简单,因此综合考虑选择方法1为最佳激素提取方法。
2.4 激素的液相色谱-质谱定量方法
2.4.1 标准曲线、检出限和定量限
通过储备液分别精确配制含9 种植物激素,质量浓度为2 g/L混合标准溶液。采用1.2.3节中条件进行高效液相色谱-质谱分析。如表3所示,9 种激素标准品在其线性范围内相关系数(R
2)均高于0.991。
表3 9 种植物激素的线性方程、检出限和定量
Table 3 Calibration curves for 9 phytohormons and their LODs and LOQs

注:Y为被分析物的峰面积;X为被分析物的质量浓度/(ng/mL)。
离子抑制率/%吲哚乙酸 Y=38 691.6+8 175.74X 0.997 8 5~5 000 2 4.8 1.3 6.5 11.3异戊烯腺苷 Y=517 487+191 915X 0.995 3 0.5~500 0.1 0.45 2.4 3.8 10.5异戊烯腺嘌呤 Y=29 342.6+247 778X 0.992 3 0.5~500 0.1 0.5 1.5 1.8 7.8反式玉米素核苷 Y=-3 237.74+46 953.2X 0.998 5 0.5~500 0.2 0.5 0.9 1.0 9.4玉米素 Y=118 012+57 440.8X 0.992 8 1~1 000 0.2 0.8 1.9 5.7 8.3脱落酸 Y=10 657.4+1 411.02X 0.996 3 5~5 000 1 3 2.2 9.1 12.5水杨酸 Y=10 523.1+2 100.79X 0.992 1 5~5 000 2 3.3 3.0 3.1 10.8赤霉素 Y=2 446.16+3 007.61X 0.998 0 5~5 000 1.5 3 1.7 2.3 14.2芸苔素内酯 Y=-5 017.81+254.01X 0.995 1 5~5 000 2.5 5 4.1 6.7 14.9植物激素 标准曲线 相关系数R
2检测范围/ (ng/mL)检出限/ (ng/mL)定量限/ (ng/mL)日内精密度/%日间精密度/%
各取1 mL 2 μg/L吲哚乙酸、0.1 μg/L异戊烯腺嘌呤、0.2 μg/L玉米酸、1 μg/L脱落酸、0.1 μg/L异戊烯腺苷、0.2 μg/L反式玉米素腺苷、2.5 μg/L芸苔素内酯、2 μg/L水杨酸和1.5 μg/L赤霉酸进行分析,测出在此质量浓度下的信噪比R
SN。将对应R
SN=10和R
SN=3的各标准品质量浓度作为定量限和检出限,结果如表3所示。方法的检出限均低于3 ng/mL,定量限在0.45~5 ng/mL之间,本方法检测激素的灵敏度很高。
2.4.2 方法的精密度和回收率
2.4.2.1 精密度实验结果
在1 d内连续进样1 µg/mL标准溶液5 次,记录9 种植物激素的峰面积并计算各植物激素峰面积的精密度;日间精密度:连续5 d每天连续进样5 次1 µg/mL标准溶液,记录9 种植物激素的峰面积并计算各植物激素峰面积的精密度。各植物激素峰面积的相对标准偏差如表3所示。由表3可见,峰面积的相对标准偏差为0.9%~9.1%,表明本方法精密度良好。
2.4.2.2 方法回收率实验结果
将空白藻体作为样品,分别添加1 µg/mL的标准溶液进行加标回收实验,每个质量浓度点平行3 次,由表2可见,8 种植物激素标准的回收率均在71%以上,相对标准偏差低于5%,而赤霉素的回收率较低(35%)。因此方法1,较好、较全面地满足藻类样品中植物激素含量(除赤霉素)测定要求。
2.4.2.3 离子抑制率的测定结果
如表3所示,离子抑制率均小于15%,说明复杂基质对激素的离子抑制能力影响可以忽略。
2.5 紫菜的形态学差异分析
表4 坛紫菜叶状体叶长、叶宽、长/宽值以及干质量信息
Table 4 Morphological indices and dry weight of thallus of Porphyra haitanensis

采集时间 品种 叶长/cm 叶宽/cm 长/宽值 干质量/g 2014-10-30 浙东1号(一水) 26.9±2.9 1.1±0.4 24.5 0.05±0.03 2014-11-19 浙东1号(二水) 33.4±4.6 1.4±0.5 23.8 0.06±0.05 2014-12-02 浙东1号(三水) 22.7±5.5 1.8±0.7 12.6 0.07±0.05 2014-10-30 当地传统栽培种(一水) 21.8±6.6 1.1±0.4 19.8 0.03±0.02 2014-11-19 当地传统栽培种(二水) 24.6±6.7 1.5±0.4 16.4 0.04±0.02 2014-12-02 当地传统栽培种(三水) 14.8±6.0 1.2±0.5 12.3 0.02±0.01 2014-11-28 浙东2号 36.3±5.9 1.6±0.6 22.7 0.05±0.02 2014-11-28 闽丰1号 40.6±7.0 2.2±0.9 18.4 0.08±0.04 2014-11-28 苏研1号 38.9±6.9 1.3±0.5 29.9 0.04±0.03 2014-11-28 苏研2号 31.0±4.4 2.5±1.0 12.4 0.10±0.07 2014-11-28 浙东1号 35.3±12.1 1.6±0.7 21.5 0.06±0.02 2014-11-28 当地传统栽培种 26.4±6.5 1.6±0.5 17.0 0.06±0.04
为分析不同品种和不同时期坛紫菜的表观生物学差异分别取不同坛紫菜各50 株,为保证实验的准确性,测量每株主枝上大致相同部位的30 cm长度进行长、宽和干质量等统计和测量,如表4所示。对于浙东1号和当地传统栽培种的各水之间进行比较,可以发现长/宽值的大小均为:一水>二水>三水,叶长:二水>一水>三水,且它们的长/宽值、叶长之间的差异显著(P<0.05),说明在表型上“浙东1号”和当地传统栽培种的各水已存在极显著差异,且是一水的紫菜质量最好。而对于不同品种的坛紫菜而言(均为二水之间进行比较),它们的长/宽值大小为:苏研1号>浙东1号>浙东2号>闵丰1号>当地传统栽培种>苏研2号,叶长:闵丰1号>苏研1号>浙东2号>浙东1号>苏研2号>当地传统栽培种。
2.6 紫菜中激素含量分析
实验选取的9 种植物激素:吲哚乙酸、反式玉米素核苷、玉米素、异戊烯腺苷、异戊烯腺嘌呤、芸苔素内酯、赤霉素、脱落酸和水杨酸进行比较分析,分析植物激素与不同时期、不同品种坛紫菜形态之间的相互关系。
2.6.1 浙东1号和当地传统栽培种各水的激素含量分析
在各水坛紫菜叶状体中共检测到了6 种植物激素,包括吲哚乙酸、反式玉米素核苷、异戊烯腺苷、异戊烯腺嘌呤、脱落酸和芸苔素内酯,其中吲哚乙酸属于生长素,反式玉米素核苷、异戊烯腺苷和异戊烯腺嘌呤都属于细胞分裂素,芸苔素内酯属于油菜素甾醇,具有打破顶端优势、促进侧芽萌发、能够透导芽的分化、促进侧枝生成的功能;脱落酸和水杨酸是植物生长抑制剂,抑制顶端分生组织生长,使植物丧失顶端优势,侧枝多,叶小,生殖器官也受影响。图2为浙东1号和当地传统栽培种各水中植物激素含量,但从数据分析,可以观察到在浙东1号和当地传统栽培种中,吲哚乙酸和芸苔素内酯在各水叶状体中含量较高,且它们的变化趋势相同,其含量变化趋势为三水>一水>二水;而由表4可知,这两种坛紫菜叶状体的叶长趋势为二水>一水>三水;由此,吲哚乙酸和芸苔素内酯在各水叶状体间的变化趋势与叶状体的叶长变化趋势相反。利用SPSS软件中的皮尔逊相关系数分析,结果可知,当地栽培种中吲哚乙酸与叶长间的相关系数为-0.998(P<0.05),芸苔素内酯与叶长的相关系数为-0.988(P>0.05),结果说明吲哚乙酸与叶长间存在高度相关,且差异性显著。而在浙东1号中,这两种激素的相关系数均大于0.9,但是P>0.05,不存在显著性差异。脱落酸在浙东1号与当地传统栽培种间的差异最大,当地传统栽培种各水中,仅仅二水中检测到脱落酸,含量为13.5 ng/g;而浙东1号各水间均检测到脱落酸,且三水>一水>二水,该变化趋势也与叶状体的叶长变化趋势相反。通过对浙东1号激素和叶长间的相关性分析发现,脱落酸与叶长间的相关系数为-0.997 (P<0.05),存在高度相关,且差异性显著。
对于细胞分裂素而言,反式玉米素核苷在浙东1号和当地传统栽培种各水间的变化趋势相同,它们含量在各水间的分布为:二水>一水>三水,与这两种坛紫菜各水叶状体的叶长变化趋势一致。经相关性分析发现,反式玉米素核苷与当地传统栽培种的叶长间皮尔逊相关系数为0.998(P<0.05),说明反式玉米素核苷与叶长间存在高度相关,且差异性显著。此外,异戊烯腺苷在各水叶状体中基本上没有检测到,而异戊烯腺嘌呤均检测到,但是含量较低(0.8~2.7 ng/g之间),且在三水叶状体中含量最低,这可能是因为异戊烯腺苷在藻体中呈现的是游离态,异戊烯腺嘌呤为结合态,并占主导地位。并且异戊烯腺嘌呤与当地传统栽培种的叶长间皮尔逊相关系数为0.997(P<0.05),说明异戊烯腺嘌呤与叶长间存在高度相关,且差异性显著。此外异戊烯腺嘌呤与浙东1号叶长间相关性分析时,发现相关系数为-0.667,P>0.05,说明不存在显著性差异。此外上述激素与长宽比的相关性分析中发现,它们的P值均大于0.05,说明不显著,没有统计学意义。

图2 不同时期坛紫菜中的植物激素含量
Fig. 2 The contents of phytohormones during different growth periods of Porphyra haitanensis
2.6.2 6 种坛紫菜中的植物激素含量分析
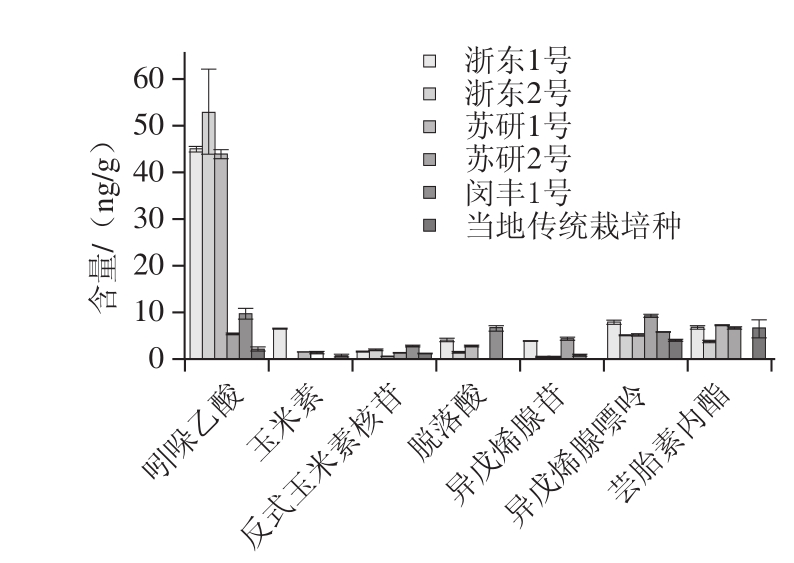
图3 不同品种坛紫菜中的植物激素含量
Fig. 3 The contents of phytohormones in different varietirs of Porphyra haitanensis
选取6 种不同品种的坛紫菜,苏研1号、苏研2号、浙东1号、浙东2号、闵丰1号和当地传统栽培种。在象山港地区进行统一养殖,采摘2014年11月28日的叶状体进行激素分析,结果如图3所示,除了水杨酸和赤霉素,共检测到7 种激素存在于叶状体中:吲哚乙酸、玉米素、反式玉米素核苷、脱落酸、异戊烯腺苷、异戊烯腺嘌呤和芸胎素内酯,其中吲哚乙酸为主要的激素,浙东1号、浙东2号、苏研1号的含量到达40 ng/g级别,明显高于其他品种中的含量;异戊烯腺嘌呤的含量要2 倍于异戊烯腺苷的含量,这与它们在藻体中状态相关。为了更好地将激素含量与形态学数据结合起来,采用SPSS软件对这些激素的含量与叶长、叶宽和长宽比3 个形态学数据进行相关性分析时,经皮尔逊相关性计算得到所有已检测激素与叶长、叶宽和长宽比之间的P值均大于0.05,说明激素的含量在不同品种坛紫菜中的相关性不显著。
3 结 论
本实验改进提取方法和液相色谱-质谱方法,以最优的条件对不同时期和不同品种坛紫菜中的植物激素进行分析研究。研究了吲哚乙酸、异戊烯腺苷、异戊烯腺嘌呤、反式玉米素核苷、玉米素、脱落酸、芸苔素内酯和水杨酸在6 种坛紫菜,即苏研1号、苏研2号、浙东1号、浙东2号、闵丰1号和当地传统栽培种的含量分布情况;并以浙东1号和当地传统栽培种为研究对象,对其不同时期,即一水、二水和三水中的激素变化情况进行分析研究。结果发现不同时期的当地传统栽培种中,吲哚乙酸、反式玉米素核苷和异戊烯腺嘌呤的含量与叶长存在高度相关性,而在不同时期的浙东1号中,脱落酸与叶长间存在高度相关性。但是已检测到的激素与不同品种的坛紫菜叶长、叶宽和长宽比间的相关性不显著。
参考文献:
[1] RITCHEY J, ZHANG H M, KAMANUS W, et al. Linearity assessment methods for sex steroid hormones and carrier proteins among men in the National Health and Nutrition Examination Survey (NHANES III)[J]. Steroids, 2014, 82: 23-28. DOI:10.1016/j.steroids.2013.12.006.
[2] ZHANG L, GUAN H L, HE Z K, et al. Determination of abscisic acid based on the fluorescent quenching of quantum dots[J]. Science China (Chemistry), 2010, 53(l): 245-249. DOI:10.1007/s11426-010-0001-7.
[3] WALE E W, BERLE J, MERTENS R, et al. Society fo rex experimentalism biology sem dinar cerise (No.29)[M]. Cambridge: Cambridge University Press, 1986: 27-58.
[4] WEI W L, GUO B Y, LIN J M. Ultra-high concentration of amylose for chiral separations in capillary electrophoresis[J]. Journal of Chromatography A, 2009, 1216(9): 1484-1489. DOI:10.1016/ j.chroma.2008.12.062.
[5] LIU X, MA L, LIN Y W, et al. Determination of abscisic acid by capillary electrophoresis with laser-induced fluorescence detection[J]. Journal of Chromatography A, 2003, 1021: 209-213. DOI:10.1016/ j.chroma.2003.09.004.
[6] ROSS A R S, AMBROSE S J, CUTLER A J, et al. Determination of endogenous and supplied deuterated abscisic acid in plant tissues by high-performance liquid chromatography-electrospray ionization tandem mass spectrometry with multiple reaction monitoring[J]. Analytical Biochemistry, 2004, 329(2): 324-333. DOI:10.1016/ j.ab.2004.02.026.
[7] 黄乐宁. 基于电化学生物传感器测定植物激素IAA的研究[D]. 长沙: 湖南农业大学, 2011.
[8] 黄乐宁, 赵严伟, 郭夏宇, 等. 基于生物传感技术测定植物激素的研究与展望[J]. 农产品加工(学刊), 2011(6): 14-16. DOI:10.3969/ jissn.1671-9646(X).2011.06.004.
[9] LI Q, WANG R Z, HUANG Z G, et al. A novel impedance immunosensor based on o-phenylenediamine modified gold electrode to analyze abscisic acid[J]. Chinese Chemical Letters, 2010, 21(4): 472-475. DOI:10.1016/j.cclet.2009.12.005.
[10] WANG R Z, LI Y W, LI Q, et al. A novel amperometric immunosensor for phytohormone abscisic acid based on in situ chemical reductive growth of gold nanoparticles on glassy carbon electrode[J]. Analytical Letters, 2009, 42(17): 2893-2904. DOI:10.1080/00032710903201909.
[11] GUPTA V, KUMAR M, BRAHMBHATT H, et al. Simultaneous determination of different endogenetic plant growth regulators in common green seaweeds using dispersive liquid-liquid microextraction method[J]. Plant Physiology and Biochemistry, 2011, 49(11): 1259-1263. DOI:10.1016/j.plaphy.2011.08.004.
[12] KAI J, FENG X M, LIU K. Development of a subcritical fluid extraction and GC-MS validation method for polychlorinated biphenyls (PCBs) in marine samples[J]. Journal of Chromatography B,2013, 923/924: 37-42. DOI:10.1016/j.jchromb.2013.01.033.
[13] 黄靖, 刘艳芝, 刘国伟, 等. 高效液相色谱法测定植物内源激素研究进展[J]. 山东农业科学, 2011(8): 101-103. DOI:10.14083/ j.issn.1001-4942.2011.08.004.
[14] SHALIGRAM S R, AJAMERI A, MODY R, et al. Development and validation of RP-HPLC and RP-UPLC methods for quantification of parathyroid hormones (1-34) in medicinal product formulated with meta-cresol[J]. Journal of Pharmaceutical Analysis, 2012, 2(2): 136-142. DOI:10.1016/j.jpha.2011.12.001.
[15] LI G L, LIU S C, SUN Z W, et al. A simple and sensitive HPLC method based on pre-column fluorescence labelling for multiple classes of plant growth regulator determination in food samples[J]. Food Chemistry, 2015, 170: 123-130. DOI:10.1016/ j.foodchem.2014.07.146.
[16] NITACHKE U, STEGEL D B. A new HPLC method for the detection of iodine applied to natural samples of edible seaweeds and commercial seaweed food products[J]. Food Chemistry, 2015, 172: 326-334. DOI:10.1016/j.foodchem.2014.09.030.
[17] MOUSSATA J, WANG Z J, WANG J. Development and validation of an HPLC method for the simultaneous quantification of indole-3-carbinol acetate, indole-3-carbinol, and 3,3’-diindolylmethane in mouse plasma, liver, and kidney tissues[J]. Journal of Chromatography B, 2014, 958: 1-9. DOI:10.1016/j.jchromb.2014.02.026.
[18] 赵曼丽, 杨迎春, 杨世杰, 等. 骆驼刺根状茎中3 种植物激素的分离与含量测定[J]. 安徽农业科学, 2012, 40(14): 8092-8093.
DOI:10.13989/j.cnki.0517-6611.2012.14.119.
[19] DURGBANSHI A, ARBONA V, POZO O, et al. Simultaneous determination of multiple phythormones in plant extracts by liquid chromatography-electrospray tandem mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2005, 53(22): 8437-8442.
DOI:10.1021/jf050884b.
[20] ZHAI X J, CHEN F, ZHU C R, et al. A simple LC-MS/MS method for the determination of cortisol, cortisone and tetrahydro-metabolites in human urine: assay development, validation and application in depression patients[J]. Journal of Pharmaceutical and Biomedical Analysis, 2015, 107: 450-455. DOI:10.1016/j.jpba.2015.01.041.
[21] ZHAO H M, WANG Y F, YUAN B, et al. A novel LC-MS/MS assay for the simultaneous determination of melatonin and its two major metabolites, 6-hydroxymelatonin and 6-sulfatoxymelatonin in dog plasma: application to a pharmacokinetic study[J]. Journal of Pharmaceutical and Biomedical Analysis, 2016, 117: 390-397.
DOI:10.1016/j.jpba.2015.09.028.
[22] YAO J F, ZHOU N, BAI L, et al. Simultaneous determination of five novel luteinizing hormone-releasing hormone antagonists by LC-MS and pharmacokinetics in rats following cassette dosing[J]. Journal of Chromatography B, 2014, 962: 94-101. DOI:10.1016/ j.jchromb.2014.05.035.
[23] PRINSEN E, DONGEN W V, ESMANS E L, et al. HPLC linked electrospray tandem mass spectrometry: a rapid and reliable method to analyse indole-3-acetic acid metabolism in bacteria[J]. Journal of Mass Spectrometry, 1997, 32: 12-22.
[24] MULLER A, DUCHTING P, WEILER E W. A multiplex GC-MS/ MS technique for the sensitive and quantitative single-run analysis of acidic phytohormones and related compounds, and its application to Arabidopsis thaliana[J]. Planta, 2002, 216: 44-56. DOI:10.1007/ s00425-002-0866-6.
[25] BJORKMAN P O, TILLBERG E. Acetylation of cytokinins and modified adenine compounds: a simple and non-destructive derivatization method for gas chromatography-mass spectrometric analysis[J]. Phytochemical Analysis, 1996, 7(2): 57-68.
[26] YANG R, ZHANG X L, SHEN M L, et al. Sequence of Mn-sod gene from Porpia haitanensis (Bangiales, Rhodophyta) and its expression under heat shock[J]. Botanica Marina, 2013, 56(3): 249-259.
[27] 刘雪梅, 赵鹏, 徐继林, 等. LC-MS同时测定大型海藻中9 个植物激素[J]. 药物分析杂志, 2012, 32(10): 1747-1752. DOI:10.16155/ j.0254-1793.2012.10.007.
[28] HAN Z, LIU G, RAO Q, et al. A liquid chromatography tandem mass spectrometry method for simultaneous determination of acid/alkaline phytohormones in grapes[J]. Journal of Chromatography B, 2012, 881: 83-89. DOI:10.1016/j.jchromb.2011.12.002.
[29] MA Z, GE L, LEE A S Y, et al. Simultaneous analysis of different classes of phytohormones in coconut (Cocos nucifera L.) water using high-performance liquid chromatography and liquid chromatographytandem mass spectrometry after solid-phase extraction[J]. Analytica Chimica Acta, 2008, 610(2): 274-281. DOI:10.1016/j.aca.2008.01.045.
Simultaneous Analysis of Nine Phytohormones in Porphyra haitanensis by High Performance Liquid Chromatography Coupled with Triple Quadrupole Tandem Mass Spectrometry
ZHAO Jiali, XU Panpan, CHEN Juanjuan*, LUO Qijun, YANG Rui, CHEN Haimin, YAN Xiaojun
(School of Marine Sciences, Ningbo University, Ningbo 315211, China)
Abstract:A quantitative method based on high performance liquid chromatography-tandem mass spectrometry (HPLC-MS) has been established for simultaneous analysis of nine phytohormones in Porphyra haitanensis. The optimized sample preparation procedure involved extraction with methonal-H
2O-formic acid (15:4:1, V/V) and re-dissolution in methonal-H
2O-acetic acid (90:10:0.05, V/V) containing 10 mmol/L ammonium acetate. The chromatography was performed using a Thermo Hypersil Gold C
18column (100 mm × 2.1 mm, 3 μm) as the stationary phase, and the mobile phase consisted of aqueous solution containing 10 mmol/L ammonium acetate-methanol. Nine phytohormones (indole-3-acetic acid, N
6-(2-isopentyl) adenosine, N
6-(2-isopentenyl)adenosine, trans-zeatin riboside, zeatin, abscisic acid, salicylic acid, gibberellin A3,and brassinolide) were quantified using selective reaction mode. As results, good linear relationships between concentrations and the corresponding peak areas of nine standards were achieved with correlation coefficients (R
2) higher than 0.991. The recoveries of eight standards except gibberellin A3 were higher than 71%. The limits of detection (LODs) of phytohormones by this method were all lower than 3 μg/L and the limits of quantification (LOQs) were in the range from 0.45 to 5 μg/L. Using the established method, the concentrations of nine phytohormones in different varieties of Porphyra haitanensis and at different cultivation periods were successfully investigated and correlated with its morphology.
Key words:Porphyra haitanensis; phytohormones; high performance liquid chromatography coupled with triple quadrupole-tandem mass spectrometry (HPLC-QqQ-MS/MS); quantitative analysis
DOI:10.7506/spkx1002-6630-201616035
中图分类号:TS252.53
文献标志码:A
文章编号:1002-6630(2016)16-0216-07
引文格式:
赵佳丽, 徐盼盼, 陈娟娟, 等. 基于HPLC-QqQ-MS/MS技术的坛紫菜中植物激素分析[J]. 食品科学, 2016, 37(16): 216-222. DOI:10.7506/spkx1002-6630-201616035. http://www.spkx.net.cn
ZHAO Jiali, XU Panpan, CHEN Juanjuan, et al. Simultaneous analysis of nine phytohormones in Porphyra haitanensis by high performance liquid chromatography coupled with triple quadrupole tandem mass spectrometry[J]. Food Science, 2016,37(16): 216-222. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201616035. http://www.spkx.net.cn
收稿日期:2015-11-09
基金项目:2015年国家星火计划重点项目(2015GA01001);宁波市自然科学基金项目(2015A610266);
浙江省水产重中之重学科开放基金项目(xkzsc1414;xkzsc1509);宁波大学王宽诚幸福基金项目
作者简介:赵佳丽(1996—),女,本科生,研究方向为质谱分析。E-mail:547085532@qq.com
*通信作者:陈娟娟(1981—),女,副教授,博士,研究方向为分析化学。E-mail:chenjuanjuan@nbu.edu.cn




 ±s。表4同。
±s。表4同。



