ELISA和UPLC-MS/MS联合检测粮食中玉米赤霉烯酮残留
李 妍
1,裴世春
1,*,王 岩
1,高建伟
1,甄玉萍
1,马明欣
2,张 品
2,谢铁志
3
(1.齐齐哈尔大学食品与生物工程学院,黑龙江 齐齐哈尔 161006;2.岛津企业管理(中国)有限公司沈阳分公司,辽宁 沈阳 110016;3.泰来县绿洲食品加工有限责任公司,黑龙江 齐齐哈尔 162400)
摘 要:建立酶联免疫吸附分析(enzyme-linked immunosorbent assay,ELISA)和超高效液相色谱-串联质谱(ultra performance liquid chromatograph-tandem mass spectrometry,UPLC-MS/MS)联合测定粮食中玉米赤霉烯酮的快速检测方法。样品经乙腈-水-乙酸(70∶29∶1,V/V)溶液提取,采用ELISA筛选出阳性样品后利用UPLC-MS/MS进行验证。实验探讨了ELISA和UPLC-MS/MS联合检测法的有效性和测定中存在的问题及其矫正方法,并且研究了UPLC-MS/MS中样品净化与未净化的回收率。结果表明,本实验建立的ELISA和UPLC-MS/MS联合检测方法快速、高效,适用于大批量粮食样品中玉米赤霉烯酮残留量的快速评估。
关键词:玉米赤霉烯酮;酶联免疫分析法;超高效液相色谱-串联质谱联用仪;粮食;检测
粮食中真菌毒素的普查和风险评估是国家科学制定真菌毒素残留法定限量标准的重要依据,也是保障粮食生产者利益和消费者安全的重要基础,由于真菌毒素的普查和风险评估研究都需要做大量的检测工作,因此可以认为快速精确的检测方法体系的确立是普查和风险评估等研究的重要前提条件。目前,酶联免疫吸附分析(enzyme-linked immunosorbent assay,ELISA)和超高效液相色谱-串联质谱(ultra performance liquid chromatograph-tandem mass spectrometry,UPLC-MS/ MS)技术是我国非国标法中应用于粮食中真菌毒素定性定量检测的最常用方法
[1-9],这两种方法各有优缺点,其中ELISA法因其具有特异性高、敏感性强、快速方便、不需要昂贵仪器设备等优点
[10],在大量样品的单一毒素阳性率的快速筛查方面具有显著优势,但是由于ELISA检测样品过程中会无法避免的受到被测物结构类似物的影响而出现明显的假阳性,需要进行进一步的确证,即便如此,ELISA仍然是大量样品中真菌毒素污染度的普查研究和风险评估研究中的重要应用手段之一;而UPLC-MS/MS技术对单个样品中多种毒素的同时精确检测方面具有明显优势,目前已有同时检测18 种毒素的研究报告
[11];杨万颖等
[12]报道了小麦粉中10 种真菌毒素的同时检测;廉慧锋等
[13]研究了9 种毒素同时检测方法。但是UPLC-MS/MS技术每次只能针对单个样品中多种毒素进行同时测定,无法进行多个样品的同时检测,另外由于基质效应
[14-17]的影响,UPLC-MS/MS分析还需要利用各种纯化设备进行样品的净化处理,这些因素往往制约了UPLC-MS/MS在真菌毒素的快速普查和风险评估研究中的广泛利用。
本实验试图构建一种基于ELISA和UPLC-MS/MS的大量样品中快速精确检测玉米赤霉烯酮(zearalenone,ZEN)残留量的联合检测法,并分析联合检测法优缺点,进而为粮食中ZEN的普查和风险评估提供一个高效检测体系。
1 材料与方法
1.1 材料与试剂
抗ZEN单克隆抗体和ZEN偶联抗原(ZEN-BSA)为本实验室自主开发;玉米、小麦、水稻 黑龙江省粮食种植区。
ZEN、α-玉米赤霉醇(α-zearalanol,α-ZAN)、β-ZAN、β-ZEN 美国Sigma公司;C
18 日本Daiso公司;0.01 mol/L的磷酸盐缓冲液(phosphate buffer solution,PBS)的配制方法:取0.27 g磷酸二氢钾,1.42 g磷酸氢二钠、8 g氯化钠、0.2 g氯化钾,加到1 000 mL去离子水中,加酸或碱调节pH值至7.4,置于4 ℃保存,备用。
1.2 仪器与设备
VICTOR X4多功能酶标仪、Wahser400 96 孔洗板机美国GE公司;Millipore-Peference超纯水系统 美国密理博公司;TYXH-B涡旋混合器 上海汗诺仪器有限公司;HH.CP-7培养箱 上海博迅实业有限公司医疗设备厂;FA1004N电子天平 上海菁海仪器有限公司;TGL-16M台式高速冷冻离心机 湖南湘仪实验室仪器开发仪器有限公司;标准检验筛(120 目) 浙江上虞市华丰五金仪器有限公司;TZ-A台式振荡器 上海跃进医疗器械厂;AISITE高速万能粉碎机 天津市泰斯特仪器有限公司;LC-30A超高效液相色谱仪与LCMS-8040三重四极杆质谱仪联用系统(具体配置为:LC-30AD×2输液泵、DGU-20A5在线脱气、SIL-30AC自动进样器、CTO-30A柱温箱、CBM-20A系统控制器、LabSolutions Ver. 5.50色谱工作站) 日本岛津公司。
1.3 方法
1.3.1 仪器参数
1.3.1.1 色谱条件
色谱柱:Shim-pack XR-ODS Ⅲ(2.0 mm×75 mm,1.6 µm);流动相A:0.02%乙酸和2 mmol/L乙酸铵溶液;B:甲醇;流速0.3 mL/min;进样体积3 µL;柱温40 ℃;梯度洗脱0~1 min、20% B,1~11 min、35% B,11~13 min、50% B,13~14 min、50% B,14~18 min、95% B,18~20 min、95% B,20~21 min、10% B,21~21.1 min、20% B。
1.3.1.2 质谱条件
离子源:电喷雾电离,正负离子扫描;干燥气(氮气)流量:15 L/min;离子源接口电压:4.5~3.5 kV;脱溶剂管温度:250 ℃;加热模块温度:450 ℃;扫描模式:多反应监测;驻留时间:10 ms。
表1 4 种真菌毒素的MRM参数
Table 1 MRM mass parameters for four mycotoxins
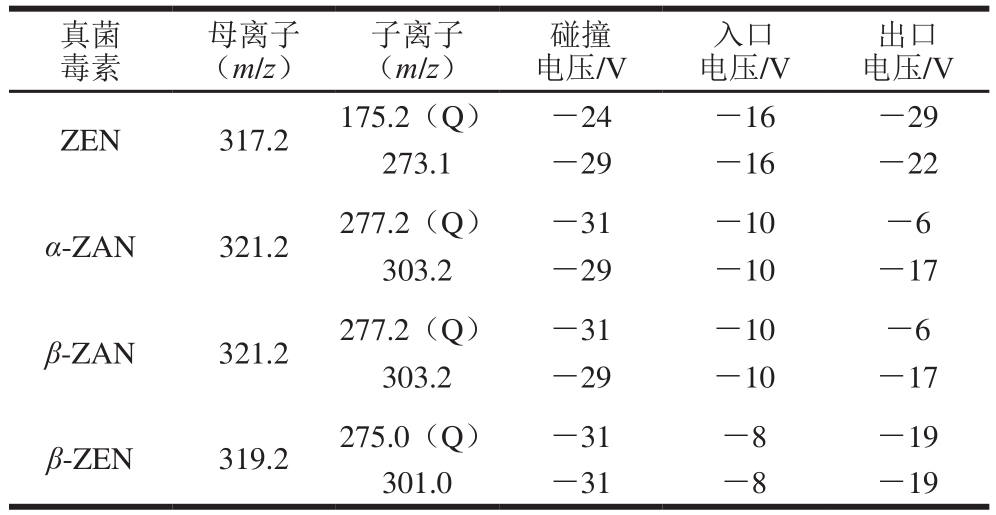
注:Q.定量离子。
出口电压/V ZEN 317.2 175.2(Q) -24 -16 -29 273.1 -29 -16 -22 α-ZAN 321.2 277.2(Q) -31 -10 -6 303.2 -29 -10 -17 β-ZAN 321.2 277.2(Q) -31 -10 -6 303.2 -29 -10 -17 β-ZEN 319.2 275.0(Q) -31 -8 -19 301.0 -31 -8 -19真菌毒素母离子(m/z)子离子(m/z)碰撞电压/V入口电压/V
1.3.2 ELISA检测
ELISA检测方法是综合了前期研究
[18-19]结果,确立了最优检测条件,即取ZEN-BSA用PBS稀释后包被液包被酶标板,以质量分数5%脱脂奶粉溶液封闭,每孔加50 μL 抗ZEN单克隆抗体,再加入标准品或待测样品50 μL,温浴后加辣根过氧化物酶标记的羊抗鼠抗体,3,3’,5,5’-四甲基联苯胺显色,加入终止液后测定OD值。
1.3.3 样品的前处理
1.3.3.1 UPLC-MS/MS检测样品的前处理
准确称取5 g粉碎样品于50 mL离心管中,加入20 mL乙腈-水-乙酸(70∶29∶1,V/V)溶液,并用涡旋混合器混匀1 min,置于旋转摇床上振荡提取30 min,然后以4 000×g离心10 min,准确转移0.5 mL上清液于1.5 mL离心管中,加入0.5 mL水,涡旋混匀后,在4 ℃条件下以12 000 r/min离心10 min,吸取上清液过0.45 μm的聚四氟乙烯滤膜,即得待测样品。
1.3.3.2 净化
取1.3.3.1节滤液2 mL,加入30 mg C
18,涡旋3 min,4 000 r/min离心5 min;过有机滤膜,供UPLC-MS/MS分析。1.3.3.3 ELISA检测样品的前处理
准确称取5 g粉碎样品于50 mL离心管中,加入20 mL乙腈-水-乙酸(70∶29∶1,V/V)溶液,并用涡旋混合器混匀1 min,置于旋转摇床上振荡提取30 min,然后以4 000×g离心 10 min,准确转移0.5 mL上清液于15 mL离心管中,加入9.5 mL PBS,涡旋混匀后,作为待测样品。
2 结果与分析
2.1 ELISA和UPLC-MS/MS方法学验证
2.1.1 线形关系及检出限、定量限
实验中利用不同质量浓度的ZEN及其衍生物的标准品工作溶液分析了ELISA和UPLC-MS/MS的检出限、定量限,其结果如表2所示,在确定的最佳ELISA条件和UPLC-MS/MS条件下进行测定的结果如图1、2所示。
表2 2 种方法的检出限及定量限
Table 2 The detection limits and quantitation limits of two methods ng/mL

检测方法 真菌毒素 检出限 定量限UPLC-MS/MS ZEN 0.02 0.07 α-ZAN 0.14 0.41 β-ZAN 2.9 8.9 β-ZEN 0.15 0.5 ELISA ZEN 0.057 0.57 α-ZAN 0.06 0.6 β-ZAN 0.055 0.55 β-ZEN 0.056 0.56
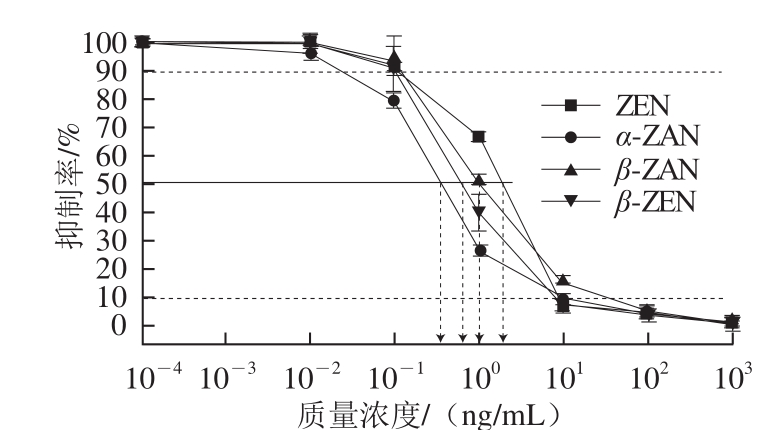
图1 毒素对ZEN单抗抑制率曲线
Fig. 1 The inhibitory curves of different toxins on anti-ZEN mAb
从图1可见,ZEN及其衍生物的抑制率曲线来看,ELISA检测的抑制率与ZEN及其衍生物的质量浓度之间总体上具有良好的非线性相关性,ZEN的抑制率在10%~90%区间内与质量浓度之间具有良好的线性相关性,可以在0.1~10 ng/mL进行定量的测定。由于粮食样品中的ZEN在前处理过程中已经被稀释了100 倍,因此实际粮食样品中的ZEN的最佳检测范围是在10~1 000 µg/kg之间为最佳,而ZEN污染度小于10 µg/kg或大于1 000 µg/kg时,ELISA检测结果则会产生较大的误差,因此对高于1 000 µg/kg污染度样品进行精确定量分析时就需要进一步稀释后进行多次的测定。而对于小于10 ng/g的污染度的粮食样品,由于国标中对粮食中的ZEN的最低残留限量设定为60 µg/kg
[20],因此多数情况下没有必要再进行测定,可视为阴性样品。

图2 UPLC-MS/MS检测毒素标准曲线(A)及流出峰(B)
Fig. 2 Standard calibration curves of toxins by UPLC-MS/MS and their elution peaks
相对于ELISA限定的检测范围,UPLC-MS/MS的检测范围却极宽(图2),从0.1~1 000 ng/mL之间均有良好的线性关系,相关系数0.99以上,考虑到样品前程处理过程中的稀释作用,利用UPLC-MS/MS可以精确检测粮食中所有高于最低残留限量值的ZEN及其衍生物。
2.1.2 回收率和精密度实验结果
选出在ELISA和UPLC-MS/MS检测不到的玉米样品中添加3 个水平ZEN标准品,使其样品中的ZEN含量分别达到10、60 µg/kg和500 µg/kg。按照前述方法经样品前处理后分别利用ELISA和UPLC-MS/MS进行了测定,其结果如表3所示。
表3 ELISA和UPLC-MS/MS检测ZEN加标回收率(n=6)
Table 3 Recoveries of zearalenone by ELISA and UPLC-MS/MS (n= 6)
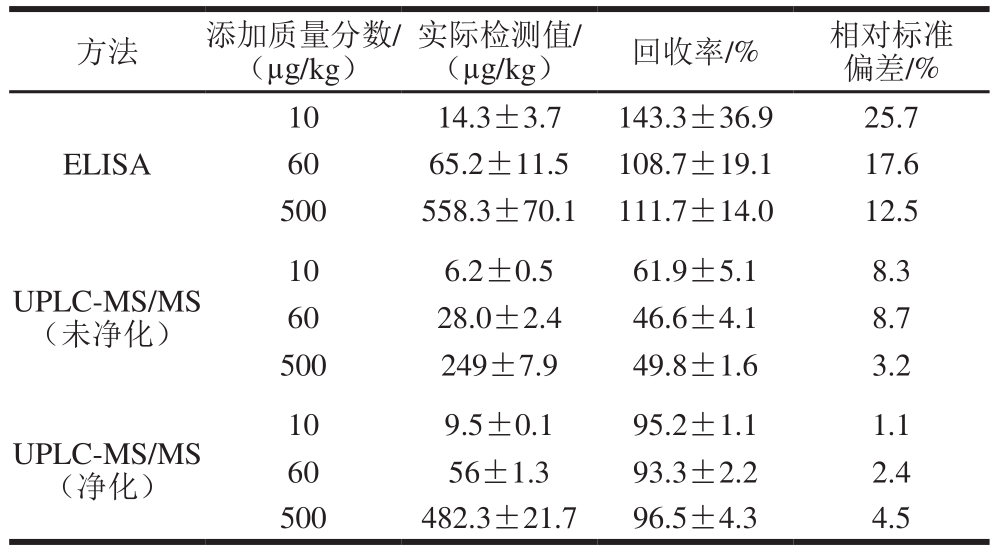
方法 添加质量分数/ (µg/kg)实际检测值/ (µg/kg) 回收率/% 相对标准偏差/% ELISA 10 14.3±3.7 143.3±36.9 25.7 60 65.2±11.5 108.7±19.1 17.6 500 558.3±70.1 111.7±14.0 12.5 UPLC-MS/MS(未净化)10 6.2±0.5 61.9±5.1 8.3 60 28.0±2.4 46.6±4.1 8.7 500 249±7.9 49.8±1.6 3.2 UPLC-MS/MS(净化)10 9.5±0.1 95.2±1.1 1.1 60 56±1.3 93.3±2.2 2.4 500 482.3±21.7 96.5±4.3 4.5
从回收率结果可以发现,不同添加水平的玉米样品中ELISA的回收率在108.7%~143.3%之间,相对标准偏差在12.5%~25.7%之间,ELISA的测定值显著高于添加量的范围,说明ELISA测定容易产生假阳性,ELISA测定值高于添加量有各种原因,其中抗ZEN单克隆抗体的交叉反应性是一个主要的影响因素。由图1可见,ZEN、α-ZAN、β-ZAN、β-ZEN的IC
50值分别为2.076、0.382、0.604 ng/mL和1.053 ng/mL,经计算α-ZAN、β-ZAN、β-ZEN相对ZEN的交叉反应率分别是544%、343%和197%,在同类研究中,马智鸿等
[21]研究报告中显示抗ZEN单克隆抗体与玉米赤霉醇的平均交叉反应度为12.3%,Erbs等
[22]研究报告中ZEN的交叉反应高于80%,说明同一类抗体的交叉反应性能具有一定的差异性,由此可知,ELISA检测过程中抗ZEN的抗体无法将ZEN和衍生物分开识别,使得样品中即使没有ZEN的污染,但只要有一定量的衍生物,也能在ELISA检测中将衍生物识别为ZEN而表现出阳性,造成ELISA在测定样品中ZEN时容易出现假阳性。而在UPLC-MS/MS检测中如图2所示,检测器将ZEN和其衍生物作为不同物质识别,ZEN、α-ZAN、β-ZAN和β-ZEN的流出峰时间分别为17.271、16.934、16.306 min和16.562 min。因此衍生物不会对检测ZEN产生明显影响。虽然ELISA和UPLC-MS/MS均可以检测ZEN,但是考虑到ELISA的假阳性出现概率较大,因此,如果在ELISA检测中样品为阴性,那么该样品中的ZEN污染度不用再进行精密检测也基本可以断定为阴性样品。
与ELISA检测出现高频次的假阳性相比较,UPLCMS/MS检测在不同水平添加样品中均表现出稳定的测定值,相对标准偏差在3.2%~8.7%之间,其添加回收率在没有经过净化处理时在46.6%~61.9%之间,明显小于添加量,说明UPLC-MS/MS检测过程中基体效应的影响较大。基体效应是LC-MS联用测定中普遍存在的问题,具体表现为当样品中的共提取物与被测物一同进入质谱系统,将在一定程度上影响被测物的离子化过程,造成响应信号的抑制或提高,由于存在基体效应,被测物在纯溶剂和在样品基体中的质谱响应值有较大差别,所以,在定量分析中,要获得较为准确的分析结果,基体效应一定要得到消除或有效抑制
[23-26]。
为了降低基体效应,利用C
18对样品进行净化后进行了检测,结果如表3所示,净化处理部分数据所示,添加回收率在93.3%~96.5%之间,比未净化处理检测值更为接近添加量值,而且相对标准偏差在1.1%~4.5%之间,测定结果更为稳定。说明C
18具有良好的消除基质效应的作用,使用C
18进行净化后可显著提高检测的回收率指标,但是C
18是昂贵耗材,而且样品处理变得复杂,对于大批量样品进行检测时不仅耗时过长而且费用也过高。通常在没有发生重大灾害条件下,粮食在采收期以及储藏初期ZEN的污染度超标比例较低,因此如果对大批量样品全部利用C
18处理后进行UPLC-MS/MS检测时就需要大量时间和巨额前处理费用,而实际上调查真菌毒素污染度的主要目标通常是为了了解超标率和超标样品的污染程度。因此,如果能采用ELISA快速筛选阳性样品后再利用UPLC-MS/MS进行精确定量,不仅节省时间,而且也可以大量节省对阴性样品进行前处理的费用。
利用同样的方法对水稻与小麦样品进行了添加回收测定,其结果与表3数据无显著性差异,因此未再重复列出相关数据。
2.2 ELISA和UPLC-MS/MS联合检测法检测实际样品
为了验证ELISA和UPLC-MS/MS联合检测法的检测效率,在粮食采收期采集了76 份小麦、玉米和水稻样品分别利用ELISA和UPLC-MS/MS进行了测定。其结果如图3所示,ELISA检测数据整体上要高于UPLC-MS/MS检测值。

图3 ZEN检测结果对比
Fig. 3 Comparison of detection results of zearalenone
将ELISA检测值以最大残留限量60 µg/kg为基准,设定小于10 µg/kg为阴性样品,10~60 µg/kg为阳性样品,大于60 µg/kg为超标样品,将图3中的检测值分段与UPLC-MS/MS检测值进行比对分析,结果如表4所示,ELISA检测为阴性的样品经UPLC-MS/MS测定,100%为阴性样品,说明仅仅利用ELISA的测定就可以断定样品是否为阴性样品,因此在实际大批量样品的ZEN检测评估中可以首先利用ELISA检测法筛选阴性样品,可以避免大量使用高价的C
18、N-丙基乙二胺或免疫亲和柱等材料对样品进行前处理;ELISA检测为未超标(10~60 µg/kg)的阳性样品经UPLC-MS/MS测定,分别有41.7%的阳性样品和58.3%的阴性样品,说明在ELISA检测中的未超标阳性样品中至少有58.3%的概率为假阳性,因此对于ELISA检测中出现的未超标阳性样品可根据具体情况需要利用UPLC-MS/MS进行验证。但是在只考虑超标样品的筛选研究时,由于ELISA检测为未超标样品时在UPLC-MS/MS中也证明了该样品没有超标,因此ELISA的检测结果可以用于确认是否有超标样品。本实验粮食样品调查中发现,利用ELISA检测结果总体有57.5%的样品没有超标,这一结果在调查超标样品的筛选研究中是有实际意义的,即可以减少大量的精确检测时间;而在ELISA检测样品为超标时,UPLC-MS/MS检测结果也存在有30.3%的阴性样品,这些样品ELISA测定值基本在60~80 µg/kg之间,说明经ELISA检测刚刚超标的样品也有很大的阴性样品的可能性,同时ELISA超标样品中在UPLC测定中出现了42.4%的阳性样品,只有27.3%的样品ELISA检测和UPLC检测均为超标样品,说明ELISA检测值在低污染样品检测中会有夸大污染的可能性,因此对于经ELISA检测为超标的样品就一定需要利用UPLC-MS/MS等精明仪器进行精确地定性定量测定,以保障正确评估粮食样品中ZEN的污染度。
表4 ELISA和UPLC-MS/MS检测样品的比较
Table 4 Comparison of detection results of samples by ELISA and UPLC-MS/MS
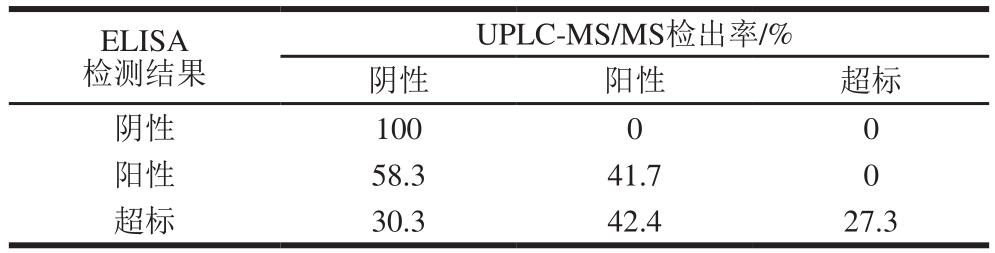
ELISA检测结果UPLC-MS/MS检出率/%阴性 阳性 超标阴性 100 0 0阳性 58.3 41.7 0超标 30.3 42.4 27.3
3 结 论
通常粮食作物在生长期、收获期、储藏期以及粮食的加工过程中由于受到微生物、环境、加工工艺等因素的影响,粮食中的ZEN污染度随时间会发生相应的变化,特别是粮食收获期的时间短,对收获期的样品检测就需要快速、简便和精准,虽然UPLC-MS/MS可以精确进行检测,但是样品需要进行必要的前处理才可以消除样品基质对测定ZEN影响,因此,对于大量样品检测时就需要耗费大量的时间和成本,往往难以快速评估粮食中ZEN的污染状况,而利用ELISA和UPLC-MS/MS相结合的检测体系可以显著减少检测时间,特别是可以大量的排除非超标样品,减少了精确检测所需样品数量,节省时间和成本,可满足大量样品中ZEN污染度普查过程中简便、快速和精准的要求。这一研究结果为收获期的粮食中真菌毒素类污染度的快速调查研究提供了科学实验依据,具有良好的推广价值。
参考文献:
[1] 张宇昊, 杨琳, 马良. 真菌毒素同时检测方法研究进展[J]. 中国粮油学报, 2011, 26(6): 123-128. DOI:1003-0174(2011)06-0123-06.
[2] 曾红燕, 黎源倩, 敬海泉. 高效液相色谱法测定粮食中玉米赤霉烯酮及其代谢物[J]. 分析化学研究简报, 2006, 34(3): 351-354.
DOI:10.3321/j.issn:0253-3820.2006.03.016.
[3] RAHMANI A, JINAP S, SOLEIMANY F. Validation of the procedure for the simultaneous determination of aflatoxins ochratoxin A and zearalenone in cereals using HPLC-FLD[J]. Food Additives and Contaminants, 2010, 27(12): 1683-1693. DOI:10.1080/19440049.2010 .514951.
[4] OFITSEROVA M, NERKAR S, PICKERING M, et al. Multiresidue mycotoxin analysis in corn grain by column high-performance liquid chromatography with postcolumn photochemical and chemical derivatization: single-laboratory validation[J]. Journal of AOAC International, 2009, 92(1): 15-26. DOI:10.3920/wmj2010.1212.
[5] 张强. ELISA技术在食品安全检测中的应用研究进展[J]. 长江大学学报, 2015, 12(33): 45-49. DOI:10.3969/j.issn.1673-1409(s).2015.33.012.
[6] 应永飞, 朱聪英, 韦敏珏, 等. 液相色谱-串联质谱法测定饲料中14种霉菌毒素及其类似物[J]. 分析化学研究报告, 2010, 38(12): 1759-1764. DOI:10.3724/SP.J.1096.2010.01759.
[7] SARTORI A V, de MATTOS J S, de MORAES M H P, et al. Determination of aflatoxins M
1, M
2, B
1, B
2, G
1, and G
2and ochratoxin A in UHT and powdered milk by modified QuEChERS method and ultra-high-performance liquid chromatography tandem mass spectrometry[J]. Food Analytical Methods, 2015, 8(9): 2321-2330.
DOI:10.1007/s12161-015-0128-4.
[8] BERNHARDT K, VALENTA H, KERSTEN S, et al. Determination of T-2 toxin, HT-2 toxin, and three other type A trichothecenes in layer feed by high-performance liquid chromatography-tandem mass spectrometry (LC-MS/MS)-comparison of two sample preparation methods[J]. Mycotoxin Research, 2016, 32(2): 89-97. DOI:10.1007/ s12550-016-0244-z.
[9] LUKACS Z, SCHAPER S, HERDERICH M, et al. Identification and determination of fumonisin FB
1and FB
2in corn and corn products by high-performance liquid chromatography-electrospray-lonization tandem mass spectrometry (HPLC-ESI-MS-MS)[J]. Chromatographia,1996, 43(3/4): 124-128. DOI:10.1007/bf02292939.
[10] 周晓, 谢体三, 刘运龙. ELISA技术在食品真菌毒素检测中的应用[J]. 粮食与食品工业, 2007, 14(5): 49-52. DOI:10.3969/ j.issn.1672-5026.2007.05.016.
[11] 宫小明, 任一平, 董静, 等. 超高效液相色谱串联质谱法测定花生粮油中18 种真菌毒素[J]. 分析测试学报, 2011, 30(1): 6-12.
DOI:10.3969/j.issn.1004-4957.2011.01.002.
[12] 杨万颖, 郑彦婕, 李碧芳, 等. 液相色谱串联质谱法同时测定小麦粉中10 种真菌毒素[J]. 广东化工, 2008, 35(9): 123-128. DOI:10.3969/ j.issn.1007-1865.2008.09.040.
[13] 廉慧锋, 赵笑天, 王蓉珍, 等. 超高效液相色谱-串联质谱法同时测定玉米、花生、麦仁中的9 种真菌毒素[J]. 食品科学, 2010, 31(20): 360-366. DOI:1002-6630(2010)20-0360-07.
[14] 王连珠, 周昱, 陈泳, 等. QuEChERS样品前处理-液相色谱-串联质谱法测定蔬菜中66 种有机磷农药残留量方法评估[J]. 色谱, 2012,30(2): 146-153. DOI:10.3724/SP.J.1123.2011.10012.
[15] 秦姗姗. 农产品中农药残留分析方法研究及基质效应探讨[D]. 郑州: 郑州大学, 2015: 5-7.
[16] 王立琦, 贺利民, 曾振灵, 等. 液相色谱-串联质谱检测兽药残留中的基质效应研究进展[J]. 质谱学报, 2011, 32(6): 311-332.
DOI:10.3969/j.issn.1001-3814.2010.07.030.
[17] 向平, 沈敏, 卓先义. 液相色谱-质谱分析中的基质效应[J].分析测试学报, 2009, 28(6): 753-756. DOI:10.3969/ j.issn.1004-4957.2009.06.026.
[18] PEI Shichun, WON J L, ZHANG Gaiping, et al. Development of antizearalenone monoclonal antibody and detection of zearalenone in corn products from China by ELISA[J]. Food Control, 2013, 31(1): 65-70.
DOI:10.1016/j.foodcont.2012.09.006.
[19] PEI Shichun, ZHEN Yuping, GAO Jianwei, et al. Screening and monitoring zearalenone-producing Fusarium species by PCR and zearalenone bymonoclonal antibodies in feed from China[J]. Food Additives and Contaminants: Part B: Surveillance, 2014, 7(4): 282-287. DOI:10.1080/19393210.2014.925981.
[20] 卫生部. GB 2761—2011 食品中真菌毒素限量[S]. 北京: 中国标准出版社, 2011.
[21] 马智鸿, 黄飚, 屠蔷, 等. 应用生物素-链霉亲和素的酶联免疫吸附法检测谷物中的玉米赤霉烯酮[J]. 安徽农业科学, 2009, 37(15): 6849-6851. DOI:10.3969/j.issn.0517-6611.2009.15.016.
[22] ERBS M, HARTMANN N, BUCHELI T D. Determination of the cross-reactivities for α-zearalenol, β-zearalenol, zearalanone,α-zearalanoi, and β-zearalanol on three commercial immunoaffínity columns targeting zearalenone[J]. Journal of AOAC Internmional,2007, 90(4): 1197-1202.
[23] 齐美玲. 液相色谱-质谱法在生物样品药物定量分析中的基质效应[J]. 药物分析杂志, 2005, 25(4): 476-479. DOI:10.16155/j.0254-1793.2005.04.017.
[24] JANSSON C, PIHLSTROM T, OSTERDAHL B G, et al. A new multi-residue method for analysis of pesticide residues in fruit and vegetables using liquid chromatography with tandem mass spectrometric detection[J]. Journal of Chromatography A, 2004, 1023: 93-104. DOI:10.1016/j.chroma.2003.10.019.
[25] HERNANDEZ F, SANCHO J V, POZO O J. Critical review of the application of liquid chromatography/mass spectrometry to the determination of pesticide residues in biological samples[J]. Analytical and Bio-analytical Chemistry, 2005, 382: 934-946. DOI:10.1007/ s00216-005-3185-5.
[26] BESTER K, BORDIN G, RODRIGUEZ A, et al. How to overcome matrix effects in the determination of pesticidesin fruit by HPLCESI-MS-MS[J]. Fresenius Journal of Chemistry, 2001, 371: 550-555.
DOI:10.1007/s002160101020.
Combined Use of ELISA and UPLC-MS/MS for Detection of Zearalenone from Grains
LI Yan
1, PEI Shichun
1,*, WANG Yan
1, GAO Jianwei
1, ZHEN Yuping
1, MA Mingxin
2, ZHANG Pin
2, XIE Tiezhi
3
(1. College of Food and Biological Engineering, Qiqihar University, Qiqihar 161006, China;2. Shenyang Analytical Application Center, Shimadzu (China) Co. Ltd., Shenyang 110016, China;3. Tailai Oasis Food Processing Co. Ltd., Qiqihar 162400, China)
Abstract:An enzyme-linked immunosorbent assay (ELISA) coupled to ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) method was developed for the determination of zearalenone in corn samples. Samples were extracted with acetonitrile-water-acetic acid (70:29:1, V/V) and then the extract was determined by ELISA and UPLCMS/MS. In the study, special attention was given to the stability of the system and the matrix effects frequently observed in the process. The recovery of UPLC-MS/MS with and without sample purification was evaluated as well. Proper approaches for dealing with these problems were obtained. This analysis method proved easy, fast and suitable for the determination of zearalenone in bulk grain samples.
Key words:zearalenone; ELISA; UPLC-MS/MS; grain; detection
DOI:10.7506/spkx1002-6630-201616037
中图分类号:TS207.5
文献标志码:A
文章编号:1002-6630(2016)16-0229-06
引文格式:
李妍, 裴世春, 王岩, 等. ELISA和UPLC-MS/MS联合检测粮食中玉米赤霉烯酮残留[J]. 食品科学, 2016, 37(16): 229-234. DOI:10.7506/spkx1002-6630-201616037. http://www.spkx.net.cn
LI Yan, PEI Shichun, WANG Yan, et al. Combined use of ELISA and UPLC-MS/MS for detection of zearalenone from grains[J]. Food Science, 2016, 37(16): 229-234. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201616037. http://www.spkx.net.cn
收稿日期:2016-03-24
基金项目:国家科技基础性工作专项(2013FY113400);黑龙江省教育厅科学计划项目(12541871)
作者简介:李妍(1992—),女,硕士研究生,研究方向为食品营养与安全。E-mail:997489417@qq.con
*通信作者:裴世春(1966—),男,教授,博士,研究方向为食品营养与安全。E-mail:peishichun@qqhru.edu.cn






