李文文,吴光斌,陈发河*
(集美大学食品与生物工程学院,福建 厦门 361000)
摘 要:目的:研究0.01%秋水仙碱处理对采后莲雾果实在冷藏期间生理品质、活性氧代谢和能量代谢的影响,探讨秋水仙碱影响采后莲雾的衰老机制。方法:分别用0、0.01%的秋水仙碱溶液浸泡莲雾果实15 min,于4 ℃贮藏,检测果实品质、活性氧代谢和能量代谢的变化。结果:秋水仙碱处理可以抑制贮藏期间絮状绵软指数的上升,第4天之后效果显著(P<0.05),处理后的果实质量损失率整个贮藏期间显著低于对照组(P<0.05);秋水仙碱处理可以减缓超氧化物歧化酶(SOD)活性的下降,抑制过氧化氢酶(CAT)活性高峰的出现,保持较低CAT活性,显著提高贮藏后期第8~12天过氧化物酶(POD)活性(P<0.05);同时可以保持较高琥珀酸脱氢酶(SDH)和细胞色素C氧化酶(CCO)活性,处理组的SDH活性在第4、8、12天显著高于对照组(P<0.05),CCO活性在第2、6、8天显著高于对照组(P<0.05);秋水仙碱处理还可以减缓贮藏后期ATP含量和能荷水平的下降,与对照组有显著差异(P<0.05)。结论:0.01%的秋水仙碱处理能显著延缓采后莲雾果实絮状绵面积的增加;采后莲雾果实絮状绵软面积与能荷水平呈显著负相关性(r=-0.793,P<0.05),能量亏缺会加剧莲雾果实衰老;能荷水平与活性氧代谢指标H 2O 2含量呈显著负相关(r=-0.766,P<0.05),与SOD活性呈显著正相关(r=0.802,P<0.05),能量代谢会影响活性氧代谢;秋水仙碱主要依靠调节能量代谢起作用。
关键词:秋水仙碱;莲雾;活性氧代谢;能量代谢;贮藏保鲜
莲雾(Syzygium samarangense Merr. et Perry)又名洋蒲桃、爪哇蒲桃、水蒲桃等,属于桃金娘科蒲桃属植物,是著名的热带、亚热带水果 [1],深受消费者喜爱。莲雾采后呼吸代谢旺盛,衰老速度快,极不耐贮运。采收后如不及时处理,短时间内就会褪色,果肉发生絮状绵软并伴有失水症状,食用品质急剧劣变并腐烂,莲雾果实采后失水性絮状绵软症状已成了限制莲雾果实市场流通的瓶颈。因此,研究采后莲雾果实絮状绵软机理及其调控具有重要的现实意义。研究 [2]表明生物体衰老过程是活性氧代谢失调与累积的过程,采后果蔬的成熟、衰老与活性氧代谢密切相关 [3],对龙眼 [4]、黄花梨 [5]、李子 [6]等的研究证明了以上观点。超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)是活性氧代谢中清除活性氧的保护酶,林植芳等 [7]发现荔枝在成熟衰老过程中,SOD活性随之下降;外源硫化氢能通过显著提高贮藏后期SOD活性,延缓桃子衰老 [8];CAT可以将H 2O 2分解成O 2和H 2O,解除H 2O 2对果实的毒害;在果实的成熟衰老中,过氧化物酶(peroxidase,POD)的作用较为复杂,在库尔勒香梨 [9]和草莓 [10]中作为保护酶,但是在荔枝 [7]中却作为果实衰老的标志。采后果实的能量亏损也会加剧果实衰老 [11],正常情况下,果蔬组织通常能够合成足够的能量以维持正常的生命活动;但当采后果蔬衰老或遭受逆境胁迫时,则会导致呼吸链受损、ATP合成能力降低,从而造成细胞因能量亏缺和代谢紊乱,最终导致细胞死亡 [11]。有研究表明,荔枝 [12]、‘油木奈’ [13]果实采后衰老与能量水平密切相关。国内外关于莲雾的研究报道较少 [14-15]。在采后贮藏保鲜方面,Khandaker等 [16]发现用萘乙酸处理采后莲雾果实可维持果实较高的可溶性固形物含量和硬度;赵菊鹏等 [17]发现 60Co-γ射线辐照可以降低莲雾腐烂率;Pan等 [18]研究发现随着贮藏温度的升高,莲雾果实的可溶性糖、淀粉、总酚、游离氨基酸含量都逐渐下降;Suriyan等 [19]发现(4 ± 2) ℃贮藏鲜切莲雾果实有利于减少果皮色泽的变化和保持其营养价值;叶建兵等 [20]发现通过用不同剂量NO熏蒸莲雾果实,10 µL/L和20 µL/L NO处理能显著抑制贮藏过程中莲雾果实的呼吸速率,减轻絮状绵软进程。
秋水仙碱是从百合科秋水仙的球茎和种子中提取的一种生物碱,目前,秋水仙碱及其衍生物在农业中主要应用于多倍体育种方面 [21-22],秋水仙碱用于调控园艺产品采后生理代谢方面的研究报道尚少。本实验通过分析秋水仙碱处理后莲雾果实活性氧和能量代谢的变化,探讨秋水仙碱对采后莲雾果实生理变化和絮状绵软进程的影响,以期为莲雾采后絮状绵软控制机理提供一定的理论依据。
1.1 材料与试剂
实验采用的台湾‘黑珍珠’莲雾,于2015年3月14日购自福建省厦门中埔台湾水果集散中心,早晨运回实验室,挑选出大小、成熟度一致、表面无机械损伤和病虫害的果实。
丙酮 西陇化工股份有限公司;四氯化钛、乙二胺四乙酸二钠(EDTA·2Na)、愈创木酚、聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)、甘露醇、琥珀酸钠、牛血清白蛋白(bovine serum albumin,BSA)、氯化硝基四氮唑蓝(nitrotetrazolium blue chloride,NBT) 国药集团化学试剂有限公司;2,6-二氯酚靛酚钠(2,6-dichloroindophenol,DCPIP)、甲硫酚嗪(5-methylphenazinium methosulfate,PMS) 上海阿拉丁公司。以上试剂均为分析纯。
1.2 仪器与设备
AL104电子天平 梅特勒-托利多仪器(上海)有限公司;XB 130制冰机 宁波格兰特制冷设备制造有限公司;DK-S26恒温水浴锅 上海精宏实验设备有限公司;IEC 31R冷冻离心机、ULT-1386-3V超低温冰箱 美国Thermo Fisher公司;TMS-PRO质构仪美国FTC公司;Cary50紫外-可见分光光度计 美国Varian公司;e2695高效液相色谱仪 美国Waters公司。
1.3 方法
1.3.1 实验分组与处理
将莲雾果实随机分成2 组,室温条件下分别在蒸馏水和0.01%秋水仙碱水溶液中浸泡15 min(0.01%秋水仙碱最佳处理质量分数通过筛选实验获得),自然晾干,然后放入塑料筐中,用保鲜膜封装,四周留有通风口,放入4 ℃冷库中贮藏12 d,每隔1 d测定相关指标。测定相关指标时取对照组果实切碎混匀后,随机取3 份样品进行实验,每份样品进行3 次平行实验,秋水仙碱处理类似。1.3.2 指标测定
1.3.2.1 绵软指数的测定
将莲雾果实从中间切开,分别测定果实纵切面絮状绵软部分的面积与纵切面的面积。以絮状绵软面积占莲雾果实纵切面面积的百分比表示莲雾果实的絮状绵软指数,数据测定重复3 次,计算见公式(1):
1.3.2.2 质量损失率的测定
取3 个成熟度一致的莲雾果实为一组,每隔1 d称量一次果实鲜质量,并记录。重复3 次。
1.3.2.3 H 2O 2含量的测定 [23]
准确称取15 g冷冻果肉,加入15 mL预冷的丙酮,冰浴研磨,4 层纱布过滤,4 ℃、12 000 r/min离心15 min,取上清液,定容至25 mL,待测。取1 mL 待测液于离心管中,依次加入0.1 mL体积分数20%四氯化钛-盐酸溶液、0.2 mL浓氨水,12 000 r/min离心25 min。用3 mL 3 mol/L硫酸将沉淀冲洗至试管中,振荡溶解后,在415 nm波长处测吸光度。对照组用1 mL丙酮代替。重复3 次,每隔2 d取样。
式中:V t为样品提取液总体积/L;C为标准曲线上对应H 2O 2浓度/(μmol/L);m为莲雾果肉质量/g。
1.3.2.4 SOD活性的测定
参照Constantine等 [24]的方法并稍加改进。称取10 g冷冻果肉于预冷的研钵中,加入20 mL磷酸缓冲液(0.05 mol/L,pH 7.8)冰浴研磨匀浆,4 ℃,12 000 r/min离心10 min,收集上清液即为酶提取液。
取3 mL磷酸缓冲液(0.05 mol/L,pH 7.8)于试管中,依次加入0.5 mL 0.1 mol/L蛋氨酸、0.5 mL 1.67 mmol/L NBT、0.5 mL酶提取液、0.5 mL 24 µmol/L核黄素(对照管酶提取液光照20 min后加入,其他与实验管一致)。充分混匀后于4 000 lx日光灯下光照反应20 min,立即放于暗处终止反应,于560 nm波长处测吸光度。用避光管作为空白管参比调零(避光管与试验管一模一样,只是加完试剂后置于暗处20 min)。重复3 次,从第2天开始每隔2 d取样,以每分钟反应体系对NBT光还原的抑制为50%时所需要的酶量为一个SOD活力单位。数据测定重复3 次。
1.3.2.5 POD活性的测定 [25]
称取4 g冷冻果肉,加入12 mL磷酸缓冲液(0.05 mol/L,pH 7.0,内含1% PVP溶液),冰浴研磨,4 层纱布过滤,4 ℃,12 000 r/min,离心25 min,收集上清液,即为酶提取液。反应体系:2.4 mL磷酸缓冲液、0.4 mL 1%愈创木酚、0.1 mL 1% H 2O 2、0.1 mL酶提液,摇匀,以每分钟在470 nm波长处吸光度变化0.01为一个POD活性单位。重复3 次,从第2天开始每隔2 d取样。
1.3.2.6 脂氧合酶(lipoxygenase,LOX)活性的测定
参考鞠延仑 [26]、Surrey [27]等的方法并稍加改进。称取5 g冷冻果肉,加入20 mL预冷提取液,冰浴研磨,4 层纱布过滤,4 ℃,12 000 r/min离心30 min,收集上清液即为酶提取液。
提取液的配制:取1 mL Triton-X 100和4 g PVP加入到100 mL 0.1 mol/L pH 6.8的磷酸缓冲液中,4 ℃冰箱预冷备用。
底物的配制:取0.5 mL 吐温20逐滴加入到10 mL硼酸缓冲液中(pH 9.0),再依次逐滴加入0.5 mL亚油酸和1.3 mL 1.0 mol/L氢氧化钠溶液,摇匀至澄清为止,加入90 mL硼酸缓冲液,最后用蒸馏水定容至200 mL即可。
反应体系:150 µL底物、2.75 mL磷酸缓冲液、80 µL酶提取液,摇匀,以234 nm波长处吸光度变化1为一个LOX活力单位。重复3 次,从第2天开始每隔2 d取样。
1.3.2.7 线粒体的提取
参照Bonner等 [28]的方法,并改进。准确称取10 g冷冻果肉置于预冷的研钵中,加入20 mL提取缓冲液(pH 7.2,50 mmol/L Tris-HCl,0.3 mol/L 甘露醇,1.0 mmol/L EDTA·2Na,1 g/L BSA,0.05 g/mL半胱氨酸),冰浴磨碎,用4 层纱布过滤,滤液于4 ℃,1 000×g,离心15 min后,弃沉淀取上清液于4 ℃,10 000×g,离心15 min得到线粒体沉淀。沉淀用悬浮缓冲液悬浮(pH 7.2,50 mmol/L Tris-HCl,0.3 mol/L甘露醇,1.0 mmol/L EDTA·2Na,1 g/L BSA)。
1.3.2.8 琥珀酸脱氢酶(succinodehydrogenase,SHD)活性的测定
参照Kan等 [29]的方法。反应体系包括0.2 mol/L磷酸钾缓冲液(pH 7.4)300 µL,0.2 mol/L琥珀酸钠溶液240 µL,0.9 mol/L DCPIP 40µL,蒸馏水240 µL,然后30 ℃条件下水浴5 min,测定时加200 µL线粒体酶液及0.33% PMS 200 µL,快速混匀后在600 nm波长处比色,以每分钟单位鲜质量果实变化的光密度值表示SDH活性。实验重复3 次,从第2天开始每隔2 d取样。
1.3.2.9 细胞色素C氧化酶(cytochrome oxidase,CCO)活性的测定
参照Kan等 [29]的方法,并改进。反应体系包括100 µL酶液和900 µL 0.04% CytC,混匀后在吸光度550 nm波长处比色,每隔1 min读取一次吸光度,持续测定2 min,以每分钟单位鲜质量果实变化的光密度值表示CCO活性。实验重复3 次,从第2天开始每隔2 d取样。
1.3.2.10 ATP、ADP、AMP及能荷水平的测定
参考吴光斌等 [30]的方法。色谱条件:Atlantis T3柱(4.6 mm×250 mm,5.0 µm);流动相:磷酸盐缓冲液(20 mmol/L磷酸二氢钾-磷酸氢二钠,pH 7.0);流速:1.2 mL/min;柱温:30 ℃;检测波长:254 nm;进样量:20 µL;定量方法:外标定量法。以保留时间定性,峰面积定量。
样品中腺苷酸的提取:称取8 g果肉,加入5 mL超纯水冰浴研磨,于100 ℃加热提取5 min后,8 000×g离心10 min,取上清液用0.45 µm微孔滤膜过滤。数据测定重复3 次。能荷计算见式(4):
1.4 数据分析
采用Excel及SPSS 17.0统计软件对数据统计分析,P<0.05为差异显著;P<0.01为差异极显著。
2.1 秋水仙碱处理对采后莲雾果实绵软进程和质量损失率的影响
2.1.1 秋水仙碱处理对采后莲雾果实绵软指数的影响
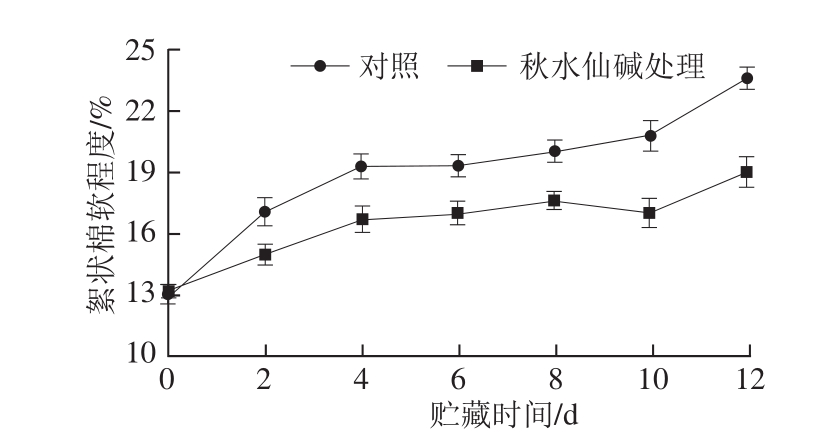
图1 秋水仙碱处理对采后莲雾果实绵软指数的影响
Fig. 1 Effects of colchicine treatment on cottony softening extent of wax apples
絮状绵软是莲雾果实特有的软化现象,也是判断莲雾采后贮藏期间果实品质的重要生理指标之一。莲雾果
实在生长至成熟时,果实内部已经存在絮状绵软组织,其具体的生长发育机理还未知。如图1所示,随着采后贮藏时间的延长,对照组和秋水仙碱处理组果肉内部的絮状绵软面积均呈不断上升的趋势。对照组贮藏0~4 d绵软指数迅速上升,随后速度减缓,贮藏12 d时,其果肉絮状绵软面积由12.92%上升至23.58%,秋水仙碱处理组0~4 d绵软指数上升迅速,但从第2天开始至贮藏末期始终低于对照组,贮藏12 d时,其果肉絮状绵软面积为19.01%,比对照组降低了19.38%。秋水仙碱处理可以抑制采后莲雾果实绵软面积的上升,第4天开始抑制效果显著(P<0.05)。

图2 秋水仙碱处理对采后莲雾果实质量损失率的影响
Fig. 2 Effects of colchicine treatment on percentage weight loss of wax apples
2.1.2 秋水仙碱处理对采后莲雾果实质量损失率的影响由图2可知,在整个贮藏期间,对照组与处理组质量损失率均呈上升趋势,对照组果实的上升速度最快,贮藏12 d时,其质量损失率上升至2.53%;秋水仙碱处理组果实在贮藏0~4 d期间,质量损失率上升趋势较为缓慢,之后上升速度有所加快,但质量损失率在贮藏期间显著低于对照组,贮藏12 d时,秋水仙碱处理组果实质量损失率为1.67%,低于对照组果实33.99%。秋水仙碱处理可以显著延缓采后莲雾果实贮藏期间质量损失率的上升(P<0.05)。
2.2 秋水仙碱处理对采后莲雾果实活性氧代谢相关酶的影响
2.2.1 秋水仙碱处理对采后莲雾果实H 2O 2含量的影响

图3 秋水仙碱处理对采后莲雾果实H
2O
2含量的影响
Fig. 3 Effects of colchicine treatment on H
2O
2content of wax apples
由图3可知,对照组果实的H 2O 2含量0~6 d缓慢上升,稍有下降后迅速上升,第10天达到峰值0.98 μmol/g,是入贮时的2.39 倍;秋水仙碱处理组果实的H 2O 2含量2~4 d呈下降趋势,第4天到达最小值0.28 μmol/g,是对照组的52.83%,之后迅速上升,至第10天到达最大值0.93 μmol/g,是对照组的94.90%,贮藏末期12 d,秋水仙碱处理果实的H 2O 2含量低于对照组。说明秋水仙碱可以在贮藏末期抑制H 2O 2的积累,但二者没有显著差异(P>0.05)。
2.2.2 秋水仙碱处理对采后莲雾果实SOD活性的影响

图4 秋水仙碱处理对采后莲雾果实SOD活性的影响
Fig. 4 Effects of colchicine treatment on SOD activity of wax apples
由图4可知,对照组果实SOD活性整体呈下降趋势,0~6 d变化缓慢,从6 d开始急速下降,10 d达到最低值0.346 U/(g·min);秋水仙碱处理组果实SOD活性整体高于对照组,0~4 d缓慢上升,之后波动下降,其中第4天和第10天SOD活性分别为0.385、0.365 U/(g·min),均高于对照5%。说明秋水仙碱处理能减缓莲雾果实在贮藏期间SOD活性的下降,但二者之间没有显著差异(P>0.05)。
2.2.3 秋水仙碱处理对采后莲雾果实CAT活性的影响

图5 秋水仙碱处理对采后莲雾果实CAT活性的影响
Fig. 5 Effects of colchicine treatment on CAT activity of wax apples
由图5可以看出,在贮藏期间,对照组果实的CAT活性0~6 d迅速上升,第6天达到最高峰,峰值为3.20 U/(g·min),是入贮时的3.09 倍,之后CAT活性快速下降;秋水仙碱处理组果实的CAT活性贮藏前期略有上升,第2天活性为1.34 U/(g·min),是对照组的1.85 倍,之后不断缓慢下降,其中第6、12天分别仅为对照组的9.69%和27.03%,极显著低于对照组(P<0.01)。表明秋水仙碱处理抑制了莲雾果实贮藏第6天CAT活性高峰的出现。
2.2.4 秋水仙碱处理对采后莲雾果实POD活性的影响

图6 秋水仙碱处理对采后莲雾果实POD活性的影响
Fig. 6 Effects of colchicine treatment on POD activity of wax apples
如图6所示,对照组和处理组贮藏前期0~6 d均呈上升趋势,对照组上升速度较快,6 d时,POD活性为24.2 U/(g·min),高于处理组16.9 U/(g·min);但6 d之后,对照组POD活性下降,处理组POD活性迅速上升,第8、10、12天分别为32.9、37.7、26.8 U/(g·min),分别为对照组的2.16、1.95、1.40 倍,显著高于对照组(P<0.05)。由此可以推断秋水仙碱处理能在贮藏后期提高POD的活性,减轻后期H 2O 2积累给果实造成的毒害,延缓果实衰老。
2.2.5 秋水仙碱处理对采后莲雾果实LOX活性的影响
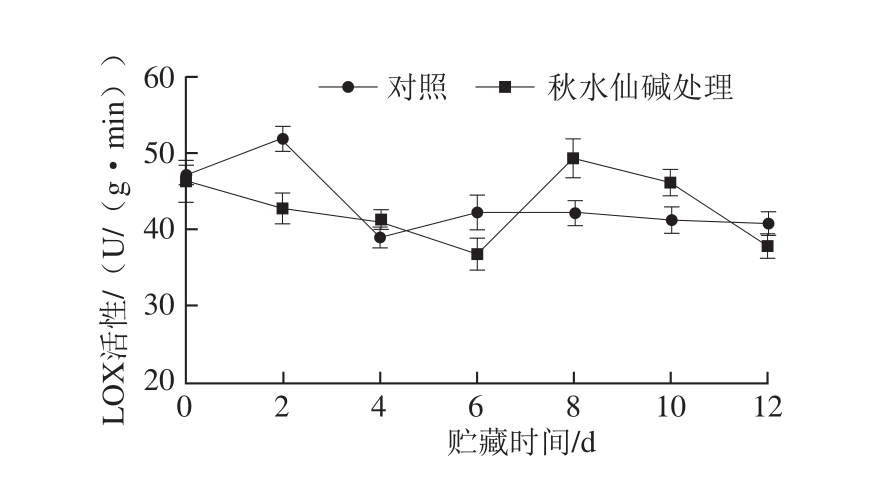
图7 秋水仙碱处理对采后莲雾果实LOX活性的影响
Fig. 7 Effects of colchicine treatment on LOX activity of wax apples
由图7可知,对照组果实LOX活性贮藏前期略有上升,2~4 d迅速下降,之后变化不明显;秋水仙碱处理组LOX活性先下降,第6天下降至最小值36.85 U/(g·min),之后短暂回升,贮藏末期不断下降。贮藏前期,秋水仙碱处理组LOX活性基本低于对照组,第2、6天分别为对照组的82.55%和87.28%,然而,贮藏后期秋水仙碱处理组果实LOX高于对照组,第8、10天LOX活性分别高于对照组17.55%和12.11%。说明秋水仙碱处理可以在贮藏前期降低果实LOX活性。
2.3 秋水仙碱处理对采后莲雾果实能量代谢的影响
2.3.1 秋水仙碱处理对采后莲雾果实SDH活性的影响

图8 秋水仙碱处理对采后莲雾果实SDH活性的影响
Fig. 8 Effects of colchicine treatment on SDH activity of wax apples
由图8可知,对照组果实的SDH活性在贮藏前期0~6 d迅速上升,至第6天达到高峰,峰值为0.41 ∆OD/ (min·g),之后迅速下降,至贮藏末期12 d为0.21 ∆OD/(min·g);秋水仙碱处理组的SDH活性在0~4 d迅速上升,之后呈波动缓慢上升,贮藏4、8、12 d SDH活性显著高于对照组(P<0.05),贮藏12 d,活性为0.40 ∆OD/(min·g),是对照组的1.90 倍。由此可知,秋水仙碱处理可以在贮藏期间保持较高的SDH活性,有利于能量的供应,起到采后保鲜作用。
2.3.2 秋水仙碱处理对采后莲雾果实CCO活性的影响

图9 秋水仙碱处理对采后莲雾果实CCO活性的影响
Fig. 9 Effects of colchicine treatment on CCO activity of wax apples
由图9可知,对照组与秋水仙碱处理组果实的CCO活性在贮藏期间整体均呈上升趋势,对照组第10天到达最高峰,峰值为0.47 ∆OD/(min·g),秋水仙碱处理组第8天到达峰值0.53 ∆OD/(min·g),除第10天之外,处理组的CCO活性都高于对照组,其中第2、6、8天处理组果实CCO活性分别为对照组的1.64、1.68、1.51 倍,显著高于对照组(P<0.05)。由此可知,秋水仙碱处理可以利于果实在贮藏期间保持较高的CCO活性,有利于能量供应。
2.3.3 秋水仙碱处理对采后莲雾果实ATP含量的影响
由图10可知,对照组和秋水仙碱处理组果实采后ATP含量的变化趋势基本一致,均在贮藏前期0~4 d上升,之后下降。其中处理组变化趋势平缓;对照组前期上升迅速,第4天达到峰值38.57 μg/g,是处理组的1.30 倍,4~6 d对照组显著高于处理组(P<0.05),6~8 d迅速下降,处理组的ATP含量在8~12 d均高于对照组,其中第8、10天分别高于对照组32.40%和24.60%,结果显著(P<0.05)。说明秋水仙碱处理有利于维持果实贮藏后期较高的ATP含量,保持能量供应。

图10 秋水仙碱处理对采后莲雾果实ATP含量的影响
Fig. 10 Effects of colchicine treatment on ATP content of wax apples
2.3.4 秋水仙碱处理对采后莲雾果实ADP含量的影响
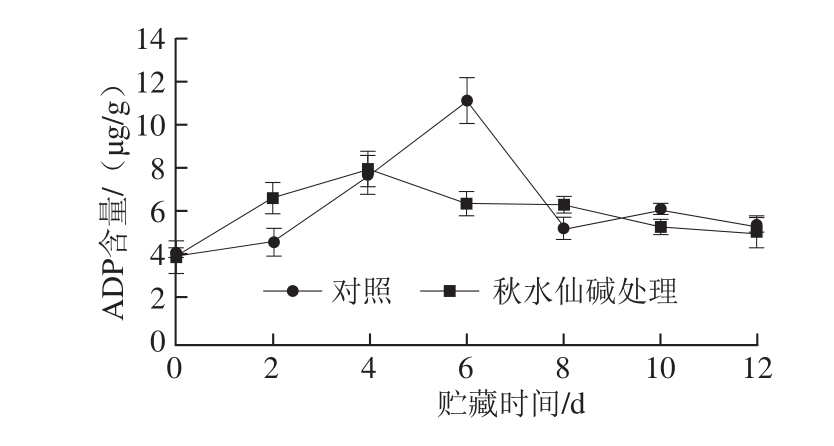
图11 秋水仙碱处理对采后莲雾果实ADP含量的影响
Fig. 11 Effects of colchicine treatment on ADP content of wax apples
由图11可知,对照组和处理组ADP含量均呈先上升后下降的趋势,对照组0~6 d迅速上升,第6天达到峰值11.06 μg/g,是秋水仙碱的1.72 倍,之后快速下降;处理组在第4天达到最大值后缓慢下降。贮藏后期处理组与对照组没有显著差异(P>0.05)。
2.3.5 秋水仙碱处理对采后莲雾果实AMP含量的影响

图12 秋水仙碱处理对采后莲雾果实AMP含量的影响
Fig. 12 Effects of colchicine treatment on AMP content of wax apples
由图12可知,秋水仙碱处理组AMP含量在贮藏期间变化趋势平缓,对照组呈先上升,第6天到达峰值,之后迅速下降;贮藏0~4 d处理组AMP含量高于对照组,之后至贮藏末期,低于对照组,但二者差异不显著(P>0.05)。
2.3.6 秋水仙碱处理对采后莲雾果实能荷的影响

图13 秋水仙碱处理对采后莲雾果实能荷的影响
Fig. 13 Effects of colchicine treatment on energy charge ratio of wax apples
能荷的定义为在总的腺苷酸系统中(即ATP、ADP 和AMP浓度之和)所负荷的高能磷酸基数量,即能量负荷。由图13可知,对照组和秋水仙碱处理组果实能荷在贮藏期间变化趋势基本一致,整体均呈下降趋势。0~4 d,秋水仙碱处理组能荷水平下降速度较快,显著低于对照组(P<0.05),之后稍有上升,第8、10、12天均低于处理组,效果显著(P<0.05)。以上结果说明秋水仙碱处理可以延缓采后莲雾果实贮藏期间能荷水平的下降。
3.1 秋水仙碱对采后莲雾果实生理品质的影响
莲雾果实的絮状绵软是其特有的软化现象,其程度越高,果实的食用品质越差,同质量损失率一样,都是判断采后莲雾品质的生理指标。贮藏期间对照组絮状绵软面积和质量损失率不断升高,说明果实品质持续下降;秋水水仙碱处理可以显著抑制二者的升高(P<0.05),减缓果实品质下降,有利于采后莲雾贮藏。3.2 秋水仙碱对采后莲雾果实活性氧代谢酶的影响
果实的成熟衰老是一系列复杂的生理变化,自由基学说研究认为生物体衰老过程是活性氧代谢失调与累积的过程 [3]。本研究发现,贮藏期间,对照组SOD活性不断下降,CAT和POD活性均呈先上升后下降趋势,第6天到达活性高峰,可能是果实抵抗衰老而进行的的生理反应,之后迅速下降;CAT和POD都可以以H 2O 2为底物,H 2O 2是活性氧的一种,贮藏期间对照组H 2O 2含量第8天后快速升高,相对应的CAT和POD活性降低,不能及时清除积累的H 2O 2,造成活性氧代谢体系失衡,衰老加剧。秋水仙碱处理组抑制了CAT活性高峰的出现,保持较低的CAT活性水平,这与1-甲基环丙烯处理对库尔勒香梨贮藏过程中CAT的影响一致 [9],但是秋水仙碱处理组果实贮藏中后期POD活性升高,显著高于对照组(P<0.05),推测秋水仙碱可能主要通过激活POD活性来减少H 2O 2积累,同时又抑制CAT活性,有助于更好地保持活性氧代谢的平衡,延缓莲雾果实衰老。相关性分析表明,采后莲雾絮状绵软面积与活性氧代谢酶活性的相关性并不显著(P>0.05),说明活性氧代谢可能不是影响采后莲雾绵软进程的重要因素。
3.3 秋水仙碱对采后莲雾果实能量代谢的影响
大量研究 [31-32]表明采后果实的衰老与细胞中的能量状态有着密切的关系,Liu等 [32]发现非跃变型果实,其ATP、ADP含量和能荷水平在贮藏期间逐渐降低;Saquet等 [33]认为园艺作物采后能量亏损是导致果实衰老和褐变的原因之一。在贮藏期间,对照组的ATP含量在贮藏前期有短暂的升高,第4天到达峰值,之后迅速下降,与Wang Hui等 [12]研究结果相似,ADP和AMP含量均是在贮藏第6天上升为最大值,之后迅速降低;相应的能荷水平也是在第4天之后出现显著下降,说明贮藏中后期果实开始出现能量供应不足。相关性分析表明,对照组的果实絮状绵软面积与能荷水平呈显著负相关(r=-0.793,P<0.05),表明低水平的ATP含量和能荷会加剧果实绵软程度,促进衰老。秋水仙碱处理组莲雾果实的ATP含量和能荷水平在贮藏中后期显著高于对照组(P<0.05),这可能SDH和CCO活性有关,SDH和CCO都是线粒体内膜酶,SDH催化琥珀酸转化成延胡索酸,是连接三羧酸循环和氧化磷酸化的关键酶。CCO是呼吸链的末端酶,可以将电子直接传递给氧气,SDH与CCO是线粒体呼吸标志酶,与能量的产生密切相关 [29],研究发现,秋水仙碱可以保持贮藏期间较高的SDH和CCO酶活性。陈文烜等 [34]的研究也表明,减压能使水蜜桃在贮藏过程中较好地保持SDH、CCO活性,使ATP含量和能荷在整个贮藏期间均维持在较高水平,延缓了果实贮藏期衰老和品质劣变进程。由此表明,秋水仙碱可以保持较高SDH和CCO活性,维持能量供应,减缓细胞能量的亏缺,抑制采后莲雾絮状绵软面积上升,延缓果实衰老。
3.4 采后莲雾果实活性氧代谢和能量代谢的关系
活性氧代谢和能量代谢都与果实衰老有关,有研究 [35]发现,采后果实活性氧的增多与低水平的ATP含量和能荷水平有关;能量的产生和能荷水平在调节诱导采后园艺作物抗氧化酶活性方面起着作用,如SOD、CAT、POD、抗坏血酸过氧化物酶、谷胱甘肽还原酶 [36-38]。相关性分析表明,对照组的H 2O 2含量与能荷水平呈显著负相关(r=-0.766,P<0.05);SOD活性与能荷水平呈显著正相关(r=0.802,P<0.05),与上述结果一致。
0.01 %秋水仙碱处理可以显著抑制采后莲雾果实絮状绵软指数和质量损失率的上升;能量代谢显著影响采后莲雾絮状绵软进程,能荷水平与絮状绵软面积呈显著负相关性(r=-0.793,P<0.05),0.01%秋水仙碱处理可以维持贮藏期间较高的SDH和CCO活性,在贮藏中后期保持较高的ATP含量和能荷水平,使果实维持较好的能量状态;0.01%秋水仙碱能够延缓SOD活性下降,使CAT活性维持较低水平,同时在贮藏后期提高POD活性,使活性氧代谢维持较好的平衡,但活性氧代谢与采后莲雾絮状绵软面积相关性并不显著。综上所述,在本实验中,0.01%秋水仙碱有利于莲雾采后贮藏保鲜,其机理与能量代谢显著相关。
参考文献:
[1] 王晓红. 莲雾的营养分析[J]. 中国食物与营养, 2006(4): 53-54.
[2] RON M. Oxidative stress, antioxidants and stress tolerance[J]. Trends in Plant Science, 2002, 7(9): 405-410.
[3] TIAN Shiping, QIN Guozheng, LI Boqiang. Reactive oxygen species involved in regulating fruit senescence and fungal pathogenicity[J]. Plant Molecular Biology, 2013, 82(6): 593-602. DOI:10.1007/s11103-013-0035-2.
[4] LIN Yifen, LIN Yixiong, LIN Hetong, et al. Inhibitory effects of propyl gallate on browning and its relationship to active oxygen metabolism in pericarp of harvested longan fruit[J]. LWT-Food Science and Technology, 2015, 60(2): 1122-1128. DOI:10.1016/ j.lwt.2014.10.008.
[5] CHEN Yihui, LIN Hetong, JOHN S, et al. Effects of a feasible 1-methylcyclopropene postharvest treatment on senescence and quality maintenance of harvested Huanghua pears during storage at ambient temperature[J]. Food Science and Technology, 2015, 64(1): 6-13.
DOI:10.1016/j.lwt.2015.05.021.
[6] GUAN Junfeng, DOU Shijuan. The effect of MAP on quality and browning of cold-stored plum fruits[J]. Journal of Food Agriculture and Environment, 2010, 8(2): 113-116.
[7] 林植芳, 李双顺, 张东林, 等. 采后荔枝果实中氧化和过氧化作用的变化[J]. 植物学报, 1988, 30(4): 382-384.
[8] 汪伟, 沈勇根, 石晶莹, 等. 外源硫化氢对桃果实保鲜效果及活性氧代谢的影响[J]. 果树学报, 2014, 31(2): 302-307. DOI:1009-9980(2014)02-0302-06.
[9] 李学文, 张辉, 逄焕明, 等. 1-MCP对库尔勒香梨采后活性氧相关代谢的影响[J]. 新疆农业科学, 2010, 47(11): 2167-2171. DOI:1001-4330(2010)11-2167-05.
[10] 蔡艳, 施丽愉, 陈伟, 等. UV-C处理对采后草莓果实品质和活性氧代谢的影响[J]. 中国食品学报, 2015, 15(3): 128-136. DOI:10.16429/ j.1009-7848.2015.03.017.
[11] JIANG Yueming, JIANG Yueling, QU Hongxia, et al. Energy aspects in ripening and senescence of harvested horticultural crops[J]. Stewart Postharvest Review, 2007, 3(2): 1-5.
[12] WANG Hui, QIAN Zhengjiang, MA Sanmei, et al. Energy status of ripening and postharvest senescent fruit of litchi (Litchi chinensis Sonn.)[J]. BMC Plant Biology, 2013, 13: 1-16. DOI:10.1186/1471-2229-13-55.
[13] 李辉, 林毅雄, 林河通, 等. 1-MCP 延缓采后‘油木奈’果实衰老及其与能量代谢的关系[J]. 现代食品科技, 2015, 31(4): 121-127.
[14] 何桥, 梁国鲁, 谢江辉, 等. 莲雾种质资源遗传多样性的ISSR分析[J]. 园艺学报, 2006, 33(2): 392-394. DOI:10.3321/j.issn:0513-353X.2006.02.035.
[15] KHANDAKER M M, BOYCE A N, OSMAN N. The influence of hydrogen peroxide on the growth, development and quality of wax apple (Syzygium samarangense [Blume] Merrill & L.M. Perry var. jambu madu) fruits[J]. Plant Physiology and Biochemistry, 2012, 53: 101-110. DOI:10.1016/j.plaphy.2012.01.016.
[16] KHANDAKER M M, HOSSAIN A S, OSMAN N, et al. Growth,yield and postharvest quality of wax apple as affected by naphthalene acetic acid application[J]. Revista Brasileira de Fruticultura, 2015, 2: 410-422. DOI:10.1590/0100-2945-062/14.
[17] 赵菊鹏, 梁广勤, 胡学难, 等. 60Co-γ射线辐照对莲雾、番木瓜果实营养成分的影响[J]. 植物检疫, 2009, 23(2): 14-16.
[18] PAN H H, SHU Z H. Temperature affects color and quality characteristics of ‘Pink’ wax apple fruit discs[J]. Scientia Horticulturae, 2007, 112(3): 290-296.
[19] SURIYAN S, JIRAPAN P, SRISUJAN P. Physicochemical changes in fresh-cut wax apple (Syzygium samarangenese [Blume] Merrill & L.M. Perry) during storage[J]. Food Chemistry, 2011, 127: 912-917.
DOI:10.1016/j.foodchem.2011.01.058.
[20] 叶建兵, 陈发河, 吴光斌. 一氧化氮对莲雾果实采后生理及品质的影响[J]. 集美大学学报(自然科学版), 2012, 17(3): 180-185.
DOI:1007-7405(2012)03-0180-06.
[21] 申利红, 李雅. 秋水仙碱的研究与应用进展[J]. 中国农学通报, 2009,25(21): 185-187.
[22] ANASTASIA S, BINITA S, MICHAEL H P, et al. Colchicine: old and new[J]. The American Journal of Medicine, 2015, 128(5): 461-470. DOI:10.1016/j.amjmed.2014.12.010.
[23] ZHENG K Z, DONALD J H, HONG X Q, et al. Enzymatic browning and antioxidant activities in harvested litchi fruitas influenced by apple polyphenols[J]. Food Chemistry, 2015, 171: 191-199. DOI:10.1016/ j.foodchen.2014.09.001.
[24] CONSTANTINE N, GIANNOPOLITIS S K R. Superoxide dismutases Ⅰ: occurrence in higer plants[J]. Plant Physiology, 1977, 59: 309-314.
[25] HAIYAN G, HANGJUN C, JINLIN M, et al. Effects of short-term anoxic treatment on antioxidant ability and membrane integrity of postharvest kiwifruit during storage[J]. Food Chemistry, 2009, 114(4): 1216-1221. DOI:10.1016/j.foodchem.2008.10.080.
[26] 鞠延仑, 房玉林, 张莉, 等. 赤霞珠葡萄脂氧合酶活性测定及脂肪酸组分的变化[J]. 食品科学, 2015, 36(5): 115-119. DOI:10.7506/ spkx1002-6630-201505022.
[27] SURREY K. Spectrophotometric method for determination of lipoxidase activity[J]. Plant Physiology, 1964, 39(1): 65-70.
DOI:10.1104/pp.39.1.65.
[28] BONNER W D Jr. A general method for the preparation of plant mitochondria[J]. Methods Enzymol, 1967, 10: 126-133.
[29] KAN J, WANG H M, JIN C H. Changes of reactive oxygen species and related enzymes in mitochondrial respiration during storage of harvested peach fruits[J]. Agricultural Sciences in China, 2011, 10(1): 149-158. DOI:10.1016/S1671-2917(11)60317-9.
[30] 吴光斌, 陈静, 陈发河. HPLC法测定采后莲雾果实中ATP、ADP 及AMP的含量[J]. 中国食品学报, 2013, 13(9): 196-200. DOI:1009-7848(2013)09-0196-05.
[31] SAQUET A A, STREIF J, BANGERTH F. Energy metabolism and membrane lipid alterations in relation to brown heart development in ‘Conference’ pears during delayed controlled atmosphere storage[J]. Postharvest Biology and Technology, 2003, 30: 123-132.
[32] LIU H, JIANG Y M, LUO Y B, et al. A simple and rapid determination of ATP, ADP and AMP concentrations of pericarp tissues of harvested litchi fruit by high performance liquid chromatograph[J]. Food Technology and Biotechnology, 2006, 44: 531-534.
[33] SAQUET A A, STREIF J, BANGERTH F. Changes in ATP, ADP and pyridine nucleotide levels related to the incidence of physiological disorders in Conference pears and Jonagold apples during controlled atmosphere storage[J]. Journal of Horticultural Science and Biotechnology, 2000, 75(2): 243-249.
[34] 陈文烜, 宋丽丽, 廖小军. 减压贮藏技术对水蜜桃采后能量代谢的影响[J]. 农业机械学报, 2014, 45(10): 226-230. DOI:10.6041/ j.issn.1000-1298.2014.10.035.
[35] DUAN X W, JIANG Y M, SU X G, et al. Role of pure oxygen treatment in browning of litchi fruit after harvest[J]. Plant Science,2004, 167(3): 665-668.
[36] VELTMAN R H, LENTHERIC I, VANDERPALS L H W, et al. Internal browning in pear fruit (Pyrus communis L. cv Conference)may be a result of a limited availability of energy and antioxidants[J]. Biology and Technology, 2003, 28: 295-302.
[37] MÖLLER I M. Plant mitochondria and oxidative stress: electron transport, NADPH turnover and metabolism of reactive oxygen species[J]. Annual Review of Plant Physiology and Molecular Biology,2001, 52: 561-591.
[38] FRANCK C, LAMMERTYN J, HO Q T, et al. Browning disorders in pear fruit[J]. Postharvest Biology and Technology, 2007, 43(1): 1-13.
Effects of Inducer Treatment on Physiological Quality, Active Oxygen and Energy Metabolism of Postharvest Wax Apples during Cold Storage
LI Wenwen, WU Guangbin, CHEN Fahe*
(College of Food and Biological Engineering, Jimei University, Xiamen 361000, China)
Abstract:Purpose: To investigate the effects of 0.01% colchicine treatment on physiological quality, active oxygen and energy metabolism of postharvest wax apples during cold storage, and further to understand better the role of colchicine on senescence of the fruits.Methods: Wax apples were dipped with 0, 0.01% colchicine for 15 minutes at room temperature and then stored at 4 ℃. The physiological quality, active oxygen metabolism and energy metabolism of wax apples were determined during storage. Results: Colchicine treatment could retard the increase of cottony softening extent and had a significant effect from the 4 thday of storage onwards (P < 0.05), the fruits treated with colchicine had a lower percentage weight loss during the whole storage (P < 0.05). Colchicine treatment could also postponed the decrease of superoxide dismutase (SOD) activity during the whole storage, maintained lower catalase (CAT) activity, and significantly increased peroxidase (POD) activity during the later stage of storage (P < 0.05). At the same time, colchicine treatment could maintain higher activity of succinate dehydrogenase (SDH) and cytochrome oxidase (CCO), as compared with the control fruits. The SDH activity was significantly higher at 4, 8, and 12 day (P < 0.05) while the activity of CCO was significantly higher at 2, 6 and 8 day (P < 0.05). Also colchicine treatment could slow down the decrease of ATP content and energy charge at later stage. Conclusions: Colchicine at 0.01% could retard the increase of cottony softening extent of wax apples. Cottony softening extent and energy charge had a significantly negative correlation with each other (r = -0.793, P < 0.05). Energy deficit could lead to the senescence of the fruits. Energy charge had a significantly negative correlation with H 2O 2content (r = -0.766, P < 0.05), but demonstrated a significantly positive correlation with SOD activity (r = 0.802, P < 0.05). Energymetabolism could influence active oxygen metabolism. The role of colchicine in delaying wax apple senescence was mainly related to its effects on energy metabolism.
Key words:colchicine; wax apples; active oxygen metabolism; energy metabolism; storage
DOI:10.7506/spkx1002-6630-201616045
中图分类号:S379.2
文献标志码:A
文章编号:1002-6630(2016)16-0272-08
引文格式:
李文文, 吴光斌, 陈发河. 秋水仙碱处理对采后莲雾果实在冷藏期间品质、活性氧代谢和能量代谢的影响[J]. 食品科学, 2016, 37(16): 272-279. DOI:10.7506/spkx1002-6630-201616045. http://www.spkx.net.cn
LI Wenwen, WU Guangbin, CHEN Fahe. Effects of inducer treatment on physiological quality, active oxygen and energy metabolism of postharvest wax apples during cold storage[J]. Food Science, 2016, 37(16): 272-279. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201616045. http://www.spkx.net.cn
收稿日期:2015-11-30
基金项目:国家自然科学基金面上项目(31171777)
作者简介:李文文(1990—),女,硕士研究生,研究方向为农产品贮藏保鲜。E-mail:413873907@qq.com
*通信作者:陈发河(1960—),男,教授,硕士,研究方向为农产品贮藏加工。E-mail:fhchen@jmu.edu.cn