表1 超声波处理制备SPI-磷脂复合物
Table 1 Ultrasonic treatments for SPI-lecithin complex
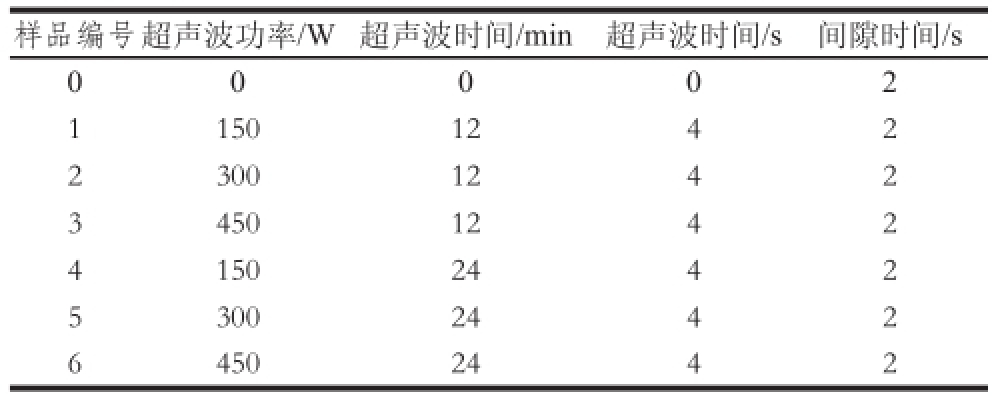
样品编号超声波功率/W超声波时间/min超声波时间/s间隙时间/s 0 0 0 0 2 11501242 23001242 34501242 41502442 53002442 64502442
毕 爽,江连洲,毛惠婷,隋晓楠,王中江,齐宝坤,李 杨 *
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
摘 要:研究不同强度的超声波(150、300、450 W)在12 min和24 min处理时间下对大豆分离蛋白-磷脂相互作用程度的影响,同时揭示了复合体系功能性质随超声条件变化的规律。通过圆二色光谱、粒径分布、ζ-电位、溶解度以及乳化性指标的测定发现:当超声波处理时间为12 min时,中功率(300 W)超声波对大豆分离蛋白-磷脂复合体系的影响最大,α-螺旋含量降低,溶解度及乳化性较高。当超声时间延长至24 min时,低功率(150 W)超声波会明显增加大豆分离蛋白-磷脂复合体系的乳化性,同时体积平均粒径由未超声样品的16.87 μm减小至6.49 μm、ζ-电位绝对值增大,α-螺旋含量降低至7.6%,溶液分散均匀且性质稳定。但随着超声波功率的进一步增大,蛋白质发生不溶性聚集,导致其与磷脂间的相互作用变弱,复合体系的各项功能性质随之下降。这表明超声波处理会影响大豆分离蛋白与磷脂相互作用的程度,适宜强度的超声波处理有利于复合体系功能性质的提升。
关键词:超声波处理;大豆分离蛋白;磷脂;空间结构;功能性质
毕爽, 江连洲, 毛惠婷, 等. 超声波处理对大豆分离蛋白-磷脂相互作用及其复合物功能性质的影响[J]. 食品科学, 2016, 37(17): 1-6. DOI:10.7506/spkx1002-6630-201617001. http://www.spkx.net.cn
BI Shuang, JIANG Lianzhou, MAO Huiting, et al. Effect of ultrasound on soybean protein isolate-phospholipid interaction and functional properties of their composite system[J]. Food Science, 2016, 37(17): 1-6. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201617001. http://www.spkx.net.cn
大豆分离蛋白(soy protein isolate,SPI)是一种良好的植物源蛋白,由于具有高营养性、较好的乳化性和溶解性而被作为食品原料,广泛地应用于食品工业 [1]。但是天然SPI的各种功能性质很难同时满足加工的需要,因此常对SPI进行适当的改性。大豆磷脂是食品中重要的营养成分,具有改善食品风味和质地的作用。Scuriatti等 [2]研究发现磷脂可以与SPI通过静电作用和疏水作用结合形成复合物,复合物的产生对SPI的功能性质具有重要影响。van Nieuwenhuyzen [3]和Li Jufang [4]等曾研究表明蛋白质的疏水区域可以结合到磷脂的疏水基团中,且维持蛋白质和磷脂间的作用力为疏水相互作用。超声波在液体介质中的动态搅拌、湍流等作用,可以改变SPI的柔性空间结构 [5-6],诱导磷脂结构变化,促进SPI与磷脂间的融合与交互。目前,超声波技术在食品加工中得到了广泛应用,但是关于不同超声波条件对SPI-磷脂复合程度及其复合物功能性质的影响研究目前仍然有限。针对此问题,本实验利用超声波的空化及剪切撞击作用调控SPI-磷脂复合体系的构建,解析超声波对SPI-磷脂交互作用的影响。采用低、中、高3 种超声波功率(150、300、450 W)和两种超声波时间(12、24 min)对复合体系进行超声波处理,探究不同超声波处理条件对SPI-磷脂复合物结构性质、理化特性及功能特性的影响,以期为超声技术在食品加工中的合理运用提供理论依据。
1.1 材料与试剂
大豆 北大荒绿野食品有限公司。
SPI 东北农业大学食品学院粮食、油脂及植物蛋白工程实验室自制;大豆卵磷脂 美国Sigma公司;葵花籽油 九三粮油工业集团有限公司;Lowry法测溶解度试剂盒 上海荔达生物科技有限公司;盐酸、氢氧化钠、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)北京新光化工试剂厂;磷酸二氢钠、磷酸氢二钠 天津市东丽区天大化学试剂厂;正己烷 天津北科化学品有限责任公司;其余试剂为国产分析纯。
1.2 仪器与设备
pHSJ-4A型实验室pH计 上海仪电科学仪器有限公司;AL204型分析天平 梅特勒-托利多仪器(上海)有限公司;GL-20G-II高速冷冻离心机 上海安亭科学仪器厂;722型可见分光光度计 上海光谱仪器有限公司;超声波细胞破碎仪 宁波新芝生物科技股份有限公司;J-810圆二色谱仪 日本Jasco公司;Mastersizer 2000激光粒度仪 英国马尔文仪器有限公司;ZetaPALS-Zeta电位仪 美国布鲁克海文仪器公司;ULTRA-TURRAX UTL2000 乳化机 德国IKA公司。
1.3 方法
1.3.1 SPI基本成分测定
蛋白质含量的测定:依据GB 5009.5—2010《食品中蛋白质的测定》 [7];水分含量的测定:依据GB 5009.3—2010《食品中水分的测定》 [8];灰分含量的测定:依据GB 5009.4—2010《食品中灰分的测定》 [9];粗脂肪含量的测定:依据GB/T 14772—2008《食品中粗脂肪的测定》 [10]。
1.3.2 SPI的制备
参考Wolf [11]提取SPI的方法,并适当修改。选取新鲜的大豆磨粉并过60 目筛,所得豆粉与正己烷以料液比1∶3(m/V)的比例混合,在40 ℃条件下搅拌2 h进行脱脂3 次。将脱脂豆粉按料液比1∶10(m/V)的比例与水混合,然后用2 mol/L的NaOH调节溶液的pH值至8.5,50 ℃搅拌l.5 h后,将其悬浮液在4 ℃条件下10 000×g离心20 min,取上清液再用2 mol/L HCl调节pH值至4.5。静置后在4 ℃条件下6 000×g离心20 min,取蛋白沉淀水洗2 次,最后将沉淀分散于水中并用2 mol/L NaOH调节pH值至7.0。将此蛋白溶液冷冻干燥后粉碎即得粉末状SPI。
1.3.3 超声波处理制备SPI-磷脂复合物
将大豆卵磷脂与SPI以1∶10的料液比混合于50 mL锥形瓶中,SPI质量浓度为10 mg/mL,室温条件下不断搅拌2 h。然后将锥形瓶置于冰水浴中1 h使混合液温度低于2 ℃,超声波处理的方法参考Hu Hao等 [12]并进行一定的修改。将超声波处理器的钛探头(直径0.636 cm)插入液面下,距离锥形瓶底部1 cm处,20 kHz、输出功率分别为150、300、450 W处理12 min和24 min,超声波时间4 s,间隔时间2 s,并每隔5 min向冰水混合物中加入冰块保持低温,将未经过超声波处理与不同超声波处理下的SPI-磷脂复合物按照表1所示编号为样品0~6号。
表1 超声波处理制备SPI-磷脂复合物
Table 1 Ultrasonic treatments for SPI-lecithin complex

样品编号超声波功率/W超声波时间/min超声波时间/s间隙时间/s 0 0 0 0 2 11501242 23001242 34501242 41502442 53002442 64502442
1.3.4 SPI-磷脂复合物溶解度的测定
参考Shi mada等 [13]的方法,精确称取10 mL经过超声波制备的SPI-磷脂复合溶液,10 000×g离心15 min。上清液经适度稀释后,采用Lowry法测定蛋白质含量。以牛血清白蛋白为标准物绘制标准曲线,用凯氏定氮法测定样品总蛋白质含量。蛋白质的溶解度表示为上清液蛋白质量浓度占总蛋白质量浓度的百分比。
1.3.5 SPI-磷脂复合物圆二色光谱的测定
本实验利用圆二色光谱在远紫外区(260~180 nm)测定超声波对样品中蛋白质二级结构的影响。取10 mL经过超声波制备的SPI-磷脂复合物,然后在20 ℃、10 000×g离心20 min以除去任何不溶性残留物,最终溶液中蛋白质质量浓度为0.1 mg/mL。在(25±1) ℃条件下,扫描速率为100 nm/min,扫描波长范围为250~200 nm,样品池光程为0.1 nm,灵敏度为100 mdeg/cm。数据通过CDPro软件分析蛋白质二级结构,使用的算法为CONTIN/LL,每个样品重复3 次测定。
1.3.6 SPI-磷脂复合物粒径分布的测定
利用Mastersizer 2000激光粒度仪进行粒径分布测定。采用不同超声波处理条件形成的SPI-磷脂复合物溶液样品进行测定,泵速1 800 r/min,颗粒折射率1.46,分散剂折射率1.33,吸收参数0.001 [14]。
1.3.7 SPI-磷脂复合物ζ-电位的测定
采用ZetaPALS-Zeta电位仪测定样品的ζ-电位,SPI-磷脂复合物溶液的配制采用0.05 mol/L pH 7.0的磷酸盐缓冲液,稀释至蛋白质质量浓度为2 mg/mL,上样体积为1 mL,测定温度为25 ℃,温度平衡2 min [15]。计算3 次重复得到的平均值为测定值。
1.3.8 SPI-磷脂复合物乳化性的测定
乳化性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI)的测定参考Li Chen等 [16]的方法。取9 mL 0.2g/100 mL蛋白液(0.05 mol/L pH 7.0磷酸盐缓冲液),向其中加入3 mL葵花籽油,在25 ℃条件下采用组织分散机20 000 r/min分散1 min后,从底部取样50 μL,分别于0、10 min后测定吸光度,再用0.1 g/100 mL SDS(pH 7.0的磷酸盐 缓冲液配制)稀释100 倍,漩涡振荡混匀后用分光光度计在500 nm波长处测其吸光度A,以0.1 g/100 mL SDS做空白对照组。EAI和ESI计算见公式(1)、(2):
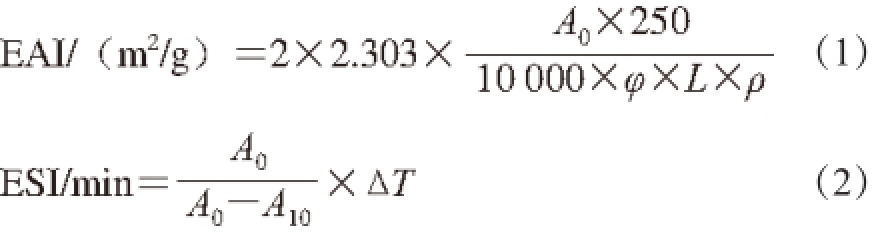
式中:φ为油相体积分数(25%);L为比色杯厚度(1 cm);ρ为乳化液形成前蛋白质质量浓度/(g/mL);A 0、A 10分别为乳状液在0、10 min的吸光度;ΔT为0 min和10 min测定温度的温度差/℃。
1.4 数据处理
所有数据均重复实验3 次,结果表示为±s。数据统计分析采用SPSS 18.5软件对数据进行方差分析(analysis of variance,ANOVA),P<0.05为差异显著。绘图采用Origin 9.1软件。
2.1 SPI的基本成分测定
表2 SPI中的基本成分含量
Table 2 Proximate components and their contents in soybean protein isolate
组分蛋白质粗脂肪水分灰分含量/%90.11±0.400.43±0.623.95±0.544.51±0.55
利用凯氏定氮的方法测定蛋白的含量,由表2可知,SPI中蛋白质含量>90%,符合实验研究的要求。粗脂肪、水分和灰分含量适宜。
2.2 超声波处理对SPI-磷脂复合物溶解度的影响

图1 不同超声波处理条件下SPI-磷脂复合物的溶解度
Fig. 1 Water solubility of untreated and ultrasonic-treated SPI-lecithin complex
蛋白质溶解度代表的是每100 g样品中可溶解蛋白质的百分含量,是衡量蛋白质结构变化及功能特性的重要指标 [17]。由图1可知,不同功率超声波处理后样品中蛋白质的溶解度分别有不同程度的提升。Jambrak等 [18]研究指出超声波作用会提升SPI的溶解性。Arzeni等 [17]也指出超声波通过降低SPI的体积平均粒径、增加与水分子的作用机率使蛋白质溶解度增加。由图1A可知,当超声波处理时间较短时(12 min),300 W超声波功率条件下复合物中蛋白质的溶解度最高,低、高功率超声波条件下蛋白质的溶解度比中功率下更接近于未超声的样品。原因可能是在低功率(150 W)下,复合体系中的SPI结构部分展开,疏水基团暴露不完全,蛋白质与水相互作用弱,致使蛋白质溶解度较低 [19]。当超声波时间延长至24 min后,低功率超声波产生的空化作用足以使蛋白质结构完全展开,埋藏在内部的疏水基团和巯基暴露到分子表面,与磷脂通过疏水相互作用结合后复合物具有更多的亲水基团 [20],因而溶解度提升(图1B)。另一种可能是因为适宜强度的超声波处理后,蛋白质分子质量降低,更多的蛋白质区域暴露到水分子周围,增加了溶解性 [21]。
2.3 声波处理对SPI-磷脂复合物圆二色光谱吸收的影响
圆二色光谱是一种测量蛋白质二级结构快速且准确灵敏的技术,可以在水溶性蛋白溶液中直接测量计算出蛋白质各类型二级结构的含量 [22]。本课题组选择能反映肽键圆二色性的远紫外区200~240 nm光谱条件,测定不同超声波条件处理后复合物中蛋白质的圆二色光谱吸收,测定结果计算后见表3。
表3 圆二色光谱测定不同超声波处理SPI-磷脂复合物中SPI的二级结构含量
Table 3 Secondary structural contents of native and ultrasonic-treated SPI-lecithin complex estimated from circular dichroism spectra

注:同列肩标小写字母不同表示样品间差异显著(P<0.05)。
%样品编号α-螺旋β-折叠β-转角无规卷曲018.7±0.0 b30.6±0.0 e20.9±0.0 b29.8±0.0 b113.6±0.1 d33.6±0.1 c21.8±0.1 a31.0±0.0 a28.5±0.1 e39.6±0.0 b21.0±0.0 b30.9±0.0 a318.5±0.0 b30.1±0.1 e21.8±0.1 a29.7±0.1 b47.6±0.2 f40.8±0.2 a21.2±0.0 b30.4±0.2 ab516.3±0.2 c31.7±0.1 d21.1±0.0 b30.9±0.1 a619.3±0.1 a32.0±0.2 d20.0±0.1 c28.7±0.0 c
经过不同条件超声波处理后,蛋白质中的各个二级结构含量均发生了明显的变化。由表3可知,超声波处理12 min,低(150 W)、中强度(300 W)超声波处理均表现出α-螺旋含量降低,β-折叠、β-转角和无规卷曲含量升高的现象。这与Li Chen等 [16]的研究一致,可能的原因是大豆卵磷脂结合到了α-螺旋结构中的疏水性氨基酸区域,从而使蛋白质分子展开改变其空间构象。但是当高强度(450 W)超声波作用于复合物后,蛋白质发生不溶性聚集,与磷脂间的相互作用减弱,α-螺旋结构又有一定程度的增加。较长超声波处理条件下(24 min),低强度(150 W)超声波处理表现出最少的α-螺旋含量(7.6%),可能是由于SPI-磷脂复合体系在较长的超声波处理时间作用下相互作用更完全,这归因于超声波产生的压力作用和湍流诱导了蛋白质的结构发生改变,从而影响了复合物的功能性质。结构和功能是高度相关的,二级结构的改变使得超声波处理后的复合物具有均匀性和柔性的特点,使其在油水界面上吸附得更完全,与本研究中复合物乳化性的测定结果一致。
2.4 超声波处理对SPI-磷脂复合物粒径分布的影响
粒径分布是用来衡量溶液理化特性和功能特性的重要参数之一。复合物溶液经超声波处理时,液滴的破碎和重新聚集同时发生,因此需用体积平均粒径D [4,3]表示不同粒径所占有的体积分布,同时表征蛋白质聚集、解聚等行为。不同超声波条件处理后SPI-磷脂复合物的粒径分布和体积平均径分别如图2、3所示。未超声时复合物的体积平均粒径D [4,3]为16.87 μm,呈双峰分布,且主要分布在10~100 μm之间。经过超声波处理后粒径降低,但当超声波功率增加超过300 W后,粒径又增大,这说明高功率超声波作用下(450 W),可溶性蛋白质聚集体通过共价键和非共价键的相互作用重新聚集成更大的不溶性聚集体 [23]。Kentish [24]和Ramisetty [25]等都指出超声波可以降低SPI的粒径,但高强度超声波对粒径的降低效果不明显。在低功率超声波处理时(150 W),湍流和微流效应增加分子间的碰撞和聚集,在空化作用下形成微小液滴。尤其是延长超声波时间至24 min后,变化更加明显,平均粒径D [4,3]只有6.49 μm。图2中4号曲线可明显发现体系中小粒径含量升高,大粒径含量降低,双峰分布更窄,说明此时溶液更加稳定 [17]。
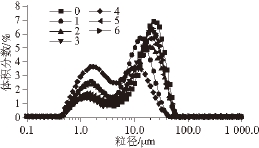
图2 不同超声波处理条件下SPI-磷脂复合物的D
[4,3]大小
Fig. 2 Size of D
[4,3]distribution of untreated and ultrasonic-treated SPI-lecithin complex

图3 不同超声波处理条件下SPI-磷脂复合物的粒径分布
Fig. 3 Particle size of untreated and ultrasonic-treated SPI-lecithin complex
2.5 超声波处理对SPI-磷脂复合物ζ-电位的影响
ζ-电位是对颗粒之间相互吸引或吸引力强度的度量 [26]。溶液体系的稳定性可以通过ζ-电位的绝对值进行判断。绝对值越高,分散粒子间的排斥力越大,越不易发生相互碰撞而聚集,呈现出稳定的体系。反之,绝对值越低,粒子间越倾向于相互吸引而发生聚集。不同超声波条件处理的SPI-磷脂复合物的ζ-电位如图4所示。

图4 不同超声波处理条件下SPI-磷脂复合物的ζ--电位
Fig. 4 Zeta-potential of untreated and ultrasonic-treated SPI-lecithin complex
由图4可知,在pH值为7的条件下,所有样品的ζ-电位均表现为负值,超声波未处理的样品的ζ-电位较低,为-8.7 mV,超声波处理后各样品的ζ-电位绝对值都有所增加。在超声波功率为150 W,处理时间为12 min时,溶液的ζ-电位绝对值有所提高,延长超声波处理时间至24 min后,ζ-电位绝对值明显增加,说明在低功率超声波条件下,延长超声波处理时间可能会增加SPI-磷脂复合物表面的负电荷,增加颗粒间的静电斥力 [27],该现象支持ESI的测定结果。超声波功率为300 W时,短时(12 min)超声波比长时(24 min)超声波处理显示出更大的ζ-电位绝对值,说明短时间处理后液滴间的静电斥力已足够维持液滴稳定。当增加超声波功率至450 W时,表面电荷绝对值降低,液滴不稳定性增加同时聚合物粒子趋向于聚集。有研究表示,粒子表面的有效电荷主要决定它们的分散和聚合 [28],短时间中强度功率超声波处理和长时间低强度功率超声波处理会使复合物表面电荷增加,然而当功率达到450 W后,无论是短时间超声处理还是长时间超声波处理都不会再增加表面电荷,蛋白质形成不可溶性聚集体,减弱了与磷脂间的疏水相互作用,导致乳液的稳定性降低。
2.6 超声波处理对SPI-磷脂复合物乳化性的影响

图5 不同超声波处理条件下SPI-磷脂复合物的EAI及EESSII
Fig. 5 Emulsifying activity and emulsion stability of untreated and ultrasonic-treated SPI-lecithin complex
EAI表示的是SPI-磷脂复合物形成油-水界面的能力,它结合了蛋白质在水相中的溶解能力以及磷脂能够强烈吸附在油-水界面形成乳化层的能力;ESI是指乳状液形成小液滴的稳定能力 [29]。因此,EAI及ESI是表征SPI-磷脂复合物功能性质最有力的指标之一。由图5可知,与未处理的SPI-磷脂溶液相比,经过超声波处理后,溶液的EAI及ESI得到 显著提高。在超声波处理时间较短时,溶液的EAI及ESI随着超声波功率的增强而增大,这可能是由于聚合物溶解性的增加或者是表面电荷分布发生变化 [18]。但当超声波功率增加到450 W时,溶液的EAI和ESI不再提升,可能是由于高强度超声波处理使蛋白质的疏水基团暴露到极端环境中,出现一定程度的变性,形成不溶性蛋白质聚集体,溶解性下降的同时乳化性也随之降低。这与Zhang Qiuting等 [30]的研究结果一致,当超声波功率超过到300 W时,EAI及ESI都不再升高。当延长超声波处理时间到24 min后,低功率超声波足以制备形成稳定的乳液,此时油-水界面层一部分被蛋白质占据,另一部分被磷脂占据,形成第一层乳化膜。另外,蛋白质的疏水基团充分暴露和磷脂通过疏水相互作用形成第二层的乳化膜,因此EAI及ESI显著提升。长时间高强度功率超声波处理与短时间高强度功率处理后的现象相同,由于蛋白质在超声波过程中可能出现一定程度的变性,进而降低了乳化效果。因此,在SPI-磷脂聚合物乳液制备过程中超声波条件的选择非常重要。
本实验采用超声波处理探究超声波功率和超声波作用时间对SPI、磷脂相互作用及复合物功能性质的影响。研究表明超声波处理可以显著提高SPI与磷脂的复合程度,同时提升功能性质如:溶解性、表面疏水性、EAI及ESI。圆二色光谱结果显示经过低、中强度功率超声波处理后SPI的α-螺旋含量降低,β-折叠、β-转角和无规卷曲含量升高,但高强度超声功率处理现象相反。可见超声时间较短时,中强度功率超声波(300 W)处理对SPI与磷脂的复合产生有利作用。延长超声波处理时间后,复合物的粒径大小随着功率的增加而增大,ζ-电位绝对值随着功率的增加而减小,说明超声波时间较长时,较低强度的超声功率可将液滴分散均匀、维持稳定,并使乳化性等功能性质达到最大,过高的功率不仅影响效果且会造成能量浪费。该结果为超声波技术运用于加工SPI-磷脂复合产品、其他蛋白与磷脂复合的食品加工过程提供了一定的理论依据。
参考文献:
[1] MA L, LI B, HAN F, et al. Evaluation of the chemical quality traits of soybean seeds, as related to sensory attributes of soymilk[J]. Food Chemistry, 2015, 173: 694-701. DOI:10.1016/j.foodchem.2014.10.096.
[2] SCURIATTI M, TOMAS M, WANGNER J. Influence of soybean protein isolates-phosphatidycholine interaction on the stabili ty on oilin-water emulsions[J]. Journal of the American Oil Chemists’ Society, 2003, 80(11): 1093-1100. DOI:10.1007/s11746-003-0825-7.
[3] van NIEUWENHUYZEN W, SZUHAJ B F. Effects of lecithins and proteins on the stability of emulsions[J]. Lipid/Fett, 1998, 100(7): 282-291. DOI:10.1002/(SICI)1521-4133(199807)100:7<282:AIDLIPI282>3.0.CO;2-W.
[4] LI J F, LI Y T, GUO S T. The binding mechanism of lecithin to soybean 11S and 7S globulins using fluorescence spectroscopy[J]. Food Science and Biotechnology, 2014, 23(6): 1785-1791. DOI:10.1007/s10068-014-0244-8.
[5] CHANDRAPALA J, OLIVER C, KENTISH S, et al. Ultrasonics in food processing[J]. Ultrasonics Sonochemistry, 2012, 19(5): 975-983. DOI:10.1016/j.ultsonch.2012.01.010.
[6] SORIA A C, VILLAMIEL M. Effect of ultrasound on the technol ogical properties and bioactivity of food: a review[J]. Trends in Food Science & Technology, 2010, 21(7): 323-331. DOI:10.1016/ j.tifs.2010.04.003.
[7] 卫生部. GB 5009.5—2010 食品中蛋白质的测定[S].北京: 中国标准出版社, 2010.
[8] 卫生部. GB 5009.3—2010 食品中水分的测定[S]. 北京: 中国标准出版社, 2010.
[9] 卫生部. GB 5009.4—2010 食品中灰分的测定[S]. 北京: 中国标准出版社, 2010.
[10] 卫生部. GB/T 14772—2008 食品中粗脂肪的测定[S].北京: 中国标准出版社, 2008.
[11] WOLF W J. Soybean proteins. their functional, chemical, and physical properties[J]. Journal of Agricultural and Food Chemistry, 1970, 18(6): 969-976. DOI:10.1021/jf60172a025.
[12] HU H, WU J, LI-CHAN E C, et al. Effects of ultrasound on structural and physical properties of soy protein isolate (SPI) dispersions[J]. Food Hydrocolloids, 2013, 30(2): 647-655. DOI:10.1016/ j.foodhyd.2012.08.001.
[13] SHIMADA K, CHEFTEL J C. Sulfhydryl group/disulfide bond interchange reactions during heat-induced gelation of whey protein isolate[J]. Journal of Agricultural and Food Chemistry, 1989, 37(1): 161-168. DOI:10.1021/jf00085a038.
[14] TANG C H, CHOI S M, MA C Y. Study of thermal properties and heat-induced denaturation and aggregation of soy proteins by modulated differential scanning calorimetry[J]. International Journal of Biological Macromolecules, 2007, 40(2): 96-104. DOI:10.1016/ j.ijbiomac.2006.06.013.
[15] 袁德保. 大豆蛋白热聚集行为及其机理研究[D]. 广州: 华南理工大学, 2010: 25-26.
[16] LI C, HUANG X, PENG Q, et al. Physicochemical properties of peanut protein isolate-glucomannan conjugates prepared by ultrasonic treatment[J]. Ultrasonics Sonochemistry, 2014, 21(5): 1722-1727. DOI:10.1016/j.ultsonch.2014.03.018.
[17] ARZENI C, MARTINEZ K, ZEMA P, et al. Comparative study of high intensity ultrasound effects on food proteins functionality[J]. Journal of Food Engineering, 2012, 108(3): 463-472. DOI:10.1016/ j.jfoodeng.2011.08.018.
[18] JAMBRAK A R, LELAS V, MASON T J, et al. Physical properties of ultrasound treated soy proteins[J]. Journal of Food Engineering, 2009, 93(4): 386-393. DOI:10.1016/j.jfoodeng.2009.02.001.
[19] 毕爽, 马文君, 李杨, 等. 脉冲电场-超声波作用对黑豆球蛋白功能性质的影响[J]. 食品科学, 2016, 37(9): 7-12. DOI:10.7506/spkx1002-6630-201609002.
[20] JIMENEZ-CASTANO L, LOPEZ-FANDINO R, OLANO A, et al. Study on β-lactoglobul in glycosylation with dextran: effect on solubility and heat stability[J]. Food Chemistry, 2005, 93(4): 689-695. DOI:10.1016/j.foodchem.2004.09.050.
[21] SHIRSATH S, SONAWANE S, GOGATE P. Intensification of extraction of natural products using ultrasonic irradiations: a review of current status[J]. Chemical Engineering and Processing, 2012, 53: 10-23. DOI:10.1016/j.cep.2012.01.003.
[22] 罗东辉. 均质改性大豆蛋白功能特性研究[D]. 广州: 华南理工大学, 2010: 48-50.
[23] TANG C H, WANG X Y, YANG X Q, et al. Formation of soluble aggregates from insoluble commercial soy protein isolate by means of ultrasonic treatment and their gelling properties[J]. Journal of Food Engineering, 2009, 92(4): 432-437. DOI:10.1016/ j.jfoodeng.2008.12.017.
[24] KENTISH S, WOOSTER T, ASHOKKUMAR M, et al. The use of ultrasonics for nanoemulsion preparation[J]. Innovative Food Science & Emerging Technologies, 2008, 9(2): 170-175. DOI:10.1016/ j.ifset.2007.07.005.
[25] RAMISETTY K A, PANDIT A B, GOGATE P R. Ultrasound assisted preparation of emulsion of coconut oil in water: understanding the effect of operating parameters and comparison of reactor designs[J]. Chemical Engineering and Processing: Process Intensifi cation, 2015, 88: 70-77. DOI:10.1016/j.cep.2014.12.006.
[26] 李向红. 大豆蛋白聚集体-多糖混合体系相行为及微观结构的研究[D].无锡: 江南大学, 2008: 32-33.
[27] PONGSAWATMANIT R, HARNSILAWAT T, MCCLEMENTS D J. Influence of alginate, pH and ultrasound treatment on palm oil-inwater emulsions stabilized by β-lactoglobulin[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2006, 287(1): 59-67. DOI:10.1016/j.colsurfa.2006.03.022.
[28] SONG X, ZHOU C, FU F, et al. Effect of high-pressure homogenization on particle size and film properties of soy protein isolate[J]. Industrial Crops and Products, 2013, 43(1): 538-544. DOI:10.1016/j.indcrop.2012.08.005.
[29] 毕爽, 齐宝坤, 隋晓楠, 等. 超声处理对黑豆蛋白结构和功能性质的影响[J]. 中国食品学报, 2016, 16(6): 153-160. DOI:10.16429/j.1009-7848.2016.06.021.
[30] ZHANG Q T, TU Z C, XIAO H, et al. Infl uence of ultrasonic treatment on the struct ure and emulsifying properties of peanut protein isolate[J]. Food and Bioproducts Processing, 2014, 92(1): 30-37. DOI:10.1016/ j.fbp.2013.07.006.
Effect of Ultrasound on Soybean Protein Isolate-Phospholipid Interaction and Functional Properties of Their Composite System
BI Shuang, JIANG Lianzhou, MAO Huiting, SUI Xiaonan, WANG Zhongjiang, QI Baokun, LI Yang
*
(College of Food Science and Technology, Northeast Agricultural University, Harbin 150030, China)
Abstract:Ultrasonic treatments with different power (150, 300 and 450 W) for different durations (12 and 24 min) were applied on soybean protein isolate-phospholipid system to evaluate their effects on the composite system. Functional properties of the composite system as a function of ultrasonic conditions were explored at the same time. Circular dichroism spectrum, particle size distribution, Zeta-potential, solubility and emulsibility were determined. The results showed that ultrasonic treatment for 12 min with medium power (300 W) had the greatest impact on the composite system. The content of α-helix decreased obviously, and the solubility and emulsibility were higher than those of the untreated sample. When the ultrasonic treatment time increased to 24 min, low ultrasonic power could signifi cantly increase emulsifying properties of the system. Particle size decreased from 16.87 μm to 6.49 μm and the absolute value of Zeta-potential increased. The content of α-helix decreased to 7.6%, and the solution had homogeneous distribution and stable properties. But various functional properties of the composite system reduced when ultrasonic power increased to 450 W due to the occurrence of insoluble protein aggregate. Thus, the interaction between soybean protein isolate and lecithin became weaker, indicating that ultrasonication had an impact on soybean protein isolate-phospholipid interaction. Ultrasonic processing at appropriate intensity would promote the functional properties of the composite system.
Key words:ultrasonic processing; soybean protein isolate; phospholipid; spatial structure; functional properties
DOI:10.7506/spkx1002-6630-201617001
中图分类号:TS214.9
文献标志码:A
文章编号:1002-6630(2016)17-0001-06
收稿日期:2015-12-17
基金项目:国家自然科学基金青年科学基金项目(31301501);国家自然科学基金面上项目(31571876);
“十二五”国家科技支撑计划项目(2014BAD22B00);黑龙江省自然科学基金重点项目(ZD201302);
高等学校博士生学科点专项科研基金博导类资助课题(20132325110013);黑龙江博士后科研启动项目(LBH-Q13018)
作者简介:毕爽(1992—),女,硕士研究生,研究方向为粮食、油脂及植物蛋白工程。E-mail:13163436989@163.com
*通信作者:李杨(1981—),男,副教授,博士,研究方向为粮食、油脂及植物蛋白工程。E-mail:liyanghuangyu@163.com
引文格式: