曹永强 1,2,张 健 1,2,赵 雯 1,2,张彤赫 1,2,孙 婧 1,2,杨贞耐 1,2,*
(1.北京食品营养与人类健康高精尖创新中心,北京工商大学,北京 100048;2.食品质量与安全北京实验室,北京工商大学,北京 100048)
摘 要:在脱脂乳中分别培养植物乳杆菌菌株YW11和菌株SKT109,经三氯乙酸除蛋白、离心、乙醇沉淀、透析、冷冻干燥得到胞外多糖粗品,再经DEAE-Sepharose Fast Flow离子交换柱和Sepharose CL-6B凝胶柱纯化,得到两种胞外多糖纯品。利用气相色谱法分析此两种多糖的单糖组成,并采用KBr压片法观察红外光谱,利用动态光散射方法测定多糖的流体力学半径(R h)。结果显示:YW11胞外多糖的单糖组成为葡萄糖、半乳糖,其物质的量比为3.45∶1,流体力学半径为69.20 nm;SKT109胞外多糖的单糖组成为葡萄糖、半乳糖,其物质的量比为1.43∶1,流体力学半径为41.74 nm;YW11胞外多糖 的乳化能力强于SKT109胞外多糖,但前者的乳化稳定性略低;两种胞外多 糖分别与其他乳化剂之间具有一定的协同作用,乳化颗粒的半径主要集中在1~2 μm之间。本研究获得的植物乳杆菌胞外多糖在食品加工中具有潜在的应用前景。
关键词:植物乳杆菌;胞外多糖;分离;纯化;乳化特性
曹永强, 张健, 赵雯, 等. 植物乳杆菌胞外多糖的分离纯化及其乳化特性[J]. 食品科学, 2016, 37(17): 7-13. DOI:10.7506/ spkx1002-6630-201617002. http://www.spkx.net.cn
CAO Yongqiang, ZHANG Jian, ZHAO Wen, et al. Isolation, purifi cation and emulsifying properties of exopolysaccharides pro duced by Lactobacillus plantarum[J]. Food Science, 2016, 37(17): 7-13. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201617002. http://www.spkx.net.cn
乳酸菌作为食源性微生物具有被公认的食用安全性,其在发酵过程中产生的胞外多糖(exopolysaccharide,EPS)被广泛应用于食品生产、制药、生物工程、生物絮凝剂以及化工生产领域 [1-2]。常见的产胞外多糖乳酸菌主要有植物乳杆菌、嗜热链球菌、双歧杆菌等 [3]。近年来,越来越多不同来源的产胞外多糖乳酸菌被分离出来,并得到了深入的研究。与植物多糖相比,乳酸菌胞外多糖具有独特的理化特性,如低质量浓度时的高黏度、浓稠特性,剪切稀释特性等,这主要是由于乳酸菌胞外多糖的单糖组成、单糖之间糖苷键连接位点、糖链分支结构等的不同造成的。乳酸菌胞外多糖的结构特性除了与菌株自身的遗传因素相关外,环境因素如培养基的碳源、氮源、菌株的生长温度等也有较大的影响 [4-5]。此外,乳酸菌胞外多糖也存在一些共同的特征,如乳酸菌胞外多糖一般由葡萄糖、半乳糖、鼠李糖、甘露糖、氨基糖等组成;大多数乳酸菌胞外多糖具有较好的亲水性 [6];许多细菌胞外多糖由于可以在水相和油相之间形成稳定的乳化液,因此可以作为生物乳化剂应用于工业生产中 [7]。
关于乳酸菌胞外多糖的研究大多数采用基于全脂乳的培养基或合成、半合成培养基,如乳酸细菌培养基、史娃兹鉴别培养基等,然而这些培养基在发酵过程中易形成络合物,对胞外多糖的生成和量化有一定的影响 [8]。本研究采用基于脱脂乳的培养基,对本课题组从西藏灵菇中分离到的两株植物乳杆菌(菌株YW11和菌株SKT109)在生长过程中产生的胞外多糖进行分离纯化,研究纯化胞外多糖的理化性质,为其进一步工业化应用开发提供技术支持。
1.1 菌种与试剂
植物乳杆菌YW11(NCBI:KM265361)、植物乳杆菌SKT109(NCBI:KJ764641),均保存于北京工商大学实验室。
三氯乙酸(trichloroacetic,TCA)、浓硫酸、重蒸酚、无水乙醇、十六烷、间羟联苯、四硼酸钠(均为分析纯) 国药集团化学试剂有限公司;脱脂乳粉新西兰恒天然乳品有限公司;离子交换柱填料 DEAESepharose Fast Flow 英国Waterman公司;Sepharose CL-6B层析柱填料 瑞典Amersham Bioscience公司;透析袋(8 000~14 000 D) 北京鼎国生物技术有限公司。
脱脂乳培养基:葡萄糖20.0 g、脱脂乳粉12.5 g,去离子水1 L,搅拌均匀后置于95 ℃灭菌15 min。
1.2 仪器与设备
CR21GⅢ立式高速冷冻离心机、U3900紫外分光光度计 日本Hitachi公司;MLS-3750高压蒸汽灭菌器日本三洋公司;BX53电子显微镜 日本奥林巴斯公司;ALV/CGS-3一体式光散射仪 德国ALV公司;Nexus470红外光谱仪 美国Nicolet公司;5975C型气相色谱仪美国安捷伦公司;XHF-DY高速匀浆机 宁波新芝生物科技股份有限公司。
1.3 植物乳杆菌胞外多糖的分离纯化
1.3.1 粗多糖的制备
将植物乳杆菌连续活化两代后转接至脱脂乳培养基中,37 ℃静置培养16 h,然后加入80%TCA至其在发酵液中最终质量浓度为4 g/L。常温下搅拌2 h,4 ℃、10 000 r/min离心45 min去除发酵液 中的细胞和蛋白。取上清液,加入两倍体积的无水乙醇,4 ℃冷藏12 h,再于4 ℃、10 000 r/min离心30 min。采用去离子水复溶沉淀物,并移入透析袋,每8 h换一次去离子水,透析24 h后冷冻干燥得到粗多糖。
1.3.2 DEAE-Sepharose Fast Flow离子交换柱层析纯化
配制20 mg/mL的粗多糖溶液,经DEAE-Sepharose Fast Flow离子交换柱层析(2.6 cm×40 cm)纯化,进样5 mL,线性梯度洗脱,1~30 管用去离子水、31~60 管用0.2 mol/L NaCl溶液、61~100 管用0.5 mol/L NaCl溶液,控制洗脱速率为1 mL/min,自动集样,每管收集5 min,检测多糖含量,合并收集单一峰组分,透析,冷冻干燥。
1.3.3 Sepharose CL-6B凝胶柱层析纯化
经离子交换层析得到的多糖组分用质量浓度9 g/L的NaCl溶液溶解后,上样至Sepharose CL-6B凝胶柱层析(2.5 cm×50 cm),进样量5 mg,进样量2 mg/mL。采用9 g/L的NaCl溶液洗脱,洗脱速率为0.5 mL/min,每管收集5 mL,检测每管多糖含量,按多糖含量检测值分别合并收集单一峰组分,去离子水透析,冷冻干燥,获得EPS纯品。
1.4 植物乳杆菌胞外多糖的理化特性
1.4.1 多糖的基本理化性质
总糖含量:采用苯酚-硫酸法;多糖中蛋白质含量:采用考马斯亮蓝比色法;糖醛酸含量:采用间羟联苯法;水分含量:采用称质量法 [9]。
1.4.2 红外光谱测定
准确称取2 mg EPS,KBr压片,使用Nexus 470红外光谱仪测定。
1.4.3 EPS动态光散射分析
配制0.1 mol/L NaNO 3溶液,将EPS溶解到NaNO 3溶液中,质量浓度为0.5 g/L。轻轻搅动至完全溶解。过0.22 μm滤膜,置于无尘处理过的石英散射池(25 mm)中,使用ALV/CGS-3一体式光散射仪测定EPS流体力学半径R h。散射角为90°,功率22 mW,波长:632.8 nm。
1.4.4 胞外多糖的单糖组成分析
多糖的酸水解与单糖衍生化参考王辑 [9]研究方法,单糖标准品为鼠李糖、葡萄糖、半乳糖、阿拉伯糖、木糖、果糖、岩藻糖。色谱条件:色谱柱类型,DB-5毛细管柱(60 m×0.25 mm,0.25 μm);进样量1 μL;氧火焰离子检测器;载气流速:1 mL/min;分流比:1∶30;升温程序:80 ℃保持3 min,5 ℃/min升至195 ℃保持1 min,5 ℃/min升至215 ℃保持1 min,10 ℃/min升至230 ℃保持3 min。
1.4.5 胞外多糖乳化特性测定
1.4.5.1 不同质量浓度胞外多糖乳化能力的测定
取不同质量浓度(0.5~2.5 g/L)的胞外多糖水溶液2 mL,加入 3 mL橄榄油,使用高速匀浆机3 600 r/min均质2 min,转移到刻度试管中,分别于24、168、360 h测定并按式(1)计算乳化指数(E),表示为E 24、E 168、E 360。
式中:h e为乳化层高度/cm;h t为总高度/cm。
1.4.5.2 胞外多糖与其他乳化剂的协同效应
分别将质量浓度为1.0 g/L的胞外多糖和质量浓度为0.5 g/L的刺槐胶、黄原胶、海藻酸钠或瓜尔豆胶按质量比1∶1混合,取混合液2 mL加入3 mL橄榄油,均质,测定168 h时的乳化指数(E 168)。
1.4.5.3 乳化稳定性的测定
质量浓度1.0 g/L的EPS水溶液和质量浓度0.5 g/L的其他乳化剂(刺槐胶、海藻酸钠、黄原胶、瓜尔豆胶)溶液按质量比1∶1混合,分别取混合液2 mL,加入0.5 mL十六烷,旋涡振荡1 min,分别在旋涡振荡前、后迅速测定混合液540 nm波长处吸光度(A 0)。振荡后的混合液在室温条件下静置30 min后,测定540 nm波长处吸光度的降低值(A t)。按公式(2)计算乳化稳定性。
1.4.5.4 乳化颗粒的粒径大小及分布
制备质量浓度1.0 g/L的胞外多糖乳化液,室温静置24 h后取60 μL乳化液,置于显微镜(100×)下观察并拍照,乳化颗粒的大小及分布情况,通过Image Pro Plus软件分析,乳化颗粒度半径及分布通过SPSS 21.0软件绘制直方图进行分析。
1.5 数据分析
实验样品3 次平行,以±s表示,SPSS 21.0软件进行方差分析,P<0.05表示差异显著。
2.1 植物乳杆菌胞外多糖的分离提纯
植物乳杆菌菌株YW11和菌株SKT109分别于脱脂乳培养基中培养,经TCA除蛋白、离心、乙醇沉淀、透析、冷冻干燥后得到胞外多糖粗品。此两种粗多糖用于进一 步纯化。
2.1.1 DEAE-Sepharose Fast Flow离子交换柱层析
菌株YW11和菌株SKT109粗多糖经离子交换柱的洗脱曲线如图1所示。YW11胞外多糖的洗脱峰出现在以0.5 mol/L的NaCl溶液作为洗脱液时(图1A),表明此胞外多糖带有电荷,为酸性多糖。SKT109胞外多糖的洗脱峰出现在以水作为洗脱液时(图1B),表明此组分不带电荷,为中性多糖。分别收集洗脱峰,经透析、冷冻干燥后得到蓬松状、白色的SKT109胞外多糖和YW11胞外多糖样品。
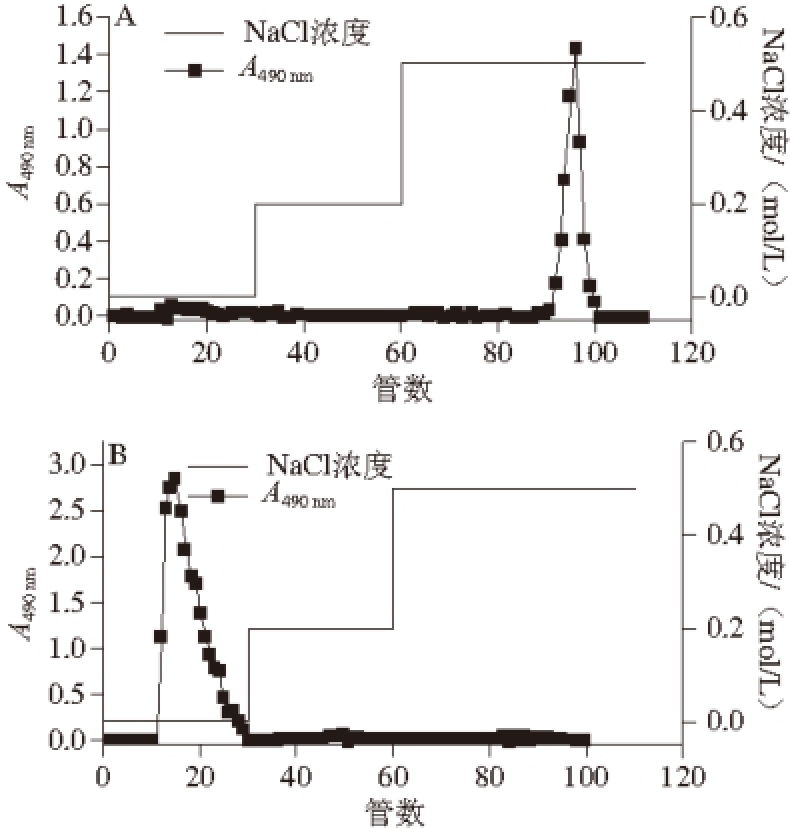
图1 DEAE-Sepharose Fast Flow离子交换柱层析纯化植物乳杆菌菌株YW11(A)和菌株SKT109(B)EPS洗脱曲线
Fig. 1 Elution profile of the EPSs from L. plantarum YW11(A) and L. plantarum SKT109 (B) on DEAE-Sepharose Fast Flow column
2.1.2 Sepharose CL-6B凝胶柱层析
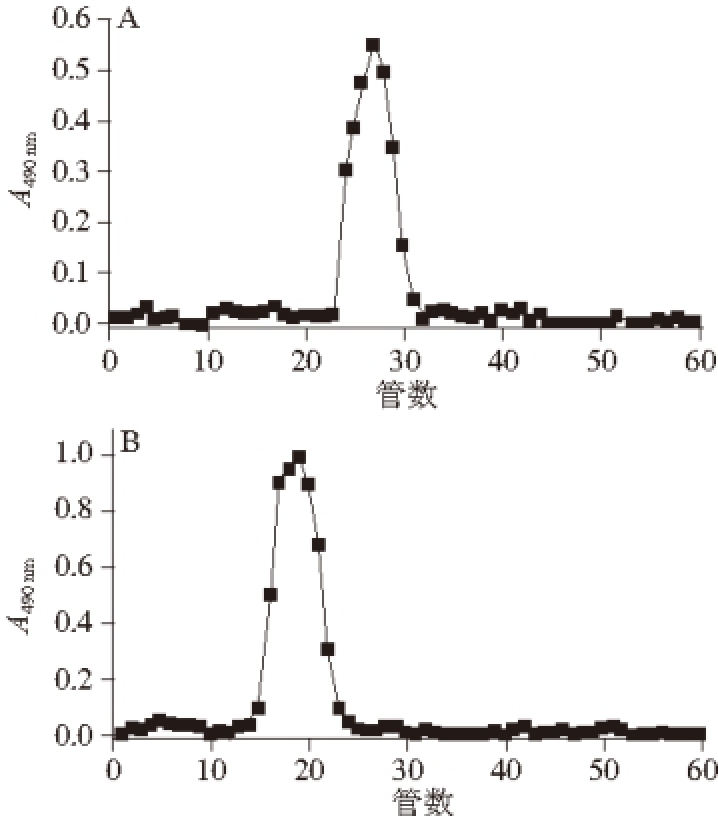
图2 Sepharose CL-6B凝胶柱层析纯化植物乳杆菌胞外多糖EPSEPS
YW11YW11(A)和EPSEPS
SKT109KT109(B)的洗脱曲线
Fig. 2 Elution profiles of different EPSs from L. plantarum on Sepharose CL-6B column (A: EPS
YW11; B: EPS
SKT109)
由于离子交换柱分离得到的多糖样品可能含有带相同电荷的不同组分,因此,需进一步采用凝胶层析按各组分分子质量的不同分离纯化。两种多糖样品经Sepharose CL-6B凝胶柱层析(图2),分别得到多糖的单一峰(图2A、B),经透析和冷冻干燥获得该两种多糖的纯品,分别记为EPS YW11和EPS SKT109,用于以下的实验。对此两种多糖纯品的进一步分析表明,经过纯化后的EPS SKT109和EPS YW11中的总糖含量分别为92.31%、89.02%,纯度较高;蛋白质含量分别为1.25%、1.01%;糖醛酸含量分别为0%、5.44%。两种多糖的水分含量均在4%左右。
2.2 植物乳杆菌胞外多糖的主要单糖组成

图3 EPS
YW11(A)、EPS
SKT109(B)和标准单糖(C)的气相色谱图
Fig. 3 GC chromatograms of EPS
YW11(A), EPS
SKT109(B) and standard monosaccharide references (C)
植物乳杆菌EPS YW11和EPS SKT109经三氟乙酸水解后的气相色谱分析及与单糖标准品的对比结果如图3所示。单糖标准品的保留时间(图3C)从左到右依次为鼠李糖(26.203 min)、岩藻糖(26.406 min)、阿拉伯糖(26.499 min)、木糖(26.904 min)、果糖(31.503 min)、葡萄糖(31.726 min)、半乳糖(31.891 min)。EPS YW11在保留时间为31.787 min和31.901 min时出峰(图3A),表明EPS YW11主要由葡萄糖和半乳糖两种单糖构成,EPS SKT109在保留时间为31.726 min和31.896 min时出峰(图3B),表明该EPS也由葡萄糖和半乳糖构成。通过面积归一化法定量分析可得,EPS YW11中葡萄糖与半乳糖物质的量比为3.45∶1,EPS SKT109中葡萄糖与半乳糖物质的量比为1.43∶1。Zhang Li等 [10]报道植物乳杆菌C88胞外多糖的单糖组成为葡萄糖和半乳糖(物质的量比为2∶1)。不同植物乳杆菌胞外多糖的单糖组成存在差异可能与产糖菌株、培养基类型和发酵条件有关。
2.3 植物乳杆菌胞外多糖的红外光谱分析
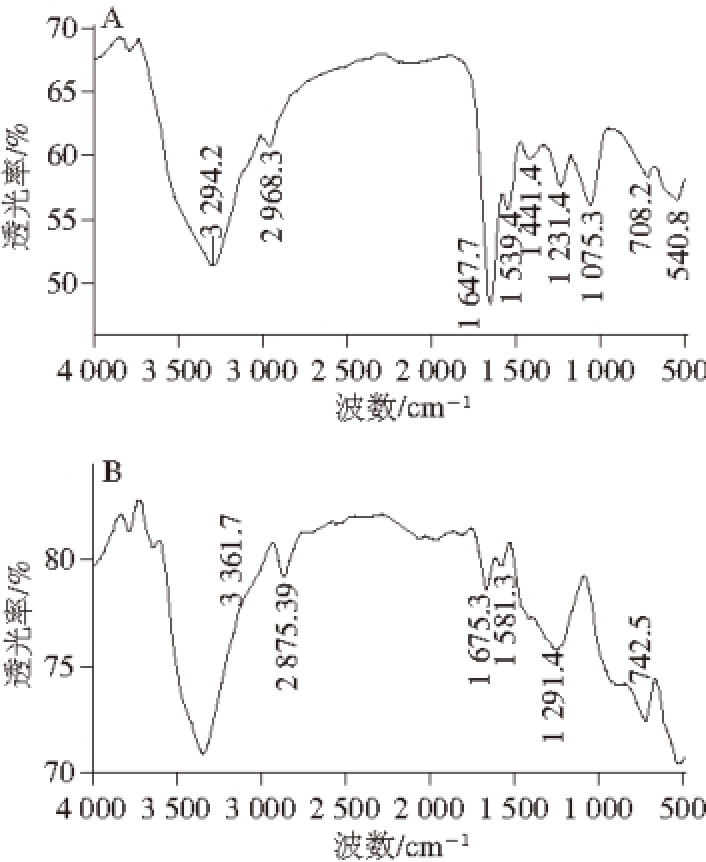
图4 EPS
YW11(A)和EPS
SKT109(B)的红外光谱图
Fig. 4 FT-IR spectra of EPS
YW11(A) and EPS
SKT109(B)
植物乳杆菌EPS YW11和EPS SKT109的红外光谱如图4所示。在3 294.2 cm -1(EPS YW11)和3 361.7 cm -1(EPS SKT109)处存在宽展圆滑的强吸收峰是由羟基伸缩振动造成的,表明多糖分子中存在大量的羟基。在2 968.3 cm -1(EPS YW11)和2 875.4 cm -1(EPS SKT109)处存在一个弱峰,归属于多糖分子中—CH 2的C—H伸缩振动,是多糖的特征吸收峰。在1 647.7 cm -1(EPS YW11)处存在一个强吸收峰,可能与胞外多糖中环状结构的C=O伸缩振动有关,在1 675.3 cm -1(EPS SKT109)处存在一个中强吸收峰,可能与C=C伸缩振动有关,Wang Jing等 [11]研究发现,此处出现红外吸收峰可能是由于半乳糖或甘露糖的存在造成的,进一步验证了两种多糖的单糖组成中存在半乳糖。在1 539.4 cm -1(EPS YW11)和1 581.3 cm -1(EPS SKT109)处存在弱的吸收峰,可能与N—H的弯曲振动有关,此峰可能是多糖中存的少量蛋白质造成的。在反应胞外多糖等高聚物的精细结构的指纹区(1 500~500 cm -1),吸收峰1 231.4 cm -1(EPS YW11)和1 291.4 cm -1(EPS SKT109)的出现可能与酯基存在有关,表明多糖结构中可能会出现CH 3COOR,Ai Lianzhong等 [12]对干酪乳杆菌LC2W胞外多糖的研究也有类似报道。EPS YW11在1 075.3 cm -1处存在宽吸收峰,是由C—OH伸缩振动和糖环的C—O—C伸缩振动引起的,708.2 cm -1(EPS YW11)和742.5 cm -1(EPS SKT109)处的弱峰表明可能存在对称环伸缩振动,表明EPS YW11和EPS SKT109中可能含有吡喃环糖残基 [13]。
2.4 植物乳杆菌胞外多糖的动态光散射分析
动态光散射技术具有对样品无干扰、测量信息量大、易操作、分析速度快等优点,采用该项技术直接测定得到的高聚物分子流体力学半径(R h)能够反映大分子在溶液中的尺寸,是研究高聚物流变特性的重要参数 [14]。通过ALV/CGS-3一体式光散射仪测定得到EPS YW11和EPS SKT109在NaNO 3溶液中的R h值分别为69.20 nm和41.74 nm。这与Shao Li等 [15]研究鼠李糖乳杆菌KF5胞外多糖的R h(59.4 nm)相接近。Schmitt等 [16]研究发现,溶液中大分子颗粒尺寸的差异可能会导致其不同的界面特性,一定范围内颗粒粒径越大,能够更有效地保持流体界面的稳定性。
2.5 植物乳杆菌胞外多糖的乳化特性
2.5.1 多糖质量浓度对其乳化能力的影响
表1 不同质量浓度EPS
YW11和EPS
SKT109的乳化指数
Table 1 Emulsifying indexes of EPS
YW11and EPS
SKT109at different concentrations
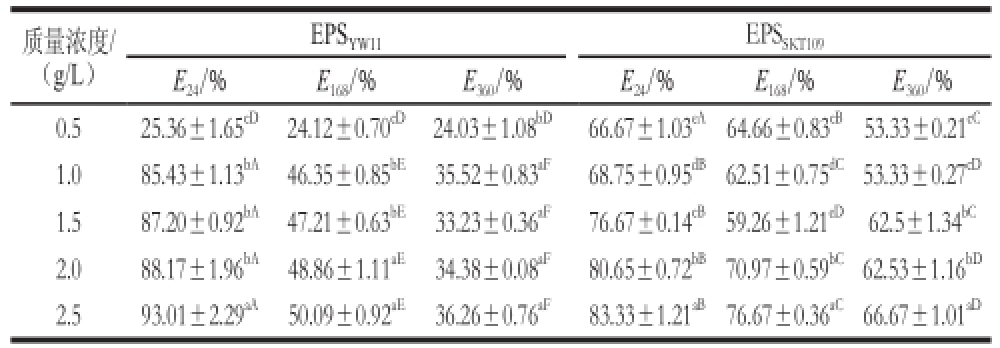
注:同行肩标小写字母不同表示差异显著(P<0.05);同列肩标大写字母不同表示差异显著(P<0.05)。
EPS SKT109E 24/%E 168/%E 360/%E 24/%E 168/%E 360/% 0.525.36±1.65 cD24.12±0.70 cD24.03±1.08 bD66.67±1.03 eA64.66±0.83 cB53.33±0.21 cC1.085.43±1.13 bA46.35±0.85 bE35.52±0.83 aF68.75±0.95 dB62.51±0.75 dC53.33±0.27 cD1.587.20±0.92 bA47.21±0.63 bE33.23±0.36 aF76.67±0.14 cB59.26±1.21 eD62.5±1.34 bC2.088.17±1.96 bA48.86±1.11 aE34.38±0.08 aF80.65±0.72 bB70.97±0.59 bC62.53±1.16 bD2.593.01±2.29 aA50.09±0.92 aE36.26±0.76 aF83.33±1.21 aB76.67±0.36 aC66.67±1.01 aD质量浓度/(g/L)EPS YW11
EPS YW11和EPS SKT109在不同质量浓度(1.0~2.5 g/L)下的乳化指数及其随时间延长的乳化稳定性如表1所示。在相同质量浓度下,EPS YW11的乳化指数( E 24)均明显高于EPS SKT109,表明EPS YW11的乳化能力强于EPS SKT109,这可能是由于在乳化初期,酸性多糖EPS YW11除了亲水基团的作用外,其他带电粒子与橄榄油中带相反电荷的基团相互作用,形成双分子层,加强了油滴之间的静电相互作用,从而增强了多糖的乳化能力 [17]。另一方面,EPS YW11的R h大于EPS SKT109的R h,可能增强了其界面稳定性,因而导致乳化能力提高。
随着多糖的质量浓度从0.5 g/L增加到2.5 g/L,此两种胞外多糖的乳化指数具有不同程度的增加,酸性胞外多糖EPS YW11的乳化指数(E 24)增加幅度最大,从25.94%增加到93.08%;而中性胞外多糖EPS SKT109的乳化指数增加幅度较小,从66.67%增加到83.33%。Han Yuzhu等 [18]研究发现,解淀粉芽孢杆菌LPL061胞外多糖在质量浓度为1.0 g/L时表现出较好的乳化特性,表明胞外多糖只有在到达一定的质量浓度时,才能起到较好的乳化作用。本研究中,植物乳杆菌EPS YW11和EPS SKT109在质量浓度为2.5 g/L时呈现较好的乳化特性。这可能是由于多糖质量浓度的增加,可导致整个体系黏度的增加 [19],同时多糖分子中亲水官能团(—CH 2等)的存在对多糖的乳化性起到一定的促进作用 [11]。
从表1还可以看出,EPS YW11和EPS SKT109的乳化指数随着时间的延长而呈现不同程度的下降趋势。在质量浓度为1 g/L时,EPS YW11随时间延长的乳化指数降幅显著,从85.43%(E 24)降为46.35%(E 168)和35.52%(E 360);而相同质量浓度时EPS SKT109的乳化指数降幅相对较小,从68.75%(E 24)降至62.51%(E 168)和53.33%(E 360)。胞外多糖乳化稳定性的差异,一方面与其形成的乳化颗粒的聚集程度不同有关;随着时间的延长,乳化液中粒径较小的乳化颗粒逐步聚集形成较大的颗粒,同时大的乳化颗粒也不断吞并小粒径乳化颗粒,最终乳液分层,乳化能力降低 [17],另一方面,胞外多糖絮凝能力的差异也影响乳化颗粒的相互聚集及最终的沉淀分离。
2.5.2 植物乳杆菌胞外多糖与不同乳化剂的协同效应
不同乳化能力的乳化剂混合,可以导致形成的乳化液的界面膜强度增加,而高强度的界面膜是形成稳定乳化液的原因之一 [20]。本实验以乳化指数(E 168)作为指标,研究了EPS YW11和EPS SKT109与其他4 种亲水乳化剂的协同效应;以乳化稳定性为指标,研究了此乳化协同效应的稳定性,结果如表2所示。EPS YW11与黄原胶复配时,乳化指数(E 168)达到89.58%,乳化能力较好,而与其他乳化剂复配时的乳化能力较单独使用EPS YW11(46.35%)的差异相对较小。EPS SKT109与刺槐胶或瓜尔豆胶复配时,乳化指数(E 168)分别为79.41%和76.47%,乳化能力较单独使用EPS SKT109(62.51%)有所提高,而当EPS SKT109与海藻酸钠和黄原胶复配时,乳化指数显著降低,一方面可能是由于多糖与凝胶复配后,协同体系的质量浓度较大,多余的乳化剂因絮凝作用导致颗粒聚集下沉,另一方面是由于协同效应影响乳化颗粒粒径,从而导致乳化体系失衡 [21]。EPS YW11与黄原胶复配时其乳化稳定性为61%,而与其他乳化剂混合乳化时,乳化稳定性都偏高,这表明在EPS YW11与黄原胶复配时,表现了较好的乳化稳定性。EPS SKT109在 与刺槐胶和瓜尔豆胶复配时,乳化稳定性为83%和75%,也表现出了相对较好的乳化稳定性。注:同列肩标小写字母不同表示差异显著(P<0.05)。
表2 EPS
YW11和EPS
SKT109与不同乳化剂的协同效应
Table 2 Synergistic effect of EPS
YW11and EPS
SKT109with another emulsifier
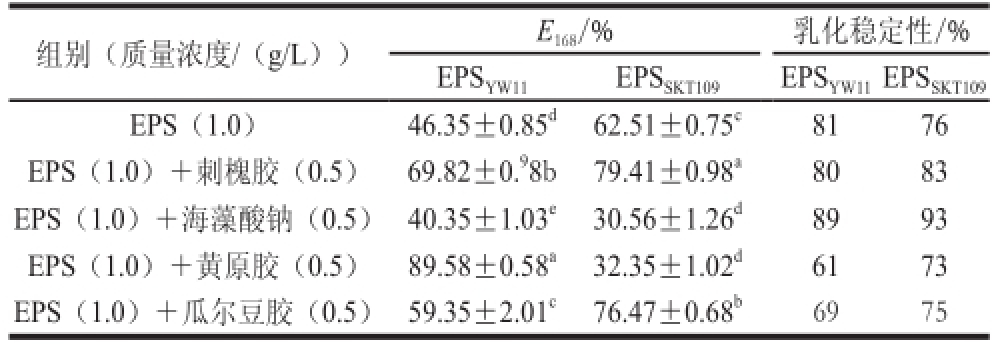
组别(质量浓度/(g/L))E 168/%乳化稳定性/% EPS YW11EPS SKT109EPS YW11EPS SKT109EPS(1.0) 46.35±0.85 d62.51±0.75 c8176 EPS(1.0)+刺槐胶(0.5)69.82±0. 98b79.41±0.98 a8083 EPS(1.0)+海藻酸钠(0.5)40.35±1.03 e30.56±1.26 d8993 EPS(1.0)+黄原胶(0.5)89.58±0.58 a32.35±1.02 d6173 EPS(1.0)+瓜尔豆胶(0.5)59.35±2.01 c76.47±0.68 b6975
2.5.3 植物乳杆菌胞外多糖乳化颗粒的粒径及分布
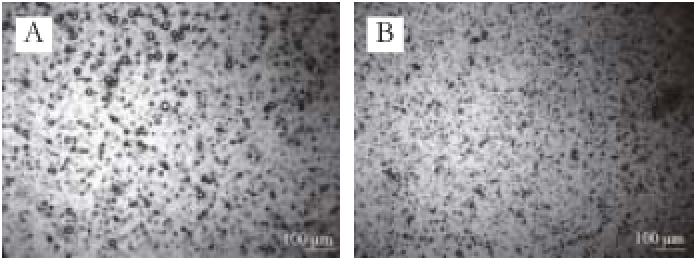
图5 EPS
YW11(A)和EPS
SKT109(B)乳化颗粒的显微照片(100×)
Fig. 5 P hotomicrographs of emulsions prepared with 1 g/100 mL of EPS
YW11(A) and EPS
SKT109(B), respectively (100 ×)
乳化颗粒粒径是反映乳化剂物理稳定性的重要指标,粒径的大小与乳化剂的絮凝能力及分层速率密切相关。本实验对EPS YW11和EPS SKT109的乳化液进行了显微观察(图5),并通过Image Pro Plus软件分析了乳化颗粒的半径及出现频率,结合SPSS21.0软件,绘制出乳化颗粒与概率密度直方图(图6)。从图5可以看出,EPS SKT109乳化颗粒较EPS YW11小,总体分布比较均匀,且乳化颗粒都是独立的球体,没有出现黏连的情况。从图6可以看出,EPS YW11乳化颗粒的半径主要分布在1~12 μm之间,其中半径1~2 μm的乳化颗粒占59%,半径1~4 μm的占75%;EPS SKT109乳化颗粒的半径主要分布在1~6 μm之间,其中大部分乳化颗粒集中在1~2 μm之间,占总量的88%。据报道 [22],戊糖乳杆菌胞外多糖的乳化颗粒相对较大,颗粒半径分布在5~20 μm之间,而婴儿双歧杆菌NCIMB 702205胞外多糖乳化颗粒半径小于5 μm的占72% [1]。Xu等 [23]对水包油型乳化液的研究表明,乳化颗粒越小,乳化液的稳定性越高。总之,本研究的EPS YW11和EPS SKT109乳化颗粒相对较小,乳化稳定性较好,而且EPS SKT109的乳化颗粒小于EPS YW11而相对更稳定一些,二者具有开发为食品级乳化剂的潜在特性。
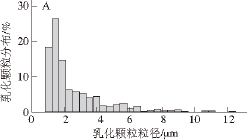

图6 EPS
YW11(A)和EPS
SKT109( B)乳化颗粒的粒径分布
Fig. 6 Particle size distribution of emulsions prepared with 1 g/100 mL of EPS
YW11(A) and EPS
SKT109(B), respectively
本研究对植物然杆菌YW11和SKT109在基于脱脂乳培养基中发酵产生的胞外多糖进行了分离纯化,分别获得了酸性多糖EPS YW11和中性多糖EPS SKT109纯品。此两种胞外多糖的红外光谱均存在多糖的特征吸收峰;其单糖组成均为葡萄糖和半乳糖,但两种单糖的物质的量比不同。对EPS YW11和EPS SKT109乳化特性的研究表明,二者均可形成相对较小的乳化颗粒,呈现良好的乳化特性;EPS SKT109乳化颗粒半径略低于EPS YW11,前者具有相对更好的乳化稳定性。同时,两种胞外多糖与常用的乳化剂具有不同程度的乳化协同效应,其中EPS YW11与黄原胶复配时的协同效应明显,且具有较好的乳化稳定性。本研究获得的植物乳杆菌胞外多糖EPS YW11和EPS SKT109在食品工业中具有潜在的应用开发前景。
参考文献:
[1] PRASANNA P H P, BELL A, GRANDISON A S, et al. Emulsifying, rheological and physicochemical properties of exopolysaccharide produced by Bifi dobacterium longum subsp. infantis CCUG 52486 and Bifidobacterium infantis NCIMB 702205[J]. Carbohydrate Polymers, 2012, 90(1): 533-540. DOI:10.1016/j.carbpol.2012.05.075.
[2] WANG Yanping, AHMED Z, FENG Wu, et al. Physicochemical properties of exopolysaccharide produced by Lactobacillus kefi ranofaciens ZW3 isolated from Tibet kefi r[J]. International Journal of Biological Macromolecules, 2008, 43(3): 283-288. DOI:10.1016/ j.ijbiomac.2008.06.011.Epub2008 Jul9.
[3] WANG Ji, ZHAO Xiao, TIAN Zheng, et al. Characterization of an exopolysaccharide produced by Lactobacillus plantarum YW11 isolate d from Tibet kefi r[J]. Carbohydrate Polymers, 2015, 125: 16-25. DOI:10.1016/j.carbpol.2015.03.003.
[4] YILMAZ M T, DERTLI E, TOKER O S, et al. Effect of in situ exopolysaccharide production on physicochemical, rheological, sensory, and microstructural properties of the yogurt drink ayran: an optimization study based on fermentation kinetics[J]. Journal of Dairy Science, 2015, 98(3): 1604-1624. DOI:10.3168/jds.2014-8936. Epub2014Dec26.
[5] de VUYST L, ZAMFIR M, MOZZI F, et al. Exopolysaccharideproducing Streptococcus thermophilus strains as functional starter cultures in the production of fermented milks[J]. International Dairy Journal, 2003, 13(8): 707-717. DOI:10.1016/S0958-6946(03)00105-5.
[6] 丹彤, 王俊国, 张和平. 乳酸菌胞外多糖的结构、生物合成及其应用[J]. 食品科学, 2013, 34(7): 335-339. DOI:10.7506/spkx1002-6630-201307071.
[7] FREITAS F, ALVES V D, CARVALHERIA M, et al. Emulsifying behaviour and rheological properties of the extracellular polysaccharide produced by Pseudomonas oleovorans grown on glycerol byproduct[J]. Carbohydrate Polymers, 2009, 78(3): 549-556. DOI:10.1016/j.carbpol.2009.05.016.
[8] HAJ-MUSTAFA M, ABDI R, SHEIKH-ZEINODDIN M, et al. Statistical study on fermentation conditions in the optimization of exopolysaccharide production by Lactobacillus rhamnosus 519 in skimmed milk base media[J]. Biocatalysis and Agricultural Biotechnology, 2011, 16(3): 542-548. DOI:10.1016/j.bcab.2015.08.013.
[9] 王辑. 产胞外多糖植物乳杆菌的分离筛选、分子表征及其应用研究[D]. 长春: 吉林大学, 2015: 43-44.
[10] ZHANG Li, LIU Chunhong, LI Da, et al. Antioxidant activity of an exopolysaccharide isolated from Lactobacillus plantarum C88[J]. International Journal of Biological Macromolecules, 2013, 54: 270-275. DOI:10.1016/j.ijbiomac.2012.12.037.
[11] WANG Jing, SOMASUNDARAN P. Study of galactomannose interaction with solids using AFM, IR and allied techniques[J]. Journal of Colloid and Interface Science, 2007, 309(2): 373-383. DOI:10.1016/ j.jcis.2006.10.086.
[12] AI Lianzhong, ZHANG Hao, GUO Benheng, et al. Preparation, partial characterization and bioactivity of exopolysaccharides from Lactobacillus casei LC2W[J]. Carbohydrate Polymers, 2008, 74(3): 353-357. DOI:10.1016/j.carbpol.2008.03.004.
[13] DERTLI E, TOKER O S, DURAK M Z, et al. Development of a fermented ice-cream as influenced by in situ exopolysaccharide production: rheological, molecular, microstructural and sensory characterization[J]. Carbohydrate Polymers, 2016, 136: 427-440. DOI:10.1016/j.carbpol.2015.08.047.
[14] 章轶锋. 超支化多糖的结构和链构象及其功能化[D]. 武汉: 武汉大学, 2011: 77-79.
[15] SHAO Li, WU Zhengjun, TIAN Fengwei, et al. Molecular characteristics of an exopolysaccharide from Lactobacillus rhamnosus KF5 in solution[J]. International Journal of Biological Macromolecules, 2015, 72: 1429-1434. DOI:10.1016/j.ijbiomac.2014.10.015.
[16] SCHMITT C, BOVAY C, ROUVET M, et al. Whey protein soluble aggregates from heating with NaCl: physicochemical, interfacial, and foaming properties[J]. Langmuir, 2007, 23(8): 4155-4166. DOI:10.1021/la0632575.
[17] 唐凌云. 沙蒿多糖流变学特性及乳化性研究[D]. 西安: 西北农林科技大学, 2014: 31-33.
[18] HAN Yuzhu, LIU Enqi, LIU Lisha, et al. Rheological, emulsifying and thermostability properties of two exopolysaccharides produced by Bacillus amyloliquefaciens LPL061[J]. Carbohydrate Polymers, 2015, 115: 230-237. DOI:10.1016/j.carbpol.2014.08.044.
[19] SUN Wenbin, SUN Dejun, WEI Yunping, et al. Oil-in-water emulsions stabilized by hydrophobically modified hydroxyethyl cellulose: adsorption and thickening effect[J]. Journal of Colloid and Interface Science, 2007, 311(1): 228-236. DOI:10.1016/j.jcis.2007.02.082.
[20] GEE R P. Emulsion polymerization of dimethylcyclosiloxane in cationic emulsion: mechanism study utilizing two phase liquidliquid reaction kinetics[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2015, 481: 297-306. DOI:10.1016/ j.colsurfa.2015.05.033.
[21] 王艳萍, 李超, AHMED Z. 一株马乳酒样乳杆菌胞外多糖的理化性质[J]. 食品与发酵工业, 2011, 37(9): 59-63.
[22] PORTILLA-RIVERA O M, TORRADO A M, DOMINGUEZ J M, et al. Stabilization of kerosene/water emulsions using bioemulsifi ers obtained by fermentation of hemicellulosic sugars with Lactobacillus pentosus[J]. Journal of Agricultural and Food Chemistry, 2010, 58(18): 10162-10168. DOI:10.1021/jf101585e.
[23] XU Q Y, NAKAJIMA M, BINKS B P. Preparation of particlestabilized oil-in-water emulsions with the microchannel emulsifi cation method[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2005, 262(1/3): 94-100. DOI:10.1016/j.colsurfa.2005.04.019.
Isolation, Purifi cation and Emulsifying Properties of Exopolysaccharides Produced by Lactobacillus plantarum
CAO Yongqiang
1,2, ZHANG Jian
1,2, ZHAO Wen
1,2, ZHANG Tonghe
1,2, SUN Jing
1,2, YANG Zhennai
1,2,*
(1. Beijing Advanced Innovation Center for Food Nutrition and Human Health, Beijing Technology and Business University, Beijing 100048, China; 2. Beijing Laboratory for Food Quality and Safety, Beijing Technology and Business University, Beijing 100048, China)
Abstract:In this study, Lactobacillus plantarum YW11 and SKT109 were separately incubated with skim milk. The crude exopolysaccharides (EPSs) produced by the 2 strains were prepared by adding the culture with trichloroacetic acid to remove proteins, followed by centrifugation, ethanol precipitation, dialysis and lyophilization, and they were further purified by successive DEAE-Sepharose Fast Flow ion-excha nge chromatography and Se pharose CL-6B gel fi ltra tion chromatography. The monosaccharide composition of EPSs was analyzed by gas chromatography and their FT-IR spectra as well as hydrodynamic radii (R h) were determined using a KBr disc technique and dynamic light scattering, respectively. The results showed that the EPS from strain YW11 was composed of glucose and galactose in a molar ratio of 3.45:1, and its R hvalue was calculated as approximately 69.20 nm. On the other hand, the EPS from strain SKT109 was composed of glucose and galactose in a molar ratio of 1.43:1, and its R hvalue was calculated as approximately 41.74 nm. The emulsifying capacity of the EPS from YW11 strain was higher, but its emulsifying stability was lower than that of the EPS from SKT109. Both EPSs had certain synergic emulsifying effects when either was mixed with other emulsifi ers, with particle size of the emulsion particles being mainly in the range of 1–2 μm. The EPSs produced by L. plantarum in this study have potentially promising applications in food processing.
Key words:Lactobacillus plantarum; exopolysaccharides; isolation; purifi cation; emulsifying properties
DOI:10.7506/spkx1002-6630-201617002
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2016)17-0007-07
收稿日期:2015-10-08
基金项目:国家自然科学基金面上项目(31371804);中国博士后科学基金项目(2015M580939)
作者简介:曹永强(1991—),男,硕士研究生,研究方向为乳品生物技术。E-mail:caoyongqiang91@163.com
*通信作者:杨贞耐(1965—),男,教授,博士,研究方向为乳品科学及加工技术。E-mail:yangzhennai@th.btbu.edu.cn
引文格式: