范智义,李晓琳,李巨秀*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
摘 要:利用葡聚糖凝胶层析柱将桑椹提取物分为6 个组分(F1、F2、F3、F4、F5、F6),研究了桑椹中酚类化合物的抗氧化能力和抗糖基化能力。采用Folin-酚法、pH示差法和高效液相色谱法测定各组分总酚、总花色苷含量和酚类化合物成分;通过1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2,2’-联氮-二(3-苯并噻唑-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulphonic acid),ABTS)自由基清除率和亚铁还原能力实验评价各组分抗氧化能力;建立牛血清白蛋白-果糖模拟反应体系和牛血清白蛋白-丙酮醛模拟反应体系评价各组分抗糖基化能力。结果表明:桑椹提取物中检测出5 种酚酸、两种花色苷和两种黄酮类物质;F3的总花色苷含量最高(P<0.05,(101.10±2.39) mg 矢车菊素-3-葡萄糖苷当量/g),F5的总酚含量最高(P<0.05,(188.05±2.01) m g 没食子酸当量/g);F3的抗氧化能力显著高于其他组分(P<0.05,DPPH自由基清除能力、ABTS +·清除能力、亚铁还原能力分别为(129.33±5.58)、(194.33±2.48)、(130.44±1.38) mmol Trolox/g),F5的抗糖基化能力显著强于其他组分(P<0.05,牛血清白蛋白-果糖模拟反应体系和牛血清白蛋白-丙酮醛模拟反应体系中的糖基化抑制率分别为(87.23±0.36)%和(66.99±1.62)%);桑椹提取物的抗氧化能力、抗糖基化能力分别与总花色苷、总酚含量呈现显著的回归关系(P<0.05)。
关键词:桑椹;酚类化合物;抗氧化;抗糖基化
范智义, 李晓琳, 李巨秀. 桑椹提取物中酚类化合物的抗氧化及抗糖基化活性分析[J]. 食品科学, 2016, 37(17): 19-26.
FAN Zhiyi, LI Xiaolin, LI Juxiu. Antioxidant and antiglycation activities of phenolic compounds extracted from mulberry fruits[J]. Food Science, 2016, 37(17): 19-26. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201617004. http://www.spkx.net.cn
非酶糖基化是指蛋白质等含游离氨基的生物分子与诸如葡萄糖、果糖等还原糖通过非酶反应结合的过程 [1]。非酶糖基化是蛋白质译后化学修饰的主要方式之一 [2],由此生成的晚期糖基化末端产物(advanced glycation end products,AGEs)与人体氧化应激状态密切相关 [3],能够引发诸如阿兹海默综合征、糖尿病在内的多种流行性慢性病 [1]。
天然酚类化合物是一类分布广泛的植物次生代谢产物,包括酚酸、黄酮、花色苷等多种 [4],,由于其突出的功能活性和保健作用,近年来引起了人们广泛的关 注。抗氧化和抗糖基化是天然酚类化合物最为重要的功能活性。通过抑制活性氧及非酶糖基化,激活体内抗氧化酶系 [5-7],天然酚类化合物能够减轻体内氧化应激,防止蛋白质的不良修饰和信号通路的异常激活 [8-10],对预防和治疗相关疾病具有一定效果。天然酚类化合物作为膳食中摄入量较大的一种抗氧化剂 [11],广泛分布于多种果蔬中,毒性相对较低 [12]。近年来的研究表明,天然酚类化合物能够通过清除自由基和活性羰基化合物、螯合金属离子、防止蛋白结构修饰等多种机制抑制AGEs的生成 [13-15]。
桑椹是桑属(Morus)各植物果实的统称,在世界范围内分布广泛 [16]。桑椹中含有丰富的维生素、矿物质以及花色苷等天然酚类化合物 [17]。研究表明,抗氧化和抗糖基化是桑椹中酚类化合物防治高血糖、高血脂、阿兹海默综合征等疾病的潜在机制 [18-20]。目前对于桑椹的研究多集中于对其提取物的成分分析及功能性评价方面,而对其中酚类化合物的种类与功能活性,尤其是与抗糖基化能力的关系仍缺乏系统的研究。
本研究利用Sephadex LH-20 葡聚糖凝胶层析柱将纯化后的桑椹提取物分离为6 个组分,分析了各组分中酚类化合物的含量和种类,同时检测了其1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和2,2’-联氮-二(3-苯并噻唑-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulphonic acid),ABTS)自由基清除能力、亚铁还原能力(ferric-reducing antioxidant power,FRAP)以及抗糖基化能力,并利用回归分析检验了不同类别酚类化合物与各组分功能活性的回归关系,初步分析了桑椹中天然酚类化合物的抗氧化能力和抗糖基化能力,以期科学评价桑椹的保健功能,并为相关疾病的防治提供新的方法。
1.1 材料与试剂
桑椹(无核大十,Morus atropurpurea Roxb.)产自陕西省周至县,使用前冻存于-80 ℃环境中。
DPPH、ABTS、2,4,6-三吡啶基三嗪(2,4,6-tripyridyls-triazine,TPTZ)、Sephadex LH-20葡聚糖凝胶、果糖、牛血清白蛋白(bovine serum albumin,BSA)、丙酮醛(methyglyoxal,MGO)、6-羟基-2,5,7,8-四甲基色烷-2-羧酸(Trolox)、氨基胍(aminoguanidine,AG)及酚类化合物标准品没食子酸、原儿茶酸、对羟基苯甲酸、咖啡酸、对香豆酸、邻香豆酸、芦丁、槲皮素 美国Sigma-Aldrich公司;矢车菊素-3-葡萄糖苷(cyanidin-3-glucoside,CG)、矢车菊素-3-芸香糖苷(cyanidin-3-rutinoside,CR)标准品 美国ChromaDex公司;AB-8大孔吸附树脂 天津波鸿树脂科技有限公司;Folin-酚试剂 上海荔达生物科技有限公司。
1.2 仪器与设备
PharmaSpec UV-1700紫外-可见分光光度计、高效液相色谱(high performance liquid chromatography,HPLC)仪 日本岛津公司;F-4500荧光分光光度计 株式会社日立制作所;BSP-250生化恒温培养箱上海博迅实业有限公司;CS110-4冷冻干燥机 丹麦LaboGene公司;RE201D旋转蒸发器 巩义市予华仪器有限责任公司;HL-2B恒流泵 上海青浦沪西仪器厂;Φ2.8 cm×55 cm普通玻璃层析柱 上海方畦仪器有限公司;BT25S分析天平 德国赛多利斯公司;HWY211卧式恒温摇床 上海智城分析仪器制造有限公司。
1.3 方法
1.3.1 桑椹中酚类化合物的提取和分离
将桑椹解冻、破碎后与体积分数70%的乙醇溶液(含0.5%盐酸)以料液比1∶15(m/V)混合,45 ℃提取2 h。提取液经纱布过滤后减压浓缩,浓缩液用AB-8大 孔吸附树脂振荡吸附24 h,取出树脂,利用体积分数70%的甲醇溶液(含1%甲酸)解吸树脂所吸附的酚类化合物。解吸液经减压浓缩、冷冻干燥即得桑椹 提取物。
将约0.5 g的桑椹提取物用2 mL一定体积分数的甲醇(含1%甲酸)溶解,装入Sephadex LH-20葡聚糖凝胶柱(Φ2.8 cm×28 cm)顶端,先后用体积分数30%、50%、70%、90%的甲醇溶液各50 mL(均含有1%甲酸)洗脱凝胶柱,恒流泵流速35 r/min。用50 mL塑料离心管收集洗脱液,每5 min收集一管。洗脱完毕后,合并颜色相近的洗脱液,分别进行真空浓缩和冷冻干燥,得到桑椹花色苷各分离组分。按照流出层析柱的先后将各组分命名为:F1、F2、F3、F4、F5、F6。将各组分配制成0.01 mg/mL质量浓度的溶液备用。
1.3.2 桑椹提取物各组分总酚含量的测定
桑椹提取物各组分的总酚含量通过Folin-酚法进行测定。将1 mL 0.01 mg/mL桑椹提取物各组分溶液、3 mL 1 mol/L Folin-酚试剂和6 mL 12 g/mL碳酸钠溶液混合,蒸馏水稀释至10 mL,常温避光反应2 h后,于765 nm波长处测吸光度。各样品的总酚含量参考标准曲线用没食子酸(gallic acid,GA)当量(每克样品干质量中酚类化合物相当于的没食子酸的毫克数,mg GA/g)表示。
1.3.3 桑椹提取物各组分总花色 苷含量的测定
各组分中总花色苷的含量利用pH示差法进行测定 [21]。取 1 mL各组分溶液与9 mL氯化钾-盐酸溶液(0.025 mol/L、pH 1)或醋酸缓冲液(0.4 mol/L、pH 4.5)混合,室温放置20 min。测量各样液在510 nm和700 nm波长处的吸光度。各样品的吸光度A通过公式(1)进行计算。
式中:(A 510 nm-A 700 nm) pH1.0为样品与氯化钾-盐酸溶液混合后在510 nm和700 nm波长处的吸光度差值;(A 510 nm-A 700 nm) pH4.5为样品与醋酸缓冲液混合后在510 nm和700 nm波长处的吸光度差值。
各样品中总花色苷含量根据公式(2)进行计算。
式中:c为样品中总花色苷的含量,即每克样品干质量所含的CG当量毫克数(mg CG/g);M W代表桑椹中主要花色苷CG的摩尔质量(M W=449.2 g/mol);DF为样品的稀释倍数(DF=10);ε为花色苷溶液的吸光系数(ε=26 900 L/(cm·mol));ρ为样品溶液的质量浓度/(mg/L);l为光程长度(1 cm)。
1.3.4 桑椹提取物各组分的HPLC分析
将桑椹提取物各组分溶解于含有0.1%甲酸的甲醇中,过0.45 μm聚四氟乙烯过滤器。各样品的HPLC分析使用LC-20AT prominence HPLC系统、SIL-20A自动进样器、DGU-20A脱气装置、SPD-M20A 二极管阵列检测器及Inertsil TMODS-SP色谱柱(250 mm×4.6 mm,5 μm)。流动相A为1%的甲酸溶液,流动相B为甲醇,流速1.0 mL/ min。梯度洗脱程序如下:0~10 min内,5%(体积分数,下同)B;10~15 min内,5%~10% B;15~30 min内,10%~20% B;30~40 min内,20%~25% B;40~55 min内,25~33% B;55~70 min内,33%~50% B;70~80 min内,50%~70% B;80~90 min内,70%~5% B。酚酸、黄酮和花色苷分别在280、320、520 nm波长处进行检测。
1.3.5 桑椹提取物各组分的抗氧化能力评价
1.3.5.1 DPPH自由基清除能力测定
DPPH自由基清除能力测定参考文献[22],稍作改动。取1 mL 0.01 mg/mL各组分溶液分别与4.5 mL 100 μmol/L DPPH溶液混合。避光反应30 min后,于517 nm波长处测定样品的吸光度,用蒸馏水代替DPPH溶液作为空白,用同浓度的抗坏血酸(VC)溶液代替各组分溶液作为阳性对照组。根据Trolox DPPH自由基清除能力标准曲线,各组分的自由基清除能力以Trolox当量抗氧化能力(trolox equivalent antioxidant capacity,TEAC)表示,它代表与1 g样品干质量具有相同抗氧化能力所需Trolox的毫摩尔数(mmol Trolox/g)。
1.3.5.2 ABTS +·清除能力测定
ABTS +·清除能力测定参考文献[23],稍作改动。ABTS +·溶液(7 mmol/L)与过硫酸钾溶液(7.35 mmol/L)按2∶1(V/V)混合,室温避光反应16 h得到ABTS +·储备液。将ABTS +·储备液用甲醇稀释至在734 nm波长处吸光度达到0.70±0.02,即得ABTS +·工作液。取1 mL桑椹提取物各组分溶液,分别与4.5 mL ABTS +·工作液混合,避光反应6 min后,于734 nm波长处测量各样品的吸光度。用蒸馏水代替ABTS +·工作液作为空白,用同浓度的VC溶液代替各组分溶液作为阳性对照组。根据Trolox ABTS +·清除能力标准曲线,各组分的自由基清除能力用TEAC表示。
1.3.5.3 FRAP测定
参考现有文献进行FRAP评价 [24]。将醋酸缓冲液(pH 3.6、30 mmol/L)、TPTZ溶液(10 mmol/L,用40 mmol/L HCl溶液溶解)和氯化铁溶液按体积比10∶1∶1混合,37 ℃加热15 min,得FRAP工作液。随后将1 mL各组分溶液分别与4.5 mL FRAP工作液混合,避光反应2 h,于593 nm波长处测量各样品的吸光度。用蒸馏水代替FRAP工作液作为空白组,用同质量浓度的VC溶液代替各组分溶液作为阳性对照组。各组分的FRAP用TEAC表示。
1.3.6 桑椹提取物各组分的抗糖基化能力评价
1.3.6.1 BSA-果糖模拟反应体系的建立
BSA-果糖模拟反应体系可用来评价整个蛋白质非酶糖基化过程中荧光性AGEs的生成情况 [25]。将1 mL果糖溶液(1.5 mol/L)与1 mL桑椹提取物组分溶液混合,37 ℃孵育2 h后,加入1 mL 30 mg/mL BSA溶液,以上反应物均用50 mmol/L pH 7.4磷酸盐缓冲液(含有0.1%叠氮化钠)溶解。用同质量浓度的AG溶液代替桑椹提取物各组分溶液作为阳性对照组,用磷酸盐缓冲液代替桑椹提取物各组分溶液作为空白组,用磷酸盐缓冲液代替果糖溶液作为BSA、桑椹提取物共孵育组。将各样品于生化培养箱中37 ℃孵育6 d后,在激发波长370 nm、发射波长440 nm条件下测定各样品的荧光强度。桑椹提取物对荧光性AGEs生成的抑制率R通过以公式(3)进行计算。
式中:F A为各样品组的荧光强度;F B代表空白组的荧光强度。
1.3.6.2 BSA-MGO模拟反应体系的建立
MGO是非酶糖基化过程中重要的中间产物,BSA-MGO模拟反应体系可用来评价蛋白质糖基化中间化合物的形成 [25]。将1 mL 60 mmol/L MGO溶液与1 mL桑椹提取物各组分溶液混合,37 ℃孵育2 h后,加入1 mL 30 mg/mL的BSA溶液。所有反应物均用50 mmol/L pH 7.4的磷酸盐缓冲液(含0.1%叠氮化钠)溶解,用同质量浓度的AG溶液代替桑椹提取物各组分溶液作为阳性对照组,用磷酸盐缓冲液代替桑椹提取物各组分溶液作为空白组,用磷酸盐缓冲液代替MGO溶液作为BSA、桑椹提取物共孵育组。将样品置于生化培养箱中,37 ℃孵育6 d,于激发波长370 nm、发射波长440 nm处测定各样品的荧光强度。各组分溶液对荧光性AGEs生成的抑制率R通过公式(3)进行计算。
1.4 数据分析
所有实验均进行3 次重复,数据以±s表示。利用DPS v7.05数据处理软件进行一元线性回归分析,并利用Duncan’s新复极差法检验数据间差异的显著性(P<0.05)。
2.1 桑椹提取物各组分总酚、总花色苷含量
Sephadex LH-20是一种羟丙基化的葡聚糖凝胶 [26],在凝胶层析柱中,不同体积分数的甲醇使桑椹提取物中的酚类化合物按照极性由大到小的顺序分离,共得到6 个组分。由图1可知,F1和F2的总酚含量(分别为(26.20±0.56)、(24.99±0.74) mg GA/ g)显著低于其他组分(P<0.05)。F3和F6的总酚含量分别为(129.62±1.79)、(97.72±1.21) GA/g,F4((185.38±1.68) mg GA/g)和F5((188.05±2.01) mg GA/g)的总酚含量较高,其中F5的总酚含量最高,显著高于其他组分(P<0.05)。花色苷主要集中在F3((101.10±2.39) mg CG/g)、F4((70.57±1.38) mg CG/g)和F5((32.68±1.36) mg CG/g)中,其中F3的总花色苷含量显著高于其他组分(P<0.05),而F1、F2和F6中的总花色苷含量显著低于其他组分(P<0.05),含量依次为(2.54±0.35)、(5.02±0.17)、(8.77±1.09) mg CG/g。
桑椹中含有丰富的酚类化合物,Bae等 [27]利用70%的乙醇溶液常温浸提不同品种桑椹中的酚类化合物,得到的干燥提取物中总酚含量在(959.9±23.1)~(2 570.4±57.1) μg GA/g之间,总花色苷含量在(137.3±7.7)~(2 057.3±18.5) μg/g(锦葵素-3-葡萄糖苷当量)之间,本实验中桑椹提取物各组分的总酚和总花色苷含量高于此结果,这可能是由于AB-8大孔树脂的吸附和Sephadex LH-20的分离对桑椹中的酚类化合物起到了一定的富集作用。
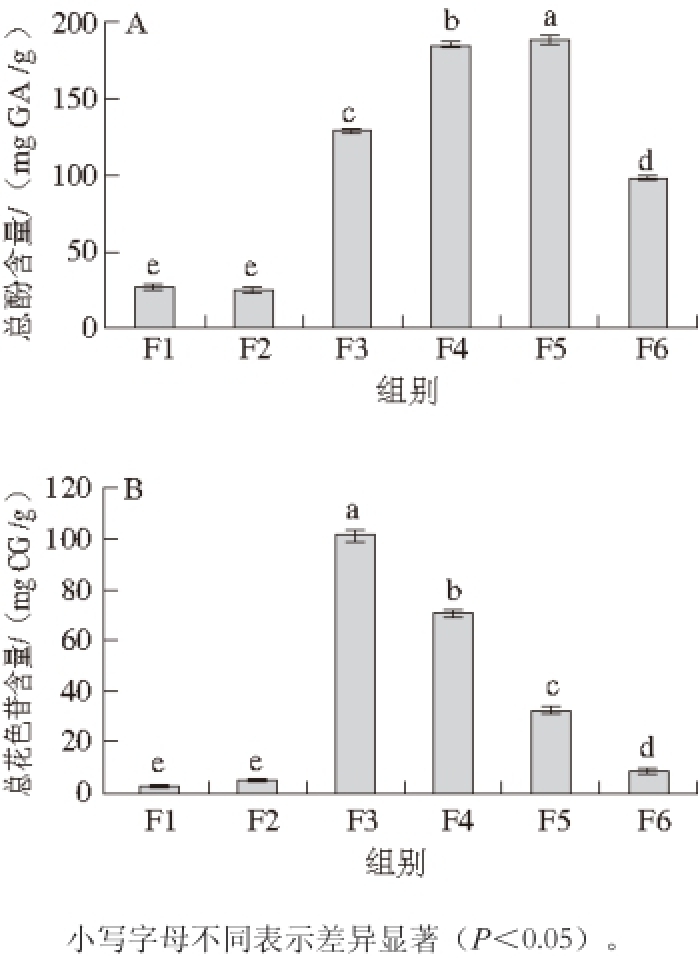
图1 桑椹提取物各组分的总酚(A)和总花色苷(B)含量
Fig. 1 Total phenolic contents (A) and total anthocyanin contents (B) of different fractions extracted from mulberry fruits
2.2 桑椹提取物各组分中酚类化合物的成分
由表1可知,F2、F3中原儿茶酸和对羟基苯甲酸含量显著高于其他组分(P<0.05),F3、F4中的花色苷(CG和CR)含量显著高于其他组分(P<0.05),F4与F5的芦丁与槲皮素含量显著高于其他组分(P<0.05),咖啡酸、邻香豆酸和对香豆酸的含量相对较低。原儿茶酸、CG和CR存在于所有组分中,对香豆酸仅存在于F4和F5中,咖啡酸和邻香豆酸仅存在于F5中。Oki等 [28]通过对比不同品种桑椹中的花色苷成分发现,CG和CR占桑椹总花色苷含量的90%以上,相比于CR,CG的含量略高,这与本研究结果相一致。本研究共鉴定出原儿茶酸、对羟基苯甲酸、咖啡酸、对香豆酸和邻香豆酸5 种酚酸化合物,此结果与Yu Yuanshan等 [29]对桑椹果汁中酚酸的分析结果基本吻合,但乙醇相对于水能够更好地浸提酚类物质 [30],故除酚酸外,本研究还检测到了几种黄酮类化合物。
由于缺乏标准品,HPLC中的某些色谱峰未能得到鉴定。这可能是造成Folin-酚法与HPLC分析中总酚含量分布不一致的原因。虽然各组分的酚类物质成分复杂,但HPLC分析显示各组分中仅有两种主要花色苷,因此,pH示差法测得的总花色苷含量在各组分的分布情况与HPLC分析的结果基本相同。
表1 桑椹提取物不同组分酚类化合物的组成
Table 1 Phenolic profiles of different fractions mg/g

注:nd.未检出;同行肩标小写字母不同表示差异显著(P<0.05)。
物质名称 F1F2F3F4F5F6原儿茶酸0.44±0.03 f14.82±0.33 b23.37±0.34 a7.54±0.54 c3.52±0.06 d0.98±0.02 e对羟基苯甲酸0.06±0.00 d33.01±0.55 a21.16±0.13 b2.05±0.10 c2.43±0.08 cnd咖啡酸ndndndnd1.90±0.10nd对香豆酸ndndnd2.11±0.11 a0.42±0.12 bnd邻香豆酸ndndndnd0.69±0.10nd CG0.33±0.01 f1.82±0.01 e99.88 ± 0.94 a77.19±0.37 b19.38±0.19 c4.38±0.04 dCR0.30±0.00 e1.23±0.01 cd24.07±1.13 a5.92±0.04 b2.04±0.00 c1.09±0.02 de芦丁nd0.21±0.02 d0.86±0.12 d31.31±1.57 a11.12±0.21 b3.12±0.06 c槲皮素ndnd0.06±0.00 b2.02±0.32 a1.71±0.07 a0.48±0.02 b
2.3 桑椹提取物各组分的抗氧化能力
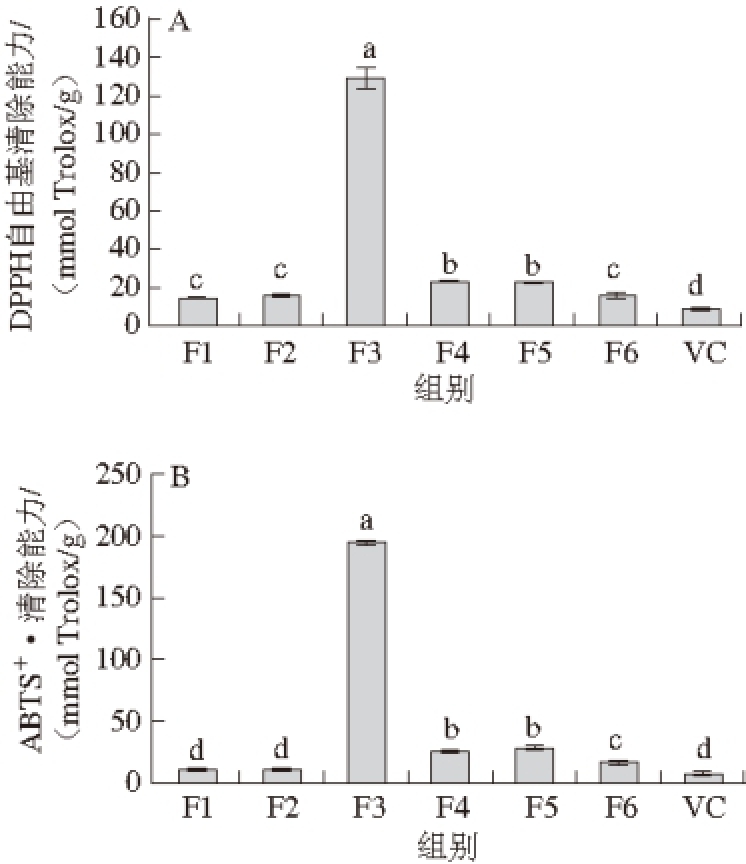
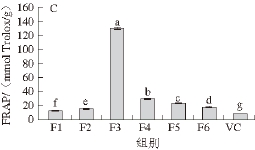
图2 桑椹提取物不同组分及抗坏血酸(VC)的DPPH自由基清除能力(A)、ABTSABTS
+·清除能力(B)和FRAP(C)APC
Fig. 2 DPPH radical scavenging activity (A), ABTS
+radical scavenging capacity (B) and ferric reducing power (C) of ascorbic acid (VC) and different fractions extracted from mulberry fruits
由图2可知,F3的自由基清除能力和FRAP显著强于其他组分及抗坏血酸(P<0.05),DPPH自由基清除能力、ABTS +·清除能力、FRAP分别为(129.33±5.58)、(194.33±2.48)、(130.44±1.38) mmol Trolox/g。而F1和F2的抗氧化能力相较其他组分最弱,其FRAP值低于20 mmol Trolox/g。总体来看,桑椹提取物各组分均表现出了一定的抗氧化能力,其抗氧化能力显著强于VC(P<0.05)。Yu Yuanshan等 [29]报道每升桑椹果汁的清除自由基能 力相当于(105.9±2.6) mmol Trolox/L;Sanchez-Salcedo等 [31]对比了不同桑椹品种的抗氧化能力,研究表明干燥桑椹的DPPH自由基、ABTS +·清除能力分别为(3.62~12.91) mg Trolox/g和(3.84~20.73) mg Trolox/g,桑椹中丰富的酚类化合物是主要的抗氧化活性成分。
2.4 桑椹提取物各组分的抗糖基化能力
多种AGEs均具有荧光性,其最大激发波长约为370 nm,最大发射波长在445 nm左右,通过测量样品的荧光强度,即可评价样品中非酶糖基化生成AGEs的总体水平 [32]。经过6 d的孵育,相对于BSA单独孵育组与BSA、桑椹提取物共孵育组,各实验组和空白组的荧光强度显著增加(P<0.05),表明实验组与空白组中的BSA已通过非酶糖基化生成荧光性的AGEs。
由图3可知,在BSA-果糖模拟反应体系中,F4、F5、F6的糖基化抑制率均显著高于阳性对照组(P<0.05)。其中,F5的抗糖基化能力最强,达(87.23±0.36)%,显著高于阳性对照组((65.49±0.70)%)和其他组分(P<0.05)。各组分中,F1和F2的抗糖基化能力最弱,分别为(23.39±2.18)%和(28.07±1.74) %。
在BSA-MGO模拟反应体系中,F5的糖基化抑制率显著高于其他组分(P<0.05),达(66.99±1.62)%,与阳性对照组((65.34±2.57)%)的抗糖基化能力相当,而F1和F2的抗糖基化能力最弱,分别达(13.26±3.56)%和(15.64±2.03)%。BSA-MGO模拟反应体系中,阳性对照组的糖基化抑制率显著高于除F5以外的各组分(P<0.05),并与F5相当,这可能是由于AG主要作用于Amadori重排产物和羰基化合物等非酶糖基化中间产物的原因 [33]。
桑椹提取物中富含花色苷等酚类物质,由于各组分中的酚类化合物含量和种类各异,其抗糖基化能力也不同。总体来看,桑椹提取物各组分对非酶糖基化均产生了不同程度的抑制作用。各组分在BSA-果糖模拟反应体系中的糖基化抑制率高于在BSA-MGO模拟反应体系中的糖基化抑制率,这说明桑椹中的酚类物质对蛋白糖基化的抑制不仅作用于非酶糖基化反应的中期,在非酶糖基化的各个阶段可能均发挥着一定的作用。
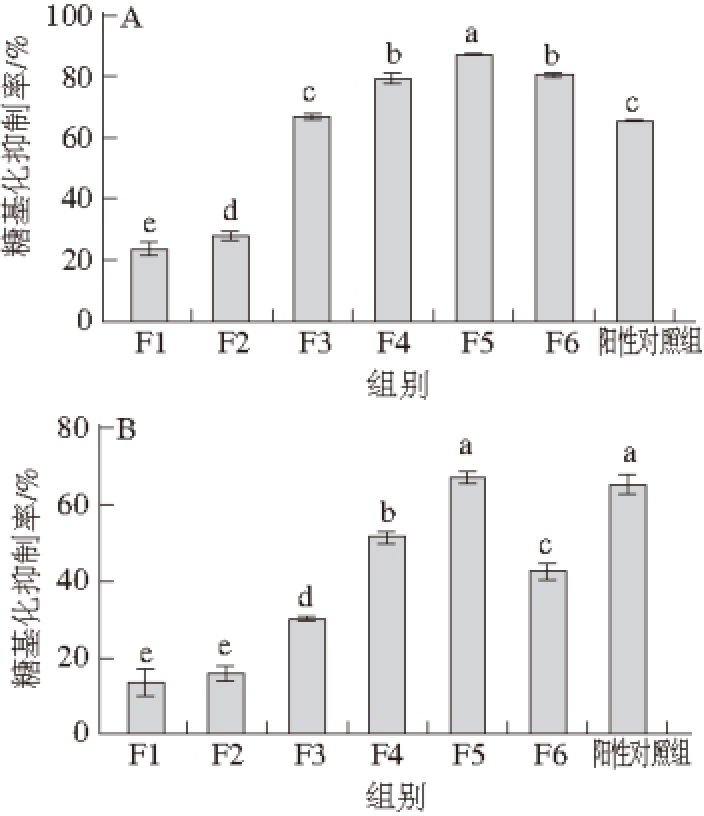
图3 桑椹提取物不同组分及阳性对照组AG在BSA-果糖(A)和BSA-MGO模拟反应体系(B)下的糖基化抑制率
Fig. 3 Glycation inhibition rates of aminoguanidine (AG) and different fractions extracted from mulberry fruits in BSA-fructose model (A) and BSA-MGO model (B)
2.5 不同组分中酚类化合物的成分与其抗氧化、抗糖基化能力的回归分析
根据以上分析结果发现桑椹提取物的各组分均表现出了一定的抗氧化与抗糖基化能力,F3和F5分别为抗氧化能力与抗糖基化能力最强的组分。与此同时,F3的总花色苷含量相对最高,而F5的总酚含量最高。为了分析桑椹提取物中各类成分与其功能活性的关系,以各组分中总花色苷含量、总酚含量为预测变量,以各组分的抗氧化和抗糖基化能力为响应变量,进行一元线性回归分析,并比较各组变量的回归系数(表2)。结果发现,桑椹提取物的总花色苷含量与DPPH自由基清除能力、ABTS +·清除能力、FRAP的回归系数均超过0.8,回归关系显著(P<0.05)。而总酚含量与抗氧化能力之间回归关系不显著。与此相反,总花色苷含量与抗糖基化能力的回归关系不显著,而各组分的总酚含量与其抗糖基化能力表现出显著的回归关系(P<0.05)。
将由HPLC鉴定出的酚类化合物分酚酸(原儿茶酸、对羟基苯甲酸、咖啡酸、对香豆酸、邻香豆酸)、花色苷(CG、CR)和黄酮(槲皮素、芦丁)3类,其含量为鉴定出的所有该类物质总和,“未检出”记为零。以各类物质含量为预测变量,以各组分的抗氧化和抗糖基化能力为响应变量,分别进行回归分析,其结果见表2。
表2 桑椹提取物成分和其抗氧化能力、抗糖基化能力的回归系数
Table 2 Regression coefficients between total phenolic and total anthocyanin contents of fractions and their antioxidant and antiglycation activities
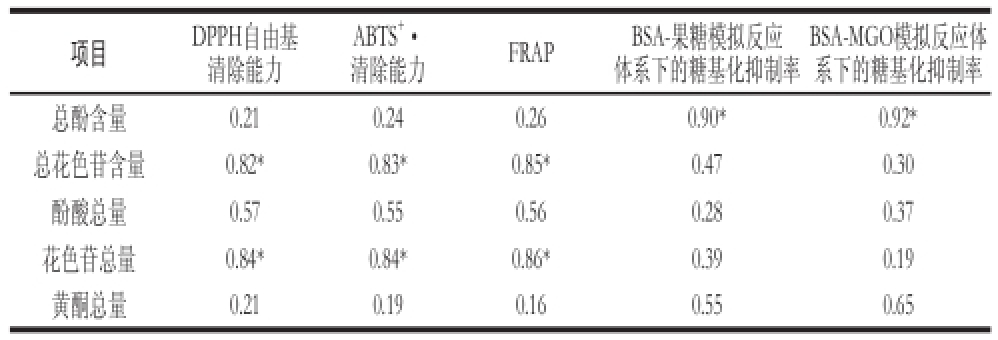
注:*. P<0.05(F检验)。
BSA-MGO模拟反应体系下的糖基化抑制率总酚含量0.210.240.260.90*0.92*总花色苷含量0.82*0.83*0.85*0.470.30酚酸总量0.570.550.560.280.37花色苷总量0.84*0.84*0.86*0.390.19黄酮总量0.210.190.160.550.65项目DPPH自由基清除能力ABTS +·清除能力FRAPBSA-果糖模拟反应体系下的糖基化抑制率
由表2可知,HPLC测得的各组分花色苷总量与其抗氧化能力的回归系数均达到显著差异(P<0.05),而与抗糖基化能力的回归系数不显著。黄酮总量与样品抗糖基化能力的回归系数相对较高,而酚酸总量与 样品氧化能力的回归系数相对较高。
根据回归分析,pH示差法测得的总花色苷含量、HPLC测得的花色苷总量均与抗氧化活性呈现显著的回归关系,表明花色苷是桑椹提取物中主要的抗氧化物质。Oki等 [28]通过在线HPLC-DPPH检测法已确定花色苷是成熟桑椹中最主要的抗氧化物质,此结论与本研究结果相一致。
对于桑椹提取物中的花色苷含量与抗糖基化能力关系的报道较少。之前的研究表明花色苷具有一定的抗糖基化能力 [14],但本研究实验结果表明花色苷并不是最主要的抗糖基化物质。Wang Wei等 [25]利用Sephadex LH-20 凝胶层析柱将蓝莓提取物分离为5 个组分,结果显示各组分中,抗糖基化能力与总酚含量呈现相关性,而花色苷含量最高的组分抗糖基化能力却相对较低。可以推测,除了花色苷,其他种类的酚类物质在桑椹的抗糖基化能力方面可能也起着重要的作用。
非酶糖基化过程常伴随着自由基的产生,这些自由基能够直接参与糖分子裂解、蛋白质构象改变以及Amadori重排产物的氧化等反应过程,促进AGEs的生成,加剧机体的氧化应激状态 [1]。因此,桑椹提取物各组分的抗氧化性质能够在一定程度上解释其抗糖基化能力。然而,抗氧化作用并非天然酚类化合物发挥其抗糖基化能力的唯一原因,Jariyapamornkoon等 [15]的研究表明,富含酚类化合物的红葡萄皮提取物除具有抗氧化能力外,还具有螯合金属离子、降低蛋白质的羰基修饰水平、阻止蛋白质中硫醇基团的减少、抑制Amadori重排产物果糖胺的生成等作用,并可能通过以上机理抑制了AGEs的生成。因此,桑椹中的酚类化合物可能同时通过其他多种机制抑制蛋白质的非酶糖基化。
通过凝胶层析分离桑椹提取物得到的6 个组分中,F3的总花色苷含量显著高于其他组分(P<0.05),F5的总酚含量显著较高(P<0.05),而F1、F2的总花色苷、总酚含量均最低。利用HPLC分析各组分中的酚类化合物,共检测到5 种酚酸、两种花色苷和两种黄酮,不同组分中所含的酚类化合物在成分和含量上具有一定差异,但各组分均表现出了不同程度的抗氧化与抗糖基化效果,其中F3、F5分别在抗氧化能力和抗糖基化能力上显著高于其他组分(P<0.05)。由回归分析得出,pH示差法测得的总花色苷含量以及HPLC测得的花色苷总量均与抗氧化能力呈现显著的回归关系(P<0.05),但与抗糖基化能力的回归关系并不显著,各组分中的总酚含量与抗糖基化能力呈现显著的回归关系(P<0.05),但与抗氧化能力的回归关系不显著。由回归分析可知,花色苷是桑椹提取物中主要的抗氧化物质,而总酚含量决定了桑椹提取物各组分抗糖基化能力的高低。
参考文献:
[1] POULSEN M W, HEDEGAARD R V, ANDERSEN J M, et al. Advanced glycation endproducts in food and their effects on health[J]. Food and Chemical Toxicology, 2013, 60(10): 10-37. DOI:10.1016/ j.fct.2013.06.052.
[2] GAENS K H, STEHOUWER C D, SCHALKWIJK C. The N ε-(carboxymethyl) lysine-RAGE axis: putative implications for the pathogenesis of obesity-related complications[J]. Expert Review of Endocrinology and Metabolism, 2014, 5(5): 839-854. DOI:10.1586/ eem.10.68.
[3] BROWNLEE M. Advanced protein glycosylation in diabetes and aging[J]. Annual Review of Medicine, 1995, 46(1): 223-234. DOI:10.1146/ annurev.med.46.1.223.
[4] CHEYNIER V. Phenolic compounds: from plants to foods[J]. Phytochemistry Reviews, 2012, 11(2/3): 153-177. DOI:10.1007/s11101-012-9242-8.
[5] GUO H, LING W, WANG Q, et al. Cyanidin 3-glucoside protects 3T3-L1 adipocytes against H 2O 2or TNF-α-induced insulin resistance by inhibiting c-Jun NH 2-terminal kinase activation[J]. Biochemical Pharmacology, 2008, 75(6): 1393-1401. DOI:10.1016/j.bcp.2007.11.016.
[6] HUANG S M, HSU C L, CHUANG H C, et al. Inhibitory effect of vanillic acid on methylglyoxal-mediated glycation in apoptotic Neuro-2A cells[J]. Neurotoxicology, 2008, 29(6): 1016-1022. DOI:10.1016/ j.neuro.2008.07.002.
[7] HSU C L, WU C H, HUANG S L, et al. Phenolic compounds rutin and o-coumaric acid ameliorate obesity induced by high-fat diet in rats[J]. Journal of Agricultural and Food Chemistry, 2009, 57(2): 425-431. DOI:10.1021/jf802715t.
[8] LEE S H, KANG S M, KO S C, et al. Octaphlorethol A, a novel phenolic compound isolated from Ishige foliacea, protects against streptozotocin-induced pancreatic β cell damage by reducing oxidative stress and apoptosis[J]. Food and Chemical Toxicology, 2013, 59(1): 643-649. DOI:10.1016/j.fct.2013.07.011.
[9] WU C H, YEH C T, YEN G C. Epigallocatechin gallate (EGCG) binds to low-density lipoproteins (LDL) and protects them from oxidation and glycation under high-glucose conditions mimicking diabetes[J]. Food Chemistry, 2010, 121(3): 639-644. DOI:10.1016/j.foodchem.2010.02.008.
[10] VAZQUEZ-PRIETO M A, BETTAIEB A, HAJ F G, et al. (−)-Epicatechin prevents TNF-α-induced activation of signaling cascades involved in infl ammation and insulin sensitivity in 3T3-L1 adipocytes[J]. Archives of Biochemistry and Biophysics, 2012, 527(2): 113-118. DOI:10.1016/j.abb.2012.02.019.
[11] SCALBERT A, MANACH C, MORAND C, et al. Dietary polyphenols and the prevention of diseases[J]. Critical Reviews in Food Science and Nutrition, 2005, 45(4): 287-306. DOI:10.1080/1040869059096.
[12] SHOJI T, AKAZOME Y, KANDA T, et al. The toxicology and safety of apple polyphenol extract[J]. Food and Chemical Toxicology, 2004, 42(6): 959-967. DOI:10.1016/j.fct.2004.02.008.
[13] LV L, SHAO X, WANG L, et al. Stilbene glucoside from Polygonum multifl orum Thunb.: a novel natural inhibitor of advanced glycation end product formation by trapping of methylglyoxal[J]. Journal of Agricultural and Food Chemistry, 2010, 58(4): 2239-2245. DOI:10.1021/jf904122q.
[14] CHEN X Y, HUANG I M, HWANG L S, et al. Anthocyanins in blackcurrant effectively prevent the formation of advanced glycation end products by trapping methylglyoxal[J]. Journal of Functional Foods, 2014, 8(3): 259-268. DOI:10.1016/j.jff.2014.03.025.
[15] JARIYAPAMORNKOON N, YIBCHOK-ANUN S, ADISAKWATTANA S. Inhibition of advanced glycation end products by red grape skin extract and its antioxidant activity[J]. BMC Complementary and Alternative Medicine, 2013, 13(1): 1-9. DOI:10.1186/1472-6882-13-171.
[16] DONNO D, CERUTTI A K, PRGOMET I, et al. Foodomics for mulberry fruit (Morus spp.): analytical fi ngerprint as antioxidants’ and health properties’ determination tool[J]. Food Research International, 2015, 69(1): 179-188. DOI:10.1016/j.foodres.2014.12.020.
[17] JIANG Y, NIE W J. Chemical properties in fruits of mulberry species from the Xinjiang province of China[J]. Food Chemistry, 2015, 174(1): 460-466. DOI:10.1016/j.foodchem.2014.11.083.
[18] STEFAUNT M N, ADINA C, RALUCA P, et al. Anti-hyperglycemic effect of bilberry, blackberry and mulberry ultrasonic extracts on diabetic rats[J]. Plant Foods for Human Nutrition, 2013, 68(4): 378-384. DOI:10.1007/s11130-013-0380-y.
[19] YANG X, LEI Y, ZHENG H. Hypolipidemic and antioxidant effects of mulberry (Morus alba L.) fruit in hyperlipidaemia rats[J]. Food and Chemical Toxicology, 2010, 48(8/9): 2374-2379. DOI:10.1016/ j.fct.2010.05.074.
[20] SHIH P H, CHAN Y C, LIAO J W, et al. Antioxidant and cognitive promotion effects of anthocyanin-rich mulberry (Morus atropurpurea L.) on senescence-accelerated mice and prevention of Alzheimer’s disease[J]. The Journal of Nutritional Biochemistry, 2010, 21(7): 598-605. DOI:10.1016/j.jnutbio.2009.03.008.
[21] HARRIS C S, ALAIN C, ERIN L, et al. Investigating wild berries as a dietary approach to reducing the formation of advanced glycation endproducts: chemical correlates of in vitro antiglycation activity[J]. Plant Foods for Human Nutrition, 2014, 69(1): 71-77. DOI:10.1007/s11130-014-0403-3.
[22] GARZON G A, WROLSTAD R E. Major anthocyanins and antioxidant activity of Nasturtium flowers (Tropaeolum majus)[J]. Food Chemistry, 2009, 114(1): 44-49. DOI:10.1016/j.foodchem.2008.09.013.
[23] ARTS M J T J, DALLINGA J S, VOSS H P, et al. A new approachto assess the total antioxidant capacity using the TEAC assay[J]. Food Chemistry, 2004, 88(4): 567-570. DOI:10.1016/j.foodchem.2004.02.008.
[24] WONG C C, LI H B, CHENG K W, et al. A systematic survey of antioxidant activity of 30 Chinese medicinal plants using the ferric reducing antioxidant power assay[J]. Food Chemistry, 2006, 97(4): 705-711. DOI:10.1016/j.foodchem.2005.05.049.
[25] WANG W, YAGIZ Y, BURAN T J, et al. Phytochemicals from berries and grapes inhibited the formation of advanced glycation end-products by scavenging reactive carbonyls[J]. Food Research International, 2011, 44(9): 2666-2673. DOI:10.1016/j.foodres.2011.05.022.
[26] KRENEK K, MARHOL P, PEIKEROVA Ž, et al. Preparatory separation of the silymarin flavonolignans by Sephadex LH-20 gel[J]. Food Research International, 2014, 65(1): 115-120. DOI:10.1016/ j.foodres.2014.02.001.
[27] BAE S H, SUH H J. Antioxidant activities of five different mulberry cultivars in Korea[J]. LWT-Food Science and Technology, 2007, 40(6): 955-962. DOI:10.1016/j.lwt.2006.06.007.
[28] OKI T, KOBAYASHI M, NAKAMURA T, et al. Changes in radical-scavenging activity and components of mulberry fruit during maturation[J]. Journal of Food Science, 2006, 71(1): C18-C22. DOI:10.1111/j.1365-2621.2006.tb12382.x.
[29] YU Y S, XU Y J, WU J J, et al. Effect of ultra-high pressure homogenisation processing on phenolic compounds, antioxidant capacity and anti-glucosidase of mulberry juice[J]. Food Chemistry, 2014, 153(12): 114-120. DOI:10.1016/j.foodchem.2013.12.038.
[30] KALLEL F, DRISS D, CHARRI F, et al. Garlic (Allium sativum L.) husk waste as a potential source of phenolic compounds: infl uence of extracting solvents on its antimicrobial and antioxidant properties[J]. Industrial Crops and Products, 2014, 62(1): 34-41. DOI:10.1007/ s000270050066.
[31] SANCHEZ-SALCEDO E M, MENA P, GARCIA-VIGUERA C, et al. Phytochemical evaluation of white (Morus alba L.) and black (Morus nigra L.) mulberry fruits, a starting point for the assessment of their beneficial properties[J]. Journal of Functional Foods, 2015, 12(1): 399-408. DOI:10.1016/j.jff.2014.12.010.
[32] MAZA M P D L, GARRIDO F, ESCALANTE N, et al. Fluorescent advanced glycation end-products (ages) detected by spectrophotofluorimetry, as a screening tool to detect diabetic microvascular complications[J]. Journal of Diabetes Mellitus, 2012, 2(2): 221-226. DOI:10.4236/jdm.2012.22035.
[33] AHEMD N. Advanced glycation endproducts: role in pathology of diabetic complications[J]. Diabetes Research and Clinical Practice, 2005, 67(1): 3-21. DOI:10.1016/j.diabres.2004.09.004.
Antioxidant and Antiglycation Activities of Phenolic Compounds Extracted from Mulberry Fruits
FAN Zhiyi, LI Xiaolin, LI Juxiu*
(College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China)
Abstract:The present study aims at evaluating the antioxidant and antiglycation activities of mulberry extracts rich in phenolics and the relationships between phenolic components and their activities. Mulberry fruit (Morus atropurpurea Roxb.) extract was separated by Sephadex LH-20 gel fi ltration column chromatography into six fractions (F1, F2, F3, F4, F5 and F6). Total phenolics and total anthocyanins of different fractions and their main phenolic components were quantified by Folin-Ciocalteu method, pH differential method and hi gh performance liquid chromatography (HPLC). DPPH and ABTS +radical scavenging and ferric reducing assays were conducted to evaluate the antioxidant abilities of fractions. Bovine serum albumin (BSA)-fructose and BSA-methyglyoxal (MGO) models were applied for the measurement of antiglycation capacity. The results indicated that the extracts contained mainly five phenolic acids (gallic acid, hydroxybenzoic acid, caffeic acid, p-coumaric acid and o-coumaric acid), two anthocyanins (cyanidin-3-glucoside and cyanidin-3-rutinoside) and two flavonoids (rutin and quercetin). Fraction F3 contained the highest amount of anthocyanin ((101.10 ± 2.39) mg cyanidin-3-glucoside/g m d, P < 0.05) and F5 was the richest in total phenolic compounds ((188.05 ± 2.01) mg gallic acid equivalent/g m d, P < 0.05). F3 had the highest antioxidant capacity among fractions (P < 0.05, which showed DPPH and ABTS +radical scavenging activity of (129.33 ± 5.58) and (194.33 ± 2.48) mmol/g and ferric reducing power of (130.44 ± 1.38) mmol/g, respectively) while the antiglycation capacity of F5 was the highest (P < 0.05), with percentage inhibition of (87.23 ± 0.36)% and (66.99 ± 1.62)% in BSA-fructose and BSA-MGO model, respectively. The linear regression analysis showed that the antioxidant capacity of the extracts was due mostly to anthocyanins and their antiglycation activity was attributed to total phenolic compounds.
Key words:mulberry; phenolic compound; antioxidant; antiglycation
收稿日期:2016-01-08
基金项目:国家自然科学基金面上项目(31471579)
作者简介:范智义(1992—),男,硕士研究生,研究方向为食品化学与营养。E-mail:fanzhiyialex@163.com
*通信作者:李巨秀(1972—),女,副教授,博士,研究方向为食品化学和营养。E-mail:juxiuli@msn.com
DOI:10.7506/spkx1002-6630-201617004
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2016)17-0019-08
DOI:10.7506/spkx1002-6630-201617004. http://www.spkx.net.cn
引文格式: