李 彦 1,李 鑫 1,刘景玲 1,张辰露 1,梁宗锁 1,2,*
(1.西北农林科技大学生命科学学院,陕西 杨凌 712100;2.浙江理工大学生命科学学院,浙江 杭州 310018)
摘 要:采用大孔吸附树脂对鸡血藤原花青素进行纯化,并对原花青素纯度、1,1-二苯基-2-三硝基苯肼(1,1-diph enyl-2-picrylhydrazyl,DPPH)自由基清除活性及α-葡萄糖苷酶抑制活性进行评价。比较3 种大孔吸附树脂对原花青素静态吸附及解吸附能力,从D101、X-5及AB-8树脂筛选出X-5型树脂用于纯化。对X-5型树脂的动态吸附及解吸附条件进行优化,获得最适条件为:上样质量浓度6.00 mg/mL,上样流速2 BV/h,上样量10 BV,洗脱流速1 BV/h,洗脱剂用量2 BV。利用不同体积分数乙醇洗脱可得到不同纯度的原花青素,其中70%乙醇纯化物原花青素纯度最高,具有最强的DPPH自由基清除活性及α-葡萄糖苷酶抑制活性。相关性分析表明原花青素可能是鸡血藤抗氧化及抑制α-葡萄糖苷酶的主要活性成分。
关键词:鸡血藤;原花青素;大孔吸附树脂纯化;1,1-二苯基-2-三硝基苯肼自由基清除活性;α-葡萄糖苷酶抑制活性
李彦, 李鑫, 刘景玲, 等. 鸡血藤原花青素的纯化及活性评价[J]. 食品科学, 2016, 37(17): 45-51. DOI:10.7506/spkx1002-6630-201617008. http://www.spkx.net.cn
LI Yan, LI Xin, LIU Jingling, et al. Purifi cation and bioactivity evaluation of proanthocyanidins from Spatholobi Caulis[J]. Food Science, 2016, 37(17): 45-51. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201617008. http://www.spkx.net.cn
原花青素(proanthocyanidins,OPC),又名缩合鞣质,为黄烷-3-醇单体经缩合而成的一类植物多酚,广泛存在于植物中 [1-2]。药理和临床研究表明,原花青素具有抗氧化 [3]、抗肿瘤 [4]、保护心脑血管 [5]、预防老年痴呆及帕金森病 [6]等作用,作为纯天然的植物提取物,原花青素具有活性好、安全性高、来源广泛、毒性低等特点,在药品、保健品、功能食品及化妆品行业具有重要的用途 [7]。
鸡血藤(Spatholobi Caulis)为豆科植物密花豆(Spayholobus suberectu)的干燥茎藤,为常用的补血活血中药 [8]。现代药理研究表明,鸡血藤具有抑制肿瘤细胞增殖 [9]、抗血小板聚集 [10]、双向调节酪氨酸酶 [11]、抗炎 [12]、抗氧化 [13]、抑制破骨细胞分化 [14]、抗病毒 [15]等作用。研究表明,鸡血藤含有大量原花青素,鸡血藤60%乙醇提取物中原花青素含量可超过50% [16];鸡血藤树脂状分泌物、木质部及韧皮部均含有原花青素,且树脂状分泌物中含量最高 [17]。鸡血藤原花青素主要由儿茶素和表儿茶素,以及少量的棓儿茶素和表棓儿茶素缩合而成,以B型原花青素为主,聚合度为3~11,平均聚合度约为5.2 [9],利用带二极管阵列检测器的液相色谱与多级质谱(liquid chromatography with diode-array detection mass spectrometry method,LC-DAD-MS n)联用技术从鸡血藤提取物中检出了原花青素B 1、原花青素B 2及原花青素C 1的存在 [18]。
鸡血藤粗提取物中含有大量蛋白质、糖类、脂类、色素等杂质,为制备高纯度鸡血藤原花青素,需要对其进行纯化,但有关鸡血藤原花青素纯化的研究却鲜见报道。目前,用于原花青素纯化的方法有大孔吸附树脂纯化法、凝胶层析法、液相萃取法、高速逆流色谱法、固相萃取法、铅盐沉淀法、膜过滤法等,其中,大孔吸附树脂纯化法作为20世纪60年代以来发展十分迅速的纯化手段,具有工艺简单、纯化效率高、生产成本低廉等优点而被广泛运用于原花青素的纯化 [19-24]。
本研究采用大孔吸附树脂法纯化鸡血藤原花青素,对树脂类型、吸附及解吸附条件进行考察,并对纯化前后鸡血藤原花青素的纯度、抗氧化活性及α-葡萄糖苷酶抑制活性进行测定,以评价树脂的纯化效果,为经济高效地制备高纯度、高活性的鸡血藤原花青素提供参考,促进鸡血藤原花青素的开发利用。
1.1 材料与试剂
鸡血藤采自广西贺州,切片晒干后粉碎,过60 目筛,于-20 ℃保存备用。
D101、X-5及AB-8型大孔吸附树脂 安徽三星树脂科技有限公司;葡萄籽原花青素分析标准品(纯度≥95%) 上海源叶生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-p icrylhydrazyl,DPPH)、α-葡萄糖苷酶(来源于酿酒酵母)、对硝基苯-α-D-吡喃葡萄糖苷(p-nitrophenyl α-D-glucopyranoside,PNPG)、阿卡波糖、L-抗坏血酸、香兰素 美国Sigma-Aldrich公司;其余化学试剂为国产分析纯,水为去离子水。
1.2 仪器与设备
UV-1700紫外-可见分光光度计 日本株式会社岛津制作所;SpectraMax M2多功能读板机 美国Molecular Devices公司;SB25-12DTD超声波清洗机 宁波新芝生物科技股份有限公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;SHB-III循环水式多用真空泵 郑州长城科工贸有限公司。
1.3 方法
1.3.1 鸡血藤粗提取物制备
取鸡血藤粗粉,按照1∶20(m/V)的料液比加入80%的乙醇,充分浸泡,于40 kHz条件下超声波提取3 次,每次30 min,减压过滤,合并3 次滤液,滤液减压浓缩,冻干,得到鸡血藤粗提取物。
1.3.2 原花青素定量分析
利用改良的香草醛-盐酸比色法 [25]对原花青素进行定量分析。分别配制1 g/100 mL 的香草醛-甲醇溶液及1 mol/L的盐酸-甲醇溶液,临用时将二者按体积比1∶1充分混匀,即制得比色工作液。称取葡萄籽原花青素分析标准品,以甲醇溶解,配制成质量浓度为0.0、0.3、0.6、0.9、1.2、1.5、1.8 mg/mL的标准溶液,然后分别取100 μL上述标准溶液,加入3 mL的比色工作液,混匀,室温条件下反应30 min,以甲醇调零,测定500 nm波长处的吸光度(A 500 nm)值,绘制A 500 nm(Y)与葡萄籽原花青素标准品质量浓度(X)的标准曲线,得到回归方程:Y = 0.324X-0.002 9(R 2= 0.999 4),各样品以同法测定,含量由回归方程计算。
1.3.3 大孔吸附树脂筛选
利用静态吸附及解吸附,从D101、X-5、AB-8型树脂中筛选出最适宜的树脂,用于鸡血 藤原花青素的纯化。
参照杨志娟等 [23]的方法对树脂进行预处理,称取2.00 g经预处理好的3 种树脂,置于250 mL三角瓶中,分别加入100 mL原花青素质量浓度为6.00 mg/mL的鸡血藤粗提取物,使体系中原花青素相对于树脂是过量的,密封后置于恒温摇床中,25 ℃、60 r/min条件下振摇24 h,以确保树脂吸附饱和,过滤并测定吸附后溶液中原花青素质量浓度,按照式(1)计算树脂对原花青素的吸附量。
式中:ρ 0为吸附后溶液的原花青素质量浓度/(mg/mL);6.00为吸附前溶液的原花青素质量浓度/(mg/mL);100为体系中溶液的体积/mL;2.00为树脂的质量/g。
称取1.00 g吸附饱和的3 种树脂,置于250 mL三角瓶中,分别加入100 mL的70%乙醇溶液,充分振摇以使原花青素解吸附,过滤并测定解吸附后溶液的原花青素质量浓度,按式(2)计算树脂对原花青素的解吸附量。
式中:ρ 1为解吸附后滤液中原花青素的质量浓度/(mg/mL);100为溶液体积/mL;1.00为树脂质量/g。
树脂的解吸附率的计算见式(3)。
1.3.4 上样流速及上样量考察
将预处理好的树脂4 份,湿法装柱,以去离子水充分平衡,然后将原花青素质量浓度为6.00 mg/mL的粗提取物以1、2、3、4 BV/h的流速分别上样吸附,每0.5 BV流出液收集为1 份,测定流出液原花青素质量浓度,绘制泄漏曲线,当流出液质量浓度达到上样质量浓度的1/10时,认为已达到树脂穿透点,不宜再上样,以此确定上样流速及上样量。
1.3.5 洗脱流速及洗脱剂用量考察
参照动态吸附的最优条件,制备4 份吸附饱和的树脂柱,充分平衡,以去离子水充分洗去杂质,用70%乙醇溶液以0.5、1.0、1.5、2.0 BV/h的流速分别洗脱,每0.1 BV流出液收集为1 份,测定流出液原花青素质量浓度,绘制洗脱曲线,根据洗脱曲线确定洗脱流速及洗脱剂用量。
1.3.6 洗脱剂体积分数考察
制备吸附饱和的层析柱,充分平衡,以去离子水充分洗去杂质,参照静态解吸附的结果,选取10%、30%、50%、70%、90%乙醇溶液,按照1 BV/h的流速依次对树脂进行充分洗脱,分别收集每份洗脱液,考察洗脱剂体积分数对原花青素洗脱能力的影响。
1.3.7 鸡血藤原花青素纯化
取4 份经预处理的X-5树脂,装柱,平衡,将原花青素质量浓度为6.00 mg/mL的鸡血藤粗提取物水溶液以2 BV/h的流速上样10 BV,待充分吸附后,以去离子水洗去杂质,分别用30%、50%、70%、90%的乙醇以1 BV/h流速洗脱,收集洗脱液,减压浓缩,冻干,分别得到鸡血藤原花青素的30%、50%、70%、90%乙醇纯化物。
1.3.8 DPPH自由基清除活性测定
DPPH自由基以甲醇溶解,配成100 μmol/L工作液。鸡血藤粗提取物及4 种纯化物以甲醇溶解,配制成0、30、60、90、120、150、180 μg/mL的溶液。分别取100 μL上述溶液,加入3 mL工作液,混匀,室温条件下避光反应30 min,以甲醇调零,测定517 nm波长处的吸光度(A 517 nm) [26],按式(4)计算DPPH自由基清除率。
式中:A 0为空白样品(0 μg/mL)与工作液反应后的A 517 nm值;A i为各样品与工作液反应后的A 517 nm值。
以L-抗坏血酸作阳性对照,按照前述方法测定DPPH自由基清除率,各样品及L-抗坏血酸清除DPPH自由基能力以对DPPH自由基的半数抑制浓度(half maximal inhibitory concentration,IC 50)表示。
1.3.9 α-葡萄糖苷酶抑制活性测定
α-葡萄糖苷酶用100 mmol/L的NaH 2PO 4-Na 2HPO 4缓冲液(pH 6.86)溶解,配制成120 U/L的酶液,底物PNPG用缓冲液溶解,配制成600 μmol/L的溶液,鸡血藤粗提取物及4 种纯化物用10%二甲基亚砜(dimethyl sulfoxide,DMSO)溶解,配制成10 mg/mL的母液,然后以缓冲液稀释成质量浓度为0、2、4、6、8、10、12、16 μg/mL的溶液。向96 孔酶标板中依次加入50 μL缓冲液,50 μL酶液以及50 μL各质量浓度的样品溶液,混匀,37 ℃孵育15 min,迅速加入50 μL底物溶液,立即用SpectraMax M2多功能读板机记录15 min内各孔A 405 nm的增量 [27],按式(5)计算α-葡萄糖苷酶的抑制率。
式中:ΔA 0为空白样品(0 μg/mL)A 405 nm的增量;ΔA i为各样品A 405 nm的增量。
各样品的抑制活性以对α-葡萄糖苷酶的IC 50表示。以阿卡波糖作阳性对照,阿卡波糖质量浓度分别为0、50、100、200、400、800、1 600、3 200 μg/mL。
1.3.10 鸡血藤原花青素纯度与其活性的相关性
以各样品原花青素纯度为x,对DPPH自由基的IC 50及对α-葡萄糖苷酶的IC 50为y,对样品原花青素纯度与清除自由基活性进行相关性分析,以相关系数r进行评价。
1.4 统计分析
所有指标平行测定3 次,结果以±s表示,采用SPSS 22.0软件对数据进行单因素方差分析(analysis of variance,ANOVA),P<0.05时认为具有显著性差异。
2.1 大孔吸附树脂的筛选
利用大孔吸附树脂法纯化原花青素,具有纯化效率高、操作简便、节约生产成本等优点,且大孔树脂和洗脱剂可重复利用,因而被广泛用于原花青素的纯化。不同类型的树脂具有不同的极性、孔径、比表面积,对原花青素的吸附和解吸附能力各不相同,一般情况下,弱极性和非极性的树脂对原花青素的吸附和解吸附能力大于中等极性及大极性树脂 [19-20]。本实验选择1 种非极性和2 种弱极性树脂,利用静态吸附和解吸附实验考察它们对鸡血藤原花青素的吸附、解吸附能力,结果如表1所示。
表1 不同大孔吸附树脂对原花青素的吸附及解吸附能力
Table 1 Adsorption and desorption capacity of different macroporous adsorption resins for proanthocyanidins
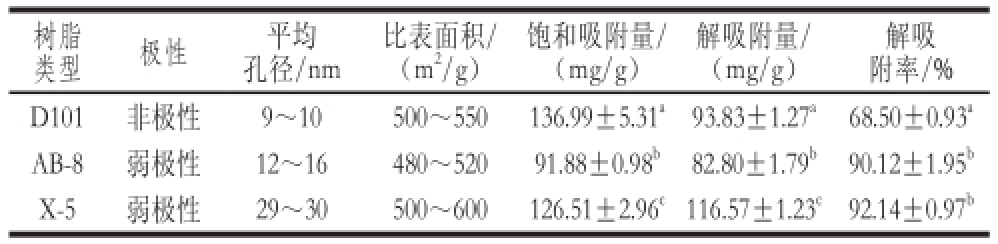
注:同列肩标小写字母不同表示差异显著(P<0.05)。
解吸附率/% D101非极性 9~10500~550136.99±5.31 a93.83±1.27 a68.50±0.93 aAB-8弱极性12~16480~52091.88±0.98 b82.80±1.79 b90.12±1.95 bX-5弱极性29~30500~600126.51±2.96 c116.57±1.23 c92.14±0.97 b树脂类型极性平均孔径/nm比表面积/(m 2/g)饱和吸附量/(mg/g)解吸附量/(mg/g)
杨志娟等 [23]研究表明AB-8树脂对火龙果原花青素的吸附量为31.4 mg/g,解吸附率可达70.06%,均高于DM130及ADS-17;范明霞等 [19]认为AB-8树脂对葡萄籽原花青素的纯化效果好于D101及LSA-10树脂,且其对葡萄籽原花青素的吸附率及解吸附率分别为95.78%及82.11%,纯化后的原花青素纯度高达87.11%;周玮婧等 [24]利用AB-8树脂对荔枝皮原花青素进行纯化,获得纯度为87.45%的原花青素。本实验条件下,3 种树脂对鸡血藤原花青素均具有较强的吸附能力,D101、X-5树脂的吸附能力强于AB-8树脂,X-5、AB-8树脂的解吸 附能力则强于D101树脂,因此,综合考虑吸附及解吸附能力选择X-5树脂用于鸡血 藤原花青素的纯化。
2.2 上样流速及上样量对X-5树脂纯化鸡血藤原花青素的影响
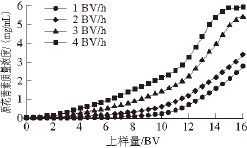
图1 上样流速 对树脂动态吸附的影响
Fig. 1 Effect of sample loading flow rate on dynamic adsorption of proanthocyanidins
不同上样流速时X-5树脂的泄漏曲线如图1所示,当上样质量浓度为6.00 mg/mL时,上样流速越大,树脂吸附能力越差,穿透点出现越早,因此,上样流速不宜过大。而当上样流速为1 BV/h时,虽然吸附量略大于2 BV/h,但流速太慢,耗时长,影响生产效率。综合考虑,认为以2 BV/h的流速上样10 BV较为适宜。
2.3 洗脱流速及洗脱剂用量对X-5树脂纯化鸡血藤原花青素的影响
不同洗脱流速对X-5树脂的洗脱曲线如图2所示,以峰面积 代表洗脱量,可知当以70%乙醇溶液洗脱时,以0.5、1.0 BV/h的流速洗脱效果较好,峰形对称,峰较高,洗脱率高,而以1.5、2.0 BV/h的流速洗脱时,拖尾现象比较严重,峰变低,洗脱率降低。当流出液体积达到2.0 BV时,流出液已基本不含原花青素,因此,综合考虑生产效率和经济性,认为洗脱流速以1.0 BV/h,洗脱剂用量以2.0 BV为宜。
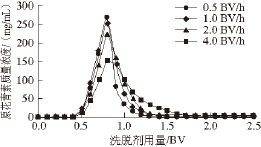
图2 洗脱流速对树脂动态解吸附的影响
Fig. 2 Effect of eluent flow rate on dynamic desorption of proanthocyanidins
2.4 乙醇体积分数对X-5树脂纯化鸡血藤原花青素的影响
在实际应用中,常用含水乙醇对吸附在树脂上的目标成分进行 洗脱,以达到纯化的目的。原花青素为多羟基酚类化合物,能够与大孔树脂产生强烈的氢键作用,难被水等强极性的洗脱剂洗脱,而易被含水的有机溶剂洗脱 [23]。从经济性、安全性等方面综合考虑,本实验选用廉价、安全、低毒的含水乙醇对吸附在X-5树脂上的鸡血藤原花青素进行洗脱。为确定最合适的体积分数,采用10%、30%、50%、70%、90%的乙醇溶液,按照1 BV/h的流速依次对X-5树脂进行充分洗脱,考察不同体积分数乙醇对鸡血藤原花青素的洗脱效果,结果如表2所示。
表2 乙醇体积分数对树脂解吸附能力的影响
Table 2 Effect of ethanol concentration on the desorption capacity of X-5 resin esin
%
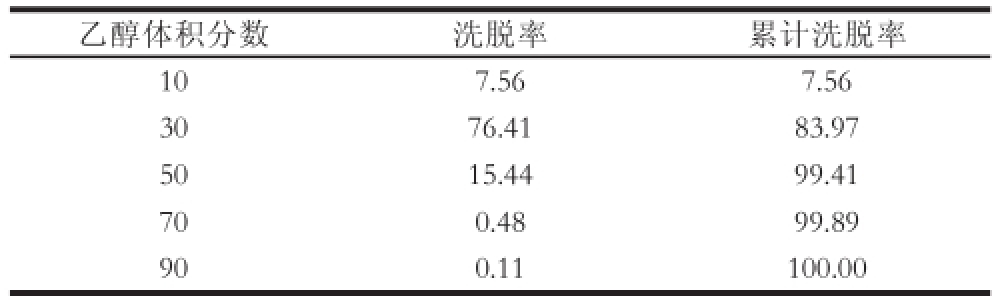
乙醇体积分数洗脱率累计洗脱率107.567.56 3076.4183.97 5015.4499.41 700.4899.89 900.11100.00
由表2可知,随着乙醇体积分数的增加,对鸡血藤原花青素的洗脱能力越强,10%乙醇洗脱效果较差,而50%、70%、90%乙醇都能够将超过99%的可洗脱原花青素洗脱下来,但不同体积分数的乙醇溶液洗脱下来的原花青素在纯度和活性上是否有差别,有待进一步研究。
2.5 样品原花青素纯度分析
利用1.3.7节所述方法对鸡血藤原花青素进行纯化,利用1.3.2节所述方法对各样品原花青素纯度进行分析,结果如表3所示。
表3 不同样品原花青素纯度及生物活性
Table 3 Purity and bioactivity of proanthocyanidin samples eluted with different concentrations of ethanol

注:CE. 鸡血藤粗提取物;F30、F50、F70、F90分别为体积分数30%、50%、70%、90%乙醇溶液洗脱纯化物。同行肩标小写字母不同表示差异显著(P<0.05)。
样品L-抗坏血酸阿卡波糖CEF30F50F70F90原花青素纯度/%48.81±0.34 a76.81±0.22 b72.48±0.88 c97.53±0.27 d87.81±0.33 e对DPPH自由基的IC 50/(μg/mL)95.15±1.54 a146.99±3.01 b86.12±2.20 c93.70±0.65 a75.48±2.60 d77.97±1.25 d对α-葡萄糖苷酶的IC 50/(μg/mL)515.23±17.35 a13.52±0.24 b6.95±0.12 c8.45±0.26 d4.79±0.06 e5.71±0.13 f
由表3可知,CE的原花青素纯度约为49%,与 程悦等 [16]的报道相近。利用30%、50%、70%、90%乙醇对吸附在X-5树脂上的原花青素进行洗脱,均可达到纯化效果。F50纯度约为粗提取物的1.48 倍,而F70纯度约为粗提取物的2.00 倍。由2.4节可知,50%、70%、90%乙醇对原花青素洗脱能力相近,而利用50%、70%、90%乙醇洗脱得到的纯化物原花青素纯度却各不相同,分析认为可能是50%、90%乙醇对吸附在X-5树脂上杂质的洗脱能力比70%乙醇强,从而导致F50、F90杂质较多。因此,在实际生产中,不但需要考察洗脱剂对原花青素的洗脱能力,还要充分考察洗脱剂对杂质的洗脱能力,选用对原花青素洗脱能力强,同时对杂质洗脱能力弱的洗脱剂,以提高纯化后原花青素纯度。
2.6 DPPH自由基清除活性
原花青素为富含羟基的植物多酚,具有很强的抗氧化活性 [1-2],本实验考察不同质量浓度下,各样品对DPPH自由基的清除活性,以评价X-5树脂的纯化效果,结果如图3所示。在0~180 μg/mL范围内,各样品对DPPH自由基的清除活性随质量浓度增加而增大,在180 μg/mL时达到最大值,除CE在所有质量浓度下对DPPH自由基的清除活性均弱于阳性对照L-抗坏血酸外,纯化后的原花青素在低质量浓度下,对DPPH自由基的清除活性均强于L-抗坏血酸,而在180 μg/mL时,则弱于L-抗坏血酸。

图3 不同质量浓度样品对DPPH自由基的清除率
Fig. 3 DPPH radical scavenging rates of proanthocyanidin samples eluted with different concentrations of ethanol
采用各样品对DPPH自由基的IC 50评价DPPH自由基清除活性,由图3可知,本实验条件下,各样品对DPPH自由基的清除活性依次为:F70>F90>F30>F50>CE,阳性对照L-抗坏血酸活性与F50相近,F70抗氧化活性约为L-抗坏血酸的1.25 倍,约为CE的1.95 倍,表明鸡血藤提取物本身具有很强的抗氧化活性,而通过X-5大孔树脂纯化,可进一步提高纯化物的抗氧化活性。经AB-8树脂纯化的荔枝皮原花青素对DPPH自由基的IC 50约为7.1 mg/L,相同实验条件下VC的IC 50约为9.8 mg/L,纯化后的荔枝皮原花青素抗氧化活性明显强于VC [24],经Sephadex LH-20纯化后的龙眼皮原花青素对DPPH自由基的IC 50约为0.083 mg/mL,相同实验条件下VC的IC 50约为0.103 mg/mL,纯化后的龙眼皮原花青素抗氧化活性明显强于VC [27],经折算后,本实验利用X-5大孔树脂纯化得到的鸡血藤原花青素抗氧化活性与文献[24,27]报道的原花青素活性相当。
2.7 α-葡萄糖苷酶抑制活性
α-葡萄糖苷酶抑制剂作为比较成熟的治疗2型糖尿病的药物,通过抑制小肠中α-葡萄糖苷酶的催化活性,降低多糖分解为葡萄糖的速率,以减缓机体对葡萄糖的摄入而达到降糖的作用。临床上常用的α-葡萄糖苷酶抑制剂如阿卡波糖、伏格列波糖等对α-葡萄糖苷酶虽有很强的抑制作用,但它们通常会引起腹胀、腹泻等副作用 [28],而法国海岸松(Pinus pinaster)树皮提取物(碧萝芷 ®)中低聚原花青素能够有效抑制α-葡萄糖苷酶 [29]。考虑到海岸松树皮的主要成分为原花青素,本实验考察并评价鸡血藤原花青素对α-葡萄糖苷酶的抑制活性。
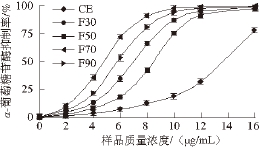
图4 不同质量浓度样品对α-葡萄糖苷酶的抑制率
Fig. 4 Percentage inhibition of α-glucosidase by proanthocyanidin samples eluted with different concentrations of ethanol
考察不同质量浓度下,各样品对α-葡萄糖苷酶的抑制活性,结果如图4所示,在0~16 μg/mL范围内,各样品对α-葡萄糖苷酶的抑制活性随质量浓度增加而增大,在16 μg/mL时达到最大。由图5可知,阳性对照阿卡波糖的抑制活性在0~3 200 μg/mL范围内,对α-葡萄糖苷酶的抑制活性随质量浓度增加而增大,3 200 μg/mL时达到最大抑制率(84.41±0.88)%,可见鸡血藤粗提物及鸡血藤原花青素对α-葡萄糖苷酶的抑制活性远强于阿卡波糖。

图5 不同质量浓度阿卡波糖对α-葡萄糖苷酶的抑制率
Fig. 5 Percentage inhibition of α-glucosidase by acarbose at different concentrations
以各样品对α-葡萄糖苷酶的IC 50评价对α-葡萄糖苷酶的抑制活性, 由表3可知,本实 验条件下,各样品对α-葡萄糖苷酶的抑制活性依次为:F70>F90>F30>F50>CE,而阳性对照阿卡波糖的IC 50约为(515.23±17.35) μg/mL, CE对α-葡萄糖苷酶的抑制活性约为阿卡波糖的38.11 倍,而F70对α-葡萄糖苷酶的抑制活性约至阿卡波糖的107.56 倍,表明表明鸡血藤提取物本身具有很强的α-葡萄糖苷酶的抑制活性,而通过X-5大孔树脂纯化,可进 一步提高纯化物的α-葡萄糖苷酶的抑制活性。Schafer等 [29]的研究表明,法 国海岸松树皮提取物对α-葡萄糖苷酶的IC 50约为5.34 μg/mL,相同实验条件下绿茶提取物对α-葡萄糖苷酶的IC 50约为19.74 μg/mL,而阿卡波糖对α-葡萄糖苷酶的IC 50约为1 mg/mL,经折算后表明,纯化后的鸡血藤原花青素对α-葡萄糖苷酶的抑制活性与法国海岸松树皮提取物相近。
2.8 鸡血藤原花青素纯度与活性的相关性
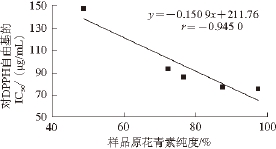
图6 样品原花青素纯度与DPPH自由基清除活性的相关性
Fig. 6 Correlation between proanthocyanidins purity and DPPH radical scavenging activity
各样品原花青素纯度与DPPH自由基清除活性的相关性如图6所示,随着样品原花青素纯度的升高,样品对DPPH自由基的IC 5 0随 之降低,二者呈负相关,相关系数r=-0. 945 0,而IC 50越低,对DPPH自由基的清除活性越强,说明鸡血藤原花青素纯度与DPPH自由基 清除活性呈正相关。
各样品原花青素纯度与α-葡萄糖苷酶的抑制活性之间的相关性如图7所示,随着样品原花青素纯度的升高,对α-葡萄糖苷酶的IC 50随之降低,二者呈负相关,相关系数r=-0.981 9,而IC 50越低,则对α-葡萄糖苷酶的抑制活性越强,说明鸡血藤原花青素纯度与α-葡萄糖苷酶抑制活性呈正相关。
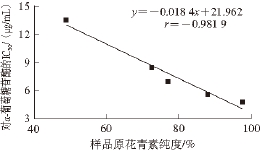
图7 样品原花青素纯度与α-葡萄糖苷酶抑制活性的相关性
Fig. 7 Correlation between proanthocyanidins purity and α-glucosidase inhibitory activity
综上所述,鸡血藤粗提取物含有大量的原花青素,具有很强的DPPH自由基清除活性及α-葡萄糖苷酶抑制活性,利用X-5树脂对鸡血藤粗提取物进行纯化,纯化物原花青素含量进一步提高,DPPH自由基清除活性及α-葡萄糖苷酶抑制活性随之增强,相关性分析表明鸡血藤原花青素纯度与DPPH自由基清除活性及α-葡萄糖苷酶抑制活性均呈正相关,推测鸡血藤原花青素可能是其抗氧化及抑制α-葡萄糖苷酶的主要活性成分。
从3 种大孔吸附树脂中筛选出X-5型树脂用于鸡血藤原花青素的纯化。纯化的最适条件为:上样质量浓度6.00 mg/mL、上样流速2 BV/h、上样量10 BV、洗脱流速1 BV/h、洗脱剂用量2 BV。利用不同体积分数乙醇洗脱可得到不同纯度的原花青素,其中70%乙醇纯化物原花青素纯度最高,具有最强的DPPH自由基清除活性及α-葡萄糖苷酶抑制活性。相关性分析表明原花青素可能是鸡血藤抗氧化及抑制α-葡萄糖苷酶的主要活性成分。
利用大孔吸附树脂可经济、高效地从鸡血藤粗提取物中制备高纯度、高活性的原花青素,本研究可为鸡血藤原花青素的纯化提供参考,促进鸡血藤在抗氧化、降糖等功能性食品添加剂等领域的应用。
参考文献:
[1] QUIDEAU S, DEFFIEU X, DOUAT-CASASSUS C, et al. Plant polyphenols: chemical properties, biological activities, and synthesis[J]. Angewandte Chemie International Edition, 2011, 50(3): 586-621. DOI:10.1002/anie.201000044.
[2] HELLSTROM J K, TORRONEN A R, MATTILA P H. Proanthocyanidins in common food products of plant origin[J]. Journal of Agricultural and Food Chemistry, 2009, 57(17): 7899-7906. DOI:10.1021/jf901434d.
[3] 高璐, 王滢, 饶胜其, 等. 葡萄籽原花青素提取物对衰老模型小鼠抗氧化作用[J]. 食品科学, 2014, 35(23): 253-256. DOI:10.7506/spkx1002-6630-201423049.
[4] 杨滢滢, 王雪青, 庞广昌. 原花青素抗 肿瘤作用机制研究进展[J]. 食品科学, 2008, 29(10): 694-697. DOI:10.3321/ j.issn:1002-6630.2008.10.165.
[5] 谢海, 战同霞, 钟明强. 原花青素对老年痴呆患者脑功能的影响[J]. 中国误诊学杂志, 2008, 8(24): 5866-5867. DOI:10.3969/ j.issn.1009-6647.2008.24.061.
[6] NISHIZUKA T, FUJITA Y, SATO Y, et al. Procyanidins are potent inhibitors of LOX-1: a new player in the French Paradox[J]. Proceedings of the Japan Academy. Series B, Physical and Biological Sciences, 2011, 87(3): 104-108. DOI:10.2183/pjab.87.104.
[7] 张慧文, 张玉, 马超美. 原花青素的研究进展[J]. 食品科学, 2015, 36(5): 296-304. DOI:10.7506/spkx1002-6630-201505052.
[8] 国家药典委员会. 中华人民共和国药典(2015年版)[S]. 北京: 中国医药科技出版社, 2015: 194.
[9] WANG Z Y, WANG D M, LOO T Y, et al. Spatholobus suberectus inhibits cancer cell growth by inducing apoptosis and arresting cell cycle at G 2/M checkpoint[J]. Journal of Ethnopharmacology, 2011, 133(2): 751-758. DOI:10.1016/j.jep.2010.11.004.
[10] LEE B J, JO I Y, BU Y M, et al. Antiplatelet effects of Spatholobus suberectus via inhibition of the glycoprotein IIb/IIIa receptor[J]. Journal of Ethnopharmacology, 2011, 134(2): 460-467. DOI:10.1016/ j.jep.2010.12.039.
[11] LEE M, LIN Y P, HSU F L, et al. Bioactive constituents of Spatholobus suberectus in regulating tyrosinase-related proteins and mRNA in HEMn cells[J]. Phytochemistry, 2006, 67(12): 1262-1270. DOI:10.1016/ j.phytochem.2006.05.008.
[12] LI R W, DAVID L G, MYERS S P, et al. Anti-infl ammatory activity of Chinese medicinal vine plants[J]. Journal of Ethnopharmacology, 2003, 85(1): 61-67. DOI:10.1016/S0378-8741(02)00339-2.
[13] LI W T, LIU J, GUAN R G, et al. Chemical characterization of procyanidins from Spatholobus suberectus and their antioxidative and anticancer activities[J]. Journal of Functional Foods, 2015, 12: 468-477. DOI:10.1016/j.jff.2014.11.009.
[14] HA H, SHIM K, AN H, et al. Water extract of Spatholobus suberectus inhibits osteoclast differentiation and bone resorption[J]. BMC Complementary & Alternative Medicine, 2013, 13(3): 1-9. DOI:10.1186/1472-6882-13-112.
[15] PANG J, GUO J P, JIN M, et al. Antiviral effects of aqueous extract from Spatholobus suberectus Dunn. against coxsackievirus B3 in mice[J]. Chinese Journal of Integrative Medicine, 2011, 17(10): 764-769. DOI:10.1007/s11655-011-0642-1.
[16] 程悦, 符影, 王志宇, 等. 鸡血藤提取物中缩合鞣质的含量测定及其抗肿瘤活性初步研究[J]. 中山大学学报(自然科学版), 2011, 50(2): 75-80.
[17] 林惠贞, 刘浩文, 韦玮, 等. 鸡血藤药材及其不同部位缩合鞣质的含量测定[J]. 中国实验方剂学杂志, 2013, 19(24): 70-74.
[18] HUANG Y W, CHEN L, FENG L, et al. Characterization of total phenolic constituents from the stems of Spatholobus suberectus using LC-DAD-MS nand their inhibitory effect on human neutrophil elastase activity[J]. Molecules, 2013, 18(7): 7549-7556. DOI:10.3390/ molecules18077549.
[19] 范明霞, 刘新桥, 陈莹, 等. 大孔树脂吸附纯化葡萄籽原花青素的研究[J]. 应用化工, 2009, 38(6): 864-867. DOI:10.3969/ j.issn.1671-3206.2009.06.024.
[20] 姬娜, 熊柳, 孙庆杰. 大孔吸附树脂分离花生种皮原花青素的研究[J]. 粮油食品科技, 2014, 22(3): 32-35. DOI:10.3969/ j.issn.1007-7561.2014.03.008.
[21] 姜倩, 张加研, 雷福厚, 等. 大孔吸附树脂AB-8分离肉桂原花青素的研究[J]. 生物质化学工程, 2015, 49(1): 26-32. DOI:10.3969/ j.issn.1673-5854.2015.01.005.
[22] 罗宝生, 戴万生. 大黄原花青素提取纯化工艺研究[J]. 云南中医中药杂志, 2007, 28(1): 36-38. DOI:10.3969/j.issn.1007-2349.2007.01.032.
[23] 杨志娟, 曾真, 吴晓萍. 火龙果皮原花青素提取纯化及定性分析[J]. 食品科学, 2015, 36(2): 75-79. DOI:10.7506/spkx1002-6630-201502014.
[24] 周玮婧, 孙智达, 谢笔钧, 等. 荔枝皮原花青素提取、纯化及抗氧化活性研究[J]. 食品科学, 2009, 30(8): 68-71. DOI:10.3321/ j.issn:1002-6630.2009.08.011.
[25] 李春阳, 许时婴, 王璋. 香草醛-盐酸法测定葡萄籽、梗中原花青素含量的研究[J]. 食品科学, 2004, 25(2): 157-161. DOI:10.3321/ j.issn:1002-6630.2004.02.036.
[26] SHARMA O P, BHAT T K. DPPH antioxidant assay revisited[J]. Food Chemistry, 2009, 113(4): 1202-1205. DOI:10.1016/ j.foodchem.2008.08.008.
[27] 黄尚荣, 杨雪娜, 张露, 等. 龙眼皮原花青素提取工艺优化及其抗氧化活性测定[J]. 食品科学, 2014, 35(10): 68-75. DOI:10.7506/spkx1002-6630-201410013.
[28] DONG H Q, LI M, ZHU F, et al. Inhibitory potential of trilobatin from Lithocarpus polystachyus Rehd against α-glucosidase and α-amylase linked to type 2 diabetes[J]. Food Chemistry, 2012, 130(2): 261-266. DOI:10.1016/j.foodchem.2011.07.030.
[29] SCHAFER A, HOGGER P. Oligomeric procyanidins of French maritime pine bark extract (Pycnogenol) effectively inhibit alphaglucosidase[J]. Diabetes Research and Clinical Practicet, 2007, 77(1): 41-46. DOI:10.1016/j.diabres.2006.10.011.
Purifi cation and Bioactivity Evaluation of Proanthocyanidins from Spatholobi Caulis
LI Yan
1, LI Xin
1, LIU Jingling
1, ZHANG Chenlu
1, LIANG Zongsuo
1,2,*
(1. College of Life Sciences, Northwest A&F University, Yangling 712100, China; 2. College of Life Sciences, Zhejiang Sci-Tech University, Hangzhou 310018, China)
Abstract:Proanthocyanidins from Spatholobi Caulis were purifi ed by macroporous adsorption resin, and then their purit y, 1,1-diphenyl-2-picrylhydrazyl (DPPH) free radical scavenging activity and α-glucosidase inhibitory activity were evaluated. In terms of static adsorption and desorption capacity, X-5 resin was chosen as the better sorbent for the purification of proanthocyanidins compared with D101 and AB-8 resin. Afterwards, the optimal parameters of dynami c adsorption and desorption for proa nthocyanidin purifi cation were obtained as follows: sample concentration, 6.00 mg/mL; loading rate, 2 BV/h; loading amount, 10 BV; eluent fl ow rate, 1 BV/h; and eluent volume, 2 BV. Proanthocyanidins with different purities were obtained by elution with different concentrations of ethanol, and the use of 70% ethanol as eluent gave the highest purity and strongest DPPH radical scavenging a cti vity as well as α-glucosidase inhibitory activity. The correlation analysis indicated that proanthocyanidins might be the major components responsible for the antioxidant activity and α-glucosidase inhibitory activity of Spatholobi Caulis.
Key words:Spatholobi Caulis; proanthocyanidins; macroporous adsorption resin purifi cation; 1,1-diphenyl-2-picrylhydrazyl (DPPH) free radical scavenging activity; α-glucosidase inhibitory activity
DOI:10.7506/spkx1002-6630-201617008
中图分类号:TS209
文献标志码:A
文章编号:1002-6630(2016)17-0045-07
收稿日期:2015-10-16
基金项目:“十二五” 国家科技支撑计划项目(2015BAC01B03);陕西省科技统筹创新工程计划项目(2012KTCL02-07)
作者简介:李彦(1992—),女,硕士研究生,研究方向为中药资源开发与利用。E-mail:18710440348@163.com
*通信作者:梁宗锁(1965—),男,教授,博士,研究方向为中药资源开发与利用。E-mail:liangzs@ms.iswc.ac.cn
引文格式: