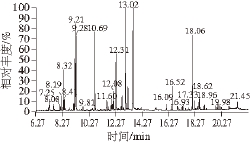
图1 SD-LCO的总离子流图
Fig. 1 Total ion current chromatogram of SD-LCO
付红军 1,2
(1.中南林业科技大学食品科学与工程学院,湖南 长沙 410004;2.稻谷及副产物深加工国家工程实验室,湖南 长沙 410004)
摘 要:研究微波对山苍子油化学成分的影响及其抑菌活性。采用水蒸气蒸馏(steam distillation,SD)法和微波辅助水蒸气蒸馏(microwave assisted steam distillation,MASD)法提取山苍子油,气相色谱-质谱法分析山苍子油的化学成分,采用滤纸片法测定山苍子油的抑菌活性,并对其抑菌机理进行探讨。两种方法提取的山苍子油中,橙花醛(SD:14.82%,MASD:11.50%,以上数据为相对含量,下同)、香叶醛(SD:17.95%,MASD:13.90%)、柠檬烯(SD:10.80%,MASD:5.57%)、α-松油醇(SD:5.70%,MASD:9.05%)、桉树脑(SD:7.11%,MASD:12.88%)和芳樟醇(SD:8.44%,MASD:12.65%)的含量发生了明显变化,微波作用下,单萜类化合物之间发生了化学转化。抑菌活性实验结果表明,山苍子油具有较好的抑菌活性,对黑曲霉和根霉的抑制活性优于对大肠杆菌和金黄色葡萄球菌的,山苍子油对大肠杆菌、金黄色葡萄球菌、黑曲霉和根霉的最小抑菌质量浓度分别为3.12、6.25、1.56、3.12 mg/mL。山苍子油能够破坏菌体细胞膜结构,增加细胞膜通透性,从而抑制其生长。
关键词:山苍子油;微波;化学转化;抑菌活性
引文格式:
付红军. 微波对山苍子油化学成分的影响及其抑菌活性研究[J]. 食品科学, 2016, 37(17): 65-69. DOI:10.7506/spkx1002-6630-201617011. http://www.spkx.net.cn
FU Hongjun. Effect of microwave on chemical components of Litsea cubeba oil and its antimicrobial activity[J]. Food Science, 2016, 37(17): 65-69. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201617011. http://www.spkx.net.cn
挥发油是植物体内的挥发性次生代谢物,因其具有源自天然、大多无毒副作用等特点,越来越受到消费者的青睐。挥发油的化学成分复杂,一种挥发油通常由几十种甚至几百种化学成分组成,而挥发油的化学成分是其发挥生物活性或特定功能的物质基础,提取方法、加工工艺、原料产地、原料部位等的不同会影响挥发油的化学组成,进而影响其生物活性 [1-6]。邹小兵等 [7]的研究表明,微波可促进薄荷挥发油中薄荷醇转化为长叶薄荷酮和薄荷呋喃酮,而花椒挥发油的桉油素重排可生成α-里那醇。张丽勇等 [8]报道了以索氏提取法和直接蒸馏法提取青蒿挥发油的化学成分和抑菌活性,两种方法提取的化学成分有明显差异,直接蒸馏法提取的青蒿挥发油抑菌活性优于索氏提取法。因此,加工工艺对挥发油化学成分和生物活性的影响日益受到研究者的重视。
山苍子(Litsea cubeba)是我国特色芳香油料植物,其果实挥发油——山苍子油具有清鲜香甜的果香味,是一种食品调料和香料以及合成鸢尾酮和二氢猕猴桃内酯的中间体 [9-10],同时,山苍子油具有抗菌 [11-12]、抗氧化 [13]、驱避昆虫 [14]和抗肿瘤 [15-16]等多种生物活性。因此,山苍子油在食品工业、医药工业中具有广阔的应用前景。
目前,关于山苍子油的提取和化学成分分析研究相对较多,提取方法有水蒸气蒸馏(steam distillation,SD)法、超临界CO 2提取法、微波辅助水蒸气蒸馏(microwave assisted steam distillation,MASD)法等 [1,17-19]。尽管微波提取山苍子油的速度快、能量利用率高,但是,微波提取对山苍子油化学成分和抑菌活性的影响尚缺乏系统研究。本实验以山苍子为研究对象,采用SD和MASD提取山苍子油,气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)法分析它们的化学成分,研究提取方法对化学成分的影响及其抑菌活性,旨在为山苍子油的应用和质量控制提供科学依据。
1.1 材料、试剂、菌种与培养基
山苍子果实2013年8月采集于湖南永顺,经鉴定为山苍子(Litsea cubeba)果实,密封保存。
柠檬醛(>95%)由中南林业科技大学食品化学实验室采用化学加成法纯化制备;胰蛋白胨、酵母提取物北京奥博星生物技术有限责任公司;葡萄糖 天津市致远化学试剂有限公司;青霉素钠 哈药集团制药总厂;马铃薯 长沙市菜市场购买;其他试剂均为分析纯。
大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、黑曲霉(Aspergillus niger)、根霉(Rhizopus)均由中南林业科技大学微生物实验室提供。
LB培养基:胰蛋白胨10 g、酵母提取物5 g、NaCl 10 g、琼脂15~20 g(液体培养基不加琼脂),蒸馏水定容至1 L,pH 7.0~7.2。
PDA培养基:马铃薯 200 g、葡萄糖 20 g、琼脂 15~20 g(液体培养基不加琼脂),蒸馏水定容至1 L。
1.2 仪器与设备
Clarcus 600 GC-MS联用仪 美国Perkin Elmer公司;CW2000超声-微波协同萃取仪 上海新拓微波溶样测试技术有限公司;AUY220电子天平 日本岛津公司;CA-920-3超净操作台 上海净化制备厂;YXQ-280MD高压蒸汽灭菌锅 上海申安医疗器械厂;HPX-9052MBE恒温振荡培养箱 上海博讯实业有限公司医疗设备厂。
1.3 方法
1.3.1 SD法提取山苍子油(SD-Litsea cubeba oil,SD-LCO)
将山苍子果实粉碎,过20 目筛,密封保存。称取30 g原料样品,加入500 mL圆底烧瓶中,加入300 mL蒸馏水,连接挥发油收集器,用电热套加热进行水蒸气蒸馏提取4 h。静置分层,收集油层,山苍子油得率为3.02%,冰箱中保存用于GC-MS分析和抑菌活性测定。
1.3.2 MASD法提取山苍子油(MASD-Litsea cubeba oil,MASD-LCO)
称取30 g过20 目筛的山苍子果实样品,加入500 mL烧瓶中,放入超声-微波协同萃取仪,加入300 mL蒸馏水,连接挥发油收集器,在100 W微波功率下进行提取2 h。静置分层,收集油层,山苍子油得率为3.07%,冰箱中保存用于GC-MS分析和抑菌活性测定。
1.3.3 山苍子油的GC-MS分析
山苍子油的GC-MS定量分析采用峰面积归一化法,化合物定性采用NIST标准谱库。
GC条件:Elite-5MS分析色谱柱(30 m×0.25 mm,0.25 μm);升温程序:初温80 ℃,保持3 min,5 ℃/min升温至100 ℃,保持1 min,10 ℃/min升温至130 ℃,保持3 min,20 ℃/min升温至230 ℃,保持6 min;高纯氦气(He)为载气;进样口温度250 ℃;进样量0.5 μL;分流比50∶1。
MS条件:电子轰击离子源进样方式;电离电压70 eV;离子源温度240 ℃;传输线温度280 ℃;质量扫描范围m/z 35~500。
1.3.4 山苍子油的抑菌活性测定
采用滤纸片法测定抑菌活性,细菌采用LB培养基,真菌采用PDA培养基。分别将4 种菌种从琼脂斜面培养基转接到相应的液体培养基中,培养生长至对数期(细菌34 ℃条件下培养8~10 h,真菌32 ℃条件下下培养12~16 h)后,吸取上述供试菌液,用无菌水稀释成10 6~10 7CFU/mL的均匀菌液,备用。山苍子油用无菌的二甲基亚砜(dimethyl sulfoxide,DMSO)稀释成50 mg/mL样品溶液。在无菌条件下,倒入20~25 mL的培养基于培养皿中制成平板,冷却后,分别吸取4 种菌悬液200 μL于相应的培养基上,涂布接种。取滤纸片(d=5.5 mm)贴在含菌平板上,在每片滤纸片上滴加5.0 μL样品溶液,做3 组平行实验。培养箱中恒温培养,细菌在34 ℃条件下培养24 h,真菌在32 ℃条件下培养48 h。根据抑菌圈直径判断抑菌效果。用灭菌处理的DMSO配制成50 mg/mL的青霉素钠溶液为阳性对照,DMSO为阴性对照。
采用上述同样方法测定柠檬醛的抑菌圈直径,质量浓度为50 mg/mL。
1.3.5 山苍子油最小抑菌浓度(minimal inhibitory concentration,MIC)的测定
采用两倍稀释法,山苍子油用灭菌处理的DMSO稀释成不同质量浓度的样品溶液(100.00、50.00、25.00、12.50、6.25、3.12、1.56、0.78 mg/mL),按1.3.4节方法进行实验,观察菌落生长情况,无菌生长的最小山苍子质量浓度即为其MIC。
采用上述方法测定柠檬醛的MIC,柠檬醛的质量浓度为100.00、50.00、25.00、12.50、6.25、3.12、1.56、0.78 mg/mL。
1.3.6 菌体培养液电导率的测定
按1%的接种量将10 6~10 7CFU/mL的金黄色葡萄球菌和黑曲霉均匀菌液分别接种至含50 mg/mL山苍子油的LB液体培养基和PDA液体培养基中,细菌在34 ℃条件下培养,真菌在32 ℃条件下培养,摇床振荡培养,分别取培养至0、2、4、6、8 h的培养液5 mL,5 000 r/min离心10 min,将上清液稀释20 倍后,用电导率仪测定其电导率。以不加山苍子油的菌体培养液作为对照组,实验重复3 次。
1.4 数据统计分析
采用SPSS 20.0进行数据统计分析,实验结果以±s表示。
2.1 提取方法对山苍子油化学成分的影响

图1 SD-LCO的总离子流图
Fig. 1 Total ion current chromatogram of SD-LCO

图2 MASD-LCO的总离子流图
Fig. 2 Total ion current chromatogram of MASD-LCO
采用SD和MASD方法提取山苍子油的GC-MS总离子流图见图1、2,其化学成分分析结果见表1,主要化合物种类见表2。
表1 SD-LCO和MASD-LCO中主要化学成分
Table 1 Chemical components of SD-LCO and MASD-LCO

化合物名称分子式相对含量/% SD-LCOMASD-LCO α-蒎烯C 10H 161.470.58莰烯C 10H 160.740.39桧烯C 10H 160.490.80 β-蒎烯C 10H 161.760.97甲基庚烯酮C 8H 14O4.244.95 α-松油烯C 10H 161.280.65对伞花烃C 10H 140.740.66柠檬烯C 10H 1610.805.57桉树脑C 10H 18O7.1112.88芳樟醇C 10H 18O8.4412.65香茅醛C 10H 18O1.221.47 2,6-二甲基-3,7-辛二烯-2,6-二醇-2,6-二醇C 10H 18O 20.370.30龙脑C 10H 18O0.901.36 4-萜品醇C 10H 18O1.672.24 α-松油醇C 10H 18O5.709.05橙花醇C 10H 18O1.822.20橙花醛C 10H 16O14.8211.50香叶醇C 10H 18O3.043.72香叶醛C 10H 16O17.9513.90 3,7-二甲基-2,6-辛二烯酸C 10H 16O 20.880.71 β-榄香烯C 15H 240.560.38 1-石竹烯C 15H 241.921.55 α-丁子香烯C 15H 240.280.26 β-蛇床烯C 15H 240.220.20斯巴醇C 15H 24O0.160.14氧化石竹烯C 15H 24O4.804.50
表2 山苍子油化合物质组成及相对含量
Table 2 Chemical composition of Litsea cubbeebbaa oil and its relative content %

注:无氧单萜化合物指仅含碳、氢的单萜类化合物。
提取方法鉴定化合物其他化合物无氧单萜化合物单萜含氧衍生物单萜类化合物倍半萜类化合物SD93.3817.2863.927.944.24 MASD93.589.6271.987.034.95
由表1、2可知,SD-LCO和MASD-LCO中共鉴定出26 种化学成分,鉴定化合物的相对含量分别占山苍子油总量的93.38%和93.58%,主要成分为单萜类化合物、倍半萜类化合物,其中单萜类化合物含量分别为81.20%和81.60%,倍半萜类化合物含量分别为7.94%和7.03%。SDLCO和MASD-LCO中柠檬醛含量分别为32.77%(橙花醛14.82%、香叶醛17.95%)和25.40%(橙花醛11.50%、香叶醛13.90%),低于文献[20]的报道,这是因为实验中采用的山苍子果实采摘后在实验室放置了6 个月左右,山苍子油中柠檬醛等香气成分挥发所致。采用相同产地的新鲜山苍子果实进行SD提取山苍子油,并对其化学成分进行GC-MS分析,结果表明山苍子油中柠檬醛含量为74.07%(橙花醛39.87%、香叶醛34.20%),这也印证了上述推测。
SD-LCO和MASD-LCO中单萜类化合物总含量基本不变,但某些化学成分的含量明显改变,无氧单萜化合物总含量从SD-LCO中的17.28%减少到MASD-LCO中的 9.62%,减少了7.66%,而MASD-LCO中单萜含氧衍生物含量比SD-LCO中提高8.06%,无氧单萜化合物的减少量近似等于单萜含氧化合物的增加量。
采用两种方法提取的山苍子油中柠檬醛的含量有明显变化,柠檬醛相对含量由SD-LCO中的32.77%减少到MASD-LCO中的25.40%,而MASD-LCO中α-松油醇相对含量(9.05%)比SD-LCO中α-松油醇相对含量(5.70%)高3.35%,桉树脑和芳樟醇的相对含量比SD-LCO中增加5.77%和4.21%。SD-LCO中柠檬烯相对含量为10.80%,比MASD-LCO中柠檬烯相对含量(5.57%)高5.23%。
为验证单萜类化合物之间的相互转化,本实验采用新鲜山苍子果提取的山苍子油和水为原料,微波辐射1.0 h,然后进行GC-MS分析,结果表明,柠檬醛、柠檬烯相对含量分别由74.07%和9.58%降低为68.09%和5.92%,α-松油醇、桉树脑和芳樟醇的相对含量分别由0.85%、1.84%和1.80%增加到1.68%、3.42%和3.95%,上述结果表明山苍子油中单萜类化合物之间发生了化学转化,其转化机理有待进一步研究。
2.2 山苍子油的抑菌活性
表3 山苍子油的抑菌活性
Table 3 Antimicrobial activity ofLitsea cubbeebbaa ooiill
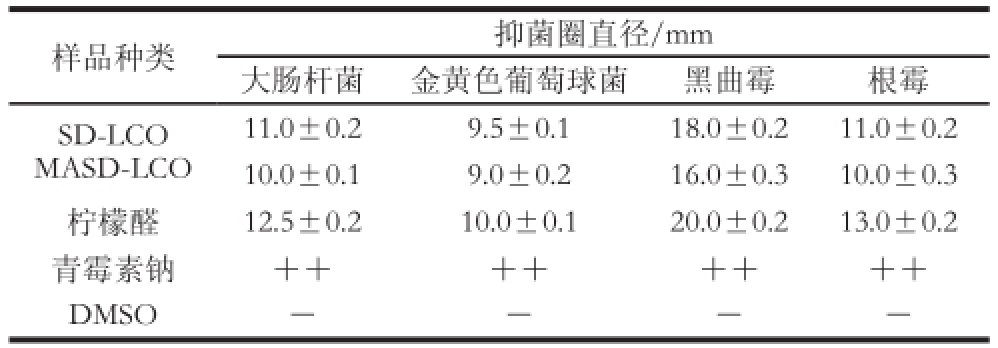
注:++.抑菌圈直径大于20 mm;-.抑菌圈直径小于6 mm。
11.0±0.29.5±0.118.0±0.211.0±0.2 10.0±0.19.0±0.216.0±0.310.0±0.3柠檬醛12.5±0.210.0±0.120.0±0.213.0±0.2青霉素钠++++++++DMSO----样品种类抑菌圈直径/mm大肠杆菌金黄色葡萄球菌黑曲霉根霉SD-LCO MASD-LCO
表4 SD-LCO和柠檬醛的MIC
Table 4 Minimal inhibitory concentrations (MIC) of SD-LCO and citral mg/mL

样品种类大肠杆菌金黄色葡萄球菌黑曲霉根霉SD-LCO3.126.251.563.12柠檬醛3.126.251.563.12
由表3、4可知,不同方法提取的山苍子油均具有较好的抑菌活性,对黑曲霉、根霉等真菌的抑制活性优于大肠杆菌和金黄色葡萄球菌,其中对黑曲霉的抑制活性最好,但其抑菌圈直径均小于阳性对照组(青霉素钠),阴性对照组(DMSO)无明显的抑菌圈。此外,柠檬醛和SD-LCO对4 种菌种的抑菌圈直径均大于MASD-LCO,因为柠檬醛组(>95%)和SD-LCO组(32.77%)中柠檬醛含量高于MASD-LCO(25.40%),这表明山苍子油的抑菌活性与其中的柠檬醛含量有一定相关性。因为α-、β-不饱和醛类以及醇类化合物具有良好的抑菌活性 [21],山苍子油中的主要成分为柠檬醛和醇类,柠檬醛具有良好的亲脂性,能破坏菌丝体细胞壁、孢子质膜的分子结构,并改变其通透性、影响菌丝体对营养物质的吸收转运,从而发挥其抑菌活性 [22]。但表4的结果表明,SD-LCO和柠檬醛对不同菌种的MIC相同,可能是样品溶液质量浓度在本实验所选定范围内下降幅度较大,抑菌作用不明显所致。
2.3 SD-LCO对菌体培养液电导率的影响
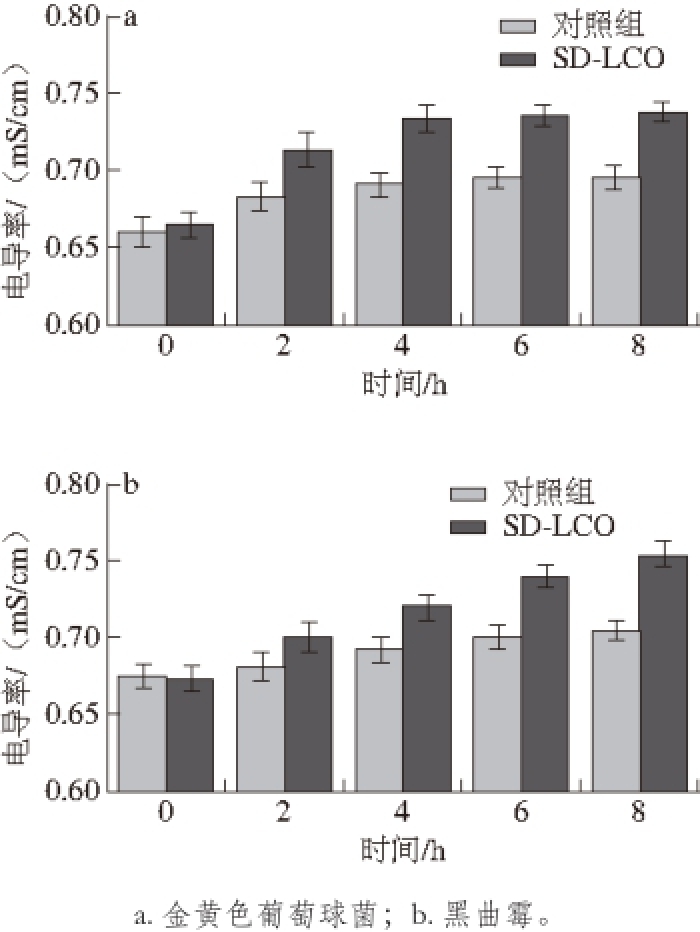
图3 SD-LCO对菌体电导率的影响
Fig. 3 Effect of SD-LCO on conductivity of thallus
由图3可知,随着作用时间延长,两种SD-LCO处理的菌体培养液的电导率都比对照组增加得更快,说明SD-LCO与两种菌体培养液作用后,金黄色葡萄球菌和黑曲霉的细胞膜通透性增加,山苍子油能够破坏细胞膜结构,从而抑制其生长。细胞膜是菌体的屏障,既可以阻挡外源物质的进入,也可以防止细胞内容物的流出。然而当细胞膜受到损坏时,胞内物质就会释放出来,如小分子物质钾离子、磷酸根离子等,因此,电导率变化可以反映细胞膜的通透性和结构的完整性 [23-25]。
本实验采用SD、MASD方法提取山苍子油,GC-MS分析山苍子油的化学成分,研究了微波对山苍子油化学成分的影响及其抑菌活性。采用SD和MASD提取的山苍子油中,单萜类化合物的相对含量分别为81.20%和81.60%,无氧单萜类化合物的相对含量分别为17.28%和9.62%,单萜含氧衍生物的相对含量分别为63.92%和71.98%,相对含量发生明显变化的化学成分是橙花醛(SD:14.82%,MASD:11.50%)、香叶醛(SD:17.95%,MASD:13.90%)、柠檬烯(SD:10.80%,MASD:5.57%)、α-松油醇(SD:5.70%,MASD:9.05%)、桉树脑(SD:7.11%,MASD:12.88%)和芳樟醇(SD:8.44%,MASD:12.65%)。这说明在微波作用下,山苍子油中单萜类化合物之间发生了化学转化。山苍子油具有较好的抑菌活性,其中对黑曲霉的抑菌活性最好,对黑曲霉、根霉的抑制活性优于对大肠杆菌和金黄色葡萄球菌的抑制活性,山苍子油对大肠杆菌、金黄色葡萄球菌、黑曲霉和根霉的MIC分别为3.12、6.25、1.56、3.12 mg/mL。山苍子油能够破坏菌体细胞膜结构,增加细胞膜通透性,从而抑制其生长。
参考文献:
[1] 李芳, SONG Y, HOLNESS H, 等. 不同提取方法山苍子油的化学成分与抗氧化活性分析[J]. 林业科学, 2015, 51(3): 124-131. DOI:10.11707/j.1001-7488.20150316.
[2] 李昕, 聂晶, 高正德, 等. 超声微波协同水蒸气蒸馏-GC-MS分析南、北五味子挥发油化学成分[J]. 食品科学, 2014, 35(8): 269-274. DOI:10.7506/spkx1002-6630-201408054.
[3] 董然, 南敏伦, 刘洪章. 两种长白山橐吾挥发油成分分析[J]. 食品科学, 2010, 31(10): 228-230.
[4] SI L, CHEN Y, HAN X, et al. Chemical composition of essential oils of Litsea cubeba harvested from its distribution areas in China[J]. Molecules, 2012, 17(6): 7057-7066. DOI:10.3390/molecules17067057.
[5] 姜明华, 姜建国, 杨丽. 不同方法提取代代花中挥发油成分的GC-MS分析[J]. 现代食品科技, 2010, 26(11): 1271-1275.
[6] 李莹, 陶海燕, 杨秀伟. 生白术和炒白术挥发油的GC-MS分析[J]. 药物分析杂志, 2013, 33(7): 1210-1217.
[7] 邹小兵, 陶进转, 夏之宁, 等. 微波提取对挥发油化学成分的影响[J].分析化学, 2011, 39(1): 142-145.
[8] 张丽勇, 林秀梅, 战月, 等. 不同方法提取青蒿挥发油成分分析及抗菌活性比较[J]. 中国实验方剂学杂志, 2011, 17(22): 60-63. DOI:10.3969/j.issn.1005-9903.2011.22.019.
[9] 胡铁, 皮少峰, 王烨, 等. 关环反应合成鸢尾酮[J]. 应用化学, 2014, 31(11): 1297-1301. DOI:10.3724/SP.J.1095.2014.40024.
[10] 晏日安, 苏镜娱, 曾陇梅. (±)二氢猕猴桃内酯合成方法的改进[J]. 有机化学, 2006, 26(5): 730-732. DOI:10.3321/ j.issn:0253-2786.2006.05.026.
[11] TIWARI B K, VALDRAMIDIS V P, O’DONNELL C P, et al. Application of natural antimicrobials for food preservation[J]. Journal of Agricultural and Food Chemistry, 2009, 57(14): 5987-6000. DOI:10.1021/jf900668n.
[12] SADDIQ A A, KHAYYAT S A. Chemical and antimicrobial studies of monoterpene: citral[J]. Pesticide Biochemistry and Physiology, 2010, 98(1): 89-93. DOI:10.1016/j.pestbp.2010.05.004.
[13] HWANG J K, CHIO E M, LEE J H. Antioxidant activity of Litsea cubeba[J]. Fitoterapia, 2005, 76(7): 684-686. DOI:10.1016/ j.fi tote.2005.05.007.
[14] OYEDELE A O, GBOLADE A A, SOSAN M B, et al. Formulation of an effective mosquito-repellent topical product from lemongrass oil[J]. Phytomedicine, 2002, 9(3): 259-262. DOI:10.1078/0944-7113-00120.
[15] 戴舒柳, 罗曼, 李化, 等. 柠檬醛胁迫下K562细胞生长增殖抑制和凋亡诱导研究[J]. 中国中药杂志, 2011, 36(10): 1370-1373.
[16] BAYALA B, BASSOLE I H N, SCIFO R, et al. Anticancer activity of essential oils and their chemical components: a review[J]. American Journal of Cancer Research, 2014, 4(6): 591-607.
[17] 韩艳利, 旷春桃, 李湘洲, 等. 用不同方法提取山苍子油的比较研究[J].中南林业科技大学学报, 2013, 33(11): 175-178. DOI:10.3969/ j.issn.1673-923X.2013.11.034.
[18] 张德权, 吕飞杰, 台建祥. 超临界CO 2流体技术萃取山苍子油的研究[J].食品与发酵工业, 2000, 26(2): 54-57. DOI:10.3321/j.issn:0253-990X.2000.02.014.
[19] 邓楠, 旷春桃, 王玲芝, 等. 山苍子油的提取、化学成分及其动力学的研究[J]. 中国食品添加剂, 2014(9): 80-84. DOI:10.3969/ j.issn.1006-2513. 2014.09.004.
[20] HU L S, DU M H, ZHANG J P, et al. Chemistry of the main component of essential oil of Litsea cubeba and its derivatives[J]. Open Journal of Forestry, 2014, 4(5): 457-466. DOI:10.4236/ojf.2014.45050.
[21] 朱顺英. 多种植物挥发油成分分析和抗菌活性及岩白菜素的研究[D].武汉: 武汉大学, 2005: 18-19.
[22] 罗曼. 天然抗菌香精油筛选及主要抗菌成分研究: 柠檬醛抗黄曲霉机理的研究[D]. 武汉: 武汉大学, 2004: 55-56.
[23] 姜玮. 长白山杜香挥发油抑菌活性成分提取及抑菌机理研究[D]. 长春: 吉林大学, 2012: 54.
[24] 张赟彬, 缪存铅, 宋庆, 等. 荷叶精油对肉类食品中常见致病菌的抑菌机理[J]. 食品科学, 2010, 31(19): 63-65.
[25] 刁文睿. 公丁香油脂的体外抗氧化、抑菌活性及抑菌机理研究[D].临汾: 山西师范大学, 2015: 31-37.
Effect of Microwave on Chemical Components of Litsea cubeba Oil and Its Antimicrobial Activity
FU Hongjun
1,2
(1. College of Food Science and Engineering, Central South University of Forestry and Technology, Changsha 410004, China; 2. National Engineering Laboratory for Rice and Byproducts Processing, Changsha 410004, China)
Abstract:The effect of microwave-assisted extraction on chemical components of Litsea cubeba oil and its antimicrobial activity were studied. Litsea cubeba oil was extracted by either steam distillation extraction (SD) or microwave-assisted steam distillation extraction (MASD), and analyzed by gas chromatography-mass spectrometry (GC-MS) for qualitative analysis of chemical components. The in vitro antimicrobial activity of Litsea cubeba oil was determined by fi lter paper method, and its underlying mechanism was explored. There were signifi cant differences in the contents of neral (SD-LCO: 14.82%, MASD-LCO: 11.50%, the same order below), geranial (17.95%, 13.90%), limonene (10.80%, 5.57%), α-terpineol (5.70%, 9.05%), cineole (7.11%, 12.88%) and linalool (8.44%, 12.65%) in Litsea cubeba oil extracted by SD and MASD. Chemical transformation of monoterpenes was promoted under microwave irradiation. The results of antimicrobial assay showed that Litsea cubeba oil displayed high antimicrobial activity. The antimicrobial activity of Litsea cubeba oil against Aspergillus niger and Rhizopus was better than that against Escherichia coli and Staphylococcus aureus, and its minimal inhibitory concentration (MIC) against Escherichia coli, Staphylococcus aureus, Aspergillus niger, and Rhizopus were 3.12, 6.25, 1.56 and 3.12 mg/mL, respectively.
Litsea cubeba oil could destroy the cell membrane structure and increase cell membrane permeability, thus inhibiting the growth of microorganisms.
Key words:Litsea cubeba oil; microwave; chemical transformation; antimicrobial activity
DOI:10.7506/spkx1002-6630-201617011
中图分类号:TS202;O629.6
文献标志码:A
文章编号:1002-6630(2016)17-0065-05
收稿日期:2016-03-07
基金项目:湖南省科技计划重点项目(2015SK20723;2015SK2072);湖南省教育厅优秀青年项目(16B282);
湖南省科技计划项目(2012NK3103)
作者简介:付红军(1975—),男,讲师,博士研究生,研究方向为森林食品加工与利用。E-mail:hj0730@126.com