赵笑笑,张慧茹*,孟素香,李 明,焦志强,李传民
(河南工业大学生物工程学院,河南 郑州 450001)
摘 要:目的:探究绞股蓝内生真菌JY25多糖对α-葡萄糖苷酶的抑制作用,为绞股蓝内生真菌多糖的应用提供基础数据。方法:确定4-硝基酚-α-D-吡喃葡萄糖苷(4-N-trophenyl-α-D-glu-copyranoside,PNPG)比色法检测α-葡萄糖苷酶活力的最佳条件,以阿卡波糖为阳性对照,采用优化后的最佳条件测定JY25多糖对α-葡萄糖苷酶的抑制作用,并确定抑制 类型、计算抑制常数;以Caco-2细胞作为体外产α-葡萄糖苷酶模型,测定JY25多糖的抑制效果。结果:反应时间30 min、反应温度44 ℃、pH 6.8、底物(PNPG)浓度5 mmol/L为PNPG比色法的最佳反应条件。以此优化条件进行比色,当JY25多糖质量浓度为6.15 mg/mL时,对α-葡萄糖苷酶抑制率达到最大(68.21%);JY25多糖的半数抑制浓度(IC 50)为(2.46±0.42) mg/mL,抑制常数K i为1.15 mg/mL,JY25多糖为竞争性抑制剂。在JY25多糖质量浓度为10.00 mg/mL时,对培养16 d的Caco-2细胞所产α-葡萄糖苷酶的抑制率达到16.48%。结论:体外实验证实JY25多糖具有竞争性抑制α-葡萄糖苷酶的作用。
关键词:内生真菌多糖;绞股蓝;α-葡萄糖苷酶;抑制作用
赵笑笑, 张慧茹, 孟素香, 等. 绞股蓝内生真菌多糖对α-葡萄糖苷酶的抑制作用[J]. 食品科学, 2016, 37(17): 70-75.
ZHAO Xiaoxiao, ZHANG Huiru, MENG Suxiang, et al. Inhibitory effect of endophytic fungal polysaccharide from Gynostemma pentaphyllum on α-glycosida se[J]. Food Science, 2016, 37(17): 70-75. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201617012. http://www.spkx.net. cn
真菌多糖是由10 个分子以上的单糖以糖苷键连接而成的高 分子聚合物,主要可从真菌子实体、菌丝体或发酵液中分离得到,具有抗肿瘤、抗病毒、抗氧化、抗衰老、免疫调节、降脂等多种生物活性,是当今医药和食品工业关注的焦点 [1-3]。药用植物内生真菌是一种新型药用微生物来源,因此,研究药用植物内生真菌多糖的生物活性对挖掘新型微生物资源的药用价值具有重要作用。
糖尿病是一种慢性 代谢性疾病,调查显示,我国有超过9 300万 人患有糖尿病 [4]。α-葡萄糖苷酶抑制剂是一类用于治疗2型糖尿病的口服降糖药,主要通过抑制α-葡萄糖苷酶的活性,减慢双糖分解成可吸收单糖的量,从而延缓肠道内碳水化合物的消化时间,控制餐后血糖浓度的迅速升高,有效降低餐后高血糖,减少糖尿病并发症的发生。目前常用的此类药物有阿卡波糖、伏格列波糖和米格列醇等 [5]。金玉妍 [6]的研究表明,真菌多糖具有抑制α-葡萄糖苷酶活性的作用,而国内鲜少内生真菌多糖抑制α-葡萄糖苷酶活性的研究报道。本研究拟采用4-硝基酚-α-D-吡喃葡萄糖苷(4-N-trophenyl-α-D-glucopyranoside,PNPG)筛选模型,首先确定PNPG比色法测定α-葡萄糖苷酶活性的最佳条件,继而探究绞股蓝内生真菌JY25多糖对α-葡萄糖苷酶活性的抑制作用,旨在挖掘内生真菌多糖的生物学活性,为降糖药物和保健品的开发提供参考资料。
1.1 材料与试剂
1.1.1 菌株
绞股蓝内生真菌JY25菌株由河南工业大学生物工程学院动物生理实验室分离,经形态学和分子生物学鉴定为子囊菌亚门(Ascomycotina)、核菌纲(Pyrenomycetes)、球壳目(Sphaeriales)、黑孢壳科(Melanospora)、毛壳菌属(Chaetomium) [7]。
1.1.2 试剂
阿卡波糖、对硝基苯酚(p-nitrophenol,PNP) 北京索莱宝有限公司;α-葡萄糖苷酶(12.4 U/mg)、PNPG美国Sigma公司;磷酸二氢钾、磷酸氢二钠、碳酸钠、盐酸、氢氧化钠 天津市科密欧化学试剂有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO) 北京拜尔特普生物科技发展有限公司;DMEM高糖干粉培养基、非必需氨基酸 美国Gibco公司;四季青胎牛血清(fetal bovine serum,FBS) 浙江天杭生物科技股份有限公司;谷氨酰胺、青霉素-链霉素、胰蛋白酶 南京凯基生物有限公司。
1.2 仪器与设备
Epoch酶标仪 美国Bio Tek公司;HZQ-X100细胞培养箱 美国Thermo Scientifi c公司;SW-CJ-1FD超净工作台 安泰空气技术有限公司;TS100倒置显微镜 日本尼康生物有限公司;AR1140电子分析天平 上海沛欧分析仪器有限公司。
1.3 方法
1.3.1 绘制PNP溶液标准曲线
精确配制1 000 μmol/L PNP溶液,稀释为7 个浓度梯度:0、5、25、50、100、200、400 μmol/L,各取100 μL加入Na 2CO 3(1 mol/L)终止液100 μL,振荡混匀15 min,测定反应体系在405 nm波长处的光密度(OD)值,以PNP浓度为横坐标,OD值为纵坐标,绘制PNP溶液标准曲线 [8]。
1.3.2 α-葡萄糖苷酶活力的测定
规定在37 ℃、pH 6.8条件下,每分钟水解产生1 μmol PNP的酶用量为一个酶活力单位(U) [8]。规定在37 ℃、pH 6.8条件下,降低1 μmol PNP所需的抑制剂的量为一个抑制剂活力单位(U)。
参考Sou等 [8]的反应体系,在96 孔板中加入磷酸盐缓冲液(phosphate buffered saline,PBS)100 μL、1.0 U/mL的α-葡萄糖苷酶溶液20 μL,37 ℃恒温反应15 min后,加入5 mmol/L PNPG溶液20 μL,37 ℃恒温反应30 min后,加入1 mol/L Na 2CO 3溶液100 μL终止反应,测定产物在405 nm波长处的OD值,应用PNP溶液标准曲线求得PNP的量,以此计算酶活力。
1.3.3 测定α-葡萄糖苷酶活力最佳反应条件的确定
采用单因素变量法,在测定酶活力体系中,分别改变反应温度、pH值、底物浓度、反应时间这4 个因素,确定不同反应条件对酶活力测定的影响。其中,反应温度设定13 个水平:26、29、32、35、37、39、41、44、47、50、53、56、59 ℃,酸碱条件设定5 个水平:pH 6.0、6.4、6.8、7.2、7.6,底物PNPG浓度设定5 个水平:1.25、2.50、5.00、7.50、10.00 mmol/L,反应时间设置7 个水平:30、60、90、120、150、180、210 min。
在单因素试验的基础上,以反应温度、pH值、PNPG浓度、反应时间为变量,设计四因素三水平的正交试验,以确定测定α-葡萄糖苷酶活力的最佳反应条件。
1.3.4 JY25多糖对体外α-葡萄糖苷酶活力的影响
从绞股蓝内生真菌JY25的发酵液中经水提醇沉的方法获取JY25粗多糖,再经除蛋白、除色素、层析柱分离层析等过程获得精制的JY25多糖 [9],纯度为95.66%。经结构分析,JY25多糖含有大量吸附水和结晶水,红外光谱分析证实其为含有α-、β-端基构型、吡喃环结构的糖蛋白。气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)分析表明JY25多糖主要由葡萄糖、阿拉伯糖、甘露糖和半乳糖4 种单糖组成。
采用PNPG法的最佳反应体系,于96 孔板中加入PBS100 μL、1.0 U/mL的α-葡萄糖苷酶溶液20 μL,再分别加入0.38、0.78、1.54、3.08、6.15 mg/mL JY25多糖溶液20 μL,测定其在405 nm波长处的OD值(OD C),以阿卡波糖为阳性对照(OD E),同时设定“缓冲液+酶液+底物”的试剂对照组(OD A)和缓冲液的空白对照组(OD B),以“样品+缓冲液”为样品对照组(OD D)消除深色多糖对实验结果的影响,根据改良寇式法求半数抑制浓度(IC 50),计算样品的抑制率,探究JY25多糖对体外α-葡萄糖苷酶的抑制作用。
1.3.5 JY25多糖抑制α-葡萄糖苷酶动力学参数的确定
配制JY25多糖质量浓度分别为0、3、6 mg/mL,取4 个PNPG底物浓度(2、4、8、12 mmol/L),分别测定添加不同质量浓度多糖后不同浓度底物的反应速率,按Lineweave-Burk作图法绘制1/[S]-1/v双倒数曲线,确定多糖的酶动力学反应类型和K i值。
1.3.6 JY25多糖对Caco-2细胞产α-葡萄糖苷酶的影响
将Caco-2细胞按1×10 4个/mL接种于24 孔板,细胞培养液为含1%青-链霉素混合物、1% L-谷氨酰胺、1%非必需氨基酸和10% FBS的DMEM高糖培养基,37 ℃、5% CO 2培养箱中培养,隔天换液 [10],培养到第16天分为7 组:空白对照组(1 mL PBS)、阴性对照组(200 μL PBS+800 μL 28 mmol/L麦芽糖)、阳性对照组(200 μL 2.00 mg/mL阿卡波糖+800 μL 28 mmol/L麦芽糖)和4 个实验组(分别为1.25、2.50、5.00、10.00 mg/mL JY25多糖200 μL+28 mmol/L麦芽糖800 μL),每种处理设置3 个以上重复。吸弃旧培养液,用温浴至37 ℃的PBS轻轻冲洗细胞2 次,按各实验组要求添加不同 溶液后,将细胞培养板置于37 ℃、5% CO 2培养箱1 h,然后迅速将细胞培养板置于冰浴中终止反应,各孔吸出50 μL反应液,加入200 μL葡萄糖试剂盒工作液,37 ℃反应30 min,在550 nm波长处测定OD值,以计算反应液中葡萄糖含量,比较JY25多糖对Caco-2细胞产α-葡萄糖苷酶的抑制作用,按公式(2)计算抑制率。
2.1 PNP溶液标准曲线
以PNP浓度为横坐标,OD值为纵坐标,绘制PNP溶液标准曲线,得到回归方程为y=0.007x+0.128(R 2=0.999),表明该模型拟合度比较高,回归拟合效果好,回归方程可以使用。
2.2 α-葡萄糖苷酶活力测定结果
采用PNPG法测得所用α-葡萄糖苷酶的OD 405 nm值为1.33,相当于标示酶活力的0.943 倍,实验中所用α-葡萄糖苷酶按照实际测得的酶活力配制为1 U/mL。
2.3 α-葡萄糖苷酶活力测定最佳反应条件的确定
2.3.1 最佳反应温度
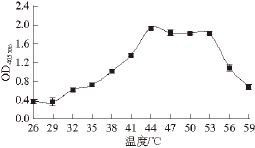
图1 温度对α-葡萄糖苷酶活力的影响
Fig. 1 Effect of reaction temperature on α-glycosidase activity
由图1可知,在底物PNPG浓度5 mmol/L、反应时间180 min时,温度对OD 405 nm有显著影响,在26~44 ℃范围内,随着温度的升高,OD 405 nm越来越大,表明反应生成的PNP量随温度升高逐渐增多,温度升高对反应有促进作用。当反应温度达到44 ℃时,OD 405 nm达到最大值1.933,即反应温度为44 ℃时,反应生成的PNP量达到最多。继续升高反应温度,OD 405 nm略有下降。在47~53 ℃范围内,OD 405 nm趋于平稳。温度高于53 ℃之后,生成PNP的量大幅减少,OD 405 nm随温度升高直线下降,推测可能是高温造成了酶失活。故而选定反应的最佳温度为44 ℃。
2.3.2 最佳反应pH值

图2 pHH值对α-葡萄糖苷酶活力的影响
Fig. 2 Effect of reaction pH on α-glycosidase activity
由图2可知,设定反应温度为44 ℃、底物PNPG浓度为5 mmol/L、反应时间为180 min,当反应pH值为6.0~6.8时,OD 405 nm随反应pH值增大而增大;当反应pH值为6.8~7.6时,OD 405 nm随反应pH值增大而减小。当反应pH值为6.8时,OD 405 nm为0.549,达到最大值,表明该反应条件下产物PNP量最大,故最佳反应酸碱度为pH 6.8。分析实验结果,选定pH 6.8为α-葡萄糖苷酶反应的最适pH值。
2.3.3 最佳底物浓度

图3 PNPG浓度对α-葡萄糖苷酶活力的影响
Fig. 3 Effect of PNPG concentration on α-glycosidase activity
由图3可知,设定反应温度44 ℃、反应pH6.8、反应时间180 min,在底物浓度为0~5 mmol/L范围内时,随着底物浓度的增加,OD 405 nm不断增大,表明该反应也迅速加快。当底物浓度达到5 mmol/L时,OD 405 nm达到最大值0.996。在底物浓度为5~10 mmol/L范围内,随着底物浓度的增加,OD 405 nm不断减小,表明产物PNP量随底物浓度增加而减少。实验结果表明,当底物浓度为5 mmol/L时,反应刚好达到饱和,反应产物PNP的量达到最大。当底物浓度超过反应需求量后,底物可能会抑制反应的进行。根据实验结果推断,选定反应的最佳底物浓度为5 mmol/L。
2.3.4 最佳反应时间
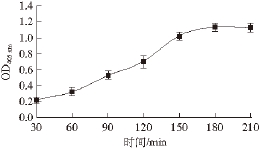
图4 反应时间对α-葡萄糖苷酶活力的影响
Fig. 4 Effect of reaction time on α-glycosidase activity
由图4可知,在反应温度44 ℃、反应pH6.8、反应底物浓度5 mmol/L时,反应时间长短对OD 405 nm影响较大。当反应时间为30~150 min时,随着反应时间的延长,OD 405 nm迅速增大,表明反应生成的PNP量越来越多;当反应时间为150~180 min时,OD 405 nm缓慢增大;在180 min时OD 405 nm达到最大值1.201;当反应时间为180~210 min时,OD 405 nm几乎没有变化,表明反应进入一个平衡状态。因此,确定最佳反应时间为180 min。
2.3.5 正交试验结果
根据单因素试验结果,设计由反应时间(A)、反应温度(B)、反应pH值(C)、底物PNPG浓度(D)所构成的四因素三水平正交试验(L 9(3 4)),试验设计方案及结果见表1。
表1 L
9(3
4)正交试验设计方案及结果
Table 1 Orthogonal array design L (3 ) with experimental results
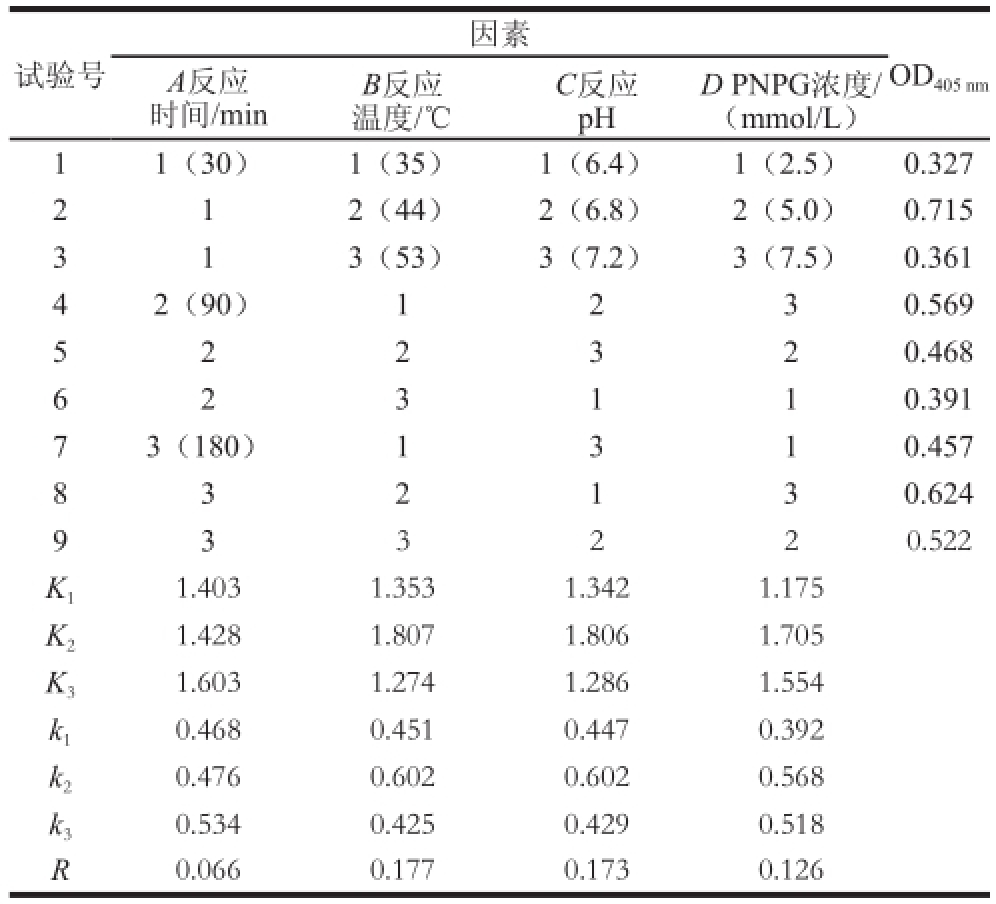
因素试验号A反应时间/minB反应温度/℃C反应pH OD405 nm D PNPG浓度/(mmol/L)11(30)1(35)1(6.4)1(2.5)0.327 212(44)2(6.8)2(5.0)0.715 313(53)3(7.2)3(7.5)0.361 42(90)1230.569 522320.468 623110.391 73(180)1310.457 832130.624 933220.522 K 11.4031.3531.3421.175 K 21.4281.8071.8061.705 K 31.6031.2741.2861.554 k 10.4680.4510.4470.392 k 20.4760.6020.6020.568 k 30.5340.4250.4290.518 R0.0660.1770.1730.126
由表1可知,根据极差值判定影响酶促反应结果因素顺序为B>C>D>A,即反应温度的影响最大,其次是反应pH值,之后是底物PNPG浓度,反应时间影响最小。最优水平组合水平为A 3B 2C 2D 2,即当反应时间为180 min、反应温度为44 ℃、反应pH值为6.8、底物PNPG浓度为5 mmol/L时,酶促反应效果最佳。但由于反应时间是影响最小的因素,并且从OD 405 nm来看,A 1B 2C 2D 2组合的效果也较优,故本着快捷、简便的原则,确定反应体系的最佳条件为:反应时间30 min、反应温度44 ℃、反应pH 6.8、底物PNPG浓度5 mmol/L。此条件下,OD值达最大,为0.715。
2.4 JY25多糖对体外α-葡萄糖苷酶的抑制作用
在最佳反应条件下,以阿卡波糖为阳性对照,测定不同质量浓度的JY25多糖对α-葡萄糖苷酶的抑制率,结果见图5。
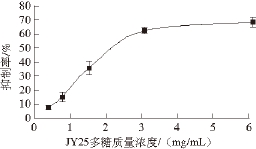
图5 JY25多糖对α-葡萄糖苷酶的抑制作用
Fig. 5 Inhibitory effect of JY25 polysaccharide on α-glycosidase activity
由图5可知,JY25多糖对α-葡萄糖苷酶活性产生了明显的抑制作用。当JY25多糖质量浓度由0.38 mg/mL增加至3.08 mg/mL时,其对α-葡萄糖苷酶的抑制率从7.37%上升到62.44%,并且JY25多糖对α-葡萄糖苷酶的抑制作用呈现质量浓度依赖性。但随着JY25多糖质量浓度增大至3.08 mg/mL以上时,抑制率趋于平稳。当JY25多糖质量浓度为6.15 mg/mL时,JY25多糖对α-葡萄糖苷酶的抑制率达到最大(68.21%)。根据以上结果计算得出JY25多糖抑制α-葡萄糖苷酶活性的IC 50为(2.46±0.42) mg/mL,阿卡波糖的IC 50为(1.19±0.21) mg/mL,可以看出,JY25多糖对α-葡萄糖苷酶的抑制活性低于阿卡波糖。
2.5 抑制类型的确定
在不同JY25多糖质量浓度、不同底物浓度条件下,采用米氏方程双倒数法,研究JY25多糖的抑制类型。以1/[S]为横坐标,1/v为纵坐标,作双倒数曲线,结果见图6。

图6 JY25多糖抑制下α-葡萄糖苷酶的双倒数动力学曲线
Fig. 6 Linewaver-Burk plot showing the inhibitory effect of JY25 polysaccharide on α-glycosidase activity
由图6可知,JY25多糖对α-葡萄糖苷酶的抑制程度随着质量浓度的增加成正比;而随着JY25多糖质量浓度的变化,最大反应速率v max基本保持不变,米氏常数K m值增加,根据酶抑制动力学方程,确定JY25多糖是竞争性地抑制α-葡萄糖苷酶活性。根据竞争性抑制方程可得K i=1.15 mg/mL。
2.6 JY25多糖对Caco-2细胞产α-葡萄糖苷酶的抑制作用以阿卡波糖为阳性对照,通过底物麦芽糖浓度的变化,测定不同质量浓度的JY25多糖对体外培养的Caco-2细胞产生α-葡萄糖苷酶的抑制率,以研究JY25多糖对模拟体内肠道产生的α-葡萄糖苷酶的抑制作用,结果见表2。
表2 JY25多糖对Caco-2细胞产α-葡萄糖苷酶的抑制作用(x±s)
Table 2 Inhibitory effect of JY25 polysaccharide on -glcosidase derived from Caco-2 cell model (x ± s )

注:同列肩标小写字母不同表示差异显著(P<0.05)。
组别OD 550 nm抑制率/%空白对照组0.092±0.083 a阴性对照组1.985±0.058 a0.00阳性对照组1.619±0.074 a21.33±3.12 a10.00 mg/mL JY25多糖组1.673±0.056 a16.48±1.89 a5.00 mg/mL JY25多糖组1.740±0.091 a12.94±2.39 b2.50 mg/mL JY25多糖组1.776±0.040 a11.04±4.27 b1.25 mg/mL JY25多糖组1.856±0.101 a6.81±1.56 b
由表2可知,JY25多糖对Caco-2细胞模型来源的α-葡萄糖苷酶活性也具有明显的抑制作用。在本实验样品质量浓度范围内(1.25~10.00 mg/mL),JY25多糖对α-葡萄糖苷酶的抑制率从6.81%上升到16.48%,并且JY25多糖对α-葡萄糖苷酶的抑制作用具有质量浓度依赖性。当JY25多糖质量浓度为10.00 mg/mL时,JY25多糖对α-葡萄糖苷酶的抑制率达到16.48%,与阳性对照组(阿卡波糖)对α-葡萄糖苷酶的抑制率(21.33%)处于同一统计显著性水平,即两者没有显著差异(P>0.05)。因此,JY25多糖对Caco-2细胞模型来源的α-葡萄糖苷酶活性也具有抑制作用。
绞股蓝又名七叶胆,为葫芦科绞股蓝属植物 [11]。欧守珍等 [12]的研究表明海南绞股蓝乙醇提取物能够明显抑制葡萄糖引致的小鼠血糖水平升高,即海南绞股蓝乙醇提取物具有明显的降血糖作用。黄晓飞等 [13]对绞股蓝不同组分的降血糖活性进行了研究,证明绞股蓝组分3能显著降低糖尿病小鼠的血糖值,改善糖尿病小鼠的症状,并可调节其血脂代谢。董义等 [14]研究了6 种保健食品原料的辅助降血糖功效,结果表明6 种原料均有明显的辅助降血糖功效。其中,苦瓜的效果最好,其次为苦荞和绞股蓝,它们可作为辅助降血糖功能食品的原料。JY25菌株是从绞股蓝中分离出的一株内生真菌 [7],菌落周边呈现浅黄褐色,形状不规则,菌落正反面颜色一致,菌丝体密实,初期菌丝淡黄色,后期呈现黄褐色,菌落中心出现黑色孢子,对大肠杆菌和金黄色葡萄球菌具有抑制作用 [15-16]。真菌多糖在国际上被称为“生物反应调节剂” [17],具有多种生物活性。云芝多糖和茯苓多糖在临床上可用于治疗肿瘤 [18],松茸多糖能降低血脂水平、提高耐缺氧能力 [19],猴头菌丝多糖对糖尿病小鼠的胰腺具有一定的保护作用 [20],灵芝多糖能显著提升大鼠血浆胰岛素水平,并减轻糖尿病导致的体质量下降 [21-22]。
国内外有关内生真菌多糖对α-葡萄糖苷酶抑制作用的研究报道极少。本研究选用从绞股蓝中分离出的内生真菌JY25所分泌的胞外多糖为实验材料,研究内生真菌多糖对α-葡萄糖苷酶的抑制作用。实验结果表明,JY25内生真菌多糖对α-葡萄糖苷酶有竞争性抑制作用,抑制率最高可达68.21%,IC 50值为(2.46±0.42) mg/mL,抑制常数K i为1.15 mg/mL。
雷红等 [23]研究灰树花子实体多糖的降血糖活性及对α-葡萄糖苷酶活性的影响,发现灰树花子实体多糖MT-α-glucan对α-葡萄糖苷酶活性具有较强的抑制作用,与本研究结果相似。鲁梅芳等 [24]研究发现灰树花胞外多糖(GLP-1)对α-葡萄糖苷酶的IC 50为35.79 mg/mL,K i值为3.4×10 -4mol/L,为非竞争性抑制,与本研究结果具有差异,推测可能是由于绞股蓝内生真菌多糖和灰树花胞外真菌多糖对α-葡萄糖苷酶的抑制原理不相同而造成的。本研究结果与田丽梅等 [25]研究的枸杞多糖对α-葡萄糖苷酶的抑制作用也不相同,枸杞多糖对α-葡萄糖苷酶的抑制作用属非竞争性抑制作用,分析可能是由于真菌多糖与植物多糖对葡萄糖苷酶的抑制机制不相同所致。本研究发现,绞股蓝内生真菌多糖的抑制类型与糖尿病临床防治药物阿卡波糖的抑制类型相同,具有开发成新型降糖药物和保健品的潜能,同时,内生真菌多糖还可发挥更强的、更多的其他生物学特性,因而对药用植物内生真菌多糖的研究更能发挥其多种药用价值。
参考文献:
[1] KROON F P, van DISSEL J T, RAVENSBERGEN E, et al. Enhanced antibody response to pneumococcal polysaccharide vaccine after prior immunization with conjugate pneumococcal vaccine in HIV-infected adults[J]. Vaccine, 2000, 19(7/8): 886-894. DOI:10.1016/S0264-410X(00)00232-2.
[2] TZIANABOS O. Polysaccharide immunomodulators as therapeutic agents: structural aspects and biological function[J]. Clinical Microbiology Reviews, 2000, 13: 523-533. DOI:10.1128/ CMR.13.4.523-533.2000.
[3] ROUT D, MONDAL S, CHAKRABORTY I, et al. Chemical analysis of a new (l→3), (l→6)-branched glucan from an edible mushroom, Pleurotus fl orida[J]. Carbohydrate Research, 2005, 340: 2533-2539. DOI:10.1016/j.carres.2005.08.006.
[4] YANG W, LU J, WENG J, et al. Prevalence of diabetes among men and women in China[J]. New England Journal of Medicine, 2010, 362(12): 1090-1101. DOI:10.1056/NEJMoa0908292.
[5] 王翼, 张旭. α-葡萄糖苷酶抑制剂的研究进展[J]. 海峡药学, 2009, 21(9): 4-5. DOI:10.3969/j.issn.1006-3765.2009.09.002.
[6] 金玉妍. 灰树花胞外多糖的分离纯化及降血糖作用研究[D]. 天津:天津科技大学, 2009: 39-42. DOI:10.7666/d.y2082982.
[7] 张慧茹, 许春平, 贺秀媛, 等. 绞股蓝内生真菌及其用途: 中国, 201310002710[P]. 2013-11-27.
[8] SOU S, MAYUMI S, TAKAHASHI H, et al. Novel α-glucosidase inhibitors with a tetrachlorophthalimide skeleton[J]. Bioorganic & Medicinal Chemistry Letters, 2000, 10: 1081-1084. DOI:10.1016/ S0960-894X(00)00161-X.
[9] 李磊, 王卫国. 真菌多糖药理作用及其提取、纯化研究进展[J]. 河南工业大学学报, 2008, 29(2): 88-92.
[10] 金叶. 银杏叶提取物类脂质体成型工艺及体外细胞摄取、转运机制的研究[D]. 长春: 吉林大学, 2012: 54-56.
[11] 中国科学院中国植物志编辑委员会. 中国植物志(第七十三卷第一分册)[M]. 北京: 科学出版社, 1986: 265-277.
[12] 欧守珍, 莫燕娜, 陈世民, 等. 海南绞股蓝乙醇提取物的降血糖作用[J].中国热带医学, 2014, 14(1): 38-40. DOI:10.13604/j.cnki.46-1064/ r.2014.01.013.
[13] 黄晓飞, 宋烨, 宋成武, 等. 绞股蓝不同组分的降血糖活性研究[J]. 湖北中医杂志, 2013, 35(6): 67-69. DOI:10.3969/ j.issn.1000-0704.2013.06.043.
[14] 董义, 王斯慧, 曾里, 等. 六种保健食品原料的辅助降血糖功效研究[J]. 食品研究与开发, 2014, 35(23): 121-124. DOI:10.3969/ j.issn.1005-6521.2014.23.033.
[15] 张慧茹, 孟素香, 曹健, 等. 绞股蓝内生真菌抗大肠杆菌抗菌机制的研究[J]. 微生物学通报, 2015, 42(1): 157-162. DOI:10.13344/ j.microbiol.china.140378.
[16] 孟素香, 曹健, 张慧茹, 等. 绞股蓝内生真菌对金黄色葡萄球菌的抗菌机制[J]. 中国抗生素杂志, 2015, 40(4): 268-273. DOI:10.3969/ j.issn.1001-8689.2015.04.007.
[17] 杜庆. 食(药)用真菌多糖的研究进展[J]. 中国食物与营养, 2011, 17(5): 75-77. DOI:10.3969/j.issn.1006-9577.2011.05.018.
[18] 张竞, 潘琢, 赵宝华. 真菌多糖抗肿瘤作用的研究进展[J]. 生命科学仪器, 2009, 7(4): 28-31. DOI:10.3969/j.issn.1671-7929.2009.04.006.
[19] JIANG Y, LI P, LI S P, et al. Optimization of pressurized liquid extraction of five major flavanoids from Lysimachia clethroide[J]. Journal of Pharmaceutical and Biomedical Analysis, 2007, 43: 341-345. DOI:10.1016/j.jpba.2006.06.030.
[20] 杜志强, 任大明, 葛超, 等. 猴头菌丝多糖降血糖作用研究[J]. 生物技术, 2006, 16(6): 40-41. DOI:10.3969/j.issn.1004-311X.2006.06.015.
[21] OLUBA O M, ONYENEKE E C, OJIEH G C, et al. Evaluation of the hypoglycemic effect of aqueous extract of Ganoderma lucidum on STZ-induced diabetic wistar rats[J]. Annals of Biological Research, 2010, 1(3): 41-49.
[22] LI F, ZHANGY, ZHONG Z, et al. Antihyperglycemic effect of Ganoderma lucidum polysaccharides on streptozotocin-induced diabetic mice[J]. International Journal of Molecular Sciences, 2011, 12(9): 6135-6145. DOI:10.3390/ijms12096135.
[23] 雷红, 王毅, 蔡亮亮, 等. 灰树花子实体多糖的降血糖活性和对α-葡萄糖苷酶活性的影响[J]. 食品科学, 2010, 31(11): 263-267.
[24] 鲁梅芳, 金玉妍, 曹小红, 等. 灰树花胞外多糖主要成分GFP-1对α-葡萄糖苷酶的抑制作用[J]. 中国新药杂志, 2009, 18(23): 2250-2254.
[25] 田丽梅, 王旻, 陈卫. 枸杞多糖对α-葡萄糖苷酶的抑制作用[J]. 华西药学杂志, 2006, 21(2): 131-133. DOI:10.3969/j.issn.1006-0103.2006.02.008.
Inhibitory Effect of Endophytic Fungal Polysaccharide from Gynostemma pentaphyllum on α-Glycosidase
ZHAO Xiaoxiao, ZHANG Huiru*, MENG Suxiang, LI Ming, JIAO Zhiqiang, LI Chuanmin
(College of Biological Engineering, Henan University of Technology, Zhengzhou 450001, China)
Abstract:The inhibitory effect of the polysaccharide secreted by the endophytic fungus Chaetomium JY25 isolated from Gymostamma pentaphyllum on α-glucosidase was explored to provide basic data for the application of this endophytic fungal polysaccharide. To this end, the conditions for colorimetrically detecting α-glycosidase activity using 4-N-trophenyl-α-D-glu-copyranoside (PNPG) as a substrate were optimized and the evaluation of α-glucosidase inhibitory effect was performed using acarbose as a positive control. At the same time, the inhibition type and inhibition constant were determined, and the inhibitory effect of the fungal polysaccharide on α-glycosidase derived from Caco-2 cells was measured in vitro. The results showed the optimum conditions for colorimetric determination of α-glycosidase activity were found to be reaction for 30 min at 44 ℃ with an initial pH of 6.8 and a substrate (PNPG) concentration of 5 mmol/L. The polysaccharide secreted by JY25 at 6.15 mg/mL showed the strongest inhibition against α-glucosidase with a percentage inhibition of 68.21%. The IC 50value of the polysaccharide was (2.46 ± 0.42) mg/mL, and the inhibition constant was 1.15 mg/mL in a competitive manner. The percentage inhibition of α-glycosidase derived from Caco-2 cells cultured for 16 days reached 16.48% in the presence of 10.00 mg/mL JY25 polysaccharide. Therefore, the exopolysaccharide produced by the endophytic fungus JY25 has inhibitory activity on α-glycosidase in vitro in a competitive man ner.
Key words:endophytic fungal polysaccharide; Gynostemma pentaphyllum; α-glycosidase; in hibitory effect
DOI:10.7506/spkx1002-6630-201617012
中图分类号:TS201.1;R285
文献标志码:A
文章编号:1002-6630(2016)17-0070-06
DOI:10.7506/spkx1002-6630-20167012. http://www.spkx.net.cn
收稿日期:2015-11-25
基金项目:河南工业大学基础研究培育计划项目(2014JCYJ10)
作者简介:赵笑笑(1990—),女,硕士研究生,研究方向为营养物质的吸收机制。E-mail:859508860@qq.com
*通信作者:张慧茹(1967—),女,教授,博士,研究方向为动物营养。E-mail:zhr67@163.com
引文格式: