江山白菇F
21品系菇根的生化特性分 析
程小华
1,汪 莹
2,戚琴芹
2,王娅妮
2,赖童飞
2,周 婷
2,*
(1.浙江商业职业技术学院旅游烹饪学院,浙江 杭州 310053;2.杭州 师范大学生命与环境科学学院,农产品质量安全控制技术研究杭州市重点实验室,浙江 杭州 310036)
摘 要:以金属含量、氨基酸组成、差异表达蛋白以及抗氧化酶活性为指标对江山白菇F
21品系菇根的生化组成进行了分析。结果表明:与菇身相比,菇根中粗脂肪、铁、磷以及必需氨基酸中的亮氨酸和赖氨酸含量较低,而灰分、砷、钙和镁元素含量较高;通过菇根与菇身的比较蛋白质组学分析,共鉴定出9 种差异表达蛋白,涉及双组分信号转导系统、乙酰辅酶A代谢、蛋白质合成、乙醛酸及二羧酸代谢、氮代谢多个生物学过程,同时菇根中的菇毒素含量显著低于菇身;货架期菇根中的抗氧化酶活性较低。
关键词:江山白菇F
21品系;菇根;氨基酸组成;比较蛋白质组学;抗氧化酶活性
程小华, 汪莹, 戚琴芹, 等. 江山白菇F
21品系菇根的生化特性分析[J]. 食品科学, 2016, 37(17): 90-95. DOI:10.7506/ spkx1002-6630-201617015. http://www.spkx.net.cn
CHENG Xiaohua, WANG Ying, QI Qinqin, et al. Biochemical properties of fruiting roots of Flammulina velutipes strain Jiangshanbai F
21[J]. Food Science, 2016, 37(17): 90-95. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201617015. http://www.spkx.net.cn
毛柄金钱菌(Flammulina velutipes)俗称金针菇,伞菌目白蘑科金针菇属,因菌柄细长,似金针菜而得名。主要由菇身即子实体(包括菌盖、菌褶及菌柄)和菇根(包括菌丝体及少量菌柄基部)两部分组成。作为一种小型食用菌,金针菇子实体丛生,菌盖滑嫩,不但含有丰富的蛋白质、碳水化合物、粗脂肪,还含有B族维生素、VC、植物血凝素、牛磺酸、香菇嘌呤、麦冬甾醇等营养成分
[1-2],作为高钾低钠食品,金针菇适合高血压、肥胖症患者食用。其富含的赖氨酸、精氨酸以及锌离子有助于儿童智力的发育,含有的火菇素以及金针菇多糖具有抗氧化活性
[3-4],能够增强机体对癌细胞的抗御能力
[5-6],含有的免疫调节蛋白Fip-five对食物过敏性免疫反应和过敏性呼吸道疾病具有预防和治疗作用
[7],此外,金针菇还可以作为高效的工程菌,能将木质纤维素转化为乙醇
[8]。
白金针菇是金针菇的白色变种,其中江山白菇F
21品系是1990年由日本引进,经浙江省江山市食用菌研究所种植改良后获得的抗杂力强、较耐高温的品系,具有菇体长 短整齐、粗细均匀、色泽亮、菇盖小的特点,且种植稳定、产量高,深受市场欢迎
[9]。然而在采收及加工过程中,会产生许多独立的菌柄、菌盖、畸形菇等,尤其是大量的菇根因口感不佳、品相差,多数不经处理而直接被丢弃,既污染环境又造成极大的浪费。因此,本实验通过生化水平的检测,对白金针菇主要栽培品种之一的江山白菇F
21品系的菇根与菇身主要成分进行了比较,研究结果有助于白色金针菇菇根的综合利用及深度开发。
1 材料与方法
1.1 材料与试剂
货架期江山白菇F
21浙江杭州下沙区当地市场。
预制的固相pH梯度(immobilized pH gradient,IPG)胶条、乙基苯基聚乙二醇、苯甲基 磺酰氟、二硫苏糖醇、两性电解质、碘乙酰胺及3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐 美国Bio-Rad公司;邻苯二甲醛、9-芴甲基氯甲酸酯、三乙胺、四氢呋喃及醋酸钠 美国Sigma公司;盐酸、硝酸、苯酚、氯化镁、三羟甲基氨基甲烷盐、β-巯基乙醇、醋酸铵、甲醇、丙酮、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、溴酚蓝、考马斯亮蓝G250、乙二胺四乙酸、聚乙烯吡咯烷酮、氯化硝基四氮唑蓝 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
MDS-2002A型微波消解仪 上海新仪微波化学科技有限公司;IRIS Intrepid型电感耦合全谱直读等离子发射光谱仪 美国Thermo公司;RV8V-C型旋转蒸发仪德国IKA公司;S-433D型全自动氨基酸分析仪德国Sykam公司;PROTEAN i12 IEF Cell型等电聚焦电泳系统、Mini-PROTEAN Tetra Cell型垂直电泳系统、ChemiDoc XRS+Imaging System型凝胶成像系统、SmartSpect
TMPlus Spectrophotometer型分光光度计 美国Bio-Rad公司。
1.3 方法
1.3.1 化学成分检测
水分的测定参见GB 5009.3—2010《食品中水分的测定》
[10];灰分的测定参见GB 5009.4—2010《食品中灰分的测定》
[11];脂肪的测定参见GB/T 5009.6—2003《食品中脂肪的测定》
[12];蛋白质含量的测定参见GB 5009.5—2010《食品中蛋白质的测定》
[13]。
金属含量测定的步骤简述如下:将0.5 g粉碎后的样品与10 mL王水(HCl与HNO
3体积比为3∶1)混合,在消解罐中100 ℃条件下消解2 h,同温度条件下加入3 mL HNO
3消解2 h,120 ℃条件下再加入1 mL HNO
3消解4 h,冷却后超纯水定容至50 mL用于检测,工作参数为:射频功率为1 050 kW,雾化气压力为4.25×10
6Pa,辅助气流速率为110 L/min,样品提升量为1 170 mL/min,样品冲洗时间为1 min,高波扫描为5 s,低波扫描为30 s。
1.3.2 氨基酸组成分析
样品用6 mol/L盐酸(含质量分数2%苯酚)混合,充N
2,熔封,置110 ℃水解20 h。旋转蒸发,加入硼砂缓冲液溶解,利用邻苯二甲醛和9-芴甲基氯甲酸酯衍生化后上样分析。工作参数为:分析柱:Hypersil ODS柱(4.0 mm×125 mm,5 μm);流动相A:20 mmol/L pH 7.6醋酸钠,含体积分数0.018%三乙胺及0.3%四氢呋喃;流动相B:V(100 mmol/L pH 7.2醋酸钠)∶V (CH
3OH)∶V (CH
3CN)=1∶2∶2;流速:1 mL/min;柱温:40 ℃;DAD UV检测器:检测波长338 nm(波谱宽度10 nm),参比波长390 nm(波谱宽度20 nm);检测波长262 nm(波谱宽度16 nm),参比波长324 nm(波谱宽度8 nm)
[14]。
1.3.3 总蛋白提取及双向电泳分析
参照Li Boqiang等
[15]方法,简述如下:取5 g样品在液氮中研磨,加入5 mL蛋白提取缓冲液(0.5 mmol/L pH 8.3 Tris-HCl,体积分数2%乙基苯基聚乙二醇,2 mmol/L氯化镁,体积分数2% β-巯基乙醇,1 mmol/L苯甲基 磺酰氟)和5 mL的pH 8.0 Tris饱和酚,离心保留酚相后加入5 倍体积的0.1 mmol/L醋酸铵-甲醇,离心弃上清,利用醋酸铵-甲醇和丙酮漂洗沉淀,按料液比10∶1(m/V)比例加入裂解缓冲液(2 mmol/L硫脲、7 mmol/L尿素、质量分数1%二硫苏糖醇、体积分数2%两性电解质(pH 3~10),质量分数4% 3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐)。利用IPG非线性胶条(pH 3~10,7 cm)在等电聚焦电泳系统中等电聚焦20 000 V·h;在分别含有二硫苏糖醇和碘乙酰胺的平衡缓冲液(6 mol/L尿素、75 mmol/L pH 8.8 Tris-HCl、体积分数29.3%甘油、2% SDS、0.002%溴酚蓝)中平衡两次;使用垂直电泳系统进行第二向SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE),考马斯亮蓝G250染色。采集图像后,运用双向凝胶电泳图像分析软件Image Master 2D Elite software分析差异表达蛋白。蛋白质的相对表达量以体积分数表示(体积分数指在蛋白点3D图像中按照从蛋白顶端开始计算的位于75%的蛋白点高度的蛋白质边界以上的体积,即该蛋白体积与所有蛋白总体积的百分比)。目标蛋白送往生工生物工程(上海)股份有限公司进行质谱鉴定。
1.3.4 抗氧化酶活性相关指标 检测
参考Lai Tongfei等
[16]的方法:取10 g样品在液氮中研磨,分别加入10 mL 0.l mol/L pH 7.0磷酸钾缓冲液用于过氧化氢酶(catalase,CAT)和过氧化物酶(peroxidase,POD)活力的测定,10 mL 0.l mol/L pH 7.8磷酸钾缓冲液用于超氧化物歧化酶(superoxide dismutase,SOD)活力的测定,缓冲液中均含有1 mmol/L乙二胺四乙酸和2%聚乙烯吡咯烷酮,离心保留上清液即为酶提取液。每个CAT活力单位(U)表示1 min内分解1 μmol H
2O
2;POD活力定义为30 ℃条件下酶提取液中每毫克蛋白质在每分钟内催化反应使体系吸光度变化0.01为一个酶活力单位(U);SOD活力单位以抑制氯化硝基四氮唑蓝光化还原50%时的酶量为一个酶活力单位(U)。
样品总还原力的检测参考Xia Zhenqiang
[17]的方法,取10 g样品在液氮中研磨,加入10 mL 0.2 mol/L pH 6.6磷酸钾缓冲液,离心保留上清液。取1 mL上清液加入2.5 mL 0.2 mol/L pH 6.6磷酸钾缓冲液以及1 mL 1%铁氰化钾,50 ℃孵育20 min后加入2 mL三氯乙酸终止反应,加入1.2 mL 0.1%三氯化铁后25 ℃孵育15 min,检测700 nm波长处的吸光度,同等条件下以去离子水代替氯化铁溶液作为对照组,还原力以样品与对照吸光度的差值表示,差值越高代表样品还原 力越强。
1.4 数据统计与分析
实验中数据为3 个或3 个以上样本平均值,利用SPSS 11.5软件进行分析。比较两个以上数据时,采用单因素方差分析,且先对平均数进行Levene’s等方差性分析。若数据等方差,则用Duncan’s检验进行多重比较;若这些数据不满足等方差,则用Dunnett’s T3检验进行多重比较。P<0.05时差异显著。
2 结果与分析
2.1 菇根生化组成及矿物质元素含量分析
江山白菇F
21品系菇根约占整菇鲜质量的15%~20%,由表1可知,菇根与菇身的蛋白质及粗纤维含量基本一致,菇根的粗脂肪含量约为菇身的一半,灰分含量高于菇身。食品中的矿物质元素及其含量多少与人体诸多代谢功能密切相关,是食品食用价值的重要指标。食品中所含的常量、微量元素能够维系身体正常新陈代谢等生命活动,如钙和磷是组成人体骨骼和牙齿的主要成分;镁是许多酶的激活剂;铁是血红蛋白及某些酶的重要成分;钾是维持体液pH值及渗透压,保持神经和肌肉兴奋性的重要因子;适量锌元素对伤口愈合以及大脑神经系统的健康发挥重要作用。而一些重金属则危害人体健康,诱发疾病,甚至死亡。如砷元素能够引起人的呼吸、神经、生殖、免疫系统的损伤,镉元素则对肾、肺、胃以及骨骼具有破坏作用。通过对这些矿物质元素含量分析表明,菇根与菇身中镉、钾和锌元素含量基本一致,但砷、钙和镁元素含量均高于菇身,铁和磷含量均低于菇身。
表1 江山白菇F
21品系菇根与菇身生化组成和矿物质元素含量分析(x±s,n=3)
Table 1 Biochemical components and metal elements between fruiting bodies and fruiting roots of Jiangshanbai F21 (x ± s, n= 3)
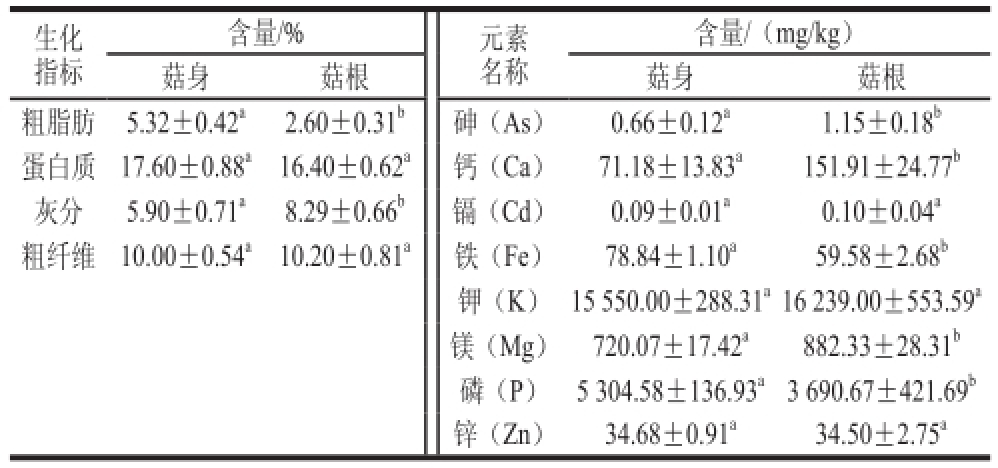
注:同指标同行小写字母不同表示差异显著(P<0.05)。下同。
含量/(m g/kg)菇身菇根菇身菇根粗脂肪5.32±0.42
a2.60±0.31
b砷(As)0.66±0.12
a1.15±0.18
b蛋白质17.60±0.88
a16.40±0.62
a钙(Ca)71.18±13.83
a151.91±24.77
b灰分5.90±0.71
a8.29±0.66
b镉(Cd)0.09±0.01
a0.10±0.04 a粗纤维10.00±0.54
a10.20±0.81
a铁(Fe)78.84±1.10
a59.58±2.68
b钾(K)15 550.00±288.31
a16 239.00±553.59
a镁(Mg)720.07±17.42
a882.33±28.31
b磷(P)5 304.58±136.93
a3 690.67±421.69
b锌(Zn)34.68±0.91
a34.50±2.75
a生化指标含量/%元素名称
2.2 菇根氨基酸组成分析
表2 江山白菇F
21品系菇身与菇根氨基酸含量分析(x±s,n=3)
Table 2 Comparative analysis of amino acid contents between fruiting bodies and fruiting roots of Jiangshanbai F
21(x±s,n=3)%

氨基酸菇身菇根氨基酸菇身菇根天冬氨酸1.12±0.12
a0.87±0.09
b蛋氨酸0.12±0.04
a0.09±0.03
a苏氨酸0.66±0.06
a0.58±0.05
a异亮氨酸0.52±0.07
a0.40±0.06
a丝氨酸0.66±0.04
a0.56±0.05
b亮氨酸0.87±0.11
a0.66±0.08
b谷氨酸2.49±0.13
a2.29±0.10
a酪氨酸0.41±0.06
a0.40±0.08
a脯氨酸0.46±0.06
a0.39±0.04
a苯丙氨酸0.62±0.05
a0.53±0.04
a甘氨酸0.68±0.05
a0.54±0.07
b组氨酸3.02±0.09
a3.88±0.12
b丙氨酸1.04±0.06
a0.90±0.04
b赖氨酸0.66±0.07
a0.50±0.05
b缬氨酸0.70±0.08
a0.58±0.05
a精氨酸0.49±0.06
a0.42±0.04
a
由表2可知,通过对16 种氨基酸相对含量分析发现,共有9 种氨基酸的相对含量在江山白菇F
21品系菇根与菇身中差异不显著,菇根中天冬氨酸、丝氨酸、甘氨酸、丙氨酸、亮氨酸以及赖氨酸相对含量较菇身低,组氨酸相对含量较高。
2.3 菇根与菇身差异表达蛋白分析
总蛋白经双向电泳分离,图谱保持了较高的重复性,蛋白点分布及分散比较均匀。由图1可知,通过Image Master软件分析,以及对软件不能正确识别的蛋白点的手工编辑优化,最终在菇身及菇根蛋白凝胶图谱上分别筛选出92 个和106 个蛋白点用于比较分析,其中有82 个蛋白点在菇身和菇根蛋白凝胶图谱对应位置均能检测到。选择其中14 个相对表达量增加或降低2 倍以上或组织特异表达的蛋白点进行质谱鉴定,除了3 个蛋白点的质谱分析数据不理想外,其余11 个蛋白点在数据库中搜索Mascot值超过阈值,包括在菇身中上调表达的精氨酰tRNA合成酶、谷氨酸草酰乙酸转氨酶AAT1、2-硝基丙烷双加氧酶和跨上皮电阻降低蛋白,下调表达的SERLA73DRAFT 178983和表皮细胞角蛋白2,以及在菇根中表达量极少的Hpt传感系统杂合型组氨酸激酶、LACBIDRAFT 252427、Bicupin草酸脱羧酶氧化酶和NUDIX水解酶(表3)。S9和S10鉴定结果为同一蛋白质,可能该蛋白质存在着翻译后修饰或者具有不同的空间结构。
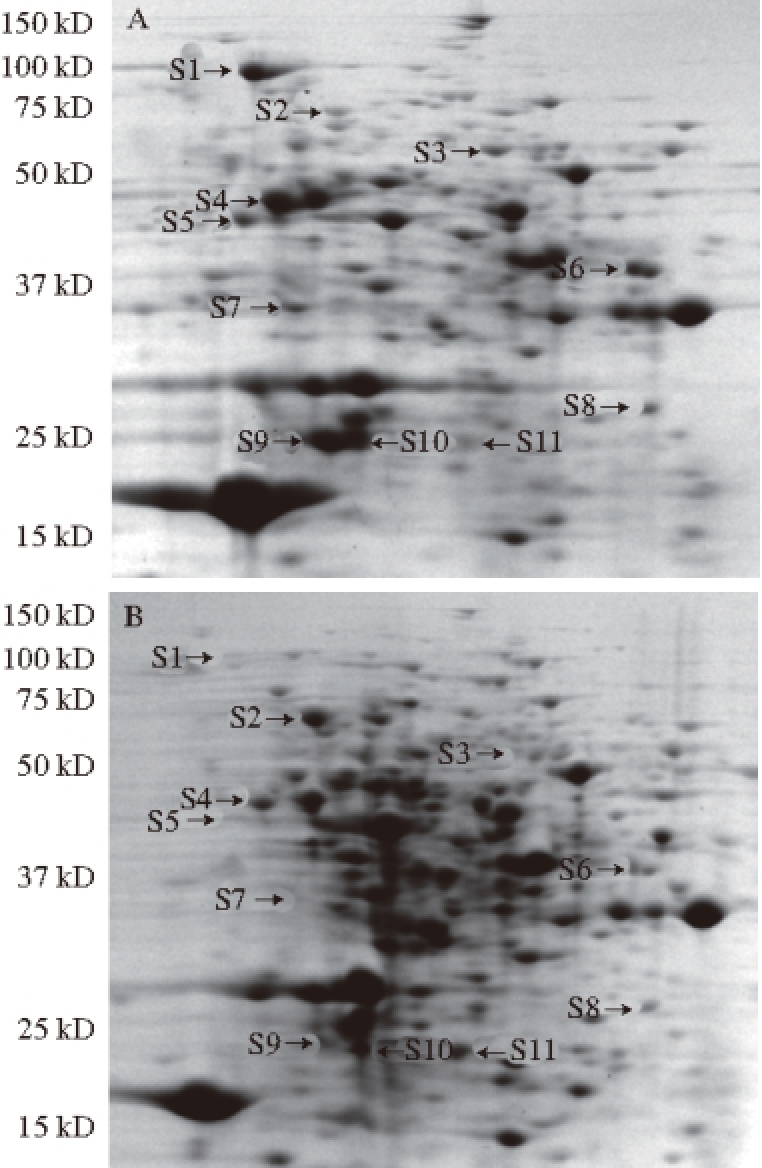
图1 江山白菇F
21品系菇身(A)和菇根(B)总蛋白双向电泳图谱
Fig. 1 Two-dimensional patterns of total proteins between fruiting bodies (A) and fruiting roots (B) of Jiangshanbai F
21
表3 江山白菇F
21品系菇身和菇根中差异表达蛋白质谱鉴定结果
Table 3 Information of differentially expressed proteins between fruiting bodies and fruiting roots of Jiangshanbai F
21evaluated by mass spectrometric analysis

注:a.蛋白编号同图1所示;b.括号外为与蛋白匹配上的肽段数量,括号内为分值超过阈值的肽段数量;NA.无数据(not applicable);SPB.菇身特有点(specifi c point for fruiting body in Jiangshanbai F
21),即表示菇身中检测到但菇根中未检测到的蛋白点。
编号
a蛋白质名称NCBI序号分子质量/D/等电点菇身与菇根蛋白相对表达量比S1 Hpt传感系统杂合型组氨酸激酶gi|50150414080 157/NA66/561(1)SPB S2 SERLA73DRAFT 178983gi|33637263669 635/5.29206/562(2)0.21 S3LACBIDRAFT 252427gi|17010657060 155/6.56383/564(3) SPB S4精氨酰tRNA合成酶gi︱29095737441 059/NA70/561(1)3.83 S5 Bicupin草酸脱羧酶氧化酶gi|39258925648 069/4.54121/562(1)SPB S6谷氨酸草酰乙酸转氨酶AAT1gi|39321807546 078/9.06276/552(2)2.64 S7NUDIX水解酶gi|34500811115 409/NA64/571(1)SPB S8 2-硝基丙烷双加氧酶gi|32126484437 855/8.79103/551(1)2.46 S9跨上皮电阻降低蛋白gi|355118620 314/5.36652/567(7)5.41 S10跨上皮电阻降低蛋白gi|355118620 314/5.36693/567(7)3.01 S11表皮细胞角蛋白2 gi|18140266 110/8.07132/561(1)0.39 Mascot值(阈值)肽段匹配数
b
2.4 菇根抗氧化活性分析
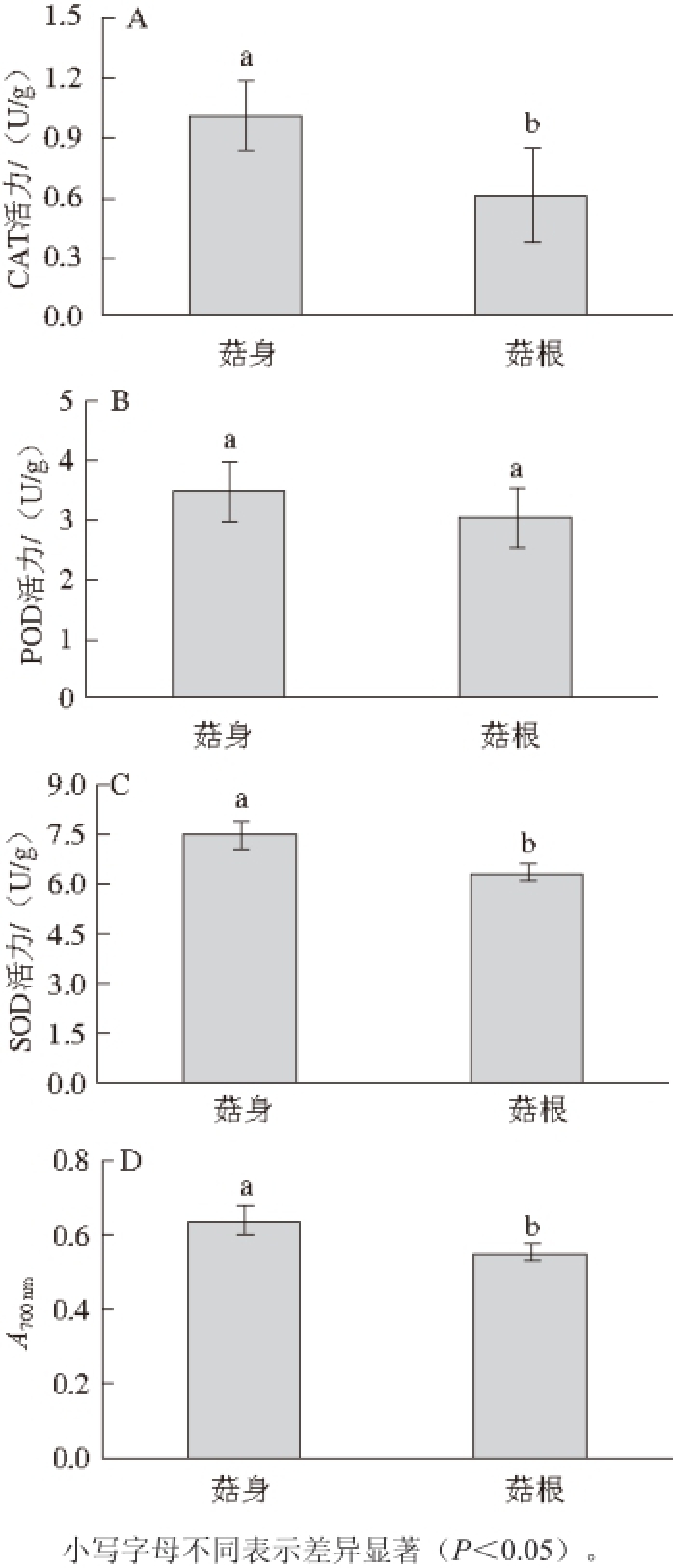
图2 江山白菇F
21品系菇身和菇根CAT (A)、POD(B)、SOD (C)活性及还原力(DD)分析
Fig. 2 Comparative analysis of catalase (A), peroxidase (B), superoxide dismutase (C) activities and reducing power (D) between fruiting bodies and fruiting roots of Jiangshanbai F
21
抗氧化酶活性与金针菇采后品质有着密切的关系,由图2可知,与菇身相比,菇根中CAT和SOD活力较低(图2A、C),POD的活性无明显差异(图2B)。还原力同样是抗氧化活性的重要指标,菇根中还原力低于菇身(图2D)。
3 讨 论
金针菇是一种传统的小型食用菌,具有很高的食用和药用价值,以往的研究多集中于菇身活性物质的分离及其药理性质分析
[18-19],而对菇根的研究鲜有报道。本课题组对江山白菇F
21菇根的生化组成进行了初步分析,研究结果表明菇根中灰分、钙、镁元素含量较高,且粗脂肪含量低于菇身,这些是导致菇根口感较差的主要原因;此外,菇根中砷的含量明显高于菇身,必需氨基酸中的亮氨酸和赖氨酸含量低于菇身,这与张乐
[20]和李学梅
[21]等的研究结果是一致的。
双向电泳结合质谱技术是比较蛋白质组学研究最常用的技术之一,可以对蛋白质组的动态性、多样性、时间性、空间性以及特异性进行分析。本研究对江山白菇F
21菇身和菇根蛋白质组中差异最为显著的14 个蛋白点进行了质谱分析,通过数据库筛选获得了11 个蛋白点(图2、表3)的信息。其中菇根中含量较高的蛋白为S2和S11,S2蛋白(SERLA73DRAFT 178983)位于膜组织,具有酸性磷酸酶活性,但具体功能尚不明晰(http:// www.uniprot.org/uniprot/F8PTE7)。S11蛋白(表皮细胞角蛋白2)为表皮角质蛋白,猜测为实验过程中操作不当引起的污染。菇根中S1、S3、S4、S5、S6、S7、S8、S9和S10蛋白含量较低。S1(Hpt传感系统杂合型组氨酸激酶)是真核双组分信号转导系统的重要组成部分,能够通过磷酸化受体组氨酸位点响应胞外信号,进而做出应答
[22];S3(LACBIDRAFT 252427)在乙酰辅酶A代谢过程中发挥作用,但具体功能尚不清晰
[23];S4(精氨酰tRNA合成酶)具有精氨酸-tRNA连接酶活性,在蛋白质合成过程中将L-精氨酸结合到同源的tRNA上
[24];S5(Bicupin草酸脱羧酶氧化酶)蛋白拥有两个拷贝的Cupin基序,同时具有草酸脱羧酶和氧化酶活性,主要参与乙醛酸及二羧酸代谢
[25];S6(谷氨酸草酰乙酸转氨酶AAT1)能够与磷酸吡哆醛结合,具有转氨酶活性,在以草酰乙酸盐为前体合成天冬酰胺的过程中发挥作用
[26];S7(NUDIX水解酶)蛋白具有保守的23 个氨基酸构成的Nudix基序,在真核、原核生物以及病毒中广泛存在,具有水解焦磷酸酯的活性,作用于结构型二磷酸核苷
[27];S8(2-硝基丙烷双加氧酶)具有双加氧酶活性,能够催化硝基丙烷和氧分子生成丙酮和亚硝酸盐,参与到氮代谢中
[28]。S9和S10蛋白(跨上皮电阻降低蛋白)是一种金针菇毒素,为水溶性非糖基化蛋白,该蛋白无细胞毒性也不会诱导细胞脱离,但可以快速降低跨上皮细胞电阻,提高细胞间紧密连接部位的渗透率。同时有报道表明该蛋白能够引起肠上皮细胞膜孔蛋白的功能紊乱,导致细胞绒毛形态改变并破坏细胞间的正常屏障
[29]。虽然菇身中的金针菇毒素含量更高,但鲜见临床报道过量食用金针菇能够引起肠道疾病,其原因可能是该蛋白为热失活蛋白,而金针菇多为煮熟后食用。以上结果表明,相对于菇身,菇根的代谢水平较低,对外界信号不敏感,不易受外界环境因素的影响。
此外,本研究选用了货架期的江山白菇F
21品系,其光合作用已经停止,呼吸作用成为代谢主导,细胞中氧自由基逐渐积累。尽管菇身与菇根中的POD活性无显著差异,但菇身中对超氧阴离子自由基有清除作用的SOD以及能够清除内源H
2O
2的CAT活性显著高于菇根,同时作为抗氧化活性重要指标的总还原力强于菇根。由此表明,江山白菇F
21品系菇身相对于菇根含水量高,组织细嫩,易受损伤、微生物侵染以及不利环境因素胁迫,需要诱导更多的抗氧化酶减轻氧自由基的伤害,延缓细胞的衰老。综上所述,江山白菇F
21品系菇根和菇身多个生化指标的差异决定了它们的生理指标不同,进而体现出菇身具有更高的食用价值,而菇根的利用应更多集中于生物能量的制备、饲料加工或者菌菇活性物质的提取方面。
参考文献:
[1] 宋爱荣, 郭立忠, 张迎春. 七个白色金针菇品种的氨基酸分析与比较[J]. 食用菌学报, 1996, 3(1): 33-38.
[3] ZHANG Z, LÜ G, HE W, et al. Effects of extraction methods on the antioxidant activities of polysaccharides obtained from Flammulina velutipes[J]. Carbohydrate Polymers, 2013, 98(2): 1524-1531. DOI:10.1016/j.carbpol.2013.07.052.
[4] MA Z, CUI F, GAO X, et al. Purifi cation, characterization, antioxidant activity and anti-aging of exopolysaccharides by Flammulina velutipes SF-06[J]. Antonie van Leeuwenhoek, 2015, 107(1): 73-82. DOI:10.1007/s10482-014-0305-2.
[5] 周萍, 李新胜, 马超, 等. 金针菇的营养成分及药用价值[J]. 中国果菜, 2014, 34(12): 44-47. DOI:10.3969/j.issn.1008-1038.2014.12.013.
[6] ZHAO C, ZHAO K, LIU X, et al. In vitro antioxidant and antitumor activities of polysaccharides extracted from the mycelia of liquidcultured Flammulina velutipes[J]. Food Science and Technology Research, 2013, 19(4): 661-667. DOI:10.3136/fstr.19.661.
[7] WANG P, HSU C, TANG S, et al. Fungal immunomodulatory protein from Flammulina velutipes induces interferon-γ production through p38 mitogen-activated protein kinase signaling pathway[J]. Journal of Agricultural and Food Chemistry, 2004, 52(9): 2721-2725. DOI:10.1021/jf034556s.
[8] MAEHAEA T, ICHINOSE H, FURUKAWA T, et al. Ethanol production from high cellulose concentration by the basidiomycete fungus Flammulina velutipes[J]. Fungal Biology, 2013, 117(3): 220-226. DOI:10.1016/j.funbio.2013.09.005.
[9] 毛日洪, 杨明华, 周建林. 白金针菇F
21出菇管理技术[J]. 中国食用菌, 2015, 18(1): 32-33. DOI:10.13629/j.cnki.53-1054.1999.01.021.
[10] 卫生部. GB 5009.3—2010 食品中水分的测定[S]. 北京: 中国标准出版社, 2010.
[11] 卫生部. GB 5009.4—2010 食品中灰分的测定[S]. 北京: 中国标准出版社, 2010.
[12] 卫生部. 中国国家标准化管理委员会. GB/T 5009.6—2003 食品中脂肪的测定[S]. 北京: 中国标准出版社, 2003.
[13] 卫生部. GB 5009.5—2010 食品中蛋白质的测定[S]. 北京: 中国标准出版社, 2010.
[14] NIE X, ZHANG Q, LIN S. Biogenic amine accumulation in silver carp sausage inoculated with Lactobacillus plantarum plus Saccharomyces cerevisiae[J]. Food Chemistry, 2014, 153(15): 432-436. DOI:10.1016/ j.foodchem.2013.12.093.
[15] LI B, LAI T, QIN G, et al. Ambient pH stress inhibits spore germination of Penicillium expansum by impairing protein synthesis and folding: a proteomic-based study[J]. Journal of Proteome Research, 2010, 9(1): 298-307. DOI:10.1021/pr900622j.
[16] LAI T F, WANG Y Y, LI B Q, et al. Defense responses of tomato fruit to exogenous nitric oxide during postharvest storage[J]. Postharvest Biology and Technology, 2011, 62(2): 127-132. DOI:10.1016/ j.postharvbio.2011.05.011.
[17] XIA Z Q. Preparation of the oligosaccharides derived from Flammulina velutipes and their antioxidant activities[J]. Carbohydrate Polymers, 2015, 118(15): 41-43. DOI:10.1016/j.carbpol.2014.10.074.
[18] 李文香, 樊铭聪, 张圣杰, 等. 金针菇多糖组成的探讨与分析[J]. 中国食用菌, 2015, 34(2): 60-65. DOI:10.13629/ j.cnki.53-1054.2015.02.016.
[19] KANG L, ZENG X, YE Z, et al. Compositional analysis of the fruiting body of transgenic Flammulina velutipes producing resveratrol[J]. Food Chemistry, 2014, 164(1): 211-218. DOI:10.1016/ j.foodchem.2014.05.023.
[20] 张乐, 王赵改, 李鹏, 等. 金针菇不同部位营养成分分析[J]. 河南农业科学, 2015, 44(6): 109-112. DOI:10.15933/j.cnki.1004-3268.2015.06.024.
[21] 李学梅, 李宗义, 单广福, 等. 金针菇蛋白质及氨基酸含量的测定与分析[J]. 中国食用菌,1999, 8(6): 20-22. DOI:10.13629/ j.cnki.53-1054.1999.06.010.
[22] THOMASON P, KAY R. Eukaryotic signal transduction via histidineaspartate phosphorelay[J]. Journal of Cell Science, 2000, 113: 3141-3150.
[23] MARTIN F, AERTSA A, AHRÉN D, et al. The genome of Laccaria bicolor provides insights into mycorrhizal symbiosis[J]. Nature, 2008, 452: 88-92. DOI:10.1038/nature06556.
[24] DELAGOUTTE B, MORAS D, CAVARELLI J. tRNA aminoacylation by arginyl-tRNA synthetase: induced conformations during substrates binding[J]. The EMBO Journal, 2000, 19(21): 5599-5610. DOI:10.1093/emboj/19.21.5599.
[25] SAYLOR B T, REINHARDT L A, LU Z, et al. A structural element that facilitates proton-coupled electron transfer in oxalate decarboxylase[J]. Biochemistry, 2012, 51(13): 2911-2920. DOI:10.1021/bi300001q.
[26] CHAN-HUOT M, DOS A, ZANDER R, et al. NMR studies of protonation and hydrogen bond states of internal aldimines of pyridoxal 5’-phosphate acid-base in alanine racemase, aspartate aminotransferase, and poly-L-lysine[J]. Journal of the American Chemical Society, 2013, 135(48): 18160-18175. DOI:10. 1021/ ja408988z.
[27] MCLENNAN A G. The nudix hydrolase superfamily[J]. Cellular and Molecular Life Sciences, 2006, 63(2): 123-143. DOI:10.1007/s00018-005-5386-7.
[28] HA J H, MIN J Y, LEE S K, et al. Crystal structure of 2-nitropropane dioxygenase complexed with FMN and substrate[J]. The Journal of Biological Chemistry, 2006, 281(27): 18660-18667. DOI:10.1074/jbc. M601658200.
[29] NARAI A, WATANABE H, IWANAGA T, et al. Effect of a poreforming protein derived from Flammulina velutipes on the Caco-2 intestinal epithelial cell monolayer[J]. Bioscience, Biotechnology and Biochemistry, 2004, 68(11): 2230-2238. DOI:10.1271/bbb.68.2230.
Biochemical Properties of Fruiting Roots of Flammulina velutipes Strain Jiangshanbai F
21
CHENG Xiaohua
1, WANG Ying
2, QI Qinqin
2, WANG Yani
2, LAI Tongfei
2, ZHOU Ting
2,*
(1. School of Tourism and Culinary Arts, Zhejiang Business College, Hangzhou 310053, China; 2. Hangzhou Key Laboratory for Safety of Agricultural Products, College of Life and Environmental Science, Hangzhou Normal University, Hangzhou 310036, China)
Abstract:The biochemical properties of fruiting roots of Flammulina velutipes strain Jiangshanbai F
21were evaluated through analysis of metal contents, amino acid composition, differentially expressed proteins and antioxidant enzyme activities in this study. The results showed that fruiting roots contained less crude fats, iron, phosphorus, the essential amino acids leucine a nd lysine, but contained more ash content, arsenic, calcium and magnesium when compared with fruiting bodies. Using comparative proteomics, 9 differentially expressed proteins were identifi ed which participated in multiple biological processes including two-component signal transduction system, acetyl-CoA metabolism, prote in synthesis, glyoxylate and dicarboxylate metabolism, and nitrogen metabolism. Meanwhile, the content of TEER-decreasing protein in fruiting roots was signifi cantly lower than in fruiting bodies. Furthermore, antioxidant enzyme activities in fruiting roots were lower than those in fruiting bodies within the shelf-life period.
Key words:Flammulina velutipes strain Jiangshanbai F
21; fruiting root; amino acid composition; comparative proteomics; antioxidant enzyme activities
DOI:10.7506/spkx1002-6630-201617015
中图分类号:S646.15
文献标志码:A
文章编号:1002-6630(2016)17-0090-06
收稿日期:2015-12-11
基金项目:2014年杭州市科技计划项目(20140432B02);浙江省社科联科普及立项课题(14ZC21);
杭州师范大学本科生创新能力提升工程项目(CX2015098)
作者简介:程小华(1982—),女,讲师,硕士,主要从事食品营养与检测研究。E-mail:675345366@qq.com
*通信作者:周婷(1983—),女,讲师,博士,主要从事农产品贮藏与加工技术研究。E-mail:zt20100061@163.com
DOI:[2] 王泽华. 金针菇食用价值初探[J]. 农产品加工, 2015(3): 47-48. 10.3969/jissn.1671-9646(X).2015.03.01.
引文格式:




