苏现波,尚会霞
(邯郸学院,河北 邯郸 056005)
摘 要:以碱提酸沉法制备的马铃薯淀粉废水蛋白为原料,分别考察了pH值、NaCl浓度和温度对蛋白功能特性(溶解性、持水能力、乳化性及乳化稳定性、起泡性及泡沫稳定性)的影响。结果表明,pH值、NaCl浓度和温度对蛋白的功能特性产生不同程度的影响。在等电点(pH 4.0)时,马铃薯蛋白表现出最低的溶解性、持水性、乳化性、乳化稳定性及起泡性,而泡沫稳定性最好。在较低NaCl浓度(<0.2 mol/L)时,蛋白溶解性、持水能力、乳化性和乳化稳定性随NaCl浓度的增加而提高,而高浓度的NaCl(>0.2 mol/L)对上述性质具有抑制作用;蛋白的起泡性和泡沫稳定性在NaCl浓度为0.4 mol/L时具有最大值。在4~80 ℃范围内,蛋白质的各项功能性质随温度的升高均呈现先增加后降低的趋势,且溶解性、持水性、乳化稳定性、起泡性及泡沫稳定性在40 ℃时最佳,乳化性在60 ℃最佳。
关键词:马铃薯淀粉废水;蛋白质;溶解性;持水性;乳化特性;起泡特性
苏现波, 尚会霞. 马铃薯淀粉废水蛋白的功能特性[J]. 食品科学, 2016, 37(17): 115-120. DOI:10.7506/spkx1002-6630-201617019. http://www.spkx.net.cn
SU Xianbo, SHANG Huixia. Functional properties of protein extracted from potato starch wastewater[J]. Food Science, 2016, 37(17): 115-120. (in Chinese wi th English abstract) DOI:10.7506/spkx1002-6630-201617019. http://www.spkx.net.cn
马铃薯淀粉的生产加工过程中会产生大量高污染废水,平均每生产1 t淀粉将排放20 t左右的废水,其中近1/4为蛋白质溶液,蛋白质溶液中蛋白质含量达0.9%~2.1% [1]。马铃薯蛋白中必需氨基酸平衡优于其他植物蛋白,且蛋白的功效比值(protein efficiency ratio,PER)高达2.3,远高于玉米(1.43)、大米(1.76)、面粉(0.77)、大豆(1.3~1.9)蛋白的PER,是良好的蛋白质来源 [2-4]。因此,不论从改善环境还是实现资源充分利用考虑,对马铃薯淀粉废水蛋白进行提取和利用,都已成为马铃薯淀粉生产工业亟待解决的问题。
对于从马铃薯淀粉废水中提取蛋白质的研究已取得一定成果,采用超滤方法提取蛋白回收率可达80%左右 [1,5]。任琼琼等 [6]采用碱提酸沉法与超滤技术相结合,蛋白回收率高达93.42%。但目前,马铃薯蛋白的利用主要集中在动物饲料的开发上 [7-8],其作为优质蛋白源在食品工业中的利用仍较少见。当应用于食品时,蛋白的功能性质主要包括水合性质(如持水力、溶解度、溶胀性)、蛋白质分子间的相互作用(如沉淀作用、凝胶作用)和表面性质(如乳化性、起泡性)3类。环境因素以及蛋白与其他食品成分间的相互作用均会对蛋白的功能特性形成影响。因此,本实验以碱提酸沉法制备的马铃薯淀粉废水蛋白为原料,分别考察pH值、NaCl浓度和温度对马铃薯蛋白功能特性(溶解性、持水能力、乳化性及乳化稳定性、起泡性及泡沫稳定性)的影响,以期为其进一步开发利用提供理论参考。
1.1 材料与试剂
马铃薯、花生油,购于重庆北碚永辉超市。
氢氧化钠、浓盐酸、冰乙酸、甲醇、氯化钠、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)均为分析纯,购于成都市科龙化工试剂厂。
1.2 仪器与设备
752紫外-可见分光光度计 上海菁华科技仪器有限公司;PHS-25型数显酸度计 雷磁分析仪器厂;QL-901漩涡振荡仪 海门市其林贝尔仪器制造有限公司;JA50002电子分析天平 上海精天电子仪器有限公司;Entrifuge5810型高速离心机 德国Eppendorf公司;金燕FSH-2型可调高速均浆机 江苏大地自动化仪器厂;恒温水浴锅 金坛市富华仪器有限公司。
1.3 方法
1.3.1 马铃薯淀粉废水蛋白粉的制备
采用任琼琼等 [6]的方法,先制备马铃薯淀粉废水,制得废水蛋白含量为(1.60±0.17)%。再按照其最优的碱提酸沉工艺从淀粉废水中提取蛋白质,经冷冻干燥后,得到马铃薯淀粉废水蛋白粉,蛋白质提取率为(54.24±0.43)%。
1.3.2 溶解性测定
参照Partsia [9]、陶健 [10]等的方法,略有改动。称取0.5 g马铃薯蛋白粉加至100 mL水溶液中,分别控制溶液体系为不同的pH值(采用1.0 mol/L HCl和1.0 mol/L NaOH进行调节)、温度(采用冰箱和恒温水浴锅进行控制)和NaCl浓度梯度。将溶液漩涡混合5~7 次,每次约1 min,间隔时间为1 min,放置30 min,使蛋白质充分溶解,5 000 r/min离心20 min后,取上清液,用考马斯亮蓝法 [11]测定上清液中可溶性蛋白质含量,样品中总蛋白质量采用凯氏定氮法测定。溶解度以蛋白质分散度指数来表示,计算见公式(1):
1.3.3 持水能力测定
参照Cao Xiaohong [12]、Bencini [13]等的方法,略有改动。取0.200 g蛋白样品于10 mL试管中,加入2 mL蒸馏水混匀。分别研究pH值、温度和NaCl浓度对蛋白持水性的影响,各因素水平的控制同溶解性一致。将溶液漩涡混合5~7 次,每次约1 min,间隔时间为1 min,静置30 min后,5 000 r/min离心20 min,弃去上清液,将试管倒置于试管架上,下面垫上吸水滤纸,10 min后沥干水分精确称质量,持水能力以1 g蛋白所吸水的质量表示,计算见公式(2):
式中:m 1为吸水后试管与样品的质量/g;m 2为吸水前试管与样品的质量/g;m为样品的质量/g。
1.3.4 乳化性及乳化稳定性的测定
采用Pearce [14]、Mu Taihua [15]等的方法,略有改动。将0.1 g蛋白粉加入至20 mL水溶液中,分别控制溶液体系为不同的pH值、温度和NaCl浓度梯度,实验因素水平的控制同溶解性一致。将溶液漩涡混合5~7 次,每次约1 min,间隔时间为1 min,静置30 min后加入5 mL花生油,在9 500~10 000 r/min条件下高速均质1 min,制成乳状液,从溶液底部吸取乳状液40 µL加入至含有10 mL 1 g/ L SDS溶液的试管中,充分摇匀后,以0.1%的SDS作参比,在500 nm波长处测定吸光度(A 0),室温放置10 min后再次测定吸光度(A t)。乳化性和乳化稳定性的计算见公式(3)、(4):

式中:A 0为初始吸光度;A t为10 min后测得吸光度;t为乳化液放置的时间,10 min。
1.3.5 起泡性及泡沫稳定性
参照Lin [16]、阚健全 [17]等的方法,略有改动。称取0.100 g蛋白粉配制成1 g/100 mL的蛋白溶液,分别控制溶液体系为不同pH值、温度和NaCl浓度梯度,实验因素水平的控制同溶解性一致。室温条件下在高速匀浆机中以9 500~10 000 r/min的转速均质2 min后,迅速移至50 mL量筒中,记录均质停止时的泡沫体积(即整个体积),以及均质停止30、60 min后的泡沫体积,起泡性及泡沫稳定性的计算见公式(5)、(6):

式中:V为均质停止时泡沫的体积/mL;V 0为溶液体积/mL;V t为t时间后泡沫体积/mL。
2.1 马铃薯蛋白的溶解性
马铃薯蛋白的溶解性不仅决定其在食品加工中的利用程度,同时也对起泡性、乳化性等性质有着一定影响,因此本实验首先探讨了pH值、NaCl浓度和温度对马铃薯蛋白溶解性的影响。
2.1.1 pH值对马铃薯蛋白溶解性的影响

图1 pH值对马铃薯蛋白溶解性的影响
Fig. 1 Effect of pH on the solubility of the protein
由图1可知,在NaCl浓度0 mol/L、温度20 ℃,调节pH值范围(2.0~10.0)后静置30 min,蛋白质的溶解度随pH值的升高呈先降低后上升的趋势,当pH 4.0时,蛋白溶解度最低,说明马铃薯蛋白的等电点在pH 4.0附近,此时蛋白质以两性离子存在,总电荷为零,缺乏分子间静电排斥作用,疏水相互作用导致蛋白聚集沉淀,因此溶解度最低。当pH值高于或低于等电点时,蛋白质分别以正或负离子形式存在,分子间以排斥作用为主,因而溶解度升高 [18]。
2.1.2 NaCl浓度对马铃薯蛋白溶解性的影响
盐离子与蛋白质表面的电荷相互作用会产生电荷屏蔽效应,从而改变蛋白的溶解度。在温度20 ℃,调节pH值至6.0后静置30 min,研究NaCl浓度对蛋白质溶解性的影响。由图2可知,NaCl浓度在0~1.0 mol/L范围内,蛋白溶解度随NaCl浓度的增加呈先增加后下降的趋势。当NaCl浓度为0.2 mol/L时,蛋白质溶解度达到最大值;NaCl浓度继续增加时,溶解性降低。这是由于在低盐浓度(<0.2 mol/L)时,盐离子与蛋白质分子上的带电基团相互作用形成双电层,降低蛋白质间的静电作用,增加其溶解性 [19-20];当NaCl浓度增大到一定程度时,盐离子将蛋白质电荷中和,破坏了双电层的水化膜,从而导致蛋白质分子发生聚集而沉淀析出,降低其溶解性 [10]。

图2 NaCl浓度对马铃薯蛋白溶解性的影响
Fig. 2 Effect of NaCl concentration on the solubility of the protein
2.1.3 温度对马铃薯蛋白溶解性的影响

图3 温度对马铃薯蛋白溶解性的影响
Fig. 3 Effect of temperature on protein solubility
由图3可知,在NaCl浓度0 mol/L,pH 6.0,调节不同温度(4~80 ℃)后静置30 min,测得蛋白质的溶解度随温度的升高呈先升高后降低的趋势,在40 ℃时溶解度达到最大值。当温度升至80 ℃时,溶解度由21.65%降至19.86%,溶解度在高温时小幅度降低。这可能是由于蛋白质的结构十分紧密,温度较低时,蛋白质结构未发生变化,蛋白质与水分子间的相互作用则较弱;当温度适当升高时,蛋白质结构发生轻微变化,分子的立体结构伸展,使隐蔽在其内部的肽链和极性侧链暴露,蛋白质分子和水分子相互作用增强 [19];但当温度继续升高,蛋白质分子过度变性,分子内部的疏水基团暴露从而导致分子相互凝结沉淀,最终降低蛋白质的溶解度。
从pH值、NaCl浓度及温度对蛋白溶解度的影响来看,马铃薯蛋白适于在低盐、偏碱类食品等产品中应用。
2.2 持水能力
蛋白质的持水能力与终产品的质量、口感等性质密切相关,分别对pH值、温度和NaCl浓度对蛋白持水能力的影响进行分析。
2.2.1 pH值对马铃薯蛋白持水能力的影响
pH值通过影响蛋白质分子的解离和带电性,从而改变蛋白质分子同水结合的能力,pH值对马铃薯蛋白持水能力的影响如图4所示。与pH值对蛋白溶解性的影响相同,在pH 2.0~10.0范围内,蛋白质的持水能力随pH值的升高呈现先降低后上升的趋势,且当pH 4.0时,蛋白的持水能力最低,为(2.38±0.16) g/g;随着碱性的增强,蛋白质的持水能力增大。这是由于在等电点时,蛋白质的净电荷为零,导致蛋白质与水之间的相互作用减弱,因此蛋白的水合作用最小,持水能力最低;而当pH值高于或低于等电点时,蛋白质以离子形式存在,分子间以排斥作用为主,使蛋白质膨胀并结合更多水分。

图4 pH值对马铃薯蛋白持水能力的影响
Fig. 4 Effect of pH on water-holding capacity of the protein
2.2.2 NaCl浓度对马铃薯蛋白持水能力的影响
盐类和氨基酸侧链基团通常与水发生竞争性结合,不同的盐浓度会导致蛋白质发生盐溶和盐析效应,进而影响蛋白质的持水能力。NaCl浓度对马铃薯蛋白持水能力的影响如图5所示。NaCl浓度在0.0~1.0 mol/L范围内,蛋白质持水能力随NaCl浓度的增加呈先增加后下降的趋势。当NaCl浓度为0.2 mol/L时,马铃薯蛋白的持水能力达到最大值(3.30±0.85) g/g,达到大豆蛋白持水能力的平均水平 [21];随着NaCl浓度继续增加,持水能力下降。这是由于在低浓度盐(<0.2 mol/L)时,中性盐的存在有利于蛋白质与水分的结合,使其持水能力增加;而高浓度盐存在时,盐离子与水竞争结合蛋白基团,削弱了蛋白质与水的结合能力,从而导致蛋白质的持水能力下降 [19,22]。
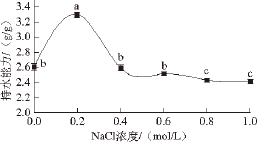
图5 NaCl浓度对马铃薯蛋白持水能力的影响
Fig. 5 Effect of NaCl concentration on water-holding capacity of the protein
2.2.3 温度对马铃薯蛋白持水力的影响
由图6可知,在4~80 ℃范围内,持水能力在40 ℃时最好。在温度低于40 ℃时,适当升温使蛋白质的结构受热而发生解离和伸展,使其隐蔽在内部的肽链和极性侧链暴露,提高蛋白质的持水能力;当温度高于40 ℃时,蛋白质开始发生变性,使得蛋白分子相互凝结而发生沉淀,蛋白质的水合能力随之下降。

图6 温度对马铃薯蛋白持水能力的影响
Fig. 6 Effect of temperature on water-holding capacity of the protein
本实验所得马铃薯蛋白的持水能力明显高于吴海文等 [23]采用碱提酸沉法制备的花生蛋白的持水能力(<2 g/g),可作为添加剂应用于肉制品和焙烤食品中,不仅可改善其风味,还能提高食品的营养价值。
2.3 乳化性
2.3.1 pH值对马铃薯蛋白乳化性的影响

图7 pH值对马铃薯蛋白乳化性及乳化稳定性的影响
Fig. 7 Effect of pH on emulsifying activity and emulsion stability of the protein
由图7可知,蛋白乳化性及稳定性随pH值变化与蛋白溶解性随pH值变化的趋势相似。当pH 2.0~4.0时,乳化性和乳化稳定性均呈降低的趋势;当pH 4.0时,马铃薯蛋白的乳化性和稳定性降至最低,随着pH值进一步升高,两者呈现上升趋势。由2.1.1节分析可知,马铃薯蛋白的等电点为pH 4.0,在等电点附近,蛋白质的净电荷几乎为零,疏水作用导致蛋白的聚集沉淀,不利用蛋白质与油之间的相互作用,乳化性能最低;而当pH值偏离等电点时,蛋白质溶解性提高,向水/油界面扩散能力增强,因而乳化性能升高 [24]。从pH值对蛋白乳化性的影响来看,马铃薯蛋白粉在碱性范围内有较好的乳化性及乳化稳定性。
2.3.2 NaCl浓度对马铃薯蛋白乳化性的影响
由图8可知,NaCl浓度在0~1.0 mol/L范围内,蛋白乳化性和乳化稳定性随NaCl浓度的增加呈先增加后下降的趋势。当NaCl浓度为0.2 mol/L时,蛋白质的乳化性和稳定性均达到最大值;NaCl浓度继续增加,乳化性及其稳定性下降,分别由0.362降至0.168,41.2 min降至17.42 min。这是由于在低浓度盐(<0.2 mol/L)时,中性盐一方面有利于蛋白质与水的结合,另一方面提高了蛋白质的溶解度和伸展度,油滴更易吸附于蛋白表面,使其乳化性得以改善;而高浓度盐存在时,盐离子与蛋白质电荷相结合,使蛋白质分子间因聚集而沉淀析出,进而削弱了蛋白质的乳化性 [10]。

图8 NaCl浓度对马铃薯蛋白乳化性及乳化稳定性的影响
Fig. 8 Effect of NaCl concentration on emulsifying activity and emulsion stability of the protein
2.3.3 温度对马铃薯蛋白乳化性的影响

图9 温度对马铃薯蛋白乳化性及乳化稳定性的影响
Fig. 9 Effect of temperature on emulsifying capacity and emulsion stability of the protein
由图9可知,在4~80 ℃范围内,蛋白质的乳化能力随温度的升高呈先升高后降低的趋势,乳化性和乳化稳定性分别在60、40 ℃时达到了最大值。这是由于适当升高温度,蛋白质受热而发生解离和伸展,有利于蛋白分子吸附在油水两相界面上 [25]。但随着温度的进一步提高,蛋白开始逐渐变性,溶解度降低,且高温降低了吸附界面上蛋白质膜的黏度和硬度,进而降低了乳状液的稳定性 [10]。
马铃薯蛋白在低盐、碱性环境中有较好的乳化性及乳化稳定性,与吴海文等 [23]采用碱提酸沉法制备的花生蛋白乳化性相当,略低于水酶法提取的大豆蛋白 [26]的乳化性,在烤制食品及汤类等食品的制作中,加入马铃薯蛋白作乳化剂可使制品状态稳定。
2.4 起泡性
2.4.1 pH值对马铃薯蛋白起泡性及泡沫稳定性的影响
pH值影响蛋白质的荷电状态,通过改变其溶解度、相互作用力和持水力,进而改变了蛋白质的起泡性和泡沫的稳定性。马铃薯蛋白起泡性及泡沫稳定性与玉米蛋白相当 [27]。由图10可知,马铃薯蛋白溶液在pH 2.0~4.0之间,随着pH值增大,蛋白起泡性由210%下降至155%,但泡沫稳定性增加;在等电点pH 4.0附近,蛋白质的起泡能力最差,泡沫稳定性最高;当继续增加溶液pH值时,蛋白起泡性提高,而泡沫稳定性降低。这是由于在等电点处,蛋白质溶解度最低,导致泡沫数量较少,而未溶解蛋白的粒子通过静电作用吸附于泡沫的两相界面,增加了膜的黏合力和厚度,有利于泡沫的稳定 [23]。当pH值偏离等电点时,蛋白质以离子形式存在,削弱了蛋白质之间的相互作用却增强了蛋白质的伸展性,使得蛋白质能够迅速扩散到空气-液体的接触面上,有利于泡沫的形成 [22]。

图10 pH值对马铃薯蛋白起泡性及泡沫稳定性的影响
Fig. 10 Effect of pH on foaming capacity and foam stability of the protein
2.4.2 NaCl浓度对马铃薯蛋白起泡性及泡沫稳定性的影响

图11 NaCl浓度对马铃薯蛋白起泡性及泡沫稳定性的影响
Fig. 11 Effect of NaCl concentration on foaming capacity and foam stability of the protein
由图11可知,在NaCl浓度为0~1.0 mol/L范围时,马铃薯蛋白的起泡性和泡沫稳定性均随NaCl浓度的升高呈先增加后降低的趋势。当NaCl浓度为0.4 mol/L时,蛋白质的起泡性和泡沫稳定性达到最大。这是由于NaCl影响蛋白质的溶解性、黏度、伸展和聚集,因而能够改变起泡性 [23]。低盐浓度时,未溶解的蛋白质以固体形态存在,液体经过均质,形成了固、液、气三相泡沫,当固液膜的接触面适中时,蛋白可吸附在界面上,阻止气泡的粗化,增强起泡能力;而当NaCl浓度过高时,未溶解蛋白的减少不利于三相泡沫的生成,因此使起泡能力降低 [24,28]。
2.4.3 温度对马铃薯蛋白起泡性及泡沫稳定性的影响

图12 温度对马铃薯蛋白起泡性及泡沫稳定性的影响
Fig. 12 Effect of temperature on foaming capacity and foam stability of the protein
由图12可知,在4~40 ℃内,马铃薯蛋白粉的起泡性和泡沫稳定性均随温度的升高而增加,温度继续上升则起泡性和泡沫稳定性下降。这可能是由于热处理可增加蛋白质的膨胀度和溶解性,因此适当升温有利于蛋白质泡沫的形成;然而温度过高会导致蛋白质溶解度降低,蛋白薄膜的黏度降低,气泡破裂、解体,进而削弱了蛋白质的起泡能力 [10]。
马铃薯蛋白的起泡性和泡沫稳定性与大豆分离蛋白粉 [29]相当,其良好的发泡性可赋予食品疏松的结构和良好的口感,因此可将其添加至蛋糕、冰激凌等泡沫型产品中。
pH值、NaCl浓度和温度均会对马铃薯蛋白的功能性质产生不同程度的影响。在pH 2.0~10.0、NaCl浓度0~1.0 mol/L、温度4~80 ℃范围内,蛋白的溶解性随着pH值的增加呈先降低后升高的趋势,而随NaCl浓度和温度的升高变化趋势相反。在pH 10.0条件下、NaCl浓度为0.2 mol/L和温度为40 ℃时,马铃薯蛋白的溶解度最好。
在不同的pH值、NaCl浓度和温度条件下,马铃薯蛋白持水性的变化趋势与溶解性的变化规律类似。蛋白的持水能力在等电点(pH 4.0)处最差,在温度为40 ℃、NaCl浓度为0.2 mol/L的低盐溶液中持水能力最佳。
马铃薯蛋白在等电点pH 4.0时乳化性和乳化稳定性最差,在远离等电点条件下乳化能力得到提高;在低盐(<0.2 mol/L)环境中,乳化性和稳定性随盐浓度的增加而升高,继续提高溶液中盐浓度,则乳化能力降低;随着温度的升高,蛋白的乳化性和稳定性均呈现先上升后下降的趋势,分别在60 ℃和40 ℃时达到最大值。
马铃薯蛋白在等电点pH 4.0附近起泡性最差,但泡沫稳定性较好;起泡性和泡沫稳定性均随NaCl浓度的增加呈先增加后降低的趋势,在NaCl浓度为0.4 mol/L时起泡性和泡沫稳定性最佳;蛋白起泡性和泡沫稳定性的最佳温度为40 ℃。
参考文献:
[1] 陈钰. 马铃薯淀粉废水中的蛋白回收及表征[D]. 广州: 华南理工大学, 2010: 3.
[2] 刘素稳, 张泽生, 杨海延, 等. 马铃薯蛋白的营养价值评价[J]. 营养学报, 2008, 30(2): 208-210. DOI:10.3321/j.issn:051-7955.2008.02.022.
[3] DESBOROUGH S L. Chapter 10: potato proteins[M]//LI P. Potato physiology. Amecica: Academic Press, 1985: 329-351. DOI:10.1016/ B978-0-12-447660-8.50015-6.
[4] LEINER I E. Nutritional aspects of soy protein products[J]. Journal of the American Oil Chemists’ Society, 1977, 54(6): 454-472. DOI:10.1007/BF02655146.
[5] 高洁. 马铃薯淀粉废水中蛋白质的回收及性质研究[D]. 西安: 陕西科技大学, 2012: 2. DOI:10.7666/d.y2093753.
[6] 任琼琼, 韩佳冬, 陈丽清, 等. 马铃薯淀粉废水中蛋白质的提取研究[J]. 食品工业科技, 2012, 33(14): 293-299. DOI:10.13386/ j.issn1002-0306.2012.14.080.
[7] 吕文博. 从马铃薯淀粉废水中提取饲料蛋白的研究[J]. 工业安全与环保, 2009, 35(7): 9-10. DOI:10.3969/j.issn.1001-425X.2009.07.004.
[8] 唐春红, 余冰, 陈代文. 马铃薯蛋白粉在仔猪上的营养价值评定[J]. 中国饲料, 2007(5): 24-27. DOI:10.3969/j.issn.1004-3314.2007.05.008.
[9] PARTSIA Z, KIOSSEOGLOU V. Foaming properties of potato proteins recovered by complexation with carboxymethylcellulose[J]. Colloids and Surfaces B: Biointerfaces, 2001, 21(1/2/3): 69-74. DOI:10.1016/S0927-7765(01)00185-0.
[10] 陶健, 毛立新, 杨小姣, 等. 荞麦蛋白的功能特性研究[J]. 中国粮油学报, 2005(5): 46-50. DOI:10.3321/j.issn:1003-0174.2005.05.010.
[11] YULIANA M, TRUONG C T, HUYNH L H, et al. Isolation and characterization of protein isolated from defatted cashew nut shell: infl uence of pH and NaCl on solubility and functional properties[J]. LWT-Food Science and Technology, 2014, 55(2): 621-626. DOI:10.1016/j.lwt.2013.10.022.
[12] CAO X H, WEN H B, LI C J, et al. Differences in functional properties and biochemical characteristics of congenetic rice proteins[J]. Journal of Cereal Science, 2009, 50(2): 184-189. DOI:10.1016/ j.jcs.2009.04.009.
[13] BENCINI M C. Functional properties of drum-dried chickpea (Cicer arietinum L.) fl ours[J]. Journal of Food Science, 1986, 51(6): 1518-1521. DOI:10.1111/j.1365-2621.1986.tb13849.x.
[14] PEARCE K N, PKINSELLA J E. Emulsifying properties of food proteins: evalustion of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry, 1978, 26(3): 716-723. DOI:10.1021/ jf60217a041.
[15] MU T H, TAN S S, XUE Y L. The amino acid composition, solubility and emulsifying properties of sweet potato protein[J]. Food Chemistry, 2009, 112(4): 1002-1005. DOI:10.1016/j.foodchem.2008.07.012.
[16] LIN M J Y, HUMBERT E S, SOSULSKI F W. Certain functional properties of sunflower meal products[J]. Journal of Food Science, 1974, 39(2): 368-370. DOI:10.1111/j.1365-2621.1974.tb02896.x.
[17] 阚健全, 陈宗道, 杨辉, 等. 蛋白质溶液表面张力及其与功能性质的关系[J]. 中国粮油学报, 1999, 14(5): 30-33. DOI:10.1017/ S0266078400010713.
[18] 薛蕾, 李大文, 尉芹, 等. 苦杏仁蛋白的功能特性[J]. 食品科学, 2013, 34(7): 70-75. DOI:10.7506/spkx1002-6630-201307016.
[19] 刘用成. 食品生物化学[M]. 北京: 中国轻工业出版社, 2005: 228.
[20] 王璋, 许时婴, 汤坚. 食品化学[M]. 北京: 中国轻工业出版社, 2003: 154-156.
[21] 华欲飞, 顾玉兴. 大豆蛋白的吸水和持水性能[J]. 中国油脂, 1999, 24(4): 64-67. DOI:10.3321/j.issn:1003-7969.1999.04.026.
[22] RAGAB D D M, BABIKER E E, ELTINAY A H. Fractionation, solubility and functional properties of cowpea (Vigna unguiculata) proteins as affected by pH and/or salt concentration[J]. Food Chemistry, 2004, 84(3): 207-212. DOI:10.1016/S0308-8146(03)00203-6.
[23] 吴海文, 王强, 马铁铮. 不同制备方法对花生蛋白功能性质的影响[J].农业工程学报, 2009, 25(4): 304-308.
[24] LINARES E, LARRE C, LEMESTE M, et al. Emulsifying and foaming properties of gluten hydrolysates with an increasing degree of hydrolysis: role of soluble and insoluble fractions[J]. Cereal Chemistry, 2000, 77(4): 414-420. DOI:10.1094/CCHEM.2000.77.4.414.
[25] PRAKASH V, NANDI P K. Isolation and characterization of a-globulin of sesame seed (Sesamum indicum L.)[J]. Journal of Agricultural and Food Chemistry, 1978, 26(2): 320-323. DOI:10.1021/jf60216a043.
[26] 杨柳, 江连洲, 李杨, 等. 水酶法提取的大豆蛋白功能特性研究[J].食品与发酵工业, 2010, 36(6): 80-84. DOI:10.13995/j.cnki.11-1802/ ts.2010.06.013.
[27] 周清涛. 玉米蛋白粉改性技术及其理化特性的研究[D]. 长春: 吉林农业大学, 2011: 39.
[28] 刘邻渭. 食品化学[M]. 北京: 中国农业出版社, 2000: 251-252.
[29] PETRUCCEL S, AÑÓN M C. Relationship between the method of obtention and the structural and functional properties of soy protein isolates surface properties[J]. Journal of Agricultural and Food Chemistry, 1994, 42(10): 2170-2176. DOI:10.1021/jf00046a018.
Functional Properties of Protein Extracted from Potato Starch Wastewater
SU Xianbo, SHANG Huixia
(Handan College, Handan 056005, China)
Abstract:The effects of pH, NaCl concentration and temperature on functional properties (solubility, water-holding capacity (WHC), emulsifying activity (EA), emulsifying stability (ES), foaming capacity (FC) and foam stability (FS)) of protein extracted by alkali from potato starch wastewater and precipitated by acid were investigated. The results showed that functional properties of potato protein were affected by pH, NaCl concentration and temperature to different extents. Solubility, WHC, EA, ES and FC were the lowest at its isoelec tric point (pH 4.0), while FS exhibited the best properties. Solubility, WHC, EA and ES were improved by increasing NaCl concentration (0–0.2 mol/L), but inhibited by higher NaCl concentration (> 0.2 mol/L). On the other hand, FC and FS reached their maximum values at NaCl concentration of 0.4 mol/L. As temperature increased from 4 to 80 ℃, all functional properties increased at fi rst and decreased later. Potato protein exhibited the highest solubility, WHC, ES, FC and FS at 40 ℃ and best EA at 60 ℃.
Key words:potato starch wastewater; protein; solubility; water-holding capacity; emulsifying properties; foaming properties
DOI:10.7506/spkx1002-6630-201617019
中图分类号:TS215
文献标志码:A
文章编号:1002-6630(2016)17-0115-06
收稿日期:2015-10-15
作者简介:苏现波(1978—),男,讲师,硕士,研究方向为功能性食品。E-mail:287837669@qq.com
引文格式: