抗孔雀石绿单链抗体-碱性磷酸酶融合表达和活性鉴定
伍伟健,董洁娴,饶美芳,詹屋强,王 弘*,孙远明
(广东省食品质量安全重点实验室,华南农业大学食品学院,广东 广州 510642)
摘 要:采用重叠延伸的方法成功将抗孔雀石绿(malachite green,MG)单克隆细胞的轻链VL和重链VH用连接肽(Gly
4Ser)
3连接,形成单链抗体(single chain variable fragment,scFv)基因,并将其酶切连接进入含有碱性磷酸酶(alkaline phosphatase,PhoA)基因的载体plip6/GN中,成功构建重组质粒plip6/GN-MG-scFv。随后重组质粒转入大肠杆菌BL21,经诱导表达后,十 二烷基硫酸钠-聚丙烯酰胺凝胶电泳和Western blotting鉴定结果表明所获得的融合蛋白scFv-PhoA大小约72 kD。利用scFv与MG特异性结合的活性和PhoA催化对硝基苯磷酸二钠的显色机制,经过直接竞争酶联免疫吸附法测定融合蛋白scFv-PhoA的IC
50为9.81 ng/mL。本方法操作简单、灵敏度高且检测时间短,这为进一步进行MG免疫法快速检测提供了参考。
关键词:孔雀石绿;单链抗体;碱性磷酸酶;融合表达;直接竞争酶联免疫吸附法
伍伟健, 董洁娴, 饶美芳, 等. 抗孔雀石绿单链抗体-碱性磷酸酶融合表达和活性鉴定[J]. 食品科学, 2016, 37(17): 121-126.
WU Weijian, DONG Jiexian, RAO Meifang, et al. Fusion expression and characterization of single chain antibody against malachite green-alkaline phosphatase[J]. Food Science, 2016, 37(17): 121-126. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201617020. http://www.spkx.net.cn
孔雀石绿(malachite green,MG)是一种禁止使用的水产添加物。它在水生生物中残留时间长、毒性强,对人体具有致癌、致畸和致突变等副作用
[1-3]。很多国家已严令禁止其添加使用于水产生物中。但是,因其抑菌作用好、价格便宜,违禁乱用的现象仍时有发生。为有效控制其滥用情况,有必要对其进行持续的监控检测。
免疫检测方法具有快速、灵敏的特点,是一种高通量的筛选手段
[4-6]。其中,制备高质量的抗体是关键
[7]。作为第三代抗体——基因工程抗体,其具有制备周期短、花费少的优点。此外,基因工程抗体可对序列进行分析、修饰、突变以改进抗体亲和力
[8-10],突破以往仅局限于半抗原分子设计的限制
[11],具有更多的灵活性。因此,基因工程重组抗体逐渐成为各国科研学者研究的重点
[12-16]。
碱性磷酸酶(alkaline phosphatase,PhoA)是免疫检测中常用的标记酶之一。目前已有不少学者报道将重组抗体与PhoA融合表达,利用PhoA的显色活性,将其应用于酶联免疫检测方法中
[17-19],可以避免使用二抗,减少操作步骤,更加经济省时。
本研究拟进行抗MG单链抗体(single chain variable fragment,scFv)和PhoA融合蛋白的制备、表达和活性鉴定——从分泌抗MG抗体的单克隆细胞中,扩增抗体重链可变区(variable region of heavy chain,简称VH)基因和轻链可变区(variable region of light chain,简称VL)基因,利用重叠延伸聚合酶链式反应(polymerase chain reaction,PCR)的方法将VH和VL用连接肽(Gly
4Ser)
3连接,酶切连接进入载体plip6/GN,转化进入大肠杆菌BL21融合表达scFv-PhoA,利用PhoA的显色机制鉴定重组蛋白的活性,从而为后续建立基于基因工程抗体的MG快速免疫检测方法提供参考。
1 材料与方法
1.1 材料与试剂
抗MG单克隆杂交瘤细胞株由广东省食品质量安全重点实验室制备;plip6/GN载体和大肠杆菌BL21由广东省食品质量安全重点实验室保存。
plip6/GN载体包含有一个PhoA基因,在其前面有酶切位点SfiⅠ和NotⅠ,通过这两个酶切位点可以将目的片段连接进入载体,并且在异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)诱导下,tac启动子能够使目的片段和PhoA融合表达
[17,20]。
Trizol试剂 日本TaKaRa公司;cDNA第一链合成试剂盒 美国Promega公司;限制性内切酶、T4 DNA连接酶 美国Thermo公司;质粒提取试剂盒、DNA切胶回收试剂盒 天根生化科技有限公司;抗PhoA抗体 美国Sigma公司;引物由上海Invitrogen公司合成。
1.2 仪器与设备
PCR扩增仪、GDS7500型凝胶成像系统、半干转印仪 美国Bio-Rad公司;5417R台式高速冷冻离心机德国Eppendorf公司;SW-CJ-IF型净化工作台 苏州净化设备厂;Multiskan MK3酶标仪 美国Thermo公司。
1.3 方法
1.3.1 RNA的提取
将培养好的约1×10
7个/mL杂交瘤细胞液于2 000 r/min离心2 min,弃上清后加入2 mL Trizol试剂,将此溶液各1 mL分装在两个1.5 mL无RNAase的离心管中,分别加入200 μL氯仿,剧烈振荡15 s,室温放置3 min后,4 ℃、12 000 r/min离心15 min(样品会分为3 层,上层水相含RNA、中间为蛋白质和DNA复合物、下层为有机相),小心吸取上层溶液,放到新的1.5 mL离心管中,加入等体积异丙醇,室温放置10 min,4 ℃、12 000 r/min离心15 min,用1 mL 75%乙醇洗涤沉淀,4 ℃、5 000 r/min离心5 min,弃上清液,干燥沉淀,用焦碳酸二乙酯(diethy pyrocarbonate,DEPC)处理过的无菌水溶解。
1.3.2 VH和VL基因片段的扩增
cDNA第一链的合成按照试剂盒说明书进行。VH、VL基因的扩增:参考Krebber等
[21]设计的引物,将轻链上下游引物和重链上下游引物一一配对,进行PCR反应。PCR反应体系如下:分别取cDNA第一链反应物2 μL、10×PCR Buffer 5 μL、dNTP(2.5 mmol/L)4 μL、VH(或VL)上下游引物各1 μL、无菌纯水37 μL。反应条件:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火1 min,72 ℃延伸1 min,30 个循环,72 ℃延伸10 min。产物经琼脂糖凝胶电泳及DNA凝胶回收纯化,连接到T载体上测序。将测序结果上传至IMGT网站进行分析
[22]。
1.3.3 scFv的构建
根据分析后的VH和VL序列设计引物(表1)。用引物VH-back和VH-linker、VL-linker和VL-for分别扩增VH和VL,PCR反应条件如下:94 ℃预变性5 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,30 个循环,最后72 ℃延伸10 min,获得带有酶切位点和Linker的PCR产物VH和VL。再将两者以质量比1∶1混合,加入包含有dNTP、Pfu酶的反应体系中,PCR反应条件为:94 ℃预变性5 min,然后94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,9 个循环,最后72 ℃延伸10 min。直接以此PCR产物为模板,以VH-back和VL-for为引物进行扩增,反应条件:94 ℃预变性5 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,30 个循环,最后72 ℃延伸10 min。将PCR产物连接到T载体上,测序验证。
表1 重叠延伸PCR引物序列
Table 1 Primers used for overlap extension PCR

注:划横线部分为酶切位点。
引物序列(5’→3’)VH-back GTGGCATCGCGGCCGCACGTTTTATTTCCAACTTTG TAGTGCGGCCCAGCCGGCCGATGTAAAGCTTCAGGAGTC VH-linkerGCCAGAGCCACCTCCGCCTGAACCGCCTCCACCCGAGGAGACGGTGACTGAGGT VL-linkerGGCGGAGGTGGCTCTGGCGGTGGCGGATCGGACATTGTTCTCAACCAGTC VL-for
1.3.4 表达质粒plip6/GN-MG-scFv构建
用引物VH-back和VL-for扩增测序成功的scFv基因。用 Sfi Ⅰ和 NotⅠ限制性内切酶对PCR产物的scFv基因片段进行双酶切,用T4 DNA连接酶将酶切后的scFv基因和用同样的酶处理过的载体plip6/GN(图1)进行连接,并将连接产物转化进入大肠杆菌BL21。挑克隆菌落进行PCR验证,并测序鉴定。

图1 重组质粒构建流程
Fig. 1 Schematic diagram of recombinant plasmid construction
1.3.5 重组蛋白的表达、鉴定
重组蛋白表达:挑取单菌落,接种到5 mL的2×YT培养基(含50 μg/mL氨苄青霉素)中,37 ℃、250 r/min培养过夜。次日,以2%的接种量转接到100 mL的2×YT培养基(含50 μg/mL氨苄青霉素)中,37 ℃、250 r/min培养,直至光密度(OD
600
nm)值为0.8~1.0,加入IPTG使其终浓度为1 mmol/L,28 ℃、250 r/min培养6 h,离心,收集上清液和沉淀。
重组蛋白鉴定:用冷冻法提取周质蛋白
[23]。对表达的scFv进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)和Western blotting鉴定,Western blotting的抗体采用鼠源的抗PhoA抗体。
1.3.6 重组蛋白的活性鉴定(竞争酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)法)
用碳酸盐溶液(pH 9.0)稀释包被原MG-卵白蛋白(ovalbumin,OVA)(MG与OVA偶联)至1 μg/mL,每孔加入100 μL,37 ℃孵育12 h。洗涤两次后,每孔加入120 μL含质量分数5%的脱脂奶粉的封闭液,37 ℃封闭3 h。弃封闭液后,每孔加入50 μL不同质量浓度的MG标准物,随后每孔再加入一定质量浓度的重组抗体scFv-PhoA 50 μL,37 ℃放置1 h。洗涤5 次后,加入PhoA底物对硝基苯磷酸二钠,37 ℃放置30 min。最后加入100 μL 3 mol/L氢氧化钠终止反应,在405 nm波长处测定吸光度。根据MG的不同质量浓度和其对应的吸光度,用Origin 8.5软件可以拟合出一条曲线,并且计算出MG的半抑制浓度(IC
50)(半抑制浓度定义为最大吸光度下降50%时对应的标准品质量浓度)。
2 结果与分析
2.1 VH和VL基因片段的扩增结果
将引物以一对一配对的形式,分别进行PCR扩增,用琼脂糖凝胶电泳检测扩增结果。抗体VH和VL的可变区基因大小约300 bp,因此将PCR产物凝胶电泳在300 bp出现的条带切胶回收,并将其分别连接T载体,依次测序,
并将序列上传至IMGT网站进行比对分析,确定合适的序列VH(351 bp)和VL(327 bp)(图2)。

图2 VH(a)和VL(b)的碱基序列和氨基酸序列
Fig. 2 Sequences of DNA and amino acids for VH (a) and VL (b)
2.2 重组质粒plip6/GN-MG-scFv的构建
根据分析的序列,设计重叠延伸PCR引物(表1),将VH和VL用连接肽(Gly
4Ser)
3连接起来。先用分别带有酶切位点和连接肽的引物(VH-back和VH-linker、VL-linker和VL-for)对VH和VL基因分别进行PCR扩增,获得带有酶切位点和部分Linker序列的PCR产物(图3泳道1、2)。将PCR产物以质量比1∶1的形式混合,进行9 个循环的PCR,VH和VL的第一轮PCR产物会利用互补序列,互为模板,进行少量扩增。最后,再加入引物VH-back和VL-for,以第二轮PCR产物为模板,进行扩增,获得带有酶切位点的全长scFv序列(图3泳道3)。用Sfi Ⅰ和 NotⅠ限制性内切酶将第三轮的PCR产物进行双酶切,连接到载体plip6/GN,转化进入大肠杆菌BL21。测序结果证明,重组质粒plip6/GN-MG-scFv构建成功。
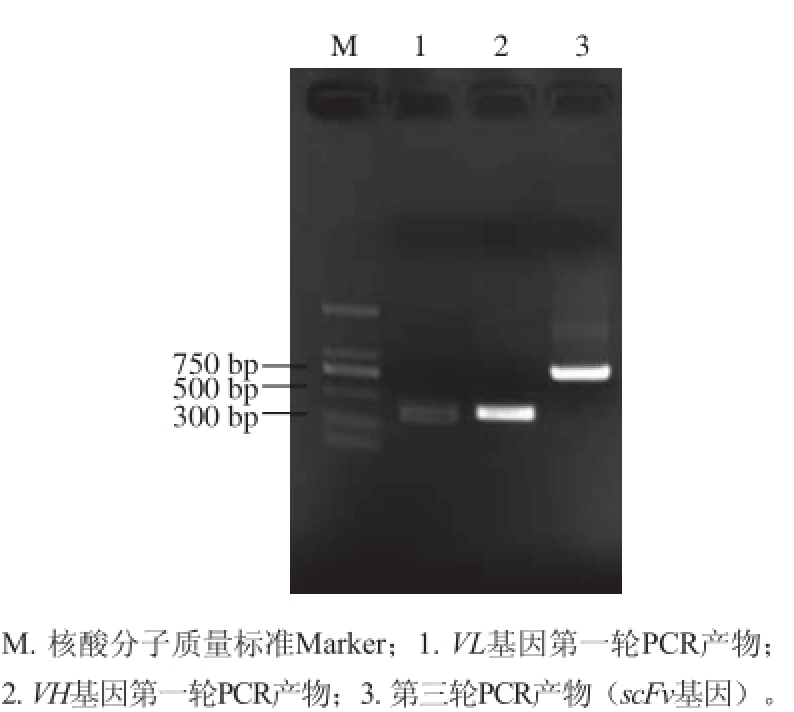
图3 重叠延伸PCR产物电泳结果
Fig. 3 Electrophoregram of overlap extension PCR products
2.3 重组蛋白scFv-PhoA的表达鉴定
挑测序成功的单菌落,进行IPTG诱导表达,提取周质蛋白,并进行SDS-PAGE和Western blotting的分析。根据序列预测,scFv-PhoA融合蛋白分子质量约为72 kD。如图4a所示,泳道2(诱导周质蛋白)上在70~100 kD之间有一条带,而作为对照的泳道1(未诱导的周质蛋白)没有,初步判定这是表达的目的蛋白。为进一步验证,对样品进行Western blotting鉴定,抗体使用鼠源的抗PhoA抗体,二抗使用标记辣根过氧化物酶的羊抗鼠抗体,经过二氨基联苯胺(辣根过氧化物酶底物)显色液显色,泳道2出现明显的单一条带(图4b),而泳道1(图4b)未诱导的周质蛋白未出现条带,显然重组蛋白表达成功。
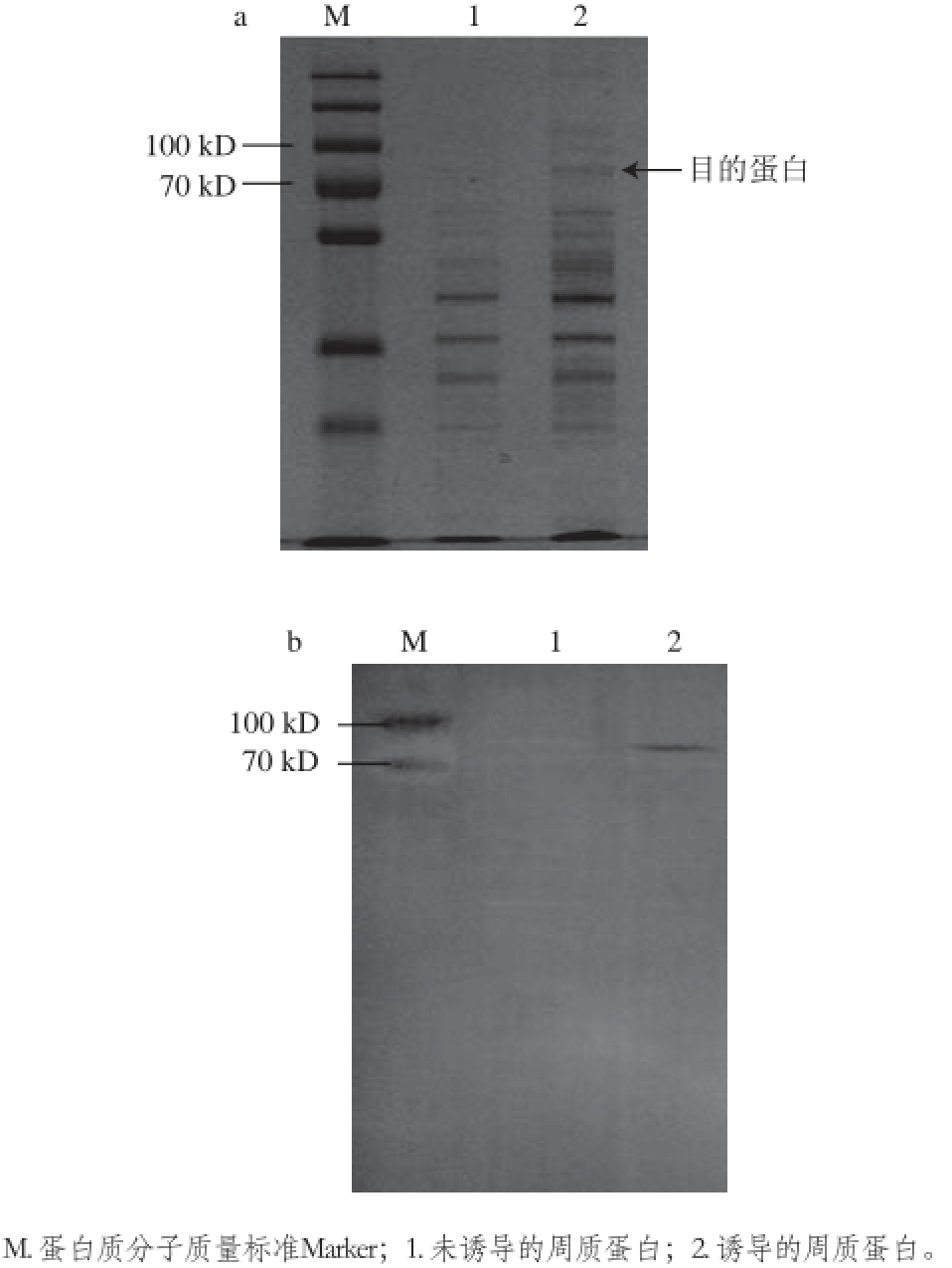
图4 重组蛋白SDS-PAGE(a)和Western blotting(b)结果
Fig. 4 Electrophoregram (a) and Western blotting pattern (b)
2.4 重组蛋白活性鉴定结果
通过固定的包被原MG-OVA和游离的MG对scFv-PhoA蛋白进行竞争,包被原的浓度固定,游离的MG质量浓度越高,结合在包被原上的scFv-PhoA蛋白越少,通过PhoA催化的底物反应越少,吸光度越低。
根据MG的不同质量浓度和其对应的吸光度,以质量浓度为横坐标,A/A
0值(A
0是MG质量浓度为0 ng/mL时的吸光度,A为MG某一质量浓度下的吸光度)为纵坐标,用Origin 8.5软件可以拟合出一条曲线(图5),并计算IC
50(A/A
0=0.50)值,以IC
50值反映方法的灵敏度,IC
50值越小,灵敏度越高
[24]。由图5可知,随着MG质量浓度的增加,A/A
0值均呈显著下降趋势,表明包被原MG-OVA和游离的MG都能与scFv-PhoA蛋白特异性结合。Origin 8.5软件拟合结果显示,IC
50值为9.81 ng/mL,最低检测限为1.34 ng/mL,表明根据scFv-PhoA建立的竞争ELISA法有较好的灵敏度。
和单克隆抗体抑制曲线(图5)的IC
50值(3.27 ng/mL)相比,scFv的灵敏度略有下降,可能是scFv和抗原的亲和力发生改变所致。Kramer等
[25]对基因工程抗体亲和力改变的原因进行过讨论,可能是因为基因工程抗体(scFv或者Fab)是单价的(一价位为一个抗原结合位点),而单克隆抗体(双价的IgG、四价的IgA和十价的IgM)都是多价的。基因工程抗体的抗原结合位点的减少导致了亲和力的改变。
虽然与对应的单抗相比,scFv灵敏度略有下降,但是scFv能在大肠杆菌中表达,无需细胞培养,可节约成本和大量生产时间,而亲和力则可通过后续基因的修饰、突变进行改进。因此,在免疫检测中,基因工程抗体仍然具有很大的研究价值。
而本研究另一个创新点是将scFv和PhoA融合表达成为一个蛋白,当竞争反应完毕,就可以直接利用PhoA的催化活性进行显色反应,无需加入二抗这一步骤,全过程反应时间约80 min,与普通单抗的间接竞争ELISA(约需130 min
[19])相比,操作步骤更简单,用时更短,为进一步进行MG免疫法快速检测提供了参考。
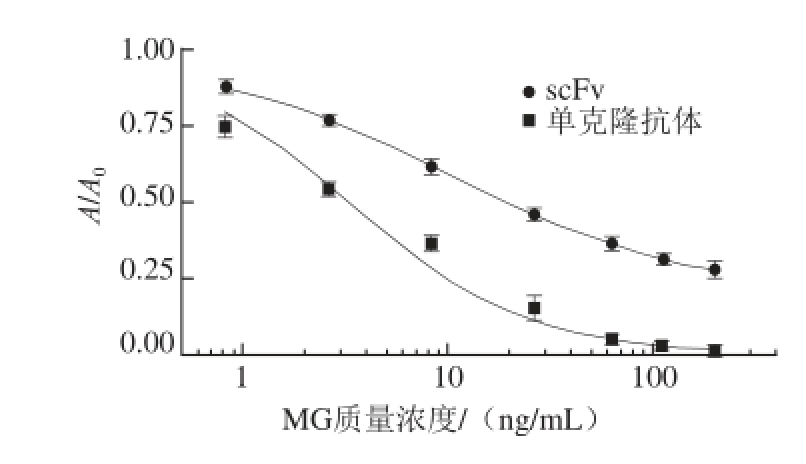
图5 单克隆抗体抑制曲线
Fig. 5 Standard inhibition curves
3 结 论
本研究成功地克隆出抗MG单克隆抗体的VL和VH可变区基因,并用重叠延伸的方法和酶切方法成功构建含有PhoA基因的重组质粒plip6/GN-MG-scFv。诱导表达,获得融合蛋白scFv-PhoA,利用SDS-PAGE和Western blotting法鉴定重组蛋白的表达,用直接竞争ELISA法鉴定重组蛋白的活性。实验结果表明,融合蛋白scFv-PhoA与MG具有良好的结合活性,为以后建立更省时的ELISA快速检测法提供了参考。
基于scFv-PhoA,不仅可以建立“一步法”直接竞争ELISA,且可以通过酶的显色反应,搭建一种新的快速检测试纸条。相比于酶标抗体,scFv-PhoA融合蛋白具有以下两方面优势:1)使用工程菌基因工程抗体的制备周期短、成本低,利于市面上产品的推广;2)在抗体制备过程中,scFv与PhoA融合表达,省却酶标记抗体步骤,使试纸条的制备更快捷。
参考文献:
[1] PLAKAS S M, SAID K R E, STEHLY G R, et al. Uptake, tissue distribution, and metabolism of malachite green in the channel catfi sh (Ictalurus punctatus)[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1996, 53(6): 1427-1433. DOI:10.1139/f96-061.
[2] CULP S J, MELLICK P W, TROTTER R W, et al. Carcinogenicity of malachite green chloride and leucomalachite green in B6C3F1 mice and F344 rats[J]. Food and Chemical Toxicology, 2006, 44(8): 1204-1212. DOI:10.1016/j.fct.2006.01.016.
[3] CULP S J, BELAND F A, HEFLICH R H, et al. Mutagenicity and carcinogenicity in relation to DNA adduct formation in rats fed leucomalachite green[J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis 8
thInternational Conference on Carcinogenic/Mutagenic N-Substituted Aryl Compounds, 2002, 506/507: 55-63. DOI:10.1016/S0027-5107(02)00152-5.
[4] SAMARAJEEWA U, WEI C I, HUANG T S, et al. Application of immunoassay in the food industry[J]. Critical Reviews in Food Science and Nutrition, 1991, 29(6): 403-434. DOI:10.1080/10408399109527535.
[5] SHERRY J. Environmental immunoassays and other bioanalytical methods: overview and update[J]. Chemosphere, 1997, 34(5/6/7): 1011-1025. DOI:10.1016/S0045-6535(97)00403-7.
[6] FARRÉ M, KANTIANI L, BARCELÓ D. Advances in immunochemical technologies for analysis of organic pollutants in the environment[J]. TrAC Trends in Analytical Chemistry, 2007, 26(11): 1100-1112. DOI:10.1016/j.trac.2007.10.004.
[7] van EMON J M. Bioanalytical methods for food contaminant analysis[J]. Journal of AOAC International, 2010, 93(6): 1681-1691.
[8] HUST M, JOSTOCK T, MENZEL C, et al. Single chain Fab (scFab) fragment[J]. BMC Biotechnology, 2007, 7: 1-15. DOI:10.1186/1472-6750-7-14.
[9] QUINTERO-HERNANDEZ V, JUAREZ-GONZALEZ V R, ORTIZLEON M, et al. The change of the scFv into the Fab format improves the stability and in vivo toxin neutralization capacity of recombinant antibodies[J]. Molecular Immunology, 2007, 44(6): 1307-1315. DOI:10.1016/j.molimm.2006.05.009.
[10] WEISSER N E, HALL J C. Applications of single-chain variable fragment antibodies in therapeutics and diagnostics[J]. Biotechnology Advances, 2009, 27(4): 502-520. DOI:10.1016/ j.biotechadv.2009.04.004.
[11] 张小莺, 赵津子, 陈琛, 等. 半抗原免疫分析在食品安全检测中的应用[J]. 食品科学, 2010, 31(17): 397-401.
[12] PLANA E, MORENO M, MONTOYA Á, et al. Development and application of recombinant antibody-based immunoassays to tetraconazole residue analysis in fruit juices[J]. Food Chemistry, 2014, 143(2): 205-213. DOI:10.1016/j.foodchem.2013.07.121.
[13] DUCANCEL F, GILLET D, CARRIER A, et al. Recombinant colorimetric antibodies: construction and characterization of a bifunctional F(ab)2/alkaline phosphatase conjugate produced in Escherichia coli[J]. Biotechnology, 1993, 11(5): 601-605. DOI:10.1038/nbt0593-601.
[14] YAU K Y, LEE H, HALL J C. Emerging trends in the synthesis and improvement of hapten-specific recombinant antibodies[J]. Biotechnology Advances, 2003, 21(7): 599-637. DOI:10.1016/S0734-9750(03)00104-6.
[15] KRAMER K, FIEDLER M, SKERRA A, et al. A generic strategy for subcloning antibody variable regions from the scFv phage display vector pCANTAB 5 E into pASK85 permits the economical production of Fab fragments and leads to improved recombinant immunoglobulin stability[J]. Biosensors and Bioelectronics, 2002, 17(4): 305-313. DOI:10.1016/S0956-5663(01)00292-5.
[16] DAN Z, TAN Z, XIA H, et al. Construction and expression of D-dimer and GPIIb/IIIa single-chain bispecific antibody[J]. Experimental & Therapeutic Medicine, 2013, 6(2): 552-556. DOI:10.3892/ etm.2013.1132.
[17] MOUSLI M, TURKI I, KHARMACHI H, et al. Recombinant singlechain Fv antibody fragment-alkaline phosphatase conjugate: a novel in vitro tool to estimate rabies viral glycoprotein antigen in vaccine manufacture[J]. Journal of Virological Methods, 2007, 146(1/2): 246-256. DOI:10.1016/j.jviromet.2007.07.015.
[18] DONG J, LI Z, LEI H, et al. Development of a single-chain variable fragment-alkaline phosphatase fusion protein and a sensitive direct competitive chemiluminescent enzyme immunoassay for detection of ractopamine in pork[J]. Analytica Chimica Acta, 2012, 736(14): 85-91. DOI:10.1016/j.aca.2012.05.033.
[19] XU Z, DONG J, WANG H, et al. Production and characterization of a single-chain variable fragment linked alkaline phosphatase fusion protein for detection of O,O-diethyl organophosphorus pesticides in a one-step enzyme-linked immunosorbent assay[J]. Journal of Agricultural and Food Chemistry, 2012, 60(20): 5076-5083. DOI:10.1021/jf300570q.
[20] BUTERA D, SKIELKA K, MCLANE M A, et al. Cloning, expression, and characterization of a bi-functional disintegrin/alkaline phosphatase hybrid protein[J]. Protein Expression and Purifi cation, 2003, 31(2): 286-291. DOI:10.1016/S1046-5928(03)00169-4.
[21] KREBBER A, BORNHAUSER S, BURMESTER J, et al. Reliable cloning of functional antibody variable domains from hybridomas and spleen cell repertoires employing a reengineered phage display system[J]. Journal of Immunological Methods, 1997, 201(1): 35-55. DOI:10.1016/ S0022-1759(96)00208-6.
[22] GIUDICELLI V, DUROUX P, GINESTOUX C, et al. IMGT/LIGMDB, the IMGT
®comprehensive database of immunoglobulin and T cell receptor nucleotide sequences[J]. Nucleic Acids Research, 2006, 34(Suppl 1): D781-D784. DOI:10.1093/nar/gkj088.
[23] CHEN Y C, CHEN L A, CHEN S J, et al. Modifi ed osmotic shock for periplasmic release of a recombinant creatinase from Escherichia coli[J]. Biochemical Engineering Journal, 2004, 19(3): 211-215. DOI:10.1016/ j.bej.2004.03.001.
[24] WANG H, LIU X, HE Y, et al. Expression and purification of an anti-clenbuterol single chain Fv antibody in Escherichia coli[J]. Protein Expression & Purification, 2010, 72(1): 26-31. DOI:10.1016/ j.pep.2010.03.001.
[25] KRAMER K, HOCK B. Recombinant antibodies for environmental analysis[J]. Analytical & Bioanalytical Chemistry, 2003, 377(3): 417-426. DOI:10.1007/s00216-003-2161-1.
Fusion Expression and Characterization of Single Chain Antibody against Malachite Green-Alkaline Phosphatase
WU Weijian, DONG Jiexian, RAO Meifang, ZHAN Wuqiang, WANG Hong*, SUN Yuanmi ng
(College of Food Science, South China Agricultural University, Guangdong Provincial Key Laboratory of Food Quality and Safety, Guangzhou 510642, China)
Abstract:The variable light and heavy chain genes from anti-malachite green (MG) monoclonal cells were cloned and linked with peptide (Gly
4Ser)
3to construct a single chain variable fragment (scFv) antibody gene. The gene was inserted into the vector plip6/GN containing alkaline phosphatase (PhoA) gene to construct the recombinant plasmid plip6/GN-MG-scFv. After the induction of E. coli BL21 containing the recombinant plasmid with isopropyl β-D-thiogalactoside (IPTG), the protein from the periplasm was detected by SDS-PAGE and Western blotting. The results demonstrated that the fusion protein scFv-PhoA (about 72 kD) was expressed successfully. A one-step enzyme-linked immunosorbent assay (ELISA) was developed (IC
50= 9.81 ng/mL) by using scFv-PhoA fusion protein with disodium 4-nitrophenyl phosphate (pNPP) as the substrate. These results demonstrate that fusion protein scFv-Ph oA can be a homologous reagent which simplifi es and accelerates the detection of malachite green.
Key words:malachite green; single chain antibody; alkaline phosphatase; fusion expression; direct competitive enzyme-linked immunosorbent assay
DOI:10.7506/spkx1002-6630-201617020
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2016)17-0121-06
DOI:10.7506/spkx1002-6630-201617020. http://www.spkx.net.cn
收稿日期:2016-03-09
基金项目:国家自然科学基金面上项目(31271866);广东省自然科学基金项目(2014A030311043);
广东省科技计划项目(2014A050503059)
作者简介:伍伟健(1990—),男,硕士研究生,研究方向为食品安全。E-mail:wwjxdy@163.com
*通信作者:王弘(1973—),女,教授,博士,研究方向为食品安全。E-mail:gzwhongd@163.com
引文格式:





