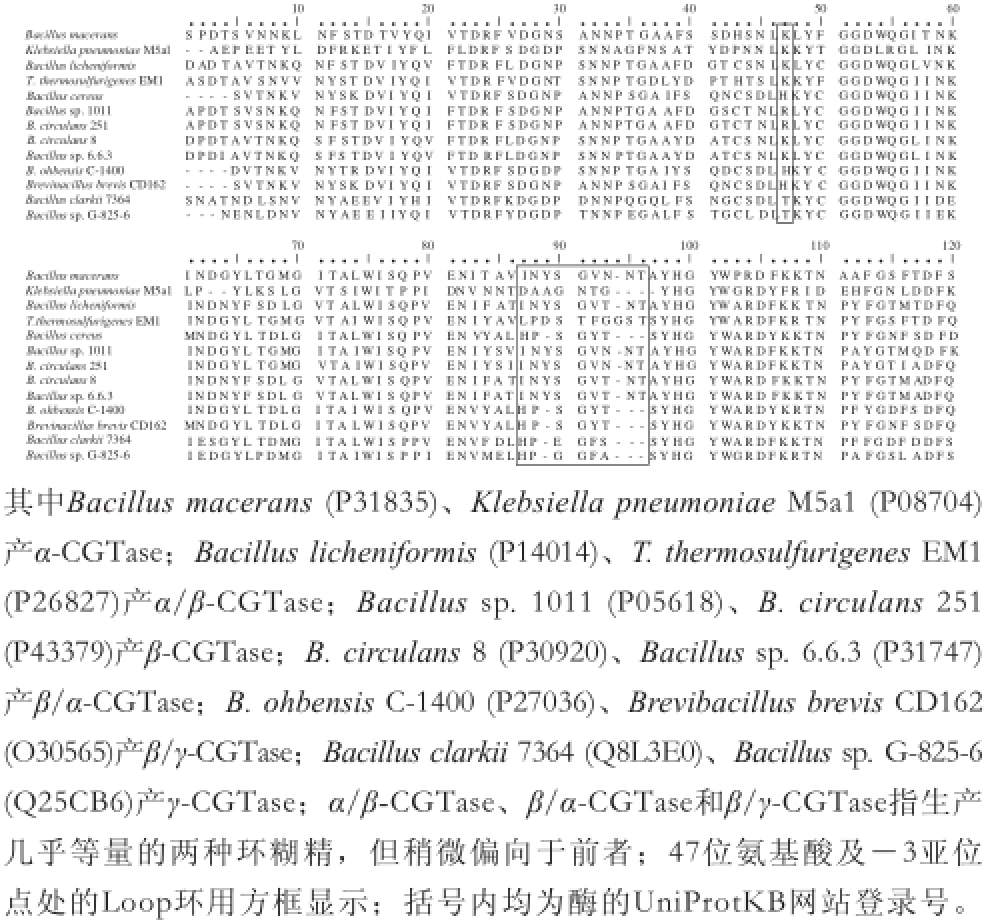
图1 不同菌株表达的CGTases在47位氨基酸附近区域的多重序列比对
Fig. 1 Multiple sequence alignment of the region around the residue 47 in CGTases from different strains
凌 凯,张洪斌*,刘鹏飞,胡雪芹
(合肥工业大学生物与医学工程学院,安徽 合肥 230009)
摘 要:环糊精葡萄糖基转移酶(cyclodextrin glycosyltransferase,CGTase)是一种多功能酶,能够催化淀粉生成环糊精(cyclodextrin,CD),本研究考察了Bacillus cereus的CGTase活性区域43位氨基酸与CGTase酶活力及其催化玉米淀粉形成γ-CD能力的联系。实验中共构建17 株突变株,并在大肠杆菌BL21中实现异源表达。结果表明:相比于原始酶,H43E、H43F、H43W、H43Y突变酶的活力均有所提高;产物特异性方面,除H43W突变酶外,其余突变酶的催化产物中γ-CD比例均有所升高,将43位组氨酸突变成脯氨酸、异亮氨酸和苏氨酸后得到的突变酶作用于玉米淀粉,酶的催化产物中β-CD含量均下降,γ-CD含量由20%分别升高到30.2%、28.4%、29.2%,实际产量由4.76 g/L升高到7.64、6.05、6.29 g/L,由此可见Bacillus cereus的CGTase活性区域中43位氨基酸对于CGTase的活力和产物特异性具有重要影响。
关键词:环糊精糖基转移酶;定点突变;产物特异性
凌凯, 张洪斌, 刘鹏飞, 等. 环糊精糖基转移酶定点突变及其产物特异性分析[J]. 食品科学, 2016, 37(17): 133-138.
LING Kai, ZHANG Hongbin, LIU Pengfei, et al. Site-directed mutation of cyclodextrin glycosyltransferase and analysis of its product specifi city[J]. Food Science, 2016, 37(17): 133-138. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201617022. http://www.spkx.net.cn
环糊精糖基转移酶(cyclodextrin glycosyltransferase,CGTase)是一种胞外酶,属于糖苷水解酶家族 [1]。CGTase可作用于淀粉或葡萄糖单元形成多聚物,主要催化4 种反应:环化反应、歧化反应、偶联反应和水解反应 [2],其中环化反应为特征反应,工业上常利用此反应生成环糊精(cyclodextrin,CD)产品。CD是葡萄糖单元通过α-1,4-糖苷键连接而成的环状低聚糖,主要包括α-CD、β-CD、γ-CD,分别包含6、7、8 个葡萄糖残基 [3]。CD呈现“外亲水,内疏水”的锥筒状空腔结构,又因CD是手性化合物,使其具备包含各种客体化合物的能力,从而改变客体化合物的物理或化学性质 [4],这种特殊性质使CD在食品、医药领域中得到广泛运用 [5-7],如β-CD与叶黄素形成包合物后,能有效提高叶黄素的稳定性、水溶性 [8]。
CGTases共有5 个结构域 [9],除A、B、C结构域外,还存在D、E两个特有结构域,C、E域能够结合生淀粉颗粒,D域是β-片层结构,其功能尚不清楚,A、B域具有催化活性,B域含有一个凹槽,通过凹槽周围氨基酸与底物结合 [10]。Glu257、Asp229、Asp328在结合过程中有重要作用,Glu257提供质子给亚位点+1和-1上的两个葡萄糖间糖苷键上的氧从而使糖苷键断裂 [11],预测本研究中来源于Bacillus cereus的CGTase与底物结合后,其非还原末端大部分结合在凹槽的-7亚位点上,形成β-CD,小部分结合在-6或-8亚位点,形成α-CD、γ-CD。
目前为止,自然界或者人工改造的CGTases催化产物均为环糊精混合物,其中γ-CD具有最大的内腔及最好的溶解性,但γ-CGTase的种类较少且环化能力弱,导致γ-CD需求量大、价格昂贵,因此亟待对CGTase进行定点突变改造,以提高γ-CD产量。目前很多针对产物特异性的定点突变集中在底物结合位点或者钙离子结合位点处的氨基酸 [12-13],其中47位氨基酸对环糊精产物特异性具有重要作用 [14],如Paenibacillus macerans sp. 602-1来源的CGTase构建突变酶K47T,产物中α-CD的比例由68.9%降低为57.1%,β-CD和γ-CD的比例分别由22.2%、8.9%增加至31%、11.9% [15]。以上研究均是针对α-CGTase,且突变有限个氨基酸,本研究拟利用来源于Bacillus cereus的β-CGTase作为目标酶,对43位氨基酸进行饱和突变,探讨此位点对CGTase产物特异性的影响。
1.1 菌种、材料与试剂
用于克隆的宿主菌E. coli DMT和用于表达的宿主菌E. coli BL21 (DE3)购自北京全式金公司;含CGTase基因的原始菌株Bacillus cereus由实验室筛选得到。
pET22b购自德国Novagen公司,重组质粒pET22b/cgt由酶工程与生物制药实验室构建保存。
TransStart FastPfu DNA Polymerase、T4 DNA Ligase、质粒抽提试剂盒 北京全式金生物技术有限公司;DpnI内切酶、蛋白质分子质量标准 生工生物工程(上海)股份有限公司;引物合成和DNA测序服务由金唯智生物科技有限公司完成;其余试剂均为国产分析纯。
1.2 仪器与设备
Life Eco PCR基因扩增仪 杭州博日科技有限公司;Knauer高效液相色谱仪(配有示差检测器和色谱工作站) 德国诺尔公司。
1.3 方法
1.3.1 定点突变方法
以重组质粒pET22b/cgt为模板,利用Primer Premier设计引物,根据下述体系进行聚合酶链式反应(polymerase chain reaction,PCR):5×TransStart FastPfu Buffer 10 μL、TransStart FastPfu DNA Polymerase 1 μL、dNTP Mixture(2.5 mmol/L)4 μL、模板质粒2 μL、Pri meF(10 μmol/L)1 μL、PrimeR(10 μmol/L)1 μL、ddH 2O 31 μL;PCR扩增条件:94 ℃ 3 min;94 ℃ 10 s,55 ℃ 20 s,72 ℃ 4 min,25 个循环;72 ℃ 10 min;利用DpnI酶特异性地切割模板质粒而留下PCR 产物,反应体系如下:10×Buffer Tango 4 μL、PCR产物10 μL、DpnI 1 μL、ddH 2O 7 μL,37 ℃反应2 h;酶切产物纯化后转化到E. coli DMT感受态细胞内,经过含氨苄青霉素(ampicillin,AMP)的LB平板筛选,挑选阳性克隆提取质粒送至金唯智生物科技有限公司测序,测序正确且未有无义突变的重组质粒转化到E. coli BL21 (DE3)中,保存菌种。
1.3.2 酶的表达和提取
将保存的菌种活化,挑选长势良好的菌株接种于20 mL LB培养基中,37 ℃、250 r/min培养12 h,按1%的接种量取上述培养液于50 mL培养基中,待OD 600 nm达到1.0左右,加入异丙基-β-D-硫代吡喃半乳糖苷(isopropylβ-D-thiogalactoside,IPTG)至终浓度为0.2 mmol/L,25 ℃诱导6 h,培养结束后8 000 r/min离心15 min,破碎(破碎2 s、间隔4 s,破碎时间15 min,破碎功率20 W,破碎量10 mL),8 000 r/min离心15 min后取上清液即为粗酶液。
1.3.3 酶活力和蛋白含量的测定
取10 μL适当稀释的粗酶液,加入到0.2 mL 0.2 g/100 mL可溶性淀粉溶液和0.2 mL pH 8.5的甘氨酸-氢氧化钠缓冲液体系中,充分混匀后在40 ℃水浴锅中反应10 min,立即加入0.5 mol/L的醋酸终止反应,加入0.05 g/L碘液显色,以蒸馏水为空白,在700 nm波长处测定吸光度,一个酶活力单位定义为吸光度下降10%所需要的酶量 [16];以牛血清白蛋白作为标准蛋白绘制标准曲线,根据标准曲线测定蛋白含量,整个过程根据Bradford法 [17]完成。
1.3.4 突变酶的纯化
在离心后的上清液中加入中性盐硫酸铵至饱和度为10%,8 000 r/min离心去除部分杂蛋白,继续添加硫酸铵至终饱和度为60%,4 ℃冰箱里静置过夜,8 000 r/min离心收集沉淀。沉淀在甘氨酸-氢氧化钠缓冲液中溶解后,放入透析袋中充分透析,期间不断更换缓冲液,至无NH + 4为止,将透析得到的酶液过预先平衡的Sephadex G-100凝胶层析柱,然后用pH 8.5的甘氨酸-氢氧化钠缓冲液洗脱,通过测定OD 280 nm及酶活力确定CGTase馏分,超滤浓缩后-20 ℃保存。
1.3.5 CD生成能力和产物特异性分析
利用CGTase环化能力催化玉米淀粉生成CD,称取2.5 g玉米淀粉加入到50 mL甘氨酸-氢氧化钠缓冲液(pH 8.5)中,分别加入800 U/g玉米淀粉的原始和突变CGTase,55 ℃反应,每隔一定时间取样,样品在沸水浴中煮沸5 min,12 000 r/min离心10 min后取上清液,经过0.45 μm滤膜过滤后取20 μL进行高效液相色谱分析。
1.3.6 酶的空间结构模拟
突变酶和原始酶的理论空间结构由Modeller软件通过同源建模得到,酶底物结合位点与麦芽九糖抑制剂的分子对接由AutoDock Vina软件完成,可视化图形由PyMol操作完成。
2.1 突变酶的构建

图1 不同菌株表达的CGTases在47位氨基酸附近区域的多重序列比对
Fig. 1 Multiple sequence alignment of the region around the residue 47 in CGTases from different strains
47位氨基酸(Bacillus cereus的CGTase氨基酸编号为43位)对于CGTase催化淀粉的底物专一性具有重要影响 [18],在此位置上不同类型的CGTase具有明显的功能特异性。由图1的多重序列对比可以看出,α-CGTase、α/β-CGTase在此处为赖氨酸,β-CGTase为精氨酸,β/α-CGTase和β/γ-CGTase在此处分别为赖氨酸和组氨酸,γ-CGTase为苏氨酸,而赖氨酸、组氨酸和精氨酸都是碱性氨基酸,带有带正电荷。47位氨基酸是-3亚位点的一部分,文献[19]曾报道-3亚位点处较短的氨基酸侧链会增加形成大环CD的可能性,β/γ-CGTase在47位上常见的组氨酸含有咪唑基团,侧链相对较短,所以会有部分大环γ-CD生成,而Bacillus clarkii 7364、Bacillus sp. G-825-6的γ-CGTase在47位是苏氨酸,苏氨酸不带电荷且侧链更短,更容易生成大环的γ-CD。
B. circulans 251 CGTase的87~93位氨基酸构成一个Loop环,且位于47位氨基酸下方 [20],由图1可知,相比于α-CGTase、α/β-CGTase、β-CGTase、β/α-CGTase,B. cereus CGTase的Loop环附近缺失氨基酸多,对此位点氨基酸进行突变效果可能会有所不同。
本研究以Bacillus cereus CGTase的43位组氨酸为研究对象,通过设计多对引物,利用PCR扩增技术,综合利用体外限制性内切酶酶解和DMT感受态降解非突变型质粒模板的方法,极大提高了突变效率和阳性克隆数。挑选出阳性克隆并经过双酶切和DNA序列测序验证,成功构建了H43P、H43Q、H43L、H43I、H43F、H43K、H43A、H43C、H43Y、H43E、H43N、H43R、H43S、H43T、H43G、H43M、H43W这17 株突变株。
2.2 突变CGTase的表达
将含有原始酶基因和突变酶基因的重组质粒导入到E. coli BL21 (DE3)中表达,破碎离心后获取上清液通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)分析蛋白表达情况,以未含cgt基因的空载pET22b(+)作为对照,如图2所示,原始酶和突变酶在68 kD有明显条带,说明均得到了可溶性蛋白的表达。

图2 原始酶和突变酶的SDS-PAGE分析
Fig. 2 SDS-PAGE analysis of wild-type and mutant CGTases
2.3 定点突变对CGTase酶活力的影响
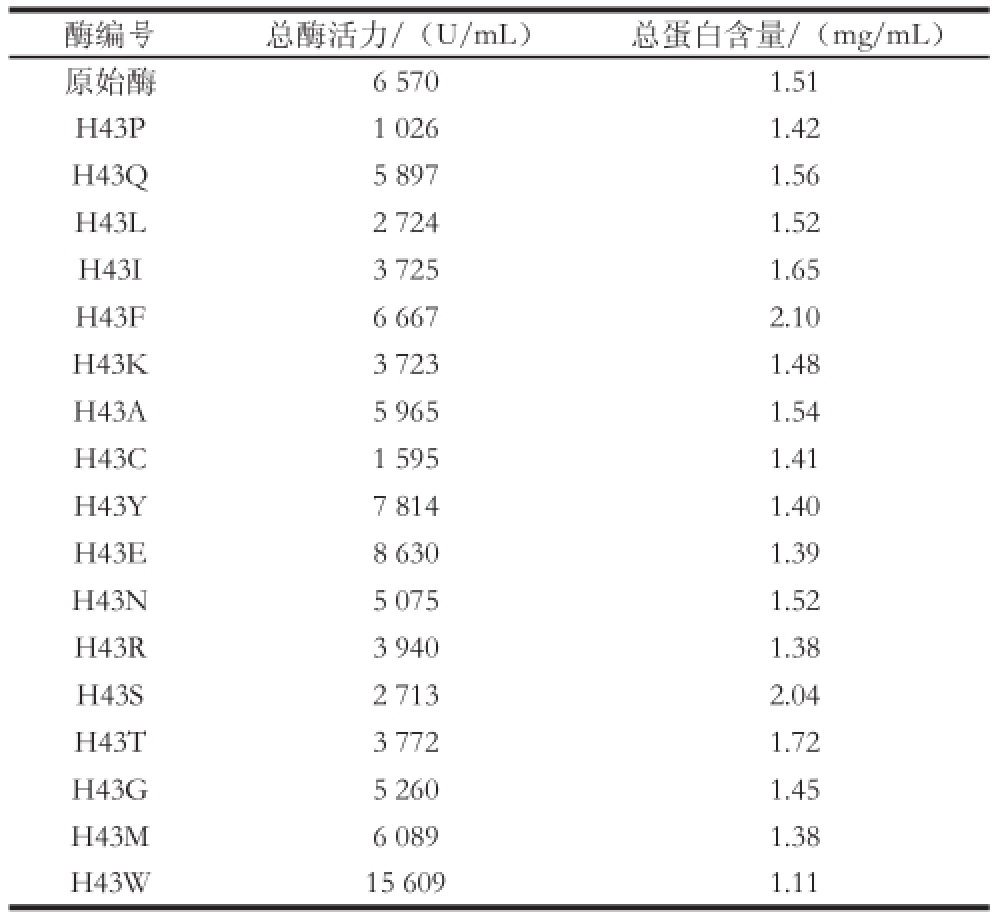
对CGTase关键氨基酸的定点突变往往会造成酶活力的变化,如Hyun-Dong等 [21]将β-CGTase中652位色氨酸突变成甘氨酸,酶的环化活性增强而水解及偶联活性降低。对原始酶的43位组氨酸进行饱和突变后酶活力也发生变化。如表1所示,绝大多数突变后的酶蛋白 粗酶液活力下降,而H43E、H43F、H43W、H43Y酶活力得到提高,其中H43W酶活力是原始酶的2.38 倍。值得注意的是,H43F、H43W、H43Y突变酶均为芳香族氨基酸替代组,说明43位带有芳香环的氨基酸对CGTase降解淀粉的能力有积极作用,这可能是由于苯丙氨酸、色氨酸、酪氨酸会与87位的酪氨酸形成芳香环间的相互作用所致。如图3所示,43位苯丙氨酸、色氨酸和酪氨酸芳香环上缺电子的氢原子与87位酪氨酸富含电子的芳香环之间形成作用力,而43、87位氨基酸均是底物结合位点-3亚位点的重要组成部分 [20],这种作用力会影响底物与酶活性中心的结合。3 种苯环堆 积作用中,43位突变成色氨酸后与87位酪氨酸苯环键距离最近,两者间的作用力最强,相应的酶活力也最大(表1)。另一方面,歧化活力和水解活力的提升很可能是造成突变酶降解淀粉能力增强的重要原因,如对Bacillus circulans 251 CGTase进行定点突变,将47位氨基酸突变为色氨酸后,歧化和水解活力从970、3 µmol/(min•mg)提高到1 305、15 µmol/(min•mg),总活力从1 239 µmol/(min•mg)提高到1 502 µmol/(min•mg) [22]。
表1 原始酶和突变酶粗酶液酶活力比较
Table 1 Comparison of enzyme activity of crude wild-type and mutant CGTases
酶编号总酶活力/(U/mL)总蛋白含量/(mg/mL)原始酶6 5701.51 H43P1 0261.42 H43Q5 8971.56 H43L2 7241.52 H43I3 7251.65 H43F6 6672.10 H43K3 7231.48 H43A5 9651.54 H43C1 5951.41 H43Y7 8141.40 H43E8 6301.39 H43N5 0751.52 H43R3 9401.38 H43S2 7132.04 H43T3 7721.72 H43G5 2601.45 H43M6 0891.38 H43W15 6091.11
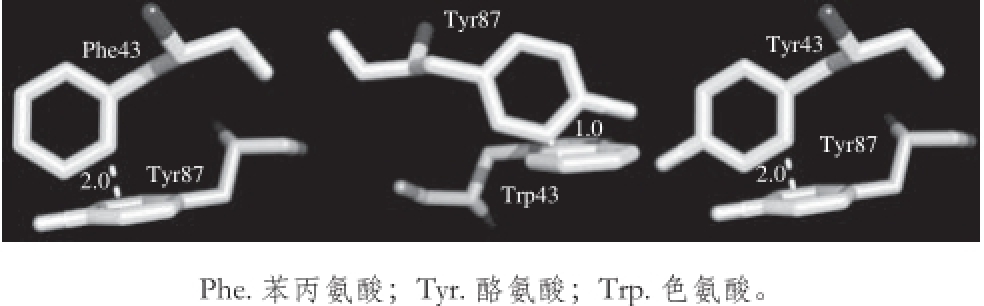
图3 3 Bacillus cereus reus CGTase的43、87位氨基酸间相互作用
Fig. 3 Interaction between amino acid residues 43 and 87 of Bacillus cereus CGTase
2.4 突变酶对γ-CD特异性的影响
表2 原始酶和突变酶作用于淀粉后CD产量比较
Table 2 Comparison of the yield of cyclodextrin with wild-type and mutant CGTases

酶编号β-CD产量/(g/L)γ-CD产量/(g/L)γ-CD含量/%原始酶19.024.7620.0 H43P17.697.6430.2 H43Q17.066.1526.5 H43I15.256.0528.4 H43L15.626.0828.0 H43F18.585.3422.3 H43K15.346.0628.3 H43A20.868.2328.3 H43C21.217.1825.3 H43Y18.765.1921.7 H43E16.496.2627.5 H43N17.345.7124.8 H43S15.414.7723.6 H43R16.516.2327.4 H43T15.296.2929.2 H43G17.806.9628.1 H43M8.904.4033.1 H43W11.902.8619.4
按1.3.2节方法制取粗酶液,作用于质量分数5%的玉米淀粉,20 h后取样灭活后用高效液相色谱分析结果,利用β-CD和γ-CD标准曲线计算实际产量(α-CD含量极低,故未在表中列出)。由表2可知,原始酶作用于玉米淀粉分别生成19.02 g/L β-CD和4.76 g/L γ-CD,γ-CD占总产量的20%,除H43W突变酶外,其他突变酶催化淀粉后产物中γ-CD的比例均有所增加,证实了His43突变能提高γ-CD的产物特异性。其中H43P、H43A、H43G组γ-CD所占比例分别为30.2%、28.3%、28.1%,而脯氨酸、丙氨酸、甘氨酸均为侧链短的氨基酸,说明侧链大小和环化作用之间有一定的相关性。如图4所示,当43位组氨基酸替换成残基侧链较短的丙氨酸、甘氨酸、脯氨酸后,凹槽空间明显变大,柔性增强。底物结合处较大的空腔体 积使得底物糖苷键在-1~+1位点断裂后,非还原端达到更远的亚位点,从而利于大环CD生成。
值得注意的是,H43L、H43I突变组也能使γ-CD产量增多,亮氨酸或者异亮氨酸不能参与形成氢键 [23],破坏了线性寡糖环化过程稳定的环化环境,使底物与凹槽不能正常结合的概率增强,有可能生成更多的γ-CD;并且异亮氨酸和亮氨酸的疏水作用很强,疏水性常数分别为4.5和3.8 [24],导致水、缓冲液分子以及小糖分子很难进入该空间。
当B. cereus β-CGTase的His43突变为苏氨酸后,γ-CD的环化能力提高,γ-CD含量比原始酶增加46%,说明43位突变为苏氨酸后有催化淀粉向更大CD生成的趋势。如用苏氨酸代替Paenibacillus macerans JFB05-01 α-CGTase该位置上的赖氨酸时,会降低五元环α-CD的环化能力,却极大提高了六元环β-CD的生成量 [25]。
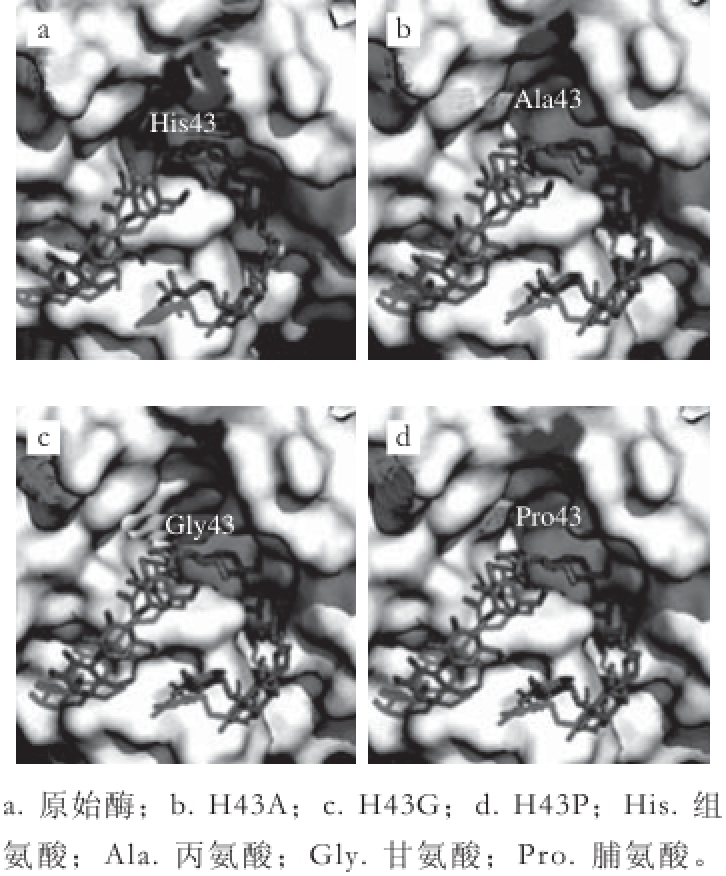
图4 原始酶和突变酶在底物结合凹槽处三维空间结构对比
Fig. 4 Comparison of three-dimensional structures of wild-type and mutant CGTases in the substrate binding groove
2.5 CGTase的纯化
选取经过定点突变后,γ-CD含量和实际产量较高的H43P、H43I、H43T突变酶作为纯化对象,经过盐析、透析后过SephadexG-100凝胶层析柱,突变酶纯化后的比活力分别为10 273、19 030、22 369 U/mg,H43T突变酶纯度最高。纯化后的酶液经过SDS-PAGE分析(图5),在68 kD处均有单一条带,且杂带不可见,纯化效果良好,将纯酶保存后用于后续实验。
图5 纯化后的原始酶及突变酶的SDS-PAGE分析
Fig. 5 SDS-PAGE analysis of purified wild-type and mutant CGTases
2.6 突变酶对CD产量的影响

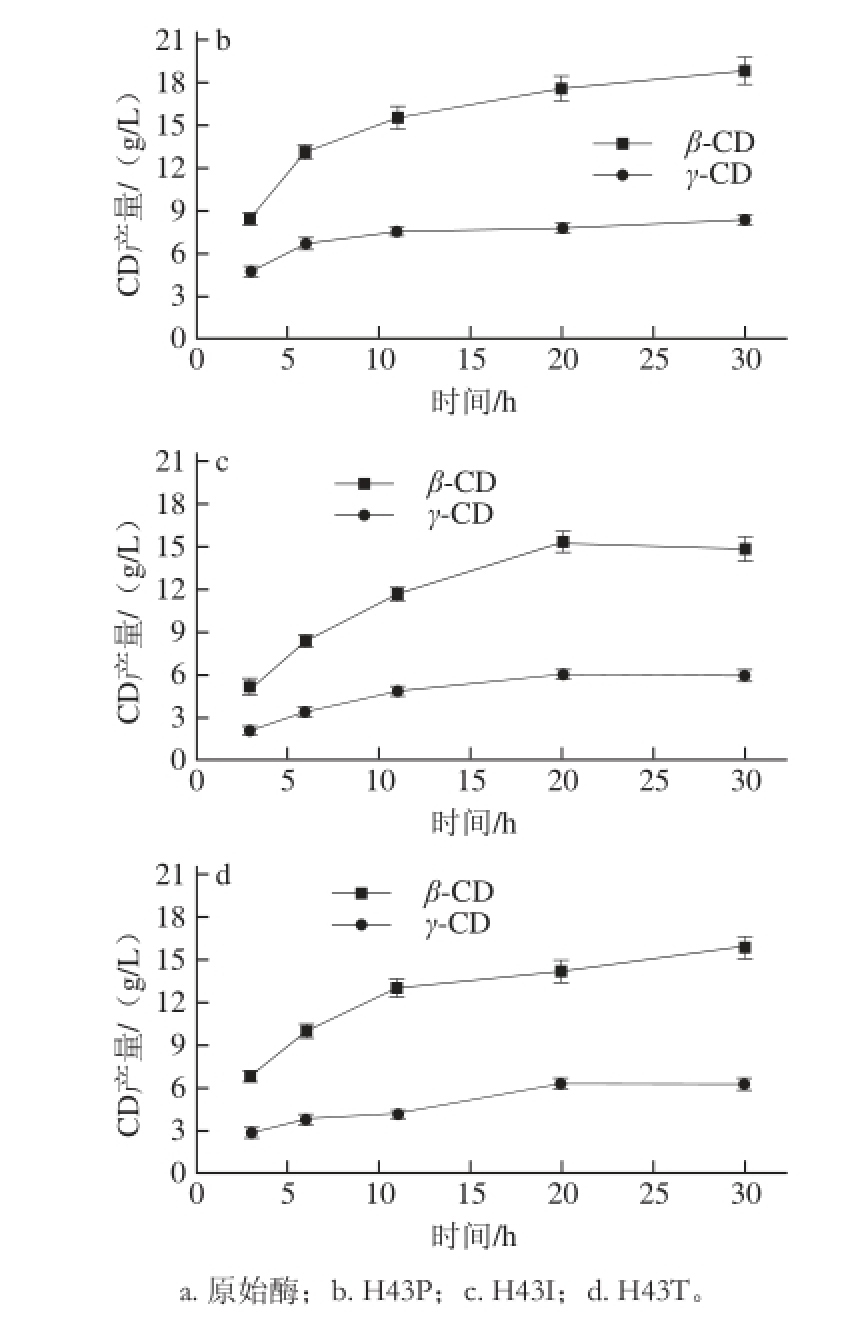
图6 原始酶与突变酶作用于玉米淀粉过程中CD产量变化
Fig. 6 Cyclodextrins formed during incubation of wild-type and
mutant CGTases with corn starch as substrate
考察CD在反应30 h过程中产量变化情况,反应体系中加酶量为800 U/g,在55 ℃的恒温摇床内反应。如图6所示,对于所有CGTases,反应过程中β-CD仍然为主要产物,同时有γ-CD生成,但是几乎没有检测出α-CD。反应20 h后,γ-CD特异性最好,相比于原始酶,H43P、H43I、H43T组γ-CD产量都有不同程度提高,实际产量由4.76 g/L提高至7.64、6.05、6.29 g/L,同时H43P突变酶的总CD产量比原始酶提高6.5%,而H43I、H43T组的总CD产量下降了10.4%和9.2%,说明这两种酶总的环化能力有所下降。
本研究以实验室构建的含有重组质粒pET22b/cgt的基因工程菌作为研究对象,通过定点饱和突变的方法对重组Bacillus cereus的CGTase 43位氨基酸进行定向改造,发现用大部分氨基酸代替43位的组氨酸均能使γ-CD产量增加。γ-CD具有更大的环结构和空腔,能够包合α-CD、β-CD不能包合的大分子,同时溶解性和安全性更好,市场需求量大,由此也体现了本研究所具有的实际意义。分析得出在43位点处残基侧链短或者疏水性强的氨基酸替代能有效提升γ-CD产量,H43P、H43I催化玉米淀粉所得的CD中γ-CD比例分别从20.0%提高至30.2%、28.4%;H43T突变酶催化产物中γ-CD所占比例也能达到29.2%。另外也可以看出,仅仅依靠单位点的突变很难使γ-CD特异性发生特别明显的变化,非常有必要利用多点突变或其他蛋白质工程手段对CGTase产物进行特异性改良。
参考文献:
[1] SCHÖFFER J D N, KLEIN M P, RODRIGUES R C, et al. Continuous production of β-cyclodextrin from starch by highly stable cyclodextrin glycosyltransferase immobilized on chitosan[J]. Carbohydrate Polymers, 2013, 98(2): 1311-1316. DOI:10.1016/j.carbpol.2013.07.044.
[2] 夏亚穆, 李晨晨. 环糊精葡萄糖基转移酶的基因改造与高效表达[J]. 中国生物工程杂志, 2015, 35(2): 105-110. DOI:10.13523/ j.cb.20150216.
[3] 凡宁, 张洪斌, 凌凯, 等. 重组环糊精葡萄糖基转移酶温控型工程菌的构建及其培养条件的优化[J]. 食品科学, 2014, 35(11): 155-159. DOI:10.7506/spkx1002-6630-201411031.
[4] LEEMHUIS H, KELLY R M, DIJKHUIZEN L. Engineering of cyclodextrin glucanotransferases and the impact for biotechnological applications[J]. Applied Microbiology & Biotechnology, 2010, 85(4): 823-835. DOI:10.1007/s00253-009-2221-3.
[5] LI Zhaofeng, CHEN Sheng, GU Zhengbiao, et al. α-Cyclodextrin: enzymatic production and food applications[J]. Trends in Food Science & Technology, 2014, 35(2): 151-160. DOI:10.1016/j.tifs.2013.11.005.
[6] del VALLE E M. Cyclodextrins and their uses: a review[J]. Process Biochemistry, 2004, 39(9): 1033-1046. DOI:10.1016/S0032-9592(03)00258-9.
[7] SZENTE L, SZEJTLI J. Cyclodextrins as food ingredients[J]. Trends in Food Science & Technology, 2004, 15(3): 137-142. DOI:10.1016/ j.tifs.2003.09.019.
[8] 张多婷, 韩静, 项文娟, 等. 叶黄素-β-环糊精包合物的制备及其光谱研究[J]. 食品科学, 2011, 32(17): 199-203.
[9] XIE T, HOU Y, LI D, et al. Structural basis of a mutant Y195I α-cyclodextrin glycosyltransferase with switched product specifi city from α-cyclodextrin to β-/γ-cyclodextrin[J]. Journal of Biotechnology, 2014, 182/183(8): 92-96. DOI:10.1016/j.jbiotec.2014.03.014.
[10] KLEIN C, SCHULZ G E. Structure of cyclodextrin glycosyltransferase refi ned at 2.0 Å resolution[J]. Journal of Molecular Biology, 1991, 217(4): 737-750. DOI:10.1016/0022-2836(91)90530-J.
[11] UITDEHAAG J C, MOSI R, KALK K H, et al. X-ray structures along the reaction pathway of cyclodextrin glycosyltransferase elucidate catalysis in the α-amylase family[J]. Nature Structural Biology, 1999, 6(5): 432-436. DOI:10.1038/8235.
[12] LI Zhaofeng, HUANG Min, GU Zhengbiao, et al. Asp577 mutations enhance the catalytic efficiency of cyclodextrin glycosyltransferase from Bacillus circulans[J]. International Journal of Biological Macromolecules, 2016, 83: 111-116. DOI:10.1016/ j.ijbiomac.2015.11.042.
[13] SONG Binghong, YUE Yang, XIE Ting, et al. Mutation of tyrosine 167 histidine at remote substrate binding subsite -6 in α-cyclodextrin glycosyltransferase enhancing α-cyclodextrin specificity by directed evolution[J]. Molecular Biotechnology, 2014, 56(3): 232-239. DOI:10.1007/s12033-013-9699-8.
[14] LI Zhaofeng, ZHANG Jiayu, WANG Miao, et al. Mutations at subsite −3 in cyclodextrin glycosyltransferase from Paenibacillus macerans, enhancing α-cyclodextrin specifi city[J]. Applied Microbiology & Biotechnology, 2009, 83(3): 483-490. DOI:10.1007/s00253-009-1865-3.
[15] 谢婷, 岳洋, 宋炳红. α-环糊精糖基转移酶活性区域突变提高选择形成γ-环糊精能力[J]. 生物工程学报, 2013, 29(9): 1234-1244.
[16] 方善康. 微生物试验技术[M]. 济南: 山东大学出版社, 1986: 35-46.
[17] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72: 248-254.
[18] STROKOPYTOV B, KNEGTEL R M, PENNINGA D, et al. Structure of cyclodextrin glycosyltransferase complexed with a maltononaose inhibitor at 2.6 angstrom resolution. Implications for product specifi city[J]. Biochemistry, 1996, 35(13): 4241-4249. DOI:10.1021/ bi952339h.
[19] XIA D, WANG F, PARMELY M J. The role of arginine 47 in the cyclization and coupling reactions of cyclodextrin glycosyltransferase from Bacillus circulans strain 251[J]. European Journal of Biochemistry, 2000, 267(12): 3432-3441.
[20] UITDEHAAG J C M, KALK K H, van der VEEN B A, et al. The cyclization mechanism of cyclodextrin glycosyltransferase (CGTase) as revealed by a γ-cyclodextrin-CGTase complex at 1.8-Å resolution[J]. Journal of Biological Chemistry, 1999, 274(49): 34868-34876. DOI:10.1021/bi952339h.
[21] HYUN-DONG S, PARK T H, LEE Y H. Site-directed mutagenesis and functional analysis of maltose-binding site of β-cyclodextrin glucanotransferase from Bacillus firmus var. alkalophilus[J]. Biotechnology Letters, 2000, 22(2): 115-121.
[22] LEEMHUIS H, ROZEBOOM H J, WILBRINK M, et al. Conversion of cyclodextrin glycosyltransferase into a starch hydrolase by directed evolution: the role of alanine 230 in acceptor subsite +1[J]. Biochemistry, 2003, 42(24): 7518-7526. DOI:10.1021/bi034439q.
[23] XIE T, SONG B, YUE Y, et al. Site-saturation mutagenesis of central tyrosine 195 leading to diverse product specificities of an α-cyclodextrin glycosyltransferase from Paenibacillus sp. 602-1[J]. Journal of Biotechnology, 2014, 170: 10-16. DOI:10.1016/ j.jbiotec.2013.10.032.
[24] KYTE J, DOOLITTLE R F. A simple method for displaying the hydropathic character of a protein[J]. Journal of Molecular Biology, 1982, 157(1): 105-132.
[25] LI Zhaofeng, ZHANG Jiayu, SUN Qi, et al. Mutations of lysine 47 in cyclodextrin glycosyltransferase from Paenibacillus macerans enhance β-cyclodextrin specifi city[J]. Journal of Agricultural and Food Chemistry, 2009, 57(18): 8386-8391. DOI:10.1021/jf902312u.
Site-Directed Mutation of Cyclodextrin Glycosyltransferase and Analysis of Its Product Specifi city
LING Kai, ZHANG Hongbin*, LIU Pengfei, HU Xueqin
(School of Biological and Medical Engineering, Hefei University of Technology, Hefei 230009, China)
Abstract:Cyclodextrin glycosyltransferase (CGTase) is a multifunctional enzyme that converts starch into cyclodextrins (CD). In this research, we applied site-directed mutagenesis to histidine residue 43 in the active site region of Bacillus cereus cyclodextrin glycosyltransferase with the aim to study mutation effect on the enzyme activity and product specificity of CGTase. A total of 17 mutant CGTases were obtained and heterologously expressed in E. coli BL21. Compared to the wild-type CGTase, most of the mutations showed decreased enzyme activity expect H43F, H43W, H43Y and H43E; for mutant H43P, H43I and H43T, the percentage of β-CD in hydrolysis products was decreased and γ-CD was increased from 20% to 30.2%, 28.4% and 29.2%, respectively. The actual yield of γ-CD was increased from 4.76 g/L to 7.64, 6.05 and 6.29 g/L, respectively. It can be seen that the active-site residue 43 has important impact on CGTase activity from Bacillus cereus as well as its product specifi city.
Key words:cyclodextrin glycosyltransferase; site-directed mutagenesis; product specifi city
DOI:10.7506/spkx1002-6630-201617022
中图分类号:Q814
文献标志码:A
文章编号:1002-6630(2016)17-0133-06
DOI:10.7506/spkx1002-6630-201617022. http://www.spkx.net.cn
收稿日期:2016-03-02
基金项目:国家自然科学基金面上项目(81573399)
作者简介:凌凯(1990—),男,硕士研究生,研究方向为生物制药与酶工程。E-mail:704949673@qq.com
*通信作者:张洪斌(1970—),男,教授,博士,研究方向为生物化工与酶工程。E-mail:hbzhang@hfut.edu.cn
引文格式: