内蒙古和新疆牧区酸马奶中酵母菌的多样性及其优势菌发酵特性
张晓旭
1,葛武鹏
1,*,梁秀珍
2,李小鹏
3,石亚新
1,马俊英
1,房若愚
1,耿 伟
4
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.陕西飞天乳业有限公司,陕西 宝鸡 721100;3.咸阳市食品药品检验检测中心,陕西 咸阳 712000;4.咸阳市质量技术检测检验所,陕西 咸阳 712000)
摘 要:探究内蒙古和新疆牧区传统酸马奶中酵母菌的多样性及其优势菌的发酵特性,依据GB 4789.15—2010《食品微生物学检验 霉菌和酵母计数》进行菌株分离,再应用26S rDNA D1/D2区序列和内转录间隔区(internal transcribed space,ITS)序列分析技术鉴定分离株,并依据产酒精能力、产酸能力、风味及质构特性等指标筛选优良菌株。结果表明:1)内蒙古酸马奶样品中酵母菌活菌数为10
5CFU/mL,新疆样品在10
5~10
7CFU/mL之间。两地样品中共鉴定出包括Kluyveromyces marxianus、Pichia fermentans、Pichia cactophila、Candida zeylanoides在内的酵母菌13 种。两地间样品酵母菌组成不尽相同,具有地区差异性,内蒙古优势菌为Kluyveromyces marxianus、Pichia cactophila和Pichia fermentans,新疆优势菌为Candida zeylanoides和Kluyveromyces marxianus。2)优选出的4 株酵母菌有2 株为Pichia cactophila,另外2 株为Kluyveromyces marxianus和Candida zeylanoides,发酵特性良好,可用于新型发酵乳制品开发。
关键词:酸马奶;酵母菌;分离鉴定;筛选
张晓旭, 葛武鹏, 梁秀珍, 等. 内蒙古和新疆牧区酸马奶中酵母菌的多样性及其优势菌发酵特性[J]. 食品科学, 2016, 37(17): 156-162. DOI:10.7506/spkx1002-6630-201617026. http://www.spkx.net.cn
ZHANG Xiaoxu, GE Wupeng, LIANG Xiuzhen, et al. Diversity and fermentation characteristics of yeasts in koumiss collected from Inner Mongolia and Xinjiang[J]. Food Science, 2016, 37(17): 156-162. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201617026. http://www.spkx.net.cn
各地的传统发酵食品中蕴藏着丰富的微生物资源。这些历经千年进化和自然优化的微生态体系中保留着许多赋予传统发酵乳制品特殊质地和风味的多种微生物,为有益微生物的发掘提供了宝贵的资源。在我国,生活在内蒙古、新疆、西藏、青海等西部牧区的牧民自古以来就有制作和食用发酵乳制品的习惯
[1],多采用牛乳、羊乳、马乳、骆驼乳等为原料,经代代相传的传统方式制成各类发酵乳制品。此类传统发酵制品种类繁多,具有明显的地域性及民族性,在风味、组织状态、微生态构成特点、营养价值等方面均与现代工业化乳制品有不少差异
[2]。由于西部各牧区自然环境、生活习惯以及制作方法的不同,各地区传统发酵乳制品中微生物构成亦存在差异
[3],分离解析其中的菌相构成,为进一步探明传统发酵乳制品的功能特性及新型发酵乳制品开发提供了依据。
酸马奶是由鲜马奶经乳酸菌和酵母菌混合发酵形成的一种酸性低酒精含量特色乳制品
[4],在中国、俄罗斯通常称为koumiss,而蒙古、哈萨克斯坦称其为airag
[5],其制作和饮用历史悠久,并且颇具文化内涵。几个世纪以来,酸马奶在牧民生活中不仅是一种必不可少的食品,更是一种具有丰富营养和药用价值的滋补品
[6]。蒙古族人将马奶酒和传统医学相结合创造的“马奶酒疗法”,可有效治疗肝炎、慢性溃疡、肺结核等疾病
[7]。在酸马奶发酵过程中,乳酸菌和酵母菌的共存不仅对产品的风味和质地的形成起着关键作用,还会产生对人体有益的促健康功效物质
[8-9]。目前对酸马奶中的乳酸菌已有较广泛深入的研究
[6,10-11],但对酵母菌的研究主要集中在对分离株进行属种鉴定上
[4,12],缺乏系统性地进行多重比较分析和发酵特性的研究。本研究应用26S rDNA和内转录间隔区(internal transcribed space,ITS)序列分析法对从内蒙古和新疆牧区酸马奶中分离出的酵母菌进行鉴定和同源性分析比较,并根据产乙醇、产酸、产品风味等方面的发酵特性进行优势菌筛选,为发掘我国西部牧区传统发酵乳制品中具有潜在益生作用的微生物资源、探究其发酵特性提供依据,为工业化开发提供支持。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
2014—2015年(每年7—9月)分别在内蒙古和新疆牧区采集不同牧民家庭用传统自然发酵方法制作的酸马奶,装入无菌样品瓶中,冷链至实验室,放入4 ℃冰箱备用。
1.1.2 培养基及试剂
马铃薯(potato dextrose agar,PDA)培养基、YPD(yeast extract peptone dextrose)培养基(葡萄糖20 g/L、蛋白胨20 g/L、酵母膏10 g/L,固体加入20 g/L琼脂粉)、孟加拉红培养基 北京奥博星生物技术有限责任公司;全脂纯马奶粉 新疆特丰药业股份有限公司;Dr. GenTLE
®(from Yeast) High Recovery、PCR Premix Taq
TM日本TaKaRa公司;乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA) 日本关东化学株式会社;其余试剂均为分析纯。
1.2 仪器与设备
生物显微镜 上海光学仪器五厂;微量移液器德国Eppendorf公司;T100™ Thermal Cycler PCR仪、E1617-T130 plus凝胶成像系统 美国Bio-Rad公司;DYY-6C电泳仪 北京市六一仪器厂;生化培养箱上海森信实验仪器有限公司;YXQ-LS-50SII-01-00立式压力蒸汽灭菌器 上海博迅实业有限公司;SE-6001F电子分析天平 美国Ohaus公司;SW-CJ-2D型超净工作台苏州净化设备有限公司;SC-2542离心机 安徽中科中佳科学仪器有限公司。
1.3 方法
1.3.1 酵母菌和乳酸菌活菌数的测定
酵母菌计数方法参考GB 4789.15—2010《食品微生物学检验 霉菌和酵母计数》
[13]。以无菌吸管吸取各样品25 mL至盛有225 mL无菌生理盐水(8.50 g/L NaCl)的锥形瓶(可在瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成1∶10的样品匀液,取1 mL稀释悬浮液按10 倍梯度稀释法稀释至10
-7。根据对样品污染状况的估计,选取适宜稀释度(10
-4~10
-7)的样品匀液,每个稀释度分别取1 mL于2 个无菌平皿内。及时将15~20 mL冷却至50 ℃左右的孟加拉红培养基(含0.10 g/L氯霉素)倾注平皿,并转动平皿使其混合均匀,28 ℃恒温培养3~5 d,对其计数并记录分析。
乳酸菌计数参考GB 4789.35—2010《食品微生物学检验 乳酸菌检验》
[14],用MRS琼脂培养基厌氧条件下37 ℃恒温培养48 h,计数。
1.3.2 酵母菌的分离纯化
选择10
-3~10
-7稀释梯度的样品匀液,每个稀释梯度取100 µL均匀涂布于无菌YPD固体培养基上,28 ℃培养箱中培养48~72 h。观察并记录菌落特征,挑取菌落较大,且呈白色或乳白色、粉色单个菌落进行染色,显微镜观察细胞形态,呈圆形或椭圆形、腊肠状且细胞较大者,将其接种于YPD琼脂培养基,28 ℃恒温培养箱中培养48~72 h,重复2~3 次纯化酵母菌,直至镜检结果为同一细胞形态。将纯培养菌种编号并接种于40%的YPD-甘油液体培养基中,于-80 ℃长期保存,或将其接种于YPD固体斜面培养基上,培养24 h后,4 ℃保存备用。
1.3.3 酵母菌的鉴定
基因组DNA的提取:按照Dr. GenTLE
®(from Yeast)High Recovery明示的方法提取酵母菌DNA,于-20 ℃保存备用。
聚合酶链式反应(polymerase chain reaction,PCR)扩增:分别对分离株的26S rDNA D1/D2区序列(NL-1:5’-GCATATCAATAAGCGGAGGAAAAG-3’;NL-4:5’-GGTCCGTGTTTCAAGACGG-3’)及ITS序列(ITS1:5’-TCCGTAGGTGAACCTGCGG-3’;ITS2:GCTGCGTTCTTCATCGATGC-3’)进行扩增
[4,15-16]。反应体系:正反向引物各0.50 μL(20 pmol/μL),PCR Premix Taq
TM25 μL,DNA模板1 μL,超纯水23 μL。扩增程序:94 ℃预变性5 min;94 ℃变性1 min,57 ℃退火1 min,72 ℃延伸1 min,循环30 次;72 ℃延伸5 min。
DNA测序及系统发育树的构建:PCR产物经1.50 g/100 mL的琼脂糖凝胶电泳检测后,进行测序。利用软件MEGA 5.1进行序列分析比较,并用Neighbor-Joining法构建系统发育树,分析其同源性。
1.3.4 优势菌发酵特性研究及筛选
对分离酵母菌的产酸性能、产乙醇性能进行比较分析,结合其风味和质构特性筛选出发酵性能良好的优势菌株。复原马乳的制作参照全脂纯马奶粉产品说明。
1.3.4.1 产酸性能
将分离纯化的各菌株活化后,以5%的接种量接种至灭菌复原马乳中,28 ℃恒温培养48 h后,测定其pH值并按照GB 5413.34—2010《乳和乳制品酸度的测定》
[17]的方法测定其滴定酸度(ºT)。
1.3.4.2 产乙醇性能
将各菌株活化后,以5%的比例接种于灭菌复原马乳中,置28 ℃恒温培养箱中发酵48~72 h,采用气相色谱法
[18]测定乙醇含量。
1.3.4.3 发酵乳风味和质构评价
结合酵母菌产酸产乙醇特性将其与实验室乳酸菌(嗜热链球菌和保加利亚乳杆菌)按一定比例复配,参照酸马奶生产工艺接种于灭菌复原马乳中。工艺流程:复原马乳→灭菌(95 ℃,10 min)→接种(复配菌种)→搅拌(20 min)→37 ℃发酵4~6 h→搅拌→4 ℃后熟1~1.5 d。发酵结束后,测定产品的pH值、滴定酸度和乙醇含量,并由12 位经培训的品评人员依据发酵乳评定惯例
[19],采用综合评分法按表1进行感官评价。
表1 酸马奶感官评价标准
Table 1 Criteria for sensory evaluation of koumiss

项目特征评分色泽(20 分)呈均匀乳白色、微黄色20~16淡黄色15~11浅灰色或灰白色10~6浅绿色等异常颜色5~0滋味和气味(50 分)酸马奶特有的滋气味,酸味适中柔和,风味醇正爽口50~41滋气味正常,酸味适中可接受,醇香可辨40~31有涩味,偏酸可接受,醇香不明显30~21较酸涩,醇香差20~11滋味或气味异常,非常酸涩10~0组织状态(30 分)乳体均匀一致,无乳清析出和沉淀物30~21乳体较均匀,有少量乳清析出20~11乳体不均匀,乳清析出较多10~0
1.4 数据处理
所有实验重复3 次,数据使用Minitab软件处理,结果采用±s表示。
2 结果与分析
2.1 两地间酸马奶样品微生物分析
表2 酸马奶采样点及样品中微生物分析
Table 2 Microbiological analysis of koumiss collected from Inner Mongolia and Xinjiang lg(CFU/mL)
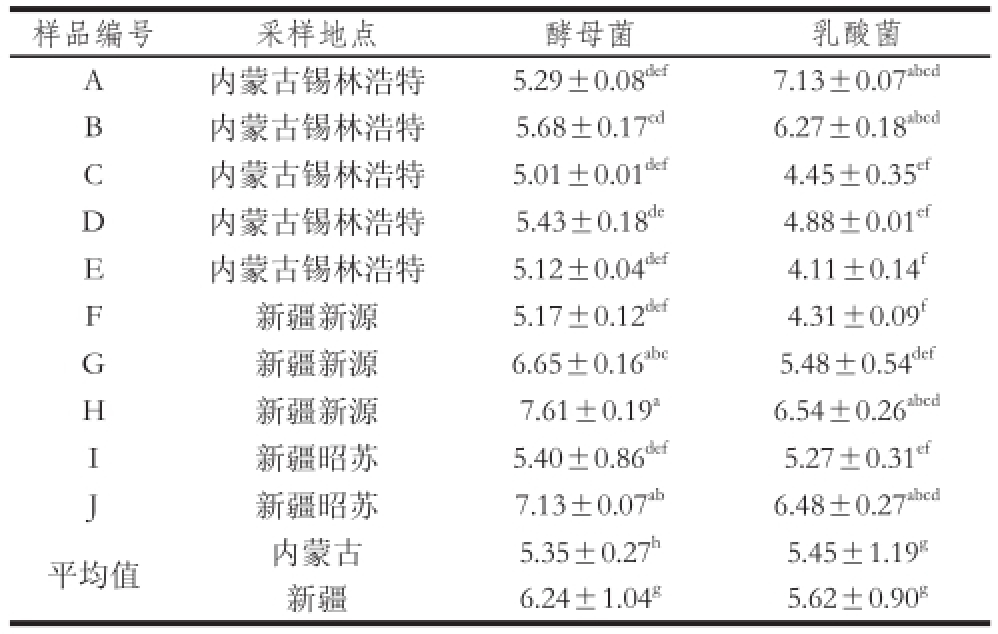
注:同列肩标小写字母不同表示差异显著(P<0.05)。
样品编号采样地点酵母菌乳酸菌A内蒙古锡林浩特5.29±0.08
def7.13±0.07
abcdB内蒙古锡林浩特5.68±0.17
cd6. 27±0.18
abcdC内蒙古锡林浩特5.01±0.01
def4.45±0.35
efD内蒙古锡林浩特5.43±0.18
de4.88±0.01
efE内蒙古锡林浩特5.12±0.04
def4.11±0.14
fF新疆新源5.17±0.12
def4.31±0.09
fG新疆新源6.65±0.16
abc5.48±0.54
defH新疆新源7.61±0.19
a6.54±0.26
abcdI新疆昭苏5.40±0.86
def5.27±0.31
efJ新疆昭苏7.13±0.07
ab6.48±0.27
abcd平均值内蒙古5.35±0.27
h5.45±1.19
g新疆6.24±1.04
g5.62±0.90
g
不同来源酸马奶样品的微生物分析结果见表2,来自10 个不同采样点样品中酵母菌活菌数在10
5~10
7CFU/mL之间,乳酸菌活菌数在10
4~10
7CFU/mL之间,这一结果与大多数人的报道相一致。倪慧娟
[12]研究发现新疆和青海地区传统发酵乳制品中酵母菌数量为10
4~10
6CFU/mL,Mu等
[4]在酸马奶中检测到的酵母菌活菌数为10
5~10
7CFU/mL,Watanabe等
[5]研究发现马奶酒中乳酸菌和酵母菌活菌数均集中在10
7CFU/mL。从各采样点来看,有7 个采样点的酵母菌活菌数在10
5CFU/mL,其余3 个活菌数略高,在10
6~10
7CFU/mL之间波动。从两地区来看,内蒙古样品活菌数主要在10
5CFU/mL水平级波动,各样品间差异不显著(P>0.05);新疆样品乳酸菌活菌数为10
5CFU/mL左右,酵母菌数量主要在10
6~10
7CFU/mL水平级波动,存在显著性差异(P<0.05),这可能与新疆的地域特点有关,该地地域辽阔、地质构造与气候条件复杂、地貌类型多样
[20],造成不同采样点活菌数不同。对两地间微生物活菌数进行比较发现,活菌数水平接近但存在差异(P<0.05),这可能与两地地理环境、气候等因素有关。
因此,自然发酵乳制品中微生物的组成和含量都与其生存环境密切相关。不同地区地理、地貌和气候等自然环境各不相同,不同牧民家庭制备酸马奶所自制的原生态菌种、马奶干物质含量、加工工艺等方面也存在差异,造成地区间自制的酸马奶中酵母菌活菌数在数量上存在一定的差异。
2.2 酵母菌的26S rDNA鉴定
两地样品经分离纯化共得到酵母菌60 株,应用26S rDNA序列分析法对其进行鉴定分析。以提取出的DNA为模板,对其26S rDNA D1/D2区间序列进行PCR扩增,经电泳及凝胶成像,扩增条带长约500~700 bp。部分菌株26S rDNA扩增产物电泳图如图1所示。
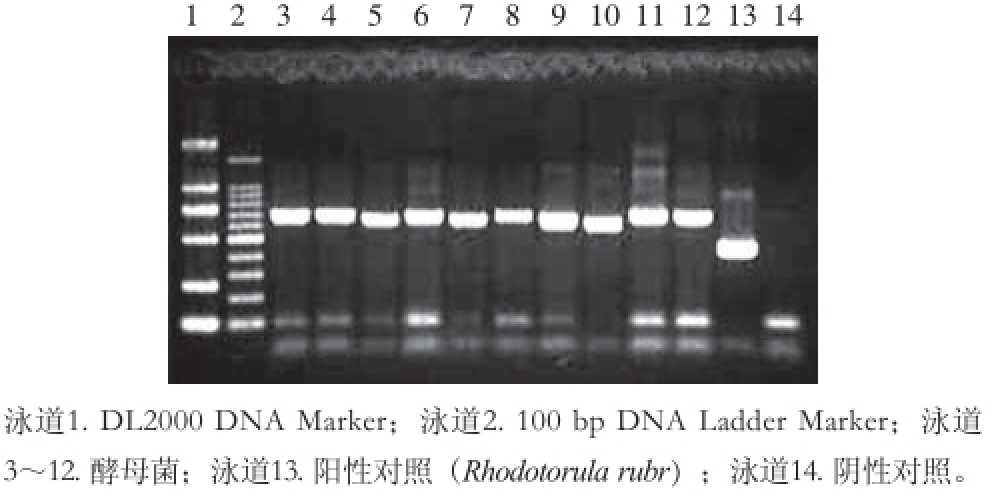
图1 部分酵母菌26S rDNA区域的PCR扩增产物电泳图
Fig. 1 Electrophoresis pattern of PCR amplification products of 26S rDNA genes form partial yeasts
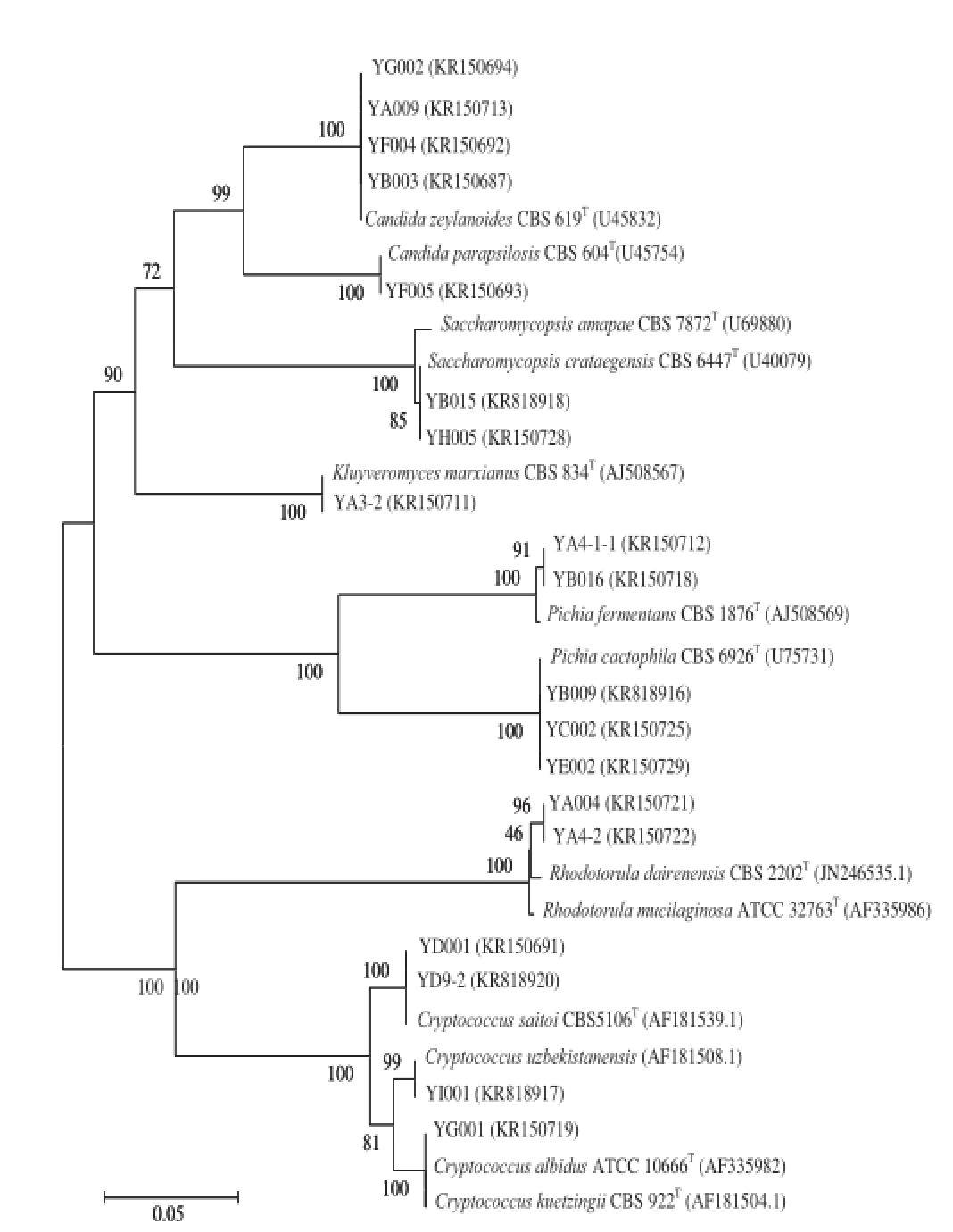
图2 酸马奶样品中代表性酵母菌株的26S rDNA D1/D2区间序列的系统发育树
Fig. 2 Phylogenetic tree of representative yeasts isolated from kumiss products based on 26S rDNA D1/D2 sequences
将获得的菌株序列在GenBank中进行同源序列比对,以各菌株序列与相应标准菌株序列相似度99%以上为确认依据。为明确分离株与已知菌株之间亲缘关系及其同源性系统地位,选取各分离株与相应种的模式菌株构建系统发育树,结果见图2。除YG001以外,其余各分离株均与相应模式菌株在同一分支上,亲缘关系较近,同源性较高,与序列比对结果相一致,分别被鉴定为Candida zeylanoides、Candida parapsilosis、Kluyveromyces marxianus、Saccharomycopsis crataegensis、Pichia fermentans、Pichia cactophila、Rhodotorula dairenensis、Cryptococcus saitoi和Cryptococcus uzbekistanensis。因此,仅根据26S rDNA D1/D2同源序列比对不能将所有酵母菌鉴定到种,还需与ITS序列分析结果相结合才能最终确定其种类及亲缘关系。
2.3 酵母菌的ITS序列鉴定
以提取出的DNA为模板,对其ITS区间序列进行PCR扩增,经电泳及凝胶成像,均出现扩增条带,扩增条带在300~1 000 bp左右。部分酵母菌株PCR扩增产物电泳结果如图3所示。
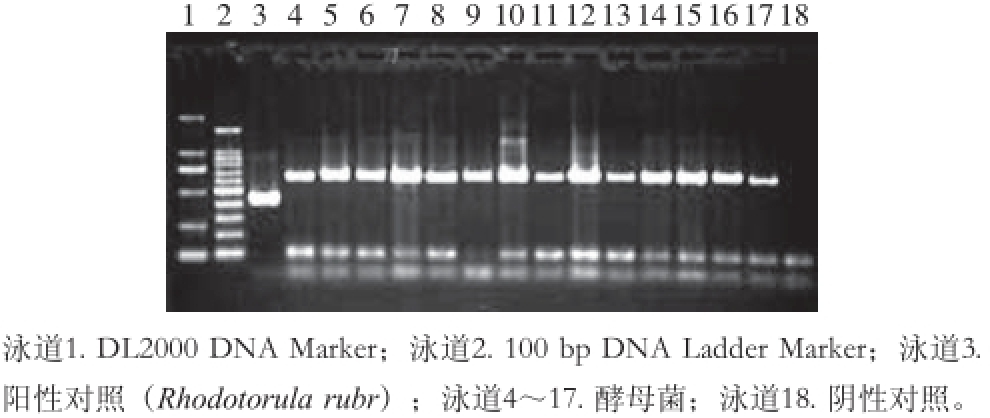
图3 ITS rDNA区域的PCR扩增产物电泳图
Fig. 3 Electrophoresis pattern of PCR amplification products of ITS rDNA genes from partial yeasts
测序后,将分离株的ITS区间序列与美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库进行比对,并与相应种的模式菌株构建系统发育树,结果见图4。各分离株均与相应模式菌株在同一分支上,亲缘关系相近,同源性较高,与26S rDNA D1/D2区域进化分析结果基本一致。在26S rDNA D1/D2区域序列分析中,YG001只能被鉴定到Cryptococcus属,在ITS序列分析中其与YI001亲缘关系较近,为进一步分析二者与Cryptococcus属酵母进化关系,构建了YG001、YI001与模式菌株的ITS序列系统发育树,结果见图5。
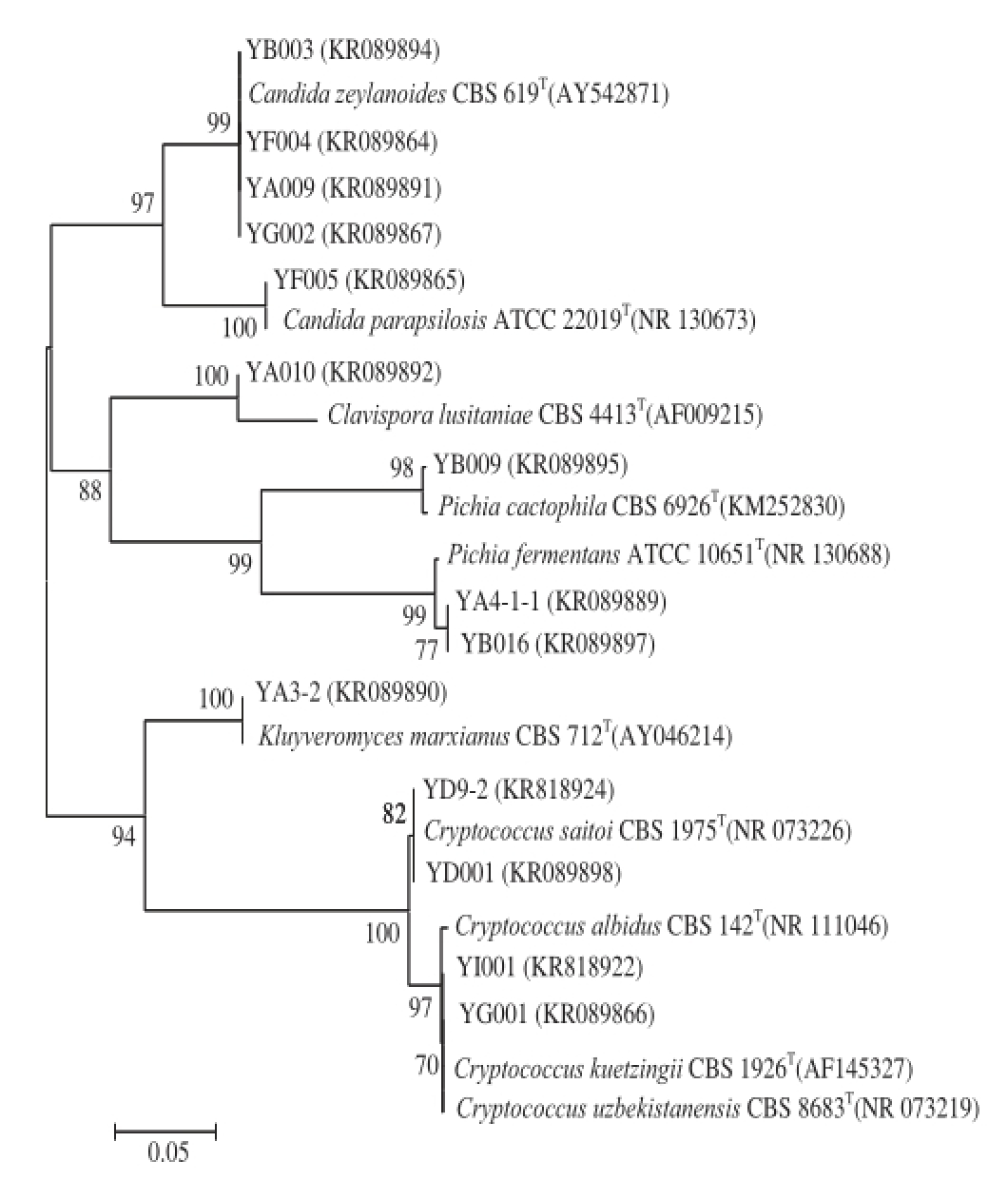
图4 酸马奶样品中代表性酵母菌的ITS rDNA序列的系统发育树
Fig. 4 Phylogenetic tree of representative yeasts isolated from koumiss products based on ITS rDNA sequences

图5 5 Cryptococcusoccus属酵母菌株的5.8S-ITS rDNA序列系统发育树
Fig. 5 Phylogenetic tree of Cryptococcus based on 5.8S-ITS rDNA sequences
由图5可知,YG001被聚在以Cryptococcus albidus CBS142
T为代表的分枝中,YI001与Cryptococcus uzbekistanensis CBS 8683
T处于同一分枝,因此将YG001鉴定为Cryptococcus albidus,YI001鉴定为Cryptococcus uzbekistanensis。对比26S rDNA D1/D2和ITS两种序列分析方法可发现,将两种方法相结合才能得到更加精确的结果。
2.4 两地区酸马奶样品中酵母菌的多样性分析
通过26S rDNA和5.8S-ITS rDNA序列分析鉴定,新疆和内蒙古两地酸马奶样品中酵母菌共鉴定为7 个属13 个种,分别是Candida parapsilosis、Candida zeylanoides、Clavispora lusitaniae、Cryptococcus albidus、Cryptococcus saitoi、Cryptococcus uzbekistanensis、Kluyveromyces marxianus、Pichia cactophila、Pichia fermentans、Rhodotorula dairenensis、Rhodotorula mucilaginosa、Saccharomyces cerevisiae和Saccharomycopsis crataegensis。
表3 酵母菌在两地区酸马奶样品中的检出率
Table 3 Frequency of indigenous yeast species in koumiss from two regions %
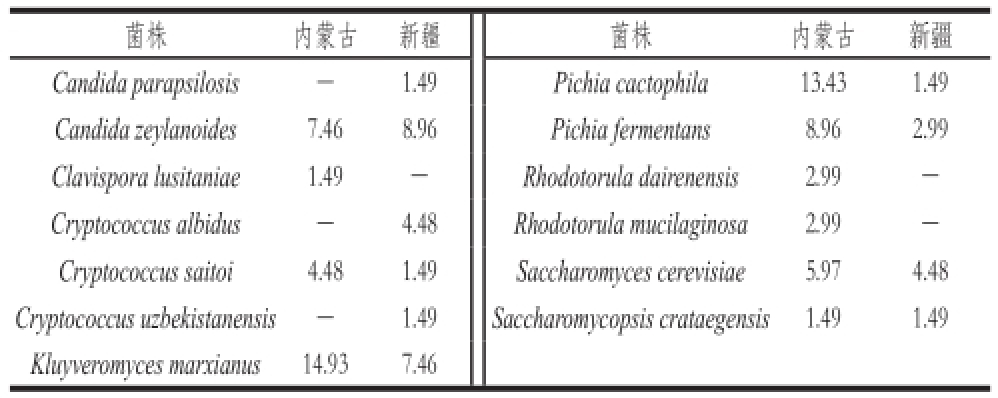
注:-.未分离出该酵母菌。
菌株内蒙古新疆菌株内蒙古新疆Candida parapsilosis-1.49 Pichia cactophila13.431.49 Candida zeylanoides7.468.96Pichia fermentans8.962.99 Clavispora lusitaniae1.49-Rhodotorula dairenensis2.99-Cryptococcus albidus-4.48Rhodotorula mucilaginosa2.99-Cryptococcus saitoi4.481.49Saccharomyces cerevisiae5.974.48 Cryptococcus uzbekistanensis- 1.49Saccharomycopsis crataegensis1.491.49 Kluyveromyces marxianus14.937.46
两地区酸马奶样品中的酵母菌分布如表3所示。不同地区酸马奶中酵母菌的组成不尽相同,其中内蒙古牧区酸马奶样品中共分离出7 个属9 个种,新疆牧区酸马奶样品中共分离出5 个属9 个种。两地间酵母菌的检出率也有所不同。在内蒙古地区样品中,以检出率为评价指标的优势菌是Kluyveromyces marxianus(14.93%)和Pichia cactophila(13.43%),其他酵母菌低于10%。新疆样品中,优势菌是Candida zeylanoides(8.96%)和Kluyveromyces marxianus(7.46%)。重复性实验结果一致,可看出两地间酵母菌资源存在差异,该差异可能与样品制作工艺、各地区的气候环境及采样时间等因素有关。
2.5 优良酵母菌筛选
本实验对酸马奶中优势酵母菌的发酵特性进行研究并根据其产酒精、产酸特性及感官评定结果优选出4 株与乳酸菌复配后发酵特性较好的酵母菌株,其中有2 株为Pichia cactophila,其余两株分别为Kluyveromyces marxianus和Candida zeylanoides,筛选结果见表4。
表4 优选酵母菌发酵特性比较
Table 4 Screening results of different yeast species in koumiss from two regions
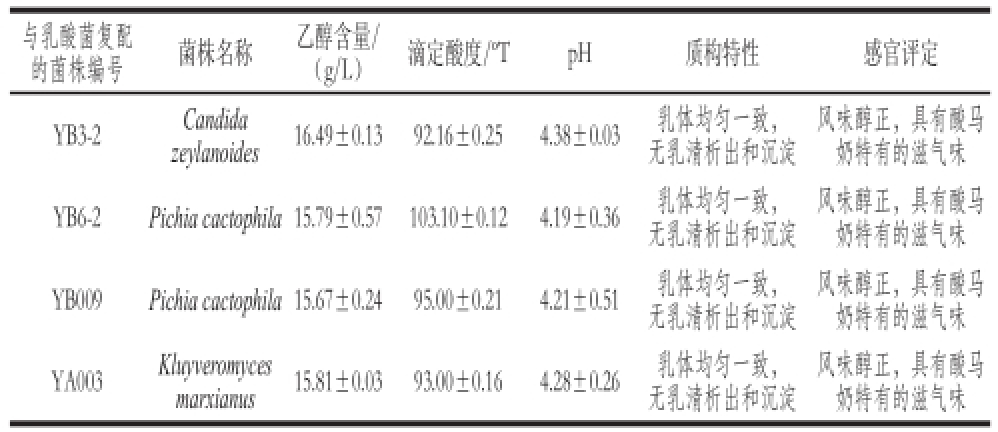
与乳酸菌复配的菌株编号菌株名称乙醇含量/(g/L)滴定酸度/ºTpH质构特性感官评定YB3-2Candida风味醇正,具有酸马奶特有的滋气味YB009Pichia cactophila15.67±0.2495.00±0.214.21±0.51乳体均匀一致,无乳清析出和沉淀风味醇正,具有酸马奶特有的滋气味YB6-2Pichia cactophila15.79±0.57103.10±0.124.19±0.36乳体均匀一致,无乳清析出和沉淀zeylanoides16.49±0.1392.16±0.254.38±0.03乳体均匀一致,无乳清析出和沉淀风味醇正,具有酸马奶特有的滋气味YA003Kluyveromyces marxianus15.81±0.0393.00±0.164.28±0.26乳体均匀一致,无乳清析出和沉淀风味醇正,具有酸马奶特有的滋气味
乙醇是酵母菌代谢过程中的标志性代谢产物之一,对产品风味的形成起着关键性的作用。但在酵母菌株发酵过程中,乙醇含量的增长会损害其细胞膜运输物质的功能,影响细胞内物质浓度的变化,从而影响发酵过程中酵母菌株的数量,所以在酵母菌筛选过程中需考虑此因素,选择优良菌株进行后期发酵实验。从表4可看出,优选出的4 株酵母菌株乙醇产量可达到15.67~16.49 g/L,其中产乙醇量最多的是YB3-2,为16.49 g/L,产乙醇量最少的是YB009,为15.67 g/L,均适合应用于发酵乳的生产。发酵乳的酸度也与其风味密切相关,其中pH值和滴定酸度是衡量其酸度的重要指标。由表4可知,发酵结束后滴定酸度达到92.16~103.10 ºT,pH值为4.19~4.38。发酵乳的感官特性和质构特性也直接影响其品质。感官评定结果显示,4 株酵母菌与乳酸菌按一定比例复配发酵后,制成的产品具有酸马奶特有的滋气味,风味醇正,乳体均匀一致,可作为工厂化生产酸马奶的发酵剂。
3 讨 论
本研究应用26S rDNA和ITS序列分析法相结合对分离自新疆和内蒙古酸马奶样中的酵母菌进行了鉴定。酵母菌的传统鉴定主要以细胞表型特征为依据,包括形态、生理、生化等方面,费时费力,而且有时不够准确
[1]。近年来发展起来的26S rDNA D1/D2区及内转录间隔区ITS序列分析技术能克服传统鉴定方法的诸多不足,可快速、准确地对酵母菌进行鉴定。真菌的26S rDNA可分为D1、D2、…D12等多个区域,其中D1/D2区域序列长度为500~600 bp左右,可用于真菌鉴定
[21]。几乎所有已知酵母种模式株的D1/D2区序列都已被测定。真菌的ITS包括ITS1及ITS2两部分,全长在300~1 000 bp左右,进化速率快,具有多态性,对于亲缘关系较近的菌株区分鉴定较适合
[22]。故使用26S rDNA D1/D2和ITS序列分析法相结合可将绝大多数未知酵母菌鉴定到种。
目前,有关酸马奶中酵母菌的多样性报道较多,在不同地域有不同的种类和优势类群。倪慧娟等
[23]对新疆采集的28 份酸马奶样品分离纯化得到87 株酵母菌,判定Saccharomyces unisporus和Kluyveromyces marxianus为优势菌,Mu等
[4]对青海、新疆、内蒙古3 个地区酸马奶样品中的酵母菌进行分离鉴定,发现优势菌为Kluyveromyces marxianus、Kazachstania unispora 和Saccharomyces cerevisiae,这些结果与本研究存在异同。这可能是由于采样点和采样季节的不同所造成的,样品间菌相差异与制作工艺、地理环境和温度密切相关,不同地区、不同季节的样品其中的含菌量和种类可能不同。Gadaga等
[24]在研究津巴布韦发酵牛乳时同样发现了其中酵母菌的数量及分布在不同地区样品中存在着差异。Wu Xiaohe等
[25]认为发酵乳微生物组成的差异可能跟其海拔高度、发酵预处理或发酵过程有关。本实验中酸马奶样品分别采自新疆和内蒙古10 个不同采样点,各采样点独特的地理环境及制作工艺使其微生物的数量和分布有所差异。两个地区间共有的酵母菌分别是Candida zeylanoides、Cryptococcus saitoi、Kluyveromyces marxianus、Pichia cactophila、Pichia fermentans、Saccharomyces cerevisiae和Saccharomycopsis crataegensis。这些酵母菌在骆驼乳
[26]和奶酪
[27]中也有报道。其中最主要的Kluyveromyces marxianus以乳糖为碳源,广泛存在于多种发酵乳制品中,能产生乙醇和乙醛,有助于产品风味的形成,可判定为酸马奶中的优势菌,有研究表明其在“藏灵菇”中亦是一种重要菌相
[28];Candida zeylanoides具有一定产乙醇能力,常见于新鲜奶酪中,在云南乳饼中也被判定为优势菌
[29];Pichia fermentans在生理生化方面的特征是能强烈同化柠檬酸盐和D-木糖,并能产生微量的酯类物质,利于产品综合风味的形成。从数量和分布上判定,Kluyveromyces、Pichia和Candida是酸马奶中的优势菌属,这与Montanari等
[30]的研究结果基本一致。酸马奶中酵母菌的多样性赋予了产品独特的风味和口感,使不同地区酸马奶具有不同的地域特色。
4 结 论
分离自新疆和内蒙古酸马奶样中的酵母菌共鉴定出了7 个属13 个种。通过对两地区酸马奶样品中酵母菌的分布进行比较分析发现,不同地区样品的酵母菌组成及优势菌群有所不同。内蒙古地区优势菌为Kluyveromyces marxianus、Pichia cactophila和Pichia fermentans。新疆地区优势菌为Candida zeylanoides和Kluyveromyces marxianus。
优选出4 株发酵性能良好的酵母菌,其中2 株为Pichia cactophila,其余2 株分别为Kluyveromyces marxianus和Candida zeylanoides。这4 株酵母菌具有特性各异的产酸、产香、产乙醇能力,需按比例复配,协同发挥作用制备优质发酵乳,用于新型发酵乳制品开发。
参考文献:
[1] YANG J J, GUO C F, GE W P, et al. Isolation and identifi cation of yeast in yak milk dreg of Tibet in China[J]. Dairy Science & Technology, 2014, 94(5): 455-467. DOI:10.1007/s13594-014-0172-7.
[2] BAO Q H, LIU W J, YU J, et al. Isolation and identifi cation of cultivable lactic acid bacteria in traditional yak milk products of Gansu province in China[J]. Journal of General and Applied Microbiology, 2012, 58: 95-105. DOI:10.2323/jgam.58.95.
[3] 南志强. 西藏地区发酵牛乳的化学组成和微生物分析及乳酸菌的分离与筛选[D]. 拉萨: 西藏大学, 2010: 21-26.
[4] MU Z, YANG X, YUAN H. Detection and identifi cation of wild yeast in Koumiss[J]. Food Microbiology, 2012, 31(2): 301-308. DOI:10.1016/ j.fm.2012.04.004.
[5] WATANABE K, FUJIMOTO J, SASAMOTO M, et al. Diversity of lactic acid bacteria and yeasts in Airag and Tarag, traditional fermented milk products of Mongolia[J]. World Journal of Microbiology and Biotechnology, 2007, 24(8): 1313-1325. DOI:10.1007/s11274-007-9604-3.
[6] XIE Y, AN H, HAO Y, et al. Characterization of an anti-Listeria bacteriocin produced by Lactobacillus plantarum LB-B1 isolated from koumiss, a traditionally fermented dairy product from China[J]. Food Control, 2011, 22(7): 1027-1031. DOI:10.1016/j.foodcont.2010.12.007.
[7] ISHII S, KONAGAYA Y. Beneficial role of koumiss intake of Mongolian Nomads[J]. Journal of the Japanese Society for Nutrition and Food Sciences, 2002, 55: 281-285.
[8] CHAVES-LOPEZ C, SERIO A, MARTUSCELLI M, et al. Microbiological characteristics of kumis, a traditional fermented Colombian milk, with particular emphasis on enterococci population[J]. Food Microbiology, 2011, 28(5): 1041-1047. DOI:10.1016/ j.fm.2011.02.006.
[9] JAKOBSEN M, NARVHUS J. Yeasts and their possible beneficial and negative effects on the quality of dairy products[J]. International Dairy Journal, 1996, 6: 755-768. DOI:10.1016/0958-6946(95)00071-2.
[10] DANOVA S, PETROV K, PAVLOV P, et al. Isolation and characterization of Lactobacillus strains involved in koumiss fermentation[J]. International Journal of Dairy Technology, 2005, 58(2): 100-105. DOI:10.1111/j.1471-0307.2005.00194.x.
[11] GUO C F, ZHANG S, YUAN Y H, et al. Comparison of lactobacilli isolated from Chinese suan-tsai and koumiss for their probiotic and functional properties[J]. Journal of Functional Foods, 2015, 12: 294-302. DOI:10.1016/j.jff.2014.11.029.
[12] 倪慧娟. 新疆地区和青海地区传统发酵乳制品中酵母菌的生物多样性[D]. 呼和浩特: 内蒙古农业大学, 2009: 24-60. DOI:10.7666/ d.y1474335.
[13] 卫生部. GB 4789.15—2010 食品微生物学检验 霉菌和酵母计数[S].北京: 中国标准出版社, 2010.
[14] 卫生部. GB 4789.35—2010 食品微生物学检验 乳酸菌检验[S]. 北京: 中国标准出版社, 2010.
[15] CLETUS P, KURTZMAN, ROBNETT C J. Identification and phylogeny of ascomycetous yeasts from analysis of nuclear large subunit (26S) ribosomal DNA partial sequences[J]. Antonie van Leeuwenhoek, 1998, 73: 331-371. DOI:10.1023/A:1001761008817.
[16] ZHANG J, LIU W, SUN Z, et al. Diversity of lactic acid bacteria and yeasts in traditional sourdoughs collected from western region in Inner Mongolia of China[J]. Food Control, 2011, 22(5): 767-774. DOI:10.1016/ j.foodcont.2010.11.012.
[17] 卫生部. GB 5413.34—2010 乳和乳制品酸度的测定[S]. 北京: 中国标准出版社, 2010.
[18] ROMANO P, FIORE C, PARAGGIO M, et al. Function of yeast species and strains in wine flavour[J]. International Journal of Food Microbiology, 2003, 86: 169-180. DOI:10.1016/S0168-1605(03)00290-3.
[19] 吴谋成. 食品分析与感官评定[M]. 北京: 中国农业出版社, 2002: 136-138.
[20] 袁方策, 杨发相. 新疆地貌的基本特征[J].干旱区地理, 1990, 13(3): 1-5. DOI:10.13826/j.cnki.cn65-1103/x.1990.03.001.
[21] KURTZMAN C P, ROBNETT C J. Identification of clinically important ascomycetous yeasts based on nucleotide divergence in 5’ end of the large-subunit (26S) ribosomal DNA gene[J]. Journal of Clinical Microbiology, 1997, 35: 1216-1223.
[22] GROENEWALD M, ROBERT V, SMITH M T. The value of the D1/ D2 and internal transcribed spacers (ITS) domains for the identifi cation of yeast species belonging to the genus Yamadazyma[J]. Persoonia, 2011, 26: 40-46. DOI:10.3767/003158511X559610.
[23] 倪慧娟, 包秋华, 孙天松, 等. 新疆地区酸马奶中酵母菌的鉴定及其生物多样性分析[J]. 微生物学报, 2007, 47(4): 578-582. DOI:10.13343/ j.cnki.wsxb.2007.04.003.
[24] GADAGA T H, MUTUKUMIRA A N, NARVHUS J A. The growth and interaction of yeasts and lactic acid bacteria isolated from Zimbabwean naturally fermented milk in UHT milk[J]. International Journal of Food Microbiology, 2001, 68: 21-32. DOI:10.1016/S0168-1605(01)00466-4.
[25] WU X H, LUO Z, YU L, et al. A survey on composition and microbiota of fresh and fermented yak milk at different Tibetan altitudes[J]. Dairy Science & Technology, 2009, 89: 201-209. DOI:10.1051/dst/2009007.
[26] SHOKRI H, KHOSRAVI A, SHARIFZADEH A, et al. Isolation and identifi cation of yeast fl ora from genital tract in healthy female camels (Camelus dromedarius)[J]. Veterinary Microbiology, 2010, 144(1/2): 183-186. DOI:10.1016/j.vetmic.2009.12.012.
[27] PADILLA B, BELLOCH C, LÓPEZ -DíEZ J J, et al. Potential impact of dairy yeasts on the typical flavour of traditional ewes’ and goats’ cheeses[J]. International Dairy Journal, 2014, 35(2): 122-129. DOI:10.1016/j.idairyj.2013.11.002.
[28] 周剑忠, 董明盛, 江汉湖. PCR-DGGE指纹技术与分离技术结合筛选藏灵菇奶发酵过程的优势菌[J]. 中国农业科学, 2006, 39(8): 1632-1638. DOI:10.3321/j.issn:0578-1752.2006.08.017.
[29] 卿蔓君, 白梅, 张勇, 等. 西藏曲拉和云南乳饼中酵母菌的鉴定及其生物多样性[J]. 微生物学报, 2010, 50(9): 1141-1146. DOI:10.13343/ j.cnki.wsxb.2010.09.014.
[30] MONTANARI G, ZAMBONELLI C, GRAZIA L, et al. Saccharomyces unisporus as the principal alcoholic fermentation microorganism of traditional koumiss[J]. Journal of Dairy Science, 1996, 63: 327-331.
Diversity and Fermentation Characteristics of Yeasts in Koumiss Collected from Inner Mongolia and Xinjiang
ZHANG Xiaoxu
1, GE Wupeng
1,*, LIANG Xiuzhen
2, LI Xiaopeng
3, SHI Yaxin
1, MA Junying
1, FANG Ruoyu
1, GENG Wei
4
(1. College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China; 2. Shaanxi Feitian Dairy Co. Ltd., Baoji 721100, China; 3. Xianyang Food and Drug Inspection Center, Xianyang 712000, China; 4. Xianyang Institute of Quality and Technology Inspection, Xianyang 712000, China)
Abstract:The aim of this study was to analyze the diversity and fermentation characteristics of the yeasts in koumiss collected from Inner Mongolia and Xinjiang. After isolation and purifi cation, the yeasts were identifi ed by 26S rDNA and ITS sequences. Excellent yeasts were selected according to alcohol yield, acid yield, texture and sensory evaluation. The results indicated that the number of yeast colonies in koumiss from Inner Mongolia was 10
5CFU/mL, while the number of yeast colonies in koumiss from Xinjiang samples ranged from 10
5to 10
7CFU/mL. Thirteen species including Kluyveromyces marxianus, Pichia fermentans, Pichia cactophila and Candida zeylanoides were identifi ed. The compositions of yeast species in koumiss samples from different regions were different. In Inner Mongolia samples, nine species were identified with the dominant species being Kluyveromyces marxianus, Pichia cactophila and Pichia fermentans. In Xinjiang samples, the dominant species were Kluyveromyces marxianus and Candida zeylanoides. Four excellent yeast strains including two strains of Pichia cactophila, one strain of Kluyveromyces marxianus and one strain of Candida zeylanoides were selected. They all had excellent fermentation characteristics and could be used in the production of novel fermented dairy products.
Key words:koumiss; yeast; isolation and identifi cation; screening
DOI:10.7506/spkx1002-6630-201617026
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2016)17-0156-07
收稿日期:2015-10-17
基金项目:陕西省战略新兴产业重大产品项目(2015KTCQ03-08)
作者简介:张晓旭(1989—),女,硕士研究生,研究方向为食品科学。E-mail:zxiaoxu2012@163.com
*通信作者:葛武鹏(1965—),男,副教授,博士,研究方向为食品生物技术。E-mail:josephge@sina.com
引文格式:








