胡凯弟 1,邓维琴 1,陈树平 1,柴先杜 1,刘爱平 1,卓文杰 1,刘书亮 1,2,*
(1.四川农业大学食品学院,四川 雅安 625014;2.四川农业大学,食品加工与安全研究所,四川 雅安 625014)
摘 要:以1 株分离自酱油曲的米曲霉(Aspergillus oryzae)M-4为材料,初步研究其降解己烯雌酚(diethylstilbestrol,DES)的特性。米曲霉M-4对DES的降解率与菌体生物量呈正相关,在基础盐培养基(mineral salt medium,MM)中培养9 d对100 mg/L的DES降解率为93%。动力学研究表明,该菌株降解DES的过程符合一级动力学方程,在所测试的培养温度、初始pH值、底物质量浓度范围内,DES半衰期为1.645~5.295 d。培养温度30 ℃和偏酸性环境有利于其对DES的降解;底物质量浓度越高,其半衰期越长。
关键词:己烯雌酚;降解;米曲霉;特性
胡凯弟, 邓维琴, 陈树平, 等. 米曲霉Aspergillus oryzae M-4降解己烯雌酚的特性研究[J]. 食品科学, 2016, 37(17): 169-172. DOI:10.7506/spkx1002-6630-201617028. http://www.spkx.net.cn
HU Kaidi, DENG Weiqin, CHEN Shuping, et al. Degradation characteristics of diethylstilbestrol by Aspergillus oryzae M-4[J]. Food Science, 2016, 37(17): 169-172. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201617028. http://www.spkx.net.cn
己烯雌酚(diethylstilbestrol,DES)是一种非甾体类、人工合成的雌激素,具有与天然雌激素如雌二醇等相同的生物活性。曾在20世纪40—60年代广泛针对女性内分泌失调、避孕等雌激素治疗和作为兽药用于畜牧业 [1-2]。但是随着研究发现DES具有免疫毒性、神经毒性 [3]、基因毒性、生殖毒性 [4]和内分泌毒性 [5],属于“三致物”,且会殃及后代 [6];美国和欧盟相继于1971年和1978年颁布法令禁止使用DES [7],我国农业部随后也出台了相应规定 [2],国际癌症研究中心已将其列为Ⅰ类人类致癌物 [1]。DES的大量使用,加之不易挥发且难降解,使其残留于土壤和水体中 [8-9],如在中国和西班牙河流中均检出有DES [10]。同时DES可在水生生物中富集 [11],并通过食物链传播,经胃肠道吸收滞留于脂肪组织中 [1],对人体健康造成巨大损伤。已有报道称某些动物源食品检出DES [12-13],因此如何消除环境及食品中的DES已成为亟需解决的问题。
消除DES的方法主要有化学氧化法 [14]、物理吸附法 [15]和生物降解法。相比于物化法处理,微生物降解由于其温和、有效、低成本、绿色且无二次污染等优点受到愈来愈多地关注,已被用于苯酚、有机磷类农药和拟除虫菊酯类农药等异生物质降解的研究中 [16-17]。筛选具有高效降解DES的功能微生物有望实现环境修复,但迄今为止关于降解DES的菌株及其降解特性的文献甚少,仅见Zhang Weiwei等 [18]筛选到一株假单胞菌(Pseudomonas sp.)J51和徐冉芳等 [19]筛选到的沙雷氏菌(Serratia sp.)S,且分别来自于受污染的海水和污泥,而真菌还鲜见报道。米曲霉(Aspergillus oryzae)M-4是一株分离自酱油曲 [20],可在基础盐培养基中降解DES的功能菌株,5 d 对25 mg/L的DES降解率为53.38% [21]。本实验对菌株M-4降解DES的特性进行初步研究,旨在为进一步探究DES降解机理和应用于食品中消除DES残留提供理论依据和数据参考。
1.1 菌株与试剂
米曲霉(Aspergillus oryzae)M-4,由四川农业大学食品微生物实验室分离并保存。
DES标准品(99.5%) 德国Dr. Ehrenstorfer公司;甲醇 瑞典Oceanpak公司。
1.2 培养基
基础无机盐培养基(mineral salt medium,MM):(NH 4) 2SO 41.5 g、K 2HPO 41.5 g、KH 2PO 40.5 g、NaCl 0.5 g、MgSO 40.2 g、吐温-80 2 g,超纯水1 000 mL,pH 7.5。葡萄糖土豆培养基(potato dextrose medium,PD):新鲜去皮土豆200 g、葡萄糖2 g,水1 000 mL,pH 7.0,固体培养基(potato dextrose agar,PDA)添加质量分数2%的琼脂。孢子洗脱液:吐温-80 0.2 g、琼脂0.1 g,蒸馏水100 mL。以上培养基和洗脱液均121 ℃灭菌15 min。DES母液配制:准确称取适量DES,用无水乙醇溶解并定容,配制成质量浓度为5 mg/mL的母液备用。
1.3 仪器与设备
LC-10A2010CHT型液相色谱仪、LC-Solution工作站日本Shimazu公司;AS10200A超声波清洗器 天津奥特赛恩斯公司;Milli-Q Gradient超纯水仪 美国Millipore公司;Sorvall ST 16R冷冻离心机 美国Thermo Fisher Scientifi c公司。
1.4 方法
1.4.1 菌种活化及种子液的制备
取菌株M-4划线于PDA斜面,28 ℃培养72 h进行活化。挑取活化好的菌株连续2 次划线于含DES的PDA斜面(DES质量浓度为50 mg/L)进行驯化(28 ℃,72 h);用5 mL孢子洗脱液洗下菌体并调整孢子浓度为10 8CFU/mL,制成种子液。
1.4.2 DES的提取与测定
取整瓶培养液,加入等体积甲醇;超声波(40 kHz,300 W)辅助提取30 min;吸取2 mL并用甲醇定容至10 mL,混匀后12 000 r/min离心15 min。取上清液过0.45 μm有机相滤膜,弃去初滤液,取续滤液供高效液相色谱(high performance liquid chromatography,HPLC)检测DES残留质量浓度 [21]。
检测条件 [21]:色谱柱为Sepax GP-C 18柱(150 mm×4.6 mm,5.0 μm);流动相为甲醇-水(70∶30,V/V),流速0.7 mL/min;紫外检测器,其波长为242 nm;柱温:25 ℃;进样量:10 μL。DES降解率按式(1)计算。
式中:ρ 0为空白对照中DES总质量浓度/(mg/L);ρ为样品培养液中DES残留质量浓度/(mg/L)。
1.4.3 米曲霉M-4生长曲线的测定
将菌株M-4种子液按体积分数5%的接种量分别接种于PD培养基、PD+DES培养基(100 mg/L DES)和MM+DES培养基(100 mg/L DES)中,分装30 mL/250 mL锥形瓶中。于28 ℃、140 r/min振荡培养,分别在1、2、3、4、5、6、7、8、9 d取整瓶培养液,过滤后取菌丝体于80 ℃干燥至恒质量,结果以供试菌生物量表示。实验重复3 次,取平均值。
1.4.4 米曲霉M-4降解曲线的测定
将菌株M-4种子液按体积分数5%的接种量接种于含100 mg/L DES的MM培养基中,分装30 mL/250 mL锥形瓶,设置添加等量无菌生理盐水为空白对照,于28 ℃、140 r/min振荡培养。 分别在1、2、3、4、5、6、7、8、9 d取整瓶培养液,检测培养液中DES残留质量浓度。检测重复3 次,取平均值。
1.4.5 米曲霉M-4降解DES的动力学特性分析
固定DES反应体系中其他条件,改变菌株M-4降解DES体系中反应的某一环境条件(培养温度、初始pH值、底物质量浓度),定时取样,测定DES质量浓度,以一级动力学方程(the first-order kinetic equation)进行拟合,确定不同影响因素下的动力学特性。在Monod方程基础上,采用的微生物一级反应动力学方程为 [22]:
式中:K d为降解速率常数/(mg/(L·d));t为降解时间/d;ρ为DES质量浓度/(mg/L);ρ 0为初始DES质量浓度/(mg/L)。
1.4.5.1 培养温度对米曲霉M-4降解DES速率的影响
将菌株M-4种子液按体积分数5%的接种量接种于含有100 mg/L DES的MM培养基(初始pH 7.5)中,分装30 mL/250 mL锥形瓶,不同温度(25、30、35 ℃)条件下140 r/min振荡培养;分别在1、2、3、4、5、6、7、8、9 d取整瓶培养液,测定DES残留量,并以一级动力学方程拟合实验数据。
1.4.5.2 初始pH值对米曲霉M-4降解DES速率的影响
将菌株M-4种子液按体积分数5%的接种量接种于含有100 mg/L DES,不同初始pH值 (6.0、7.0、8.0)的MM培养基中,分装30 mL/250 mL锥形瓶,28 ℃、140 r/min振荡培养;分别在1、2、3、4、5、6、7、8、9 d取整瓶培养液,测定DES残留量,并以一级动力学方程拟合实验数据。
1.4.5.3 底物质量浓度对米曲霉M-4降解DES速率的影响
将菌株M-4种子液体积分数按5%的接种量接种于含有不同质量浓度(50、100、200 mg/L)DES的MM培养基(pH 7.5)中,分装30 mL/250 mL锥形瓶,28 ℃、140 r/min振荡培养;50 mg/L培养液取样时间为1、2、3、4、5 d;100 mg/L培养液取样时间为1、2、3、4、5、6、7、8、9 d;200 mg/L培养液取样时间为3、4、5、6、7、8、9、10、11、12、13 d;取整瓶培养液,测定DES残留量,并以一级动力学方程拟合实验数据。
1.5 数据处理
实验数据采用SPSS 22软件进行分析。
2.1 米曲霉M-4的生长曲线
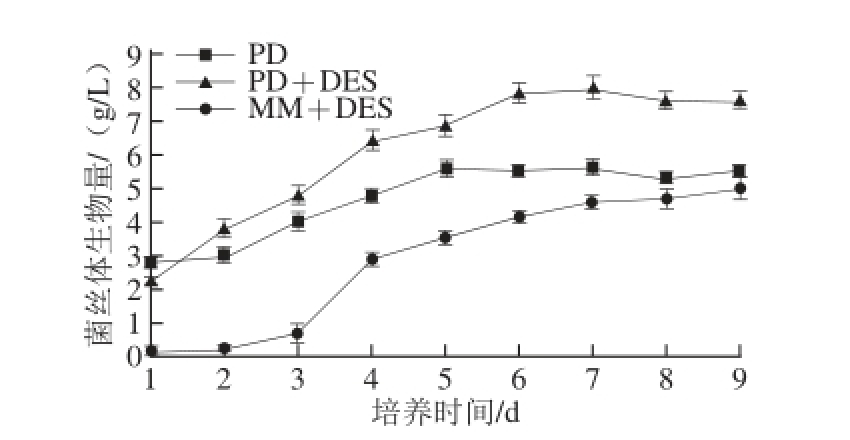
图1 不同培养基中米曲霉M-4的生长曲线
Fig. 1 Growth curves of Aspergillus oryzae M-4 in different media
比较菌株M-4在PD、PD+DES及MM+DES培养基中的生长情况,结果如图1所示,M-4在3 种培养基中生物量略有不同,但总体趋势一致;1~2 d生长缓慢,3 d后生长迅速,7 d后基本进入稳定期,表现为生物量增长缓慢至趋于稳定,最终菌丝体生物量分别为5.47、7.59、4.97 g/L;在此期间,菌株M-4在MM+DES培养基中细胞生物量较PD和PD+DES小。对比PD和PD+DES培养基中M-4生长曲线,可知一定质量浓度的DES可抑制菌株的初期生长,但并不影响其快速生长期的到来,且菌株M-4可利用DES及其代谢产物,从而使得加入DES后生物量较普通的更高,且差异显著(P<0.05)。
2.2 米曲霉M-4降解DES曲线
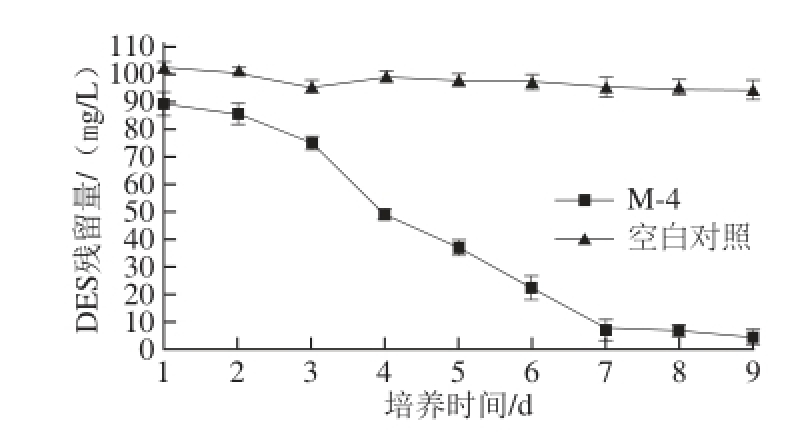
图2 米曲霉M-4对DES降解的影响
Fig. 2 Biodegradation curve of DES by Aspergillus oryzae M-4
菌株M-4在MM+DES培养基中(100 mg/L DES)经9 d培养后对DES降解情况如图2所示。除去空白对照组损失部分,菌株M-4在9 d内对DES的降解率达到93%;1~2 d时降解率较低,结合生长曲线可知此时菌株生长处于延滞期;3 d后伴随菌株M-4生物量的迅速增长,DES降解速率加快。
2.3 米曲霉M-4降解DES的动力学特性
2.3.1 培养温度对米曲霉M-4降解DES速率的影响
固定培养体系初始pH值和底物质量浓度,考察不同培养温度下菌株M-4对DES降解速率的影响。由表1可知,不同培养温度条件下菌株M-4对DES的降解符合一级动力学方程。30 ℃时半衰期最短,菌株对DES的降解能力最强;培养温度升高或降低,半衰期均延长。
表1 不同培养温度下米曲霉M-4对DES的降解动力学参数
Table 1 Kinetic equations for DES degradation at different culture temperatures by Aspergillus oryzae M-4

?
2.3.2 初始pH值对米曲霉M-4降解DES速率的影响
固定培养体系温度和底物质量浓度,考察不同初始pH值下菌株M-4对DES降解速率的影响。由表2可知,不同初始pH值下米曲霉M-4对DES的降解符合一级动力学方程。在初始pH值为6.0~8.0范围内,DES半衰期变化不大,pH 6.0时,半衰期最短。
表2 不同初始pH值条件下米曲霉M-4对DES的降解动力学方程
Table 2 Kinetic equations for DES degradation at different initial pH values by s by Aspergillus oryzae zae M-4M-4

初始pH动力学方程半衰期t 1/2/d相关系数R 26.0ρ=97.22e -1.534t1.8361.5340.918 8 7.0ρ=99.70e -1.745t1.9161.7450.930 1 8.0ρ=98.47e -0.964t2.4630.9640.893 4降解速率常数/(mg/(L·d))
2.3.3 底物质量浓度对米曲霉M-4降解DES速率的影响
固定培养体系温度和初始pH值,考察不同底物质量浓度条件下菌株M-4对DES降解速率的影响,结果见表3。不同底物质量浓度条件下,菌株M-4对DES的降解符合一级动力学方程。底物质量浓度在50~200 mg/L范围内,DES半衰期变化较大,在1.645~5.295 d之间。
表3 不同底物质量浓度米曲霉M-4对DES的降解动力学方程
Table 3 Kinetic equations for DES degradation at different DES concentrations by s by Aspergillus oryzae yzae M-4 M-4
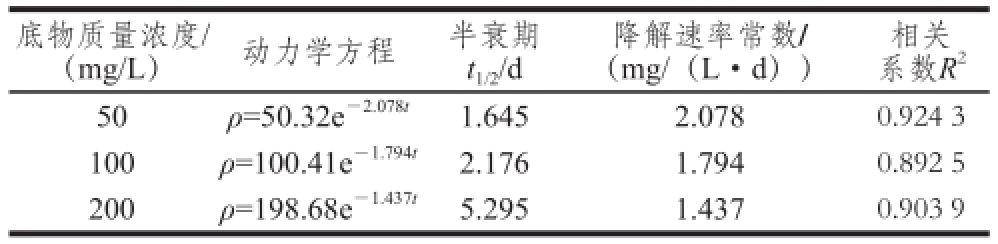
底物质量浓度/(mg/L)动力学方程半衰期t 1/2/d相关系数R 250ρ=50.32e -2.078t1.6452.0780.924 3 100ρ=100.41e -1.794t2.1761.7940.892 5 200ρ=198.68e -1.437t5.2951.4370.903 9降解速率常数/(mg/(L·d))
总体而言,菌株M-4降解DES受底物质量浓度影响较大,随着DES质量浓度的增加,半衰期也相应的延长,说明高质量浓度底物会对菌株产生一定的毒害作用 [23-24];培养温度对半衰期有一定影响,30 ℃时降解速率最大,与徐冉芳等 [19]关于Serratia sp. S降解DES特性研究的结果相类似;初始pH值影响较小,偏酸性有利于菌株M-4降解DES。
不同于分离自被污染地区的Pseudomonas sp. J51和Serratia sp. S [18-19],本实验所用米曲霉M-4来源于酱油曲,安全性良好;菌株M-4对DES的降解率与菌体生物量呈正相关,在MM培养基中培养9 d对100 mg/L的DES降解率为93%,降解能力远强于上述2 株细菌。DES可通过运输、污水、药物丢弃或掩埋进入土壤并被强力吸附,也可进入水体,难以降解 [1];菌株M-4对DES的降解过程符合一级动力学方程,在所测定的培养温度、初始pH值、底物质量浓度范围内,DES半衰期仅为1.645~5.295 d;培养温度30 ℃和偏酸性环境有利于DES的降解,底物质量浓度越高,其半衰期越长。综上所述,米曲霉M-4是一株可高效降解DES的有益真菌,具有良好的应用前景。
参考文献:
[1] MITRA M S, PHILIP B K. Encyclopedia of toxicology[M]. 3rd ed. Amsterdam: Elsevier, 2014: 143-145. DOI:10.1016/B978-0-12-386454-3.00449-8.
[2] 黄芬, 叶绍辉, 龚振明. 己烯雌酚的研究进展[J]. 中国畜牧兽医, 2007, 34(2): 51-54.
[3] RYAN B C, VANDENBERGH J G. Developmental exposure to environmental estrogens alters anxiety and spatial memory in female mice[J]. Hormones and Behavior, 2006, 50(1): 85-93. DOI:10.1016/ j.yhbeh.2006.01.007.
[4] vom SAAL F S, TIMMS B G, MONTANO M M, et al. Prostate enlargement in mice due to fetal exposure to low doses of estradiol or diethylstilbestrol and opposite effects at high doses[J]. Proceedings of the National Academy of Sciences, 1997, 94(5): 2056-2061.
[5] SAFEA S. Endocrine disruptors and human health: is there a problem[J]. Toxicology, 2004, 205(1/2): 3-10. DOI:10.1016/ j.tox.2004.06.032.
[6] NEWBOLD R R, HANSON R B, JEFFERSON W N, et al. Proliferative lesions and reproductive tract tumors in male descendants of mice exposed developmentally to diethylstilbestrol[J]. Carcinogenesis, 2000, 21(7): 1355-1363. DOI:10.1093/carcin/21.7.1355.
[7] GIUSTI R M, IWAMOTO K, HATCH E E. Diethylstilbestrol revisited: a review of the long-term health effects[J]. Annals of Internal Medicine, 1995, 122(10): 778-788. DOI:10.7326/0003-4819-122-10-199505150-00008.
[8] CHEN T S, CHEN T C, YEH K J C, et al. High estrogen concentrations in receiving river discharge from a concentrated livestock feedlot[J]. Science of the Total Environment, 2010, 408(16): 3223-3230. DOI:10.1016/j.scitotenv.2010.03.054.
[9] HERNANDO M D, MEZCUA M, FERNÁDEZ-ALBA A R, et al. Environmental risk assessment of pharmaceutical residues in wastewater effl uents, surface waters and sediments[J]. Talanta, 2006, 69(2): 334-342. DOI:10.1016/j.talanta.2005.09.037.
[10] KUSTER M, de ALDA M J L, HERNANDO M D, et al. Analysis and occurrence of pharmaceuticals, estrogens, progestogens and polar pesticides in sewage treatment plant effl uents, river water and drinking water in the Llobregat river basin (Barcelona, Spain)[J]. Journal of Hydrology, 2008, 358(1): 112-123. DOI:10.1016/ j.jhydrol.2008.05.030.
[11] KATAGI T. Reviews of environmental contamination and toxicology[M]. New York: Springer, 2010: 1-132. DOI:10.1007/978-1-4419-1440-9_1.
[12] ZHANNG Q L, LI J, MA T T, et al. Chemiluminescence screening assay for diethylstilbestrol in meat[J]. Food Chemistry, 2008, 111(2): 498-502. DOI:10.1016/j.foodchem.2008.04.010.
[13] YANG Y, CHEN J, SHI Y P. Determination of diethylstilbestrol in milk using carbon nanotube-reinforced hollow fiber solidphase microextraction combined with high-performance liquid chromatography[J]. Talanta, 2012, 97: 222-228. DOI:10.1016/ j.talanta.2012.04.021.
[14] 张秋香, 唐晓姝, 孙媛媛, 等. US-Fenton法降解水中的己烯雌酚[J].食品工业科技, 2013, 34(21): 215-218; 223. DOI:10.13386/ j.issn1002-0306.2013.21.092.
[15] 危晶, 何奕轩, 王邃. 石墨烯/Fe 3O 4磁性纳米材料分散固相萃取环境水样中的己烯雌酚[J]. 分析测试学报, 2012, 31(10): 1223-1228. DOI:10.3969/j.issn.1004-4957.2012.10.002.
[16] SINGH B K, WALKER A. Microbial degradation of organophosphorus compounds[J]. FEMS Microbiology Reviews, 2006, 30(3): 428-471. DOI:10.1111/j.1574-6976.2006.00018.x.
[17] BASHA K M, RAJENDRAN A, THANGAVELU V. Recent advances in the biodegradation of phenol: a review[J]. Asian Journal Experimental Biological Science, 2010, 1(2): 219-234.
[18] ZHANG W, NIU Z, LIAO C, et al. Isolation and characterization of Pseudomonas sp. strain capable of degrading diethylstilbestrol[J]. Applied Microbiology and Biotechnology, 2013, 97(9): 4095-4104. DOI:10.1007/s00253-012-4648-1.
[19] 徐冉芳, 孙敏霞, 刘娟, 等. 己烯雌酚降解菌株沙雷氏菌的分离鉴定及其降解特性[J]. 环境科学, 2014, 35(8): 3169-3174. DOI:10.13227/ j.hjkx.2014.08.047.
[20] 喻志强, 迟原龙, 高涵, 等. 米曲霉产3-苯氧基苯甲酸降解酶条件及酶性质的研究[J]. 食品科技, 2014, 39(6): 17-20. DOI:10.13648/ j.cnki.spkj.2014.06.004.
[21] 邓维琴, 李阿霜, 彭贤, 等. 高效液相色谱-紫外检测法测定微生物降解体系中己烯雌酚含量[J]. 食品与机械, 2016, 32(1): 51-55. DOI:10. 13652/j. issn.1003-5788.2016.01.012.
[22] 李建龙, 邵向丽, 刘书亮, 等. 邻苯二甲酸二丁酯降解菌株的筛选鉴定及其降解特性研究[J]. 现代食品科技, 2014, 30(10): 108-114; 244. DOI:10.13982/j.mfst.1673-9078.2014.10.019.
[23] 杨俊, 姜理英, 陈建孟. 1 株17β-雌二醇高效降解菌的分离鉴定及降解特性[J]. 环境科学, 2010, 31(5): 1313-1319. DOI:10.13227/ j.hjkx.2010.05.025.
[24] 邓伟光, 谌建宇, 李小明, 等. 壬基酚和双酚A降解菌株的分离、鉴定和特性研究[J]. 环境科学学报, 2013, 33(3): 700-707. DOI:10.13671/j.hjkxxb.2013.03.003.
Degradation Characteristics of Diethylstilbestrol by Aspergillus oryzae M-4
HU Kaidi
1, DENG Weiqin
1, CHEN Shuping
1, CHAI Xiandu
1, LIU Aiping
1, ZHUO Wenjie
1, LIU Shuliang
1,2,*
(1. College of Food Science, Sichuan Agricultural University, Ya’an 625014, China; 2. Research Institute of Food Processing and Security, Sichuan Agricultural University, Ya’an 625014, China)
Abstract:Aspergillus oryzae M-4, isolated from soy sauce koji, was applied in the present study to investigate its degradation characteristics for diethylstilbestrol (DES). The degradation rate of DES had a positive correlation with the biomass of Aspergillus oryzae M-4 and reached up to 93% when the strain was cultured in MM medium with 100 mg/L DES for 9 d. Kinetic studies indicated that the process of degradation fi tted well with a fi rst-order kinetic equation. The half-life of DES was 1.645–5.295 d under the tested conditions of culture temperature, initial pH and substrate concentration. Culture temperature of 30 ℃ and acidic environment were favorable for the degradation of DES, while high concentration of DES extended its half-life.
Key words:diethylstilbestrol (DES); degradation; Aspergillus oryzae; characteristics
DOI:10.7506/spkx1002-6630-201617028
中图分类号:TS201.6
文献标志码:A
文章编号:1002-6630(2016)17-0169-04
收稿日期:2016-03-31
基金项目:四川省农业科技成果转化资金项目(14NZ0012)
作者简介:胡凯弟(1992—),男,硕士研究生,研究方向为食品微生物。E-mail:kaidiminer@163.com
*通信作者:刘书亮(1968—),男,教授,博士,研究方向为食品微生物与发酵工程。E-mail:lsliang999@163.com
引文格式: