吴 娱,王开萍,唐正江,汤 飞,刘国庆 *
(合肥工业大学食品科学与工程学院,安徽 合肥 230009)
摘 要:研究米曲霉Aspergillus oryzae A s-W.6对脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)的降解作用。经高效液相色谱(high performance liquid chromatography,HPLC)检测,不同初始质量浓度的DON经菌株As-W.6发酵7 d后,降解率均在35%以上;发酵14 d后,降解率均在90%以上;同时该菌株中提取的降解酶对不同初始质量浓度DON的降解率均达70%以上。对降解产物采用高效液相色谱-质谱(HPLC-mass spectrometry,HPLC-MS)分析检测,结果显示DON经该降解菌降解后,相对分子质量从原来的295.1变为281.2,减少了13.9,说明DON确实被该菌降解成为另一种物质。
关键词:脱氧雪腐镰刀菌烯醇;米曲霉;生物降解;降解产物
吴娱, 王开萍, 唐正江, 等. 米曲霉Aspergillus oryzae As-W.6对脱氧雪腐镰刀菌烯醇的降解效果[J]. 食品科学, 2016, 37(17): 185-189. DOI:10.7506/spkx1002-6630-201617031. http://www.spkx.net.cn
WU Yu, WANG Kaiping, TANG Zhengjiang, et al. Degradation efficiency of deoxynivalenol by Aspergillus oryzae As-W.6[J]. Food Science, 2016, 37(17): 185-189. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201617031. http://www.spkx.net.cn
脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON),又称呕吐毒素,是一种B型单端孢霉烯族毒素 [1],主要是由禾谷镰刀菌和黄色镰刀菌产生的次级代谢产物 [2],广泛存在于大自然中,容易污染谷物和饲料,是一种全球性的污染毒素 [3-4]。DON被摄入到人和动物体内超过一定量后,能引起人和动物呕吐、腹泻、皮肤刺激、拒食、神经紊乱、流产、死胎等,因此DON的防治研究迫在眉睫 [5]。目前关于DON的脱毒方法主要有物理法、化学法和生物降解法 [6]。其中由于DON的结构十分稳定 [7],物理方法的脱毒效果并不理想 [8],化学处理法虽然能达到较好的脱毒效果,但会引入其他有害物质并造成谷物营养损失 [9],而生物降解法是通过筛选自然界中的微生物在温和条件下降解真菌毒素 [10-11],将DON转化为无毒或低毒物质,且不会造成营养丢失 [12]。因此生物降解法被认为是去除真菌毒素的最佳方法 [13-14]。本实验采用生物法降解DON,利用高效液相色谱(high performance liquidchromatography,HPLC)法对该降解菌和菌株中提取的降解酶对DON的降解效果进行检测,并利用高效液相色谱-质谱(HPLC-mass spectrometry,HPLC-MS)联用仪对降解产物进行分析。
1.1 材料、培养基与试剂
Aspergillus oryzae As-W.6 合肥工业大学生化楼425实验室选育保存菌种。
无机盐培养基(g/L):(NH 4) 2SO 41、KH 2PO 43、K 2HPO 4•3H 2O 6、NaCl 0.5、MgSO 4•7H 2O 0.5、FeSO 4•7H 2O 0.001、CaCl 20.05,蒸馏水定容至l L,pH 7.0,121 ℃高压灭菌20 min。
察氏培养基(g/L):NaNO 33、K 2HPO 41、MgSO 4•7H 2O 0.5、FeSO 4•7H 2O 0.01、KCl 0.5、蔗糖30,蒸馏水定容至1 L,pH 6.8,121 ℃高压灭菌20 min。
发酵培养基(g/L):葡萄糖20、玉米粉20、NaCl 10,pH 4.0,121 ℃高压灭菌20 min。
DON毒素、二乙氨基乙基纤维素(diethylaminoethylcellulose,DEAE)、Sephadex G-75葡聚糖凝胶 美国Sigma公司;硫酸铵、磷酸氢二钠、磷酸二氢钠、乙腈、氯仿、无水乙醇、甲醇、石油醚、乙酸乙酯、硫酸铁、硫酸镁、氯化钙、氯化钠、Tris-HCl、缓冲液、牛血清白蛋白 国药集团化学试剂有限公司;所有试剂均为分析纯。
1.2 仪器与设备
SW-CJ-1D型超净工作台 苏州净化设备有限公司;SPX-150B型生化恒温培养箱、THZ-92B型摇床 上海博泰实验设备有限公司;RE52CS型旋转蒸发仪 上海亚荣生化仪器厂;SYQ-DSX-280B型高压灭菌锅 上海申安医疗器械厂;HH-2型数显恒温水浴锅 金坛市杰瑞尔电器有限公司;TDL-50B型台式离心机 上海安亭科学仪器厂;1100型HPLC仪 美国Agilent公司;JY920-Ⅱ型超声破细胞破碎仪 宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 菌株对DON的降解
将Aspergillus oryzae As-W.6菌株接种于含有不同质量浓度DON(10、20、50 μg/mL)的无机盐培养基中,分别标号为1、2、3,另外,用不接菌只加DON(1 μg/mL)和不接菌不添加DON的无机盐培养基作DON添加组和空白对照组,32 ℃、180 r/min摇床培养7 d和14 d,然后用HPLC仪检测培养基中剩余DON质量浓度,每组设置3 个平行,按下式计算降解率,结果取平均值。
1.3.2 发酵液中DON的提取
用超声波细胞破碎仪(输出功率400 W、间隔时间10 s、每次裂解时间10 s、裂解总时间20 min)对发酵液及菌体进行裂解,过滤后收集滤液。滤液用旋转蒸发仪在60 ℃、2.0 MPa条件下真空旋转蒸干,加入乙腈将其溶解,然后4 ℃、10 000 r/min离心10 min,弃沉淀后于4 ℃保存备用。
1.3.3 DON的检测
提取的DON采用HPLC进行检测,检测条件如下:色谱柱:Agilent Zorbax SB-Aq C 18(4.6 mm×250 mm,5 μm);柱温:29 ℃;进样量:20 μL;流动相:乙腈-水(15∶85,V/V);流速:0.8 mL/min;检测波长:218 nm [15]。
DON标准品用pH 7.0的磷酸盐缓冲液溶解,配制成4、10、20、50、100 μg/mL的标准品溶液。用HPLC仪进行检测,峰面积为横坐标,DON质量浓度为纵坐标,绘制标准曲线。
1.3.4 降解酶对DON的降解
1.3.4.1 降解酶的粗提取
Aspergillus oryzae As-W.6菌种在察氏培养基上活化后,用无菌水制成浓度为10 5~10 6个孢子/mL的孢子悬浮液。按2%的接种量接种到发酵培养基中,在32 ℃、180 r/min条件下发酵培养72 h。将发酵液用双层纱布过滤后,4 ℃、12 000 r/min离心20 min得到发酵上清液,用0.45 μm的微孔滤膜过滤上清液。收集滤液,将其作为粗酶液,先将粗酶液中加入硫酸铵细粉末至30%饱和度,去除杂蛋白沉淀,再向上清液中加入硫酸铵细粉末至80%饱和度,离心收集沉淀,透析脱盐后冷冻干燥保存备用 [16]。
1.3.4.2 降解酶的纯化
将1.3.4.1节保存的酶溶解于0.05 mol/L、pH 7.0的Tris-HCl缓冲液中,然后将其上样于装有DEAE-52纤维素的层析柱(1.8 cm×100 cm)中,以0~1.0 mol/L NaCl溶液线性梯度洗脱,洗脱液流速为1.0 mL/min。在280 nm波长处测定每管洗脱液的酶活力。蛋白质含量的测定采用Bradford法 [17],用牛血清白蛋白作为标准蛋白,收集合并有酶活力及蛋白质含量高的部分,真空冷冻干燥后保存备用。
将经过DEAE-52纤维素层析柱纯化后的冷冻干燥的酶粉溶解于0.05 mol/L、pH 7.0的Tris-HCl缓冲液中,然后上样于装有Sephadex G-75葡聚糖凝胶的层析柱(2.6 cm×10 cm)中,以0~1.0 mol/L NaCl溶液线性梯度洗脱,洗脱液流速为1.0 mL/min。按上述方法测定每管洗脱液的酶活力,收集合并酶活力高的部分,真空冷冻干燥。即得到较纯的酶。
1.3.4.3 降解酶对DON的降解
称取1 g纯化后的降解酶,将其溶于pH 7.0的1 L磷酸盐缓冲液中,分别取100 μL该酶液加入到9 个离心管中,编号1~9,然后分别向1~9号试管加入50 μL不同质量浓度(10、20、50 μg/mL,标记为处理组4、5、6)的DON,每个质量浓度做3 管平行对照,然后取100 μL磷酸盐缓冲液加入另两支试管中,编号10和11,10号管加入50 μL蒸馏水,作为空白对照组,11号管加入0.5 μg/mL的DON作为DON添加组,振荡混匀,30 ℃水浴反应10 min后,加入150 μL乙腈终止反应并提取DON,用于HPLC检测。
1.3.5 DON降解效果
1.3.5.1 DON降解产物的提取
反应体系中加入乙腈终止反应后,将氯仿-无水乙醇(4∶1,V/V)加入反应液中使其溶解后过滤。滤液旋转蒸干后用石油醚将其分多次溶解,然后用甲醇-水(4∶1,V/V)多次洗涤并转移至分液漏斗中,充分振荡,收集下层提取液,过层析柱纯化。将过柱后的洗脱液旋转浓缩蒸干,趁热加入乙酸乙酯,蒸干后,再重复操作两次,最后加入乙酸乙酯,冷却至室温后转移至浓缩瓶,将其于95 ℃条件下水浴蒸干,保存备用 [18]。
1.3.5.2 DON降解产物的检测
DON的转化产物采用HPLC-MS进行分析检测,检测条件如下:色谱柱:Agilent Zorbax SB-Aq C 18(4.6 mm×250 mm,5 μm);进样量:20 μL;流动相:乙腈-水(15∶85,V/V);流速:0.8 mL/min;柱温:30℃;检测波长:200~600 nm。模式:负离子场;离子源温度:200 ℃;探头类型:APCI;探头温度:450 ℃;扫描范围:m/z 150~500;碰撞诱导解离反应(collisioninduced dissociation,CID)能量:22%。
2.1 DON标准曲线的绘制
为确立HPLC的检测方法,根据不同质量浓度的DON标准品溶液绘制出DON的标准曲线,HPLC的峰面积和DON的质量浓度呈良好的线性关系,线性回归方程为:y=0.002 6x-0.000 8(R 2=0.999 7)。
2.2 菌株As-W.6对DON的降解
通过在菌株生长的培养基中添加不同质量浓度的DON后发酵14 d,分别在7 d和14 d时通过HPLC检测,再根据DON的标准曲线计算出剩余DON质量浓度,进而得出菌株As-W.6对DON的降解效果,结果如表1所示。
表1 菌株As-W.6对DON的降解效果
Table 1 Degradation efficiency of DON by strain As-W.6

培养14 d DON降解率/%组别DON初始质量浓度/(μg/mL)培养7 d后DON质量浓度/(μg/mL)培养14 d后DON质量浓度/(μg/mL)处理组1102.86±0.020.402±0.03096.0*处理组2206.52±0.041.43±0.0592.9*处理组35016.78±0.064.89±0.1290.2*
注:*.与DON添加组相比,差异极显著(P<0.01)。下同。
?
由表1可知,不同初始质量浓度的DON经过菌株As-W.6 7 d的发酵后,降解率达到35%以上,而经过14 d发酵后DON降解率均达到90%以上,且随着DON初始质量浓度的增高,降解率略有降低,这可能与菌株对DON的耐受力有关。以上结果表明,菌株As-W.6能够降解DON。
2.3 降解酶对DON的降解

图1 DON 降解前(a)后(b) HPLC图
Fig. 1 HPLC results for DON degradation
由图1可知,HPLC检测DON的保留时间为6.67 min,磷酸盐缓冲液保留时间为2.25 min。通过比较DON降解前和降解后的峰面积可知,DON被降解酶降解转化。根据不同初始质量浓度转化结果,计算DON的降解率,结果如表2所示。
表2 降解酶对DON的降解效果
Table 2 DON biotransformation efficiencies at different initial DON concentrations
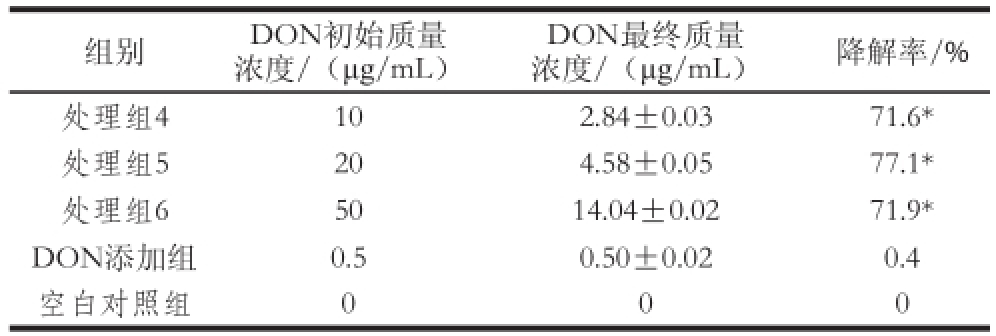
组别DON初始质量浓度/(μg/mL)DON最终质量浓度/(μg/mL)降解率/%处理组4102.84±0.0371.6*处理组5204.58±0.0577.1*处理组65014.04±0.0271.9* DON添加组0.50.50±0.020.4空白对照组000
由表2可知,初始质量浓度为10 μg/mL的DON经降解酶降解后其最终质量浓度为(2.84±0.03)μg/mL,降解率达到71.6%,初始质量浓度为20 μg/mL的DON经降解酶降解后其最终质量浓度为(4.58±0.05) μg/mL,降解率达到77.1%,初始质量浓度为50 μg/mL的DON经降解酶降解后其最终质量浓度为(14.04±0.02) μg/mL,降解率达到71.9%,不同初始质量浓度的DON降解效果会有所不同,且纯化后降解酶对DON的降解率均达到70%以上。
2.4 DON降解产物的检测结果

图2 负离子模式对降解酶降解DON前(a)后(b)产物的HPLC--MMSS分析
Fig. 2 HPLC-MS analysis of DON (a) and its degraded products (b) in negative ion mode
由图2a可知,DON标准品的相对分子质量为295.1,由图2b可知,降解产物的相对分子质量为281.2,相对分子质量减少了13.9。通过以上结果可以肯定,该菌株能够对DON进行生物降解转化,降解率达70%以上,降解产物的相对分子质量为281.2。有关该降解产物的相关结构及性质还需要进一步研究。He Ping等 [19]报道从猪肠、瘤胃液和土壤中分离的微生物可以在体外完全转化DON,转化产物为DOM-1。Young等 [20]报道菌株LS100&SS3可以将DON转化为DOM-1,相对分子质量为280.3。于大海 [21]在2008年研究发现,脂肪酶可以拆分环氧丙醇和2-辛醇;Tay等 [22]从细菌中分离出一种脂肪酶,能够在酸性水解条件下降解聚己内酯;Palomo等 [23]从真菌Mucor miehei中纯化出一种脂肪酶用于固定不同的环氧树脂,发现该脂肪酶在催化水解条件下能够将这些环氧树脂转化为羧酸。以上研究都表明,脂肪酶具有催化水解环氧化合物的功能 [24],结合前文介绍的脂肪酶能够催化水解环氧化合物生成二醇的性质 [25],本课题组推断可能的降解途径是DON结构中的环氧键被打开生成两个羟基。推测的脂肪酶催化降解DON的方程式如图3所示。
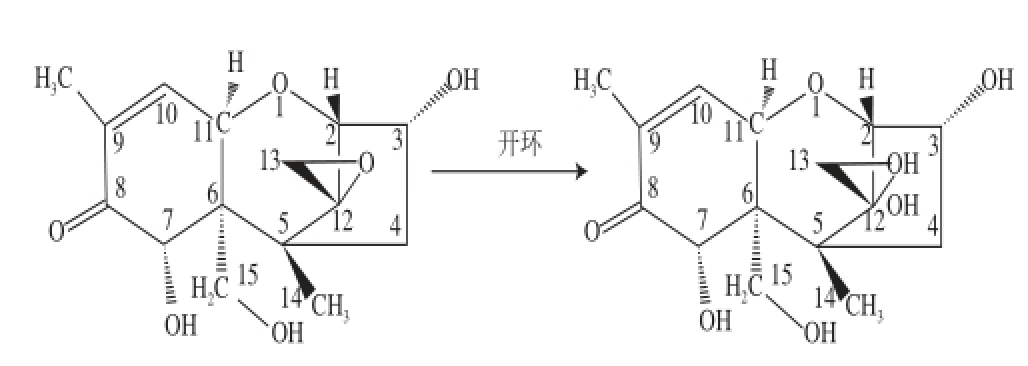
图3 DON的降解方程式
Fig. 3 Equation of DON degradation
降解菌对DON的降解效果经HPLC检测,不同初始质量浓度的DON菌株经As-W.6发酵7 d后,降解率均在35%以上;发酵14 d后,降解率都在90%以上;同时该菌株中提取的降解酶对不同初始质量浓度的DON的降解率均达70%以上。且随着DON初始质量浓度的增加,降解率略有降低,这可能与菌株对DON的耐受力有关。发酵过程比酶处理具有更好的降解效果,可能存在多种原因比如降解菌的吸附作用,提取纯化DON时是否受到菌株代谢物的影响,还有降解酶本身的活性影响等。从DON与该降解菌的反应液中提取DON的降解产物,然后对降解产物采用HPLC-MS分析检测,结果显示DON降解后,相对分子质量从原来的295.1变为281.2,减少了13.9,说明DON确实被降解成为另一种物质。从结构分析出发,本课题组推断可能DON结构中的环氧键被打开生成两个羟基。
参考文献:
[1] 尚艳娥. 真菌毒素检测技术研究进展[J]. 北京工商大学学报(自然科学版), 2012, 11(6): 2-3. DOI:10.3969/j.issn.2095-6002.2012.04.004.
[2] 魏文忠, 梁艳红, 马红峰. 粮食中真菌毒素检测技术研究进展[J]. 粮油食品科技, 2012(2): 4-5. DOI:10.3969/j.issn.1007-7561.2012.02.015.
[3] IVERSON F, ARMSTRONG C, NERA E, et al. Chronic feeding study of deoxynivalenol in B6C3F1 male and female mice[J]. Teratogenesis Carcinogenesis, and Mutagenesis, 1995, 15(6): 283-306. DOI:10.1002/ tcm.1770150606.
[4] PARK B J, TAKATORI K, KIM I H, et al. Degradatio of mycotoxin using microwave-induced argon plasma at atmospheric pressure[J]. Surface and Coating Technology, 2007, 201(9): 5733-5737. DOI:10.1016/ j.surfcoat.2006.07.092.
[5] 黄凯, 黄明明, 朱祖贤. 呕吐毒素毒性研究进展[J]. 饲料博览, 2013(12): 8-11. DOI:10.3969/j.issn.1001-0084.2013.12.003.
[6] 樊平声, 沙国栋, 沈培银. 脱氧雪腐镰刀菌烯醇毒性和检测方法研究进展[J]. 检验检疫学刊, 2010, 20(1): 2-4. DOI:10.3969/ j.issn.1674-5354.2010.01.010.
[7] ROTTER B A. Invited review: toxicology of dexoynivalenol (vomitoxin)[J]. Journal of Toxicol Environmental Health Part A, 1996, 48(1): 1-34. DOI:10.1080/009841096161447.
[8] 王守经, 胡鹏, 汝医, 等. 谷物真菌毒素污染及其控制技术[J]. 中国食物与营养, 2012(3): 3-4. DOI:10.3969/j.issn.1006-9577.2012.03.004.
[9] YOUNG J C, ZHOU T, YU H, et al. Degradation of trichothecene mycotoxins by chicken intestinal microbes[J]. Food and Chemical Toxicology, 2007, 45(1): 136-143. DOI:10.1016/j.fct.2006.07.028.
[10] MURPHY P, CUNNICK J, HENDRICH S, et al. Synthesis and characterization of deoxynivalenol glucuronide: its comparative immunotoxicity with deoxynivalenol[J]. Food and Chemical Toxicology, 2007, 45(10): 1846-1855. DOI:10.1016/j.fct.2007.03.018.
[11] 马惠蕊, 王玉坤, 刘淑艳, 等. 食源性真菌毒素检测技术研究进展[J]. 福建分析测试, 2011(1): 4-5. DOI:10.3969/j.issn.1009-8143.2011.01.010.
[12] 胡娜, 许杨, 刘仁荣. 脱氧雪腐镰刀菌烯醇检测方法建立[J]. 中国公共卫生, 2011(10): 3-5. DOI:10.11847/zgggws-2011-27-10-49.
[13] BEJAOUI H, MATHIEU F, TAILLANDIER P, et al. Biodegradation of ochratoxin A by Aspergillus section Nigri species isolated from French grapes: a potential means of ochratoxin a decontamination in grap juices and musts[J]. FEMS Microbiology Letters, 2006, 255(2): 203-208. DOI:10.1111/j.1574-6968.2005.00073.x.
[14] 宫小明, 任一平, 董静, 等. 超高效液相色谱串联质谱法测定花生、粮油中18 种真菌毒素[J]. 分析测试学报, 2011, 30(1): 6-12. DOI:10.3969/j.issn.1004-4957.2011.01.002.
[15] 朱孟丽. 高效液相色谱法对谷物中呕吐毒素的测定[J]. 粮食与饲料工业, 2005(8): 42-43. DOI:10.3969/j.issn.1003-6202.2005.08.019.
[16] 赵俊廷. NJA-1菌产环氧化物水解酶条件的优化及对脱氧雪腐镰刀菌烯醇生物转化的研究[D]. 南京: 南京农业大学, 2008: 42-43.
[17] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254. DOI:10.1016/0003-2697(76)90527-3.
[18] BRETZ M, BEYER M, CRAMER B. Hermal degradation of the Fusarium mycotoxin deoxynivalenol[J]. Journal of Agricultural and Food Chemistry, 2006, 54(17): 6445-6451. DOI:10.1021/jf061008g.
[19] HE P, YOUNG L G, FORSBERG C. Microbial transformation of deoxynivalenol (vomitoxin)[J]. Applied and Environmental Microbiology, 1992, 58(12): 3857-3863.
[20] YOUNG J C, BLACKWELL B A, APSIMON J W. Alkaline degradation of the mycotoxin 4-deoxynivalenol[J]. Tetrahedron Letters, 1986, 27(9): 1019-1022.
[21] 于大海. 脂肪酶拆分环氧丙醇和2-辛醇[D]. 长春: 吉林大学, 2008: 49-123.
[22] TAY F R, PASHLEY D H, YIU C K, et al. Susceptibility of a polycaprolactone-based root canal filling material to degradation. I. Alkaline hydrolysis[J]. Journal of Endodontics, 2005, 31(8): 593-598. DOI:10.1097/01.don.0000152301.72828.61.
[23] PALOMO J M, MUNOZ G, MATEO C, et al. Modulation of Mucor miehei lipase properties via directed immobilization on different heterofunctional epoxy resins: hydrolytic resolution of (R,S)-2-butyroyl-2-phenylacetic acid[J]. Journal of Molecular Catalysis B: Enzymatic, 2003, 21(4): 201-210. DOI:10.1016/S1381-1177(02)00224-2.
[24] SHARMA R, CHISTI Y, BANERJEE U C. Production, purification, characterization, and applications of lipases[J]. Biotechnology Advances, 2001, 19(8): 627-662. DOI:10.1016/S0734-9750(01)00086-6.
[25] JASZCZ K. Studies on hydrolytic degradation of epoxy-polyester resins cured with glutaric anhydride[J]. Polymers for Advanced Technologies, 2002, 13(10/12): 871-883. DOI:10.1002/pat.281.
Degradation Effi ciency of Deoxynivalenol by Aspergillus oryzae As-W.6
WU Yu, WANG Kaiping, TANG Zhengjiang, TANG Fei, LIU Guoqing*
(College of Food Science and Engineering, Hefei University of Technology, Hefei 230009, China)
Abstract:This research work was conducted to investigate the degradation of deoxynivalenol (DON) by Aspergillus oryzae As-W.6, which was isolated and preserved in our laboratory. Results showed the degradation rate of DON at all initial concentrations investigated was greater than 35% after 7 d fermentation by strain As-W.6 and reached higher than 90% with fermentation time up to 14 d. Moreover, the strain could degrade more than 70% of DON with the enzyme produced by it. HPLC-MS analysis revealed that the relative molecular mass of DON was decreased from 295.1 to 281.2 after the degradati on, a decrease of 13.9, suggesting that DON was degraded into another substance by As-W.6.
Key words:deoxynivalenol; Aspergillus oryzae; biodegradation; degradation products
DOI:10.7506/spkx1002-6630-201617031
中图分类号:Q517
文献标志码:A
文章编号:1002-6630(2016)17-0185-05
收稿日期:2015-09-22
作者简介:吴娱(1991—),女,硕士研究生,研究方向为食品质量与安全。E-mail:18255137100@163.com
*通信作者:刘国庆(1963—),男,教授,博士,研究方向为食品质量与安全,动物营养。E-mail:liugq_168@163.com
引文格式: