
佀营营 1,袁玉婷 2,邱理红 2,吕欢欢 3,周 慧 2,许 波 1,李 刚 1,李 忌 1,王振华 1,*
(1.烟台大学生命科学学院,线粒体与健康衰老研究中心,山东 烟台 264005;2.石河子大学药学院,新疆 石河子 832005;3.中国科学院西北高原生物研究所,青海 西宁 810001)
摘 要:目的:考察亚甲基蓝(methylene blue,MB )对冈田酸(okadaic acid,OA)所致分化神经元损伤的保护作用,并探究其作用机制。方法:采用全反式维甲酸诱导SK-N-SH人神经母细胞瘤细胞分化为成熟神经元细胞;OA诱导分化神经元损伤模拟阿尔茨 海默症(Alzheimer’s disease,AD)神经元损伤;磺酰罗丹明B法检测MB对神经元细胞活性的影响;Giemsa染色法观察细胞形态变化;Western blotting检测突触素蛋白、磷酸化tau蛋白(p-tau)的表达水平。结果:全反式维甲酸可浓度依赖性抑制SK-N-SH细胞增殖,10 μmol/L全反式维甲酸处理SK-N-SH细胞7 d后,细胞突触明显伸长,出现典型神经元特征;以40 nmol/L OA构建AD模型;MB可浓度依赖性抑制分化的SK-N-SH细胞活性,与OA组相比,随着MB浓度增加,细胞轴突长度与胞体长度比值增大,细胞突触变长,MB改善了OA所致的细胞突触损伤,突触素蛋白表达量明显升高(P<0.01),p-tau(Ser262)蛋白水平明显降低(P<0.01)。结论:MB对OA所造成的分化SK-N-SH神经元细胞突触损伤有保护作用,可防止AD中tau蛋白的过度磷酸化。
关键词:亚甲基蓝;分化SK-N-SH人神经母细胞瘤细胞;全反式维甲酸;冈田酸;tau蛋白磷酸化
佀营营, 袁玉婷, 邱理红, 等. 亚甲基蓝对冈田酸所致SK-N-SH细胞分化神经元损伤的保护作用[J]. 食品科学, 2016, 37(17): 195-200. DOI:10.7506/spkx1002-6630-201617033. http://www.spkx.net.cn
SI Yingying, YUAN Yuting, QIU Lihong, et al. Protective effect of methylene blue on neuronal damage induced by okadaic acid in differentiated SK-N-SH neuroblastoma cells[J]. Food Science, 2016, 37(17): 195-200. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201617033. http://www.spkx.net.cn
阿尔茨海默症(Alzheimer’s disease,AD)是以进行性认知功能障碍、智力减退及人格改变为特征的神经退行性疾病,其典型病理学特征包括:神经细胞外以淀粉样蛋白沉积为核心形成老年斑、神经细胞内以高度磷酸化的tau蛋白为核心形成神经纤维缠结(nerve fiber tangles,NFTs)和神经元缺失 [1-3]。目前认为tau蛋白过度磷酸化是引起AD神经元纤维退变的关键 [4]。AD已严重影响老年人的生活质量,探索新的治疗方案是目前生物医学研究的热点。
冈田酸(okadaic acid,OA)是蛋白磷酸酶(protein phosphatase,PP)PP1和PP2A的抑制剂,对PP2A作用较强,可诱导tau蛋白高度磷酸化。体外研究表明,OA可使皮层神经元tau蛋白异常过度磷酸化;体内研究显示,OA导致神经元变性、突触减少等类似于AD病理学改变,可用来制备AD中tau蛋白过度磷酸化的细胞模型 [5]。
亚甲基蓝(methylene blue,MB)是一种水溶性的芳香杂环化合物,为美国食品药品监督管理局批准临床用药,被用作防腐剂和抗疟疾药物 [6]。Hochgrafe等 [7]发现MB可用于治疗中轻度AD病人体内的拮抗tau蛋白病变,减轻认知功能障碍;O’Leary等 [8]发现长期食用MB处理过的饮食,能降低3xTg-AD小鼠模型Aβ和tau蛋白聚合水平,减轻认知功能障碍;Fatouros等 [9]在秀丽隐杆线虫神经系统中建构tau病变模型,发现MB能改善tau蛋白聚集引起的神经毒性。以上研究结果均提示MB对AD有一定的治疗作用。本研究拟考察MB在细胞水平上对OA诱导分化的神经元损伤的保护作用,以期为临床神经退行性疾病的治疗提供参考。
1.1 材料与试剂
SK-N-SH人神经母细胞瘤细胞,购自中国典型培养物保藏中心(China Center for Type Culture Collection,CCTCC),由烟台大学线粒体与健康衰老中心传代保存。
DMEM培养基、胎牛血清(fetal bovine serum,FBS) 美国Gibco公司;MB、全反式维甲酸(all-trans retinoic acid,ATRA)、OA、二甲基亚砜(dimethyl sulfoxide,DMSO) 美国Sigma公司;磺酰罗丹明B(sulphorhodamine B,SRB) 上海晶纯生化科技股份有限公司;Giemsa干粉 北京拜尔迪生物技术有限公司;兔抗p-tau(Ser262)抗体、鼠抗tau-5抗体、β-actin抗体 美国Santa Cruz生物科技公司;兔抗突触素蛋白抗体 美国Cell Signaling公司。
1.2 仪器与设备
AE-31型荧光倒置显微镜 麦克奥迪实业集团有限公司;SpectraMax Paradigm型多功能酶标仪 美国美谷分子仪器有限公司;DYCZ-24DN型电泳槽电泳仪北京六一仪器厂;5200凝胶成像系统 上海天能科技有限公司;HC-3018R型高速冷冻离心机 安徽中科中佳科学仪器有限公司。
1.3 方法
1.3.1 细胞培养
将SK-N-SH人神经母细胞瘤细胞接种于含10%胎牛血清、100 U/ mL青霉 素、100 μg/mL链霉素的DMEM培养基中,于37 ℃、5% CO 2条件下培养传代。
1.3.2 ATRA诱导SK-N-SH细胞分化 [10-13]
收集对数期生长的SK-N-SH细胞,以1.5×10 4个/mL接种于96 孔板,每孔加细胞悬液100 μL,置于培养箱中培养24 h,随后换以含有不同浓度ATRA及1%胎牛血清的DMEM培养液,继续培养7 d,每隔1 d半量换液,每组设6 个平行复孔。采用SRB法检测细胞增殖情况,台盼蓝拒染法检测细胞存活率,确定ATRA诱导SK-N-SH细胞分化的最佳浓度,Giemsa染色法观察细胞形态变化。
1.3.3 SRB法检测细胞增殖活性
参考文献:[14]方法,采用SRB法测定不同浓度MB对细胞增殖活性的影响:药物处理后取出培养板,每孔加入50 μL 50%三氯乙酸(trichloroacetic acid,TCA)进行细胞固定,4 ℃放置1 h。各孔用去离子水洗涤3 遍,自然晾干,每孔加入100 μL 0.4%的SRB溶液,染色15 min,用1%乙酸洗涤3 遍,洗去未结合染料,自然晾干,每孔加100 μL Tris碱液(10 mmol/L、pH 10.5)溶解,平板振荡20 min,用多功能酶标仪在540 nm波长处测光密度(OD 540 nm)值。

1.3.4 Giemsa染色法观察细胞形态变化
取对数生长期细胞接种于6 孔板,药物处理后,用磷酸盐缓冲液(phosphate buffered s aline,PBS)洗涤两次,甲醇固定10 min,PBS再洗涤两次,滴加Giemsa染液显色10 min,晾干后于显微镜下观察并拍照。在显微镜下观察细胞核呈紫红色或蓝紫色,细胞浆为粉红色。采用Image pro-plus软件进行图像分析,测量轴突长度与胞体长度,计算出其比值,衡量MB对突触长度的影响。
1.3.5 Western blotting法检测磷酸化tau蛋白的表达
不同浓度MB处理分化的SK-N-SH细胞12 h后,补充OA,使其终浓度为40 nmol/L,继续孵育6 h后,用预冷PBS洗涤两次,提取蛋白,BCA法检测蛋白含量,于-80 ℃保存。样品蛋白变性后,取30 μg蛋白样品用于十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gelelectrophoresis,SDS-PAGE),12%分离胶、5%浓缩胶分离蛋白,300 mA转移100 min至聚偏二氟乙烯(polyvinylidene fl uoride,PVDF)膜,用5%脱脂奶粉封闭3 h,用1∶1 000稀释的兔抗p-tau抗体4 ℃孵育过夜,TBST(Tris buffered saline with Tween)清洗4 次,每次10 min,再用1∶2 000稀释的辣根过氧化物酶标记的二抗室温孵育2 h,TBST洗涤4 次后用ECL发光显色试剂盒显影,拍照后分析蛋白条带的相对光密度值。
1.4 数据统计学处理
所有实验数据以±s表示,用SPSS 22.0分析软件进行数据统计分析。组间统计学差异比较采用独立样本t检验,其中P<0.05为具有显著差异,P<0.01为具有极显著差异。
2.1 ATRA诱导SK-N-SH细胞分化为成熟神经元细胞
如图1所示,以ATRA处理SK-N-SH细胞7 d,ATRA可浓度依赖性地抑制SK-N-SH细胞增殖。以10 μmol/L ATRA处理后即可明显抑制细胞增殖,分化后细胞形态正常。10 μmol/L ATRA处理后有较少细胞死亡,而20 μmol/L ATRA处理后大部分细胞死亡。当ATRA浓度为10 μmol/L时,细胞分化7 d时的增殖抑制率为59.2%,存活率为80.0%。
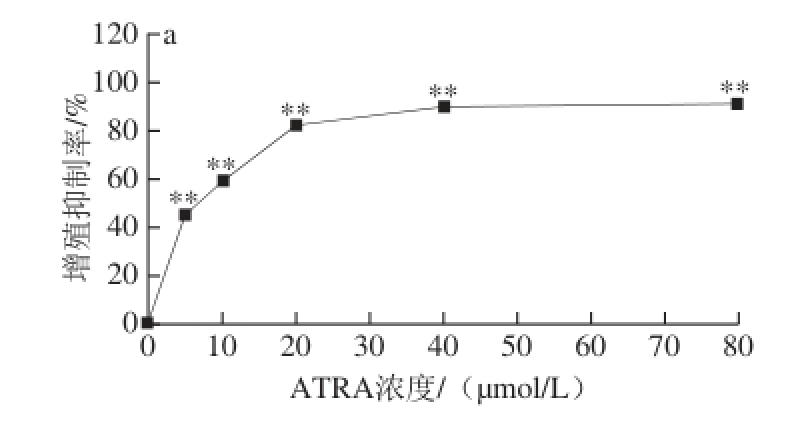
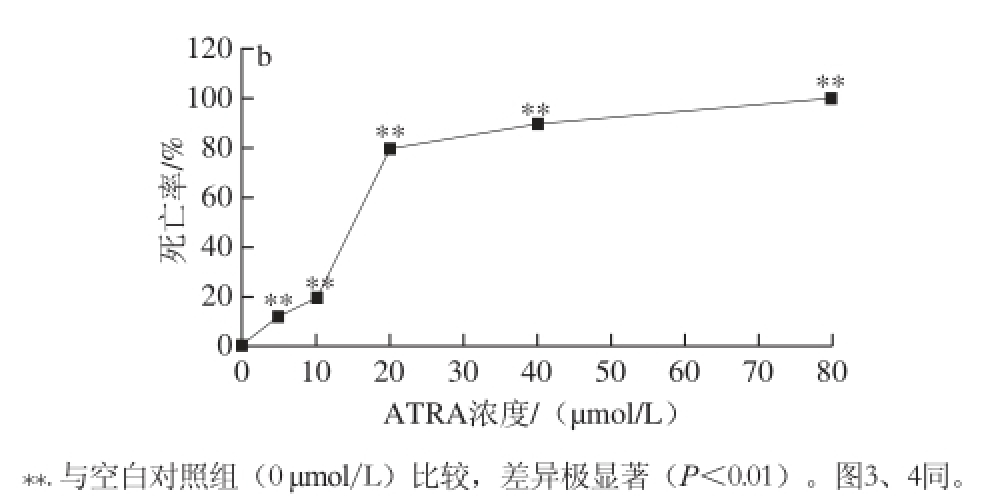
图1 ATRA对SK-N-SH细胞增殖抑制率(a)和死亡率(b)的影响(x±s,n=3)
Fig. 1 Inhibitory and lethal effect of ATRA on SK-N-SH neuroblastoma cells (x±s,n=3)
SK-N-SH经10 μmol/L ATRA诱导分化后,用Giemsa染色,显微镜下观察不同分化时间的细胞形态。采用Image pro-plus软件进行图像分析,测量轴突长度与胞体长度,计算出 其比值。如图2所示,未分化时SK-N-SH细胞呈梭型,分化1 d的细胞偶有轴突但较短,分化3 d的细胞有部分突触伸长,且随着分化时间的延长而增长,分化后的SK-N-SH细胞突触明显伸长。如图3所示,随着分化时间的延长,突触长度与胞体长度的比值逐渐增大,第7天时比值为2.8,大于2.5,与空白对照组比较有极显著差异(P<0.01),这提示SK-N-SH细胞分化后出现了典型神经元特征。本研究最终确定10 μmol/L ATRA连续处理7 d以诱导SK-N-SH细胞分化为成熟神经元。

图2 10 μmol/L ATRA对SK-N-SH细胞分化的影响(200×)
Fig. 2 Effect of 10 μmmooll/L ATRA on the differentiation of SK-N-SH neuroblastoma cells (200 ×)

图 3 1100 μmol/L ATRA对SK-N-SH细胞突触长度的影响(x±s,n=3)
Fig. 3 Effect of 10 μmmooll/L ATRA on synapse length of SK-N-SH neuroblastoma cells (x± s, n = 3)
2.2 MB对OA所致分化神经元损伤的保护作用
2.2.1 MB对细胞活性的影响

图4 MB对分化的SK-N-SH细胞增殖的影响(x±s,n=3)
Fig. 4 Effect of MB on the proliferation of differentiated SK-N-SH neuroblastoma cells (x± s, n = 3)
用不同浓度(0、0.1、1、5、10 μmol/L)的MB处理分化的SK-N-SH细胞24、48、72 h后,采用SRB法测定MB的细胞毒性。如图4所示,MB可时间依赖性抑制分化的SK-N-SH细胞增殖,同时MB还可浓度依赖性抑制分化的SK-N-SH细胞增殖,0.1 μmol/L MB对细胞未表现出明显毒性,但1 μmol/L MB可明显抑制细胞增殖,因此在后续实验中选择10、50、100 nmol/L作为MB处理分化的SK-NSH细胞的低、中、高剂量。
2.2.2 MB对OA所致分化神经元损伤的影响


图5 MB对OA所致分化的SK-N-SH细胞损伤形态的影响(200×)
Fig. 5 Effects of MB on OA-induced damage to differentiated SK-N-SH neuroblastoma cells (200 ×)

图6 MB对OA所致SK-N-SH细胞突触损伤的影响(x±s,n=3)
Fig. 6 Effect of MB on OA-induced synapse damage in differentiated SK-NSH neuroblastoma cells (x± s, n = 3)

图7 MB对突触素蛋白表达的影响(x±s,n=3)
Fig. 7 Effect of MB on the expression of synaptophysin in differentiated SKN-SH neuroblastoma cells (x± s, n = 3)
以不同浓度的MB处理分化的SK-N-SH细胞12 h后,加入终浓度为40 nmol/L OA孵育6 h,分析MB对OA所致分化神经元损伤的影响。如图5、6所示,空白对照组细胞形态完好、突触较长,其长度是胞体长度的2.6 倍;OA模型组细胞形态受损、突触变短;加入MB后,细胞形态得到改善,随着MB浓度增加,轴突长度与胞体长度比值增大,细胞突触变长,MB从形态学上改善了OA所致的细胞突触损伤。如图7所示,Western blotting结果显示,不同浓度MB均能够使突触素蛋白表达量升高,与OA模型组比较有极显著差异(P<0.01)。综上可知,MB对OA所致神经元损伤有一定的保护作用。
2.2.3 MB对tau蛋白磷酸化的影响
不同浓度MB处理分化的SK-N-SH细胞12 h后,补充OA使其终浓度为40 nmol/L,继续孵育6 h,采用Western blotting法检测分化神经元Ser262位点tau蛋白磷酸化水平。如图8所示,不同浓度的MB均明显降低Ser262位 点tau蛋白磷酸化水平,且呈现一定的浓度依赖效应(P<0.01)。
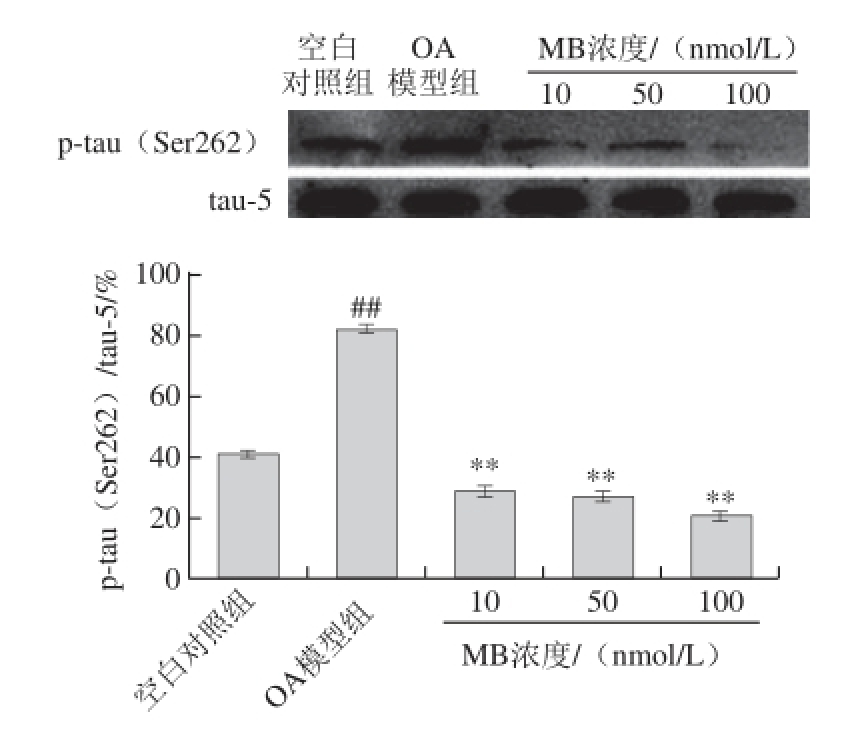
图8 MB对SK-N-SH细胞分化神经元Ser262位点tau蛋白磷酸化的影响(x±s,n=3)
Fig. 8 Effect of MB on the phosphorylation of tau protein at Ser262 site in differentiated SK-N-SH neuroblastoma cells (x± s, n = 3)
SK-N-SH细胞为人神经母细胞瘤细胞 [15],胞体为梭形,大多数研究采用未分化的神经瘤细胞 [16-18],与临床AD病理变化之间存在一定的差异性。SK-N-SH经诱导分化后不再表现恶性肿瘤特征,向正常神经元方向转变,出现类似神经突触样的突起和形态学改变,并表达突触素,具有许多神经元细胞的生化和功能特征,可更好地模拟神经元应答反应,可用于研究神经退行性疾病 [19-20]。
本实验采用ATRA诱导SK-N-SH分化为成熟神经元细胞,ATRA是作用效果较强的诱导分化剂之一 [21],是一种VA酸受体(retinoic acid receptor,RAR)和Retinoid X受体(retinoid X receptor,RXR )的配体,结合RAR和RXR作为转导因子,调控正常细胞和肿瘤细胞的生长和分化。实验结果显示,10 μmol/L ATRA处理SK-N-SH 细胞7 d后可明显抑制细胞增殖,分化后细胞形态正常,突触长度与胞体长度比值明显增大,与空白对照组相比较有极显著差异(P<0.01),提示 SK-N-SH细胞分化后出现典型神经元特征。
用40 nmol/L OA造成神经元损伤作为AD模型组,tau蛋白磷酸化位点包括Ser199/202、Ser213、Ser262、Ser396、Ser404等,本实验选取Ser262位点进行探究,原因是Ser262位点位于tau微管结合区域,Ser262位点磷酸化可以导致突触前和突触后蛋白损失及神经元树突减少,是引起GSK-3β、CDK5磷酸化的先决条件,Ser262位点的磷酸化在AD病变中有重要作用 [22]。
MB为噻嗪类物质,在食品行业用途广泛,可用于消毒水产品、解救亚硝酸盐中毒 [23]、保健品抗氧化 [24]研究等方面。同时,MB可降低tau聚集,体内研究报道表明MB能降低P301L tau突变小鼠的tau蛋白聚集,体外研究也表明MB可抑制tau蛋白聚集,改善神经细胞病变。但对MB在神经突触损伤方面保护作用的研究较少。本实验选取MB为研究对象,实验结果显示,OA模型组细胞形态受损,突触变短;加入MB后,细胞轴突长度与胞体长度比值增大,细胞突触变长,突触素蛋白表达量升高,呈一定的浓度依赖性,与OA模型组相比较有极显著差异(P<0.01)。不同浓度MB均明显降低Ser262位点tau蛋白磷酸化水平,且呈一定的浓度依赖性。这些均提示MB对OA所致神经元损伤有一定的保护作用,其机制与tau蛋白磷酸化水平降低有关。
目前AD的防治仍缺乏有效药物,临床上常用主要的治疗药物包括:胆碱脂酶抑制剂和N-甲基-D-天冬氨酸受体拮抗剂,虽能部分改善患者症状,但不能延缓AD患者脑内的病理改变 [25]。AD患者脑中存在大量过度磷酸化tau蛋白,缓解tau蛋白的过度磷酸化对AD治疗具有重要作用。本实验结果显示,MB从形态学上改善了OA所致细胞突触损伤,随着MB浓度升高,突触素蛋白表达量升高,其机制与降低tau蛋白的磷酸化有关,提示MB对于防治AD等神经退行性疾病有潜在的应用前景。
参考文献:
[1] El KHOURY N B, GRATUZE M, PAPON M A, et al. Insulin dysfunction and Tau pathology[J]. Frontiers in Cellular Neuroscience, 2014, 8: 22. DOI:10.3389/fncel.2014.00022.
[2] WHITTINGTON R A, BRETTEVILLE A, DICKLER M F, et al.Anesthesia and tau pathology[J]. Progress in Neuro-psychopharmacology & Biological Psychiatry, 2013, 47: 147-155. DOI:10.1016/ j.pnpbp.2013.03.004.
[3] GINTER E, SIMKO V, WEINREBOVA D, et al. Novel potential for the management of Alzheimer disease[J]. Bratislavske Lekarske Listy, 2015, 116(10): 580-581.
[4] 王丹. Humanin拮抗冈田酸诱导的Tau蛋白过度磷酸化的作用研究[D].太原: 山西医科大学, 2007: 1-48. DOI:10.7666/d.y1109483.
[5] KAMAT P K, RAI S, NATH C. Okadaic acid induced neurotoxicity: an emerging tool to study Alzheimer’s disease pathology[J]. Neurotoxicology, 2013, 37: 163-172. DOI:10.1016/j.neuro.2013.05.002.
[6] POTEET E, WINTERS A, YAN L J, et al. Neuroprotective actions of methylene blue and its derivatives[J]. PLoS ONE, 2012, 7(10): e48279. DOI:10.1371/journal.pone.0048279.
[7] HOCHGRAFE K, SYDOW A, MATENIA D, et al. Preventive methylene blue treatment preserves cognition in mice expressing full-length pro-aggregant human Tau[J]. Acta Neuropathologica Communications, 2015, 3(1): 1-22. DOI:10.1186/s40478-015-0204-4.
[8] O’LEARY J C, LI Q, MARINEC P, et al. Phenothiazine-mediated rescue of cognition in tau transgenic mice requires neuroprotection and reduced soluble tau burden[J]. Molecular Neurodegeneration, 2010, 5(1): 1-11. DOI:10.1186/1750-1326-5-45.
[9] FATOUROS C, PIR G J, BIEMAT J, et al. Inhibition of tau aggregation in a novel Caenorhabditis elegans model of tauopathy mitigates proteotoxicity[J]. Human Molecular Genetics, 2012, 21(16): 3587-3603. DOI:10.1093/hmg/dds190.
[10] KATARIA H, WADHWA R, KAUL S C, et al. Water extract from the leaves of Withania somnifera protect RA differentiated C6 and IMR-32 cells against glutamate-induced excitotoxicity[J]. PLoS ONE, 2012, 7(5): e37080. DOI:10. 1371/journal.pone.0037080.
[11] 解洪荣, 常明, 张玉花, 等. 应用两种方法诱导SH-SY5Y细胞分化的研究[J]. 现代生物医学进展, 2011, 11(1): 63-67.
[12] CHEN Q, ZHOU Z, ZHANG L, et al. The cellular distribution and Ser262 phosphorylation of tau protein are regulated by BDNF in vitro[J]. PLoS ONE, 2014, 9(3): e91793. DOI:10.1371/journal.pone.0091793.
[13] 吴琳. NDRG2转录调控机制及其在人神经母细胞瘤细胞中增殖和分化中的作用研究[D]. 西安: 第四军医大学, 2013: 1-93.
[14] 李雅娟, 甘露, 王占洋, 等. 异甘草素对大鼠C6胶质瘤细胞增殖和分化的影响[J]. 中国药理学通报, 2015(9): 1298-1303. DOI:10.3969/ j.issn.1001-1978.2015.09.023.
[15] 孙超, 甘露, 张梅, 等. 丹参素对低氧低糖损伤神经细胞的影响[J]. 时珍国医国药, 2010(4): 912-914.
[16] 张秀艳. 维甲酸对人神经母细胞瘤SK-N-SH细胞的诱导分化作用及其机理研究[D]. 厦门: 厦门大学, 2008: 1-86. DOI:10.7666/ d.y1442856.
[17] ZHANG Z, SIMPKINS J W. Okadaic acid induces tau phosphorylation in SH-SY5Y cells in an estrogen-preventable manner[J]. Brain Research, 2010, 1345: 176-181. DOI:10.1016/j.brainres.2010.04.074.
[18] 吴敏霞, 许盈, 胡祥炬, 等. 冈田酸诱导SH-SY5Y细胞建立阿尔茨海默病细胞模型超微结构的变化[J]. 中国老年学杂志, 2011, 31(11): 2014-2016. DOI:10.3969/j.issn.1005-9202.2011.11.033.
[19] 白鹏, 彭晓明, 高莉, 等. 类叶升麻苷对冈田酸诱导的阿尔茨海默病细胞模型的保护作用研究[J]. 中国中药杂志, 2013, 38(9): 1323-1326.
[20] 梁盈. 维甲酸诱导人神经母细胞瘤SK-N-SH细胞分化过程中核基质蛋白的变化研究[D]. 厦门: 厦门大学, 2008: 1-205. DOI:10.7666/ d.y1522455.
[21] FENG D, CAO Z, LI C, et al. Combination of valproic acid and ATRA restores RARβ2 expression and induces differentiation in cervical cancer through the PI3K/Akt pathway[J]. Current Molecular Medicine, 2012, 12(3): 342-354.
[22] QURESHI H Y, HAN D, MACDONALD R, et al. Overexpression of 14-3-3ζ promotes tau phosphorylation at Ser 262and accelerates proteosomal degradation of synaptophysin in rat primary hippocampal neurons[J]. PLoS ONE, 2013, 8(12): e84615. DOI:10.1371/journal. pone.0084615.
[23] 范克伟. 水产品中亚甲基蓝及其代谢物多残留检测方法的研究[D].福州: 福建农林大学, 2009: 1-205. DOI:10.7666/d.y1512284.
[24] 蔡卓, 莫创荣, 杜良伟, 等. 亚甲基蓝光度法测定保健品抗氧化活性的研究[J]. 食品研究与开发, 2012, 33(2): 137-139. DOI:10.3969/ j.issn.1005-6521.2012.02.040.
[25] 沈杰. 人参皂苷Rb1/Rg1对高表达GSK3β的SH-SY5Y细胞Tau磷酸化和微管乙酰化水平的影响[D]. 福州: 福建医科大学, 2006: 1-57. DOI:10.7666/d.y950124.
Protective Effect of Methylene Blue on Neuronal Damage Induced by Okadaic Acid in Different iated SK-N-SH Neuroblastoma Cells
SI Yingying
1, YUAN Yuting
2, QIU Lihong
2, LÜ Huanhuan
3, ZHOU Hui
2, XU Bo
1, LI Gang
1, LI Ji
1, WANG Zhenhua
1,*
(1. Center of Mitochondria and Healthy Aging, College of Life Sciences, Yantai University, Yantai 264005, China; 2. School of Pharmacy, Shihezi University, Shihezi 832005, China; 3. Northwest Institute of Plateau Biology, Chinese Academy of Sciences, Xining 810001, China)
Abstract:O bjective: To investigate the protective e ffect and underlying mechanism of methylene blue (MB) on neuronal damage induced by okadaic acid (OA). Methods: The mature neurons differentiated from SK-N-SH neuroblastoma cells induced by all-trans retinoic acid (ATRA) were exposed to OA to induce synaptic atrophy and cell injury. The SRB assay was used to measure the effect of MB on the proliferation of differentiated SK-N-SH cells. Giemsa staining was used to observe cell morphology. The expressi on of synaptophysin and the phosphorylation of tau protein were detected by Western blotting. Results: ATRA inhibited the proliferation of SK-N-SH cells in a dose-dependent manner in vitro. The 10 μmol/ L ATRA exposure for 7 days could induce SK-N-SH neuroblastoma cells differentiation into mature neurons with obviously extended synapse. Treatment with 40 nmol/L OA resulted in synaptic atrophy in differen tiated SK-N-SH neuroblastoma cells. MB inhibited the proliferation of differentiated SK-N-SH cells in a dose-dependent manner in vitro. Moreover, MB treatment significantly increased the ratio of axon length to cell body length and the expression of synaptophysin (P < 0.01), while it decreased the phosphorylation of tau protein at Ser262 site (P < 0.01). Conclusion: MB can alleviate synaptic atrophy induced by OA, which may be due to the down-regulation of tau phosphorylation at Ser262 site.
Key words:methylene blue; differentiated SK-N-SH neuroblastoma cells; all-trans retinoic acid; okadaic acid; tau phosphorylation
收稿日期:2015-11-23
基金项目:国家自然科学基金面上项目(11175222);石河子大学重大科技攻关计划项目(gxjs2012-zdgg02);
山东省泰山学者建设工程专项(tshw201502046);烟台市科技计划项目(2014LGS004)
作者简介:佀营营(1989—),女,硕士研究生,研究方向为食品营养与健康。E-mail:15253518423@163.com
*通信作者:王振华(1973—),男,副教授,博士,研究方向为自由基生物医学。E-mail:zhenhuawang@tom.com
DOI:10.7506/spkx1002-6630-201617033
中图分类号:R966
文献标志码:A
文章编号:1002-6630(2016)17-0195-06
引文格式: