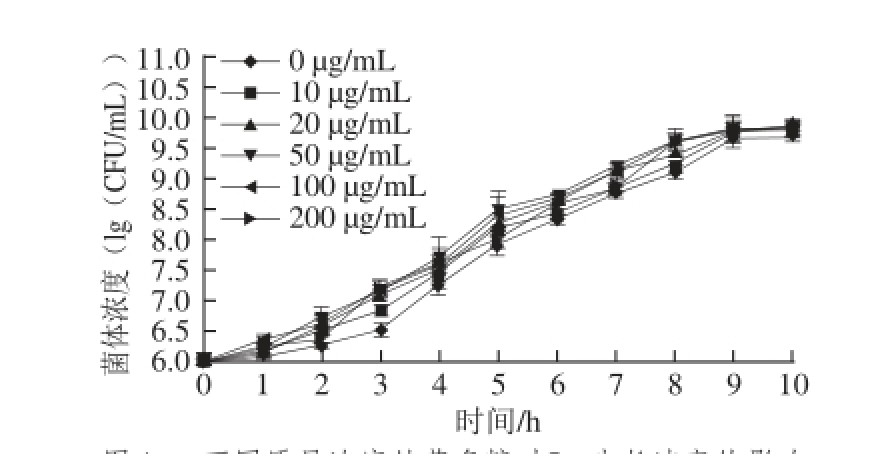
图1 不同质量浓度甘草多糖对Lm生长速率的影响
Fig. 1 Effect of Glycyrrhiza polysaccharide on the growth of Lm
廖成水 1,2,贾艳艳 1,李智丽 3,孙宁娜 4,李亮伟 5,王晓利 1,5,余祖华 1,郁 川 1,程相朝 1,*
(1.河南科技大学,河南动物疫病与公共安全重点实验室,河南省动物疫病与公共安全院士工作站,河南 洛阳 471003;2.吉林大学 人兽共患病研究所,人兽共患病研究教育部重点实验室,吉林 长春 130062;3.河南科技大学食品与生物工程学院,河南 洛阳 471023;4.中共汝州市委办公室,河南 汝州 467500;5.汝州市动物卫生监督所,河南 汝州 467500)
摘 要:目的:探讨甘草多糖对单核细胞增生性李斯特菌(Listeria monocytogenes,Lm)体内外生长的影响。方法:采用平板计数法和荧光显微镜、分光光度法及Bliss法分别分析甘草多糖对Lm生长速率和生物被膜形成的影响及计算细菌对小鼠半数致死量(median lethal dose,LD 50)。观察低剂量(1 mg/kg)、中剂量(10 mg/kg)和高剂量(100 mg/kg)甘草多糖对感染100×LD 50Lm小鼠的保护力。小鼠感染0.01×LD 50的Lm后1、7、14、21、28、35 d剖杀小鼠,检测脾脏、肝脏和肺脏中Lm分布的消长情况。结果:低质量浓度时(10、20、50 μg/mL),甘草多糖随着质量浓度增加对Lm标准菌株10403S生长速率和生物被膜形成的促进作用呈上升趋势;但高质量浓度时(100、200 μg/mL)这种促进作用逐渐降低。Lm口服感染小鼠的LD 50为2.70×10 8CFU。高剂量甘草多糖对于100×LD 50的Lm感染可提供50%的保护力。0.01×LD 50的Lm感染小鼠,随着甘草多糖质量浓度增加小鼠脾脏、肝脏和肺脏的细菌量逐渐减少。结论:低质量浓度甘草多糖在体外对Lm的生长具有促进作用,但随着质量浓度增高促进强度逐渐降低,而甘草多糖可以提高小鼠抵抗Lm感染的能力。
关键词:甘草多糖;单核细胞增生性李斯特菌;生物被膜;抑制
廖成水, 贾艳艳, 李智丽, 等. 甘草多糖对单核细胞增生性李斯特菌体内外生长的影响[J]. 食品科学, 2016, 37(17): 213-218.
LIAO Chengshui, JIA Yanyan, LI Zhili, et al. Effect of Glycyrrhiza polysaccharide on the growth of Listeria monocytogenes in vitro and in vivo[J]. Food Science, 2016, 37(17): 213-218. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201617036. http://www.spkx.net.cn
单核细胞增生性李斯特菌(Listeria monocytogenes,Lm)属于一种短小的革兰氏阳性无芽孢杆菌,是李斯特菌属中唯一能引起人类疾病的一种重要人畜共患病致病菌,被世界卫生组织列为四大食源性病原菌之一 [1]。Lm可引起人和动物脑膜炎、脑炎、败血症、心内膜炎、脓肿和局部的脓性损伤以及流产、死胎等。本实验室以及其他许多流行病学调查资料显示,Lm引起的食物中毒事件占相当高的比例,肉类、蛋类、禽类、海产品、乳制品、蔬菜等都是Lm污染率较高的食品 [2-3],使得Lm成为衡量食品卫生状况的一个重要指标 [4],许多国家都将Lm列为进出口食品的必检项目 [5]。抗生素治疗被认为是控制疾病的优先选择,但由于临床上滥用抗生素,近年来不断出现大量Lm耐药菌株 [6],因此,寻找有效Lm抵抗药物就显得尤为重要。
甘草是一种具有消炎、抗菌、抗病毒、抗癌、抗高血脂以及增强细胞免疫等多种药理活性的草本植物 [7],素有“十方九草”之称,被历代名医尊称为“众药之王”。多糖是一种由糖苷键连接起来的醛糖或酮糖组成的天然大分子,现代医学研究表明,天然植物活性多糖可通过激活、增强、调节以及修复机体免疫能力发挥抗炎、抗病毒和抗肿瘤等多种生理功能。研究显示,甘草主要有效成分甘草多糖能够促进淋巴细胞增殖,增强吞噬细胞的吞噬功能 [8-9]。目前,鲜见甘草多糖体外对Lm抑菌作用的报道。因此,本研究通过观察甘草多糖体外对Lm生长的影响,以及对小鼠抵抗Lm感染的影响,以探讨甘草多糖对抵抗Lm感染的作用。
1.1 试剂、标准菌株与动物
甘草多糖为洛阳蓝冰贸易有限公司产品。
脑心浸液肉汤(brain heart infusion broth,BHI)青岛海博生物技术有限公司;琼脂粉 生工生物工程(上海)股份有限公司;SYTO9绿色荧光核酸染料美国Invitrogen公司;结晶紫、乙醇等其他试剂 国药集团化学试剂有限公司。
Lm标准菌株10403S(1/2a血清型) 河南科技大学动物疫病与公共安全重点实验室冻存。
清洁级昆明小鼠(动物合格证号:1603031;动物生产许可证号:SCXK晋20I50001,6~8 周龄,体质量(20±2) g,雌雄各半) 山西医科大学实验动物中心。
1.2 仪器与设备
超净工作台 苏州安泰空气技术有限公司;电子天平 德国Sartorius公司;立式全温恒温振荡培养箱 哈尔滨市东联电子技术开发有限公司;荧光显微镜日本Olympus公司;高速低温离心机 德国Sigma-Aldrich公司;CO 2培养箱 日本Sanyo公司。
1.3 方法
1.3.1 甘草多糖对Lm生长速率的影响
取出冻存Lm标准菌株10403S,接菌环划线于BHI固体平板上,37 ℃培养箱培养24 h后挑取单个菌落接种于BHI液体培养基中,放在37 ℃摇床上培养24 h。用磷酸盐缓冲液(phosphate buffer saline,PBS)将甘草多糖配制成质量浓度为10 mg/mL的溶液。按终菌浓度为1×10 6CFU/ mL将新鲜培养菌转接BHI液体培养基,同时加入甘草多糖,使其终质量浓度分别为10、20、50、100、200 μg/ mL,37 ℃、200 r/min培养,每1 h取样涂板计数,即培养到各时间点收集菌液,用无菌PBS连续10 倍稀释样品,取100 μL适当稀释度菌液均匀涂布于含BHI固体平板上,每个稀释度做3 个重复,同时设空白对照,培养过夜后计数,取平均值计算原液的菌体浓度,绘制Lm的生长曲线。
1.3.2 甘草多糖对Lm生物被膜形成的影响
按照Djordjevic等 [10]推荐的96孔微孔板结晶紫染色法和荧光显微镜观察Lm生物被膜。挑取Lm单菌落接种于BHI液体培养基,37 ℃培养过夜,然后将新鲜培养液转接于96 孔细胞培养板内,置于CO 2培养箱培养48 h,同时进行两个96 孔细胞培养板。往96 孔细胞培养板加入终质量浓度为10、20、50、100、200 μg/mL的甘草多糖,继续孵育2、4、6、8、10 h。孵育结束后,用无菌PBS洗3 次除去未附着的细菌,其中一板加入核酸染料之后立即置于荧光显微镜下观察。另一板晾干后加入1%结晶紫染色45 min,用蒸馏水洗去浮色,37 ℃放置10 min干燥,每孔用200 μL乙醇溶解,于590 nm波长处检测,同时做空白对照孔(0 μg/mL甘草多糖),每孔重复3 次。
1.3.3 Lm对小鼠的毒力测定
将60 只小鼠平均随机分为6 组,包含5 个实验组和1 个PBS对照组。Lm在BHI液体培养基中37 ℃培养过夜,离心收集菌体,用无菌PBS洗涤两次,调整菌液浓度,然后用无菌PBS进行5 倍梯度系列稀释,选取合适的稀释度,每个稀释度口服感染10 只小鼠,每只500 μL,各组隔离正常饲养,连续观察小鼠的临床症状,记录各组小鼠死亡情况并解剖死亡小鼠,采用Bliss法计算Lm对小鼠半数致死量(median lethal dose,LD 50)。
1.3.4 甘草多糖对小鼠感染Lm的保护力测定
将40 只小鼠平均随机分为4 组,包含3 个实验组(低、中、高剂量组)和1 个PBS对照组。用PBS将甘草多糖配制成质量浓度10 mg/mL,在小鼠Lm感染前4 h分别灌胃给予1(低剂量组)、10(中剂量组)和100 mg/kg(高剂量组)的甘草多糖。然后将100×LD 50的Lm分别感染各组小鼠,连续观察小鼠的临床症状直至无小鼠死亡,记录各组小鼠死亡情况。
1.3.5 甘草多糖对小鼠感染Lm体内分布的影响
将240 只小鼠按照1.3.4节方法进行分组和给予甘草多糖。以0.01×LD 50的Lm分别感染各组小鼠,于感染后1、7、14、21、28、35 d脱臼法处死小鼠,在无菌操作台剖解取出肺脏、肝脏和脾脏,剪一小块称质量后利用组织研磨器充分研磨,用无菌PBS稀释,取适当稀释度匀浆液均匀涂布于BHI固体平板上,37 ℃培养过夜,计数,每个稀释度做3 个重复,取平均值计算各个组织器官的菌落数(CFU/mg)。
2.1 甘草多糖对Lm生长速率的影响
如图1所示,各质量浓度甘草多糖在不同时间点与空白对照组相比均不同程度地增强Lm生长速率(P<0.01或P<0.05)。甘草多糖在低质量浓度(10、20、50 μg/mL)时,随着甘草多糖质量浓度的增加,其对Lm生长速率促进作用呈上升趋势,但甘草多糖在高质量浓度时,100 μg/mL和200 μg/mL对Lm生长速率的影响与50 μg/mL时相比并无显著差异。

图1 不同质量浓度甘草多糖对Lm生长速率的影响
Fig. 1 Effect of Glycyrrhiza polysaccharide on the growth of Lm
2.2 甘草多糖对Lm生物被膜形成的影响



图2 荧光显微镜观察不同质量浓度甘草多糖对Lm生物被膜形成的影响(100×20)
Fig. 2 Effect of Glycyrrhiza polysaccharide on the biofilm formation of LLmm observed by fl uorescence microscope (100 × 20)

图3 不同质量浓度甘草多糖对Lm生物被膜形成的影响
Fig. 3 Effect of Glycyrrhiza polysaccharide on the biofilm formation of Lm
利用荧光显微镜和分光光度法观察甘草多糖对Lm生物被膜形成的影响,如图2、3所示。与空白对照组相比,当添加10、20、50、100、200 μg/mL甘草多糖后,Lm在聚乙烯板孔内形成生物被膜的量逐渐增加。在同一时间点,随着甘草多糖质量浓度增强,对Lm生物被膜形成的促进作用呈上升趋势(P<0.01或P<0.05),但甘草多糖达到高质量浓度时(100、200 μg/mL),甘草多糖对Lm生物被膜形成的促进作用逐渐降低,与50 μg/mL相比并无显著差异(图3)。
2.3 甘草多糖对小鼠感染Lm的保护力
Lm口服感染小鼠后每天观察并记录小鼠症状,感染后小鼠表现出精神萎靡、食欲低下、被毛直立、扎堆、肛门有黏液等症状。攻毒16 h后出现死亡小鼠,死亡时间多集中于72~100 h左右。对死亡小鼠进行病理解剖,发现小鼠胸腔有积液,肝脏和脾脏肿大,肝脏、心脏、脾脏和淋巴系膜等组织器官有弥漫性出血现象,肾脏和脑组织有水肿。空白对照组小鼠无异常变化。应用Bliss法计算,得到Lm的口服感染小鼠的LD 50为2.70×10 8CFU(表1)。同时,小鼠给予高剂量(100 mg/kg)甘草多糖对于100×LD 50的Lm感染可提供50%的保护力,而低剂量组(1 mg/kg)只能提高20%的保护力(表2)。
表1 1 LmLm对小鼠的毒力
Table 1 Toxicity assay of mice infected withLmLm
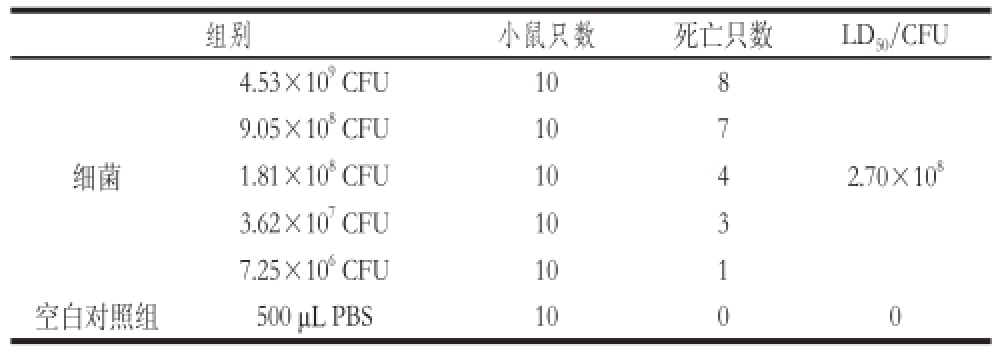
组别小鼠只数死亡只数LD 50/CFU 4.53×10 9CFU108 9.05×10 8CFU107 1.81×10 8CFU104 3.62×10 7CFU103 7.25×10 6CFU101空白对照组500 μL PBS1000细菌2.70×10 8
表2 甘草多糖对小鼠感染Lm的保护力
Table 2 Protection effect of Glycyrrhiza polysaccharide on mice infected with Lm

组别小鼠只数死亡只数死亡率/%空白对照组1010100低剂量组10880中剂量组10660高剂量组10550
2.4 甘草多糖对小鼠感染Lm体内分布的影响

图4 甘草多糖对小鼠感染Lm肺脏(A)、肝脏(B)和脾脏(CC)分布的影响
Fig. 4 Effect of Glycyrrhiza polysaccharide on bacterial distribution in the lung (A), liver (B), and spleen (C) of mice infected with Lm
0.01 ×LD 50的Lm感染小鼠后,在1、7、14、21、28、35 d这6 个时间点对小鼠进行无菌病理解剖,通过涂板计数法计算脾脏、肝脏和肺脏中Lm的浓度。由图4可知,Lm感染小鼠后1 d就可分离到Lm,并且在14 d细菌分离数达到高峰,之后随时间延长呈缓慢下降的趋势,35 d仍能分离出细菌。Lm感染小鼠给予甘草多糖后,各组织细菌量与空白对照组相比明显减少(P<0.01或P<0.05),并且在各个时间点随着甘草多糖质量浓度增加,小鼠体内细菌量逐渐减少(P<0.01或P<0.05)。
多糖及其复合物是自然界含量丰富的重要生物大分子之一,糖类和蛋白质、脂类和核酸共同构成最基本的生命物质,对于维持生命活动起着至关重要的作用 [11]。研究资料证实,甘草是一种有价值的开发保健品和药品的药用植物。甘草在抗氧化、抗炎、抗溃疡、抗菌、抗动脉粥样僵化以及降压、降血脂等方面显示出多种生理活性 [12-13],具有潜在的应用价值。天然活性生物资源的开发利用是天然药物、生物化学和生命科学的主要研究方向,与蛋白质组学、转录组学、代谢组学等各种组学并列成为另一研究热点。但是目前对于甘草成分的药理、药代动力学以及临床副作用尚不清楚,缺乏足够的实验室基础研究、药物纯化分析和临床前期应用,这是制约甘草资源合理利用和深度开发的主要因素。
鼠李糖、葡聚糖、阿拉伯糖和半乳糖等共同构成了甘草多糖组分 [14]。靳嘉巍等 [15]研究发现,葡萄糖对细菌的生长以及生物被膜的形成具有一定促进作用。在本研究中,同一时间点10、20、50、100、200 μg/mL甘草多糖对Lm的生长表现出一定的促进作用,并且随甘草多糖质量浓度的增高而明显增强,但在高质量浓度时促进作用有所下降。在培养液中添加糖后增加了细菌生长所需要的营养成分,因而有助于细菌的生长,但随着糖分质量浓度的增高培养液中的渗透压有所增加,对细菌的生长不利。细菌生物被膜是指细菌黏附于一个物体(或人体组织)的表面,通过分泌多糖基质、纤维蛋白、脂质蛋白等,将其自身包绕其中而形成的大量高度组织化、系统化的膜样聚合物 [16]。因此,低质量浓度的甘草多糖为细菌生物被膜的形成提供了基础材料。但随着甘草多糖质量浓度增大,细菌生活环境的渗透压的改变,导致细菌的生长受阻,生物被膜形成受到抑制。病原微生物生物被膜在抵抗机体清除入侵病原微生物中起着重要作用,超过80%的人类感染与细菌生物被膜形成有关,同时病原微生物生物被膜形成可显著增强细菌的耐药性 [17]。资料显示,Lm通过形成生物被膜使其能够长期存留于食品环境中 [18],由于目前对于Lm形成生物被膜的相关分子机制尚不清楚,使得Lm的防治工作受到限制。本研究中甘草多糖对Lm生物被膜形成的影响与甘草多糖对Lm生长影响的变化趋势一致。
活性物质主要是通过提高机体的非特异性免疫和细胞免疫发挥作用,甘草甜素是一种有效的生物应答修饰剂,是甘草提取物中应用最为广泛的活性成分,具有增强自然杀伤细胞和巨噬细胞的活性以及消除抑制性巨噬细胞的抑制活性 [19],在体外或体内抑制水痘病毒、艾滋病病毒、SARS病毒、乙肝病毒以及抑制肿瘤生长 [20]。一定量的甘草多糖能够抑制小鼠S180等肿瘤生长,以及抑制水疤性口炎病毒、腺病毒Ⅱ型、HSV-Ⅰ、牛痘病毒、柯萨奇病毒 [21-22]。巨噬细胞在细胞免疫中占据重要作用,具有吞噬和分泌多种细胞因子等功能。甘草多糖可通过促进巨噬细胞分泌IL-1β、IL-6、IL-12和TNF-α,抑制IL-4、TGF-β和IL-10的分泌从而显著增强小鼠腹腔巨噬细胞吞噬大肠杆菌 [23]。本研究结果显示,甘草多糖可明显提高小鼠抵抗Lm感染的能力,且这种保护力具有质量浓度依赖性。同时,不同质量浓度甘草多糖均可增强机体清除细菌的能力,呈质量浓度依赖降低Lm在肝脏、脾脏和肺脏中的细菌数量。
实验表明,低质量浓度甘草多糖在体外对Lm的生长具有促进作用,且呈质量浓度依赖性,但高质量浓度时对Lm则表现出一定的抑制作用。而体内给予甘草多糖可以增强小鼠抵抗Lm感染的能力。
参考文献:
[1] Centers for Disease Control and Prevention. Outbreak of listeriosisnortheastern United States, 2002[J]. Morbidity and Mortality Weekly Report, 2002, 51(42): 950-951. DOI:10.1001/jama.288.18.2260.
[2] 贾艳艳, 何雷, 郁川, 等. 豫西地区市售鸭翅中单增李斯特菌毒力基因的检测[J]. 中国畜牧兽医, 2014, 41(11): 283-287.
[3] 连凯, 谈卫军, 赵丹, 等. 2002—2012年人和动物李斯特菌感染报告数据流行病学分析[J]. 中国人兽共患病学报, 2014, 30(10): 1033-1038. DOI:10.3969/cjz.j.issn.1002-2694.2014.10.010.
[4] JOHNSTON L M, JAYKUS L A, MOLL D, et al. A field study of the microbiological quality of fresh produce of domestic and Mexican origin[J]. International Journal of Food Microbiology, 2006, 112(2): 83-95. DOI:10.1016/j.ijfoodmicro.2006.05.002.
[5] 靳晓燕, 韩军, 于宏伟, 等. 食品中单核增生性李斯特菌(Listeria monocytogenes)污染状况研究[J]. 中国食品学报, 2009, 9(1): 226-231. DOI:10.3969/j.issn.1009-7848.2009.01.038.
[6] 王天姝, 王艳, 贺春月, 等. 中国部分食品分离单增李斯特菌的抗菌药物敏感性及耐药基因检测[J]. 疾病监测, 2013, 28(3): 224-229. DOI:10.3784/j.issn.1003-9961.2013.3.016.
[7] 高雪岩, 王文全, 魏胜利, 等. 甘草及其活性成分的药理活性研究进展[J]. 中国中药杂志, 2009, 34(21): 2695-2700. DOI:10.3321/ j.issn:1001-5302.2009.21.001.
[8] FIORE C, EISENHUT M, KRAUSSE R, et al. Antiviral effects of Glycyrrhiza species[J]. Phytotherapy Research, 2008, 22(2): 141-148. DOI:10.1002/ptr.2295.
[9] CHENG Anwei, WAN Fachun, JIN Zhengyu, et al. Nitrite oxide and inducible nitric oxide synthase were regulated by polysaccharides isolated from Glycyrrhiza uralensis Fisch[J]. Journal of Ethnopharmacology, 2008, 118(1): 59-64. DOI:10.1016/j.jep.2008.03.002.
[10] DJORDJEVIC D, WIEDMANN M, MCLANDSBOROUGH L A. Microtiter plate assay for assessment of Listeria monocytogenes biofi lm formation[J]. Applied and Environmental Microbiology, 2002, 68(6): 2950-2958. DOI:10.1128/AEM.68.6.2950-2958.2002.
[11] 谢明勇, 聂少平. 天然产物活性多糖结构与功能研究进展[J]. 中国食品学报, 2010, 10(2): 1-11. DOI:10.3969/j.issn.1009-7848.2010.02.001.
[12] 张明发, 沈雅琴. 甘草及其活性成分抗炎与抗炎机制的研究进展[J].现代药物与临床, 2011, 26(4): 261-268.
[13] 梁冰, 杨爱馥, 黄凤兰, 等. 甘草属(Glycyrrhiza)化学成分及药理作用研究进展[J]. 东北农业大学学报, 2006, 37(1): 115-119. DOI:10.3969/ j.issn.1005-9369.2006.01.025.
[14] 汲晨锋, 姜薇, 王晓晶. 甘草多糖的化学与药理研究[J]. 哈尔滨商业大学学报(自然科学版), 2004, 20(5): 515-518. DOI:10.3969/ j.issn.1672-0946.2004.05.004.
[15] 靳嘉巍, 张力, 查锡良, 等. 葡萄糖对表皮葡萄球菌生物被膜形成的影响及调节机制的研究[J]. 微生物学报, 2005, 45(3): 431-436. DOI:10.3321/j.issn:0001-6209.2005.03.024.
[16] 刘琳, 谭小娟, 贾爱群. 细菌群体感应与细菌生物被膜形成之间的关系[J]. 微生物学报, 2012, 52(3): 271-278.
[17] ROMERO R, SCHAUDINN C, KUSANOVIC J P, et al. Detection of a microbial biofilm in intraamniotic infection[J]. American Journal of Obstetrics and Gynecology, 2008, 198(1): e1-e135. DOI:10.1016/ j.ajog.2007.11.026.
[18] 叶正兴, 王艳, 李培京, 等. 单增李斯特菌1/2a血清型菌株生物膜形成能力及相关基因差异研究[J]. 中国人兽共患病学报, 2013, 29(4): 354-360. DOI:10.3969/cjz.j.issn.1002-2694.2013.04.008.
[19] 程安玮, 金征宇, 万发春. 甘草多糖对小鼠腹腔巨噬细胞NO、iNOS及iNOS mRNA表达的影响[J]. 食品科学, 2009, 30(21): 351-354. DOI:10.3321/j.issn:1002-6630.2009.21.082.
[20] 曲中堂, 项昭保. 甘草甜素药理作用研究动态[J]. 时珍国医国药, 2007, 18(10): 2568-2570. DOI:10.3969/j.issn.1008-0805.2007.10.152.
[21] 王忱, 谢广茹, 史玉荣, 等. 甘草多糖的体内抑瘤作用及其机制的研究[J]. 临床肿瘤学杂志, 2003, 8(2): 85-87. DOI:10.3969/ j.issn.1009-0460.2003.02.002.
[22] 王兵, 王亚新, 赵红燕, 等. 甘草的主要成分及其药理作用的研究进展[J]. 吉林医药学院学报, 2013, 34(3): 215-218. DOI:10.3969/ j.issn.1673-2995.2013.03.024.
[23] 王晓利, 廖成水, 程源斌, 等. 甘草甜素甘草多糖和光甘草定对小鼠巨噬细胞的毒性与免疫功能的调节[J]. 中国兽医科学, 2014(3): 320-325.
Effect of Glycyrrhiza Polysaccharide on the Growth of Listeria monocytogenes in Vitro and in Vivo
LIAO Chengshui
1,2, JIA Yanyan
1, LI Zhili
3, SUN Ningna
4, LI Liangwei
5, WANG Xiaoli
1,5, YU Zuhua
1, YU Chuan
1, CHENG Xiangchao
1,*
(1. Animal Disease and Public Security Academician Workstation of Henan Province, Henan Key Laboratory of Animal Disease and Public Health, Henan University of Science and Technology, Luoyang 471003, China; 2. Key Laboratory of Zoonosis, Ministry of Education, Institute of Zoonosis, Jilin University, Changchun 130062, China; 3. College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471023, China; 4. Offi ce of Ruzhou Committee of Communist Party of China, Ruzhou 467500, China; 5. Ruzhou Animal Health Inspection Institute, Ruzhou 467500, China)
Abstract:Objective: To investigate the effect of Glycyrrhiza polysaccharide on Listeria monocytogenes (Lm) in vitro and in vivo. Methods: Colony counting method and fluorescence microscope/spectrophotometric method were used to evaluate the effect of Glycyrrhiza polysaccharide on the growth and biofilm formation of Lm, respectively. The median lethal dosage (LD 50) was calculated by Bliss method. Protective efficacy against 100 × LD 50Lm was tested in mice administered with Glycyrrhiza polysaccharide at high, middle and low doses. Mice infected with 0.01 × LD 50Lm were killed at 1, 7, 14, 21, 28 and 35 days for the detection of bacterial distribution in spleen, liver, and lung. Results: The promotion effect of Glycyrrhiza polysaccharide on the growth and biofilm formation of Lm 10403S at low concentrations (10, 20 and 50 μg/mL) was observed in a concentration-dependent manner, whereas it was slightly reduced at high doses (100 and 200 μg/mL). LD 50of Lm was 2.70 × 10 8CFU. A total of 50% mice infected with 100 × LD 50Lm could still be alive after administration of Glycyrrhiza polysaccharide (100 mg/kg). Bacterial number in spleen, liver, and lung of the mice infected with 0.01 × LD 50Lm was gradually decreased by increasing the dose of Glycyrrhiza polysaccharide. Conclusion: Glycyrrhiza polysaccharide at low doses can promote the growth of Lm in vitro, but this effect gradually decreases with the increase in drugconcentration. Conclusively, Glycyrrhiza polysaccharide has a protective effect against Lm infection in mice in vivo.
Key words:Glycyrrhiza polysaccharide; Listeria monocytogenes; biofilm formation; inhibition
收稿日期:2015-12-08
基金项目:河南科技大学博士启动基金项目(13480071);河南科技大学青年科学基金资助项目(2015QN033);
国家自然科学基金面上项目(31572489)
作者简介:廖成水(1986—),男,副教授,博士,研究方向为微生物感染与先天性免疫细胞作用。E-mail:liaochengshui33@163.com
*通信作者:程相朝(1965—),男,教授,博士,研究方向为动物疫病发生的分子与免疫学机制。E-mail:chengxch@126.com
DOI:10.7506/spkx1002-6630-201617036
中图分类号:R967
文献标志码:A
文章编号:1002-6630(2016)17-0213-06
DOI:10.7506/spkx1002-6630-201617036. http://www.spkx.net.cn
引文格式: