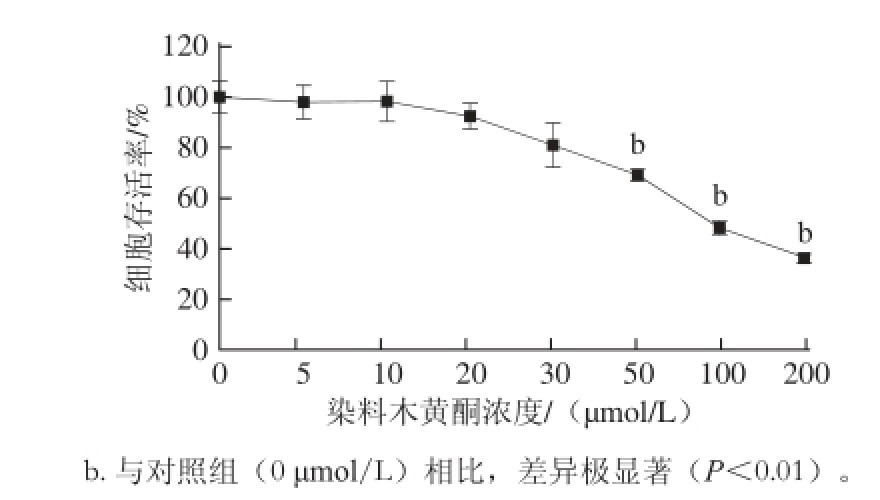
图1 染料木黄酮对3T3-L1细胞存活率的影响
Fig. 1 Effect of genistein on the survival rate of 3T3-L1 cells
胡文敏,张 岭,李林子,张丽婧,胡志航,陈建国,刘冬英,刘 臻,王 茵 *
(浙江省医学科学院,浙江 杭州 310013)
摘 要:目的:研究染料木黄酮是否通过雌激素受体介导影响3T3-L1前脂肪细胞成脂分化,并探讨其可能的机制。方法:以不同浓度染料木黄酮处理3T3-L1细胞,四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)法测定细胞存活率;在3T3-L1前脂肪细胞成脂分化过程中分别加入不同浓度染料木黄酮、染料木黄酮和ICI182780(一种雌激素受体抑制剂)混合物及不同浓度雌二醇,油红染色观察分化结果,测定细胞甘油三酯(triglyceride,TG)含量;染料木黄酮、染料木黄酮和ICI182780混合物及不同浓度雌二醇处理诱导成熟后的脂肪细胞,测定培养液甘油含量;分别用染料木黄酮(30 μmol/L)、染料木黄酮(30 μmol/L)和ICI182780混合物干预细胞成脂分化,Western blotting法检测细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、p-ERK、腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)、p-AMPK、激素敏感性脂肪酶(hormone sensitive lipase,HSL)、脂肪酸合成酶(fatty acid synthetase,FAS)蛋白表达量。结果:3T3-L1细胞存活率随染料木黄酮浓度的升高而降低,50~200 μmol/L染料木黄酮能抑制细胞生长(P<0.01);染料木黄酮能负向调节成脂分化后细胞胞浆内TG含量,在0~50 μmol/L浓度范围内呈剂量依赖关系,高剂量雌二醇(100 nmol/L)能下调TG含量;染料木黄酮能促进成熟脂肪细胞脂解,提高细胞培养液甘油浓度;染料木黄酮(30 μmol/L)能上调p-AMPK、HSL蛋白表达,下调FAS蛋白表达(P<0.01),对ERK、p-ERK、AMPK表达量无明显影响(P>0.05)。ICI182780(1 μmol/L)能部分阻断染料木黄酮(30 μmol/L)对p-AMPK的调节作用(P<0.05)。结论:染料木黄酮能抑制3T3-L1细胞成脂分化,其机制可能是染料木黄酮一方面下调FAS蛋白表达,抑制脂肪合成,另一方面激活AMPK-HSL途径促进脂肪分解;染料木黄酮还可能通过非雌激素受体途径抑制3T3-L1细胞成脂分化。
关键词:染料木黄酮;3T3-L1细胞;磷酸化腺苷酸活化蛋白激酶;激素敏感性脂肪酶;脂肪酸合成酶
胡文敏, 张岭, 李林子, 等. 染料木黄酮抑制3T3-L1细胞成脂分化机制[J]. 食品科学, 2016, 37(17): 219-224. DOI:10.7506/ spkx1002-6630-201617037. http://www.spkx.net.cn
HU Wenmin, ZHANG Ling, LI Linzi, et al. Anti-adipogenic effect of genistein in 3T3-L1 cells and its mechanism[J]. Food Science, 2016, 37(17): 219-224. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201617037. http://www.spkx.net.cn
肥胖是脂肪代谢紊乱的结果,表现为脂肪大量沉积及脂肪分布失衡。更年期肥胖已成为重要的公共卫生问题,与绝经前女性相比,更年期女性身体脂肪沉积量呈明显上升趋势,尤其表现为腹部脂肪增多,脂肪肝患病率升高,雌激素替代治疗能改善更年期女性脂肪代谢,减少脂肪合成,改善腹型肥胖症状 [1-2]。在细胞层面上,肥胖的产生表现为脂肪细胞体积增大及脂肪细胞数量增多 [3],因此抑制前脂肪细胞增殖分化也是预防和治疗肥胖的方法之一。
染料木黄酮(genistein,Gen)是大豆异黄酮中的主要活性成分,与内源性雌激素结构相似,具有植物雌激素样作用。染料木黄酮能延缓更年期,减少更年期相关疾病的发生率,其机制可能与其雌激素效应有关 [4],现有研究已证明染料木黄酮能抑制3T3-L1前脂肪细胞成脂分化,改善大鼠脂代谢,降低去势雌鼠体质量,促进去势雌鼠脂肪细胞凋亡及脂肪分解代谢 [5-7]。吴丹等 [8]研究表明染料木黄酮(10~50 μmol/L)能减轻HepG2细胞脂肪变状态,并呈剂量依赖关系。本实验将探讨染料木黄酮对3T3-L1前脂肪细胞成脂分化的作用是否由雌激素受体介导,并通过检测脂肪代谢相关信号蛋白的表达,进一步分析染料木黄酮抑制脂肪细胞分化的机制。
1.1 材料与试剂
小鼠3T3-L1成纤维细胞,由中国科学院上海细胞库提供。
胰岛素、3-异丁基-1-甲基黄嘌呤、地塞米松、染料木黄酮、油红、雌二醇 美国Sigma公司;胰酶-乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)美国Gibco公司;磷酸盐缓冲液(phosphate buffered saline,PBS) 杭州吉诺公司;新生牛血清(130105)杭州四季青公司;胎牛血清(fetal bovine serum,FBS)以色列Biological Industries公司;组织细胞甘油三酯(triglyceride,TG)酶法测定试剂盒、液体样本甘油含量酶法测定试剂盒 北京普利莱基因技术有限公司;四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)细胞增殖及细胞毒性检测试剂盒(KGA312) 南京凯基生物发展有限公司;激素敏感性脂肪酶(hormone sensitive lipase,HSL)抗体 美国Santa Cruz公司;腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)抗体、p-AMPK、细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、p-ERK、脂肪酸合成酶(fatty acid synthetase,FAS)抗体美国Cell Signaling公司;磷酸甘油醛脱氢酶(reduced glyceraldehyde-phosphate dehydrogenase) 杭州贤至生物科技有限公司;荧光二抗 美国Licor公司。
1.2 仪器与设备
SW-CJ-1FD型单人单面净化工作台 苏州净化设备有限公司;BB150二氧化碳培养箱 美国Thermo Sciencetifi c公司;5417R低温高速离心机 德国Eppendorf公司;TDL-4低速离心机 上海安亭科学仪器厂;DKS22型电热恒温水浴锅 上海精宏实验设备有限公司;SpectraMax M4多功能酶标仪 美国Molecular Devices公司。
1.3 方法
1.3.1 3T3-L1细胞培养
3T3-L1细胞用含10%新生牛血清的DMEM完全培养基培养于37 ℃、5% CO 2的恒温培养箱中,当细胞密度达到70%时用0.25%胰酶(含0.02% EDTA)消化,1∶5传代,取对数期细胞用于实验。
1.3.2 MTT细胞增殖实验
将3T3-L1细胞接种于96 孔板,接种密度为5×10 4个/mL,每孔100 μL,设空白组(未接种细胞)、对照组和Gen(5、10、20、30、50、100、200 μmol/L)组,置于37 ℃、5% CO 2的恒温培养箱中培养12 h。弃培养基,空白组及对照组加100 μL完全培养基,Gen组分别加等体积含各剂量染料木黄酮的完全培养基,调整各组二甲基亚砜(dimethyl sulfoxide,DMSO)体积分数至0.01%。培养48 h后每孔加50 μL MTT液,于培养箱中孵育4 h后取出,2 000 r/ min离心5 min,小心吸去培养液,每孔加150 μL DMSO,避光摇床振摇15 min使紫色结晶充分溶解,用酶标仪在570 nm波长处测定吸光度,计算细胞存活率。
1.3.3 3T3-L1前脂肪细胞诱导分化
取对数生长期的3T3-L1细胞接种于6 孔板,接种密度为2×10 4个/mL,每隔2 d换液一次。细胞接触性抑制2 d后(d0)加诱导剂Ⅰ进行诱导,培养60 h后换诱导剂Ⅱ,诱导剂Ⅱ培养3 d后(d6),约90%的3T3-L1前脂肪细胞分化为成熟脂肪细胞。诱导剂Ⅰ组成:1-甲基-3-异丁基黄嘌呤(0.5 mol/L)、地塞米松(1 μmol/mL)、胰岛素(insulin,INS)(10 μg/mL)、10% FBS;诱导剂Ⅱ组成:INS(10 μg/mL)、10% FBS。药物干预组诱导剂Ⅰ、Ⅱ含各剂量干预药物。
1.3.4 油红染色
将0.6 g油红溶于200 mL异丙醇中,过滤,配制成油红贮备液,染色前取一定量油红贮备液加双蒸水以3∶2的比例混匀,过滤,静置10 min,取配制好的油红上清液用于染色。染色前用10%的甲醛溶液固定细胞1 h,弃固定液,用60%异丙醇溶液小心漂洗细胞,加当天配制的油红上清液染色20 min,弃油红染液,双蒸水小心漂洗3 遍,至倒置显微镜下观察分化结果。
1.3.5 细胞TG含量测定
取对数生长期的3T3-L1细胞接种于6 孔板,接种密度为2×10 4个/mL,按1.3.3节方法进行分组诱导分化。取d6期细胞,用4 ℃预冷的PBS洗涤细胞两次,细胞刮收集细胞,按组织细胞TG酶法测定试剂盒测定TG含量,剩余裂解后的细胞用二辛可宁酸(butyleyanoacrylate,BCA)法测定蛋白含量用于校正TG值。
1.3.6 脂肪分解测定
取对数生长期的3T3-L1前脂肪细胞,按2×10 4个/孔的密度接种到24 孔板中进行诱导分化(方法如1.3.3节中对照组),诱导分化成熟后,小心吸去培养基,用37 ℃预热的无酚红DMEM培养基洗涤细胞,分别加1 mL含各剂量组干预药物的无酚红培养液(无血清),作用7 h后吸取上层培养基,按照普利莱基因技术有限公司的液体样品甘油含量甘油磷酸氧化酶(glycerol-3-phosphate oxidase,GPO)-过氧化物酶(peroxidase,POD)酶法测定试剂盒测定甘油含量。各组培养液DMSO体积分数均为0.01%。
1.3.7 蛋白印记分析
取对数生长期的3T3-L1细胞接种于6 孔板进行分组诱导(方法如1.3.3节中对照组),取d6期细胞,用4 ℃预冷的PBS洗涤两次,加细胞裂解液裂解,4 ℃摇床20 min后,13 000 r/min离心10 min,取中间层清液,重复离心一次。取10 μL样品蛋白用BCA法测定蛋白含量,将剩余样品用裂解液稀释到同一蛋白浓度,加入5×Loading Buffer于100 ℃煮样变性5 min,冷却后涡旋混匀,用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)分离蛋白,转膜,30 ℃封闭1.5 h,一抗4 ℃孵育过夜,洗膜,30 ℃荧光二抗孵育1 h,洗膜,用Odyssey荧光扫描仪扫描荧光信号。
1.4 数据统计分析
两组间比较用t检验,组间多重比较用最小显著差法。P<0.05或P<0.01表示差异有统计学意义。
2.1 染料木黄酮对3T3-L1细胞增殖的影响
3T3-L1细胞分别在含0、5、10、20、30、50、100、200 μmol/L染料木黄酮的培养液中培养48 h。如图1所示,与对照组(0 μmol/L)相比,50、100、200 μmol/L染料木黄酮能明显抑制3T3-L1细胞增殖,差异有统计学意义(P<0.01);5、10、20、30 μmol/L染料木黄酮对3T3-L1细胞增殖无明显影响,差异无统计学意义(P>0.05)。

图1 染料木黄酮对3T3-L1细胞存活率的影响
Fig. 1 Effect of genistein on the survival rate of 3T3-L1 cells
2.2 3T3-L1细胞成脂分化结果
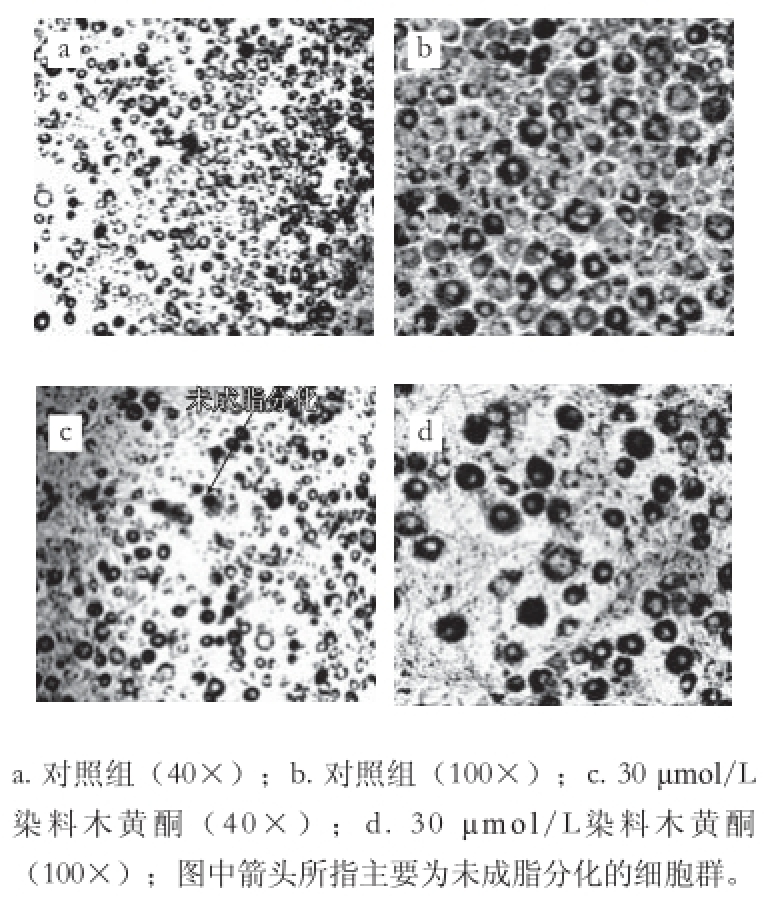
图2 3T3-L1细胞诱导至d6期的油红染色结果
Fig. 2 Oil red staining results for 3T3-L1 cells at d6 stage
对照组3T3-L1细胞诱导分化至d6期90%的细胞分化成熟,油红染色后可见密集的红色圆环状脂肪细胞群(图2)。30 μmol/L染料木黄酮干预组d6期细胞分化率明显低于对照组,油红染色后红色圆环状脂肪细胞分布较稀疏,仍有许多未着色细胞群。
2.3 细胞胞浆内的TG含量
在3T3-L1细胞成脂分化过程中分别加0、5、10、20、30、50 μmol/L染料木黄酮(表示为G0~G50)及雌二醇(1、100 nmol/L,表示为E1、E100)。如图3所示,与对照组(G0)相比,100 nmol/L雌二醇能使3T3-L1细胞TG含量降低10%(P<0.05),20、30、50 μmol/L染料木黄酮能明显抑制3T3-L1成脂分化,降低细胞胞浆中TG含量,抑制率分别为12%、22%、64%,差异有统计学意义(P<0.05或P<0.01),而雌激素受体抑制剂ICI182780能部分阻断染料木黄酮对细胞胞浆中TG的调节作用(G30+IC)。因此,染料木黄酮可抑制3T3-L1前脂肪细胞成脂分化,并呈剂量依赖关系,雌激素受体抑制剂不能完全阻断染料木黄酮对细胞胞浆中TG的调节作用,而高剂量的雌二醇(100 nmol/L)也可降低3T3-L1细胞TG含量。
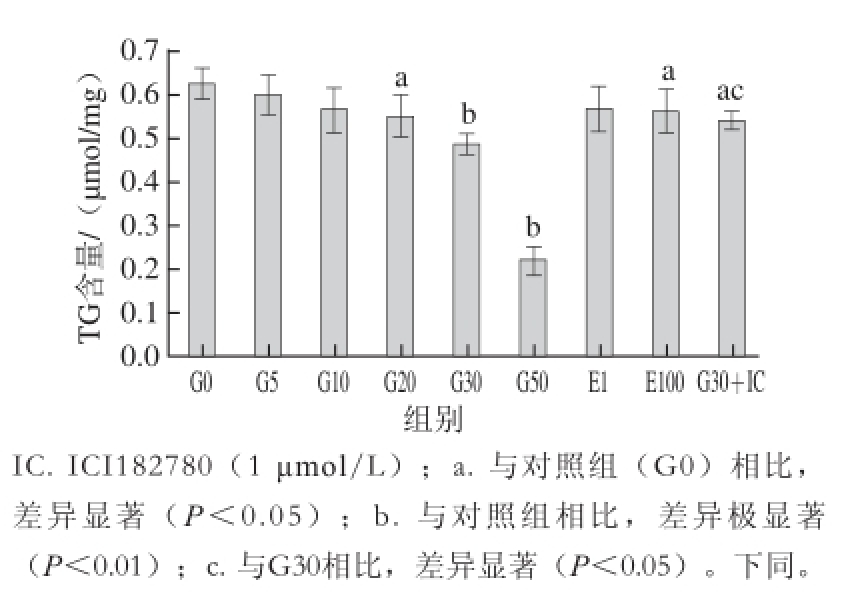
图3 染料木黄酮和雌二醇对3T3-L1细胞TG含量的影响(分化至d6期)
Fig. 3 Effect of genistein and estradiol on triglyceride levels (d6)
2.4 培养液中的甘油浓度
对分化成熟的脂肪细胞进行分别进行染料木黄酮干预和雌二醇干预,染料木黄酮干预浓度分别为0、10、20、30、50 μmol/L,雌二醇干预浓度分别为1、100 nmol/L。如图4所示,与对照组(G0)相比,20、30、50 μmol/L的染料木黄酮显著或极显著促进脂肪细胞脂解(P<0.05或P<0.01),分别使细胞培养基中甘油含量上调14%、17%、31%;高剂量的雌二醇(100 nmol/L)使培养液中甘油含量上调12%,差异有统计学意义(P<0.05)。雌激素受体抑制剂ICI182780不能完全阻断染料木黄酮对培养液甘油的调节作用,与G30组相比,差异无统计学意义。以上结果提示染料木黄酮促进脂肪细胞脂解,并呈剂量依赖关系,高剂量雌二醇能促进脂肪细胞脂解。

图4 染料木黄酮和雌二醇对成熟脂肪细胞脂解作用的影响
Fig. 4 Effect of genistein and estradiol on adipocyte lipolysis
2.5 染料木黄酮对ERK、p-ERK表达的影响

图5 染料木黄酮对ERK、p-ERK表达的影响
Fig. 5 Effect of genistein and estrogen on the expression of ERK and p-ERK
如图5所示,与对照组(G0)相比,30 μmol/L染料木黄酮干预对ERK、p-ERK蛋白表达量无明显影响,差异无统计学意义(P>0.05)。这提示染料木黄酮不通过ERK/p-ERK途径抑制3T3-L1细胞成脂分化。
2.6 染料木黄酮对AMPK、p-AMPK表达的影响

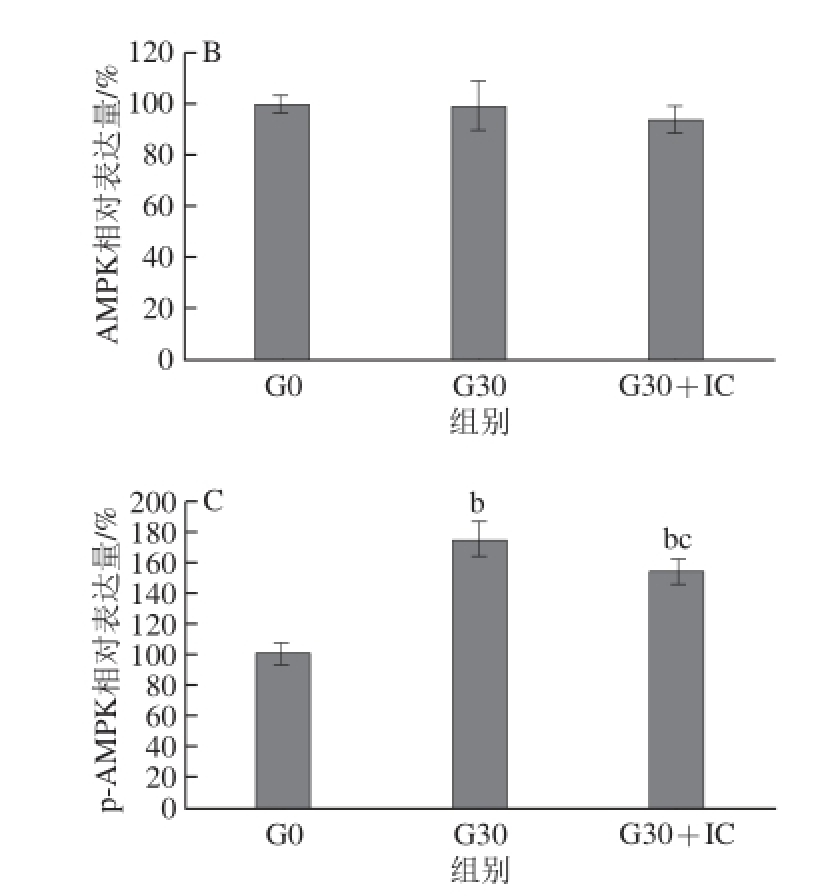
图6 染料木黄酮对AMPK、p-AMPK表达的影响
Fig. 6 Effect of genistein and estrogen on the expression of AMPK and p-AMPK
如图6所示,与对照组(G0)相比,G30组细胞AMPK表达量无明显差异(P>0.05),p-AMPK表达量上调74%,差异具有统计学意义(P<0.01);G30+IC组AMPK表达量无明显差异(P>0.05),p-AMPK表达量上调53%,差异有统计学意义(P<0.01)。与G30组相比,G30+IC组AMPK表达量无明显差异(P>0.05),p-AMPK表达量下调(P<0.05)。以上结果说明染料木黄酮可能通过上调p-AMPK表达,激活AMPK相关途径抑制3T3-L1细胞成脂分化,此作用能被高剂量雌激素受体抑制剂ICI182780部分阻断。
2.7 染料木黄酮对HSL表达的影响
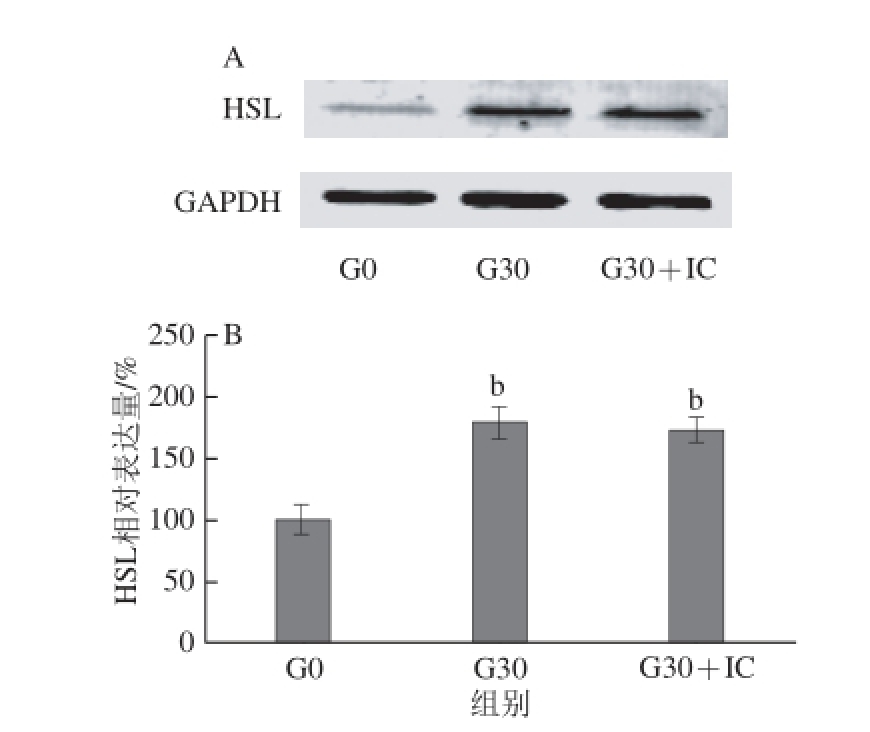
图7 染料木黄酮对HSL表达的影响
Fig. 7 Effect of genistein and estrogen on the expression of HSL
如图7所示,与对照组(G0)相比,G30组细胞HSL表达量上调81%,G30+IC组HSL表达量上调72%,差异有统计学意义(P<0.01)。与G30组相比,G30+IC组HSL表达量无明显差异(P>0.05)。这提示染料木黄酮可能通过上调HSL表达促进脂肪合成作用,此作用不能被雌激素受体抑制剂ICI182780阻断。
2.8 染料木黄酮对FAS表达的影响

图8 染料木黄酮对FAS表达的影响
Fig. 8 Effect of genistein and estrogen on the expression of FAS
如图8所示,与对照组(G0)相比,G30组细胞FAS表达量下调35%,G30+IC组FAS表达量下调37%,差异有统计学意义(P<0.01)。与G30组相比,G30+IC组FAS表达量无明显差异(P>0.05)。这提示染料木黄酮可能通过下调FAS表达抑制脂肪合成作用,此作用不能被雌激素受体抑制剂ICI182780阻断。
TG在细胞中的蓄积量是脂肪细胞成脂分化的评价指标。本实验结果显示,染料木黄酮可下调TG在细胞中的蓄积量,且呈剂量依赖关系。此外,有文献报道高剂量的染料木黄酮对3T3-L1有细胞毒性作用,在48 h干预培养实验中,其半数致死剂量为111.67 μmol/L [9]。因此,本实验采用染料木黄酮安全有效剂量30 μmol/L进行研究。
染料木黄酮与两种亚型雌激素受体ERα和ERβ都有亲和力,其中对ERβ的亲和力约为ERα的22 倍 [10]。低剂量染料木黄酮(10 –8~10 –5μmol/L)对3T3-L1的细胞增殖作用主要由ERα介导,在未分化的3T3-L1细胞中,染料木黄酮干预后ERα表达量下调,而对诱导分化初期的3T3-L1细胞,染料木黄酮干预48 h后ERα表达量上调1.98 倍 [11-12]。Phrakonkham等 [13]研究发现:染料木黄酮能影响ERα mRNA的表达,但其表达结果与细胞分化程度不相关;ERβ mRNA的表达量与细胞分化程度成负相关;染料木黄酮(100 μmol/L)能明显抑制细胞成脂分化,且同时上调ERα mRNA、ERβ mRNA水平。此外有研究表明,雌激素干预48 h能减少成熟脂肪细胞TG含量 [14]。为研究染料木黄酮对3T3-L1细胞的抑制作用是否通过雌激素受体介导,本实验采用雌激素受体拮抗剂ICI182780联合染料木黄酮对3T3-L1细胞进行干预诱导,结果显示染料木黄酮能明显抑制3T3-L1成脂分化且染料木黄酮的这种作用不能完全被雌激素受体抑制剂ICI182780阻断,雌激素对3T3-L1成脂分化有较弱影响,雌二醇(100 nmol/ L)能减少TG在细胞中蓄积,但其抑制效果弱于染料木黄酮(30 μmol/L)。
3T3-L1细胞成脂分化由多种信号通路介导。MAPK/ERK途径是经典的促细胞增殖途径,通过激活细胞周期相关蛋白,提高细胞增殖能力 [15]。在3T3-L1分化过程中,ERK在分化早期起重要作用,但另有研究表明激活后的ERK能抑制胰岛素诱导的3T3-L1细胞分化,这两种结论相悖 [16-17]。本实验发现染料木黄酮对ERK、p-ERK的表达无明显影响。
AMPK是生物能量代谢调节的关键因子。激活的AMPK可使乙酰辅酶A羧化酶、肉毒碱棕榈酰转移酶-1磷酸化从而抑制胆固醇、脂肪酸和TG的合成,增强线粒体功能,提高脂肪酸氧化速率 [18-19]。染料木黄酮能改善高脂大鼠肝脏脂肪代谢,减少肝脏脂质沉积,抑制3T3-L1成脂分化,其作用可能与p-AMPK蛋白表达上调有关 [20-21]。HSL主要在动物白色脂肪组织中表达,其生理作用主要表现为促进TG水解成甘油和游离脂肪酸以满足机体能量需要。Harada等 [22]研究表明HSL基因敲除小鼠白色脂肪组织的质量和TG的含量均下降,但棕色脂肪组织和肝脏中TG的含量均升高。本实验结果显示,染料木黄酮能显著上调p-AMPK(74%)和HSL(81%)表达,ICI182780能部分减弱染料木黄酮对p-AMPK的调节作用。
FAS是合成脂肪酸的关键酶,刘姚等 [23-24]研究发现青钱柳多糖能下调高脂血症小鼠肝脏及脂肪组织FAS表达,抑制3T3-L1细胞成脂分化,下调3T3-L1细胞FAS表达。已有的研究也表明染料木黄酮能抑制3T3-L1成脂分化,下调FAS表达 [6]。本实验发现染料木黄酮能下调FAS表达(37%),ICI182780、染料木黄酮联合应用对FAS表达量的影响与染料木黄酮单独作用效果无明显差异。
综上所述,染料木黄酮能抑制3T3-L1细胞成脂分化,此作用不完全由雌激素受体介导。染料木黄酮对3T3-L1细胞成脂分化的抑制作用可能通过p-AMPK、HSL、FAS信号通路介导完成。
参考文献:
[1] ESHTIAGHI R, ESTEGHAMATI A, NAKHJAVANI M. Menopause is an independent predictor of metabolic syndrome in Iranian women[J]. Maturitas, 2010, 65(3): 262-266. DOI:10.1016/j.maturitas.2009.11.004.
[2] SANGHAVI M, TURER A, NEELAND I, et al. Postmenopausal status is independently associated with advanced hepatic steatosis: the dallas heart study[J]. Journal of the American College of Cardiology, 2013, 61(10): E1429. DOI:10.1016/S0735-1097(13)61429-1.
[3] 鞠大鹏, 詹丽杏. 脂肪细胞分化及其调控的研究进展[J]. 中国细胞生物学学报, 2010(5): 690-695.
[4] 李亚玲, 叶云, 李俊. 天然植物雌激素-染料木黄酮延缓女性更年期的临床疗效观察及其作用机制的研究[J]. 中国妇幼保健, 2013, 28(4): 645-649. DOI:10.7620/zgfybj.j.issn.1001-4411.2013.28.27.
[5] 马海田, 姚一琳, 陈香, 等. 染料木黄酮对幼年大鼠脂代谢和抗氧化作用的影响[J]. 中国组织工程研究与临床康复, 2008, 12(2): 297-301. DOI:10.3321/j.issn:1673-8225.2008.02.022.
[6] 张萌, 池田克己, 家森幸男. 染料木黄酮对3T3-L1前脂肪细胞分化的作用及其机制研究[J]. 营养学报, 2009, 31(2): 152-155. DOI:10.13325/ j.cnki.acta.nutr.sin.2009.02.021.
[7] KIM H K, NELSON-DOOLEY C, DELLA-FERA M A, et al. Genistein decreases food intake, body weight, and fat pad weight and causes adipose tissue apoptosis in ovariectomized female mice[J]. Journal of Nutrition, 2006, 136(2): 409-414.
[8] 吴丹, 邓颖勋, 王宇琦, 等. 染料木黄酮对脂肪变HepG2细胞甘油三酯水平和Lipin 1表达的影响[J]. 营养学报, 2013, 35(4): 353-356. DOI:10.13325/j.cnki.acta.nutr.sin.2013.04.010.
[9] CHOI E J, JUNG J Y, KIM G H. Genistein inhibits the proliferation and differentiation of MCF-7 and 3T3-L1 cells via the regulation of ERα expression and induction of apoptosis[J]. Experimental & Therapeutic Medicine, 2014, 8(2): 454-458. DOI:10.3892/etm.2014.1771.
[10] KUIPER G G J M, LEMMEN J G, CARLSSON B O, et al. Interaction of estrogenic chemicals and phytoestrogens with estrogen receptor β[J]. Endocrinology, 1998, 139(10): 4252-4263. DOI:10.1210/ endo.139.10.6216.
[11] WANG T T, SATHYAMOORTHY N, PHANG J M. Molecular effects of genistein on estrogen receptor mediated pathways[J]. Carcinogenesis, 1996, 17(2): 271-275. DOI:10.1093/carcin/17.2.271.
[12] CHOI E J, JUNG J Y, KIM G H. Genistein inhibits the proliferation and differentiation of MCF-7 and 3T3-L1 cells via the regulation of ERα expression and induction of apoptosis[J]. Experimental & Therapeutic Medicine, 2014, 8(2): 454-458. DOI:10.3892/etm.2014.1771.
[13] PHRAKONKHAM P, VIENGCHAREUN S, BELLOIR C, et al. Dietary xenoestrogens differentially impair 3T3-L1 preadipocyte differentiation and persistently affect leptin synthesis[J]. Journal of Steroid Biochemistry & Molecular Biology, 2008, 110(1/2): 95-103. DOI:10.1016/j.jsbmb.2008.02.006.
[14] 黄文钰. 雌激素对脂肪细胞甘油三酯代谢的影响及机制探讨[D]. 长沙: 中南大学, 2014: 1-30.
[15] KIM J H, PARK S H, NAM S W, et al. Curcumin stimulates proliferation, stemness acting signals and migration of 3T3-L1 preadipocytes[J]. International Journal of Molecular Medicine, 2011, 28(3): 429-435. DOI:10.3892/ijmm.2011.680.
[16] PRUSTY D, PARK B H, DAVIS K E, et al. Activation of MEK/ERK signaling promotes adipogenesis by enhancing peroxisome proliferatoractivated receptor γ (PPARγ) and C/EBPα gene expression during the differentiation of 3T3-L1 preadipocytes[J]. Journal of Biological Chemistry, 2002, 277(48): 46226-46232. DOI:10.1074/jbc.M207776200.
[17] BONEY C M, GRUPPUSO P A, FARIS R A, et al. The critical role of Shc in insulin-like growth factor-I-mediated mitogenesis and differentiation in 3T3-L1 preadipocytes[J]. Molecular Endocrinology, 2000, 14(6): 805-813. DOI:10.1210/mend.14.6.0487.
[18] MOORE F, BROPHY P J. Regulation of acetyl-CoA carboxylase (ACC) by ATP depletion in developing oligodendrocytes mimics the action of AMP-activated protein kinase (AMPK)[J]. Biochemical Society Transactions, 1994, 22(4): 416. DOI:10.1042/bst022416s.
[19] ZAMMIT V A, ARDUINI A. The AMPK-malonyl-CoA-CPT1 axis in the control of hypothalamic neuronal function [J]. Cell Metabolism, 2008, 8(3): 175. DOI:10.1016/j.cmet.2008.07.009.
[20] 纪桂元, 邓颖勋, 王宇琦, 等. 染料木黄酮对高脂饮食喂养大鼠肝脏脂质代谢和AMPK磷酸化的影响[J]. 华南预防医学, 2014(4): 388-391. DOI:10.13217/j.scjpm.2014.0388.
[21] HWANG J T, PARK I J, SHIN J I, et al. Genistein, EGCG, and capsaicin inhibit adipocyte differentiation process via activating AMP-activated protein kinase[J]. Biochemical and Biophysical Research Communications, 2005, 338(2): 694-699. DOI:10.1016/ j.bbrc.2005.09.195.
[22] HARADA K, SHEN W J, PATEL S, et al. Resistance to high-fat dietinduced obesity and altered expression of adipose-specifi c genes in HSL-deficient mice[J]. American Journal of Physiology-Endocrinology and Metabolism, 2003, 285(6): E1182-E1195. DOI:10.1152/ ajpendo.00259.2003.
[23] 刘姚, 陈婷婷, 傅凌韵, 等. 青钱柳多糖对高脂血症小鼠脂肪酸合成酶(FAS)表达影响[J]. 江西农业大学学报, 2013, 35(2): 392-397. DOI:10.13836/j.jjau.2013070.
[24] 刘姚. 青钱柳多糖对3T3-L1脂肪细胞的细胞增殖及脂肪代谢的影响[D]. 南昌: 江西农业大学, 2013: 15-32.
Anti-adipogenic Effect of Genistein in 3T3-L1 Cells and Its Mechanism
HU Wenmin, ZHANG Ling, LI Linzi, ZHANG Lijing, HU Zhihang, CHEN Jianguo, LIU Dongying, LIU Zhen, WANG Yin*
(Zhejiang Academy of Medical Sciences, Hangzhou 310013, China)
Abstract:Objective: To investigate the anti-adipogenic effect and underlying mechanism of genistein in 3T3-L1 cells and its estrogen receptor (ER) mediated pathway. Methods: After treated with various concentrations of genistein, the survival rate of 3T3-L1 cells was assessed by MTT assay. In addition, after treated with genistein, genistein-ICI182780, or estrogen, differentiation degree and lipid accumulation of the cells were assessed by oil red staining and a TG assay kit, and adipocyte lipolysis was assessed by a glycerin assay kit. After intervention by genistein or genistein-ICI182780, the expression of extracellular signal-regulated kinase (ERK), phospho-extracellular signal-regulated kinase (p-ERK), adenosine monophosphate activated protein kinase (AMPK), phospho-adenosine monophosphate activated protein kinase (p-AMPK), hormone sensitive lipase (HSL), and fatty acid synthetase (FAS) were analyzed by Western blotting. Results: Genistein and high-dose estrogen inhibited lipid accumulation of 3T3-L1 and increased lipolysis in adipocytes. The presence of ICI182780 partly decreased both functions of genistein. Furthermore, genistein increased the expression of p-AMPK and HSL, and decreased the expression of FAS. The presence of ICI182780 could slightly suppress the increase of p-AMPK caused by genistein intervention. Conclusion:Genistein can inhibit the adipogenesis and differentiation of 3T3-L1 cells via a non-ER pathway through a mechanism which may be relate to p-AMPK, HSL and FAS.
Key words:genistein; 3T3-L1 cell; phospho-adenosine monophosphate activated protein kinase (p-AMPK); hormone sensitive lipase (HSL); fatty acid synthetase (FAS)
收稿日期:2015-10-22
基金项目:浙江省医药卫生平台重点资助计划项目(2014ZDA004);浙江省营养学医学支撑学科建设项目(11-zc03);
浙江省科技厅创新团队建设与人才培养项目(2011F20038);浙江省科技厅支撑学科建设项目(2013F10007);浙
江省151人才培养项目;食品(保健食品)质量安全评价研究实验室建设项目(2015F10014)
作者简介:胡文敏(1991—),女,硕士研究生,主要从事营养学研究。E-mail:hwm616@163.com
*通信作者:王茵(1963—),女,研究员,本科,主要从事营养与健康关系研究。E-mail:wy3333@163.com
DOI:10.7506/spkx1002-6630-201617037
中图分类号:R151
文献标志码:A
文章编号:1002-6630(2016)17-0219-06
引文格式: