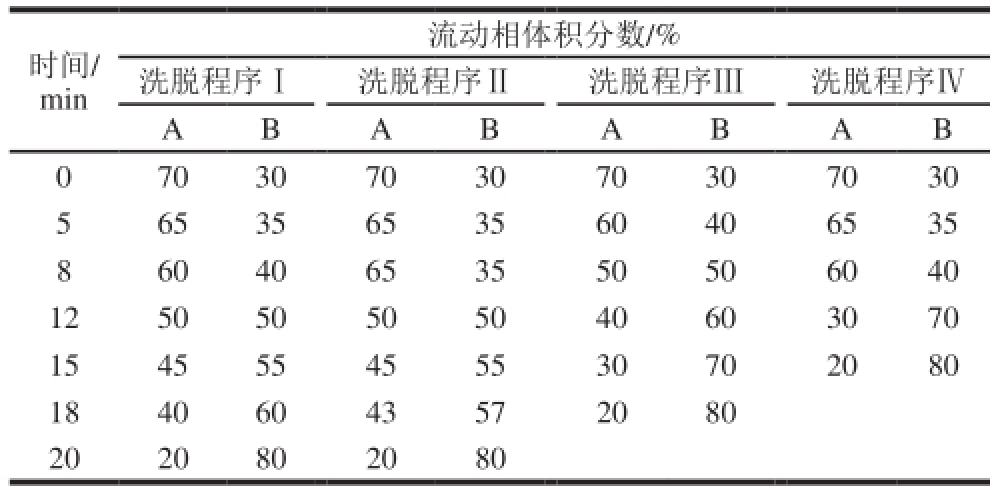
表1 梯度洗脱程序Ⅰ、Ⅱ、Ⅲ和Ⅳ
Table1 Mobile phase gradient elution conditions Ⅰ, Ⅱ, Ⅲ and Ⅳ
?
王维茜 1,邓洁红 1,*,刘永红 2
(1.湖南农业大学食品科技学院,湖南 长沙 410128;2.湖南生物机电职业技术学院,湖南 长沙 410127)
摘 要:经大孔吸附树脂HP-20纯化刺葡萄花色苷的粗提物后,以半制备型高效液相色谱法分离得到高纯度的刺葡萄花色苷单体。以XCharge C 18柱(20 mm×250 mm,10 μm)制备柱,考察梯度洗脱条件、流动相流速、进样量对刺葡萄花色苷分离的影响,确定了最佳制备条件为甲醇-3%甲酸溶液流动相梯度洗脱、流速15 mL/min、进样量1.2 mL,实现了2 种主要花色苷单体的分离及制备。经超高效液相色谱-四极杆飞行时间质谱鉴定,2 种花色苷单体分别是锦葵素-3,5-O-双葡萄糖苷和锦葵素-3,5-O-双葡萄糖苷-香豆酰,产品纯度分别达到了99.54%和98.28%。方法具有简单易行、经济快速、易于放大等特点,适用于刺葡萄花色苷标准品的大规模制备。
关键词:刺葡萄;锦葵素;半制备液相色谱;超高效液相色谱-四极杆飞行时间质谱
花色苷是一类重要的植物色素,色泽鲜艳、来源广泛且具有独特的生理活性功能 [1-3],雷用东等 [4]研究表明紫甘薯花色苷提取物对猪传染性胃肠炎病毒有很好的抗病毒功效,殷丽琴等 [5]通过对紫色马铃薯的花色苷含量与抗氧化活性的测定发现整薯总花色苷含量与总抗氧化活性的正相关性极显著。但由于花色苷稳定性较差,对pH值、热、光、金属等因素极其敏感 [6-8],使其开发应用受到限制,所以研究其稳定化理论和技术具有重要意义。因花色苷单体分离精制过程复杂且成本较高,研究报道多采用色素混合粗提物作为研究对象,无法说明花色苷降解规律。因此,采用简单易行的方法得到大量花色苷单体对花色苷的进一步研究具有重要意义。刺葡萄(Vitis davidii Foex)产量高,价格低,生产废料果皮中富含花色苷,是一种具有巨大潜力的色素资源,课题组前期研究发现,刺葡萄皮中的主要花色苷为锦葵素 [9],但相关标准品种类匮乏且价格昂贵,故有必要建立规模化生产锦葵素对照品的工艺,完善其图谱数据,克服制备性分离瓶颈。
目前,制备花色苷单体的主要方法有薄层色谱法 [10]、凝胶色谱法 [11-12]、半制备型高效液相色谱法 [13-15]、高速逆流色谱法 [16-18]。课题组前期尝试采用大孔吸附树脂层析和葡聚糖凝胶分离相结合,但操作复杂、耗时长、成本高。半制备型高效液相色谱法具有简单易行、经济快速、易于放大等特点,是制备天然产物的重要手段,已广泛应用于多种物质单体标准品的制备 [19-20]。目前应用半制备型高效液相色谱技术制备刺葡萄中锦葵素的研究鲜见报道,本实验利用半制备型高效液相色谱法分离纯化刺葡萄花色苷,对半制备液相色谱条件进行了优化,主要考察了梯度洗脱条件、流动相流速、进样量对刺葡萄花色苷分离的影响,并最终确定了半制备型高效液相色谱法分离纯化刺葡萄花色苷的制备条件,可满足刺葡萄花色苷标准品的大规模制备。
1.1 材料与试剂
刺葡萄果皮购于湖南省芷江县,品种为紫秋。实验之前将果皮洗净,晾干,手工剥皮,-40 ℃冻藏备用。
HP-20大孔吸附树脂 日本三菱公司;乙醇、盐酸、丙酮、乙酸乙酯、乙醚、盐酸、氯化钾、冰醋酸、醋酸钠(均为分析纯) 国药集团化学试剂有限公司;甲醇、乙酸(均为色谱纯) 美国Tedia公司;三氟乙酸、甲酸 美国Aladdin公司。
1.2 仪器与设备
AEY-220型电子天平、UV-2450紫外-可见分光光度计日本岛津集团;THZ-92A气浴恒温振荡器 上海浦东物理光学仪器厂;TDZ5台式低速离心机 湖南赫西仪器装备有限公司;RE-2000B旋转蒸发器、SHZ-D(Ⅲ)循环水式真空泵 巩义市予华仪器有限责任公司;e2695自动进样高效液相色谱仪 美国Waters公司;218半制备型高效液相色谱、440-LC部分收集器、1290超高效液相色谱-G6500四极杆飞行时间质谱(ultra performance liquid chromatography-quadrupole time of flight-mass spectrometer,UPLC-QTOF MS E)联用仪 美国Agilent公司;真空冷冻干燥机 丹麦Heto公司。
1.3 方法
1.3.1 刺葡萄花色苷的提取和纯化
刺葡萄皮以1∶6(g/mL)的料液比加入70%酸化乙醇(含0.03%盐酸),避光浸提24 h,真空浓缩后离心,上清液加入4 倍体积丙酮振荡2 h后真空浓缩,然后分别用无水乙醚和乙酸乙酯萃取2 次,合并水相。用已处理好的HP-20大孔吸附树脂进行初步分离,收集洗脱液浓缩,真空冻干后用甲醇溶解,采用示差法 [21]测得花色苷含量为29.78 mg/mL(上述过程均在温度小于40 ℃条件下进行)。
1.3.2 半制备型高效液相色谱条件的优化
采用XCharge C 18柱(20 mm×250 mm,10 μm);柱温30 ℃;流动相A:3%甲酸溶液,流动相B:甲醇;检测波长520 nm;10 mL定量环。
1.3.2.1 洗脱程序的选择
控制洗脱流速为20 mL/min,进样量为0.8 mL,考察洗脱程序Ⅰ、Ⅱ、Ⅲ、Ⅳ(表1)对刺葡萄花色苷分离的影响。
表1 梯度洗脱程序Ⅰ、Ⅱ、Ⅲ和Ⅳ
Table1 Mobile phase gradient elution conditions Ⅰ, Ⅱ, Ⅲ and Ⅳ

?
1.3.2.2 流速的选择
控制进样量为0.8 mL,洗脱程序为程序Ⅰ,考察流速10、15、20 mL/min对刺葡萄花色苷分离的影响。
1.3.2.3 进样量的选择
控制洗脱流速为15 mL/min,洗脱程序为程序Ⅰ,考察进样量0.8、1.0、1.2、1.5、2.0 mL对刺葡萄花色苷分离的影响。
1.3.3 分析色谱条件
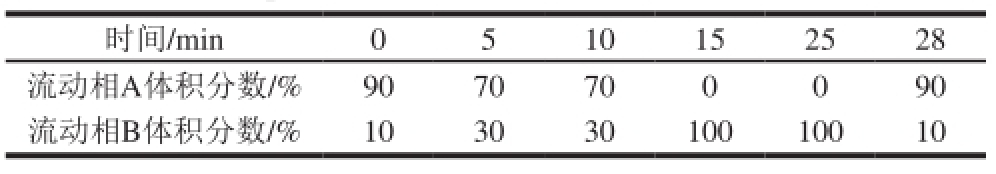
采用hypersil ODS柱(4.6 mm×250 mm,5 μm);柱温30 ℃,流速1.2 mL/min;流动相A:V(甲酸)∶V(水)=1∶9,流动相B:V(甲酸)∶V(水)∶V(甲醇)= 1∶4∶5;线性洗脱条件见表2;Prostar320 PDA检测器,检测波长520 nm;20 μL定量环 [9]。
表2 分析色谱的梯度洗脱条件
Table2 Mobile phase gradient elution conditions of analytical HPLC
?
1.3.4 UPLC-QTOF MS E分析
液相色谱条件:色谱柱Xaqua C 18(2.1 mm×150 mm,5 μm),柱温35 ℃,流速0.3 mL/min;进样体积2 μL;流动相A:0.1%甲酸溶液溶液,流动相B:0.1%甲酸-乙腈;梯度洗脱条件见表3;二极管阵列检测器扫描波长为190~530 nm,色素检测波长为520 nm。
表3 UPLC-QTOF的梯度洗脱条件
Table3 Mobile phase gradient elution conditions of UPLC-QTOF

时间/min1679152525303035流动相A体积分数/%907062624025559090流动相B体积分数/%10303838607595951010
MS条件为:电喷雾电离离子源;喷射电压4 000 V,喷射压力45 psi;辅助气流速10 L/min,温度345 ℃;鞘气流速11 L/min,温度350 ℃;扫描质量范围100~1 000 m/z,正离子模式。
2.1 半制备型高效液相色谱条件的建立
制备型高效液相色谱的效能取决于分离度、分离速度和上样量,提高效能则要求在分离度R不小于1.5条件下具有较快的分离速度和较大的上样量 [22-23]。分离速度主要取决于流动相,上样量取决于进样体积。本实验采用甲醇-甲酸体系,检测波长测定为520 nm,对半制备型高效液相色谱条件的梯度洗脱程序、流速、进样量进行优化。
2.1.1 洗脱程序的选择
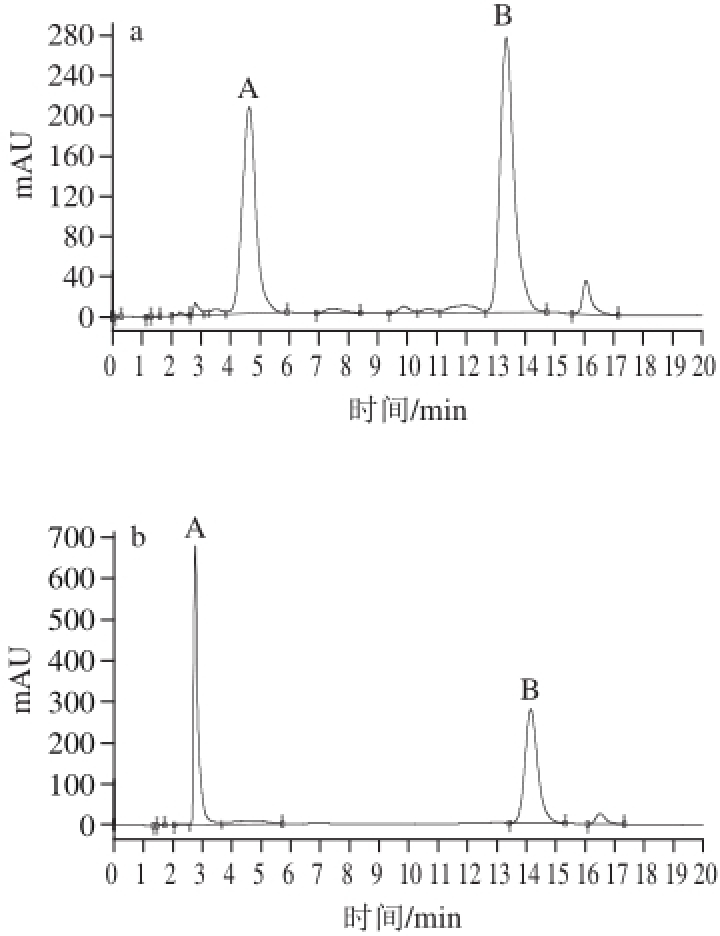
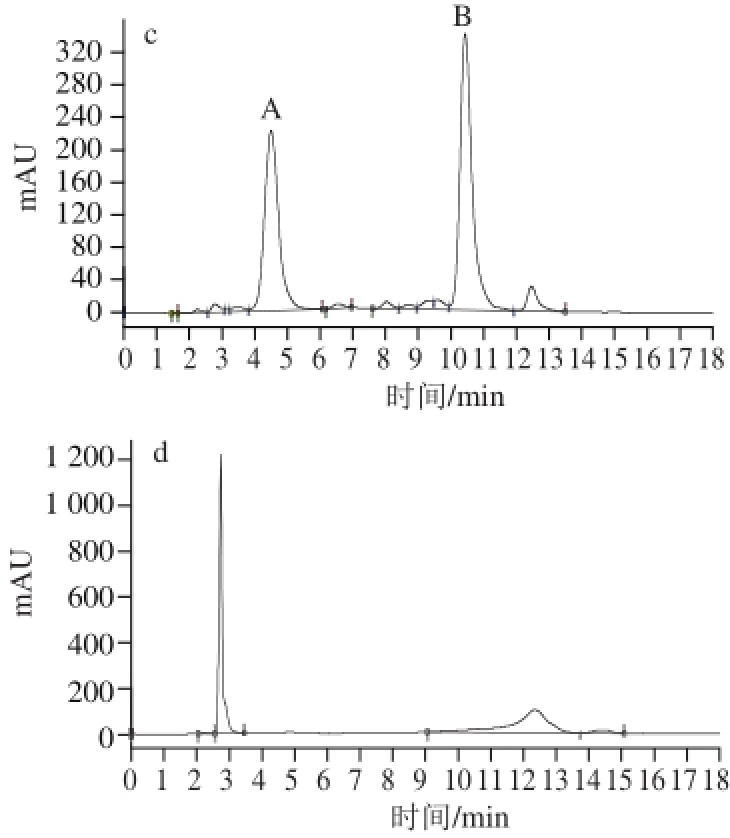
图1 不同梯度洗脱条件下刺葡萄花色苷的制备色谱图
Fig.1 Preparative HPLC chromatogram of anthocyanins from Vitis davidii Foex with different mobile phase gradient elution conditions
A、B.花色苷A、B。下同。a.洗脱程序Ⅰ;b.洗脱程序Ⅱ;c.洗脱程序Ⅲ;d.洗脱程序Ⅳ。
流动相梯度洗脱条件的优化包括改变各梯度变化的时间和每个梯度的流动相组成。分别考察了洗脱程序Ⅰ、Ⅱ、Ⅲ、Ⅳ对刺葡萄花色苷分离的影响。不同梯度洗脱程序下刺葡萄花色苷的制备图谱如图1所示。
表4 洗脱程序对刺葡萄花色苷分离的影响
Table4 Effect of mobile phase gradient elution conditions on isolation of anthocyanins from Vitis davidii Foex

指标程序Ⅰ程序Ⅱ程序Ⅲ程序Ⅳ出峰时间/min3.82.63.82.6单次制备时间/min17.217.413.515.2单次制备流动相消耗量/mL400400360300峰形对称不对称对称不对称花色苷A、B纯度高低A高,B较低低
由图1、表4可知,当实验采用梯度洗脱程序Ⅱ进行分离时,虽出峰时间提前但峰形发生较大改变,花色苷A、B比例出现异常,经分析液相色谱检测纯度均小于60%,采用梯度洗脱程序Ⅳ时,出现了过载现象,采用梯度洗脱程序Ⅲ时,虽然峰形较好,单次制备流动相消耗较低,但是花色苷B后的杂峰提前出峰对花色苷B的纯度造成了一定影响;而采用梯度洗脱程序Ⅰ时,峰形对称,更有利于收集,且花色苷A、B纯度均高于98%,综合考虑,选择梯度洗脱程序Ⅰ进行后续研究。
2.1.2 流速的选择
流动相的流速主要影响的是溶质与固定相和流动相间的相互作用,从而引起待分离组分保留时间的变化。流动相流速的选择在保证分离度的情况下,流速越大越好。流速的选择受3 个因素影响:一是分离度;二是填料本身;三是色谱系统泵的工作能力 [24]。本实验分别考察了10、15、20 mL/min流速下刺葡萄花色苷的分离情况,不同流速时刺葡萄花色苷的制备图谱如图2所示。
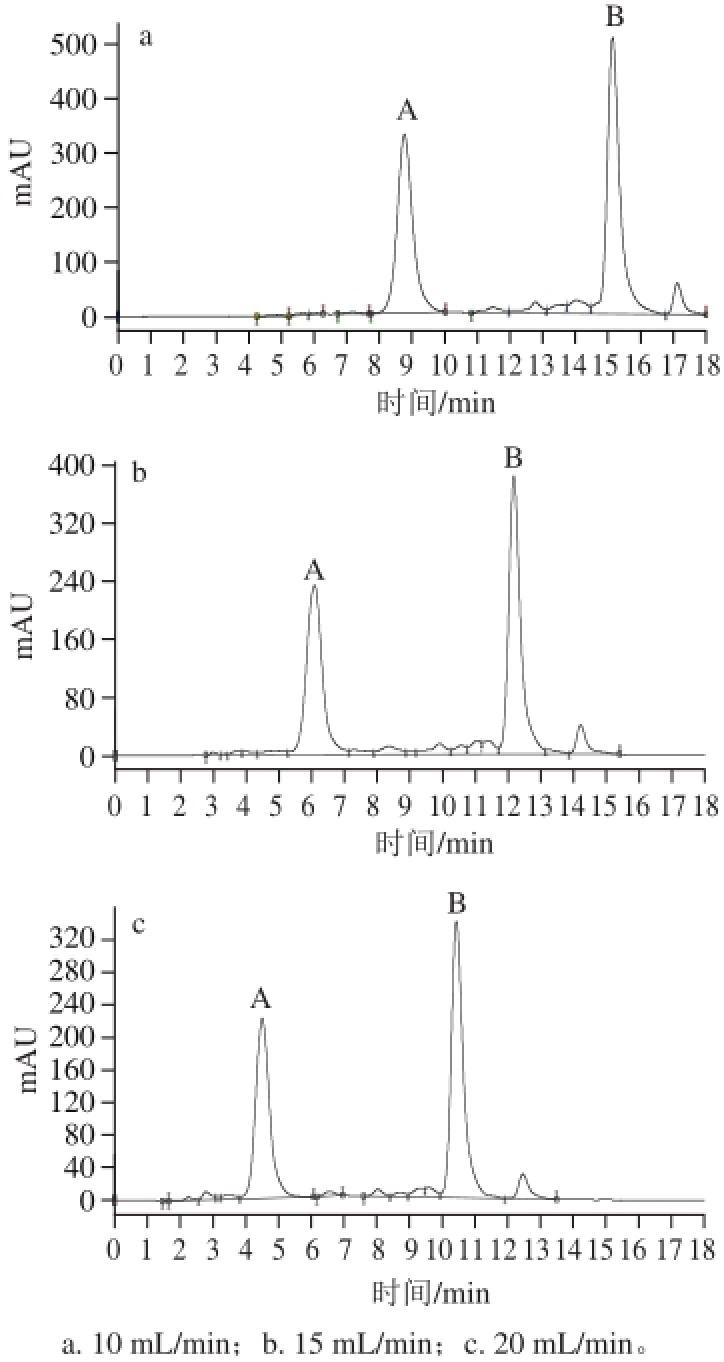
图2 不同流速时刺葡萄花色苷的制备色谱图
Fig.2 Preparative HPLC chromatograms of anthocyanins from Vitis davidiiFoex with different flow rates
表5 流速对刺葡萄花色苷分离的影响
Table5 Effect of flow rate on isolation of anthocyanins from Vitis davidiiFoex
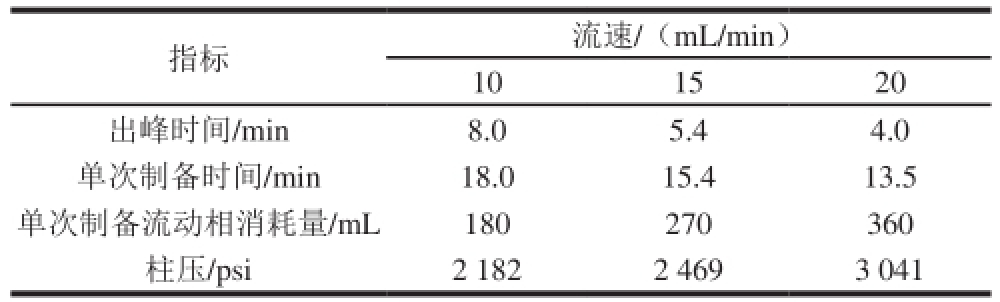
指标流速/(mL/min)10 1520出峰时间/min8.05.44.0单次制备时间/min18.015.413.5单次制备流动相消耗量/mL180270360柱压/psi2 1822 4693 041
由图2、表5可知,在10、15、20 mL/min流速条件下花色苷A、B的分离度R均远大于1.5,峰形对称无明显差别。随着流速的增加,虽然花色苷A、B的保留时间提前,但柱压升高,柱子的使用寿命缩短,同时流动相消耗增大,收集液被过度稀释,后续处理的耗能增多,总的制备成本增加。但是,当流速小于15 mL/min时,出峰时间明显延后,延长了总的制备时间,并增加了流动相消耗量。因此选择最佳流速为15 mL/min。
2.1.3 进样量的选择
在确定了流动相梯度洗脱条件和流速后,进样量成为影响制备效能的重要因素,其不仅影响分离度,同时也决定了制备效率和产物纯度。在进样质量浓度一定的条件下,通过增大进样体积来增大进样量。实验分别考察了进样体积为0.8、1.0、1.2、1.5、2.0 mL时的分离效果,结果如图3所示。

图3 不同进样量时刺葡萄花色苷的制备色谱图
Fig.3 Preparative HPLC chromatograms of anthocyanins from Vitis davidii Foex with different injection volumes
表6 进样量对刺葡萄花色苷分离的影响
Table6 Effect of injection volume on isolation of anthocyanins from Vitis davidiiFoex

指标进样量/mL 0.81.01.21.52.0出峰时间/min4.04.24.03.62.25单次制备时间/min17.217.017.017.0峰形对称对称对称不对称过载花色苷A、B纯度高高高A低,B高
由图3、表6可知,在不影响分离度的情况下,单次进样量越大越好,既节约了实验时间,又减少了流动相消耗量,提高了实验效率。但是,当进样量为1.5 mL时,出峰提前,但花色苷A峰形变差,纯度小于80%,而且进样量过大,柱压增加,物质的分离度下降,当进样量增加到2.0 mL时,出现了明显的过载现象。综合考虑,选择最佳进样量为1.2 mL。
2.2 分析型高效液相色谱检测纯度
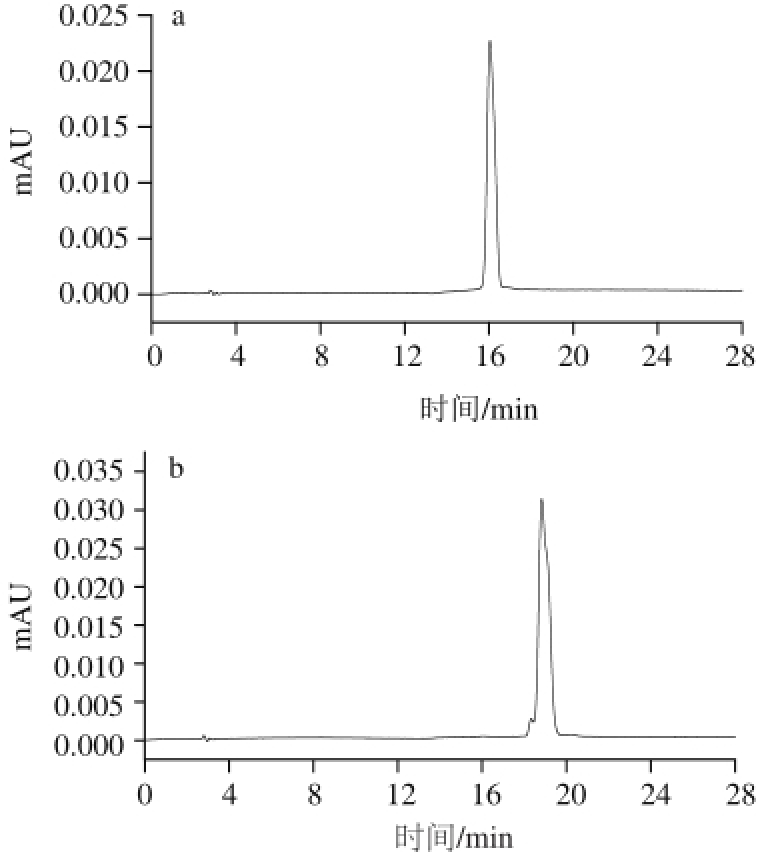
图4 花色苷A(a)和花色苷B(b)单体的HPLC图谱
Fig.4 HPLC chromatograms of anthocyanins A and B
分析型高效液相色谱检测半制备型液相色谱分离所得花色苷A、B的结果如图4所示。花色苷A的保留时间为16.029 min,以归一法计算峰面积,纯度达到99.54%;花色苷B的保留时间为18.815 min,纯度为98.28%。
2.3 UPLC-QTOF MS E检测结果
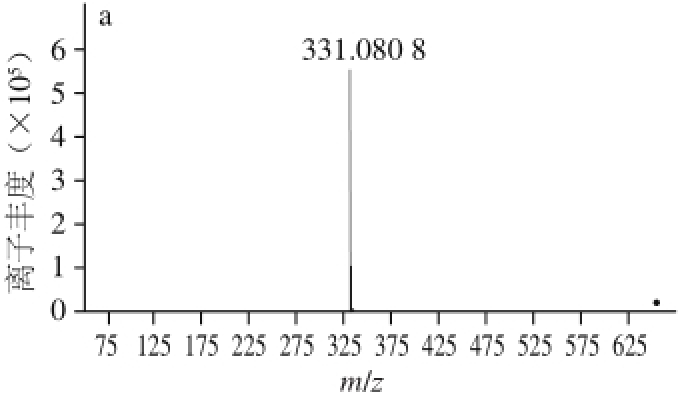
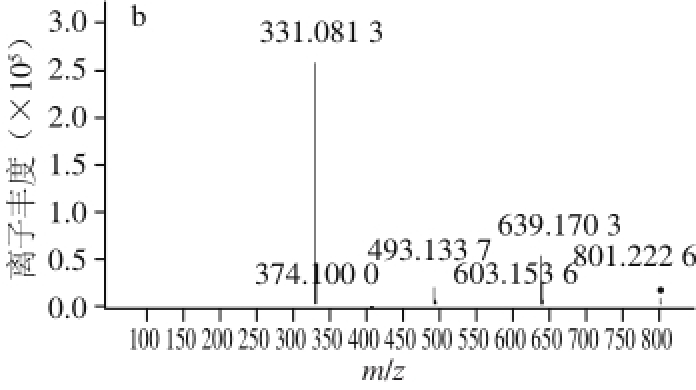
图5 花色苷A(a)和花色苷B(b)的二级质谱图
Fig.5 MS
2spectra of anthocyanin A and anthocyanin B
由图5a可知,花色苷A的保留时间为4.002 min,MS 2信息表明,其分子离子峰为m/z 655,两碎片离子峰分别为m/z 331、493。参考文献[25]并结合前期研究,确定花色苷A为锦葵素-3,5-O-双葡萄糖苷。
由图5b可知,花色苷B的保留时间为6.610 min,MS 2信息表明,其分子离子峰为m/z 801,三碎片离子峰分别为m/z 331、493、639。参考文献[25]并结合前期研究,确定花色苷B为锦葵素-3,5-双葡萄糖苷-香豆酰。
UPLC-QTOF MS E检测结果显示,锦葵素-3,5-O-双葡萄糖苷和锦葵素-3,5-O-双葡萄糖苷-香豆酰产品纯度分别达到了99.54%和98.28%。
花色苷在酸性条件下较稳定,且甲酸可改善峰形,减少拖尾现象,因此选用甲醇-3%甲酸溶液作为流动相。粗提取物先经大孔树脂HP-20除去大部分杂质后,降低了半制备高效液相色谱的分离难度,简化了分离条件和提高了分离效能。
半制备高效液相色谱操作类似于普通分析型高效液相色谱,分离条件简单,分离效果良好,目标产物纯度与收率较高,且无需其他特殊设备。在保证2 个化合物分离度的条件下,本实验对半制备高效液相色谱条件进行了优化,考察了梯度洗脱条件、流动相流速、进样量对刺葡萄花色苷分离的影响,并最终确定了半制备型高效液相色谱法分离制备刺葡萄花色苷的条件为甲醇-3%甲酸溶液流动相梯度洗脱、流速15 mL/min、进样量1.2 mL,实现了2 种主要花色苷单体的分离及制备,经UPLCQTOF MS E鉴定为锦葵素-3,5-O-双葡萄糖苷和锦葵素-3,5-双葡萄糖苷-香豆酰,且纯度均达到了对照品的要求,可满足刺葡萄花色苷标准品的大规模制备。
参考文献:
[1] ADISAKWATTANA S, YIBCHOK-ANUN S, CHAROENLERTKUL P, et al. Cyanidin-3-rutinoside alleviates postprandial hyperglycemia and its synergism with acarbose by inhibition of intestinal alphaglucosidase[J]. Journal of Clinical Biochemistry and Nutrition, 2011,49: 36-41.
[2] JARIYAPAMORNKOON N, YIBCHOK-ANUN S,ADISAKWATTANA S. Inhibition of advanced glycation end products by red grape skin extract and its antioxidant activity[J]. Bmc Complementary and Alternative Medicine, 2013, 13(10): 947-950. DOI:10.1186/1472-6882-13-171.
[3] LI M, HAIQING G, BAOYING L, et al. Grape seed proanthocyanidin extracts inhibit vascular cell adhesion molecule expression induced by advanced glycation end products through activation of peroxisome proliferators-activated receptor gamma[J]. Journal of Cardiovascular Pharmacology, 2007, 49(5): 293-298.
[4] 雷用东, 陈姗姗, 赵晓燕, 等. 紫甘薯花色苷制备及其抗猪传染性胃肠炎病毒(TGEV)活性的研究[J]. 食品工业科技, 2012, 33(21): 349-352.
[5] 殷丽琴, 韦献雅, 钟成, 等. 不同品种彩色马铃薯总花色苷含量与总抗氧化活性[J]. 食品科学, 2014, 35(5): 96-100. DOI:10.7506/ spkx1002-6630-201405019.
[6] 孙建霞, 张燕, 胡小松, 等. 花色苷的结构稳定性与降解机制研究进展[J]. 中国农业科学, 2009, 42(3): 996-1008. DOI:10.3864/ j.issn.0578-1752.2009.03.031.
[7] VERBEYST L, CROMBRUGGEN K V, PLANCKEN I V D, et al. Anthocyanin degradation kinetics during thermal and high pressure treatments of raspberries[J]. Journal of Food Engineering, 2011,105(3): 513-521. DOI:10.1016/ j.jfoodeng.2011.03.015.
[8] 李颖畅, 孟宪军, 周艳, 等. 金属离子和食品添加剂对蓝莓花色苷稳定性的影响[J]. 食品科学, 2009, 30(9): 80-84. DOI:10.3321/ j.issn:1002-6630.2009.09.019.
[9] 邓洁红. 刺葡萄皮色素的研究[D]. 长沙: 湖南农业大学, 2007.
[10] WANG E, YIN Y, XU C, et al. Isolation of high-purity anthocyanin mixtures and monomers from blueberries using combined chromatographic techniques[J]. Journal of Chromatography A, 2014,1327: 39-48.
[11] ZHANG Y, LIAO X, CHEN F, et al. Isolation, identification, and color characterization of cyanidin-3-glucoside and cyanidin-3-sophoroside from red raspberry[J]. European Food Research and Technology, 2008, 226(3): 395-403.
[12] GRIGORAS C G, DESTANDAU E, ZUBRZYCKI S, et al. Sweet cherries anthocyanins: an environmental friendly extraction and purification method[J]. Separation and Purification Technology, 2012,100(44): 51-58.
[13] BOCHI V C, GODOY H T, GIUSTI M M. Anthocyanin and other phenolic compounds in Ceylon gooseberry (Dovyalis hebecarpa)fruits[J]. Food Chemistry, 2015, 176: 234-243. DOI:10.1016/ j.foodchem.2014.12.041.
[14] 赵清洁, 龙奇志, 钟海雁, 等. 半制备液相色谱法分离制备油茶果皮多酚的优化条件[J]. 经济林研究, 2012(2): 73-77.
[15] 梁晓芳, 王步军. 应用制备高效液相色谱同时制备6 种大豆异黄酮单体的方法研究[J]. 分析测试学报, 2014, 33(1): 63-67. DOI:10.3969/j.issn.1004-4957.2014.01.011.
[16] 刘雪辉, 王振, 吴琪, 等. 高速逆流色谱法分离玫瑰茄中的花色苷[J].现代食品科技, 2014, 30(1): 190-194; 169.
[17] 邸多隆, 郑媛媛, 陈小芬, 等. 高速逆流色谱技术分离纯化天然产物中黄酮类化合物的研究进展[J]. 分析化学, 2011(2): 269-275.
[18] 王尉, 林楠, 乐胜锋, 等. 高速逆流色谱法分离绿茶中的化学成分[J]. 食品科学, 2014, 35(8): 137-141. DOI:10.7506/spkx1002-6630-201408027.
[19] 杨玲, 苏亚丽, 陈敏. 新疆药桑椹中花色苷的分离与鉴定[J]. 食品科学, 2012, 33(21): 145-148.
[20] 宁德生, 梁小燕, 方宏, 等. 半制备高压液相色谱法制备罗汉果苷Ⅴ标准品[J]. 食品科学, 2010, 31(12): 137-140.
[21] GIUSTI M M, WROLSTAD R E. Characterization and measurement of anthocyanins by UV-visible spectroscopy[M]//Current protocols in food analytical chemistry. NewYork: Wiley, 2001. DOI:10.1002/0471142913.faf0102s00.
[22] OKAMURA N, ASAI M, HINE N, et al. High-performance liquid chromatographic determination of phenolic compounds in aloe species[J]. Journal of Chromatography A, 1996, 746(2): 225-231. DOI:10.1016/0021-9673(96)00342-1.
[23] SU T, NAKAMURA K, TONG C, et al. High-performance liquid chromatographic determination of phenolic compounds in rice[J]. Journal of Chromatography A, 2005, 1063(1/2): 121-128.
[24] LEVISON P R, JONES R M H, TOOME D W, et al. Influence of flowrate on the chromatographic performance of agarose- and cellulose-based anion-exchange media[J]. Journal of Chromatography A, 1996, 734(1): 137-143.
[25] 邓洁红, 谭兴和, 王锋, 等. 刺葡萄皮色素的分离及检定[J]. 中国食品学报, 2010, 10(1): 200-206.
Preparation of Monomeric Anthocyanins from Vitis davidii Foex by Semi-Preparative HPLC
WANG Weiqian
1, DENG Jiehong
1,*, LIU Yonghong
2
(1. College of Food Science and Technology, Hunan Agricultural University, Changsha 410128, China;2. Hunan Biological and Electromechanical Polytechnic, Changsha 410127, China)
Abstract:A semi-preparative high performance liquid chromatographic (HPLC) method using an XCharge C 18preparative column (20 mm × 250 mm, 10 μm) was established for the preparation of anthocyanins monomers with high purity from crude extracts of Vitis davidii Foex after purification with macroporous resin HP-20. The effects of experimental conditions including mobile phase gradient elution conditions, flow rate and injection volume were investigated on the separation efficiency of anthocyanins. The optimal chromatographic conditions were determined as follows: mobile phase, a mixture of methanol and 3% formic acid water for gradient elution; flow rate, 15 mL/min; and injection volume, 1.2 mL, which allowed the isolation and preparation of two major anthocyanins monomers in 18 min. The two anthocyanins were identified by MS Emethod using ultra-performance liquid chromatography quadrupole time of flight mass spectrometry (UPLC-QTOF MS E)as malvidin-3,5-O- diglucoside and malvidin-3,5-O-diglucoside-coumary with purities of 99.54% and 98.28%, respectively. The developed procedure was simple, effective, scalable and economic. It could be a promising alternative procedure for large-scale preparation of standard materials of anthocyanins from Vitis davidii Foex.
Key words:Vitis davidii Foex; malvidin; semi-preparative HPLC; UPLC-QTOF MS E
DOI:10.7506/spkx1002-6630-201618012
中图分类号:TS261.4
文献标志码:A
文章编号:1002-6630(2016)18-0071-06
引文格式:
王维茜, 邓洁红, 刘永红.半制备型高效液相色谱法分离刺葡萄花色苷单体[J]. 食品科学, 2016, 37(18): 71-76. DOI:10.7506/spkx1002-6630-201618012. http://www.spkx.net.cn
WANG Weiqian, DENG Jiehong, LIU Yonghong. Preparation of monomeric anthocyanins from Vitis davidii Foex by semipreparative HPLC[J]. Food Science, 2016, 37(18): 71-76. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201618012. http://www.spkx.net.cn
收稿日期:2015-10-30
基金项目:国家自然科学基金面上项目(31271836);湖南省教育厅研究生科研创新课题(CX2015B264)
作者简介:王维茜(1990—),女,硕士研究生,研究方向为农产品加工及贮藏工程。E-mail:1731686696@qq.com
*通信作者:邓洁红(1967—),女,教授,博士,研究方向为园艺产品深加工理论与技术。E-mail:hongjiedeng@163.com