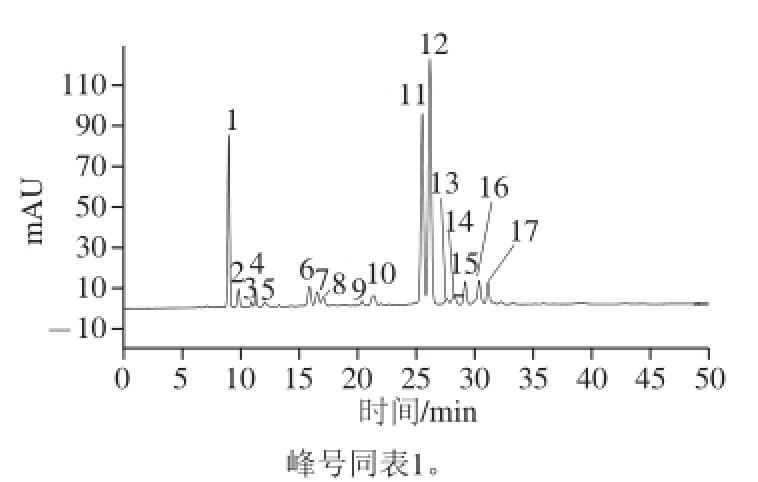
图1 紫甘蓝花青苷的HPLC图
Fig.1 HPLC chromatogram for the anthocyanins of red cabbage
宋 亚 1,李凯利 2,方佳宁 1,朱祝军 1,杨 静 1,吴峰华 1,刘兴泉 1,*
(1.浙江农林大学农业与食品科学学院,浙江省农产品品质改良重点实验室,浙江 临安 311300;2.浙江农林大学林业与生物技术学院,浙江 临安 311300)
摘 要:采用高效液相色谱和液相色谱-质谱联用技术,对紫甘蓝(Brassica oleracea L. ssp. capitata f. rubra)中花青苷、硫代葡萄糖苷(简称硫苷)成分和含量进行鉴定和分析,并对低温(8±1)℃条件下经鲜切处理的紫甘蓝中花青苷和硫苷在货架期内(7 d)的变化情况进行研究。结果表明:紫甘蓝中存在11 种不同矢车菊花青苷,矢车菊-3-阿魏酰-槐糖苷-5-葡萄糖苷作为紫甘蓝中最主要的花青苷,在贮藏过程中的损失量占总花青苷损失量的55.51%,其占总量比例也在贮藏7 d后由35.12%下降至30.60%;紫甘蓝中存在10 种硫苷(由6 种脂肪族硫苷、3 种吲哚族硫苷和1 种芳香族硫苷组成),以4-戊烯基硫苷和3-丁烯基硫苷为主,贮藏7 d后,二者损失率均为7%左右,损失量相加却达总花青苷损失量的50.07%,而所占比例相加也由71.68%上升到74.33%。
关键词:鲜切紫甘蓝;功能性成分;花青苷;硫苷
花青苷由花青素在自然状态下与多种单糖结合构成,是蔬菜主要水溶性色素物质,属于生物类黄酮物质,具有抗氧化、抗肿瘤、抗突变、预防心脑血管疾病等生理功能 [1-3]。而硫代葡萄糖苷(简称硫苷)是一些植物特有的次生代谢产物,对哺乳动物的前列腺癌、膀胱癌、直肠癌等疾病有一定防御作用 [4]。食用富含花青苷的果蔬、提取物以及纯花青苷能帮助生物体预防或者抑制疾病的发生 [4-5],因此,兼具花青苷和硫苷的芸薹属蔬菜越来越受到广大消费者的青睐。随着现代生活节奏的加快和人们生活水平的提高,蔬菜的消费量不断增加,鲜切蔬菜以新鲜、方便、营养、无公害等特点,备受欧美、日本等国家消费者的喜爱,在我国也开始受到关注,近年来的消费量持续增加。作为芸薹属蔬菜的最重要的日常蔬菜之一,鲜切紫甘蓝的全球消费量正在急剧增加 [6]。
然而,切割所造成的机械损伤会引发一系列不利于贮藏的生理生化变化,鲜切蔬菜的存储和品质保持成为一大难题 [7],引起研究者们的广泛关注。研究表明,低温贮藏是保持鲜切蔬菜品质的最简单、有效的措施。遗传因素、采前及采后的物理损伤、贮藏条件 [8]、包装材料 [9]以及热处理、紫外线辐照处理 [10]、多种化学保鲜剂处理 [11]等非生物因素对鲜切果蔬贮藏品质的影响是前人研究的重点;气调贮藏 [12]、切割方式和清洗方式 [13]等对鲜切蔬菜品质的干预机制也逐渐清晰,但鲜切蔬菜在货架期中功能性物质及其各成分的消解和变化情况国内外鲜有报道。本实验以鲜切紫甘蓝为原料,研究其在货架期(7 d)中花青苷和硫苷含量和组分的变化情况,为鲜切紫甘蓝营养价值和功能价值的开发和利用提供理论参考。
1.1 材料与试剂
大小鲜嫩一致、无虫害、无损伤的紫甘蓝 临安市浙皖农贸城;2-丙烯基硫苷、矢车菊-3,5-双葡萄糖苷标样(均为色谱纯) 美国Sigma公司。
1.2 仪器与设备
LC-20AT高效液相色谱(high performance liquid chromatography,HPLC)仪 日本岛津公司;6460 Triple Quad HPLC-质谱(HPLC-mass spectrometry,HPLC-MS)联用仪(配有电喷雾离子源和Agilent Chemstation Qualitative Analysis B.07.00数据处理系统)美国安捷伦科技有限公司。
1.3 方法
1.3.1 样品前处理
将叶片分离,无菌水冲洗表面砂石尘土,将叶片切分成长约10 cm,宽约1.0 cm,然后充分混合,沙拉甩干机脱水1 min甩干表面水珠,通风处沥干;精确称量200 g置于一次性果蔬托盘,用保鲜膜覆盖密封,(8±1) ℃条件下恒温贮藏,分别于贮藏的第0、1、3、5、7天检测紫甘蓝中花青苷和硫苷含量变化。
1.3.2 花青苷的提取和测定
提取方法参考Park等 [14]的方法,并稍作修改。称取0.200 g样品,加入10 mL体积分数5%甲酸溶液研磨至匀浆,旋涡振荡5 min,超声提取1 h,8 000 r/min离心15 min,取上清液过0.22 μm滤膜后进行HPLC/HPLC-MS联用分析。
HPLC条件:InertSustain C 18色谱柱(4.6 mm× 250 mm,5 μm);流动相:A相为体积分数5%甲酸溶液,B相为体积分数5%甲酸-乙腈溶液;进样量10 μL;流速1.0 mL/min;柱温40 ℃;线性洗脱梯度:0 min,5% B;8~13 min,13% B;13~20 min,17% B;20~23 min,17% B;23~30 min,20% B;30~40 min,20% B;40~40.1 min,5% B;40.1~50 min,5% B;二极管阵列检测器,检测波长520 nm。
样品定量采用外标法。由于紫甘蓝中花青苷主要为矢车菊素苷及其衍生物且结构多有不同,难以获得所有成分的标准品,本实验以矢车菊-3,5-双葡萄糖苷为标准品。称取1 mg标准品溶于10 mL体积分数5%甲酸溶液,再依次稀释为2.5、5、10、25、50、100 μg/mL和125 μg/mL,HPLC测定并绘制标准曲线,回归方程为:y=15 188.01x-16 778.39(R 2=0.999),样品花青苷以单位原料干质量中花青苷质量表示(mg/g)。
1.3.3 硫苷的提取和测定
硫苷提取方法参照Schonhof等 [15]并加以改进。称取0.250 g粉碎样品于75 ℃水浴中预热1 min,用4 mL体积分数70%甲醇溶液于75 ℃水浴条件下提取10 min。冷却后加入1 mL乙酸钡,用旋涡仪充分混合,4 000 r/min离心10 min。保存上清液,沉淀再用3 mL体积分数70%甲醇溶液提取2 次。将3 次提取的上清液定容至10 mL。同时做1 个平行,在另1 份样品中加入200 μL 5 mmol/L 2-丙烯基硫苷溶液作为内标,其他操作相同。
取5 mL提取液在负压条件下用DEAE Sephadex TMA25固相萃取。当提取液完全流经萃取柱后,在固相柱中加入250 μL硫酸酯酶,待酶流经小柱30 ℃恒温反应12 h,用5 mL超纯水洗脱过柱。再经0.22 μm滤膜过滤,得到洗脱液进行HPLC-MS分析。
HPLC条件:C 18ODS2色谱柱(250 mm×4 mm,5 μm)。流动相A为超纯水,B为乙腈,进样量为20 μL,梯度洗脱。检测波长229 nm,柱温控制在35 ℃。数据由Aglient 1200化学工作站自动采集完成。梯度洗脱程序:0~2 min,0% B;2~34 min,20% B;34~40 min,20% B;40~45 min,100% B;45~52 min,100% B;52~54 min,0% B;54~64 min,0% B。
硫苷的结构鉴定依据其紫外光谱、MS信息以及现有的标样对照进行,硫苷的含量根据以2-丙烯基硫苷为当量的相关系数进行计算。
1.3.4 MS条件
色谱柱分离后样品经三通阀分流后进入MS分析。MS条件:电喷雾离子源;正负双离子扫描模式;质量扫描范围m/z 100 ~1 000;干燥气温度325 ℃;氮气流速11 L/min;毛细管电压3 500 V;雾化器压力45 kPa;目标离子m/z 1 000。采用综合色谱相对保留时间、质谱分子离子峰和碎片离子峰等确定其分子结构。
2.1 贮藏期鲜切紫甘蓝含量测定
2.1.1 花青苷的种类鉴定和含量分析

图1 紫甘蓝花青苷的HPLC图
Fig.1 HPLC chromatogram for the anthocyanins of red cabbage
表1 紫甘蓝中花青苷组成
Table1 Composition of anthocyanins in red cabbage
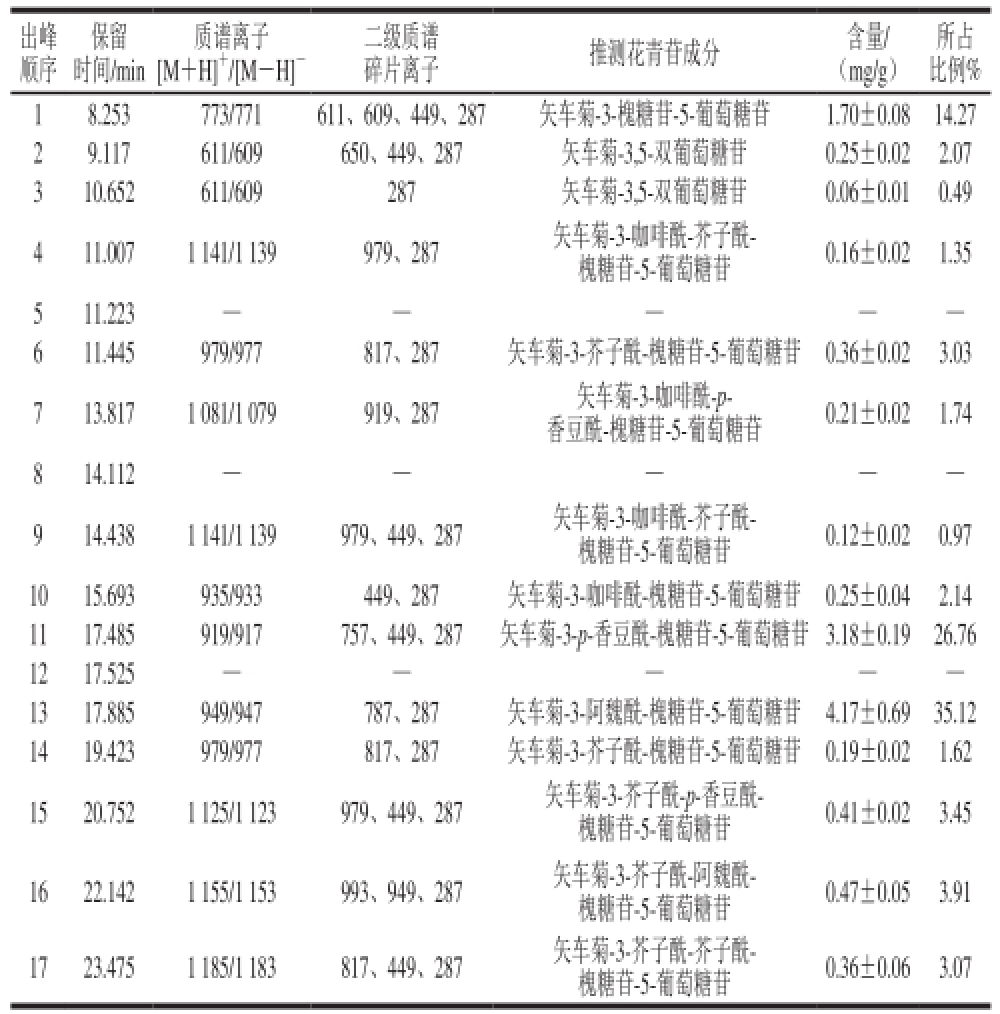
注:—.无响应峰。
出峰顺序所占比例% 18.253773/771611、609、449、287矢车菊-3-槐糖苷-5-葡萄糖苷1.70±0.0814.27 29.117611/609650、449、287矢车菊-3,5-双葡萄糖苷0.25±0.022.07 310.652611/609287矢车菊-3,5-双葡萄糖苷0.06±0.010.49 411.0071 141/1 139979、287矢车菊-3-咖啡酰-芥子酰-槐糖苷-5-葡萄糖苷0.16±0.021.35 511.223——611.445979/977817、287矢车菊-3-芥子酰-槐糖苷-5-葡萄糖苷0.36±0.023.03 713.8171 081/1 079919、287矢车菊-3-咖啡酰-p-香豆酰-槐糖苷-5-葡萄糖苷0.21±0.021.74 814.112——914.4381 141/1 139979、449、287矢车菊-3-咖啡酰-芥子酰-槐糖苷-5-葡萄糖苷0.12±0.020.97 1015.693935/933449、287矢车菊-3-咖啡酰-槐糖苷-5-葡萄糖苷0.25±0.042.14 1117.485919/917757、449、287矢车菊-3-p-香豆酰-槐糖苷-5-葡萄糖苷3.18±0.1926.76 1217.525——1317.885949/947787、287矢车菊-3-阿魏酰-槐糖苷-5-葡萄糖苷4.17±0.6935.12 1419.423979/977817、287矢车菊-3-芥子酰-槐糖苷-5-葡萄糖苷0.19±0.021.62 1520.7521 125/1 123979、449、287矢车菊-3-芥子酰-p-香豆酰-槐糖苷-5-葡萄糖苷0.41±0.023.45 1622.1421 155/1 153993、949、287矢车菊-3-芥子酰-阿魏酰-槐糖苷-5-葡萄糖苷0.47±0.053.91 1723.4751 185/1 183817、449、287矢车菊-3-芥子酰-芥子酰-槐糖苷-5-葡萄糖苷0.36±0.063.07保留时间/min [M+H] +/[M-H] -二级质谱质谱离子碎片离子推测花青苷成分含量/(mg/g)
紫甘蓝花青苷提取液经HPLC分离出17 个主要峰如图1所示,再结合保留时间、液相图谱、分子碎片和文献对各个色谱峰进行结构推断,获得了紫甘蓝中花青苷的种类推断,最后外标法进行含量分析,结果如表1所示。各质谱响应峰均可发现由矢车菊素的母核形成的离子碎片峰,其特征质荷比m/z 287,进而可推断紫甘蓝中花青苷均为矢车菊素结合不同结构糖分子形成。紫甘蓝中总花青苷含量为11.88 mg/g,共有15 个离子响应峰,峰5、峰8、峰13因在离子质谱中没有出现响应峰排除在外,峰2和峰3,峰4和峰9以及峰6和峰14为3 组相同种类花青苷,因此紫甘蓝中存在11 种不同矢车菊花青苷。矢车菊-3-阿魏酰-槐糖苷-5-葡萄糖苷和矢车菊-3-p-香豆酰-槐糖苷-5-葡萄糖苷为最主要的种类,分别占花青苷总含量的35.12%和26.76%;其次为矢车菊-3-槐糖苷-5-葡萄糖苷,占花青苷总含量的14.27%。
2.1.2 贮藏期花青苷含量变化
鲜切蔬菜中花青苷在贮藏过程中的变化情况因蔬菜品种不一而有所不同,Perez-Gregorio等 [16]在研究不同包装方式对鲜切洋葱中黄酮类物质的影响时曾报道在1~2 ℃条件下,所有处理的鲜切洋葱在贮藏16 d后总花青苷减少了16%~24%;而Oner等 [17]却发现(4±1) ℃条件下,鲜切红肉甜土豆中的总花青苷含量在0~7 d有轻微增长,8~14 d呈减少趋势;Berno等 [18]报道鲜切紫洋葱在5 ℃条件下贮藏15 d后总花青苷没有显著变化。本实验研究表明,鲜切紫甘蓝中总花青苷呈现先平缓下降后显著上升、下降再上升的频繁波动趋势(表2)。贮藏7 d后,总花青苷出现了显著下降(P<0.05),损失率达到18.12%,第3天达到最大值12.50 mg/g,第5天为最小值7.96 mg/g,第7天再出现显著上升(P<0.05),这可能与矢车菊花青苷自身的变化规律有关。因此,人们通过研究包装方式 [16]、辐射剂量 [17]、贮藏温度 [18]、切割方式和清洗方式 [13]等非生物因素干扰鲜切蔬菜中花青苷的变化轨迹,达到更好地维持鲜切蔬菜中花青苷等有益物质的生理功能。
鲜切紫甘蓝中各花青苷成分除矢车菊-3-芥子酰-p-香豆酰-槐糖苷-5-葡萄糖苷(峰15)外在贮藏过程中出现不同程度的消解与损失,矢车菊-3-咖啡酰-槐糖苷-5-葡萄糖苷(峰10)、矢车菊-3-阿魏酰-槐糖苷-5-葡萄糖苷(峰12)、矢车菊-3-芥子酰-槐糖苷-5-葡萄糖苷(峰14)和矢车菊-3-芥子酰-芥子酰-槐糖苷-5-葡萄糖苷(峰17)损失率分别为28.80%、28.64%、32.96%和20.58%,下降显著(P<0.05)。Wulfkuehler等 [13]研究不同切割和清洗方式对菊苣品质影响,以矢车菊-3-丙二酰-葡萄糖苷的变化反映鲜切菊苣中花青苷的变化。矢车菊-3-阿魏酰-槐糖苷-5-葡萄糖苷(峰12)作为紫甘蓝中最主要的花青苷,损失量占总花青苷损失量的55.51%,在一定程度上反映了鲜切紫甘蓝中花青苷的变化情况。尽管菜体中各花青苷成分所占比例在贮藏过程中的变化情况不一致,但矢车菊-3-阿魏酰-槐糖苷-5-葡萄糖苷占总量比例在贮藏7 d后仅由35.12%下降至30.60%,仍是紫甘蓝中含量最高的花青苷成分,比例变化不显著(P>0.05)。紫甘蓝中花青苷均为矢车菊花青苷,本实验结果在一定程度上探索了部分矢车菊花青苷在低温贮藏过程中的变化情况。
表2 鲜切紫甘蓝中总花青苷及各成分在贮藏期的含量变化
Table2 Change of content of total anthocyanin and components in the storage period in fresh-cut red cabbage
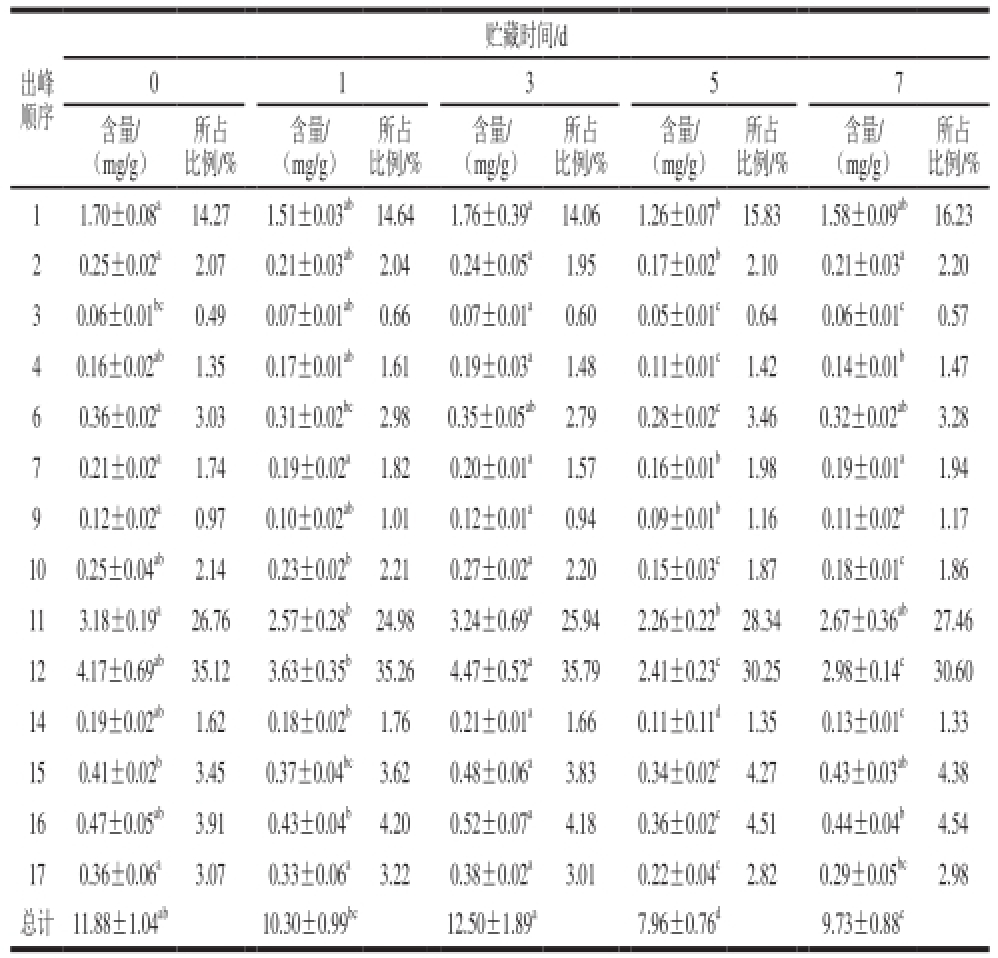
注:同行中同一组分含量数据不同肩标小写字母表示差异显著(P<0.05)。表4同。
出峰顺序贮藏时间/d 0 1 3 5 7所占比例/% 11.70±0.08 a14.271.51±0.03 ab14.641.76±0.39 a14.061.26±0.07 b15.831.58±0.09 ab16.23 20.25±0.02 a2.070.21±0.03 ab2.040.24±0.05 a1.950.17±0.02 b2.100.21±0.03 a2.20 30.06±0.01 bc0.490.07±0.01 ab0.660.07±0.01 a0.600.05±0.01 c0.640.06±0.01 c0.57 40.16±0.02 ab1.350.17±0.01 ab1.610.19±0.03 a1.480.11±0.01 c1.420.14±0.01 b1.47 60.36±0.02 a3.030.31±0.02 bc2.980.35±0.05 ab2.790.28±0.02 c3.460.32±0.02 ab3.28 70.21±0.02 a1.740.19±0.02 a1.820.20±0.01 a1.570.16±0.01 b1.980.19±0.01 a1.94 90.12±0.02 a0.970.10±0.02 ab1.010.12±0.01 a0.940.09±0.01 b1.160.11±0.02 a1.17 100.25±0.04 ab2.140.23±0.02 b2.210.27±0.02 a2.200.15±0.03 c1.870.18±0.01 c1.86 113.18±0.19 a26.762.57±0.28 b24.983.24±0.69 a25.942.26±0.22 b28.342.67±0.36 ab27.46 124.17±0.69 ab35.123.63±0.35 b35.264.47±0.52 a35.792.41±0.23 c30.252.98±0.14 c30.60 140.19±0.02 ab1.620.18±0.02 b1.760.21±0.01 a1.660.11±0.11 d1.350.13±0.01 c1.33 150.41±0.02 b3.450.37±0.04 bc3.620.48±0.06 a3.830.34±0.02 c4.270.43±0.03 ab4.38 160.47±0.05 ab3.910.43±0.04 b4.200.52±0.07 a4.180.36±0.02 c4.510.44±0.04 b4.54 170.36±0.06 a3.070.33±0.06 a3.220.38±0.02 a3.010.22±0.04 c2.820.29±0.05 bc2.98总计11.88±1.04 ab10.30±0.99 bc12.50±1.89 a7.96±0.76 d9.73±0.88 c含量/(mg/g)所占比例/%含量/(mg/g)所占比例/%含量/(mg/g)所占比例/%含量/(mg/g)所占比例/%含量/(mg/g)
2.2 贮藏期硫苷含量测定
2.2.1 硫苷的种类鉴定和含量分析
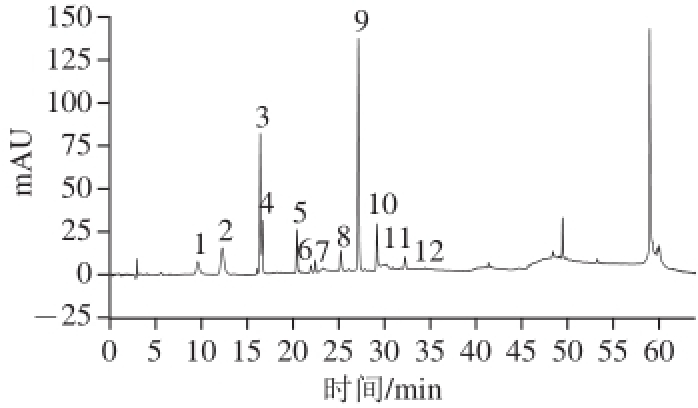
图2 紫甘蓝中硫苷HPLC图
Fig.2 HPLC chromatogram for the glucosinolates of red cabbage
如图2所示,共分离出12 个主要色谱峰,为进一步对其进行鉴定,本实验采用正、负离子双模式获得电喷雾电离质谱图以获得每个目标分子的双重质谱信息。
硫酸酯酶的加入能使硫苷分子发生水解去掉硫酸根,正离子极性条件下脱硫硫苷易与H +结合形成质子化合物[M+H] +,与Na +、K +结合形成钠化分子[M+Na] +和钾化分子[M+K] +。当保留时间为7.773 min时,正离子丰度最大的2 个离子m/z为332.1和348,可能为[M+ Na] +和[M+K] +。而在负离子电喷雾碰撞激活条件下,脱硫硫苷丢失一个葡萄糖分子(G)形成碎片离子[MG-H] -,结合一个氯离子形成碎片离子[M+Cl] -,负离子条件下丰度最大的2 个碎片离子m/z 146、344,与[M-G-H] -、[M+Cl] -正好吻合。碎片离子[M-H] -的出现(m/z 308.1)进一步验证了此化合物的相对分子质量为309,参考Pasini等 [19]的结果,可推知此化合物(峰1)为2-羟基-3-丁烯基硫苷。
表3 紫甘蓝中硫苷组成
Table3 Composition of glucosinolates in red cabbage
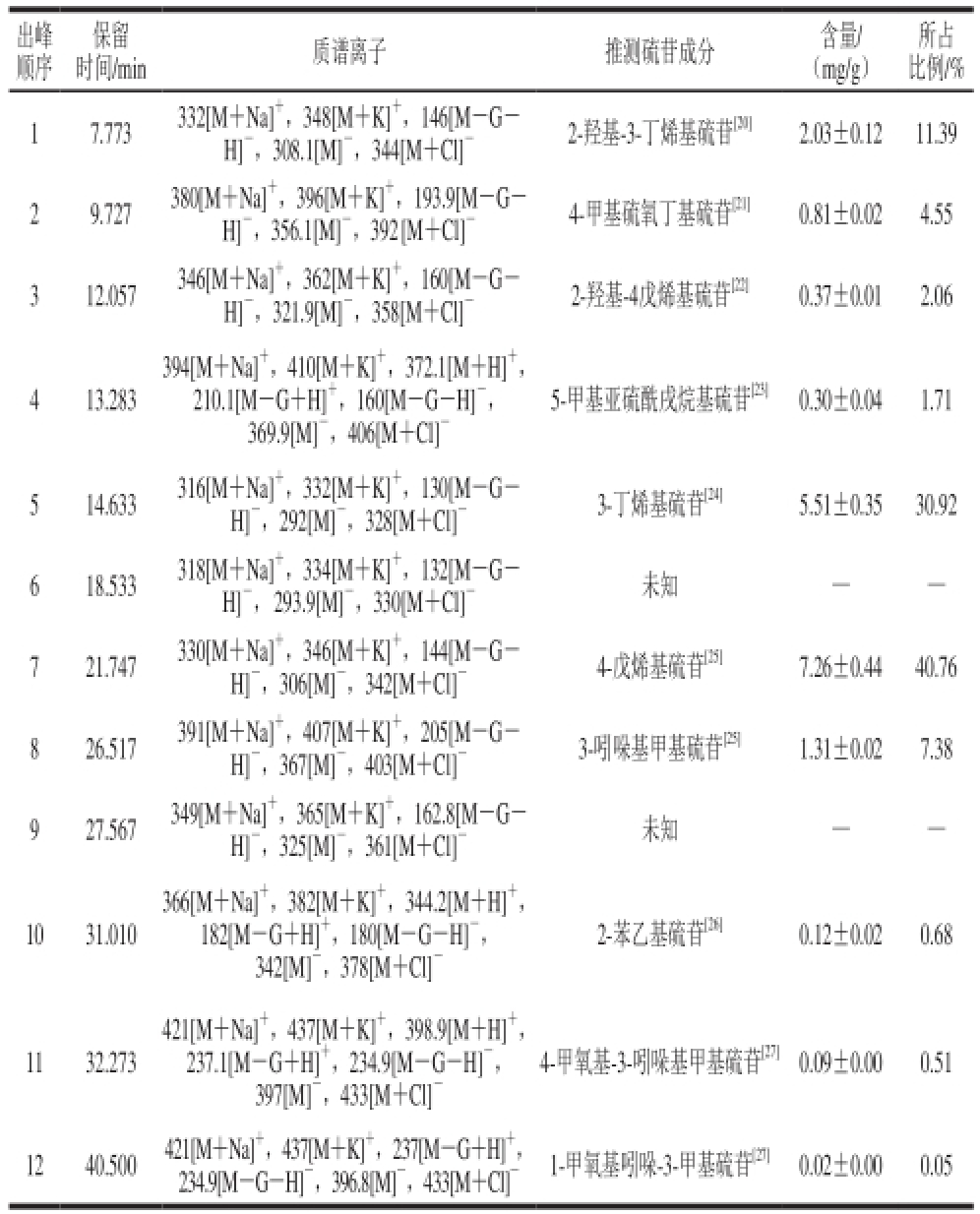
出峰顺序所占比例/% 17.773332[M+Na] +,348[M+K] +,146[M-GH] -,308.1[M] -,344[M+Cl] -2-羟基-3-丁烯基硫苷 [20]2.03±0.1211.39时间/min质谱离子推测硫苷成分含量/(mg/g)保留29.727380[M+Na] +,396[M+K] +,193.9[M-GH] -,356.1[M] -,392 [M+Cl] -4-甲基硫氧丁基硫苷 [21]0.81±0.024.55 312.057346[M+Na] +,362[M+K] +,160[M-GH] -,321.9[M] -,358[M+Cl] -2-羟基-4戊烯基硫苷 [22]0.37±0.012.06 413.283 394[M+Na] +,410[M+K] +,372.1[M+H] +,210.1[M-G+H] +,160[M-G-H] -,369.9[M] -,406[M+Cl] -5-甲基亚硫酰戌烷基硫苷 [23]0.30±0.041.71 514.633316[M+Na] +,332[M+K] +,130[M-GH] -,292[M] -,328[M+Cl] -3-丁烯基硫苷 [24]5.51±0.3530.92 618.533318[M+Na] +,334[M+K] +,132[M-GH] -, 293.9[M] -,330[M+Cl] -未知——721.747330[M+Na] +,346[M+K] +,144[M-GH] -,306[M] -,342[M+Cl] -4-戊烯基硫苷 [25]7.26±0.4440.76 826.517391[M+Na] +,407[M+K] +,205[M-GH] -,367[M] -,403[M+Cl] -3-吲哚基甲基硫苷 [25]1.31±0.027.38 927.567349[M+Na] +,365[M+K] +,162.8[M-GH] -,325[M] -,361[M+Cl] -未知——1031.010 366[M+Na] +,382[M+K] +,344.2[M+H] +,182[M-G+H] +,180[M-G-H] -,342[M] -,378[M+Cl] -2-苯乙基硫苷 [26]0.12±0.020.68 1132.273 421[M+Na] +,437[M+K] +,398.9[M+H] +,237.1[M-G+H] +,234.9[M-G-H] -,397[M] -,433[M+Cl] -4-甲氧基-3-吲哚基甲基硫苷 [27]0.09±0.000.51 1240.500421[M+Na] +,437[M+K] +,237[M-G+H] +,234.9[M-G-H] -,396.8[M] -,433[M+Cl] -1-甲氧基吲哚-3-甲基硫苷 [27]0.02±0.000.05
采用上述方法,结合保留时间、HPLC图谱、分子碎片和文献[20-26]对各个色谱峰进行结构推断,如表3所示。紫甘蓝中总硫苷含量达到17.82 mg/g,共10 种,分别由6 种脂肪族硫苷(16.28 mg/g)、3 种吲哚族硫苷(1.42 mg/g)和1 种芳香族硫苷(0.12 mg/g)组成,其中以4-戊烯基硫苷和3-丁烯基硫苷为主,分别占硫苷总含量的40.76%和30.92%,2-羟基-3-丁烯基硫苷和3-吲哚基甲基硫苷次之,分别占硫苷总含量的11.39%和7.38%。
2.2.2 贮藏期硫苷含量变化
表4 鲜切紫甘蓝中总硫苷及各成分在贮藏期的含量变化
Table4 Change of content of total glucosinolate and components in the storage period in fresh-cut red cabbage
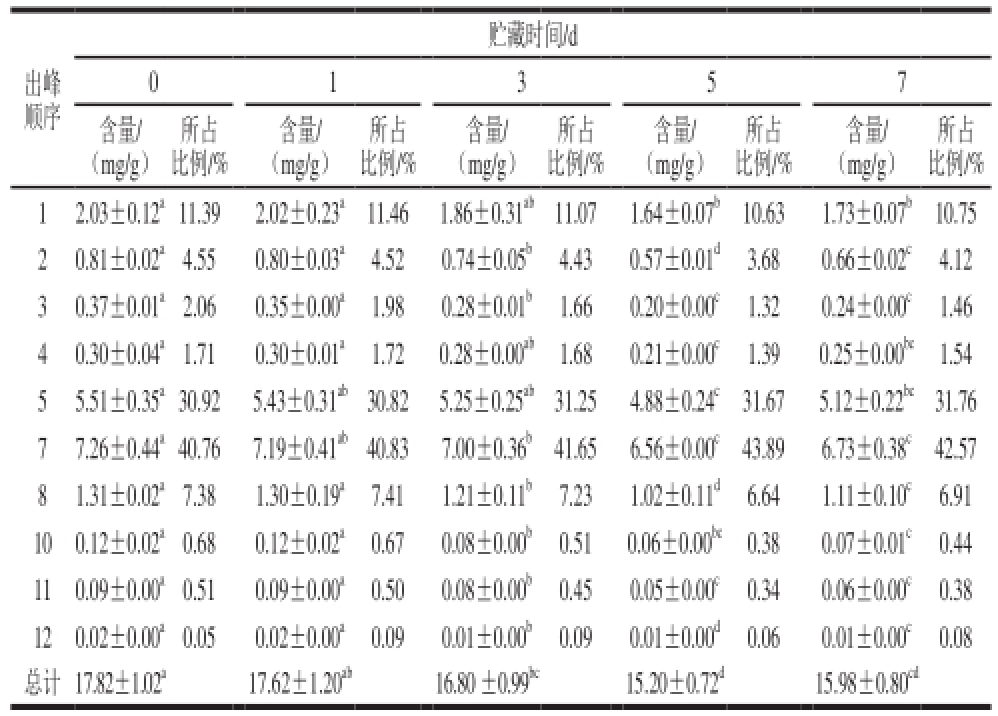
出峰顺序贮藏时间/d 0 1 3 5 7所占比例/% 12.03±0.12 a11.392.02±0.23 a11.461.86±0.31 ab11.071.64±0.07 b10.631.73±0.07 b10.75 20.81±0.02 a4.550.80±0.03 a4.520.74±0.05 b4.430.57±0.01 d3.680.66±0.02 c4.12 30.37±0.01 a2.060.35±0.00 a1.980.28±0.01 b1.660.20±0.00 c1.320.24±0.00 c1.46 40.30±0.04 a1.710.30±0.01 a1.720.28±0.00 ab1.680.21±0.00 c1.390.25±0.00 bc1.54 55.51±0.35 a30.925.43±0.31 ab30.825.25±0.25 ab31.254.88±0.24 c31.675.12±0.22 bc31.76 77.26±0.44 a40.767.19±0.41 ab40.837.00±0.36 b41.656.56±0.00 c43.896.73±0.38 c42.57 81.31±0.02 a7.381.30±0.19 a7.411.21±0.11 b7.231.02±0.11 d6.641.11±0.10 c6.91 100.12±0.02 a0.680.12±0.02 a0.670.08±0.00 b0.510.06±0.00 bc0.380.07±0.01 c0.44 110.09±0.00 a0.510.09±0.00 a0.500.08±0.00 b0.450.05±0.00 c0.340.06±0.00 c0.38 120.02±0.00 a0.050.02±0.00 a0.090.01±0.00 b0.090.01±0.00 d0.060.01±0.00 c0.08总计17.82±1.02 a17.62±1.20 ab16.80 ±0.99 bc15.20±0.72 d15.98±0.80 cd含量/(mg/g)所占比例/%含量/(mg/g)所占比例/%含量/(mg/g)所占比例/%含量/(mg/g)所占比例/%含量/(mg/g)
基因、生长环境 [27]以及生长过程 [28-29]中自身的机体代谢都能引起硫苷含量的变化。硫苷作为一类稳定的次生代谢产物,当植物体受到机械损伤时,会使硫苷物质和芥子酶相遇并发生水解生成不稳定的物质。硫苷物质的含量变化还会受到贮藏温度和相对湿度等贮藏环境 [30]以及加工方式 [31-32]的影响。如表4所示,紫甘蓝经鲜切处理货架温度条件下贮藏7 d后,总硫苷含量下降显著(P<0.05),损失率达到10.32%。硫苷含量总体呈现先下降后缓慢回升的趋势,在贮藏第5天下降到最小值15.20 mg/g,第7天时出现略微上升(P>0.05),这和芸薹属蔬菜中另一重要成员——西兰花 [33]的研究结果一致。
在贮藏过程中2-苯乙基硫苷(峰10)、1-甲氧基吲哚-3-甲基硫苷(峰12)、2-羟基-4戊烯基硫苷(峰3)和4-甲氧基-3-吲哚基甲基硫苷(峰11)损失率分别为41.67%、37.37%、35.94%和32.33%,下降显著(P<0.05)。4-戊烯基硫苷和3-丁烯基硫苷(峰5、峰7)2 种硫苷所占比例随着贮藏时间延长呈上升趋势,其他硫苷所占比例随着贮藏时间延长不断下降,第5天下降至最低。
紫甘蓝中硫苷以脂肪族硫苷为主,吲哚族次之,芳香族微量。贮藏7 d后,菜体中脂肪族、吲哚族和芳香族硫苷分别损失9.52%、16.90%和41.67%,损失量占总花青苷损失量的84.24%、13.04%和2.72%。4-戊烯基硫苷、3-丁烯基硫苷(峰5、峰7)作为紫甘蓝中最主要的2 种硫苷,二者均为脂肪族硫苷,损失率7%左右,而损失量却达总花青苷损失量的50.07%。鲜切紫甘蓝中硫苷物质在贮藏过程中的变化主要是由脂肪族硫苷的消解和损失引起的,尤其是由4-戊烯基硫苷、3-丁烯基硫苷的消解和损失引起的。结果显示,脂肪族硫苷含量下降显著,贮藏7 d后呈增长趋势(从91.34%上升至92.20%),吲哚族硫苷和芳香族硫苷呈下降趋势。
利用HPLC/HPLC-MS技术对紫甘蓝中花青苷和硫苷进行鉴定和含量分析。紫甘蓝中含11 种不同矢车菊花青苷(11.88 mg/g)和10 种硫苷(17.82 mg/g),含量丰富。在货架温度(8±1) ℃条件下贮藏7 d后,鲜切处理的紫甘蓝中总花青苷和总硫苷损失显著(P<0.05),损失率分别为18.12%和10.32%。矢车菊-3-阿魏酰-槐糖苷-5-葡萄糖苷和脂肪族硫苷(4-戊烯基硫苷和3-丁烯基硫苷)作为紫甘蓝中最主要的花青苷(35.12%)和硫苷(71.68%)。鲜切紫甘蓝中总花青苷的变化主要是由相对应的主要成分的变化所引起的,可以通过靶向的保护或调控紫甘蓝中花青苷和硫苷的主成分,进而保存鲜切紫甘蓝中主要功能性成分,具体还有待进一步深入研究。
参考文献:
[1] CLIFFORD M. Anthocyanins-nature, occurrence and dietary burden[J]. Journal of the Science of Food and Agriculture, 2000, 80(7): 1063-1072. DOI:10.1002/(SICI)1097-0010(20000515)80:7<1063::AIDJSFA605>3.0.CO;2-Q.
[2] ZAFRA-STONE S, YASMIN T, BAGCHI M, et al. Berry anthocyanins as novel antioxidants in human health and disease prevention[J]. Molecular Nutrition and Food Research, 2007, 51(6): 675-683. DOI:10.1002/mnfr.200700002.
[3] PASCUAL-TERESA S D, SANCHEZ-BALLESTA M T. Anthocyanins: from plant to health[J]. Phytochemistry Reviews, 2008,7(2): 281-299. DOI:10.1007/s11101-007-9074-0.
[4] CARTEA M E, VELASCO P. Glucosinolates in Brassica foods: bioavailability in food and significance for human health[J]. Phytochemistry Reviews, 2008, 7(2): 213-229. DOI:10.1007/s11101-007-9072-2.
[5] MAZZA G, KAY C D, COTTRELL T, et al. Absorption of anthocyanins from blueberries and serum antioxidant status in human subjects[J]. Journal of Agricultural and Food Chemistry, 2002, 50(26): 7731-7737. DOI:10.1021/jf020690l.
[6] LUCIER G, JERAROD A. Vegetables and melon outlook[J]. Economic Research Service, 2003, 145: 291-297.
[7] FALAHA M A F, NADINEB M D, SURYANDONOA A. Effects of storage conditions on quality and shelf-life of freshcut Melon (Cucumis melo L.) and Papaya (Carica papaya L.)procedia[J]. Procedia Food Science, 2015, 3: 313-322. DOI:10.1016/ j.profoo.2015.01.034.
[8] HODGES D M, TOIVONEN P M A. Quality of fresh-cut fruits and vegetables as affected by exposure to abiotic stress[J]. Postharvest Biology and Technology, 2008, 48(2): 155-162. DOI:10.1016/ j.postharvbio.2007.10.016.
[9] LEE H H, HONG S I, KIM D. Microbiological and visual quality of fresh-cut cabbage as affected by packaging treatments[J]. Food Science and Biotechnology, 2011, 20(1): 229-235. DOI:10.1007/ s10068-011-0031-8.
[10] ALEGRIA C, PINHEIRO J, DUTHOIT M, et al, Fresh-cut carrot (cv. Nantes) quality as affected by abiotic stress (heat shock and UV-C irradiation) pre-treatments[J]. LWT-Food Science and Technology,2012, 48(2): 197-203. DOI:10.1016/j.lwt.2012.03.013.
[11] ANTUNES M D C, RODRIGUES D, PANTAZIS V. Nutritional quality changes of fresh-cut tomato during shelf life[J]. Food Science Biotechnol, 2013, 22(5): 1-8. DOI:10.1007/s10068-013-0206-6.
[12] RODONI L, VICENTE A, AZEVEDO S, et al. Quality retention of fresh-cut pepper as affected by atmosphere gas composition and ripening stage[J]. Food Science and Technology, 2015, 60(1): 109-114. DOI:10.1016/j.lwt.2014.08.023.
[13] WULFKUEHLER S, DIETZ J, SCHMIDT H, et al. Quality of fresh-cut radicchiocv. Rossodi Chioggia (Cichoriumintybus L. var. foliosum Hegi) as affected by water jet cutting and different washing procedures[J]. European Food Research and Technology, 2015,240(1): 159-172. DOI:10.1007/s00217-014-2317-6.
[14] PARK S, ARASU M V, JIANG N, et al. Metabolite profiling of phenolics, anthocyanins and flavonols in cabbage (Brassica oleracea var. capitata)[J]. Industrial Crops and Products, 2014, 60(1): 8-14. DOI:10.1016/j.indcrop.2014.05.037.
[15] SCHONHOF I, KRUMBEIN A, BRUCKNER B. Genotypic effects on glucosinolates and sensory properties of broccoli and cauliflower[J]. Food, 2004, 48(1): 25-33. DOI:10.1002/food.200300329.
[16] PEREZ-GREGORIO M R, GAECIA-FALCON M S, SIMALGANDARA J. Flavonoids changes in fresh-cut onions during storage in different packaging systems[J]. Food Chemistry, 2011, 124(2): 652-658. DOI:10.1016/j.foodchem.2010.06.090.
[17] ONER M E, WALL M M. Quality of fresh-cut purple-fleshed sweet potatoes after X-ray irradiation treatment and refrigerated storage[J]. International Journal of Food Science and Technology, 2013, 48: 2064-2070. DOI:10.1111/ijfs.12187.
[18] BEMO N D, TEZOTTO-ULIANA J V, DIAS C T D S, et al. Storage temperature and type of cut affect the biochemical and physiological characteristics of fresh-cut purple onions[J]. Postharvest Biology and Technology, 2014, 93: 91-96. DOI:10.1016/j.postharvbio.2014.02.012.[19] PASINI F, VERARDO V, CABONI M F, et al. Determination of glucosinolates and phenolic compounds in rocket salad by HPLCDAD-MS: evaluation of Eruca sativa Mill. and Diplotaxis tenuifolia L. genetic resources[J]. Food Chemistry, 2012, 133(3): 1025-1033. DOI:10.1016/j.foodchem.2012.01.021.
[20] VOLDEN J, BORGE G I A, BENGTSSON G B, et al. Effect of thermal treatment on glucosinolates and antioxidant-related parameters in red cabbage (Brassica oleracea L. ssp. capitata f. rubra)[J]. Food Chemistry, 2008, 109(3): 595-605. DOI:10.1016/ j.foodchem.2008.01.010.
[21] BARBIERI G, PEMICE R, MAGGIO A, et al. Glucosinolates profile of Brassica rapa L. subsp. Sylvestris L. Janch. var. esculenta Hort[J]. Food Chemistry, 2008, 107(4): 1687-1691. DOI:10.1016/ j.foodchem.2007.09.054.
[22] SCHONHOF I, KRUMBEIN A, BRUCKNER B. Genotypic effects on glucosinolates and sensory properties of broccoli and cauliflower[J]. Food, 2008, 48(1): 25-33. DOI:10.1002/food.200300329.
[23] LEE M K, CHUN J H, DONG H B, et al. Variation of glucosinolates in 62 varieties of Chinese cabbage (Brassica rapa L. ssp. pekinensis)and their antioxidant activity[J]. LWT-Food Science and Technology,2014, 58(1): 93-101. DOI:10.1016/j.lwt.2014.03.001.
[24] HONG E, KIM S J, KIM G H. Identification and quantitative determination of glucosinolates in seeds and edible parts of Korean Chinese cabbage[J]. Food Chemistry, 2011, 128(4): 1115-1120. DOI:10.1016/j.foodchem.2010.11.102.
[25] CCARTEA M E, VELASCO P, OBREGO’N S, et al. Seasonal variation in glucosinolate content in Brassica oleracea crops grown in northwestern Spain[J]. Phytochemistry, 2008, 69(2): 403-410. DOI:10.1016/j.phytochem.2007.08.014.
[26] 陈新娟, 朱祝军, 钱琼秋, 等. 硫代葡萄糖苷的提取、分离和鉴定[J]. 中国食品学报, 2007, 7(3): 43-47. DOI:10.3969/ j.issn.1009-7848.2007.03.007.
[27] 黄华磊, 石有明, 周燕, 等. 海拔高度对油菜品质的影响[J]. 浙江农业科学, 2012(10): 1384-1390. DOI:10.16178/j.issn.0528-9017.2012.10.025.
[28] 周晨光, 朱毅毒, 罗云波. 萝卜苗发芽过程中营养物质的动态变化[J]. 食品科学, 2014, 35(9): 1-5. DOI:10.7506/spkx1002-6630-201409001.
[29] 王志英, 郭丽萍, 李倩倩, 等. 甘蓝苗生长过程中主要生理生化变化[J]. 食品科学, 2015, 36(3): 6-11. DOI:10.7506/spkx1002-6630-201503002.
[30] 何湘漪, 范志红, 何洪巨. 贮藏、加工、烹调对十字花科蔬菜中硫苷物质含量的影响[J]. 中国食物与营养, 2012, 18(8): 34-38. DOI:10.3969/j.issn.1006-9577.2012.08.010.
[31] 弓志青, 张憋, 刘春泉. 甘蓝不同部位及加工对硫代葡萄糖苷组分和含量的影响[J]. 中国食品学报, 2011, 11(4): 218-223. DOI:10.3969/j.issn.1009-7848.2011.04.032.
[32] XU F, ZHENG Y H, YANG Z F, et al. Domestic cooking methods affect the nutritional quality of red cabbage[J]. Food Chemistry, 2014,161(6): 162-167. DOI:10.1016/j.foodchem.2014.04.025.
[33] 王慧倩, 郑聪, 王华东, 等. 乙醇熏蒸处理对鲜切西兰花活性成分和抗氧化活性的影响[J]. 食品科学, 2014, 35(16): 250-254. DOI:10.7506/spkx1002-6630-201416048.
Changes in Anthocyanins and Glucosinolates in Fresh-Cut Red Cabbage during Storage
SONG Ya
1, LI Kaili
2, FANG Jianing
1, ZHU Zhujun
1, YANG Jing
1, WU Fenghua
1, LIU Xingquan
1,*
(1. Key Laboratory of Quality Improvement of Zhejiang Province, School of Agriculture and Food Science, Zhejiang A&F University,Lin’an 311300, China; 2. School of Forestry and Bio-technology, Zhejiang A&F University, Lin’an 311300, China)
Abstract:This study explored the changes in the composition and contents of anthocyanins and glucosinolates in freshcut red cabbage during storage at low temperature (8 ± 1) ℃ for 7 days. The two classes of compounds were separated,identified and quantitatively analyzed by high performance liquid chromatography (HPLC) and HPLC-tandem mass spectrometry (HPLC-MS/MS). The results showed that a total of 11 cyanidins were found to be present in red cabbage, with cyanidin 3-feruloylsophoroside-5-glucoside being the most predominant, and its loss accounted for 55.51% of the total loss of anthocyanins during the storage period. In addition, the relative content of cyanidin 3-feruloylsophoroside-5-glucoside was decreased from 35.12% to 30.60% at the end of storage. Furthermore, a total of 10 glucosinolates (GS) were detected in red cabbage, including 6 aliphatic GS, 3 indole GS and 1 aromatic GS. Glucobrassicanapin and gluconapin were the major components in red cabbage, and their loss rates were both around 7%, altogether accounting for accounted for 50.07% of the total loss. Meanwhile, their relative content was increased from 71.68% to 74.33%.
Key words:fresh-cut red cabbage; functional compounds; anthocyanins; glucosinolates
DOI:10.7506/spkx1002-6630-201618016
中图分类号:TS255.3
文献标志码:A
文章编号:1002-6630(2016)18-0096-06
引文格式:
宋亚, 李凯利, 方佳宁, 等. 鲜切紫甘蓝中花青苷和硫代葡萄糖苷在贮藏过程中的变化[J]. 食品科学, 2016, 37(18): 96-101. DOI:10.7506/spkx1002-6630-201618016. http://www.spkx.net.cn
SONG Ya, LI Kaili, FANG Jianing, et al. Changes in anthocyanins and glucosinolates in fresh-cut red cabbage during storage[J]. Food Science, 2016, 37(18): 96-101. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201618016. http://www.spkx.net.cn
收稿日期:2016-03-11
基金项目:“十二五”国家科技支撑计划项目(2014BAD04B03)
作者简介:宋亚(1990—),男,硕士,研究方向为农产品加工与贮藏工程。E-mail:502372182@qq.com
*通信作者:刘兴泉(1973—),男,副教授,博士,研究方向为农产品质量与安全。E-mail:liuxq@zafu.edu.cn