外源可发酵糖对葡萄酒挥发性化合物的影响
谢克林
1,冯 涛
1,*,庄海宁
2,邴芳玲
1,高林林
1,桑 敏
1
(1.上海应用技术大学香料香精技术与工程学院,上海 201418;2.国家食用菌工程技术研究中心,农业部南方食用菌资源利用重点实验室,上海市农业科学院食用菌研究所,上海 201403)
摘 要:通过气相色谱-质谱法对4 种外源可发酵糖葡萄酒中的挥发性化合物进行定性定量分析。结果表明:添加外源可发酵糖,影响葡萄酒挥发性物质的特征;添加麦芽糖,葡萄酒中醇类、酮类、酸类、醛类、酚类和萜烯类的含量较高,酯类含量较低,而醇类和酯类的总含量在添加果糖和葡萄糖的条件下达到最大值。通过计算挥发性物质的香气活性值,确定20 种挥发性化合物为葡萄酒的关键香气物质。主成分分析和感官分析显示添加不同可发酵糖发酵葡萄酒的关键香气物质有显著差别,添加葡萄糖改善了葡萄酒的植物香和果香,风味强度最大,添加果糖和蔗糖改善了葡萄酒的青草香、花香、甜香和果香,添加麦芽糖改善了葡萄酒的花香、酯香、果香和甜香。
关键词:可发酵糖;挥发性化合物;葡萄酒;香气活性值;主成分分析
酒精发酵是葡萄酒生产的关键工艺,对于葡萄酒的颜色、风味、口感、香气等感官指标形成有至关重要的作用。葡萄酒的酒精发酵是酵母发酵糖类产生酒精的过程,主要受到葡萄汁的糖浓度
[1]、温度、pH值、氧气含量等因素的影响
[2]。糖作为发酵底物,决定了酿造葡萄酒的酒精含量,对酒的品质起着至关重要的作用
[3]。同时可发酵糖的类型对葡萄酒的感官品质都有重要影响
[4],同时还是葡萄酒中的重要呈味物质。
葡萄中能被酵母利用的糖有葡萄糖、果糖、蔗糖、麦芽糖等,在发酵过程中,酵母优先利用葡萄糖,大多数酵母发酵糖的顺序为:葡萄糖>果糖>蔗糖>麦芽糖
[5]。相关研究表明,不同种类的糖及添加量对发酵制品有很大影响,如张凤宽等
[6]研究表明,糖的添加有助于降低制品的pH值,增加乳酸量,促进良好风味形成,且蔗糖制品的风味最佳。Younis等
[7]研究发现,Saccharomyces cerevisiae分别利用麦芽糖、果糖、葡萄糖发酵时,麦芽糖培养基的菌体最有活力,但挥发性化合物的含量比果糖和葡萄糖低。
在发酵葡萄酒的过程中,会有葡萄成熟度不够或葡萄品种本身含糖量不高的现象,当葡萄原料糖含量较低达不到酿酒要求时,人们会添加蔗糖以提高葡萄酒的酒精体积分数。要酿造高质量的葡萄酒,就必须对葡萄酒酒精发酵的底物浓度——葡萄汁初始含糖及糖种类对葡萄酒风味影响进行分析研究,找出发酵过程有关指标的变化规律,对发酵期关键控制措施的制定和提供加糖量的参考具有一定的理论指导意义。
‘藤稔’葡萄是国内种植量大、品质好、产量高、颜色深的鲜食葡萄,本实验以含糖量较低的鲜食‘藤稔’葡萄为研究对象,在酿造葡萄酒的过程中分别添加葡萄糖、果糖、麦芽糖、蔗糖这4 种外源可发酵糖来探究其对葡萄酒风味的影响。
1 材料与方法
1.1 材料与试剂
葡萄糖、果糖、麦芽糖、蔗糖(食品级) 上海耐因实业有限公司;‘藤稔’葡萄 上海奉贤区海湾区葡萄种植园;酵母、Saccharomyces Cerevisiae菌株安琪酵母有限公司;磷酸氢二铵、氢氧化钠、偏重亚硫酸钾、磷酸二氢钾、氯化钠(均为析纯),乙腈(色谱纯) 国药集团化学试剂有限公司;2-辛醇(色谱纯,含量99.0%)、C
7~C
30正构烷烃(色谱纯) 美国Dr.EhxenstorferGmbH公司。
1.2 仪器与设备
BSA423S型电子天平 德国Sartorius仪器有限公司;PB.10型pH计 北京Sartorius仪器系统有限公司;HPX-9272MBE型电热恒温培养箱 上海一恒科学仪器有限公司;50/30 μm二乙基苯/碳分子筛/聚二甲基硅氧烷(divinylbenzene/carboxen/polydimethylsiloxane,DVB/CAR/PDMS)萃取头 美国Supelco公司;GC7890A/5975C型气相色谱-质谱(gas chromatographymass spectrometry,GC-MS)联用仪 美国Agilent公司;比重计(比重范围为0.9~1.0和1.0~1.1)、15 L发酵罐江苏琳琅玻璃制品有限公司。
1.3 方法
1.3.1 葡萄酒发酵
将10 kg‘藤稔’葡萄破碎装入15 L发酵罐内,加入果胶酶(0.1 g/kg),磷酸氢二铵0.08 g/kg,放置一夜后,测定葡萄汁的起始比重,分别加入1 kg(为了保证酒精体积分数能达到12%,便于酒样的保存)葡萄糖、蔗糖、果糖和麦芽糖(每组实验重复3 次),并接入质量分数0.02%葡萄酒酵母(Saccharomyces Cerevisiae菌株,接入前用36 ℃温水活化15 min),于25 ℃的恒温培养箱中发酵,测定葡萄醪的比重变化。酒液的比重降到1以下或连续2 d保持不变即视为发酵完成,终止发酵,并测定葡萄酒样的基本理化指标。发酵结束后进行澄清、过滤处理放入恒温酒柜(12 ℃)贮存。6 个月后,取样装满50 mL的离心管,盖住管口,并用密封胶密封,继续放入恒温酒柜贮藏备用分析。
1.3.2 主要理化指标的测定
残糖量(总糖)、酒精体积分数、总还原糖含量、挥发酸含量,游离二氧化硫含量、总酸含量的测定方法参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》
[8]。总酚含量测定根据Wang等
[9]的Folin-Ciocalteu法测定。
1.3.3 挥发性化合物的提取
[10]
将5 mL酒样置于15 mL顶空瓶中,同时加入1 g氯化钠和10 μL 2-辛醇(内标,700 mg/L),盖上盖子,将75 μL CAR/PDMS萃取头插入样品瓶上空,一起放置于60 ℃恒温水浴锅中,保持30 min。
1.3.4 GC-MS测定条件
[10-11]
GC条件:HP-INNOWAX毛细管色谱柱(60 m×250 mm,0.25 μm);进样口温度250 ℃;程序升温:初始温度40 ℃,保留2 min,以5 ℃/min的速率升至180 ℃,再以8 ℃/min的速率升至230 ℃,保留15 min;检测器温度250 ℃;载气He,流速1 mL/min;不分流进样。
MS条件:四极杆温度150 ℃;离子源温度230 ℃;接口温度250 ℃;电子电离源;电子能量70 eV;质量扫描范围10~450 u。
1.3.5 物质的定性定量分析
定性分析:将C
7~C
30的烷烃标样进入GC-MS分析,根据正构烷烃的保留时间计算检测物质的保留指数(retention index,RI)。利用全离子扫描的质谱图,比对Wiley 7n.1和NIST数据库中的标准谱图,并与文献报道的RI相比较或与同条件下该物质的标准品的RI和MS谱图相比较以确定某物质。定量分析:采用2-辛醇内标法进行定量
[12]。
1.3.6 香气活性值(odor active value,OAV)
根据文献查找每个香气物质在9.5%~14%乙醇溶液中的阈值,再根据物质的阈值和含量计算每个物质的OAV,以此表征某种香气化合物对香气贡献的大小。
1.3.7 感官评定
按照Jackson
[13]的感官环境和操作步骤,对葡萄酒品进行感官评定,且品评小组成员(五男五女,年龄范围为28~36 岁)根据ISO 13300—2
[14]的标准进行培训。为了解和比较这5 种自酿干红葡萄酒香气特点,引用Rutan等
[15]的感官分析方法,并根据实际情况建立对葡萄酒呈香感官描述评定表(表1),评定方法为9 分划线法,从0~9 分表示风味强度逐渐变强,其中0 分代表没有被察觉,9 分代表风味强度最大。所有的酒样采用盲评方法,每一品种葡萄酒的感官评定3 次,取平均值。
表1 葡萄酒感官描述评定
Table1 Sensory descriptors of wine samples

描述术语风味定义风味强度酒体风味强度柑橘类葡萄柚、柠檬、橙子莓果类草莓、黑醋栗、黑莓、覆盆子植物味青草、葡萄梗、四季豆果脯味葡萄干、无花果、李子干、西梅乳酸酸奶、奶酪、奶油坚果杏仁、核桃、榛子香料丁香、甘草、茴香、黑胡椒花香味玫瑰、丁香花、紫罗兰、茉莉果树类凤梨、荔枝、香蕉果酱果酱、果味棒棒糖不良风味塑料味、烧焦味、烟味、马厩味
1.4 数据分析
使用SAS 9.3(North Carolina State University,Raleigh, USA)对各个葡萄酒样品的挥发性化合物、葡萄酒样品的基本理化指标的含量及感官评价数据进行单因素方差分析,Duncan多元比较测试比较,当P<0.05认为差异显著。应用Unscramble 9.7(CAMO Software AS,Norway)对OAV大于1的挥发性化合物的定量数据进行主成分分析(principal component analysis,PCA)。
2 结果与分析
2.1 理化指标分析
如表2所示,添加不同可发酵糖发酵的葡萄酒的各项指标均存在显著性差异。比较不同的酒样可以看出,酒样中的总糖含量和总还原糖含量的变化规律均是葡萄糖组<果糖组<蔗糖组<麦芽糖组,这可能是酵母对不同的可发酵糖的利用率不同引起的,相关研究
[16]表明,酵母对不同可发酵糖的发酵能力大小为:葡萄糖>果糖>蔗糖>麦芽糖。对于总酸、挥发酸、总二氧化硫、游离二氧化硫及总酚,添加不同的可发酵糖,其含量有不同的变化规律,这可能是添加不同的糖产物不同或酵母菌对不同的糖利用率不同,致使发酵罐内酒样内部压力发生不同的变化造成的。Rantsiou等
[17]研究表明,添加不同高浓度的糖会形成一个复杂的发酵环境,对葡萄酒的发酵产物产生显著性的影响。
表2 理化指标分析结果
Table2 Physicochemical indexes of wines
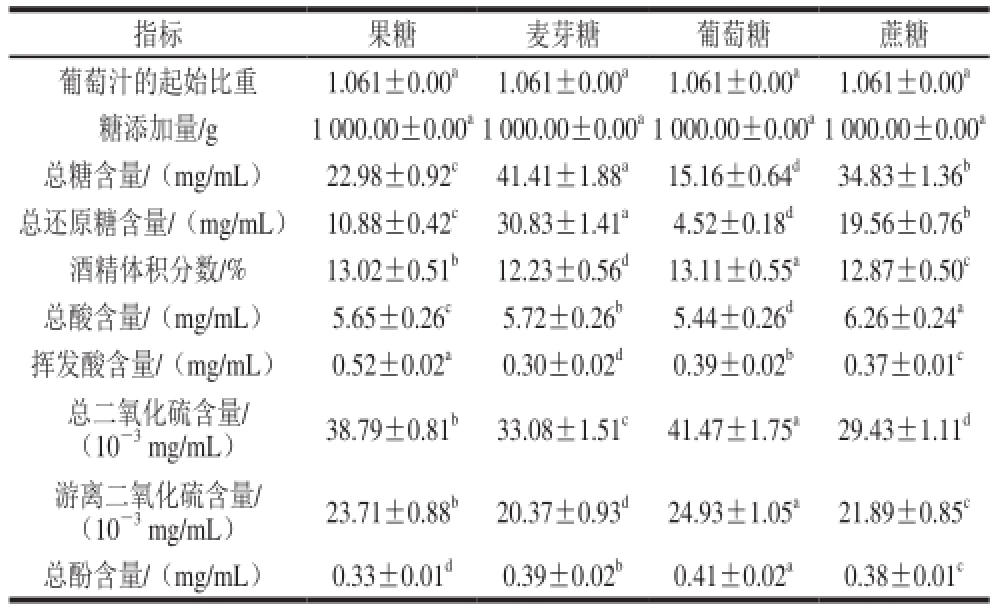
注:总糖、总还原糖含量均以葡萄糖计;总酚质量浓度以没食子酸计。同行肩标不同小写字母表示差异显著(P<0.05),下同。
?
2.2 挥发性化合物成分分析
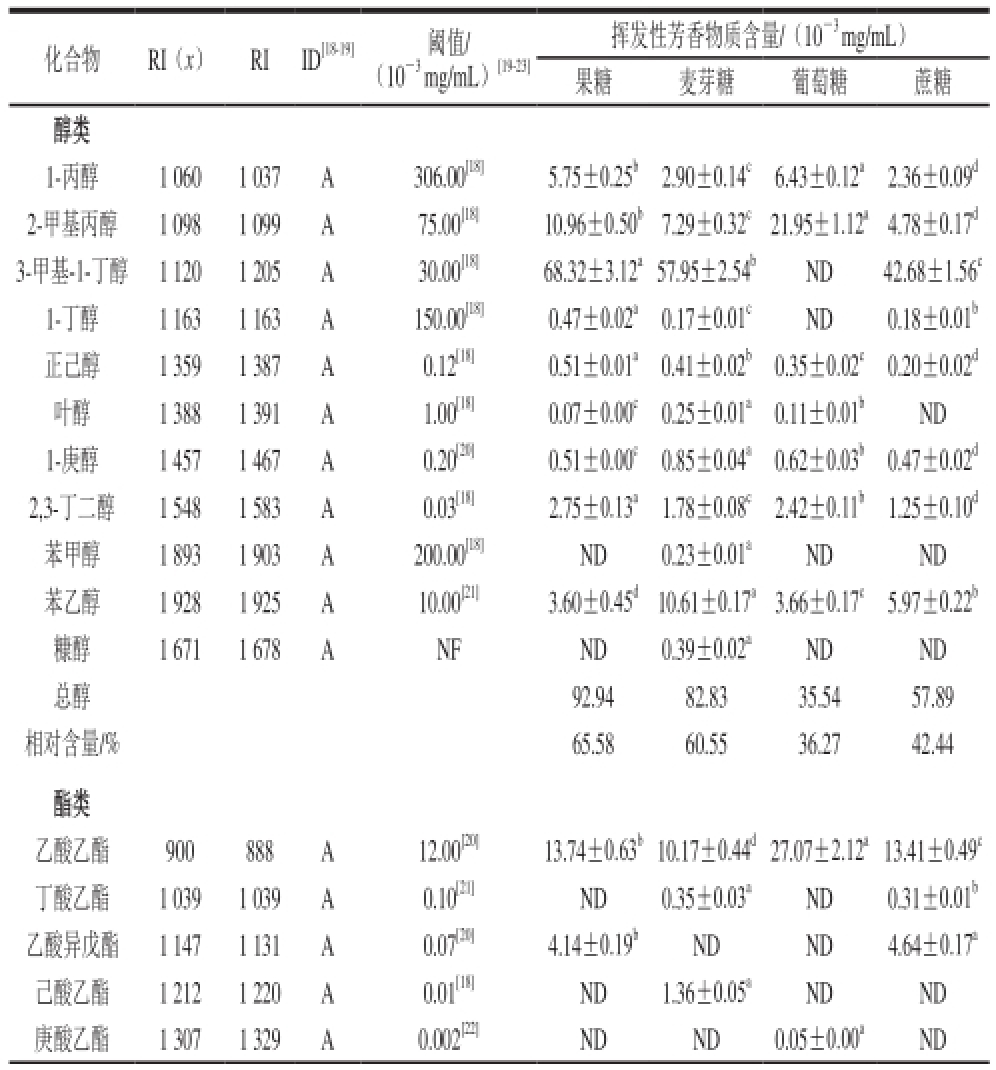
对不添加任何糖的对照组酒样及添加4 种不同糖酿造的葡萄酒进行GC-MS分析,共鉴定出46 种挥发性物质,包括酯类21 种、醇类11 种、醛类2 种、酸类4 种、酚类3 种、酮类2 种、烯萜类3 种,如表3所示。
表3 4 种不同糖发酵的葡萄酒的挥发性成分及含量
Table3 Volatile components and their concentrations in wines made with 4 different fermentable sugars
?
续表3

注:NF.没有找到相关数据,下同;ND.在当前条件下该化合物低于检测限,不能检测到此物质;RI(x).挥发性化合物的保留指数(INNOWAX柱);RI.文献中查到的保留指数;ID.定性方法,其中,A表示该物质的RI符合标准,B表示该物质的RI符合文献[18-19]。挥发性化合物阈值所对应的参考文献为[19-23]。
化合物RI(x)RIID
[18-19]阈值/(10
-3mg/mL)
[19-23]挥发性芳香物质含量/(10
-3mg/mL)果糖麦芽糖葡萄糖蔗糖乙酸庚酯1 3531 385A0.67
[18]0.12±0.01
bND0.16±0.01
a0.10±0.01
c辛酸甲酯1 3811 399A0.20
[18]0.02±0.00
cND0.04±0.00
b0.09±0.01
a辛酸乙酯1 4181 436A0.58
[18]7.32±0.33
c4.18±0.18
d7.89±0.36
b10.30±0.36
a癸酸甲酯1 588B
[18]0.01
[18]0.05±0.00
bNDND0.15±0.01
a癸酸乙酯1 6391 636A0.20
[18]8.50±0.39
c0.29±0.01
d9.24±0.43
b17.99±0.66
a9-葵烯酸乙酯1 676B
[18]0.10
[18]4.01±0.18
c1.60±0.05
d5.44±0.24
b5.72±0.24
a苯甲酸乙酯1 6801 648A0.58
[18]NDNDND0.20±0.01
a水杨酸甲酯1 7881 745A0.07
[18]0.49±0.01
d0.57±0.02
b0.50±0.01
c0.75±0.01
a月桂酸乙酯1 8391 835ANF3.95±0.20
bND5.24±0.20
c5.89±0.21
a9-十六碳烯酸乙酯1 889B
[18]NF0.06±0.00
d0.58±0.00
b0.12±0.01
c2.41±0.09
a十四酸乙酯 2 0342 034A1.80
[18]0.21±0.01
c0.26±0.01
b0.26±0.01
b0.48±0.02
a十六酸甲酯2 2182 208ANFNDNDND0.23±0.01
a十五酸乙酯2 153B
[18]NFNDND0.10±0.01
b0.14±0.01
a十六酸乙酯2 2602 250A0.04
[18]0.59±0.03
d2.20±0.11
a1.11±0.04
c1.26±0.05
b水杨酸辛酯2 324B
[18]NFNDND0.05±0.00
aND十八酸乙酯 2 4602 464ANFND0.71±0.03
aNDND总酯43.2022.2757.2764.07相对含量/%30.4816.2858.4446.97酮类2-辛酮1 2751 275A0.05
[18]0.17±0.01
b0.19±0.01
aND0.09±0.01
c甲基庚烯酮1 3431 343A0.02
[18]ND0.06±0.00
aNDND总酮0.170.25ND0.09相对含量/%0.120.180.000.07酸类乙酸1 4651 450A200.00
[18]1.75±0.08
b2.47±0.11
a1.22±0.06
c0.74±0.03
d辛酸2 0502 083A0.50
[18]2.34±0.11
c17.13±0.66
a0.90±0.04
d6.96±0.25
b山梨酸2 160B
[19]NFND0.26±0.01
aNDND癸酸2 2582 361A15.00
[18]1.14±0.05
d9.85±0.53
a2.24±0.10
c6.47±0.24
b总酸5.2329.714.3614.17相对含量/%3.6921.724.4510.39醛类糠醛1 4761 479A3.00
[18]ND0.50±0.00
aNDND苯甲醛1 5211 495A0.80
[18]0.03±0.00
b0.51±0.01
a0.03±0.00
bND总醛0.031.010.03ND相对含量/%0.020.740.030.00酚类2,6-二叔丁基对甲酚1 9201 920A0.35
[22]0.02±0.00
aNDNDND苯酚2 0122 020ANF0.01±0.01
b0.07±0.00
aNDND 2,4-二叔丁基苯酚总酚2 3102 315A0.033
[22]0.10±0.00
c0.18±0.01
a0.07±0.01
d0.12±0.00
b0.120.250.070.12相对含量/%0.090.180.070.09萜烯类柠檬烯1 1771 202A0.01
[23]ND0.18±0.01
b0.73±0.03
a0.08±0.00
c4-萜烯醇1 5901 636A0.25
[18]0.03±0.00
b0.12±0.01
aNDND α-萜品醇1 698B
[18]1.00
[20]ND0.18±0.01
aNDND总萜烯0.030.480.730.08相对含量/%0.020.350.740.06
由表3可知,酯类物质是样品中主要的挥发性化合物,共鉴别出21 种,葡萄酒的酯主要来源于葡萄及在酵母发酵过程中形成
[24-25]。总酯的含量大小依次为蔗糖组(64.07×10
-3mg/mL)>葡萄糖组(57.27×10
-3mg/mL)>果糖组(43.20×10
-3mg/mL)>麦芽糖组(22.27×10
-3mg/mL)。各化合物含量存在显著性的差异,其中,乙酸乙酯、辛酸乙酯、9-癸稀酸乙酯、十六酸乙酯在各实验组中的含量都较高。十八酸乙酯是麦芽糖发酵组独有的酯,水杨酸辛酯是葡萄糖发酵组独有的酯,十六酸甲酯是蔗糖发酵组中独有的酯,但含量均较低,癸酸乙酯在蔗糖发酵组中最高为17.99×10
-3mg/mL,远高于其他发酵组。
醇类物质是发酵组中第二大类的挥发性化合物,共鉴别出11 种,主要由酵母代谢和糖苷与酯的水解作用形成
[26]。总醇的含量大小依次为果糖组(92.94×10
-3mg/mL)>麦芽糖组(82.83×10
-3mg/mL)>蔗糖组(57.89×10
-3mg/mL)>葡萄糖组(35.54×10
-3mg/mL),各化合物在含量上存在显著性差异,蔗糖组检测出8 种,麦芽糖组中检测出11 种,葡萄糖组和果糖组分别检测出7 种和9 种,其中,大部分化合物含量在果糖组均较高,3-甲基-1-丁醇和1-丁醇在葡萄糖组未检测到,而其在其他3 组含量却非常高,糠醇、苯甲醇仅在麦芽糖组被检测到,苯乙醇在麦芽糖组明显高于其他发酵组。说明在葡萄酒发酵时,添加果糖能增加部分醇类和总醇的含量,增强葡萄酒的香气,添加足量的葡萄糖会抑制3-甲基-1-丁醇和1-丁醇的产生,降低总醇含量,添加麦芽糖则会增加糖醇、苯甲醇及苯乙醇的含量,丰富葡萄酒的香气物质。
醛和酮主要是由酸的脱羧和醇的氧化形成
[12,18]。共有2 种醛类和2 种酮类物质被检测出来,且含量均存在显著性差异。甲基庚烯酮、糠醛仅在麦芽糖组中被检出,2-辛酮和苯甲醛均在麦芽糖组含量最高,甲基庚烯酮、糠醛和苯甲醇均未在蔗糖组检测出,2-辛酮含量也在所有发酵组中最低,说明添加麦芽糖发酵有利于羰基化合物的形成,添加蔗糖不利于羰基化合的形成。
酸类物质是在酒精发酵过程中酶促反应形成的,是葡萄酒中重要的香气物质,能形成水果、奶酪、脂肪及腐败味的一类化合物
[14]。在葡萄酒中的总含量相对较高,含量范围为4.36×10
-3~29.71×10
-3mg/mL。山梨酸是麦芽糖组独有的化合物,含量约为0.26× 10
-3mg/mL。乙酸、辛酸、癸酸在各实验组的含量均存在显著性差异,其中,辛酸和癸酸均是在麦芽糖组含量远高于其他发酵组,它们在蔗糖组的含量又高于果糖和葡萄糖发酵组。
对于酚类化合物,2,6-二叔丁基对甲酚是果糖组中独有的酚类,苯酚仅存在于果糖组和麦芽糖组,2,4-二叔丁基苯酚在各实验组存在显著差异,在麦芽糖组最高,含量为0.18×10
-3mg/mL,低于其阈值。而和其他挥发性物质相比,烯萜类和杂环类物质的含量较低,但是萜类物质的阈值相对也低,麦芽糖组和葡萄糖发酵组中烯萜类和杂环类物质的总含量明显高于其他组,对增加葡萄酒风味的丰富性起重要作用
[20,27]。
由以上的分析可知,添加麦芽糖发酵对葡萄酒香气的种类和含量影响最为显著,可以通过调节麦芽糖的添加量来调节葡萄酒的风味物质和种类,可以为葡萄酒风味调节提供一个新的方向。
2.3 不同糖发酵葡萄酒挥发性化合物的OAV
OAV可用于评价各风味化合物对酒香气的贡献,Allen等
[28]研究发现OAV大于1的化合物对酒风味有贡献。不同糖发酵酒中挥发性化合物的OAV如表4所示。
表4 不同糖发酵产生的OAV大于1的挥发性化合物的OAV
Table4 OAV of volatile compounds with OAV > 1 produced by adding different fermentable sugars

化合物挥发性芳香物质的OAV果糖麦芽糖葡萄糖蔗糖3-甲基-1-丁醇2.28±0.13
a1.93±0.10
bNF1.42±0.06
c正己醇4.25±0.10
a3.42±0.10
b2.92±0.2
c1.67±0.20
d1-庚醇2.55±0.02
c4.25±0.24
a3.10±0.18
b2.35±0.12
d2,3-丁二醇91.67±5.31
a59.33±3.27
c80.67±4.49
b41.67±4.08
d苯乙醇0.36±0.06
d1.06±0.062
a0.37±0.02
c0.60±0.03
b乙酸乙酯1.15±0.05
b0.85±0.02
d2.26±0.02
a1.12±0.02
c丁酸乙酯NF0.35±0.37
bNF3.10±0.12
a乙酸异戊酯59.14±3.34
bNFNF66.29±2.97
a己酸乙酯NF136.00±6.12
aNFNF庚酸乙酯NFNF25.00±1.22
aNF辛酸乙酯12.62±0.70
c7.21±0.38
d13.60±0.76
b17.76±0.76
a癸酸甲酯5.00±0.12
bNFNF15.00±1.22
a9-癸烯酸乙酯40.10±2.20
c16.00±0.61
d54.40±2.94
b57.20±2.94
a水杨酸甲酯7.00±0.17
d8.14±0.35
b7.14±0.17
c10.71±0.17
a十六酸乙酯14.75±0.92
d55.00±3.37
a27.75±1.22
c31.50±1.53
b2-辛酮3.40±0.24
b3.80±0.24
aNF1.80±0.24
c甲基庚烯酮NF3.00±0.18
aNFNF辛酸4.68±0.27
c34.26±1.62
a1.80±0.10
d13.92±0.61
b柠檬烯NF18.00±1.22
b70.00±3.67
a8.00±0.37
c
由表4可以看出,共有20 种挥发性化合物的OAV大于1,以酯类和醇类为主,其中,辛酸乙酯(7.21~17.76)、9-癸烯酸乙酯(16.00~57.20)、十六酸乙酯(14.75~55.00)、2,3-丁二醇(41.67~91.67)在4 种酒的OAV都很高,说明这3 种化合物对葡萄酒的特征香气贡献都很高,它们主要赋予酒体以果香、青香和木香气息
[18-21]。其次是3-甲基-1-丁醇、正己醇、1-庚醇、乙酸乙酯、水杨酸甲酯、2-辛酮(添加麦芽糖的酒样除外)的OAV均小于10,对4 种葡萄酒都有较低的贡献。这些物质主要赋予酒体果香、青香、花香和甜香
[18,29]。乙酸异戊酯对果糖组及蔗糖组贡献较大,OAV分别为66.29和59.14,己酸乙酯对麦芽糖组贡献较大,OAV为136.00,但己酸乙酯在其他3 组酒样中均没有被检测到。此外,庚酸乙酯对葡萄糖组贡献较大(OAV为25.00)、癸酸甲酯对果糖组和蔗糖组贡献较大(OAV分别为5.00和15.00)、9-癸烯酸乙酯对果糖组、麦芽糖、葡萄糖组和蔗糖组贡献都较大(OAV分别为40.10、16.00、54.40和57.20)、辛酸对麦芽糖组和蔗糖组贡献较大(OAV分别为34.26和13.92)、柠檬烯对葡萄糖组贡献较大(OAV为70.00)。这些主要香气物质融合成为协调细腻的香气,给人以愉悦、柔和优雅的感觉,对葡萄酒的香气有非常重要的贡献。
2.4 挥发性化合物的PCA
为揭示不同发酵糖组之间香气贡献的挥发性化合物的主要差异,以OAV大于1的物质定量数据作图,前2 个主成分PC1和PC2的累计贡献率占总变量的91.00%,其中,PC1解释了69.00%的变量,PC2解释的22.00%的变量,如图1所示。

图1 PCA图
Fig.1 Principal component analysis
1. 3-甲基-1-丁醇;2.正己醇;3. 1-庚醇;4. 2,3-丁二醇;5.苯乙醇;6.苯乙醇;7.丁酸乙酯;8.乙酸异戊酯;9.己酸乙酯;10.庚酸乙酯;11.辛酸乙酯;12.癸酸甲酯;13.癸酸乙酯;14. 9-癸烯酸乙酯;15.水杨酸甲酯;16.十六酸乙酯;17. 2-辛酮;18.甲基庚烯酮;19.辛酸;20.柠檬烯。
b. 20 种OAV大于1的挥发性化合物对前两个主成分的相关性图
由图1可以看出,以PC1为基准麦芽糖组明显区别于果糖组、蔗糖组及葡萄糖组,以PC2为基准,葡萄糖组明显区别于果糖和蔗糖。葡萄糖组位于第2象限内,与之相关的物质有2,3-丁二醇、乙酸乙酯、庚酸乙酯、柠檬烯和9-癸烯酸乙酯。果糖组和蔗糖组位于第3象限,与它相关的挥发性物质有正己醇、乙酸异戊酯、辛酸乙酯、癸酸甲酯、癸酸乙酯、水杨酸甲酯。麦芽糖组位于第4象限内,相关的挥发性物质有3-甲基-1-丁醇、苯乙醇、丁酸乙酯、己酸乙酯、十六酸乙酯、2-辛酮、甲基庚烯酮和辛酸。添加不同的糖发酵后,葡萄酒的挥发性化合物含量和种类都发生了显著变化,这可能是由于不同糖对酵母代谢造成了不同的影响。酵母对不同糖的发酵能力和代谢方式均不同,吴辉等
[30]研究发现,果糖、葡萄糖和麦芽糖有明显的代谢差异。结果表明:添加葡萄糖,提高了2,3-丁二醇、乙酸乙酯、庚酸乙酯和9-癸烯酸乙酯的含量,改善了葡萄酒的植物香和菠萝香。添加果糖和蔗糖,提高了正己醇、乙酸异戊酯、辛酸乙酯、癸酸甲酯、癸酸乙酯、水杨酸甲酯的含量,改善了葡萄酒的青草香、花香、甜香和果香(主要为苹果、梨和柑橘香味)。添加麦芽糖提高了3-甲基-1-丁醇、苯乙醇、丁酸乙酯、己酸乙酯、十六酸乙酯、2-辛酮、甲基庚烯酮和辛酸的含量,改善了葡萄酒的花香、酯香、果香(主要为草莓和绿苹果)和甜香。
2.5 感官特性分析
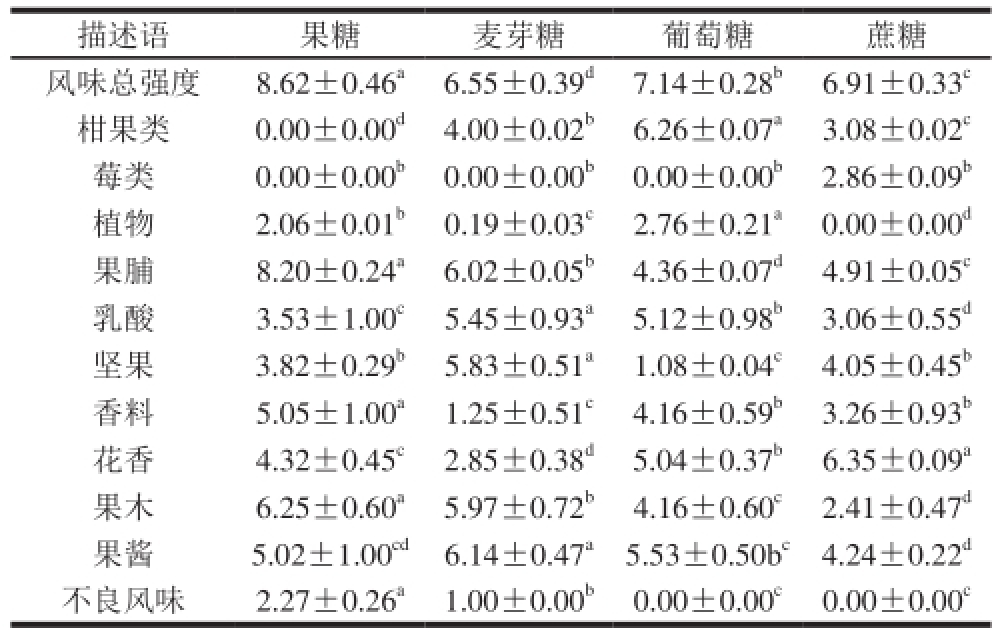
酒中的化合物之间通过相互影响,最终影响酒中的感官质量
[31],4组酒样感官评定结果及对其数据的单因素方差分析(P<0.05)结果见表5。
表5 4 种葡萄酒的感官评定结果
Table5 Sensory evaluation results of four wine samples
描述语果糖麦芽糖葡萄糖蔗糖风味总强度8.62±0.46
a6.55±0.39
d7.14±0.28
b6.91±0.33
c柑果类0.00±0.00
d4.00±0.02
b6.26±0.07
a3.08±0.02
c莓类0.00±0.00
b0.00±0.00
b0.00±0.00
b2.86±0.09
b植物2.06±0.01
b0.19±0.03
c2.76±0.21
a0.00±0.00
d果脯8.20±0.24
a6.02±0.05
b4.36±0.07
d4.91±0.05
c乳酸3.53±1.00
c5.45±0.93
a5.12±0.98
b3.06±0.55
d坚果3.82±0.29
b5.83±0.51
a1.08±0.04
c4.05±0.45
b香料5.05±1.00
a1.25±0.51
c4.16±0.59
b3.26±0.93
b花香4.32±0.45
c2.85±0.38
d5.04±0.37
b6.35±0.09
a果木6.25±0.60
a5.97±0.72
b4.16±0.60
c2.41±0.47
d果酱5.02±1.00
cd6.14±0.47
a5.53±0.50b
c4.24±0.22
d不良风味2.27±0.26
a1.00±0.00
b0.00±0.00
c0.00±0.00
c
由表5可以看出,添加果糖发酵的酒样在12 组感官指标中的风味总强度(8.62)、果脯(8.20)、香料(5.05)和果木(6.25)的强度都最高,添加葡萄糖发酵的酒样柑果类(6.26)、植物(2.76)的强度达到最高值,添加蔗糖发酵的酒样的花香(6.35)强度达到最高,添加麦芽糖发酵的酒样乳酸(5.45)、坚果(5.83)和果酱(6.14)的强度达到最高,Styger等
[31]发现风味强度与酒中醇类的种类和总质量浓度高度相关,果糖发酵的葡萄酒的醇类总含量分别达到92.94 mg/L,这可能使得他们在风味强度指标上有较高的分值。添加果糖和麦芽糖发酵的葡萄酒在果脯指标上较突显,风味强度值分别达到了8.20和6.02,添加蔗糖发酵的葡萄酒在花香指标上较突显,风味强度值达到了6.35,添加葡萄糖发酵的葡萄酒在柑果类指标上较突显,风味强度值达到了6.26,Ana等
[32]报道水果酯类赋予葡萄酒愉悦的水果香气和萜烯类化合物可增强酒中的水果香气,Álvarez等
[20]研究Godello葡萄酒的香气特征时,发现其在花香、苹果和柑橘水果味、草本香气上表现最突出。
3 结 论
通过GC-MS分析了分别添加了果糖、蔗糖、葡萄糖和麦芽糖发酵葡萄酒挥发性化合物,检测出46 种挥发性物质,计算了OAV,并对OAV大于1的挥发性化合物进行了PCA,对4 组酒样的风味强度进行了感官评价。结果表明:添加了不同糖发酵葡萄酒的挥发性化合物含量和理化指标含量存在显著性差异,总酯和总醇含量分别在蔗糖组和果糖组发酵的酒样最高,添加麦芽糖发酵葡萄酒中醇类、酮类、酸类、醛类、酚类和萜烯类的种类较多,酯类含量较低且大部分化合物含量在果糖发酵条件下较大。通过OAV的计算,20 种挥发性化合物的OAV大于1,是葡萄酒的关键香气成分;PCA的结果表明添加不同可发酵糖发酵葡萄酒的关键香气物质有较大差别,添加葡萄糖,改善了葡萄酒的植物香和菠萝香,添加果糖和蔗糖,改善了葡萄酒的青草香、花香、甜香和果香,添加麦芽糖改善了葡萄酒的花香、酯香、果香和甜香。感官分析表明添加果糖发酵酒样的风味总强度、果脯、香料和果木的强度最高,添加葡萄糖发酵的酒样柑果类、植物的强度达到最高,添加蔗糖发酵酒样的花香强度达到最高,添加麦芽糖发酵酒样的乳酸、坚果和果酱的强度达到最高,添加果糖或麦芽糖、蔗糖、葡萄糖发酵葡萄酒分别在果脯、花香、柑果类的强度较突显。
参考文献:
[1] BERENGUER M, VEGARA S, BARRAJÓN E, et al. Physicochemical characterization of pomegranate wines fermented with three different Saccharomyces cerevisiae yeast strains[J]. Food Chemistry, 2016, 190: 848-855. DOI:10.1016/j.foodchem.2015.06.027.
[2] REDDY L V A, REDDY O V S. Effect of fermentation conditions on yeast growth and volatile composition of wine produced from mango(Mangifera indica L.) fruit juice[J]. Food and Bioproducts Processing,2011, 89(4): 487-491. DOI:10.1016/j.fbp.2010.11.007.
[3] JORDÃO A M, VILELA A, COSME F. From sugar of grape to alcohol of wine: sensorial impact of alcohol in wine[J]. Beverages,2015, 1(4): 292-310. DOI:10.3390/beverages1040292.
[4] FONTOIN H, SAUCIER C, TEISSEDRE P L, et al. Effect of pH,ethanol and acidity on astringency and bitterness of grape seed tannin oligomers in model wine solution[J]. Food Quality and Preference,2008, 19(3): 286-291. DOI:10.1016/j.foodqual.2007.08.004.
[5] 李华. 葡萄酒化学[M]. 北京: 科学出版社, 2005.
[6] 张凤宽, 易小艳, 陈海燕, 等. 不同种类的糖对发酵牛肉香肠发酵的影响[J]. 食品科学, 2009, 30(17): 200-203. DOI:10.3321/ j.issn:1002-6630.2009.17.046.
[7] YOUNIS O S, STEWART G G. Sugar uptake and subsequent ester and higher alcohol production by Saccharomyces cerevisiae[J]. Journal of the Institute of Brewing, 1998, 104(5): 255-264. DOI:10.1002/ j.2050-0416.1998.tb00998.x.
[8] 国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 15038—2006 葡萄酒、果酒通用分析方法[S].
[9] WANG X, XIE K, ZHUANG H, et al. Volatile flavor compounds,total polyphenolic contents and antioxidant activities of a China gingko wine[J]. Food Chemistry, 2015, 182: 41-46. DOI:10.1016/ j.foodchem.2015.02.120.
[10] SAGRATINI G, MAGGI F, CAPRIOLI G, et al. Comparative study of aroma profile and phenolic content of Montepulciano monovarietal red wines from the Marches and Abruzzo regions of Italy using HSSPME-GC-MS and HPLC-MS[J]. Food Chemistry, 2012, 132(3): 1592-1599. DOI:10.1016/j.foodchem.2011.11.108.
[11] 李华. 贺兰山东麓地区霞多丽干白葡萄酒香气成分的GC/ MS分析[J]. 中国食品学报, 2004, 4(3): 72-75. DOI:10.3969/ j.issn.1009-7848.2004.03.016.
[12] XIAO Z, YU D, NIU Y, et al. Characterization of aroma compounds of Chinese famous liquors by gas chromatography-mass spectrometry and flash GC electronic-nose[J]. Journal of Chromatography B Analytical Technologies in the Biomedical and Life Sciences, 2014,945/946(2): 92-100. DOI:10.1016/j.jchromb.2013.11.032.
[13] JACKSON R S. Wine tasting: a professional handbook[M]. 2th ed. Pittsburgh: Academic Press, 2009.
[14] International Organization for Standardization. Sensory analysis: general guidance for the staff of a sensory evaluation laboratory: Part 2: recruitment and training of panel leaders[S]. Switzerland: Geneva, 2006.
[15] RUTAN T, JONHSTONE M H, PINEAU B, et al. Characterization of the aroma of central otago pinot noir wines using sensory reconstitution studies[J]. American Journal of Enology and Viticulture,2014, 65(4): 424-434. DOI:10.5344/ajev.2014.14003.
[16] 迟玉杰. 食品化学[M]. 北京: 化学工业出版社, 2012.
[17] RANTSIOU K, CAMPOLONGO S, ALESSANDRIA V, et al. Yeast populations associated with grapes during withering and their fate during alcoholic fermentation of high-sugar must[J]. Australian Journal of Grape and Wine Research, 2013, 19(1): 40-46. DOI:10.1111/ ajgw.12000.
[18] WELKE J E, ZANUS M, LAZZAROTTO M, et al. Quantitative analysis of headspace volatile compounds using comprehensive twodimensional gas chromatography and their contribution to the aroma of Chardonnay wine[J]. Food Research International, 2014, 59(4): 85-99. DOI:10.1016/j.foodres.2014.02.002.
[19] CARSTEN K I, HENRIK B J, CARLERIK O. Aroma changes during black currant (Ribes nigrum L.) nectar processing[J]. Journal of Agricultural and Food Chemistry, 1998, 46(3): 1132-1136. DOI:10.1021/jf970513y.
[20] ÁLVAREZ M G, GONZÁLEZ-BARREIRO C, CANCHOGRANDE B, et al. Relationships between Godello white wine sensory properties and its aromatic fingerprinting obtained by GCMS[J]. Food Chemistry, 2011, 129(3): 890-898. DOI:10.1016/ j.foodchem.2011.05.040.
[21] TUFARIELLO M, CAPONE S, SICILIANO P. Volatile components of Negroamaro red wines produced in Apulian Salento area[J]. Food Chemistry, 2012, 132(4): 2155-2164. DOI:10.1016/ j.foodchem.2011.11.122.
[22] CAPONE S, TUFARIELLO M, FRANCIOSO L, et al. Aroma analysis by GC/MS and electronic nose dedicated to Negroamaro and Primitivo typical Italian Apulian wines[J]. Sensors and Actuators B Chemical,2013, 179(2): 259-269. DOI:10.1016/j.snb.2012.10.142.
[23] PINO J A, QUERIS O. Analysis of volatile compounds of mango wine[J]. Food Chemistry, 2011, 125(4): 1141-1146. DOI:10.1016/ j.foodchem.2010.09.056.
[24] PINO J A, MESA J Y, MARTI M P, et al. Volatile components from mango (Mangifera indica L.) cultivars[J]. Journal of Agricultural and Food Chemistry, 2005, 53(6): 2213-2223. DOI:10.1021/jf0402633.
[25] QUIJANO C E, SALAMANCA G, PINO J A. Aroma volatile constituents of Colombian varieties of mango (Mangifera indica L.)[J]. Flavour and Fragrance Journal, 2007, 22(5): 401-406. DOI:10.1002/ ffj.1812.
[26] GONZÁLEZ-ROMPINELLI E M, RODRÍGUEZ-BENCOMO J J, GARCÍA-RUIZ A, et al. A winery-scale trial of the use of antimicrobial plant phenolic extracts as preservatives during wine ageing in barrels[J]. Food Control, 2013, 33(2): 440-447. DOI:10.1016/j.foodcont.2013.03.026.
[27] NIU Y, ZHANG X, XIAO Z, et al. Characterization of odor-active compounds of various cherry wines by gas chromatography-mass spectrometry, gas chromatography-olfactometry and their correlation with sensory attributes[J]. Journal of Chromatography B Analytical Technologies in the Biomedical and Life Sciences, 2011, 879(23): 2287-2293. DOI:10.1016/j.jchromb.2011.06.015.
[28] ALLEN M S, LACEY M J, BOYD S. Determination of methoxypyrazines in red wines by stable isotope dilution gas chromatography-mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 1994, 42(8): 1734-1738. DOI:10.1021/jf00044a030.
[29] QIAN M C, WANG Y. Seasonal variation of volatile composition and odor activity value of ‘Marion’(Rubus spp. hyb) and ‘Thornless Evergreen’ (R. laciniatus L.) blackberries[J]. Journal of Food Science,2005, 70(1): C13-C20. DOI:10.1111/j.1365-2621.2005.tb09013.x.
[30] 吴辉, 李志敏, 叶勤. 果糖和麦芽糖作为有氧碳源对大肠杆菌NZN111两阶段发酵中厌氧发酵的影响[J]. 生物工程学报, 2011,27(9): 1299-1308.
[31] STYGER G, PRIOR B, BAUER F F. Wine flavor and aroma[J]. Journal of Industrial Microbiology and Biotechnology, 2011, 38(9): 1145-1159. DOI:10.1007/s10295-011-1018-4.
[32] ANA E, EVA C, LAURA F, et al. Analytical characterization of the aroma of five premium red wines. Insights into the role of odor families and the concept of fruitiness of wines[J]. Journal of Agricultural and Food Chemistry, 2007, 55(11): 73-80. DOI:10.1021/ jf0636418.
Influence of Different Exogenous Fermentable Sugars on Volatile Compounds of Wine
XIE Kelin
1, FENG Tao
1,*, ZHUANG Haining
2, BING Fangling
1, GAO Linlin
1, SANG Min
1
(1. School of Perfume and Aroma Technology, Shanghai Institute of Technology, Shanghai 201418, China;2. Key Laboratory of Edible Fungi Resources and Utilization (South), Ministry of Agriculture, National Engineering Research Center of Edible Fungi, Institute of Edible Fungi, Shanghai Academy of Agriculture Sciences, Shanghai 201403, China)
Abstract:The volatile compounds of wines fermented after the addition of four different exogenous fermentable sugars were identified and quantified by gas chromatography-mass spectrometry (GC-MS). The results showed that volatiles characteristics of wine were affected by adding exogenous fermentable sugars and the contents of alcohols, ketones, acids,aldehydes, phenols and terpenes were higher while esters were lower upon the addition of maltose. Meanwhile, the total contents of esters and alcohols reached maximum respectively upon the addition of glucose and fructose. Moreover, a total of 20 volatiles were determined as the key aroma compounds by calculating odor activity value (OAV). Then, principal component analysis (PCA) and sensory analysis showed that addition of different fermentable sugars resulted in significant differences in the key volatile components of wine. Moreover, glucose improved the botanical and fruity aroma of wine and produced the strongest flavor intensity, fructose and sucrose improved grass, floral, sweet and fruity aroma, and maltose improved floral, ester, fruity and sweet aroma.
Key words:fermentable sugars; volatile compounds; wine; odor activity value; principal component analysis
DOI:10.7506/spkx1002-6630-201618019
中图分类号:TS261.4
文献标志码:A
文章编号:1002-6630(2016)18-0113-07
引文格式:
谢克林, 冯涛, 庄海宁, 等. 外源可发酵糖对葡萄酒挥发性化合物的影响[J]. 食品科学, 2016, 37(18): 113-119. DOI:10.7506/spkx1002-6630-201618019. http://www.spkx.net.cn
XIE Kelin, FENG Tao, ZHUANG Haining, et al. Influence of different exogenous fermentable sugars on volatile compounds of wine[J]. Food Science, 2016, 37(18): 113-119. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201618019. http://www.spkx.net.cn
收稿日期:2016-02-29
基金项目:上海市教委科技创新重点项目(12ZZ187);上海市联盟计划项目(LM201436)
作者简介:谢克林(1987—),女,助理工程师,硕士,研究方向为葡萄酒酿造工艺。E-mail:kelinhappy@139.com
*通信作者:冯涛(1978—),男,教授,博士,研究方向为淀粉科学、食品风味化学、葡萄酒酿造工艺。E-mail:fengtao@sit.edu.cn






