表1 HPLC梯度洗脱程序
Table1 Gradient elution program of HPLC

?
艾鑫卫 1,胡思平 1,龚姮姮 1,黄文邺 1,杨洁球 2,王 力 1,廖照江 1,*
(1.三峡大学生物与制药学院,湖北 宜昌 443000;2.宜昌人福口服固体制剂厂,湖北 宜昌 443000)
摘 要:目的:建立一种简单、快速、准确的高效液相色谱-串联质谱法,同时分离与检测紫苏叶、茎和根中酚类化合物含量,探讨紫苏各部位酚类物质的累积规律,为确定紫苏各部位最佳采收时期提供依据。方法:对紫苏进行人工栽培,样品分期采集,采集后的样品经乙醇提取,采用高效液相色谱-串联质谱法进行分析,对影响色谱、质谱的重要参数进行优化,通过对照标准物质的保留时间及质谱分析,确定相应的化合物;通过标准曲线法定量,以其中13 种酚类化合物为主要参考指标,观察它们在各部位的动态含量变化。结果:鉴定出化合物:咖啡酸、咖啡酸-3-O-葡萄糖苷、迷迭香酸、迷迭香酸-3-O-葡萄糖苷、木犀草素、木犀草素-7-O-葡萄糖苷、木犀草素-7-O-葡萄糖苷酸、木犀草素-7-O-二葡萄糖苷酸、芹菜素、芹菜素-7-咖啡酰基葡萄糖苷、芹菜素-7-O-二葡萄糖苷、野黄岑素-7-O-二葡萄糖苷、迷迭香酸甲酯,以上化合物中酚酸及其糖苷化合物含量呈先降低,至结果期急剧上升达到最大,黄酮及其糖苷化合物含量则递增至结果期达到最大。其中鉴定出迷迭香酸和木犀草素-7-O-葡萄糖苷酸分别在结果期达到最大,含量分别为21.41 mg/g和19.89 mg/g,结果期叶部位总酚类含量达到最大,含量为47.50 mg/g。结论:通过对紫苏各个部位不同采收时期黄酮、黄酮糖基化、酚酸的动态变化、总含量变化和部位成分分布的研究,对紫苏酚类资源的利用提供参考依据。
关键词:紫苏;酚类物质;高效液相色谱-串联质谱法;动态积累;最佳采收时期
紫苏(Perilla frutescens),别名桂荏、白苏、赤苏等,为一年生草本植物,属于唇形科。由于具有特有的活性物质及营养成分,紫苏经济价值很高,成为备受世界关注的植物,可以广泛应用于食品、医药和保健。紫苏所含有的酚类物质具有抗氧化活性、对酶的作用、止痒活性、抗肿瘤、保护肝脏和其他作用 [1-5]。随着对酚类化合物的深入研究和应用不断发展,人们将目光转向寻找天然酚类化合物,而酚类化合物在紫苏中分布比较广泛,所以紫苏对于人们的开发利用至关重要。
目前关于紫苏酚类化合物的分离和检测研究较多,如对紫苏籽中的酚类抗氧化性研究 [6],迷迭香酸和迷迭香酸-3-O-葡萄糖苷的抗氧化活性比较 [7],紫苏酚类化合物商业化 [8],对皮肤炎症、皮肤疾病、帕金森症、血管性痴呆、老年痴呆和抑制脑衰老的作用和功效 [9]。由此可见,紫苏的酚类化合物无论是在食用、药用还是酚类的商业化产品发展都将具有着稳定的发展趋势。
目前,国内外研究人员主要对紫苏属植物叶和种子的成分鉴定 [10]、分离和化合物的表征 [11]进行研究。对紫苏籽渣中的酚类物质 [12]、不同紫苏叶中的迷迭香酸 [13],紫苏籽主要成分 [14]、总黄酮和总多酚含量进行比较 [15]。鲜见紫苏4 个部位的酚类化合物及其糖苷的相关报道。
本研究基于紫苏全部位不同时期的酚类化合物,采用快速、准确、灵敏度高、专属性好、双重检测器表征的高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry, HPLC-MS/ MS)法对紫苏提取物进行分离和表征,对于影响色谱、质谱分离效果的重要因素,如进样量、流动相的流速、流动相中酸的添加量及多级质谱参数进行优化,并应用于紫苏全部位不同时期酚类化合物含量测定。可为紫苏酚类累积、各部位不同酚类采收时期、酚类资源合理利用,提供理论依据。
1.1 材料与试剂
紫苏籽药材购买于湖北,该样本经三峡大学王玉兵副教授鉴定为湖北紫苏,标本存放于三峡大学实验室。
标准品:迷迭香酸(含量:20 mg;批号:15030306)、木犀草素(含量:20 mg;批号:15030404)、芹菜素(含量:20 mg;批号:15060501)、野黄岑素(含量:20 mg;批号:15041311) 成都瑞发科技开发有限公司;咖啡酸(含量:20 mg;批号:EK140410) 上海伊卡生物技术有限公司;甲醇(色谱纯) 美国Fisher公司;乙酸(分析纯) 国药集团化学试剂有限公司;无水乙醇(分析纯) 天津恒兴化学试剂制造有限公司;其他试剂均为分析纯。
1.2 仪器与设备
1200 UPLC仪(配有电喷雾离子源及Hystar3.2数据处理系统) 美国Agilent公司;Amazon SL MS联用仪德国Brüker公司。
1.3 方法
1.3.1 样品制备
将种子于2015年6月5日(150605)播种,直至2015年6月15日(150615)发芽长出两对叶片,小心对幼苗进行移栽,每组幼苗随机种植。种植到实验田后每隔20 d后按规则采样(150705、150725、150815、150905、150925、151015),采样方法为实验田对角线取样,在实验田对角线上选定5 个取样点,在每个取样点上按规定的面积(50×50)cm内采样,每个点采取至少一株紫苏,为全株采摘。根据植物生长情况,根、茎、叶采摘分为营养期、开花期、结果期。将新鲜的植株用清水除去表面的泥沙后将植株表面的水除去,自然阴干,备用。
精密称取紫苏根、茎、叶粉末各1.5 g,种子5.0 g(过40 目筛),种子进行索氏提取,用石油醚65 ℃回流除去脂肪,将粉碎过目样品加入50 mL乙醇(80∶20,V/V)溶液,超声波辅助提取。重复3 次,合并提取液减压蒸干。然后加入甲醇-水(80∶20,V/V)溶液定容。定容后过0.45 µm有机膜,进样5 µL。每期样品分别重复3 次,并求得各部位酚类化合物的平均含量。
1.3.2 HPLC条件
色谱柱:Agligent C 18液相色谱柱(150 mm× 2.1 mm,5 µm);流速0.2 mL/min;柱温40 ℃;进样量5 µL;流动相:A为甲醇溶液;B为体积分数0.01%醋酸溶液;流动相洗脱程序如表1所示。
表1 HPLC梯度洗脱程序
Table1 Gradient elution program of HPLC

?
1.3.3 MS条件
电喷雾离子源;自动二级质谱模式;负离子模式扫描;毛细管电压4 000 V;挡板电压2 500 V;干燥气流5 L/min;干燥气压力35 psi;干燥器温度350 ℃;二级质谱条件:MS/MS多级质谱裂解能量1.00 V;离子肼离子数目30 000;最大积累时间300.00 ms;质量扫描范围m/z 100~1 200。
1.3.4 标准曲线的绘制
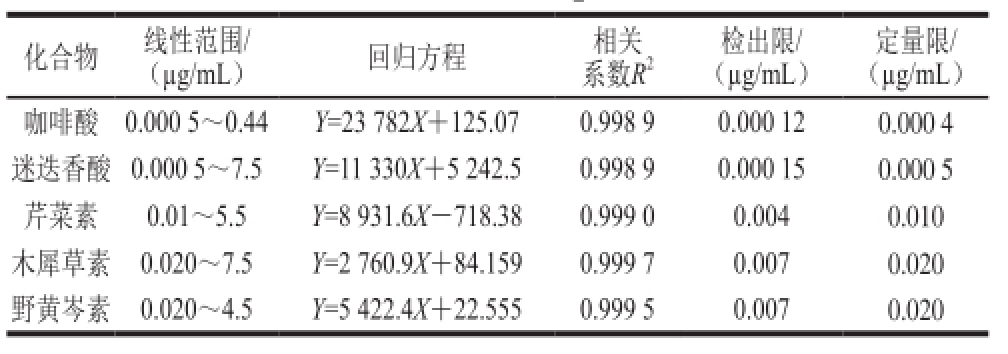
准确称取标准品咖啡酸、迷迭香酸、芹菜素、木犀草素、野黄岑素各5.00 mg,分别用甲醇溶解,定容10 mL,即得0.5 mg/mL的标准品储备液,0 ℃保存。使用时分别用甲醇逐级稀释,得到合适的线性范围。线性方程及相关系数如表2所示。
表2 标准曲线及相关系数
Table2 Standard curves with correlation coefficients as well as limits of detection and quantitation
?
本实验将根、茎、叶分为3 个时期:营养期(0~60 d)、开花期(60~100 d)、结果期(100~120 d)。
2.1 HPLC-MS条件的优化
2.1.1 HPLC条件的选择
2.1.1.1 流动相的选择
本实验考察甲醇-水、乙腈-水作为流动相的分离效果,结果表明,所提取的酚类化合物在甲醇-水的体系能够取得较好的分离效果。
2.1.1.2 流速和进样量的选择
本实验对于流动相流速进行优化,发现液相流速为0.2 mL/min时效果优于0.3 mL/min;考察进样量分别为5、10、15 µL时效果,发现当进样量为5 µL时,目标峰峰形好,分离度好,如图1所示。
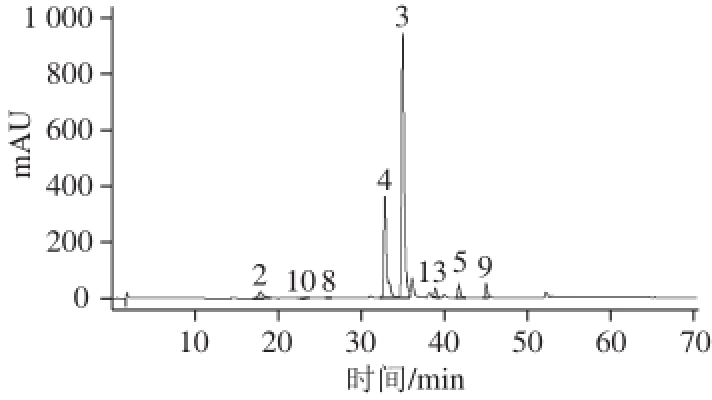
图1 紫苏样品酚类化合物色谱图
Fig.1 HPLC chromatograms of phenolic compounds in Perilla frutescens
2.咖啡酸-3-O-葡萄糖苷;3.迷迭香酸;4.迷迭香酸-3-O-葡萄糖苷;5.木犀草素;8.木犀草素-7-O-二葡萄糖苷酸;9.芹菜素;10.芹菜素-7-O-咖啡酰基葡萄糖苷;13.迷迭香酸甲酯。
2.1.2 MS条件的选择
本实验采用负离子模式监测,对分子离子峰及其二级质谱信号采集分别进行优化,发现在多级质谱裂解能量1.00 V;离子肼离子数目30 000;最大积累时间300.00 ms条件下,能够保证离子化效率高、信号强且仪器分辨率正常,如图2所示。
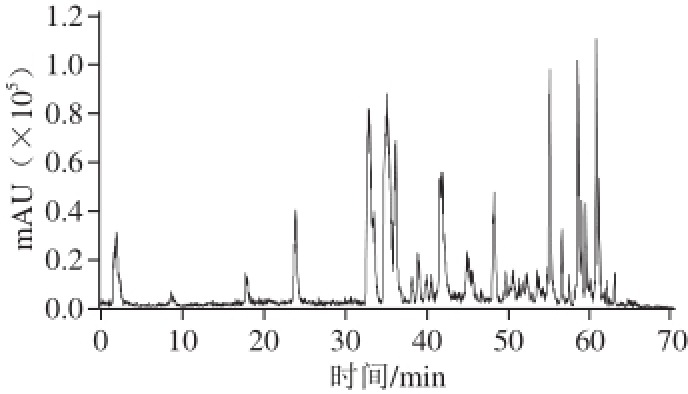
图2 紫苏样品酚类化合物总离子流图
Fig.2 HPLC-MS/MS total ion chromatograms of phenolic compounds in Perilla frutescens
2.2 酚类化合物时间变化规律
将不同采收时期根、茎、叶3 个部位醇提取物通过HPLC分离,初步鉴定其中13 种酚类化合物,分别为咖啡酸、咖啡酸-3-O-葡萄糖苷、迷迭香酸、迷迭香酸-3-O-葡萄糖苷、木犀草素、木犀草素-7-O-葡萄糖苷、木犀草素-7-O-葡萄糖苷酸、木犀草素-7-O-二葡萄糖苷酸、芹菜素、芹菜素-7-O-咖啡酰基葡萄糖苷、芹菜素-7-O-二葡萄糖苷酸、野黄岑素-7-O-二葡萄糖苷酸、迷迭香酸甲酯。紫苏各部位的酚类含量动态变化如图3A~F所示,紫苏各部位的黄酮含量动态变化如图3G~O所示。



图3 各生长期紫苏根、茎、叶部位酚酸化合物含量(A~F)和黄酮化合物含量(G~O)
Fig.3 Dynamic changes in the contents of phenolics in roots, stems,and leaves of Perilla frutescens at different growing periods
A.咖啡酸;B.咖啡酸-3-O-葡萄糖苷;C.迷迭香酸;D.迷迭香酸-3-O-葡萄糖苷;E.迷迭香酸甲酯;F.酚酸总含量变化;G.木犀草素;H.木犀草素-7-葡萄糖苷;I.木犀草素-7-O-葡萄糖苷酸;J.木犀草素-7-O-二葡萄糖苷酸;K.芹菜素;L.芹菜素-7-O-咖啡酰基葡萄糖苷;M.芹菜素-7-O-二葡萄糖苷;N.野黄岑素-7-O-二葡萄糖苷;O.黄酮总含量变化。
根据图3可以看出,不同采收时期的根、茎、叶三部位13 种主要成分分析显示,紫苏的茎、叶部位黄酮化合物总含量从营养期到开花期逐渐增加,到结果期达到最大,含量分别为7.99 mg/g和25.86 mg/g。紫苏茎、叶部位的酚酸从营养期到开花期略有降低,但在结果期含量反弹到最大,含量分别为1.66 mg/g和21.42 mg/g。紫苏茎、叶部位的总酚类含量在结果期达到最大,含量分别为9.65 mg/g和47.50 mg/g。
木犀草素-7-O-葡萄糖苷酸为紫苏中黄酮化合物最主要成分,均在茎、叶的开花初期和开花期形成,随着植物代谢增强,含量急剧上升以结果期达到最大,含量分别为3.88 mg/g和19.88 mg/g。迷迭香酸为紫苏中酚酸化合物最主要成分,其在营养初期就存在于紫苏的根、茎、叶3 个部位,迷迭香酸含量在营养初期较大,随后到开花期含量急剧降低,但到了结果期达到最大。根部位迷迭香酸含量在营养期和开花期均比其他部位要高,在营养初期根部位含量最高为3.10 mg/g,含量最低为茎部位为0.24 mg/g。紫苏在开花期,代谢更加旺盛,其中根部位与茎、叶部位迷迭香酸含量相比较而言,含量更高于这2 个部位,根部位含量最高为1.24 mg/g,大约为茎部位的18 倍。到了结果期,叶片作为植物最主要器官,为整个植株提供营养成分,叶部位迷迭香酸含量增加到最大,含量由开花期的0.045 mg/g急剧增加到21.40 mg/g,均远高于其他3 个部位,分别是茎、根部位的13.51 倍和31.88 倍。
紫苏叶、籽等部位的酚酸类物质国内外已有多篇文献报道,最主要的酚酸类物质为迷迭香酸 [16]。本实验将紫苏根、茎、叶、种子4 个部位的提取物采用HPLCMS/MS法分析,检测到紫苏茎、叶部位迷迭香酸在结果期含量达到最大,叶部位含量为21.41 mg/g,种子部位含量为5.02 mg/g,同时也检测到叶部位化合物含量可达19.89 mg/g。而芹菜素-7-咖啡酰基葡萄糖苷和芹菜素-7-O-二葡萄糖苷的含量在开花期达到最大,以开花期为最佳采收时期。紫苏4 个部位的酚类含量差异很大,很可能是紫苏本身的酚酸合成和在植物体内代谢、体内转运有很大的关系,Liu Jing等 [17]研究了12 种紫苏茎、叶、种子部位的迷迭香酸的含量,结果表明:紫苏叶部位迷迭香酸含量在8.33~14.98 mg/g之间,茎部位含量在0.34~3.08 mg/g之间,种子部位含量在1.03~3.30 mg/g之间。购买于四川、广西、香港等大多数样品叶部位迷迭香酸含量较高,而北京、湖北、江苏等样品种子部位含量远高于叶片。本实验为人工栽培湖北紫苏,迷迭香酸含量与文献[17]购买于香港的品种相类似,种子部位含量高于文献[17]种子部位的含量。江安娜 [18]研究了不同紫苏叶片总黄酮含量的变化,其中营养期到开花期总黄酮含量呈上升态势,随后逐渐递增,在结果期达到最大,本实验紫苏总黄酮变化与文献[18]所报道的4 种紫苏变化趋势一致。
2.3 糖基化随时间变化规律
紫苏根、茎、叶三部位的酚类糖基化化合物为:咖啡酸-3-O-葡萄糖苷、迷迭香酸-3-O-葡萄糖苷、木犀草素-7-O-葡萄糖苷、木犀草素-7-O-葡萄糖苷酸、木犀草素-7-O-二葡萄糖苷酸、芹菜素、芹菜素-7-咖啡酰基葡萄糖苷、芹菜素-7-O-二葡萄糖苷、野黄岑素-7-O-二葡萄糖。由图3可以看出,紫苏茎、叶部位酚酸、黄酮的糖基化均在开花期被检测到,叶片在营养期出现少量的黄酮糖苷,由于植物体内相关酶的活性变化导致相关酚类化合物变化来满足植物本身的生理需求 [19-20],酚类化合物在酶的作用下通过生物合成改变本身的结构,如糖基化、基化酰化和甲基化,这些改变对于植物体累化合物的溶解性、稳定性和降低毒性都至关重要 [21-23],所以随着植物的生长、新陈代谢逐步增强,糖基化的种类和含量也逐渐增多,含量和种类均到结果期达到最大,种子部位酚酸和黄酮的糖基化物质相对于茎、叶部位要少。酚酸的糖基化主要以葡萄糖苷形式存在,黄酮主要以葡萄糖苷、苷酸、二苷酸形式存在。
营养期:叶中木犀草素、芹菜素主要以其葡萄糖苷酸和葡萄糖苷形式存在,且葡萄糖苷酸占主要成分,黄酮化合物均为7号位上;茎部位糖基化总类和含量少,根部位未检测到相关糖苷。
开花期和结果期:茎、叶部位木犀草素主要以葡萄糖苷、葡萄糖苷酸和二葡萄糖苷酸存在,葡萄糖苷酸占主要成分,芹菜素主要以二葡萄糖苷酸和咖啡酰基糖苷存在,二葡萄糖苷酸占主要成分,野黄岑素主要以二葡萄糖苷酸存在。种子部位木犀草素主要以葡萄糖苷形式存在,芹菜素主要以咖啡酰基糖苷存在,茎、叶和种子三部位的咖啡酸和迷迭香酸分别以糖苷形式存在,且种子部位酚酸糖苷含量要高于其他部位,黄酮化合物的糖苷均为7号位,酚酸化合物的糖苷均为3号位,根部位未检测到相关糖苷的存在。
本研究表明,紫苏酚类含量较高的化合物是迷迭香酸和木犀草素-7-O-葡萄糖苷酸。根部位迷迭香酸累积峰值出现在营养期,而叶部位为落叶期,主要以迷迭香酸形式存在,糖苷较少。木犀草素累积最高主要是在叶部位的落叶期,主要存在的形式为木犀草素-7-O-葡萄糖苷酸。紫苏特征酚酸的最佳采收时期为落叶期,主要积累在落叶期叶片中,含量可达21.41 mg/g。黄亮辉等 [13]研究不同紫苏叶的迷迭香酸采收时期为8月,江安娜 [18]研究了紫苏叶部位总黄酮含量,认为结果期为最佳采收时期,该结论与本实验相符合,不同的植物其总黄酮含量变化不同,植物体内的黄酮酚酸抗紫外、外部环境变化有很密切的关系 [24-25]。本研究实现了高灵敏度、高效率、低成本、准确等优势,为全面认识紫苏各部位的酚类化合物组成及其含量动态变化提供了依据,同时也为紫苏的品质、营养功能提供了必要的基础。还需结合相关合成黄酮的酶进行研究,从而能够解释这些化合物的动态变化,也更能够为这些化合物的合成提供重要的依据。
参考文献:
[1] RAMEŠOV Š, SOKOLOV R, TARBEK J, et al. The oxidation of luteolin, the natural flavonoid dye[J]. Electrochim Acta, 2013, 110(6): 46-54. DOI:10.1016/j.electacta.2013.06.136.
[2] HA T J, LEE J H, LEE M H, et al. Isolation and identification of phenolic compounds from the seeds of Perilla frutescens (L.) and their inhibitory activities against alpha-glucosidase and aldose reductase[J]. Food Chemistry, 2012, 135(3): 1397-1403. DOI:10.1016/ j.foodchem.2012.05.104.
[3] NABAVI S F, BRAIDY N, GORTZI O, et al. Luteolin as an anti-inflammatory and neuroprotective agent: a brief review[J]. Brain Reserach Bulletin, 2015, 119: 1-11. DOI:10.1016/ j.brainresbull.2015.09.002.
[4] LIN E S, CHOU H J, KUO P L, et al. Antioxidant and antiprolife active of mehanolic extracts of Perilla frutescend[J]. Journal of Medical Plants Reserachs, 2010, 4: 477-483. DOI:10.5897/ JMPR10.035.
[5] YANG S Y, HONG C O, LEE G P, et al. The hepatoprotection of caffeic acid and rosmarinic acid, major compounds of Perilla frutescens, against t-BHP-induced oxidative liver damage[J]. Food and Chemical Toxicology, 2013, 55: 92-99. DOI:10.1016/j.fct.2012.12.042.
[6] LEE J H, PARK K H, LEE M H, et al. Identification, characterisation,and quantification of phenolic compounds in the antioxidant activitycontaining fraction from the seeds of Korean perilla (Perilla frutescens) cultivars[J]. Food Chemistry, 2013, 136(2): 843-852. DOI:10.1016/ j.foodchem.2012.08.057.
[7] ZHOU Xiaojing, YAN Linlin, YIN Peiei, et al. Structural characterisation and antioxidant activity evaluation of phenolic compounds from cold-pressed Perilla frutescens var. arguta seed flour[J]. Food Chemistry, 2014, 164: 150-157. DOI:10.1016/ j.foodchem.2014.05.062.
[8] MENG L, LOZANO Y, BOMBARDA I, et al. Polyphenol extraction from eight Perilla frutescens cultivars[J]. Comptes Rendus Chimie,2009, 12(5): 602-611. DOI:10.1016/j.crci.2008.04.011.
[9] ZHAO Gang, CHEN Yaoyue, QIN Guowei, et al. Luteolin from Purple Perilla mitigates ROS insult particularly in primary neurons[J]. Neurobiology of Aging, 2012, 33(1): 176-186. DOI:10.1016/ j.neurobiolaging.2010.02.013.
[10] GUAN Zheng, LI Sicong, LIN Zongtao, et al. Identification and quantitation of phenolic compounds from the seed and pomace of Perilla frutescens using HPLC/PDA and HPLC-ESI/QTOF/MS/ MS[J]. Phytochemical Analysis, 2014, 25(6): 508-513. DOI:10.1002/ pca.2521.
[11] JUN H I, KIM B T, SONG G S, et al. Structural characterization of phenolic antioxidants from purple perilla (Perilla frutescens var. acuta) leaves[J]. Food Chemistry, 2014, 148: 367-372. DOI:10.1016/ j.foodchem.2013.10.028.
[12] 吴娆, 马飞, 张良晓, 等. 高效液相色谱-串联质谱法测定紫苏籽油中11种酚类化合物[J]. 分析化学, 2015, 43(10): 208-211. DOI:10.11895/j.jssn.0253-3820.150367.
[13] 黄亮辉, 苏琪, 张新新, 等. 不同采收时期的紫苏叶和白苏叶中迷迭香酸的含量测定[J]. 药物分析杂志, 2012, 32(10): 1753-1755. DOI:10.16155/j.0254-1793.2012.10.008.
[14] 李晓鹏. 紫苏籽粒主要营养成分的提取与分离[D]. 太原: 中北大学, 2013.
[15] 周晓晶. 紫苏种子脂肪酸、醇提物成分含量分析及其抗氧化活性研究[D]. 北京: 北京林业大学, 2014.
[16] OSAKABE N, YASUDA A, NATSUME M, et al. Rosmarinic acid,a major polyphenolic component of Perilla frutescens, reduces lipopolysaccharide (LPS)-induced liver injury in D-galactosamine(D-GalN)-sensitized mice[J]. Free Radical Biology and Medicine,2002, 33(6): 798-806. DOI:10.1016/ S0891-5849(02)00970-X.
[17] LIU Jing, WANY K, ZHAO Zhongzhen, et al. Determination of the content of rosmarinic acid by HPLC and analytical comparison of volatile constituents by GC-MS in different parts of Perilla frutescens (L.) Britt[J]. Chemistry Central Journal, 2013, 7(1): 61. DOI:10.1186/1752-153X-7-61.
[18] 江安娜. 叶用紫苏农艺性状比较及不同生育期叶片中主要成分的含量变化研究[D]. 武汉: 华中农业大学, 2012.
[19] WINKEL B S J. Metabolic channeling in plants[J]. Annual Review of Plant Biology, 2004, 55: 85-107. DOI:10.1146/annurcy.arplant.55. 031903.141714.
[20] JORGENSEN K, RASMUSSEN A V, MORANT M, et al. Metabolon formation and metabolic channeling in the biosynthesis of plant natural products[J]. Current Opinion in Plant Biology, 2005, 8: 280-291. DOI:10.1016/j.pbi.2005.03.014.
[21] KLEIN M, MARTINOIA E, HOFFMANN THOMA G, et al. A membrane-potential dependent ABC-like transporter mediates the vacuolar uptake of rye flavoneglucuronides: regulation of glucuronide uptake by glutathione and its conjugates[J]. Plant Journal, 2002, 21(3): 289-304. DOI:10.1046/j.1365-313x.2000.00684.x.
[22] BARTHOLOMEW D M, van DYKL D E, CINDYLAUL S M, et al. Alternate energy-dependent pathways for the vacuolar uptake of glucose and glutathione conjugates[J]. Plant Physiology, 2002, 130(3): 1562-1572. DOI:10.1104/pp.008334.
[23] FRANGNE N, EGGMANNL T, KOBLISCHKE C, et al. Flavone glucoside uptake into barley mesophyll and Arabidopsis cell culture vacuoles: energization occursby H(+)-antiport and ATP-binding cassette-type mechanisms[J]. Plant Physioogyl, 2002, 128(2): 726-733. DOI:10.1104/pp.010590.
[24] AGATI G, CEROVIC Z G, MARTA A D, et al. Optically-assessed preformed flavonoids and susceptibility of grapevine to Plasmopara viticola under different lignt egimes[J]. Functional Plant Biology,2008, 35(1): 77-84. DOI:10.1071/FP07178.
[25] ROGERS L A, DUBOSC, CULLIS I F, et al. Light, the circadian clock, and sugar perception in the control of biosynthesis[J]. Journal of Experimental Botany, 2005, 56: 1651-1663. DOI:10.1093/jxb/eri162.
Quantitation of Phenolic Compounds in Perilla frutescens at Different Growing Stages Using HPLC-MS/MS
AI Xinwei
1, HU Siping
1, GONG Hengheng
1, HUANG Wenye
1, YANG Jieqiu
2, WANG Li
1, LIAO Zhaojiang
1,*
(1. College of Biological and Pharmaceutical, China Three Gorges University, Yichang 443000, China;2. Yichang Humanwell Oral Solid Dosage Plant, Yichang 443000, China)
Abstract:Purpose: To establish a simple, rapid, accurate high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS) for the simultaneous separation and determination of phenolic compounds in leaves, stems and roots of Perilla frutescens and further to examine the accumulation patterns of phenolics in different plant parts during the growing period for the purpose of determining the optimal harvest time for Perilla frutescens. Methods: Samples of cultivated Perilla frutescens were collected at three different growing stages and extracted with ethanol for HPLCMS analysis. The important chromatographic and mass spectrometric parameters were optimized. The identification of phenolic compounds was done by retention time comparison with reference standards and quantitation was performed using calibration curves. Moreover, changes in the contents of 13 major phenolic compounds in various parts of Perilla frutescens at different growing stages were observed. Results: The following compounds were identified: caffeic acid, caffeic acid-3-O-glucoside, rosmarinic-acid, rosmarinic-acid-3-O-glucoside, luteolin, luteloin-7-O-glucoside, luteloin-7-O-diglucuronide,luteloin-7-O-glucuronide, apigenin, apigenin-7-O-caffeoyglucoside, apigenin-7-O-diglucuronide and scutellarein-7-O-diglucuronide. Among these, the contents of rosmarinic acid and its glucoside derivatives decreased initially and then sharply increased to the maximum at the fruiting stage, while the flavonoids and their glucoside derivatives gradually increased until reaching the maximum at the fruiting stage. The contents of rosmarinic acid and luteloin-7-O-glucuronide in leaves at the fruiting stage were the highest, reaching 21.41 mg/g and 19.89 mg/g, respectively. Furthermore, leaves at the fruiting stage had the highest total phenol content of 47.50 mg/g among the various parts examined. Conclusions: The results of ourpresent work may provide a good reference for the utilization of Perilla frutescens as a phenolics resource.
Key words:Perilla frutescens; phenolics; high performance liquid chormatography-tandem mass spectrometry (HPLC-MS/MS);accumulation; optimal harvest time
DOI:10.7506/spkx1002-6630-201618021
中图分类号:TS255.7
文献标志码:A
文章编号:1002-6630(2016)18-0126-07
引文格式:
艾鑫卫, 胡思平, 龚姮姮, 等. 高效液相色谱-串联质谱法测定各生长期紫苏中酚类物质的含量[J]. 食品科学, 2016,37(18): 126-132. DOI:10.7506/spkx1002-6630-201618021. http://www.spkx.net.cn
AI Xinwei, HU Siping, GONG Hengheng, et al. Quantitation of phenolic compounds in Perilla frutescens at different growing stages using HPLC-MS/MS[J]. Food Science, 2016, 37(18): 126-132. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201618021. http://www.spkx.net.cn
收稿日期:2016-03-12
基金项目:三峡大学科学基金项目(KJ2013B070);宜昌市科技局自然基础科学研究与应用专项(A15-302-a05)
作者简介:艾鑫卫(1990—),男,硕士研究生,研究方向为现代仪器分析及应用。E-mail:392589019@qq.com
*通信作者:廖照江(1964—),男,副教授,博士,研究方向为无机化学及分析化学。E-mail:Liaozhaojiang@163.com