QuEChERS-气相色谱法测定牛奶中24 种有机氯及菊酯类农药残留
邓小娟
1,李文斌
2,晋立川
2,顾春燕
2,陈小平
1,*
(1.天津大学分析中心,天津 300072;2.迪马科技有限公司,天津 300402)
摘 要:建立QuEChERS快速净化结合气相色谱法测定牛奶中24 种有机氯及菊酯类农药残留的分析方法。样品经乙腈提取,QuEChERS法净化,气相色谱-电子捕获检测器分析,外标法定量。结果表明,待测物质在5~250 µg/L范围内线性关系良好,相关系数大于0.99,检出限为0.06~0.30 µg/kg,样品加标平均回收率为85.5%~111.2%,相对标准偏差为3.2%~10.8%。该方法简单、准确、高效,可用于牛奶样品中有机氯及菊酯类农药残留的快速筛查和定量检测。
关键词:QuEChERS;气相色谱;有机氯;菊酯类农药;牛奶
有机氯及菊酯类农药作为广谱杀虫剂曾在农业生产中被广泛使用。目前,有机氯农药虽被各国禁止使用,但其化学性质稳定、毒性大、在环境中降解缓慢,能够长期残留于土壤和农产品中;菊酯类农药因其具有高效、低度等特点而被广泛使用,也使其大量残留于土壤和农产品中,并可通过生物链富集在动植物体内,对人体健康和生态环境造成很大危害。目前许多国家对牛奶中有机氯及菊酯类农药的最高残留限量作了严格规定。因此,建立简单、快速的多种有机氯及菊酯类农药残留的同时检测方法,对于保证食品安全和保护人类健康具有重大的现实意义。
目前,有机氯及菊酯类农药残留常用的检测方法有气相色谱电子捕获检测法、气相色谱-质谱法、液相色谱-串联质谱法等
[1-3]。由于其在水体、食品中的含量较低且受复杂基质的影响,在分析前需要进行富集、净化等复杂的样品前处理过程。通常采用有机溶剂提取,浓硫酸磺化
[4-6]、凝胶渗透色谱
[7-9]、固相萃取
[10-12]、基质分散固相萃取
[13-16]、液液微萃取
[17]、固相微萃取
[18-19]等方法净化。对于食品中有机氯及菊酯类农药残留的检测方法普遍存在前处理操作繁琐、耗时费力、需要消耗大量有机溶剂等问题。QuEChERS(quick, easy, cheap, effective,rugged, safe)是近年来国际上最新发展起来的一种用于蔬菜、水果等农产品中多农残检测的快速样品前处理技术
[20-21],由美国化学家Steven J. Lehotay和Michelangelo Anastassiades等于2003年提出。与传统的液液萃取、固相萃取等样品前处理技术相比,QuEChERS方法的优势在于分析速度快、溶剂使用量少、操作及装置简单且回收率、准确度等较高。目前,有超过200 种农药残留可用QuEChERS方法分析,该方法改良后也广泛用于动植物食品中农药残留检测及水产品中兽药的分析测定
[22-25],但在牛奶样品中的应用报道较少。相对于气相色谱通用的氢火焰离子化检测器而言,电子捕获检测器对有机氯及菊酯类农药残留的灵敏度高、选择性强,适合于含卤原子化合物、多环芳烃等的痕量分析;相对于价格较贵的质谱检测器及其苛刻的检测条件而言,电子捕获检测器相对廉价,易于在更多实验室实现推广应用。
本研究拟采用QuEChERS法快速净化样品,用毛细管柱气相色谱分离,电子捕获检测器测定,以保留时间定性,外标法定量,建立QuEChERS-气相色谱法同时检测牛奶中24 种有机氯及菊酯类农药残留的方法。针对牛奶样品的特点优化QuEChERS前处理条件,包括提取溶剂、吸附剂的种类及配比等,以减少试剂用量并缩短前处理时间;同时针对有机氯及菊酯类农药的结构特性选择电子捕获检测器(electron capture detector,ECD)并优化仪器检测条件,为实现牛奶中多种有机氯及菊酯类农药残留的快速监测提供实验依据。
1 材料与方法
1.2 仪器与设备
7890A气相色谱仪(配µECD和三合一自动进样器)美国安捷伦科技有限公司;DM-1701毛细管柱(30.0 m× 0.32 mm,0.25 μm)、DM-5毛细管柱(30.0 m×0.25 mm,0.25 μm) 北京迪马科技有限公司;H-1850高速冷冻离心机 湘仪仪器有限公司;XH-C涡旋混合器江苏金怡仪器科技公司;HSC-24B氮吹仪 天津恒奥科技发展有限公司。
1.3 方法
1.3.1 标准溶液配制
有机氯及菊酯类农药标准单标储备液:将农药标准品各0.01 g分别准确移入10 mL容量瓶中,用正己烷定容,配成1 000 mg/L的标准单标储备液,于4 ℃保存备用。
农药混合标准工作液:分别量取适量农药标准单标储备液,混合并用正己烷稀释定容,配成系列质量浓度农药混合标准工作液,于4 ℃保存备用。
1.3.2 样品前处理
1.3.2.1 样品的提取
准确称取5.0 g样品至20 mL离心管中,加入15 mL乙腈溶液、4.0 g氯化钠、2 mL 200 g/L乙酸铅溶液,振荡5 min,以8 000 r/min离心2 min,收集上层清液;再加入15 mL乙腈溶液,重复上述步骤;合并上层清液,于40 ℃水浴条件下氮气吹干,加入1 mL乙酸乙酯-正己烷(2∶8,V/V)溶液,超声溶解,待净化。
1.3.2.2 样品净化
将待净化液转移到预先装有100 mg水硫酸镁、50 mg NH
2和50 mg C
18的2 mL离心管中,涡旋混合1 min,于4 ℃ 8 000 r/min条件下离心2 min,上清液经0.45 μm滤膜过滤后,供气相色谱分析。
1.3.3 色谱条件
色谱柱:DM-1701毛细管柱(30.0 m×0.32 mm,0.25 μm);升温程序:90 ℃保持1 min,以40 ℃/min升温至180 ℃,保持4 min;以2 ℃/min升温至195 ℃,保持2 min,以2 ℃/min升温至200 ℃,保持2 min;以30 ℃/min升至280 ℃,保持7 min;进样口温度260 ℃;检测器温度300 ℃;尾吹气流速60 mL/min;载气:氮气,纯度大于99.99%,恒流模式,流速1.0 mL/min;进样量1.0 μL;进样方式:不分流进样。
2 结果与分析
1.1 材料与试剂
牛奶 市购;乙腈、正己烷、丙酮(均为色谱纯)、xStandard有机氯及菊酯类农药标准品、NH
2、N-丙基乙二胺(N-propylethylenediamine,PSA)、石墨化碳黑(graphitized carbon black,GCB)、C
18填料 北京迪马科技有限公司;其他分离用有机溶剂均为国产分析纯。
2.1 色谱柱及色谱条件的选择
多残留测定需要在一次进样中良好地分离多种不同分子质量和极性的化合物,因此色谱条件的选择是至关重要的。本研究比较了DM-5毛细管色谱柱和DM-1701毛细管色谱柱对24 种有机氯及菊酯类农药的分离效果。结果表明,DM-5毛细管色谱柱不能有效分离p,p’-滴滴伊与狄氏剂、o,p’-滴滴涕与p,p’-滴滴滴;而DM-1701毛细管色谱柱能将24 种有机氯和菊酯类农药有效分离,且色谱峰形良好,因此本实验选择DM-1701毛细管柱作为分离柱,同时优化了载气流速、进样口温度和程序升温速率等气相色谱条件。
2.2 样品提取方法的优化
本实验比较了正己烷-丙酮(9∶1,V/V)溶液、二氯甲烷、乙腈作为提取溶剂对牛奶中24 种有机氯及菊酯类农药残留的提取效果。结果表明,正己烷-丙酮作为提取溶剂时,提取液浓缩后颜色发黄,杂质较多,不易净化;二氯甲烷作为提取溶剂时,多数待测物提取效率较低;而乙腈提取效果最好。因此采用单一乙腈溶液对样品进行提取,优先乙腈是因其能够提取多种农药,同时又不会萃取出大量的脂溶性物质。乙腈是萃取水果、蔬菜等样品中各种极性农药的合适试剂,但实验表明用纯乙腈对牛奶样品中有机氯及菊酯类农药进行提取时不能获得令人满意的回收率。因此,本实验还需加入氯化钠作为盐析剂以减小样品乳化现象的发生;加入乙酸铅沉淀蛋白质,提高乙腈对牛奶中农残的萃取效果。结果表明,乙腈加氯化钠和乙酸铅作为提取溶液可以获得较高的提取效率。
2.3 样品净化方法的改进
牛奶样品基质复杂,经过萃取后还存在少量脂肪酸、酚类、碳水化合物等杂质,需要采用有效的分离和净化技术,才能有效检测其中的农药残留。本实验基于QuEChERS方法原理,针对牛奶样品基质,考察PSA、PSA+GCB、NH
2、NH
2+C
18作为分散固相萃取材料的处理效果。结果表明,采用PSA、PSA+GCB净化效果理想,但PSA由于含有叔胺基团,导致硫丹硫酸盐回收率偏低,而PSA+GCB导致大多数平面结构化合物无法完全解吸。选用碱性较弱的NH
2做为吸附材料,即能够获得较高的回收率,且可去除极性有机酸、酚类和某些糖类杂质,同时加入C
18、无水硫酸镁可以去除较多脂类和固醇类干扰及待净化液中微量水分,减少对仪器和色谱柱的损害。因此,本实验基于改进的QuEChERS方法,采用NH
2+C
18作为分散固相萃取材料对牛奶提取液进行净化处理,通过实验优化选择100 mg无水硫酸镁、50 mg NH
2和50 mg C
18作为分散固相萃取材料时,能够达到较好的样品净化效果,又能保证较高的目标物回收率。该方法明显缩短样品前处理时间和步骤,减少有机溶剂用量,而且简单、快速、有效,能够满足多种有机氯及菊酯类农药残留同时分析的要求,如图1所示。

图1 气相色谱图
Fig.1 GC chromatograms of mixture of pesticide standards, blank milk sample and spiked milk sample (at 10 μg/kg)
1. α-六六六;2.五氯硝基苯;3. γ-六六六;4.七氯;5.艾氏剂;6. β-六六六;7. δ-六六六;8.环氧七氯;9. α-硫丹;10.顺式氯丹;11.反式氯丹;12.氧化氯丹;13. p,p’-滴滴伊;14.狄氏剂;15. p,p’-滴滴滴;16. β-硫丹;17. p,p’-滴滴涕;18. o,p’-滴滴涕;19.硫丹硫酸盐;20.高效氯氰菊酯-1;21.高效氯氰菊酯-2;22.氰戊菊酯-1;23.氰戊菊酯-2;24.溴氰菊酯。
2.4 线性范围和检出限
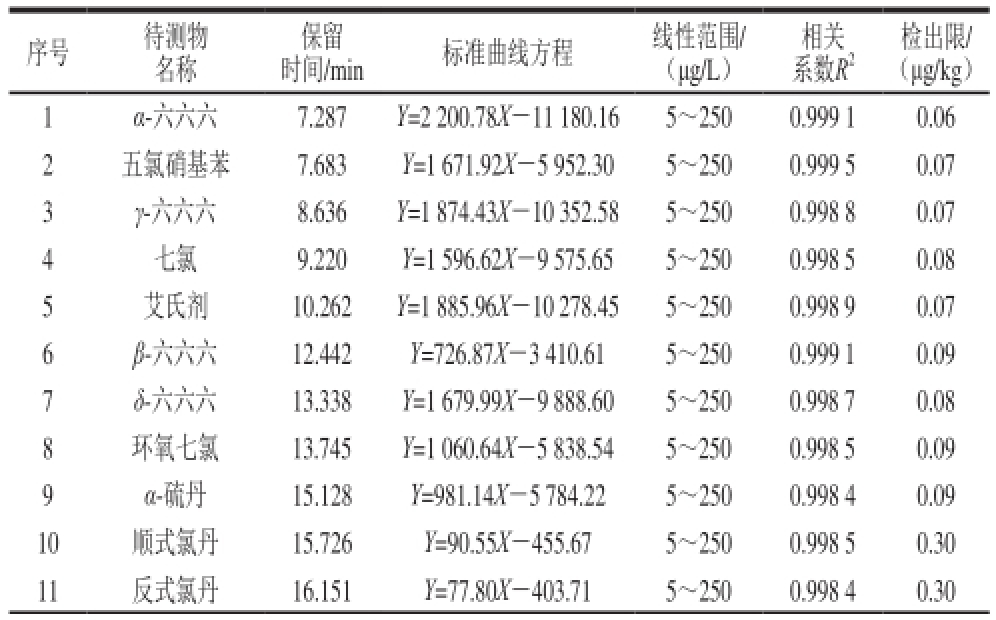
表1 线性范围和检出限
Table1 Standard curve equations, correlation coefficients (R
2), linear ranges, and limits of detection for the analytes
序号待测物名称系数R
2检出限/(μg/kg)1α-六六六7.287Y=2 200.78X-11 180.165~2500.999 10.06 2五氯硝基苯7.683Y=1 671.92X-5 952.305~2500.999 50.07 3γ-六六六8.636Y=1 874.43X-10 352.585~2500.998 80.07 4七氯9.220Y=1 596.62X-9 575.655~2500.998 50.08 5艾氏剂10.262Y=1 885.96X-10 278.455~2500.998 90.07 6β-六六六12.442Y=726.87X-3 410.615~2500.999 10.09 7δ-六六六13.338Y=1 679.99X-9 888.605~2500.998 70.08 8环氧七氯13.745Y=1 060.64X-5 838.545~2500.998 50.09 9α-硫丹15.128Y=981.14X-5 784.225~2500.998 40.09 10顺式氯丹15.726Y=90.55X-455.675~2500.998 50.30 11反式氯丹16.151Y=77.80X-403.715~2500.998 40.30时间/min标准曲线方程线性范围/(μg/L)保留相关
续表1

?
配制5~250 μg/L范围内5个质量浓度的混合标准溶液进样测定,以目标化合物的峰面积(Y)为纵坐标,以质量浓度X(μg/L)为横坐标绘制标准曲线并进行回归计算,得到线性方程,以3 倍信噪比计算检出限,见表1。24 种有机氯及菊酯类农药在5~250 μg/L范围内,标准曲线的线性相关系数均大于0.99,检出限为0.06~0.30 μg/kg。
2.5 方法的精密度和回收率结果
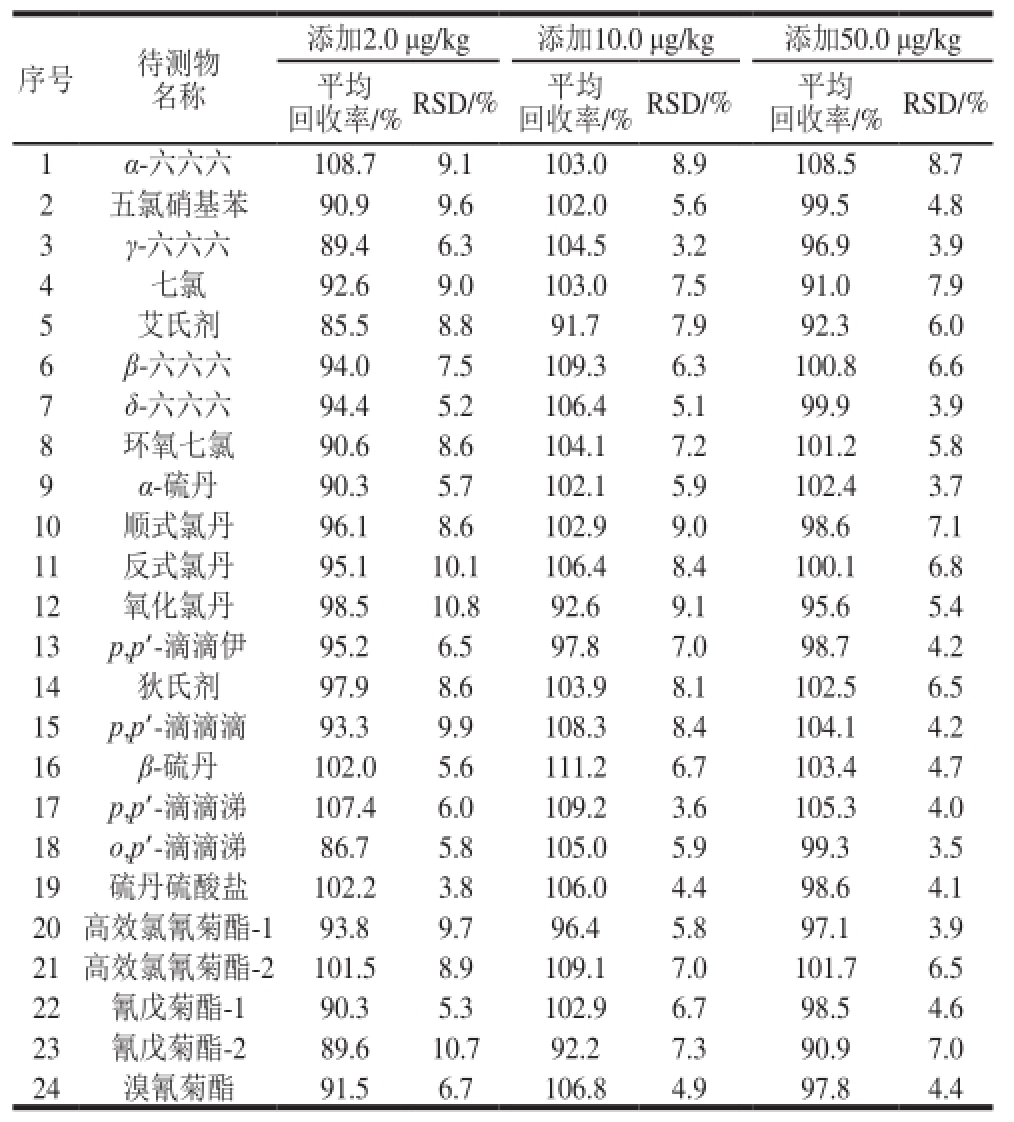
表2 空白基质中24 种有机氯及菊酯类农药残留的加标回收率和精密度(n=5)
Table2 Recoveries and precision (RSD) of 24 organochlorine and pyrethroid pesticide residues spiked in blank matrices (n = 5)
?
方法的准确度用回收率表示。在空白基质中做添加回收率实验,添加水平分别为2.0、10.0、50.0 μg/kg,每个添加水平重复测定5 次。方法的精密度用5 次平行测定的相对标准偏差(relative standard deviation,RSD)表示。实验结果表明,24 种有机氯及菊酯类农药的加标回收率范围为85.5%~111.2%,RSD为3.2%~10.8%,低于11%,见表2。
2.6 实际样品检测
采用本方法对当地超市中购买的6 种牛奶样品进行检测,结果在1 种样品中发现环氧七氯,检出量为1.8 µg/kg,小于GB 2763—2014《食品中农药最大残留限量》规定最大残留限量6 µg/kg,其他有机氯及菊酯类农药均未检出。
3 结 论
由于牛奶样品基质的复杂性及持久性污染物结构及性质的多样性等问题,牛奶样品中的农药残留分析通常不易获得准确而稳定的结果。本实验通过对实验条件等进行选择和优化,建立了QuEChERS-气相色谱法同时测定牛奶中24 种有机氯及菊酯类农药残留的分析方法。方法简单、快速、净化效果好、灵敏度高、重复性好,可满足牛奶中有机氯及菊酯类农药残留的快速筛查和定量分析要求。
参考文献:
[1] 卫生部, 中国国家标准化管理委员会. GB/T 5009.162—2008 动物性食品中有机氯农药和拟除虫菊酯农药多组分残留量的测定[S].北京: 中国标准出版社, 2008.
[2] 国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 23210—2008 牛奶和奶粉中511 种农药及相关化学品残留量的测定: 气相色谱-质谱法[S]. 北京: 中国标准出版社, 2008.
[3] 国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 23211—2008 牛奶和奶粉中493 种农药及相关化学品残留量的测定: 液相色谱-串联质谱法[S]. 北京: 中国标准出版社, 2008.
[4] 陈顺琴, 张勇, 李存雄, 等. 超声提取-气相色谱法测定鱼腥草中有机氯农药残留[J]. 理化检验(化学分册), 2015, 51(6): 833-836. DOI:10. 11973/lhjy-hx201506025.
[5] 李妮娜, 王举涛. 气相色谱法对丹参中有机氯农药残留的分析研究[J]. 安徽医药, 2015, 19(4): 656-659. DOI:10.3969/ j.issn.1009-6469.2015.04.012.
[6] 王裔耿, 普秋榕, 陈宏仙, 等. 气相色谱法测定农产品中8 种有机氯农药的残留[J]. 云南大学学报(自然科学版), 2015, 37(5): 750-757. DOI:10.7540/j.ynu.20150239.
[7] 刘毅, 郑国灿, 王晶, 等. 气相色谱-串联质谱法测定牛奶中20 种有机氯农药残留[J]. 检验检疫学刊, 2012, 22(4): 38-45. DOI:10.3969/ j.issn.1674-5354.2012.04.011.
[8] 方杰, 王凯雄. 气相色谱-离子阱质谱法测定海洋贝类中多残留有机氯农药、多氯联苯和多环芳烃[J]. 分析化学, 2007, 35(11): 1607-1613. DOI:10.3321/j.issn:0253-3820.2007.11.013.
[9] 颜慧, 张文丽, 蒋家骁, 等. 加速溶剂萃取-气相色谱/串联质谱法测定土壤中20 种有机氯农药[J]. 分析试验室, 2015, 34(6): 722-726. DOI:10.13595/j.cnki.issn1000-0720.2015.0156.
[10] 苏建峰, 钟茂生, 陈晶, 等. 气相色谱-质谱法与气相色谱法测定茶叶及茶叶加工品中295 种农药多残留[J]. 分析测试学报, 2015, 34(6): 625-638. DOI:10.3969/j.issn.1004-4957.2015.06.001.
[11] 王波, 李贤良, 张雷, 等. 气相色谱法测定火锅底料中的多种有机氯农药和拟除虫菊酯农药残留[J]. 分析化学, 2010, 38(10): 1433-1438. DOI:10.3724/SP.J.1096.2010.01433.
[12] 张园, 张琦, 王贤亲. 固相萃取-气相色谱串联质谱法测定温莪术中19 种有机氯和有机磷农药残留[J]. 药物分析杂志, 2012, 32(1): 95-98. DOI:10.16155/j.0254-1793.2012.01.001.
[13] 张权, 陈文生, 洪亮, 等. MSPD-GPC净化GC-ECD法测定辣椒酱中8 种有机氯农药残留分析[J]. 食品科学, 2014, 35(8): 295-298. DOI:10.7506/spkx1002-6630-201408059.
[14] KODBA Z C, VONCINA D B. A rapid method for the determination of organochlorine, pyrethroid pesticides and polychlorobiphenyls in fatty foods using GC with electron capture detection[J]. Chromatographia,2007, 66(7/8): 619-624. DOI:10.1365/s10337-007-0369-5.
[15] COVACI A, HURA C, SCHEPENS P. Determination of selected persistent organochlorine pollutants in human milk using solid phase disk extraction in human milk using solid phase disk extraction and narrow bore capillary GC-MS[J]. Chromatographia, 2001, 54(3/4): 247-252. DOI:10.1007/BF02492253.
[16] ZHAN J, LI J, LIU D, et al. A simple method for the determination of organochlorine pollutants and the enantiomers in oil seeds based on matrix solid-phase dispersion[J]. Food Chemistry, 2016, 194: 319-324. DOI:10.1016/j.foodchem.2015.07.067.
[17] SHEN Z, HE Z, WANG P, et al. Low-density magnetofluid dispersive liquid-liquid microextraction for the fast determination of organochlorine pesticides in watersamples by GC-ECD[J]. Analytica Chimica Acta, 2013, 793(2): 37-43. DOI:10.1016/j.aca.2013.07.050.
[18] 王水亮. 固相微萃取技术用于牛奶中有机氯类农药残留的检测[J]. 福建分析测试, 2012, 21(6): 29-32. DOI:10.3969/ j.issn.1009-8143.2012.06.010.
[19] 朱捷, 杨欣, 封锦芳, 等. 牛奶中有机氯农药及拟除虫菊酯农药多残留的HS-SPME-GC-MS分析方法研究[J]. 中国食品卫生杂志, 2007,19(4): 289-293. DOI:10.13590/j.cjfh.2007.04.001.
[20] LEHOTAY S J, KOK A, HIEMSTRA M, et al. Validation of a fast and easy method for the determination of residues from 229 pesticides in fruits and vegetables using gas and liquid chromatography and mass spectrometric detection[J]. Journal of AOAC International, 2005,88(2): 595-614.
[21] LEHOTAY S J, SON K A, KWON H, et al. Comparison of QuEChERS sample preparation methods for the analysis of pesticide residues in fruits and vegetables[J]. Journal of Chromatography A,2010, 1217(16): 2548-2560. DOI:10.1016/j.chroma.2010.01.044.
[22] MOLINA-RUIZ J M, CIESLIK E, WALKOWSK I. Optimization of the QuEChERS method for determination of pesticide residues in chicken liver samples by gas chromatography-mass spectrometry[J]. Food Analytical Methods, 2015, 8(4): 898-906. DOI:10.1007/s12161-014-9966-8.
[23] LUO Y, LI X, JIANG X, et al. Magnetic graphene as modified quick, easy, cheap, effective, rugged and safe adsorbent for the determination of organochlorine pesticide residues in tobacco[J]. Journal of Chromatography A, 2015, 1406: 1-9. DOI:10.1016/ j.chroma.2015.05.066.
[24] RIZZETTI T M, KEMMERICH M L, MARTINS M L, et al. Optimization of a QuEChERS based method by means of central composite design for pesticide multiresidue determination in orange juice by UHPLC-MS/MS[J]. Food Chemistry, 2016, 196: 25-33. DOI:10.1016/j.foodchem.2015.09.010.
[25] HOLMES B, DUNKIN A, SCHOEN R, et al. Single-laboratory ruggedness testing and validation of a modified QuEChERS approach to quantify 185 pesticide residues in salmon by liquid chromatographyand gas chromatography-tandem mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2015, 63(21): 5100-5106. DOI:10.1021/jf5055276.
Determination of 24 Organochlorine and Pyrethroid Pesticide Residues in Milk by Modified QuEChERS Method and Gas Chromatography
DENG Xiaojuan
1, LI Wenbin
2, JIN Lichuan
2, GU Chunyan
2, CHEN Xiaoping
1,*
(1. Analysis Center, Tianjin University, Tianjin 300072, China; 2. Dikma Technologies Inc., Tianjin 300402, China)
Abstract:In this study, a modified quick, easy, cheap, effective, rugged and safe (QuEChERS ) approach was applied for the determination of 24 organochlorine pesticide and pyrethroid residues in milk samples by gas chromatography-electron capture detector (GC-ECD). Milk samples were extracted with acetonitrile, purified with the modified QuEChERS approach,and detected by GC-ECD. The external standard method was used for quantification. Excellent linearities were achieved for all target analytes in the range of 5-250 μg/L with correlation coefficients greater than 0.99. The limits of detection (LODs)ranged from 0.06 to 0.30 µg/kg. The recoveries were in the range of 85.5%-111.2%, with relative standard deviations (RSDs)less than 11%. In summary, the proposed method was simple, accurate, efficient and adequate for the rapid screening and quantitative analysis of organochlorine pesticide and pyrethroid residues in milk.
Key words:QuEChERS (quick, easy, cheap, effective, rugged and safe); gas chromatography; organochlorine; pyrethroid pesticide; milk
DOI:10.7506/spkx1002-6630-201618023
中图分类号:O657
文献标志码:A
文章编号:1002-6630(2016)18-0141-05
引文格式:
邓小娟, 李文斌, 晋立川, 等. QuEChERS-气相色谱法测定牛奶中24 种有机氯及菊酯类农药残留[J]. 食品科学, 2016,37(18): 141-145. DOI:10.7506/spkx1002-6630-201618023. http://www.spkx.net.cn
DENG Xiaojuan, LI Wenbin, JIN Lichuan, et al. Determination of 24 organochlorine and pyrethroid pesticide residues in milk by modified QuEChERS method and gas chromatography[J]. Food Science, 2016, 37(18): 141-145. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201618023. http://www.spkx.net.cn
收稿日期:2016-03-28
基金项目:国家自然科学基金青年科学基金项目(201506147)
作者简介:邓小娟(1980—),女,工程师,博士,研究方向为色谱分析。E-mail:lilinjia2009@126.com
*通信作者:陈小平(1960—),男,工程师,大专,研究方向为仪器分析。E-mail:fxzx_tju@163.com



