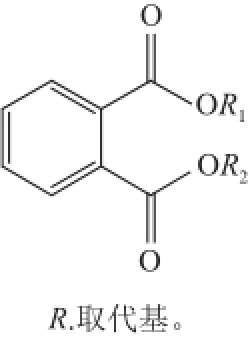
图1 邻苯甲酸酯的结构通式
Fig.1 General chemical structure of PAEs
胡爱鹏 1,刘玉兰 1,*,张明明 1,陈 刚 2,安 骏 2
(1.河南工业大学粮油食品学院,河南 郑州 450001;2.中粮食品营销有限公司,北京 100020)
摘 要:建立有机溶剂萃取、N-正丙基乙二胺(N-(n-propyl) ethylenediamine,PSA)玻璃固相萃取柱净化、内标法定量、气相色谱-质谱法直接测定植物油料中邻苯二甲酸二甲酯(dimethyl phthalate,DMP)、邻苯二甲酸二乙酯(diethyl phthalate,DEP)、邻苯二甲酸二异丁酯(di-iso-butyl phthalate,DIBP)、邻苯二甲酸二丁酯(dibutyl phthalate,DBP)、邻苯二甲酸丁基苄基酯(butyl benzyl phthalate,BBP)、邻苯二甲酸二(2-乙基)己酯(di(2-ethtlhexyl) phthalate,DEHP)和邻苯二甲酸正辛酯(di-n-octyl phthalate,DNOP)7 种邻苯二甲酸酯的方法。该方法在0.01~2.0 mg/L范围内具有良好的线性关系,相关系数R 2在0.999 8~1.000 0之间,仪器检出限(R SN=3)为0.01~0.02 μg/L,定量限(R SN=10)为0.03~0.06 μg/L。7 种目标物在0.1、0.5、1.0 mg/kg的加标水平下平均回收率为77.2%~98.8%,相对标准偏差为0.62%~9.37%(n=6)。采用本方法对不同种类、不同产地的76 个植物油料样品中7 种邻苯二甲酸酯类塑化剂含量进行测定。结果表明:所有受检植物油料样品中均检出DBP和DEHP,范围分别为(0.015±0.002)~(0.584±0.012) mg/kg和(0.085±0.006)~(2.334±0.016) mg/kg,检出率均为100%(76/76);DIBP、DEP、DMP、BBP、DNOP检出率分别为98.7%(75/76)、64.5%(49/76)、63.2%(48/76)、32.9%(25/76)、5.3%(4/76)。17 个油料样品中DBP含量超出国家标准限量(≤0.3 mg/kg),超标率为22.4%;1 个油料样品中DEHP含量超出国家标准限量(≤1.5 mg/kg),超标率为1.3%。
关键词:植物油料;邻苯二甲酸酯;固相萃取;内标法定量;气相色谱-质谱法
塑化剂又称增塑剂,主要包括脂肪族二元酸酯类、多元醇酯类、苯多酸酯类、聚酯类、苯二甲酸酯类(包括邻苯二甲酸酯类和对苯二甲酸酯类)、环氧类、柠檬酸类等,其中以邻苯二甲酸酯(phthalatic acid esters,PAEs)类塑化剂的使用最为普遍 [1-2]。PAEs是由一个刚性平面芳环和2 个可塑非线性脂肪链组成 [3],通式如图1所示 [4],占位符R 1和R 2一般代表相同的基团,当R 1和R 2为甲基时,代表邻苯二甲酸二甲酯(dimethyl phthalate,DMP);为乙基时,代表邻苯二甲酸二乙酯(diethyl phthalate,DEP) [5]。

图1 邻苯甲酸酯的结构通式
Fig.1 General chemical structure of PAEs
PAEs类塑化剂可以增加产品明度、弹性、耐用性等而被广泛应用于各工业领域 [6-8]。由于塑化剂与塑料基质分子之间没有紧密的化学键结合,因此很容易从聚合物中迁移出来污染与之接触的基质环境 [9-10],成为全球最广泛的环境污染物之一 [2]。有调查表明,我国大气、湖泊、河流和土壤受塑化剂污染严重 [11-13]。塑化剂的急性毒性很低,但长期接触塑化剂或者食用被塑化剂污染的食品,轻则会引起生殖系统的异常,重则可能致畸致癌 [14-17]。GB 9685—2008《食品容器、包装材料用添加剂使用卫生标准》和《卫办监督函{2011}551号》规定食品和食品添加剂中塑化剂成分邻苯二甲酸二(2-乙基)己酯(di(2-ethtlhexyl) phthalate,DEHP)、邻苯二甲酸二异壬酯、邻苯二甲酸二丁酯(dibutyl phthalate,DBP)的最大残留量分别为1.5、9.0、0.3 mg/kg,但并未明确规定植物油料中塑化剂限量。植物对PAEs有一定的富集作用 [18-20],植物油料中的PAEs在制油过程迁移到植物油中很可能是食用植物油受PAEs污染的重要成因。因此,很有必要对植物油料中PAEs污染情况进行研究。
食用油脂中PAEs检测方法有气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用法 [21-22]、高效液相色谱法 [23]、高效液相色谱-串联质谱法 [24]。但对植物油料中PAEs的检测,需要先将油料中的油脂萃取出来,再对油脂中的PAEs进行检测,存在着检测路线长、耗时长、对油料中PAEs萃取不完全、检测准确度低、仪器检测线高等缺点和局限性。此外,对样品前处理的净化过程要求高,需要经过凝胶渗透色谱处理,成本较高。本实验研究建立固相萃取、GC-MS法直接检测植物油料中PAEs的方法,该方法前处理简单、分析时间短、检出限低、准确度高、适用性强。利用所建立的检测方法对76 个植物油料样品中PAEs进行测定,为植物油料中PAEs直接检测和PAEs风险控制提供数据基础。
1.1 材料与试剂
76 个植物油料样品,共11 类,分别为大豆、花生、油菜籽、芝麻、亚麻籽、玉米胚芽、油茶籽、文冠果、花椒籽、美藤果、核桃仁。其中大豆2 个、花生仁13 个、油菜籽4 个、芝麻12 个、亚麻籽2 个、玉米胚芽16 个、油茶籽仁8 个、文冠果仁4 个、花椒籽仁6 个、美藤果仁8 个、核桃仁1 个,均来源于油脂生产企业或原料主产区。
DMP、DEP、DBP、邻苯二甲酸丁基苄基酯(butyl benzyl phthalate,BBP)、DEHP和邻苯二甲酸正辛酯(di-n-octyl phthalate,DNOP)标准品(纯度≥98.0%)美国Supelco公司;邻苯二甲酸二异丁酯(di-iso-butyl phthalate,DIBP)标准品(纯度99.0%) 美国Dr. Ehrenstorfer GmbH公司;7 种氘代同位素内标(d 4-DMP、d 4-DEP、d 4-DIBP、d 4-DBP、d 4-BBP、d 4-DEHP和d 4-DNOP)(纯度≥99%) 上海有机化学研究所;正己烷、丙酮、乙腈、二氯甲烷,均为色谱纯;实验所用水均为超纯水(18.25 MΩ·cm)。
1.2 仪器与设备
Trace1310-ISQ GC-MS联用仪、TG-5MS毛细管色谱柱(30 m×0.25 mm,0.25 μm) 美国Thermo Fisher公司;ProElut N-正丙基乙二胺(N-(n-propyl)ethylenediamine,PSA)固相萃取柱(1 g、6 mL) 上海安谱科学仪器有限公司;R-201Ⅱ旋转蒸发器 上海申顺生物科技有限公司;MTN-2800W氮吹浓缩仪 天津奥特赛恩斯仪器有限公司;MVS-1旋涡混合器 北京金北德工贸有限公司;FW-100高速万能粉粹机 北京永光明医疗仪器有限公司;LD5-10低速离心机 北京京立离心机有限公司;Molecular超纯水器 上海摩勒科学仪器有限公司。
1.3 方法
1.3.1 标准溶液的配制及标准曲线的绘制
单标储备液:分别称取100 mg(精确至0.1 mg)上述7 种塑化剂标样,用正己烷定容于100 mL容量瓶,配制成1 000 mg/L的单标储备液,4 ℃冰箱中保存备用。再将7 种氘代同位素内标混合物用正己烷稀释成1.0 mg/L的内标储备液,4 ℃冰箱中保存备用。
混合标准储备液:准确移取上述内标储备液各1 mL,不同质量浓度的7 种PAEs混合标准溶液用正己烷配制成0.01、0.05、0.1、0.5、1.0、2.0 mg/L的工作液(其中内标质量浓度为0.1 mg/L),4 ℃冰箱中保存备用。
标准曲线的绘制:以标准溶液中目标物质量浓度/内标物质量浓度为横坐标,标准溶液中目标物峰面积/内标物峰面积为纵坐标绘制标准曲线,采用内标法定量。
1.3.2 样品前处理
取一定量的植物油料于恒温干燥箱中105 ℃烘烤30 min,然后进行粉碎全部过筛(30 目),称取筛下物1.0 g(精确至0.001 g)于10 mL玻璃离心管中,加入100 µL氘代内标,然后向离心管中加入5 mL正己烷溶液,涡旋混合2 min,超声5 min,以4 500 r/min离心5 min,收集正己烷层,重复上述步骤1 次,合并2 次提取液旋转蒸发至2 mL,-20 ℃冷冻过后,4 500 r/min离心2 min,取上层清液待净化。将待净化液通过PSA玻璃固相萃取柱净化,收集上样液,而后依次加入5 mL正己烷溶液,5 mL丙酮-正己烷(1∶9,V/V)溶液洗脱,并收集洗脱液,合并上样液与洗脱液在40 ℃条件下旋转蒸发至干,然后氮气吹干,乙腈定容至1 mL,供GC-MS检测。
1.3.3 回收率及重复性测定
取均匀的同一油料样品,分为3 组,构成高、中、低3 个加标组及一个空白对照组。加标水平分别为0.1、0.5、1.0 mg/kg,每个水平重复测定6 次,计算回收率,并计算相对标准偏差(relative standard deviation,RSD),表示方法的重复性。
1.3.4 GC-MS条件
GC条件:TG-5MS气相毛细管色谱柱(30 m× 0.25 mm,0.25 μm);进样口温度300 ℃;程序升温:60 ℃保持1 min,然后以20 ℃/min升至220 ℃,保持1 min,再以5 ℃/min升至280 ℃,保持4 min;脉冲不分流模式进样,进样量1.0 μL;载气:氦气(纯度≥99.999%),恒流模式,流速1.0 mL/min。
MS条件:电子电离源;电子能量70 eV;离子源温度300 ℃;传输线温度300 ℃;灯丝电流25 μA。溶剂延迟6 min,全扫描定性,选择离子扫描定量。在选择离子监测模式下,7 种PAEs的保留时间、定性定量特征离子见表1。
表1 选择反应监测扫描模式下7 种PAEs的保留时间及特征离子
Table1 Characteristic ions and retention times of 7 PAEs under SIM mode

PAEs保留时间/min定性离子定量离子DMP7.76163、77、135、194163、167 DEP8.63149、105、177、222149、153 DIBP10.38149、223、205、167149、153 DBP11.12149、223、205、121149、153 BBP15.11149、91、206、238149、153 DEHP17.54149、167、279、113149、153 DNOP19.82149、279、167、261149、153
2.1 样品前处理条件的优化
2.1.1 提取溶剂的选择
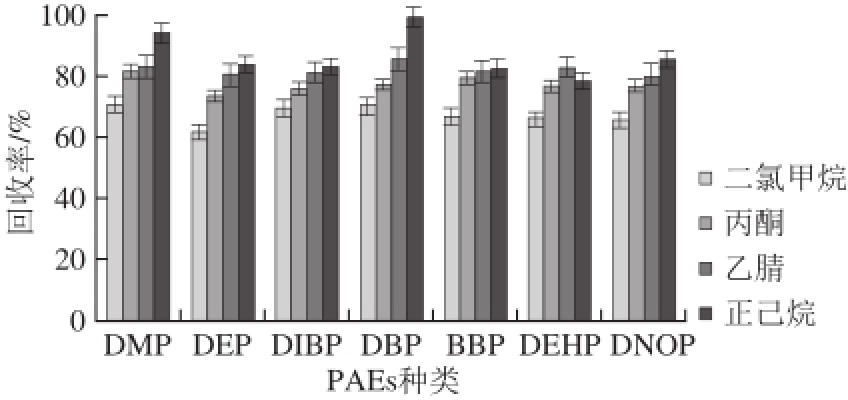
图2 提取溶剂对7 种PAEs回收率的影响
Fig.2 Effect of different extraction solvents on recovery of 7 PAEs
取1.0 g(精确至0.001 g)粉碎过筛(30 目)后的大豆粉末,向其加入10 mg/L的7 种混合标准溶液(加标量为1 mg/kg),同时加入100 µL氘代内标(内标质量浓度1 mg/L),按照1.3.2节方法,分别采用二氯甲烷、丙酮、乙腈和正己烷各5 mL进行提取,提取2 次,每次超声5 min,比较不同提取溶剂对7 种PAEs回收率的影响。由图2可知,提取溶剂为正己烷时,DEHP的回收率为77.1%,其他各目标物的平均回收率均在86%左右,总体提取效果最好,其次为乙腈,二氯甲烷对7 种PAEs的提取效果最差,因此选择正己烷作为油料油籽中PAEs的提取溶剂。
2.1.2 提取次数的选择
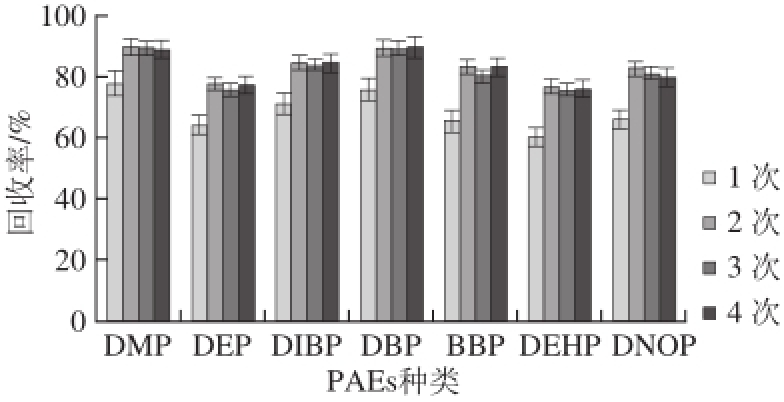
图3 提取次数对7 种PAEs回收率的影响
Fig.3 Effect of number of extraction cycles on recovery of 7 PAEs
取1.0 g(精确至0.001 g)粉碎过筛(30 目)后的大豆粉末,向其加入10 mg/L的7 种混合标准溶液(加标量为1 mg/kg),同时加入100 µL氘代内标(内标质量浓度1 mg/L),按照1.3.2节方法,分别用5 mL正己烷提取1、2、3、4 次,每次超声5 min,比较不同提取次数对7 种PAEs回收率的影响。由图3可知,用正己烷提取1 次时,各目标物的回收率相对较低,平均在69%左右,当提取2 次时,DEHP的回收率为78.4%,其他各目标物的回收率平均已达到84%左右。随着提取次数增加,各目标物的回收率基本不变,因此选择用5 mL正己烷提取2 次,既能缩短前处理耗时提高效率,还能节约试剂用量降低实验成本。
2.1.3 超声时间的选择
取1.0 g(精确至0.001 g)粉碎过筛(30 目)后的大豆粉末,向其加入10 mg/L的7 种混合标准溶液(加标量为1 mg/kg),同时加入100 µL氘代内标(内标质量浓度1 mg/L),按照1.3.2节方法,分别用5 mL正己烷提取2 次,每次超声时间分别为5、10、20、30 min,比较不同超声时间对7 种PAEs回收率的影响。由图4可知,随着超声时间的延长,各目标物的总体回收率逐渐降低。因此,在保证回收率的情况下,同时缩短整个油料油籽中PAEs的提取时间,选用超声时间为5 min。
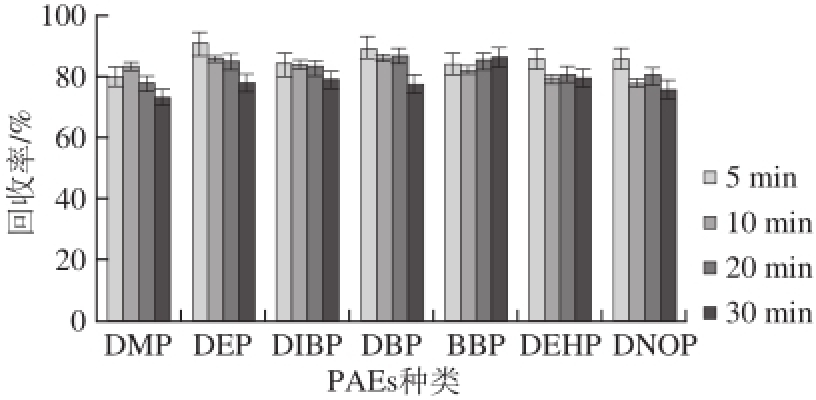
图4 超声时间对7 种PAEs回收率的影响
Fig.4 Effect of different ultrasound treatment durations on recovery of 7 PAEs
2.2 标准曲线、回收率和精密度结果
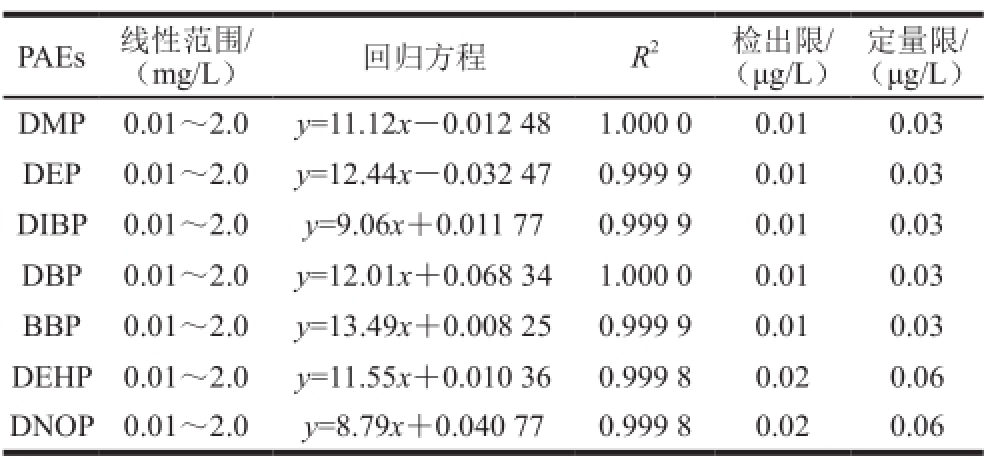
在选定的GC-MS分析条件下对1.3.1节中配制的标准溶液进行分析,线性方程和相关系数由Xcalibur软件给出。以3 倍信噪比计算检测限,10 倍信噪比计算定量限。7 种PAEs的线性范围、回归方程、检出限、定量限及R 2见表2。
表2 7 种PAEs的线性范围、回归方程、R
2、定量限和检出限
Table2 Linear ranges, regression equations, correlation coefficients,LODs and LOQs for 7 PAEs
?
由表2可以看出,7 种PAEs的R 2值在0.999 8~1.000 0之间,各目标物线性关系良好,7 种PAEs的仪器检出限(R SN=3)在0.01~0.02 µg/L之间,定量限(R SN=10)在0.03~0.06 µg/L之间,可以满足实验检测需要。
为保证测定结果的准确性,采用1.3.2节方法对某一产地的大豆原料进行低、中、高3 个不同质量浓度的加标回收实验,3 种加标量分别为0.1、0.5、1.0 mg/L。每个加标量平行测定6 次,计算加标回收率以及RSD。由表3可知,7 种PAEs的加标回收率在77.2%~98.8%之间,RSD在0.62%~9.37%之间,表明方法对植物油料中PAEs的分析具有良好的重复性和精密度。
表3 不同加标水平的7 种PAEs回收率及RSD
Table3 Recoveries and RSDs of 7 PAEs at different spiked levels
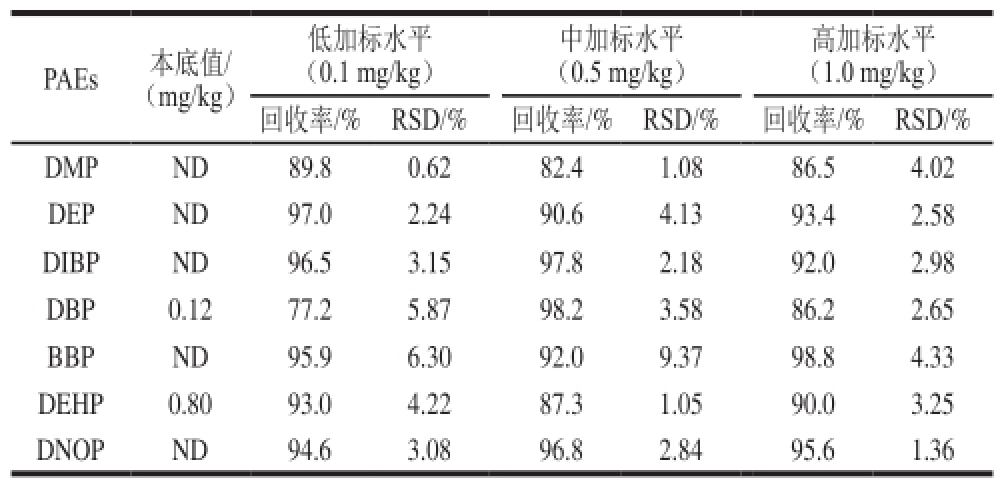
注:ND.未检出。下表同。
?
2.3 植物油料中PAEs含量测定
采用本检测方法对76 个油料样品中PAEs含量进行检测,检测结果见表4。不同植物油料样品中7 种PAEs的平均含量水平见表5。
表4 不同植物油料样品中7 种PAEs的含量水平
Table 4 The levels of 7 PAEs in different oil feedstock samples
mg/kg
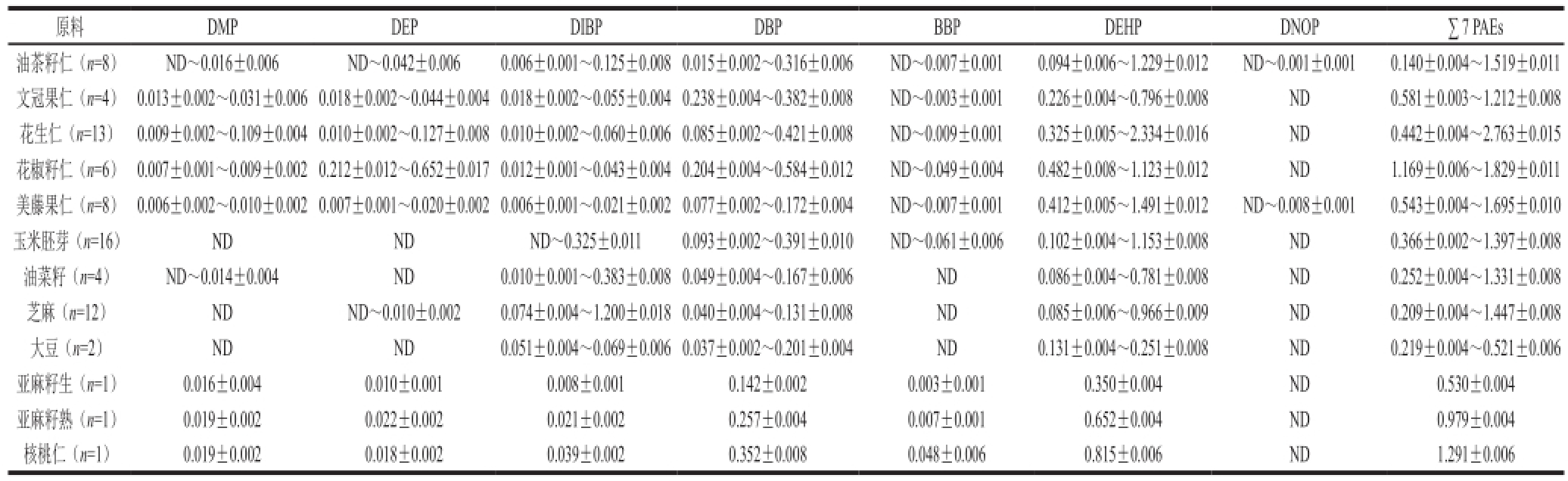
注:∑7 PAEs. DMP、DEP、DIBP、DBP、BBP、DEHP和DNOP 7 种PAEs含量总和。下表同。
原料DMPDEPDIBPDBPBBPDEHPDNOP∑ 7 PAEs油茶籽仁(n=8)ND~0.016±0.006ND~0.042±0.0060.006±0.001~0.125±0.0080.015±0.002~0.316±0.006ND~0.007±0.0010.094±0.006~1.229±0.012ND~0.001±0.0010.140±0.004~1.519±0.011文冠果仁(n=4)0.013±0.002~0.031±0.0060.018±0.002~0.044±0.0040.018±0.002~0.055±0.0040.238±0.004~0.382±0.008ND~0.003±0.0010.226±0.004~0.796±0.008ND0.581±0.003~1.212±0.008花生仁(n=13)0.009±0.002~0.109±0.0040.010±0.002~0.127±0.0080.010±0.002~0.060±0.0060.085±0.002~0.421±0.008ND~0.009±0.0010.325±0.005~2.334±0.016ND0.442±0.004~2.763±0.015花椒籽仁(n=6)0.007±0.001~0.009±0.0020.212±0.012~0.652±0.0170.012±0.001~0.043±0.0040.204±0.004~0.584±0.012ND~0.049±0.0040.482±0.008~1.123±0.012ND1.169±0.006~1.829±0.011美藤果仁(n=8)0.006±0.002~0.010±0.0020.007±0.001~0.020±0.0020.006±0.001~0.021±0.0020.077±0.002~0.172±0.004ND~0.007±0.0010.412±0.005~1.491±0.012ND~0.008±0.0010.543±0.004~1.695±0.010玉米胚芽(n=16)NDNDND~0.325±0.0110.093±0.002~0.391±0.010ND~0.061±0.0060.102±0.004~1.153±0.008ND0.366±0.002~1.397±0.008油菜籽(n=4)ND~0.014±0.004ND0.010±0.001~0.383±0.0080.049±0.004~0.167±0.006ND0.086±0.004~0.781±0.008ND0.252±0.004~1.331±0.008芝麻(n=12)NDND~0.010±0.0020.074±0.004~1.200±0.0180.040±0.004~0.131±0.008ND0.085±0.006~0.966±0.009ND0.209±0.004~1.447±0.008大豆(n=2)NDND0.051±0.004~0.069±0.0060.037±0.002~0.201±0.004ND0.131±0.004~0.251±0.008ND0.219±0.004~0.521±0.006亚麻籽生(n=1)0.016±0.0040.010±0.0010.008±0.0010.142±0.0020.003±0.0010.350±0.004ND0.530±0.004亚麻籽熟(n=1)0.019±0.0020.022±0.0020.021±0.0020.257±0.0040.007±0.0010.652±0.004ND0.979±0.004核桃仁(n=1)0.019±0.0020.018±0.0020.039±0.0020.352±0.0080.048±0.0060.815±0.006ND1.291±0.006
表5 不同植物油料样品中7 种PAEs的平均含量水平
Table5 The average levels of 7 PAEs in different oil feedstock samples mg/kg
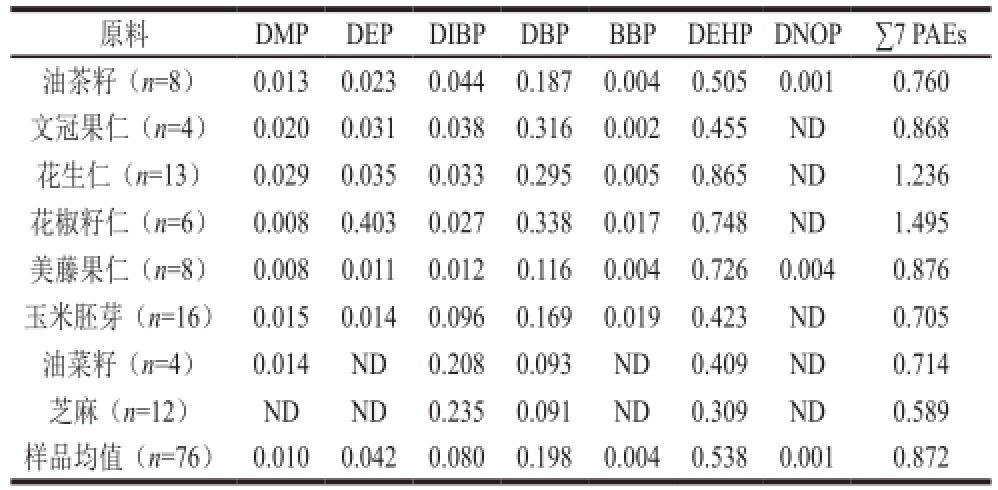
原料DMPDEPDIBPDBPBBPDEHPDNOP∑7 PAEs油茶籽(n=8)0.013 0.023 0.044 0.187 0.004 0.505 0.001 0.760文冠果仁(n=4)0.020 0.031 0.038 0.316 0.002 0.455 ND 0.868花生仁(n=13)0.029 0.035 0.033 0.295 0.005 0.865 ND 1.236花椒籽仁(n=6)0.008 0.403 0.027 0.338 0.017 0.748 ND 1.495美藤果仁(n=8)0.008 0.011 0.012 0.116 0.004 0.726 0.004 0.876玉米胚芽(n=16)0.015 0.014 0.096 0.169 0.019 0.423 ND 0.705油菜籽(n=4)0.014 ND0.208 0.093 ND 0.409 ND 0.714芝麻(n=12)NDND0.235 0.091 ND0.309 ND0.589样品均值(n=76)0.010 0.042 0.080 0.198 0.004 0.538 0.001 0.872
由表4可以看出,76 个油料样品中均检测出DBP和DEHP,含量范围为(0.015±0.002)~(0.584±0.012)mg/kg和(0.085±0.006)~(2.334±0.016) mg/kg;DMP、DEP、DIBP、BBP、DNOP检出率分别为63.2%(48/76)、64.5%(49/76)、98.7%(75/76)、32.9%(25/76)、5.3%(4/76)。对照国标要求DEHP不大于1.5 mg/kg、DBP不大于0.3 mg/kg,所测样品中有1 个样品DEHP超标(花生),超标率为1.3%,17 个油料DBP超标(17/76),超标率为22.4%,其中花生仁超标率为61.5%(8/13),文冠果仁50%(2/4),花椒籽仁超标率为50%(3/6),油茶籽仁超标率25%(2/8),玉米胚超标率为6.25%(1/16),还有一个核桃仁DBP超标。所有油料样品中都不同程度检测出PAEs,这与油料作物生长的环境受PAEs污染有关。受检油料样品中DBP与DEHP的含量约占∑7 PAEs的70%~96%,这与文献[25]报道的大气、水体及土壤中PAEs污染物主要为DBP、DEHP相一致。受检油料中短碳链的PAEs组分如DMP、DEP含量相对较低,可能缘于这些短碳链的PAEs组分有较高的水溶性和较小的辛醇分配系数,容易被微生物分解或经其他途径分解有关。
由表5可以看出,9 类植物油料样品中∑7 PAEs的平均含量依次为花椒籽仁>花生仁>美藤果仁>文冠果仁>油茶籽仁>菜籽仁>玉米胚芽>芝麻,其差别可能是由于油料作物对土壤和大气中PAEs的富集吸收程度不同所造成。9 类植物油料样品无论按∑7 PAEs含量或DBP含量还是DEHP含量排序,草本油料中花生仁含量最高,究其原因,可能与近年推行的花生地膜覆盖栽培技术有关,塑料薄膜中的PAEs在长时间风吹日晒及微生物的作用下会迁移到周围的土壤、空气和水体中,使得花生在生长过程中直接或间接过多的接触PAEs而受污染。5 种木本油料∑7 PAEs平均含量明显高于草本油料,这还可能与它们具有较大叶面,能从大气和水中吸收更多的PAEs有关。目前GB 19641—2009《植物油料卫生标准》中并没有对DBP、DEHP等PAEs做出限量要求,因此,植物油料中PAEs的安全风险应该引起重视并对相关标准做出修订和完善。
本研究建立有机溶剂萃取、硅胶PSA玻璃柱净化、内标法定量、GC-MS联用法直接测定植物油料中7 种邻苯二甲酸酯类塑化剂的方法。7 种邻苯二甲酸酯类塑化剂的定量限为0.03~0.06 µg/L,平均回收率范围为77.2%~98.8%。利用该方法对76 个油料样品进行检测,DBP、DEHP、∑7 PAEs均值分别为0.198、0.538、0.872 mg/kg,含量范围分别为(0.015±0.002)~(0.584±0.012)、(0.085±0.006)~(2.334±0.016)、(0.140±0.004)~(2.763±0.015) mg/kg。对照国家相关标准,17 个油料样品DBP超过限量,超标率为22.4%(17/76);1 个油料样品DEHP超过的限量,超标率为1.3%(1/76)。从总体来看,植物油料中DBP和DEHP超标率并不高,但考虑到这2 种塑化剂都是脂溶性的,会随着制油过程进入到食用油脂中,特别是花生仁、芝麻、大豆等既可以作为提取食用油的原料又可以直接食用,塑化剂安全风险更应引起重视,以确保粮油食品的安全。
参考文献:
[1] 向斌. 食品包装中塑化剂问题解析[J]. 中国包装, 2011(9): 51-53. DOI:10.3969/j.issn.1003-062X.2011.09.017.
[2] 王瑞元, 金青哲, 安骏, 等. 塑化剂与粮油制品的安全[J]. 中国油脂,2013, 38(4): 1-4. DOI:10.3969/j.issn.1003-7969.2013.04.001.
[3] 吴莉莉. 邻苯二甲酸酯类增塑剂的检测标准现状分析[J]. 塑料工业,2011, 9(1): 11-15.
[4] XU L C. Phthalate esters in foods sources, occurrence andanalytical methods[J]. Comprehensive Reviews in Food Science and Food Safety, 2010, 9(1): 21-43. DOI:10.1111/j.1541-4337.2009.00093.x.
[5] HE L, GIELEN G, BOLAN N S, et al. Contamination and remediation of phthalic acid esters in agricultural soils in China: a review[J]. Agronomy for Sustainable Development, 2015, 35(2): 519-534. DOI:10.1007/s13593-014-0270-1.
[6] 曹九超. 食用油中邻苯二甲酸酯的测定及其迁移动力学的研究[D].无锡: 江南大学, 2014.
[7] RADEL R A, PEROVICH L J. Endocrine disrupting chemicals in indoor and outdoor air[J]. Atmospheric Environment, 2009, 43(1): 170-181. DOI:10.1016/j.atmosenv.2008.09.025.
[8] WEUVE J, SANCHEZ B N, CALAFAT A M, et al. Exposure to phthalates in neonatal intensive care unit infants: urinary concentrations of monoesters and oxidative metabolites[J]. Environmental Health Perspectives, 2006: 1424-1431. DOI:10.1289/ehp.8926.
[9] YUAN S Y, LIU C, LIAO C S, et al. Occurrence and microbial degradation of phthalate esters in Taiwan river sediments[J]. Chemosphere, 2002, 49(10): 1295-1299. DOI:10.1016/S0045-6535(02)00495-2.
[10] WITTASSEK M, KOCH H M, ANGERER J, et al. Assessing exposure to phthalates-the human biomonitoring approach[J]. Molecular Nutrition and Food Research, 2011, 55(1): 7-31. DOI:10.1002/ mnfr.201000121.
[11] 王春兰. 浅析地膜覆盖对环境污染的防治与建议[J]. 农业与技术,2013, 33(7): 18-25. DOI:10.3969/j.issn.1671-962X.2013.07.017.
[12] 王序俭, 曹肆林, 王敏, 等. 农田地膜残留现状, 危害及防治措施研究[C]//中国环境科学学会2013年学术年会论文集, 2013: 5023-5028.
[13] CHEN L, YAN Z, LU X L, et al. Exposure assessment of phthalates in non-occupational populations in China[J]. Science of the Total Environment, 2012, 428: 60-69. DOI:10.1016/j.scitotenv.2012.03.090.
[14] EMA M, MIYAWAKI E. Adverse effects on development of the reproductive system in male offspring of rats given monobutyl phthalate, a metabolite of dibutyl phthalate, during late pregnancy[J]. Reproductive Toxicology, 2001, 15: 189-194. DOI:10.1016/S0890-6238(01)00111-3.
[15] ARCAKI F A, COSTA C, IMPERATORE C, et al. Oral toxicity of bis(2-ethylhexyl) phthalate during pregnancy and suckling in the Long-Evans rat[J]. Food and Chemical Toxicology, 1998, 36(11): 963-970. DOI:10.1016/S0278-6915(98)00065-9.
[16] XU C K, WANG X H, TANG S B. Effects of di-(2-ethylhexyl)phthalate on rat ovarian function[J]. Journal of Medical Biochemistry,2011, 30: 309-316. DOI:10.2478/v10011-011-0026-2.
[17] KONSTANTIN S, IRINA S, OLLE S. Inhibitory effects of monoethylhexyl phthalate on steroidogenesis in immature and adultrat leydig in vitro[J]. Reprod Toxicol, 2008, 25(4): 485-490. DOI:10.1016/ j.reprotox.2008.05.057.
[18] FU X W, DU Q Z. Uptake of di-(2-ethylhexyl) phthalate of vegetables from plastic film greenhouses[J]. Agricultural and Food Chemistry,2011, 59: 11585-11588. DOI:10.1021/jf203502e.
[19] 王绪强. 植物累积有机污染物DEHP能力及其特异性研究[D]. 杭州: 浙江工商大学, 2009.
[20] 曾巧云, 莫测辉, 蔡全英, 等. 菜心对邻苯二甲酸酯(PAEs)吸收途径的初步研究[J]. 农业工程学报, 2005, 21(8): 137-141. DOI:10.3321/ j.issn:1002-6819.2005.08.030.
[21] 张明明, 刘玉兰, 马宇翔, 等. 固相萃取-气相色谱-质谱法测定食用油中7 种邻苯二甲酸酯类塑化剂[J]. 中国油脂, 2015(2): 56-60.
[22] 王淑惠, 刘印平, 王丽. 气相色谱串接质谱快速检测植物油中邻苯二甲酸酯[J]. 应用化工, 2013, 42(2): 376-379. DOI:10.16581/j.cnki. issn1671-3206.2013.02.010.
[23] 李仁伟, 程明川, 李想, 等. 凝胶渗透色谱-高效液相色谱法检测食用油中邻苯二甲酸酯类的含量[J]. 食品工业科技, 2011, 32(12): 484-486. DOI:10.13386/j.issn1002-0306.2011.12.047.
[24] 袁永添, 刘正华, 李拥军, 等. 高效液相色谱-串联质谱法同时测定牛奶中9 种邻苯二甲酸酯[J]. 广东农业科学, 2012(6): 100-108. DOI:10.16768/j.issn.1004-874x.2012.06.009.
[25] KONG S F, JI Y Q, LIU L L, et al. Diversities of phthalate esters in suburban agricultural soils and wasteland soil appeared with urbanization in China[J]. Environmental Pollution, 2012, 170: 161-168. DOI:10.1016/j.envpol.2012.06.017.
Direct Determination of Phthalate Acid Esters in Oil Feedstock by Gas Chromatography-Mass Spectrometry
HU Aipeng
1, LIU Yulan
1,*, ZHANG Mingming
1, CHEN Gang
2, AN Jun
2
(1. College of Food Science and Technology, Henan University of Technology, Zhengzhou 450001, China;2. COFCO Food Sales & Distribution Co. Ltd., Beijing 100020, China)
Abstract:A method for the analysis of seven phthalate acid esters (PAEs) including dimethyl phthalate (DMP), diethyl phthalate (DEP), di-iso-butyl phthalate (DIBP), dibutyl phthalate (DBP), di (2-ethtlhexyl) phthalate (DEHP), butyl benzyl phthalate (BBP) and di-n-octyl phthalate (DNOP) in oil feedstock by gas chromatography-mass spectrometry (GC-MS) was established. In this method, sample pretreatment was achieved by organic solvent extraction and subsequent purification by N-(n-propyl) ethylenediamine (PSA) solid-phase extraction (SPE), and the analytes were analyzed by GC-MS with internal standard calibration. The proposed calibration curves had good linearity in the range of 0.01-2.0 mg/L with correlation coefficients between 0.999 8 and 1.000 0. The limits of detection (LODs) (R SN=3) of this method were 0.01-0.02 μg/L and the limits of quantitation (LOQs) (R SN=10) ranged from 0.03 μg/L to 0.06 μg/L. The average recoveries of 7 PAEs varied from 77.2% to 98.8% with relative standard deviation (LSDs) of 0.62%-9.37% (n = 6) at the spiked levels 0.1, 0.5,and 1.0 mg/kg. The contents of 7 PAEs (DMP, DEP, DBP, DIBP, BBP, DEHP, and DNOP) in 76 oil feedstock samples from different species and geographic origins were determined by this method. The results showed that DBP and DEHP were detected in all these samples, ranging from (0.015 ± 0.002) to (0.584 ± 0.012) mg/kg and from (0.085 ± 0.006) to(2.334 ± 0.016) mg/kg, respectively. The detection rates of DIBP, DEP, DMP, BBP, and DNOP were 98.7% (75/76), 64.5%(49/76), 63.2% (48/76), 32.9% (25/76), and 5.3% (4/76), respectively. Of the 76 samples, the contents of DBP in 17 samples(22.4%) and DEHP in 1 sample (1.3%) exceeded the maximum limit stipulated in the national standard as 0.3 mg/kg for DBP and 1.5 mg/kg for DEHP.
Key words:oil feedstock; phthalate acid esters; solid-phase extraction; internal standard method; gas chromatography-mass spectrometry (GC-MS)
DOI:10.7506/spkx1002-6630-201618024
中图分类号:TS222.1
文献标志码:A
文章编号:1002-6630(2016)18-0146-06
引文格式:
胡爱鹏, 刘玉兰, 张明明, 等. 气相色谱-质谱联用法直接测定植物油料中邻苯二甲酸酯类塑化剂[J]. 食品科学, 2016,37(18): 146-151. DOI:10.7506/spkx1002-6630-201618024. http://www.spkx.net.cn
HU Aipeng, LIU Yulan, ZHANG mingming, et al. Direct determination of phthalate acid esters in oil feedstock by gas chromatography-mass spectrometry[J]. Food Science, 2016, 37(18): 146-151. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201618024. http://www.spkx.net.cn
收稿日期:2016-03-12
基金项目:“十三五”国家重点研发计划专项(2016YFD0401400/2016YFD0401405)
作者简介:胡爱鹏(1989—),男,硕士研究生,研究方向为油料油脂加工与品质安全。E-mail:huaipeng1107@163.com
*通信作者:刘玉兰(1957—),女,教授,硕士,研究方向为油料油脂加工与品质安全。E-mail:liuyl7446@163.com