
图1 不同用量NO处理采后莲雾果实絮状绵软指数的变化
Fig.1 Cottony softening index of wax apple fruits treated with different concentrations of NO during storage
高维亚,吴光斌,陈发河*
(集美大学食品与生物工程学院,福建 厦门 361000)
摘 要:探明NO处理对采后莲雾果实成熟衰老过程中絮状绵软进程的影响。以台湾‘黑珍珠’莲雾果实为材料,用不同用量(5、10、20 μL/L)外源NO熏蒸处理莲雾果实,以0 μL/L NO熏蒸处理作对照,研究其对采后莲雾果实生理及品质、细胞壁代谢及木质素代谢的影响。结果表明:与对照相比,不同用量外源NO熏蒸处理能够显著抑制莲雾果实贮藏过程中絮状绵软指数及质量损失率的上升,保持果实硬度,延缓果实纤维素含量的下降,10 μL/L NO显著降低了多聚半乳糖醛酸酶(PG)、果胶甲酯酶(PME)、β-半乳糖苷酶(β-Gal)活性。同时,不同用量外源NO熏蒸处理能够延缓果实木质素含量的上升,10 μL/L NO显著降低了苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)、4-香豆酸辅酶A连接酶(4-CL)活性。相关性分析表明,絮状绵软指数与质量损失率、果肉硬度、纤维素含量和木质素含量之间均存在显著相关性,且与原果胶含量呈极显著负相关,与可溶性果胶含量呈极显著正相关。NO处理能够抑制细胞壁类物质降解酶活性,延缓采后莲雾果实絮状绵软进程,延长果实贮藏期,其中以10 μL/L NO处理效果最好。
关键词:莲雾;一氧化氮;絮状绵软;品质;细胞壁代谢;木质素代谢
莲雾(Syzygium samarangense Merr. et Perry)又称洋蒲桃、金山蒲桃、甜雾等,为桃金娘科蒲桃属植物。莲雾果实色泽鲜艳,外形美观,风味独特,深受消费者喜爱。但由于莲雾果实采后呼吸代谢旺盛、衰老速率快、极不耐贮藏,采收后如不及时处理,短时间内就会褪色、腐烂,果肉发生絮状绵软并伴有失水症状,食用品质急剧劣变,失去商品价值。因此,研究莲雾果实采后生理与保鲜技术,对延长其贮藏期和货架期,具有重要的实际意义。
一氧化氮(NO)是近年来发现的存在于动植物中的一种信号分子。NO在植物体内作为一个关键信号因子,它参与多种生命活动的调节,具有多种生理功能 [1]。近来研究表明,外源NO熏蒸处理可以延缓植物细胞成熟与衰老,提高植物抗逆性 [2],延长货架期,这在草莓 [3-4]、猕猴桃 [5]、番茄 [6]、梨 [7]、龙眼 [8]、芒果 [9]、冬枣 [10]、枇杷 [11]、橙 [12]、肥城桃 [13]等都有报道。果胶类物质和纤维素物质存在于多种高等植物细胞壁中,是构成细胞壁的主要物质,能够直接影响果实的硬度和坚韧度 [14]。果肉的软化与果实硬度和细胞壁降解酶密切相关,且细胞壁降解酶活性变化与硬度呈现负相关 [15]。罗自生等 [16]发现黄花梨采后贮藏期间果实软化与细胞壁代谢相关。陈艺晖等 [17]报道采后杨桃果实细胞壁物质含量和组分在果实成熟软化过程中均发生明显变化,进一步证明细胞壁物质的变化是导致杨桃果实软化的主要原因。魏建梅等 [18]研究发现,采后“京白梨”果实软化过程与细胞壁代谢紧密相关。果胶甲酯酶(pectin methylesterase,PME)和多聚半乳糖醛酸酶(polygalacturonase,PG)主要作用于果实软化后期,促进不溶性果胶向可溶性果胶的转化,β-半乳糖苷酶(β-galactosidase,β-Gal)可能在果实软化早期起主要作用,参与了中性糖从果胶、纤维素和半纤维素上的解离。潘腾飞等 [19]在对琯溪蜜柚的研究中发现,随着果实成熟度的增加,木质素含量逐渐增高,苯丙氨酸解氨酶(phenylalanin ammonia-lyase,PAL)和过氧化物酶(peroxidase,POD)等相关酶活性也逐渐增大。目前关于外源NO处理对采后莲雾果实絮状绵软机理的研究报道较少,尚缺乏系统研究,且目前关于采后莲雾果实木质素代谢的研究鲜见报道。
本研究以台湾‘黑珍珠’莲雾为试材,用不同用量NO熏蒸处理采后莲雾果实,测定果实絮状绵软期间生理品质、细胞壁代谢以及木质素代谢相关酶活性变化,探讨NO对采后莲雾果实絮状绵软进程的影响,以期为莲雾采后贮藏保鲜技术提供一定的理论支持和实践指导。
1.1 材料与试剂
台湾‘黑珍珠’莲雾(Syzygium samarangense Merr. et Perry) 厦门市台湾水果集散中心。
NO气体(纯度99.99%) 林德气体(厦门)有限公司;其余试剂均为分析纯。
1.2 仪器与设备
AL104电子分析天平 梅特勒-托利多仪器(上海)有限公司;DK-S26恒温水浴锅 上海精宏实验设备有限公司;UV-8000A紫外-可见分光光度计 厦门亿辰科技有限公司;TMS-Pro质构仪 美国FTC公司;3K18高速冷冻离心机 德国Sigma公司;ULT1386-3-V40超低温冰箱 美国Thermo Electron公司。
1.3 方法
1.3.1 样品处理
选择大小均匀、色泽成熟度一致、无机械损伤和病虫害侵染的优质莲雾果实进行NO熏蒸处理。NO处理参考Singh等 [20]的方法:随机分为4组,5、10、20 μL/L NO和0 μL/L NO(对照)组,每组果实70 个。将选取的果实置于真空干燥器(16 L)内,向干燥器内通N 220 min,以排出干燥器内的O 2。注入相应体积的NO气体,使得干燥器内NO用量分别为5、10、20 μL/L和0 μL/L(对照),熏蒸2 h,取出果实,置于空气中通风1 h。将果实按照不同处理用量分别装入塑料篮中,保鲜膜(打孔)包装后,置于温度(4±0.5)℃、相对湿度(85±2)%条件下贮藏,贮藏期为12 d。贮藏期间每隔1 d取样进行相关指标测定及分析。
1.3.2 生理生化特性与品质相关指标的测定
絮状绵软指数的测定采用将莲雾果实从中间纵向切开,分别测定莲雾果实纵切面絮状绵软部分面积和纵切面整体的面积,以絮状绵软面积占莲雾果实纵切面面积的百分比表示莲雾果实的絮状绵软指数,重复6 次;质量损失率的测定采用称质量法,选取6 个成熟度一致的果实为1 组,每隔1 d称量并记录果实鲜质量,平行3 组,重复3 次;果实硬度的测定采用TMSPRO质构仪进行测定,重复6 次;纤维素含量的测定参考宁正祥 [21]的方法,重复3 次;原果胶及可溶性果胶含量的测定参照韩雅珊 [22]的方法,重复3 次;木质素含量的测定参考朱海英等 [23]的方法,重复3 次。
根据絮状绵软指数、质量损失率、硬度、纤维素含量和木质素含量5 个生理指标测定结果,筛选出最优NO用量处理,然后研究最优NO用量处理对采后莲雾果实细胞壁代谢和木质素代谢相关酶活性的影响,以进一步研究NO的保鲜效果和作用机理。
1.3.3 细胞壁代谢相关酶活性的测定
PG活性的测定参照Gross [24]的方法,50 ℃条件下每小时每克鲜果催化底物产生1 μg半乳糖醛酸为1个酶活力单位(U),以半乳糖醛酸标准溶液作标准曲线,重复3 次。
PME活性的测定参照Lin等 [25]的方法,略加修改,取果肉5 g,加入10 mL 1% NaCl溶液,冰浴条件下研磨匀浆,移入离心管,于4 ℃条件下,10 000×g离心30 min,取上清液,贮于冰浴中,用于酶活性分析。取1.0mL酶液,加入到10 mL质量分数1%果胶溶液(用0.5% NaCl溶液配制,测定前用NaOH调pH值至7.4)中,用0.01 mol/L NaOH溶液滴定,在37℃条件下30 min内维持pH 7.4。30 min内每克鲜果消耗1 μmol NaOH为1个酶活力单位(U),重复3次。
β-Gal活性的测定参照Carrington等 [26]的方法,每小时每克鲜果产生1 μmol对硝基苯酚为1 个酶活力单位(U)。以对硝基苯酚标准溶液作标准曲线,重复3次。
1.3.4 木质素代谢相关酶活性的测定
PAL活性的测定参照Koukol等 [27]的方法,加以修改。取果肉10 g,加入10 mL 50 mmol/L硼酸缓冲液(pH 8.8,内含0.5% PVP),冰浴条件下研钵中研磨成匀浆,于4 ℃条件下,8 000 r/min离心30 min,取上清液,贮于冰浴中,用于酶活性分析。反应体系为1 mL已稀释5 倍的酶液、1 mL 20 mmol/L L-苯丙氨酸(用pH 8.8 50 mmol硼酸缓冲液配制)、2 mL 50 mmol/L硼酸缓冲液。混匀后在30 ℃反应1 h,在290 nm波长处测定吸光度,重复3次。以吸光度每小时变化0.001为1 个酶活力单位(U),结果以U/g表示。
POD活性的测定参照Chen等 [28]的方法。以470 nm波长处吸光度每分钟变化0.01为1 个POD活力单位(U),结果以U/g表示,重复3次。
4-CL活性的测定参照毕咏梅等 [29]的方法。以333 nm波长处吸光度每分钟变化0.001为1 个酶活力单位(U),结果以U/g表示,重复3 次。
1.4 数据处理
数据为3 个或3 个以上样本平均值,利用Excel 2013软件统计所有数据并绘制图表。利用SPSS 17.0软件进行方差分析和相关性分析,用Duncan’s检验进行差异显著性分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2.1 NO对采后莲雾果实品质的影响
2.1.1 絮状绵软指数
如图1所示,经过不同用量NO处理后,采后莲雾果实的絮状绵软指数均表现出增加趋势。贮藏0 d时测得对照组的絮状绵软指数为15.33%,到贮藏12 d增加至21.51%。不同用量NO处理均可以抑制莲雾果实絮状绵软指数增长。贮藏12 d,10 μL/L NO处理莲雾果实絮状绵软指数为对照组絮状绵软指数的77.97%,且显著低于对照组(P<0.05)。贮藏8~12 d,10 μL/L NO处理可显著抑制采后莲雾果实絮状绵软指数的上升(P<0.05)。贮藏12 d,10 μL/L NO处理组与对照组差异极显著(P<0.01)。在整个贮藏期,不同用量NO处理组果实絮状绵软指数均低于对照组。

图1 不同用量NO处理采后莲雾果实絮状绵软指数的变化
Fig.1 Cottony softening index of wax apple fruits treated with different concentrations of NO during storage
2.1.2 质量损失率
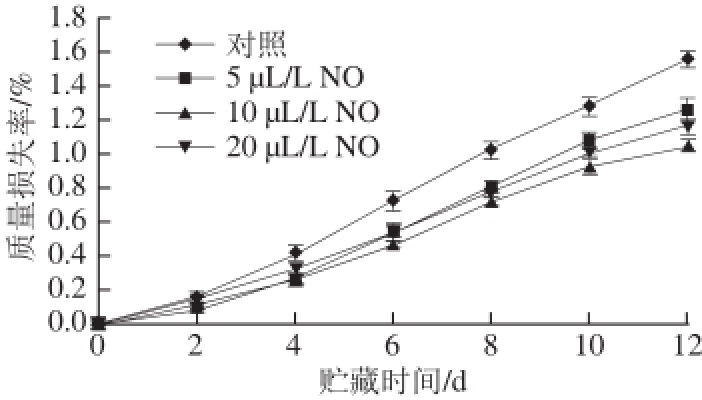
图2 不同用量NO处理采后莲雾果实质量损失率的变化
Fig.2 Weight loss rate of wax apple fruits treated with different concentrations of NO during storage
如图2所示,随着贮藏时间的延长,对照组和NO处理组采后莲雾果实的质量损失率均呈上升趋势。在贮藏2 d以后,5、10、20 μL/L NO均可以抑制采后莲雾果实的质量损失率的上升,其中,贮藏4~12 d,10、20 μL/L NO可以显著抑制采后莲雾果实质量损失率的上升(P<0.05)。由此推断,适宜用量的NO处理能够抑制采后莲雾果实质量损失率的上升,本试验结果表明10、20 μL/L NO处理均可以较好地抑制采后莲雾果实质量损失率的上升。
2.1.3 果肉硬度
由图3可见,在贮藏期间,果实硬度总体均呈现下降趋势。贮藏12 d,10 μL/L NO处理的莲雾果实果肉硬度为对照组果实硬度的1.14 倍。在整个贮藏期间,5、10 μL/L NO处理组果肉的硬度均显著高于对照组和20 μL/L NO处理组的果肉硬度(P<0.05)。
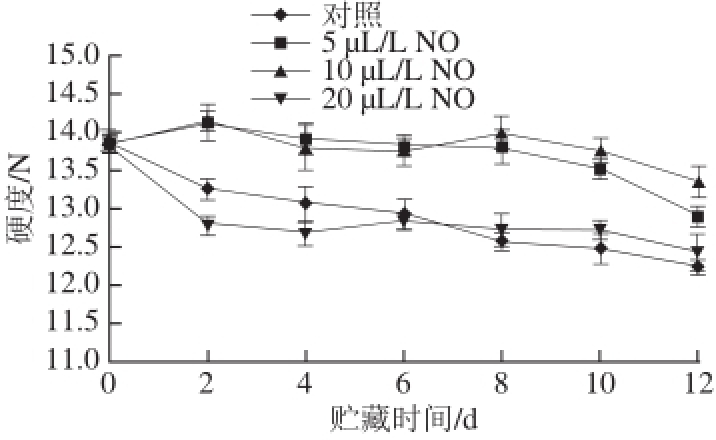
图3 不同用量NO处理采后莲雾果实硬度的变化
Fig.3 Firmness of wax apple fruits treated with different concentrations of NO during storage
2.1.4 相关性分析
表1 采后莲雾果实品质指标间相关系数
Table1 Correlation coefficients between cottony softening index and weight loss rate as well as firmness of postharvest wax apple
注:**.差异极显著,P<0.01;*.差异显著,P<0.05。下同。
指标质量损失率硬度絮状绵软指数0.839**-0.730**
如表1所示,采后莲雾果实絮状绵软指数与质量损失率间呈极显著正相关,絮状绵软指数与果肉硬度间呈极显著负相关。
2.2 NO对采后莲雾果实细胞壁代谢及相关酶活性的影响
2.2.1 纤维素含量

图4 不同用量NO处理采后莲雾果实纤维素含量的变化
Fig.4 Cellulose content of wax apple fruits treated with different concentrations of NO during storage
如图4所示,采后莲雾果实细胞壁的纤维素含量在贮藏过程中总体呈现逐渐降低趋势。在贮藏2~4 d,10 μL/L NO处理组的莲雾果实细胞壁纤维素含量显著高于对照组(P<0.05)。贮藏6 d后,NO处理组与对照组没有显著性差异(P>0.05)。在整个贮藏期间,不同NO处理组之间差异不显著。由图4可以看出,10 μL/L NO处理组的莲雾果实细胞壁纤维素含量在整个贮藏期间均高于对照组及5、20 μL/L NO处理组,因此认为10 μL/L NO处理效果最好。

图5 NO处理采后莲雾果实原果胶(a)和可溶性果胶(b)含量的变化
Fig.5 Protopcetin and soluble pectin contents of wax apple fruits treated with NO during storage
2.2.2 原果胶及可溶性果胶含量随着贮藏期的延长,对照组和10 μL/L NO处理组莲雾果实中原果胶含量均呈不断下降趋势,可溶性果胶含量均呈不断上升趋势,但两者的变化幅度不同(图5)。整个贮藏期间,10 μL/L NO处理组果实的原果胶含量显著高于对照组(P<0.01),贮藏12 d,处理组原果胶含量是对照组的1.62倍(图5a);10 μL/L NO处理组果实的可溶性果胶含量显著低于对照组(P<0.05),贮藏12 d,对照组原果胶含量是10 μL/L NO处理组的1.33 倍(图5b)。结果表明,10 μL/L NO处理能够显著抑制莲雾果实原果胶的降解速率。
2.2.3 PG活性
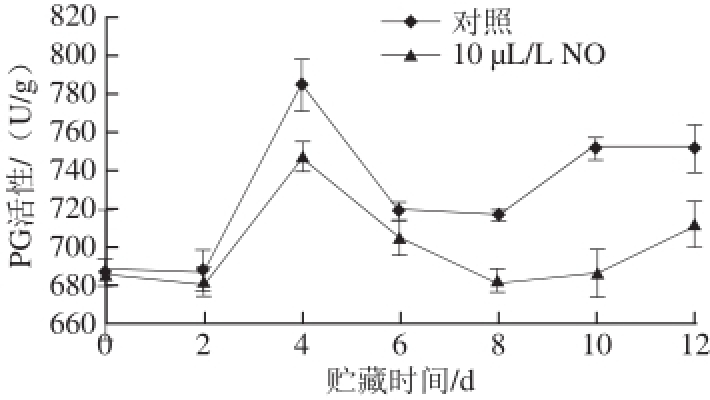
图6 NO处理采后莲雾果实PG活性的变化
Fig.6 PG activity of wax apple fruits treated with NO during storage
如图6所示,贮藏期间采后莲雾果实PG活性总体呈现上升趋势,对照组贮藏前期PG活性逐渐升高,贮藏4 d达到峰值,为原来的1.14 倍,之后开始下降。10 μL/L NO处理组在贮藏4 d达到峰值,为对照组的95.09%,显著低于对照组(P<0.05)。贮藏12 d,NO处理组PG活性为原来的1.04 倍。显著性分析表明,贮藏期间10 μL/L NO处理组莲雾果实对PG活性有显著降低作用(P<0.05)。
2.2.4 PME活性

图7 NO处理采后莲雾果实PME活性的变化
Fig.7 PME activity of wax apple fruits treated with NO during storage
如图7所示,对照组采后莲雾果实PME活性在贮藏0~6 d上升迅速,在贮藏6 d达到峰值,酶活性为贮藏初期的2.195 倍,贮藏6 d之后略有下降。10 μL/L NO处理组莲雾果实酶活性在贮藏0~4 d上升缓慢,贮藏6 d后上升迅速,并在贮藏10 d达到峰值。在整个贮藏期间,10 μL/L NO处理组酶活性始终低于对照组,显著性分析表明,贮藏期2~8 d,对照组和10 μL/L NO处理组差异显著(P<0.05),其中,贮藏2、4 d和6 d差异达到极显著水平(P<0.01)。结果表明,10 μL/L NO处理能够抑制采后莲雾果实PME活性上升。
2.2.5 β-Gal活性
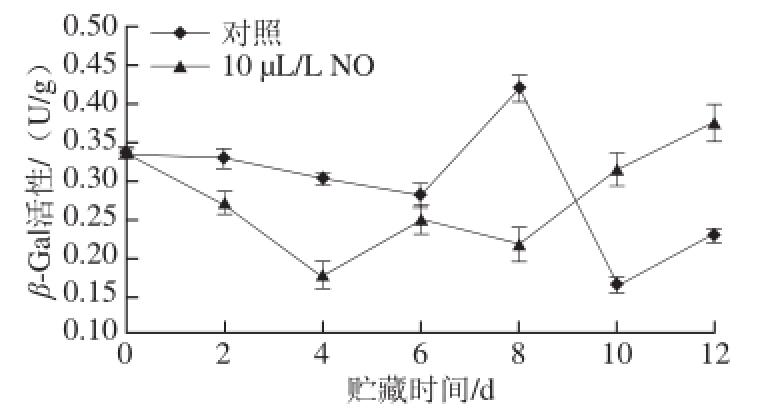
图8 NO处理采后莲雾果实β-Gal活性的变化
Fig.8 β-Gal activity of wax apple fruits treated with NO during storage
如图8所示,β-Gal活性在贮藏前期下降,对照组下降缓慢,NO处理组则下将迅速。从贮藏6 d开始,对照组β-Gal活性迅速上升,并在第8天达到峰值,之后又迅速下降。10 μL/L NO处理组β-Gal活性从贮藏8 d开始迅速上升,在12 d达到峰值。从贮藏期开始至贮藏8 d,10 μL/L NO处理组β-Gal活性均低于对照组,在贮藏10d后酶活性超过对照组。显著性分析表明,贮藏2、4 d和8 d,10 μL/L NO处理组β-Gal活性显著低于对照组(P<0.05)。结果表明,10 μL/L NO处理能够影响采后莲雾果实贮藏期间β-Gal活性,表现在能够推迟β-Gal活性高峰的到来,并且同时降低了β-Gal活性峰值。
2.2.6 相关性分析
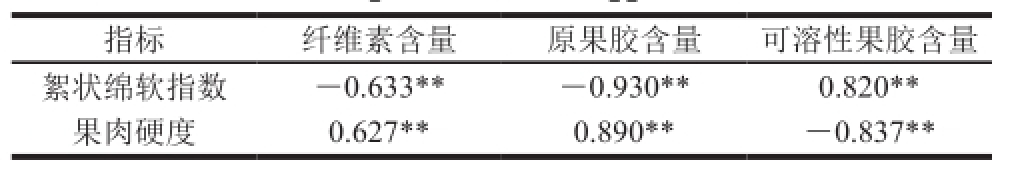
表2 采后莲雾果实品质指标与细胞壁代谢指标相关系数
Table2 Correlation coefficients between cottony softening index and firmness, cellulose content, protopectin content or soluble pectin content of postharvest wax apple
?
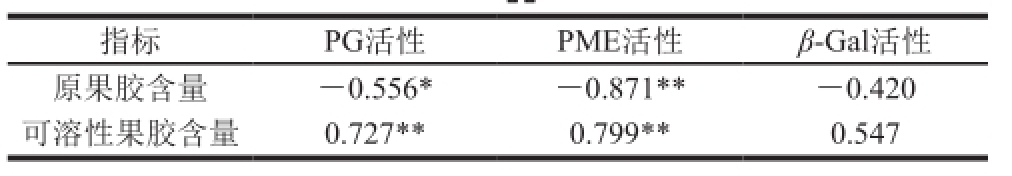
表3 采后莲雾果实原果胶含量及可溶性果胶含量与相关酶活性相关系数
Table3 Correlation coefficients between protopectin content and soluble pectin content or PG, PME and β-Gal activities of postharvest wax apple
?
如表2、3所示,纤维素含量、原果胶含量与果肉硬度间呈极显著正相关,与絮状绵软指数间呈极显著负相关;可溶性果胶含量与果实硬度间呈极显著负相关,且与絮状绵软指数间呈极显著正相关。PG活性、PME活性与原果胶含量间呈显著负相关,与可溶性果胶含量间呈极显著正相关;β-Gal活性与原果胶、可溶性果胶含量间均有一定相关性。
2.3 NO对采后莲雾果实木质素代谢及相关酶活性的影响
2.3.1 木质素含量
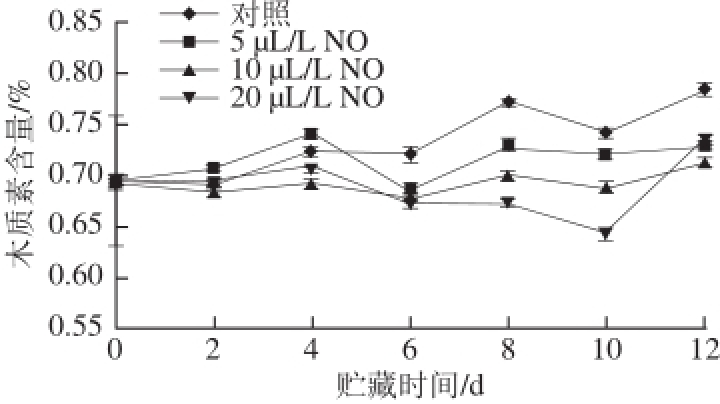
图9 不同用量NO处理采后莲雾果实木质素含量的变化
Fig.9 Lignin content of wax apple fruits treated with different concentrations of NO during storage
由图9可知,在整个贮藏期间,采后莲雾果实木质素含量总体呈逐渐上升趋势。在贮藏0~6 d,莲雾果实木质素含量较低,木质素含量无显著变化。从贮藏6 d开始,莲雾果实木质素含量呈现上升趋势。从贮藏6~12 d,NO处理组莲雾果实木质素含量均低于对照组含量,但5、10、20 μL/L NO处理间差异不显著(P>0.05)。贮藏8 d,10 μL/L NO处理组的莲雾果实木质素含量显著低于对照组(P<0.05)。贮藏12 d,5、10、20 μL/L NO处理莲雾果实木质素含量分别为对照组的92.99%、89.08%、93.80%。结果表明,NO处理可以抑制莲雾果实木质素含量的累积,从而能够更好地保持果实质地。由絮状绵软指数、质量损失率、硬度、纤维素含量和木质素含量5 个生理指标可以表明,10 μL/L NO处理可以较好地保持采后莲雾果实的品质。
2.3.2 PAL活性

图10 NO处理采后莲雾果实PAL活性的变化
Fig.10 PAL activity of wax apple fruits treated with NO during storage
如图10所示,贮藏期间采后莲雾果实PAL活性呈现先上升,后缓慢下降,再上升趋势。贮藏0~2 d,对照组PAL活性上升迅速,为初始的1.27 倍,显著高于NO处理组酶活性(P<0.05)。贮藏12 d,莲雾果实PAL活性迅速上升,对照组和10 μL/L NO处理组分别为初始的1.36 倍和1.15 倍。显著性分析表明,整个贮藏期间,10 μL/L NO处理组PAL活性显著低于对照组(P<0.05)。结果表明,NO处理能够显著抑制PAL活性,延缓木质素代谢进程。
2.3.3 POD活性

图11 NO处理采后莲雾果实POD活性的变化
Fig.11 POD activity of wax apple fruits treated with NO during storage
如图11所示,采后莲雾果实在贮藏过程中,对照组果实POD活性呈现先上升、后下降、再上升的变化趋势。10 μL/L NO处理组果实酶活性呈现波动上升变化趋势。在贮藏前期,对照组酶活性迅速上升,在贮藏6 d达到峰值,为初始的8.46 倍,显著高于NO处理组(P<0.05)。而10 μL/L NO处理组POD活性在贮藏8 d达到峰值,为初始的5.25 倍。贮藏12 d,对照组和10 μL/L NO处理组POD活性分别为初始的6.69 倍和4.13 倍。结果表明,10 μL/L NO处理能够显著影响POD活性,不仅能够抑制POD活性,也能够推迟POD活性高峰的到来。
2.3.4 4-CL活性
如图12所示,对照组莲雾采后果实4-CL活性在整个贮藏期间总体呈现上升趋势。其中,贮藏2~8 d,酶活性上升迅速。贮藏12 d,对照组4-CL活性为贮藏初期的1.203 倍。10 μL/L NO处理组酶活性在贮藏2 d有所下降,之后不断上升。其中,贮藏2~6 d,4-CL活性上升较为迅速。整个贮藏过程中,10 μL/L NO处理组4-CL活性始终低于对照组其差异达到极显著水平(P<0.01)。结果表明,与对照组相比,10 μL/L NO处理显著抑制了4-CL活性的上升。
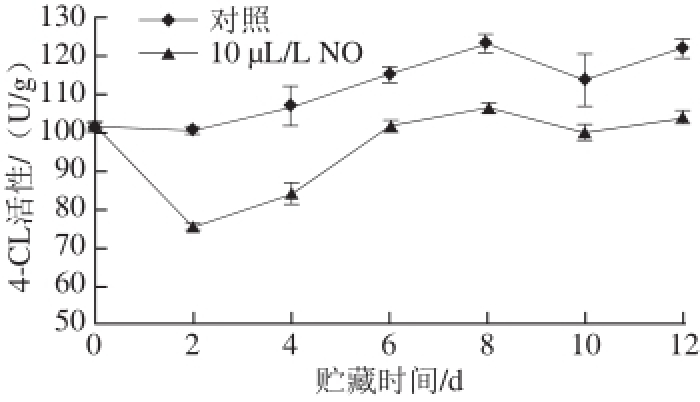
图12 NO处理采后莲雾果实4-CL活性的变化
Fig.12 4-CL activity of wax apple fruits treated with NO during storage
2.3.5 相关性分析
表4 采后莲雾果实木质素含量与絮状绵软知数及木质素代谢相关酶的相关系数
Table4 Correlation coefficients between lignin content and cottony softening index or PAL, POD and 4-CL activities of postharvest wax apple
指标絮状绵软指数PAL活性POD活性4-CL活性木质素含量0.793**0.710**0.4970.895**
如表4所示,木质素含量与絮状绵软指数、PAL活性、4-CL活性呈极显著正相关;POD活性与木质素含量间有一定相关性。
莲雾果实生长发育至成熟时,果实内部果心处就存在一定面积的絮状绵软组织。采后随着贮藏期的延长,果实内部的絮状绵软组织面积不断增大。许多研究证实,NO可以延缓园艺产品的成熟衰老,朱树华等 [30]研究表明,5 μL/L和10 μL/L NO气体熏蒸肥城桃果实有利于减轻贮藏过程中桃果实的絮败。本实验表明,贮藏期间采后莲雾果实絮状绵软进程不断加剧,不同用量NO处理均延缓了莲雾果实絮状绵软进程。质量损失率作为园艺产品的一项重要的生理指标,其变化可以直观地反映果实采后营养品质的变化,质量损失率越高,说明果实的营养品质下降的越快。采后莲雾果实重量的减少包括水分散失和营养物质消耗,莲雾果实的质量损失率上升越快,表明了果实水分的散失和营养物质的消耗越快,其品质下降的越快。NO处理能够有效地抑制莲雾质量损失率的上升,这与已有研究在番茄果实 [6,31]和木瓜果实 [32]中的结果相一致。果实硬度是反映果实质地的重要生理指标,其直接反映果实采后的贮藏性。结果显示,贮藏期间,采后莲雾果实果肉硬度整体呈现下降趋势,NO处理延缓了采后莲雾果实果肉硬度的下降,特别是10 μL/L NO处理表现出较好的效果,维持果肉硬度明显高于对照组。Hu等 [33]研究发现,外源NO能够有效抑制芒果果实果肉硬度的下降。Asghari等 [34]研究表明,NO处理可以有效地降低草莓果实软化速率,保持果实硬度。陈松江等 [35]也在杏果实中得到类似结果。
植物细胞壁由胞间层、初生壁、次生壁组成,其中,细胞壁的构架物质主要是纤维素 [36]。此外,果胶、半纤维素等大分子也是细胞壁的主要组分。细胞壁组成物质对果实的硬度和软化过程起着重要作用。果胶质的分解和细胞壁纤维素、半纤维素的降解等使细胞结构破坏,果实硬度下降 [37]。王玲利等 [38]研究发现,“黄冠”梨在成熟与衰老过程中伴随着果胶降解,果胶和纤维素网络结构的变化。本研究发现,NO处理能够降低果实纤维素含量的下降速率,以10 μL/L NO处理效果最好。朱树华等 [30]研究也指出,5、10 µL/L NO熏蒸肥城桃能够延缓贮藏过程中细胞壁纤维素、半纤维素的降解。本研究相关性分析表明,贮藏期内果实硬度与纤维素含量存在显著正相关关系,r= 0.627**,与可溶性果胶含量间呈极显著负相关关系,r=-0.837**。NO显著抑制了纤维素和果胶物质的降解,因而有利于保持莲雾果实的果肉硬度。果实软化是由细胞壁降解酶催化细胞壁物质降解而实现的 [39]。高利平等 [40]研究发现,新疆红肉苹果杂交后代绵肉株系果实软化过程伴随着多种果实软化酶活性的上升。本研究发现,采后莲雾果实贮藏过程中PG和PME活性变化总体呈上升趋势,果胶物质的分解加速,原果胶含量不断降低,可溶性果胶含量不断增加。据此认为在PG和PME共同作用下,果胶类物质降解,导致莲雾果实硬度下降。这与刘熙东等 [41]在龙眼果实中的研究类似。β-Gal活性高峰出现在贮藏中后期,据此认为,β-Gal可能在莲雾软化后期起重要作用。NO处理通过抑制PG、PME、β-Gal的活性,减缓果胶类物质的降解,从而较好地保持了果实的硬度,延缓了莲雾果实的絮状绵软进程。相关性分析表明,PG、PME、β-Gal活性与原果胶之间的相关性系数(r)分别为-0.556*、-0.871**、-0.420,与可溶性果胶之间的相关性系数(r)分别为0.727**、0.799**、0.547,说明PG、PME和β-Gal在采后莲雾果实细胞壁代谢过程中起重要作用。
木质素代谢在植物体内具有重要意义,与植物生长发育息息相关。木质素是植物苯丙烷代谢途径的主要产物之一,PAL、POD、4-CL等是木质素生物合成途径的关键控制酶,与木质素的生物合成密不可分。朱学亮 [42]研究发现,随着琯溪蜜柚果实成熟度的增加,木质素含量增加,汁胞粒化程度加快。本研究显示,贮藏期间,采后莲雾果实木质素含量总体呈上升趋势,且与絮状绵软指数显著正相关。分析这是由于莲雾果实特殊的软化方式导致木质素沉积,果实由中心向外发生絮状绵软,木质素含量的增加在采后莲雾果实絮状绵软进程中起着十分重要的作用。研究表明,NO处理可以抑制莲雾果实木质素含量的累积,从而能够更好地保持果实质地。本研究显示,NO处理组莲雾果实PAL活性低于对照组,果肉木质素含量也较低,PAL活性与木质素含量间极显著正相关,表明采后莲雾果实果肉的木质化与PAL活性密切相关,NO可以通过降低PAL活性,抑制果肉木质素的生成来延缓莲雾木质化进程。POD活性变化趋势与木质素含量增加的趋势并不完全一致,但是有一定相关性,原因可能与POD属于多功能酶类有关,除参与木质素代谢外,还参与抗性、衰老等其他生理活动。有研究指出,POD一方面可在逆境或衰老初期表达,清除H 2O 2,是细胞活性氧保护酶系统的成员之一;另一方面,POD又能在衰老后期或逆境中表达,参与活性氧的生成、叶绿素的降解,并能够引发膜脂过氧化作用 [43]。4-CL活性在贮藏期内呈上升趋势,与木质素含量间极显著相关,NO处理显著降低了4-CL活性,从而减缓了木质素代谢进程。此外,相关性分析结果进一步表明,采后莲雾果实絮状绵软进程与细胞壁代谢和木质素代谢密切相关,NO处理可以延缓细胞壁代谢和木质素代谢,从而延缓采后莲雾果实絮状绵软进程的加剧,延长采后莲雾果实的贮藏寿命。
综上所述,NO处理能够延缓采后莲雾果实絮状绵软指数和质量损失率的上升,延缓果肉硬度的下降,抑制纤维素的降解和木质素的合成,减缓采后莲雾果实絮状绵软进程的加剧。本研究中,外源NO处理可以显著地抑制细胞壁代谢相关酶类PG、PME、β-Gal的活性,减缓果胶类物质的降解,并且显著地抑制木质素代谢相关酶类PAL、POD、4-CL的活性。采后莲雾果实絮状绵软指数与纤维素含量、原果胶含量、可溶性果胶含量和木质素含量显著相关,说明采后莲雾果实絮状绵软进程与细胞壁代谢和木质素代谢密切相关。由此表明,NO处理可以通过调节细胞壁代谢、木质素代谢相关酶活性,减缓采后莲雾果实絮状绵软进程,适宜用量的NO熏蒸处理可以用于采后莲雾果实的贮藏与保鲜,总体上以10 μL/L NO处理效果较好。
参考文献:
[1] STAMLER J S. Redox signalling: nitrosylation and related targets interactions of nitric oxide[J]. Cell, 1994, 78: 931-936. DOI:10.1016/0092-8674(94)90269-0.
[2] NEILL S J, DESIKAN R, CLARKE A, et al. Nitric oxide is a novel component of abscisic acid signaling in stomatal guard cells[J]. Plant Physiol, 2002, 128: 13-16. DOI:10.1104/pp.010707.
[3] WILLS R B H, KU V V V, LESHENM Y Y. Fumigation with nitric oxide to extend the postharvest life of strawberries[J]. Postharvest Biology and Technology, 2000, 18: 75-79. DOI:10.1016/S0925-5214(99)00061-7.
[4] 朱树华, 周杰, 束怀瑞, 等. 一氧化氮延缓草莓成熟衰老的生理效应[J]. 中国农业科学, 2005, 38(7): 1418-1424. DOI:10.3321/ j.issn:0578-1752.2005.07.022.
[5] 张晓平, 任小林, 任亚梅, 等. NO处理对采后猕猴桃贮藏性及叶绿素含量的影响[J]. 食品研究与开发, 2007, 28(1): 145-148. DOI:10.3969/j.issn.1005-6521.2007.01.044.
[6] 丹阳, 吴成勇. 外源一氧化氮熏蒸处理对番茄采后品质的影响[J]. 食品科学, 2008, 29(6): 419-423. DOI:10.3321/ j.issn:1002-6630.2008.06.094.
[7] GABRIEL O S, GUSTAVO D T, ADELA A F. Delayed ripening of “Bartlett” pears treated with nitric oxide[J]. The Journal of Horticultural Science and Biotechnology, 2003, 78: 899-903. DOI:10.1 080/14620316.2003.11511716.
[8] 段学武, 邹如意, 蒋跃明, 等. NO对采后龙眼常温贮藏效果的影响[J]. 食品科学, 2007, 28(2): 327-329. DOI:10.3321/ j.issn:1002-6630.2007.02.084.
[9] ZAHARAH S S, ZORA S. Postharvest nitric oxide fumigation alleviates chilling injury, delays fruit ripening and maintains quality in cold-stored ‘Kensington Pride’ mango[J]. Postharvest Biology and Technology, 2011, 60(3): 202-210. DOI:10.1016/ j.postharvbio.2011.01.011.
[10] 孙丽娜, 刘孟臣, 朱树华, 等. 一氧化氮处理对冬枣贮藏期间乙醇代谢及相关品质的影响[J]. 中国农业科学, 2007, 40(12): 2827-2834. DOI:10.3321/j.issn:0578-1752.2007.12.023.
[11] 张美姿, 吴光斌, 陈发河. NO熏蒸处理对冷藏枇杷果实木质化劣变的影响[J]. 食品科学, 2014, 35(16): 232-237. DOI:10.7506/spkx1002-6630-201416045.
[12] LIU L D, WANG J J, QU L W, et al. Effect of nitric oxide treatment on storage quality of glorious oranges[J]. Procedia Engineering, 2012, 37: 150-154. DOI:10.1016/j.proeng.2012.04.218.
[13] 刘孟臣. 一氧化氮处理提高肥城桃和猕猴桃果实贮藏性能生理机制的研究[D]. 泰安: 山东农业大学, 2007.
[14] 曲凤静, 韩涛, 李丽萍, 等. 不同用量乙醛处理对桃果实软化及相关生理代谢的影响[J]. 中国农业科学, 2009, 42(1): 245-250. DOI:10.3864/j.issn.0578-1752.2009.01.031.
[15] 李明霞, 韩建群, 王琦, 等. 低强度微波处理对猕猴桃细胞壁降解酶活性的影响[J]. 食品与发酵工业, 2015, 41(11): 52-58.
[16] 罗自生, 寿浩林. NSCC涂膜对黄花梨软化和细胞壁代谢的影响[J].果树学报, 2011, 28(1): 143-146. DOI:10.13995/j.cnki.11-1802/ ts.201511010.
[17] 陈艺晖, 张华, 林河通, 等. 1-甲基环丙烯处理对采后杨桃果实软化和细胞壁代谢的影响[J]. 热带亚热带植物学报, 2013, 21(6): 566-571. DOI:10.3969/j.issn.1005-3395.2013.06.011.
[18] 魏建梅, 马锋旺, 关军锋, 等. 京白梨果实软化过程中细胞壁代谢及其调控[J]. 中国农业科学, 2009, 42(8): 2987-2996. DOI:10.3864/ j.issn.0578-1752.2009.08.044.
[19] 潘腾飞, 朱学亮, 潘东明, 等. ‘琯溪蜜柚’贮藏期间汁胞粒化与木质素代谢的关系[J]. 果树学报, 2013, 30(2): 294-298.
[20] SINGH S P, SINGH Z, SWINNY E E. Postharvest nitric oxide fumigation delays fruit ripening and alleviates chilling injury during cold storage of Japanese plums (Prunus salicina Lindell)[J]. Postharvest Biology and Technology, 2009, 53: 101-108. DOI:10.1016/j.postharvbio.2009.04.007.
[21] 宁正祥. 食品成分分析手册[M]. 北京: 中国轻工业出版社, 1998: 45-48.
[22] 韩雅珊. 食品化学试验指导[M]. 北京: 北京农业大学出版社, 1992: 32-33.
[23] 朱海英, 李人圭, 王隆华, 等. 丝瓜果实发育中木质素代谢及有关导管的生理生化研究[J]. 华东师范大学学报, 1997(1): 87-97.
[24] GROSS K C. A rapid and sensitive spectrophotometric method for assaying polygalacturonase using 2-cyanoacetamide[J]. HortScience,1982, 17: 933-934.
[25] LIN T P, LIU C C, CHEN S W, et al. Purification and characterization of pectinmethylesterase from Ficus Awkeotsang makino achenes[J]. Plant Physiol, 1989, 91: 1445-1453. DOI:10.1104/pp.91.4.1445.
[26] CARRINGTON C M S, GREVE L C, LABAVITCH J M. Cell wall metabolism in ripening fruit[J]. Plant Physiol, 1993, 103: 429-434.
[27] KOUKOL J, COMM E E. The metabolism of aromatic compounds in higher plants[J]. Journal of Biological Chemistry, 1961, 236(10): 2692-2698.
[28] CHEN Y Z, WANG Y R. A study on peroxidase in litchi pericarp[J]. Acta Botanica Austro Sinica, 1989, 5: 47-52.
[29] 毕咏梅, 欧阳光察. 水稻4-香豆酸COA连接酶的基本性质[J]. 植物生理学通讯, 1990(6): 18-20. DOI:10.13592/j.cnki.ppj.1990.06.007.
[30] 朱树华, 刘孟臣, 周杰. 一氧化氮熏蒸对采后肥城桃果实细胞壁代谢的影响[J]. 中国农业科学, 2006, 39(9): 1878-1884. DOI:10.3321/ j.issn:0578-1752.2006.09.022.
[31] 徐福乐. 外源一氧化氮熏蒸对番茄果实采后品质的影响[J]. 福建农业学报, 2010, 25(1): 72-76. DOI:10.3969/j.issn.1008-0384.2010.01.014.
[32] LI X P, WU B, GUO Q, et al. Effects of nitric oxide on postharvest quality and soluble sugar content in papaya fruit during ripening[J]. Journal of Food Processing and Preservation, 2014, 38: 591-599. DOI:10.1111/jfpp.12007.
[33] HU M J, YANG D P, HUBER D J, et al. Reduction of postharvest anthracnose and enhancement of disease resistance in ripening mango fruit by nitric oxide treatment[J]. Postharvest Biology and Technology,2014, 97: 115-122. DOI:10.1016/j.postharvbio.2014.06.013.
[34] ASGHARI M R, ABDOLLAHI R. Changes in quality of strawberries during cold storage in response to postharvest nitric oxide and putrescine treatments[J]. Acta Alimentaria, 2013, 42(4): 529-539. DOI:10.1556/AAlim.42.2013.4.8.
[35] 陈松江, 毕阳, 李永才, 等. 一氧化氮处理对杏果实贮藏品质的影响[J]. 食品科技, 2011, 36(6): 46-50. DOI:10.13684/j.cnki. spkj.2011.06.030.
[36] 徐汉卿, 宋协志. 植物学[M]. 北京: 中国农业大学出版社, 2000: 15-18.
[37] BRUMMEL D A, CIN V D, CRISOSTOET C H, et al. Cell wall metabolism during maturation, ripening and senescence of peach fruit[J]. Journal of Experimental Botany, 2004, 55: 2029-2039. DOI:10.1093/jxb/erh227.
[38] 王玲利, 刘超, 黄艳花, 等. ‘黄冠’梨采后热处理和钙处理对其钙形态及细胞壁物质代谢的影响[J]. 园艺学报, 2014, 41(2): 249-258. DOI:10.3969/j.issn.0513-353X.2014.02.005.
[39] 彭丽桃, 饶景萍, 杨书珍, 等. 果实软化的胞壁物质和水解酶变化[J]. 热带亚热带植物学报, 2002, 10(3): 271-280. DOI:10.3969/ j.issn.1005-3395.2002.03.014.
[40] 高利平, 冀晓昊, 张艳敏, 等. 新疆红肉苹果杂交后代绵/脆肉株系果实质地差异相关酶活性的初步研究[J]. 园艺学报, 2013, 40(6): 1153-1161.
[41] 刘熙东, 吴振先, 韩冬梅, 等. 龙眼采后果皮细胞壁代谢相关酶活性的变化[J]. 热带作物学报, 2006, 27(2): 24-28. DOI:10.3969/ j.issn.1000-2561.2006.02.005.
[42] 朱学亮. 琯溪蜜柚果实木质素代谢研究[D]. 福州: 福建农林大学, 2009.
[43] 赵丽英, 邓西平, 山仑. 活性氧清除系统对干旱胁迫的响应机制[J]. 西北植物学报, 2005, 25(2): 413-418. DOI:10.3321/ j.issn:1000-4025.2005.02.034.
Effects of Exogenous Nitric Oxide Fumigation on Cottony Softening of Postharvest Wax Apple(Syzygium samarangense Merr. et Perry) Fruit
GAO Weiya, WU Guangbin, CHEN Fahe*
(College of Food and Biological Engineering, Jimei University, Xiamen 361000, China)
Abstract:This study aimed to investigate the effects of nitric oxide (NO) fumigation on cottony softening of postharvest wax apple fruit. ‘Black Pearl’ wax apple fruit (Syzygium samarangense Merr. et Perry) were treated with different concentrations of exogenous NO (5, 10 and 20 μL/L), with 0 μL/L nitric oxide as control. The fruit quality, cottony softening index, cell wall metabolism and lignin metabolism were determined. The results indicated that compared with control,different concentrations of exogenous NO fumigation inhibited significantly fruit cottony softening development and weight loss, maintained fruit firmness, reduced effectively the decrease of cellulose content. NO fumigation at 10 μL/L decreased the activities of polygalacturonase (PG), pectin methylesterase (PME), and β-galactosidase (β-Gal). Meanwhile, different concentrations of exogenous NO fumigation also retarded effectively the rise of lignin content. NO at 10 μL/L decreased the activities of phenylalanin ammonia-lyase (PAL), peroxidase (POD) and 4-coumarate:coenzyme A ligase (4-CL). Correlation analysis indicated that weight loss, fruit firmness, and the contents of cellulose and lignin were significantly correlated with cottony softening index, and that cottony softening index was correlated significantly negatively with the content of protopectin but significantly positively with the content of soluble pectin. Taken together, NO treatment decreased the activities of cell wall-degrading enzymes, and effectively postponed fruit ripening and senescence process of postharvest wax apple, and prolonged its storage life. Among different concentrations tested, 10 μL/L NO treatment presented the best effect.
Key words:wax apple; nitric oxide; cottony softening; quality; cell wall metabolism; lignin metabolism
DOI:10.7506/spkx1002-6630-201618034
中图分类号:TS205.9
文献标志码:A
文章编号:1002-6630(2016)18-0208-08
引文格式:
高维亚, 吴光斌, 陈发河. NO处理对采后莲雾果实絮状绵软进程的影响[J]. 食品科学, 2016, 37(18): 208-215. DOI:10.7506/spkx1002-6630-201618034. http://www.spkx.net.cn
GAO Weiya, WU Guangbin, CHEN Fahe. Effects of exogenous nitric oxide fumigation on cottony softening of postharvest wax apple (Syzygium samarangense Merr. et Perry) fruit[J]. Food Science, 2016, 37(18): 208-215. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201618034. http://www.spkx.net.cn
收稿日期:2016-03-01
基金项目:国家自然科学基金面上项目(31171777);福建省自然科学基金项目(2010J01211)
作者简介:高维亚(1990—),女,硕士研究生,研究方向为农产品加工与贮藏。E-mail:1002097343@qq.com
*通信作者:陈发河(1960—),男,教授,硕士,研究方向为农产品加工与贮藏。E-mail:fhchen@jmu.edu.cn