 ±s形式表示,差异显著性水平为P<0.05。
±s形式表示,差异显著性水平为P<0.05。
邵 颖 1,2,王小红 2,熊光权 1,李 新 1,吴文锦 1,乔 宇 1,丁安子 1,廖 李 1,王 俊 1,汪 兰 1,*
(1.湖北省农业科学院农产品加工与核农技术研究所,湖北省农业科技创新中心农产品加工研究分中心,湖北 武汉 430064;2.华中农业大学食品科学技术学院,湖北 武汉 430070)
摘 要:以草鱼肌原纤维蛋白作为研究对象,添加魔芋葡甘聚糖降解产物及葡聚糖(7 000 D,T7),测定草鱼肌原纤维蛋白质量浓度、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)和流变性质的变化,比较不同多糖对冻藏过程中肌原纤维蛋白的冷冻保护效果,探讨不同多糖对草鱼肌原纤维蛋白结构的冷冻保护机制。研究发现,随冻藏时间的延长,空白、酶解魔芋葡甘聚糖、辐解魔芋葡甘聚糖、T7及商业抗冻剂各组对应草鱼肌原纤维蛋白质量浓度和流变储能模量(G’)均下降,与冻藏过程草鱼肌原纤维蛋白SDS-PAGE的变化基本吻合。同时,添加上述不同多糖各组草鱼肌原纤维蛋白质量浓度和G’均高于空白组。研究结果表明:T7、酶解魔芋葡甘聚糖及辐解魔芋葡甘聚糖通过保护副肌球蛋白和肌球蛋白轻链,延缓草鱼肌原纤维蛋白的变性,其中,辐解魔芋葡甘聚糖效果最强,T7次之,酶解魔芋葡甘聚糖最弱,但都具有明显的冷冻保护作用。
关键词:肌原纤维蛋白;多糖;冷冻保护;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳;流变
随着中国渔业经济保持良好的发展态势,淡水鱼产量持续升高,鱼类食品加工业不断发展。目前,为了实现鱼糜的长期保藏,工业化生产通常采用冷冻贮藏的方式,而肌原纤维蛋白作为鱼糜的主要功能性成分 [1],极易发生冷冻变性,从而导致功能性的降低和品质的劣化 [2],严重影响消费者对口感和营养成分的需求,因而常常添加抗冻剂以降低冰点、提高抗冻能力,在一定程度上抑制蛋白质冷冻变性。现代工业生产上广泛采用商业抗冻剂(4%山梨糖醇+4%蔗糖),但是,该抗冻剂甜度和热量较高,不符合现代生活中人们对健康饮食的追求 [3],因而关于开发低甜度、低热量抗冻剂的研究有待进一步深入。本课题组在前期研究的基础上,筛选出β-葡聚糖酶酶解魔芋葡甘聚糖(konjac glucomannan,KGM)、辐解KGM及葡聚糖(7 000 D,T7)这3 种多糖,发现它们对肌原纤维蛋白具有优良的冷冻保护作用,现从肌原纤维蛋白的结构角度探讨上述3 种多糖的冷冻保护作用机制。
蛋白质作为参与生理活动和构成生物体的必要物质,其流变性及凝胶性等流变学性质会影响食品的感官特性 [4]及其在加工、运输或贮藏过程中的理化特性。由于肌原纤维蛋白是鱼糜蛋白的主要成分,因而冷冻草鱼鱼糜的品质及后续加工性能高低与冻藏过程中肌原纤维蛋白发生聚集变性的程度密切相关。尤其,肌原纤维蛋白凝胶化过程中的流变特性反映蛋白质的品质 [5],其中,储能模量(G’)作为凝胶材料的弹性反映,反映了蛋白质在加热过程中形成三维弹性凝胶网络结构的变化情况以及展幵和聚集过程。Liu Ru等 [6]研究表明不同离子强度、蛋白质质量浓度和温度条件下鱼肉肌球蛋白的静态流变性质差异显著。Westphalen等 [7]研究发现由于蛋白质凝胶的逐步形成,猪肉肌原纤维蛋白在加热至40 ℃后,G’不断增加。
目前,蛋白水解物、酶解物及低聚糖类等抗冻剂对鱼糜的冷冻保护作用已成为近年来的研究热点 [1],且主要研究其对鱼糜蛋白总巯基含量、二硫键含量和Ca 2+-ATPase活性等理化指标及质构特性、持水力等凝胶性能的影响。另外,许多研究探讨了鱼糜蛋白的变性机制,发现海藻糖、木糖、聚葡萄糖及乳酸钠等对蛋白质凝胶特性及理化性质影响显著,有助于抑制冷冻变性,可作为传统商业抗冻剂的替代物 [1,8]。但是对β-葡聚糖酶酶解KGM、辐解KGM及T7等不同多糖鲜有研究,本实验以草鱼肌原纤维蛋白为研究对象,测定草鱼肌原纤维蛋白质量浓度、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)和流变性能的变化,比较不同多糖对冻藏过程中肌原纤维蛋白的冷冻保护效果,为开发新型低甜度、低热量抗冻剂提供理论依据。
1.1 材料与试剂
1 450~1 500 g的新鲜健康草鱼(Ctenopharyngodon idellus,2 h内致死) 湖北省武汉市武商量贩农科城店。
pH值校正缓冲液(pH 4.00、6.86、9.18;25 ℃)邦西仪器科技(上海)有限公司;牛血清蛋白(生化试剂)、β-葡聚糖(200 000 U/g)(化学纯) 美国BioSharp公司;NaCl、EDTA、MgCl 2·6H 2O、KH 2PO 4、NaOH、HCl、Na 2HPO 4·12H 2O、KCl、双缩脲试剂及葡聚糖T7(含盐量0%)(均为分析纯) 国药集团化学试剂有限公司;KGM(化学纯) 湖北强森魔芋科技有限公司。
1.2 仪器与设备
AR2000ex流变仪 美国TA仪器公司;GL-21M高速冷冻离心机 湖北赛特湘仪离心机仪器有限公司;XHF-D型高速分散器 宁波新芝生物科技股份有限公司;722G可见分光光度计 上海精密科学仪器有限公司;钴60γ射线辐照装置、pH-5A酸度计 梅特勒-托利多仪器(上海)有限公司;电子天平 赛多利斯科学仪器(北京)有限公司。
1.3 方法
1.3.1 原料处理
每条鱼取背部即自鱼体两侧鳃盖骨后至尾鳍前肌肉作为样品进行测定 [9]。将鱼宰杀去掉鱼头、鱼皮和内脏,用水将其冲洗干净,手工采取侧线上方、背鳍附近的白肉,将其切成鱼块(2 mm×2 mm×2 mm),放于自封袋(120 mm×170 mm)中,置于4 ℃冰箱中冷藏,备用。
1.3.2 肌原纤维蛋白的提取
参照刘红彦 [10]的方法从鱼肉肌肉中提取肌原纤维蛋白,并适当修改。将新鲜鱼肉切碎,加入4 倍体积的冷50 mmol/L磷酸盐缓冲液(1 mmol/L EDTA、2 mmol/LMgCl 2、0.1 mol/L NaCl,pH 7.0),高速匀浆2 min,在转速8 000×g、温度4 ℃条件下冷冻离心15 min,弃除上清液,收集沉淀,重复上述步骤3 次;向沉淀中加入4 倍体积的冷0.1 mol/L NaCl溶液,高速匀浆30 s,调整混合液的pH值为6.25,在转速8 000×g、温度4 ℃条件下冷冻离心15 min,弃除上清液,收集沉淀,重复2 次,收集的沉淀为肌原纤维蛋白。
1.3.3 KGM降解产物的制备
辐解KGM(分子质量1.209×10 4D [11],纯度100%,含盐量0%)的制备:取5 g KGM精粉,以料液比1∶60(g/mL)溶解于蒸馏水中,在静态常温条件下进行20 kGy降解,然后冷冻干燥,粉碎备用 [12];β-葡聚糖酶酶解KGM(分子质量2.093×10 4D [11],纯度100%,含盐量5.75×10 -2.5%)的制备:取5 g KGM精粉,以料液比1∶60(g/mL)溶解于稀盐酸溶液(pH 5.5)中,50 ℃水浴加热,加入β-葡聚糖酶,缓慢搅拌至均匀分散,酶解100 min,然后用1 mol/L的NaOH溶液中和,干燥后粉碎备用 [12]。
1.3.4 样品制备
称取0.25 g酶解KGM(0.5%)、0.25 g辐解KGM(0.5%)及0.25 g T7(0.5%),分别加入25 g 50 mmol/L的磷酸盐缓冲液(含0.6 mol/L NaCl,pH 6.25),溶解均匀,再分别加入至25 g肌原纤维蛋白沉淀中,均质,然后分装至50 mL离心管中,共3 份,每份约15 g,放置于-18 ℃冰箱中贮藏,分别在0、10、75 d后取出进行分析。空白组不添加任何糖类,阳性对照组添加商业抗冻剂,即2.0 g山梨糖醇(4.0%)与2.0 g蔗糖(4.0%)的复配物。
1.3.5 蛋白质量浓度测定
向样品中加入25 倍体积的50 mmol/L磷酸盐缓冲液(含0.6 mol/L NaCl,pH 6.25),高速匀浆2 min,4 ℃放置1 h,得到肌原纤维蛋白溶液 [10]。参照周茹等 [13]的方法,采用双缩脲法测定蛋白质量浓度,标准蛋白为牛血清白蛋白。标准曲线为Y=0.043 7X+0.015 4,相关系数R 2=0.999 4,对照标准曲线求得样品蛋白质量浓度。
1.3.6 SDS-PAGE测定
参照Laermmli [14]、郭壳君 [15]等的方法,并适当修改:取干净的微量离心管,将样品按体积比1∶1加入SDS缓冲液(2 倍配比),沸水浴5 min后取出。吸取10 µL蛋白样品及5 µL标准分子质量蛋白Marker,轻轻加入梳孔中,然后向内槽中加入适量的电泳缓冲液(1 倍配比),选择恒压条件,积层胶(4%)中于60 V电压跑胶,待样品跑成一条直线且进入分离胶(10%)后,调节电压至100 V,继续电泳,直到溴酚蓝跑出凝胶底部,关闭电源。将胶从玻璃板取出后置于干净的玻璃培养皿中,加入适量的考马斯亮蓝染色液 R-250,置于摇床过夜染色。染色完毕后,回收染色液,加入适量脱色液,置于摇床脱色,换液数次,直至凝胶上的背景色完全脱去,然后置于湿润的白板上,使用凝胶成像仪照相。
1.3.7 流变性能测定
参照刘泽宇等 [16]的方法,并适当修改:采用直径40.00 mm、角度0 °的平行板进行测定。取2 mL样品上样,控制夹缝高度为1 mm,刮除四周溢出的样品,盖住避免外周水分的蒸发。温度扫描条件:频率0.1 Hz,应变1%,程序升温范围20~90 ℃,升温速率1 ℃/min,在90 ℃处恒温2 min后,以5 ℃/min的降温速率降温至20 ℃后结束,然后进行该样品的频率扫描。频率扫描条件为:频率0.1~10 Hz,应变1%,恒温20 ℃。每个样品测定4~5 次,记录肌原纤维蛋白G’,绘制升温和降温过程中G’随温度T变化以及频率扫描过程中G’随频率f变化的曲线图。
1.4 数据分析
数据分析采用数学软件SAS 8.0和Microsoft Excel,结果采用
 ±s形式表示,差异显著性水平为P<0.05。
±s形式表示,差异显著性水平为P<0.05。
2.1 肌原纤维蛋白质量浓度的变化
表1 冻藏过程中不同多糖作用条件下的草鱼肌原纤维蛋白质量浓度
Table1 Effect of different-molecular-weight polysaccharides on the concentration of grass carp myofibrillar protein during frozen storage mg/mL

注:a~d不同表示同列差异显著(P<0.05);x~z不同表示同行差异显著(P<0.05)。
1075空白51.34±1.32 cx49.18±0.58 dx36.10±1.68 dy酶解KGM(0.5%)64.32±3.03 ax55.54±0.66 bcy47.09±0.73 bz辐解KGM(0.5%)56.30±2.67 bx56.43±1.54 bx40.62±3.07 cyT7(0.5%)59.23±2.30 bx61.52±0.96 ax52.83±2.15 ay商业抗冻剂(4%蔗糖+4%山梨糖醇)50.96±1.01 cy54.52±0.79 cx52.10±0.92 axy样品贮藏时间/d 0
如表1所示,随时间延长,空白、酶解KGM、辐解KGM、T7及商业抗冻剂各组对应冻藏过程中草鱼肌原纤维蛋白质量浓度均在一定程度上降低。其中,空白组、辐解KGM组和T7组冻藏0 d与冻藏10 d对应肌原纤维蛋白质量浓度变化不显著(P>0.05),但是冻藏时间延长至75 d时,变化显著(P<0.05);酶解KGM组冻藏0、10 d及75 d时肌原纤维蛋白质量浓度变化均显著(P<0.05);商业抗冻剂组冻藏0、10、75 d时肌原纤维蛋白质量浓度变化显著(P<0.05),但呈现微弱的波动性变化。当冻藏0 d及10 d时,酶解KGM、辐解KGM及T7各组草鱼肌原纤维蛋白质量浓度均高于空白组及商业抗冻剂组,且差异显著(P<0.05),冻藏0 d时空白组与商业抗冻剂组相近,差异不显著(P>0.05),而冻藏10 d时商业抗冻剂组高于空白组,差异显著(P<0.05);当冻藏75 d时,酶解KGM、辐解KGM、T7及商业抗冻剂各组草鱼肌原纤维蛋白质量浓度均高于空白组,差异显著(P<0.05),酶解KGM及辐解KGM两组均低于商业抗冻剂组,差异显著(P<0.05),T7组与商业抗冻剂组相近,差异不显著(P>0.05)。冻藏过程中蛋白质量浓度的降低源于蛋白质的冷冻变性。杨芳 [17]研究指出冰晶的形成会导致蛋白质发生冷冻变性,主要表现在结合水发生脱离,蛋白质容易聚集,并且伴随冰晶逐渐增大,细胞液外流加剧。在添加多糖后,肌原纤维蛋白最终质量浓度高于空白组可能是由于多糖的冷冻保护作用,即多糖一方面排除蛋白质表面的稳定溶质,促使其优先水合 [18],另一方面与蛋白质的功能基团以离子键或氢键结合,取代极性基团附近的水分子,避免氢键连接点的直接暴露,进而稳定蛋白质的高级结构。Macdonald [19]、Carvajal [20]等研究认为多糖可以形成玻璃态结构或固定水,从而稳定蛋白质,发挥冷冻稳定剂的作用。综上,酶解KGM、辐解KGM及T7对冻藏过程中的草鱼肌原纤维蛋白皆具有一定的冷冻保护作用,且T7效果最佳,与传统商业抗冻剂接近。
2.2 肌原纤维蛋白SDS-PAGE结果
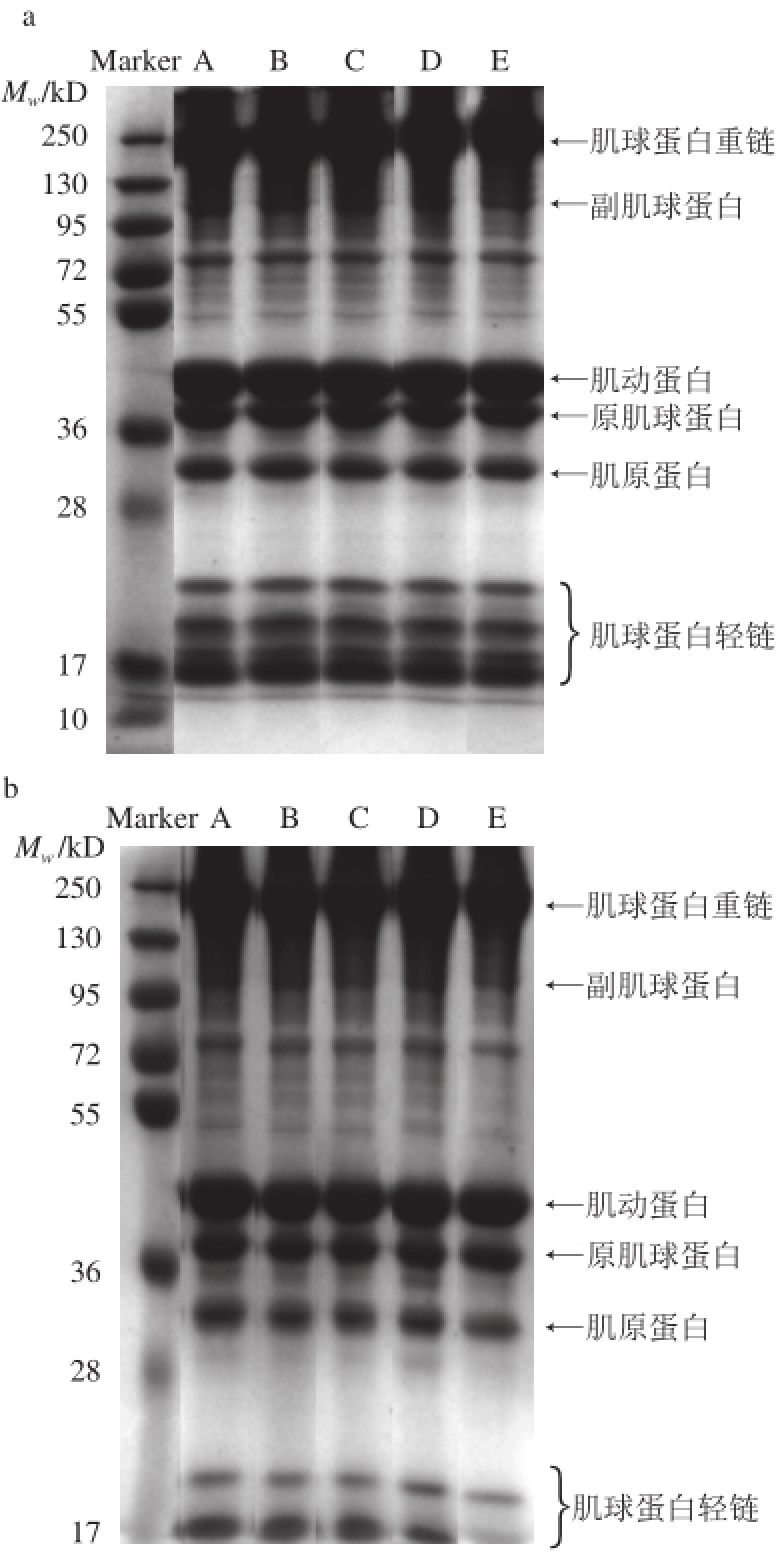
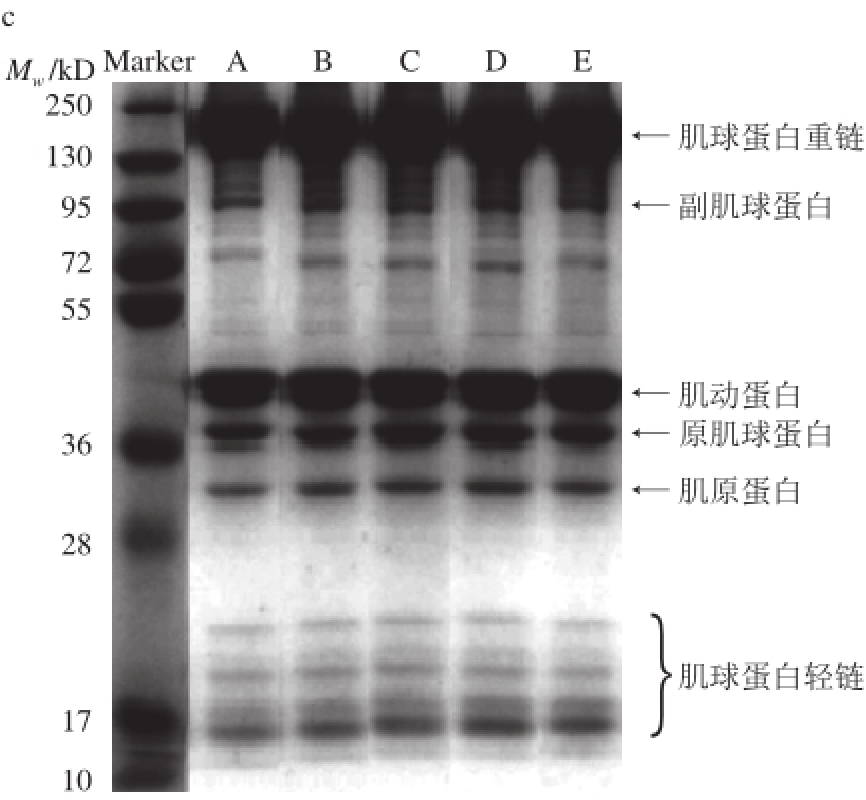
图1 添加不同多糖的草鱼肌原纤维蛋白SDS-PAGE图
Fig.1 SDS-PAGE patterns of grass carp myofibrillar protein with different-molecular-weight polysaccharides added
a.冻藏0 d;b.冻藏10 d;c.冻藏75 d。A.空白;B.酶解KGM;C.辐解KGM;D. T7;E.商业抗冻剂。下同。
如图1所示,草鱼肌原纤维蛋白是一个较为复杂的蛋白体系,在SDS-PAGE图谱上可清晰分辨出约10 条蛋白带,其中主要条带为肌球蛋白重链(220 kD)、副肌球蛋白(100 kD)、肌动蛋白(44.3 kD)、原肌球蛋白(37 kD)、肌原蛋白(33 kD)以及3 种肌球蛋白轻链(15、17、24 kD),结果与Lametsch [21]、Mignino [22]等研究基本一致。另外,还有一些分子质量在72~95 kD间的明显蛋白条带,而肌球蛋白重链和肌动蛋白为最主要的蛋白条带。电泳条带颜色深浅在一定程度上反映肌原纤维蛋白质量浓度高低,观察发现以上电泳条带深浅与肌原纤维蛋白质量浓度相吻合。
在冻藏0 d时,空白、酶解KGM、辐解KGM、T7及商业抗冻剂各组蛋白条带间没有太大差别。但是,当冻藏时间延长至10 d及75 d时,上述各组蛋白条带间出现明显差异。随冻藏时间的延长,空白组蛋白条带整体变窄变浅,其中,肌球蛋白重链、肌球蛋白轻链、副肌球蛋白及肌动蛋白变化明显,最后肌球蛋白轻链甚至消失。肌球蛋白重链变窄可能是因为大分子的肌球蛋白重链降解为小分子的蛋白质从而导致肌球蛋白重链量的减少。同时,分子质量在72~95 kD间蛋白条带变浅,肌动蛋白及原肌球蛋白的条带变窄,且靠近原肌球蛋白处有新的小分子质量条带出现,说明原肌球蛋白和肌动蛋白可能发生部分变性,蛋白质在一定程度上发生降解。相比于空白组,冻藏10 d及75 d时酶解KGM组蛋白条带整体更窄,冻藏75 d时辐解KGM及T7两组蛋白条带中肌球蛋白重链及肌动蛋白均宽于空白组,但是冻藏10 d时原肌球蛋白及肌原蛋白更窄;在冻藏过程中商业抗冻剂组蛋白条带整体宽于空白组,且靠近原肌球蛋白处没有新的小分子质量条带出现,而酶解KGM、辐解KGM及T7各组均出现。另外,最为突出的是酶解KGM、辐解KGM、T7及商业抗冻剂各组副肌球蛋白及肌球蛋白轻链颜色均明显深于空白组,说明酶解KGM、辐解KGM及T7对冻藏过程中的草鱼肌原纤维蛋白尤其对副肌球蛋白及肌球蛋白轻链具有有效的冷冻保护作用。
2.3 肌原纤维蛋白流变性能变化
2.3.1 升温过程中草鱼肌原纤维蛋白G’的变化
流变学特性可以代表蛋白质在升温过程中的相关变化,其中,肌原纤维蛋白G’的改变表明蛋白质弹性凝胶网络形成速率的变化,反映结构的打开、折叠和凝集情况 [23]。
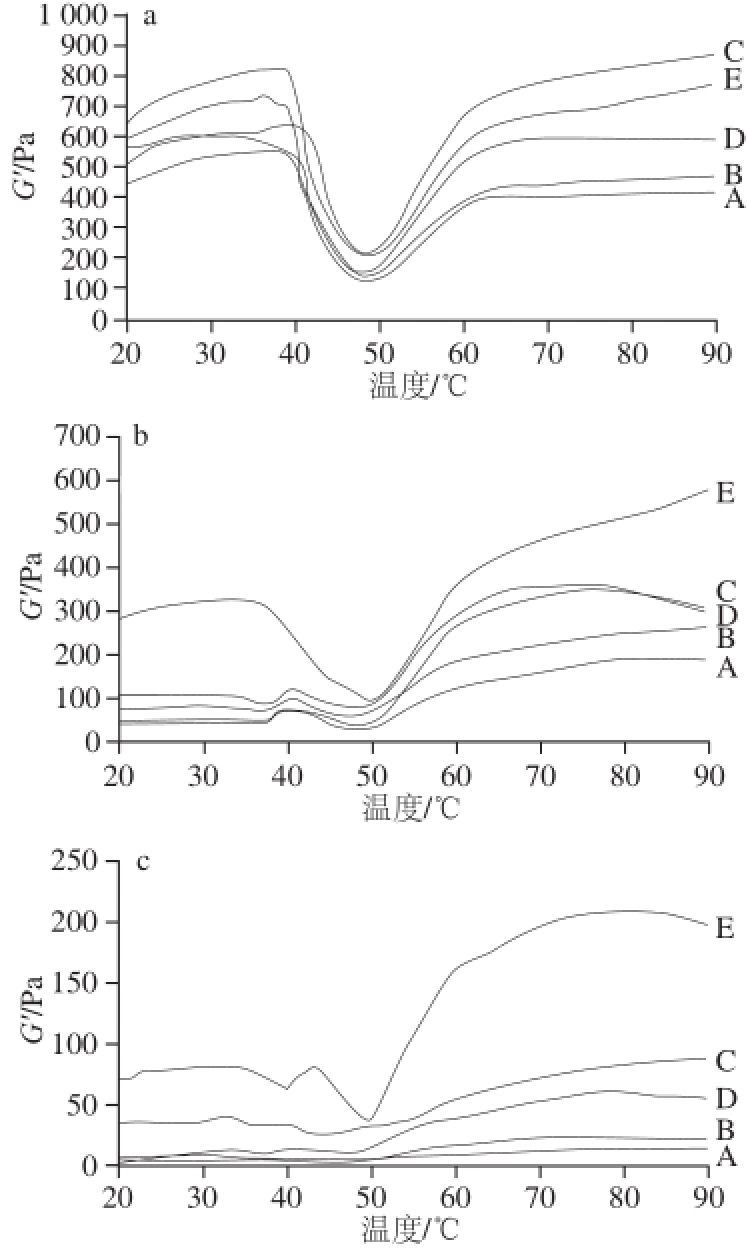
图2 升温过程中草鱼肌原纤维蛋白G’的变化
Fig.2 Changes in G’ of grass carp myofibrillar protein in heating process
图2 a显示,当冻藏0 d时,随着温度的升高,空白、酶解KGM、辐解KGM、T7及商业抗冻剂各组对应冻藏过程中草鱼肌原纤维蛋白G’总体变化趋势相同。当温度由20 ℃上升至40 ℃时,G’升高但变化平缓,其间,空白、酶解KGM、辐解KGM、T7及商业抗冻剂各组对应最高G’分别为618(33 ℃)、559.9(37.7 ℃)、823.1(38.7 ℃)、732.4 Pa(36 ℃)及642.05 Pa(39.7 ℃);在40~50 ℃时,G’迅速下降且在50 ℃左右到达最低值,空白、酶解KGM、辐解KGM、T7及商业抗冻剂各组对应最低G’分别为125(48.3 ℃)、142.75(48.3 ℃)、210.9(47.9 ℃)、159.05 Pa(47.9 ℃)及214.15 Pa(49.6 ℃),在50~65 ℃时呈现明显的上升趋势,在温度上升至90 ℃的过程中,G’缓慢升高最终趋于平缓。
图2b显示,冻藏10 d时,随着温度的升高,空白、酶解KGM、辐解KGM及T7各组对应冻藏过程中草鱼肌原纤维蛋白G’总体变化趋势相同。当温度由20 ℃上升至35 ℃左右时,G’基本保持不变,然后略微下降,当温度到达36 ℃附近时,空白、酶解KGM、辐解KGM及T7各组出现最低G’分别为43.67(36.3 ℃)、48.17(35.6 ℃)、89.18 Pa(38.7 ℃)及69.27 Pa(36.7 ℃);当温度升高至40 ℃时,G’上升且在40 ℃左右到达峰顶,空白、酶解KGM、辐解KGM及T7各组对应最高G’分别为76.51(40.1 ℃)、77(40.1 ℃)、122.9 Pa(40.4 ℃)及 101.85 Pa(40.1 ℃),在40~48 ℃左右时,G’下降至最低值,空白、酶解KGM、辐解KGM及T7各组对应最低G’分别为29.06(47.9 ℃)、43.1(48.6 ℃)、77.6 Pa(47.6 ℃)及54.43 Pa(47.9 ℃),当温度上升至65 ℃前,G’迅速上升,在温度上升至90 ℃的过程中,G’缓慢升高。在温度上升至90 ℃的过程中,G’缓慢升高趋于平缓。但是,商业抗冻剂组在升温过程中草鱼肌原纤维蛋白G’的变化与上述样品组存在明显差别。在20~40 ℃之间,G’基本保持不变,在温度40~50 ℃时,G’迅速下降至最低值88.79 Pa(50 ℃),当温度上升至65 ℃前,G’迅速上升,在温度上升至90 ℃的过程中,G’缓慢升高。
图2c显示,冻藏75 d时,随着温度的升高,酶解KGM、辐解KGM及T7各组对应冻藏过程中草鱼肌原纤维蛋白G’总体变化趋势相同。当温度由20 ℃上升至33 ℃左右时,G’缓慢上升至第一个峰顶,此时酶解KGM、辐解KGM及T7各组对应草鱼肌原纤维蛋白G’为4.749(33.6 ℃)、37.79 Pa(32.6 ℃)及11.25 Pa(34 ℃),然后缓慢下降,当温度接近37 ℃时出现峰谷,此时酶解KGM、辐解KGM及T7各组对应草鱼肌原纤维蛋白G’为3.693(37 ℃)、32.14 Pa(36.7 ℃)及9.487 Pa(37 ℃),当温度到达36 ℃附近时,空白、酶解KGM、辐解KGM及T7各组出现最低G’分别为43.67(36.3 ℃)、48.17(35.6 ℃)、89.18 Pa(38.7 ℃)及69.27 Pa(36.7 ℃);当温度升高至40 ℃时出现第2个峰顶,此时KGM、辐解KGM及T7各组对应G’为4.569(40.1 ℃)、33.37 Pa(39.8 ℃)及12.55 Pa(40.4 ℃),然后缓慢下降,直至47 ℃左右后G’缓慢上升。但是,空白组及商业抗冻剂组在升温过程中草鱼肌原纤维蛋白G’的变化与上述样品组存在明显差别。对于空白组,在20~33 ℃之间,G’缓慢上升至第一个峰顶,此时G’为7.683 Pa(33.6 ℃),在温度上升至48 ℃的过程中,G’缓慢下降,最后在温度上升至90 ℃期间G’再次缓慢上升趋于稳定。对于商业抗冻剂组,在20~40 ℃之间,G’缓慢下降至第一个峰谷,此时G’为63.33 Pa(40.1 ℃),当温度升高至44 ℃,G’上升至第一个峰顶78.54Pa(43.8 ℃),然后迅速下降至第2个峰谷,此时G’为37.46 Pa(49.7 ℃),之后迅速上升直至温度到达70 ℃,最后在70~90 ℃之间,G’上升但变化微弱。
升温过程中肌原纤维蛋白G’的变化曲线反映了蛋白质开始变性、发生聚集及形成空间网络的过程 [24]。图2a、b中,在温度由20 ℃上升至30 ℃左右时,G’的上升可能由于肌原纤维蛋白在低温条件下发生的相互作用 [25]。G’于40 ℃附近出现一个峰可能是因为肌球蛋白开始形成网络结构,而图2c中,G’于30~40 ℃之间出现两个峰一方面因为变性肌球蛋白头部与解旋肌球蛋白尾部的结合 [26],另一方面归于肌球蛋白头部和尾部热稳定性不同,因此发生热变性形成网络结构的温度存在一定差异。随后,在40~50 ℃之间G’迅速下降一方面因为肌球蛋白发生解螺旋,从而破坏蛋白质网络结构的完整性 [27]并导致流动性增强 [27],另一方面因为肌动球蛋白复合物的解体 [7],还可能因为加热激活蛋白酶,肌球蛋白量降低,更容易击破松散的凝胶网络 [25]。当温度由50 ℃上升至65 ℃左右时,G’再次升高是由于超过变性温度后分子展开,活跃基团暴露 [28],解螺旋蛋白质开始聚集、沉淀及交联,再次构建空间网络结构 [29],这主要依靠二硫键、疏水相互作用及肌球蛋白的不可逆交联 [30]。最后,温度在上升至90 ℃过程中,G’上升意味着蛋白质凝胶网络随着活性基团的暴露刚性增强。有研究发现草鱼肌原纤维蛋白G’与温度密切相关,在升温过程中G’先上升(20~55 ℃),再下降(55~63 ℃),最后上升(63~85 ℃) [5,31],其中,G’的减小源于蛋白质分子内和分子间的破坏,当蛋白质螺旋转变为卷曲状构象后,半凝胶的流动性急剧增大,故而破坏蛋白质网络结构 [32],与本实验的结果基本吻合。
当冻藏0 d时,在升温过程(20~90 ℃)中草鱼肌原纤维蛋白G’由高到低依次为:辐解KGM组>商业抗冻剂组>T7组>酶解KGM组>空白组,即加入不同相对分子质量多糖的样品弹性大小由高到低依次为:辐解KGM组>商业抗冻剂组>T7组>酶解KGM组>空白组;当冻藏10 d及75 d时升温过程中草鱼肌原纤维蛋白G’由高到低依次为:商业抗冻剂组>辐解KGM组>T7组>酶解KGM组>空白组,即加入不同相对分子质量多糖的样品弹性大小由高到低依次为:商业抗冻剂组>辐解KGM组>T7组>酶解KGM组>空白组。
随冻藏时间的延长,空白、酶解KGM、辐解KGM及T7各组对应草鱼肌原纤维蛋白G’均下降,与各组冻藏过程草鱼肌原纤维蛋白质量浓度的变化基本吻合。不同样品组在相同冻藏时间条件下,草鱼肌原纤维蛋白G’大小与SDS-PAGE图谱中蛋白条带颜色深浅及宽度相关联。肌球蛋白作为肌原纤维蛋白主要组成成分,其热变性温度在40 ℃左右,图2中40 ℃附近各组峰值大小则与蛋白条带中肌球蛋白条带颜色深浅及宽度吻合;同一样品组在不同冻藏时间下,草鱼肌原纤维蛋白G’大小随冻藏时间的延长整体逐渐减小,同时SDS-PAGE图谱中蛋白条带也呈现整体逐渐变浅变窄的趋势,即二者相互吻合。观察草鱼肌原纤维蛋白G’发现,商业抗冻剂作为阳性对照,效果明显优于酶解KGM、辐解KGM及T7这3 种多糖,这可能与商业抗冻剂的高添加量密切相关。但是,从上述现象中不难得出这3 种多糖对整个冻藏过程中的草鱼肌原纤维蛋白皆起到一定的冷冻保护作用,且对照SDS-PAGE图谱发现它们主要保护副肌球蛋白和肌球蛋白轻链。肌球蛋白轻链具有与肌动蛋白结合的能力及ATP酶活性 [33-34],由于肌动蛋白无法单独形成凝胶,只有与肌球蛋白轻链结合后,再与伸展的肌球蛋白形成蛋白质凝胶网络 [35],故而肌球蛋白轻链在很大程度上决定肌原纤维蛋白凝胶的形成 [33-34]。副肌球蛋白主要由α-螺旋组成,在冷冻变性时α-螺旋会部分转化为β-折叠和无规则卷曲结构 [36],蛋白质构象的稳定性和紧密程度大幅下降,在进一步解旋后,多肽键伸展,蛋白质内部疏水残基暴露,疏水相互作用增强,同时巯基氧化成二硫键,导致蛋白质相互聚合从而变性 [37]。本课题组在前期研究的基础上发现,辐解KGM和酶解KGM通过稳定α-螺旋和β-折叠保护蛋白质二级结构从而延缓聚集变性 [12]。由此,推测这3 种多糖可能保护副肌球蛋白的α-螺旋及肌球蛋白轻链,在一定程度上延缓副肌球蛋白的解螺旋及肌球蛋白轻链的重折叠,有利于保持蛋白质结构的完整性,从而减小蛋白质凝胶性能的损失,故而G’均高于空白组,即这3 种多糖对整个冻藏过程中的草鱼肌原纤维蛋白皆起到一定的冷冻保护作用,其中,辐解KGM冷冻保护作用最强,T7次之,酶解KGM具有冷冻保护作用但是效果最弱。
2.3.2 降温过程中草鱼肌原纤维蛋白G’的变化

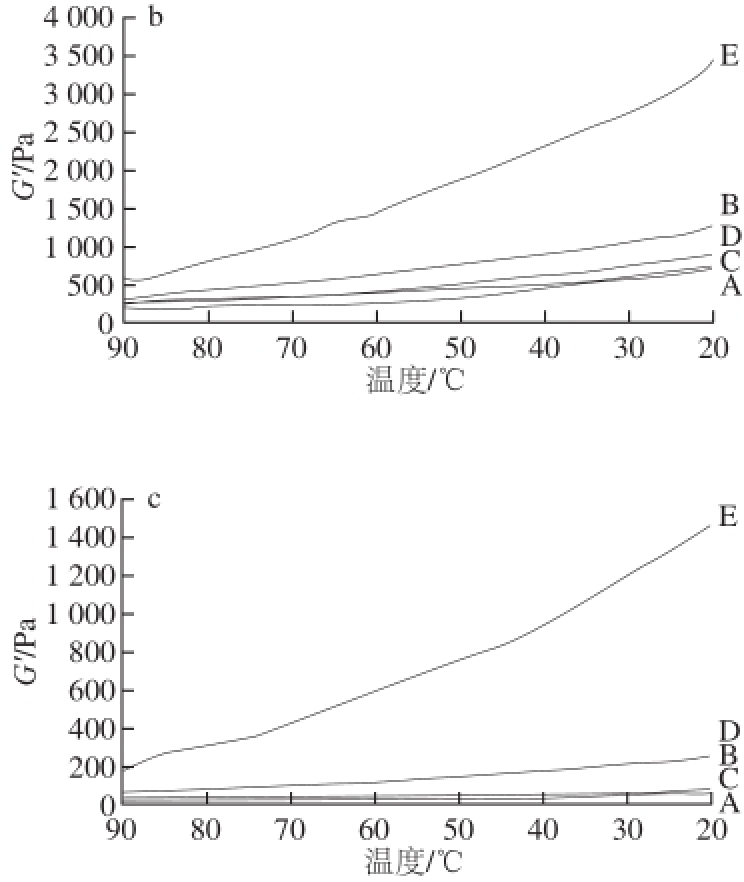
图3 升温过程中草鱼肌原纤维蛋白G’的变化
Fig.3 Changes in G’ of grass carp myofibrillar protein in heating process
图3 a显示,当冻藏0 d时,随着温度的降低(由90 ℃下降至20 ℃),空白、酶解KGM、辐解KGM、T7及商业抗冻剂各组对应冻藏过程中草鱼肌原纤维蛋白G’均呈上升趋势,说明低温有利于肌原纤维蛋白凝胶形成,不同多糖组变化趋势相同。在降温过程中草鱼肌原纤维蛋白G’由高到低依次为:T7组>空白组>商业抗冻剂组>辐解KGM组>酶解KGM组,即加入不同相对分子质量多糖的样品弹性大小由高到低依次为:T7组>空白组>商业抗冻剂组>辐解KGM组>酶解KGM组。
图3b显示,当冻藏10 d时,随着温度的降低,空白、酶解KGM、辐解KGM、T7及商业抗冻剂各组对应冻藏过程中草鱼肌原纤维蛋白G′均呈上升趋势,说明低温有利于肌原纤维蛋白凝胶形成,不同多糖组变化趋势相同。在降温过程中草鱼肌原纤维蛋白G′由高到低依次为:商业抗冻剂组>酶解KGM组>T7组>辐解KGM组>空白组,即加入不同相对分子质量多糖的样品弹性大小由高到低依次为:商业抗冻剂组>酶解KGM组>T7组>辐解KGM组>空白组。
图3c显示,当冻藏75 d时,随着温度的降低,空白、酶解KGM、辐解KGM、T7及商业抗冻剂各组对应冻藏过程中草鱼肌原纤维蛋白G’均呈上升趋势,说明低温有利于肌原纤维蛋白凝胶形成,不同多糖组变化趋势相同。在降温过程中草鱼肌原纤维蛋白G’由高到低依次为:商业抗冻剂组>T7组>酶解KGM组>辐解KGM组>空白组,即加入不同相对分子质量多糖的样品弹性大小由高到低依次为:商业抗冻剂组>T7组>酶解KGM组>辐解KGM组>空白组。
已有研究 [25,28]发现,在温度由90 ℃下降至20 ℃过程中,草鱼和鸡肉肌原纤维蛋白G’一直上升,这意味着蛋白质凝胶网络在冷却过程中增强。随着冻藏时间的延长,同一样品组在降温过程中草鱼肌原纤维蛋白G’下降,代表着蛋白质凝胶网络强度逐渐下降,但是,在相同冻藏时间条件下酶解KGM、辐解KGM、T7及商业抗冻剂各组G’均上升且基本皆高于空白组,说明酶解KGM、辐解KGM、T7及商业抗冻剂都能够增强草鱼肌原纤维蛋白凝胶网络的强度。其中,商业抗冻剂作为阳性对照,效果明显优于酶解KGM、辐解KGM及T7这3 种多糖。但是,从上述现象中不难发现这3 种多糖对整个冻藏过程中的草鱼肌原纤维蛋白皆起到一定的冷冻保护作用,且三者中T7冷冻保护作用最强,酶解KGM次之,辐解KGM具有冷冻保护作用但是效果最弱。
2.3.3 频率扫描过程中草鱼肌原纤维蛋白G′的变化

图4 频率扫描过程中草鱼肌原纤维蛋白G’的变化
Fig.4 Changes in G’ of grass carp myofibrillar protein in frequency scanning process
图4 a显示,当冻藏0 d时,随着频率的升高(0.1~10 Hz),空白、酶解KGM、辐解KGM、T7及商业抗冻剂各组对应冻藏过程中草鱼肌原纤维蛋白G’总体变化趋势相同且皆略有升高。在频率扫描过程中草鱼肌原纤维蛋白G′由高到低依次为:辐解KGM组>T7组>商业抗冻剂组>空白组>酶解KGM组,即加入不同相对分子质量多糖的样品弹性大小由高到低依次为:辐解KGM组>T7组>商业抗冻剂组>空白组>酶解KGM组。
图4b显示,当冻藏10 d时,随着频率的升高,空白、酶解KGM、辐解KGM、T7及商业抗冻剂各组对应冻藏过程中草鱼肌原纤维蛋白G’总体变化趋势相同且皆略有升高。在频率扫描过程中草鱼肌原纤维蛋白G’由高到低依次为:商业抗冻剂组>酶解KGM组>T7组>辐解KGM组>空白组,即加入不同相对分子质量多糖的样品弹性大小由高到低依次为:商业抗冻剂组>酶解KGM组>T7组>辐解KGM组>空白组。
图4c显示,当冻藏75 d时,随着频率的升高,空白、酶解KGM、辐解KGM、T7及商业抗冻剂各组对应冻藏过程中草鱼肌原纤维蛋白G’总体变化趋势相同且皆略有升高。在频率扫描过程中草鱼肌原纤维蛋白G’由高到低依次为:商业抗冻剂组>T7组>酶解KGM组>辐解KGM组>空白组,即加入不同相对分子质量多糖的样品弹性大小由高到低依次为:商业抗冻剂组>T7组>辐解KGM组>酶解组>空白组。
频率扫描主要反映材料力学性能和频率的关系,展示不明显次级转变的特性 [38]。在相同冻藏时间条件下,各组G’在整个频率扫描范围内皆呈单调性增大,与部分聚合物溶液在低频率扫描时表现的黏弹性极为相似 [39],很好地揭示了凝胶微观结构的变化 [40],另外,这意味着随扫描频率的升高,肌原纤维蛋白三维凝胶网络的凝胶性能增强。随着冻藏时间的延长,同一样品组在频率扫描过程中草鱼肌原纤维蛋白G’下降,代表蛋白质凝胶网络强度逐渐下降,但是,酶解KGM、辐解KGM、T7及商业抗冻剂各组基本皆高于空白组,说明酶解KGM、辐解KGM、T7及商业抗冻剂都能够增强草鱼肌原纤维蛋白凝胶网络的弹性。其中,商业抗冻剂作为阳性对照,效果明显优于酶解KGM、辐解KGM及T7这3 种多糖。但是,从上述现象中不难发现这3 种多糖对整个冻藏过程中的草鱼肌原纤维蛋白皆起到一定的冷冻保护作用,且三者中T7冷冻保护作用最强,酶解KGM次之,辐解KGM具有冷冻保护作用但是效果最弱。
随冻藏时间的延长,空白、酶解KGM、辐解KGM、T7及商业抗冻剂各组对应草鱼肌原纤维蛋白质量浓度和G’皆下降,与冻藏过程草鱼肌原纤维蛋白SDS-PAGE条带的变化基本吻合。同时,添加上述不同多糖各组草鱼肌原纤维蛋白质量浓度和G’均高于空白组,对照SDS-PAGE图发现多糖主要保护副肌球蛋白和肌球蛋白轻链,延缓副肌球蛋白的解螺旋及肌球蛋白轻链的重折叠,减轻蛋白质的冷冻变性,有利于保持蛋白质结构的完整性,从而减小蛋白质凝胶性能的损失。其中,辐解KGM、T7、酶解KGM效果依次减弱,但都对冻藏过程中的草鱼肌原纤维蛋白具有一定的冷冻保护作用。
参考文献:
[1] 杨振, 孔保华. 抗冻剂对冷冻鱼糜蛋白理化和凝胶特性的影响综述[J].食品科学, 2011, 32(23): 321-325.
[2] 薛勇, 薛长湖, 李兆杰, 等. 海藻糖对冻藏过程中鳙肌原纤维蛋白冷冻变性的影响[J]. 中国水产科学, 2006, 13(4): 637-641. DOI:10.3321/j.issn:1005-8737.2006.04.020.
[3] 张静雅, 陆剑锋, 林琳, 等. 鲢鱼冷冻鱼糜抗冻剂的复配研究[J]. 食品科学, 2012, 33(2): 127-132.
[4] 陈复生, 郭兴凤. 蛋白质化学与工艺[M]. 郑州: 郑州大学出版社, 2012.
[5] XIA Xiufang, KONG Baohua, XIONG Youling, et al. Decreased gelling and emulsifying properties of myofibrillar protein from repeatedly frozen-thawed porcine longissimus muscle are due to protein denaturation and susceptibility to aggregation[J]. Meat Science,2010, 85(3): 481-486. DOI:10.1016/j.meatsci.2010.02.019.
[6] LIU R, ZHAO S M, XIONG S B. Rheological properties of fish actomyosin and pork actomyosin solutions[J]. Journal of Food Engineering, 2008, 85(2): 173-179. DOI:10.1016/ j.jfoodeng.2007.06.031.
[7] WESTPHALEN A, BRIGGS J, LONERGAN S. Influence of muscle type on rheological properties of porcine mypfibrillar protein during heat-induced gelation[J]. Meat Science, 2006, 72(4): 697-703.
[8] 周爱梅, 龚翠, 曹环, 等. 几种新型抗冻剂对鲮鱼鱼糜蛋白抗冻效果研究[J]. 食品工业科技, 2010, 31(11): 318-321.
[9] 张延华, 马国红, 宋理平, 等. 4 种鱼肉的基本成分及胶原蛋白含量分析[J]. 中国农村小康科技, 2014, 4(9): 80.
[10] 刘红彦. 鲤鱼肌肉中肌原纤维蛋白的性质研究[D]. 天津: 天津商业大学, 2012: 10-11.
[11] WANG L, XIONG G Q, PENG Y B , et al. The cryoprotective effect of different konjac glucomannan (KGM) hydrolysates on the glass carp (Ctenopharygodon idella) myofibrillar during frozen storage[J]. Food Bioprocess Technology, 2014, 7(12): 3398-3406. DOI:10.1007/ s11947-014-1345-3.
[12] 汪兰, 吴文锦, 乔宇, 等. 冻藏条件下魔芋葡甘聚糖降解产物对肌原纤维蛋白结构的影响[J]. 食品科学, 2015, 36(22): 244-249. DOI:10.7506/spkx1002-6630-201522046.
[13] 周茹, 倪渠峰, 林伟伟, 等. 肌原纤维蛋白溶解度对盐离子浓度的依赖性[J]. 中国食品学报, 2015, 15(3): 32-39. DOI:10.16429/j.1009-7848.2015.03.005.
[14] LAEMMLI U. Cleavage of structural proteins during the assembly of the head of the bacteriophage T4[J]. Nature, 1970, 227: 680-685. DOI:10.1038/227680a0.
[15] 郭尧君. 蛋白质电泳实验技术[M]. 北京: 科学出版社, 2005.
[16] 刘泽宇, 刘焱, 罗灿. 茶多酚对草鱼鱼肉蛋白质流变学特性的影响[J].现代食品科技, 2015, 31(6): 50-58.
[17] 杨芳. 阿根廷鱿鱼肌原纤维蛋白特性及其加工的研究[D]. 厦门: 集美大学, 2009. DOI:10.7666/d.y2164116
[18] ARAKAWA T, TIMASHEFF S N. Stabilization of protein structure by sugars[J]. Biochemistry, 1982, 21(25): 6536-6544. DOI:10.1021/ bi00268a033.
[19] MACDONALD G A, LANIER T. Carbohydrates as cryoprotectants for meats and surimi[J]. Food Technology, 1991, 45: 151-159.
[20] CARVAJAL P A, MACDONALD G A, LANIER T. Cryostabilization mechanism of fish muscle proteins by maltodextrins[J]. Cryobiology,1999, 38(1): 16-26. DOI:10.1006/cryo.1998.2142 .
[21] LAMETSCH R, ROEPSTORFF P, MØLLER H S, et al. Identification of myofibrillar substrates for calpain[J]. Meat Science, 2004, 68(4): 515-521. DOI:10.1016/j.meatsci.2004.03.018.
[22] MIGNINO L A, PAREDI M E. Physico-chemical and functional properties of myofibrillar proteins from different species of molluscs[J]. LWT-Food Science and Technology, 2006, 39(1): 35-42. DOI:10.1016/j.lwt.2004.12.004.
[23] XIONG Y L, BLANCHARD S P. Myofibrillar protein gelation: viscoelastic changes related to heating procedures[J]. Journal of Food Science, 1994, 59(4): 734-738. DOI:10.1111/j.1365-2621.1994. tb08115.x.
[24] 彭晓蓓. 肌原纤维蛋白及其与脂肪替代品混合凝胶流变性与形成机制研究[D]. 南京: 南京财经大学, 2012.
[25] SUN Fengyuan, HUANG Qilin, HUA Ting, et al. Effects and mechanism of modified starches on the gel properties of myofibrillar protein from grass carp[J]. International Journal of Biological Macromolecules, 2014, 64: 17-24. DOI:10.1016/ j.ijbiomac.2013.11.019.
[26] CAO Yungang, XIONG Youling L. Chlorogenic acidmediated gel formation of oxidatively stressed myofibrillar protein[J]. Food Chemistry, 2015, 180: 235-243. DOI:10.1016/ j.foodchem.2015.02.036.
[27] SANO T, NOGUCHI S F, TAUCHIYA T. Dynamic viscoelastic behavior of natural actomyosin and myosin during thermal gelation[J]. Food Science, 1988, 53: 924-928. DOI:10.1111/j.1365-2621.1988. tb08987.x.
[28] SUN Xiangdong, ARNTFIELD S D. Gelation properties of chicken myofibrillar protein induced by transglutaminase crosslinking[J]. Journal of Food Engineering, 2011, 107(2): 226-233. DOI:10.1016/ j.jfoodeng.2011.06.019.
[29] 于巍, 周坚. 草鱼盐溶蛋白保水性及流变性质的研究[J]. 食品与发酵工业, 2007, 33(10): 72-75.
[30] LIU Qin, BAO Hairong, XI Chunrui, et al. Rheological characterization of tuna myofibrillar protein in linear and nonlinear viscoelastic regions[J]. Journal of Food Engineering, 2014, 121: 58-63. DOI:10.1016/j.jfoodeng.2013.08.016.
[31] CHEN Hongsheng, DIAO Jingjing, LI Yuanyuan, et al. The effectiveness of clove extracts in the inhibition of hydroxyl radical oxidation-induced structural and rheological changes in porcine myofibrillar protein[J]. Meat Science, 2016, 111: 60-66. DOI:10.1016/ j.meatsci.2015.08.017.
[32] 陈文博. 肌原纤维蛋白热诱导凝胶形成机制研究[D]. 南京: 南京农业大学, 2010.
[33] 黄晓钰, 余海虎. 冷藏期间淡水鱼新鲜度变化的研究[J]. 华南农业大学学报, 1997, 18(3): 100-104.
[34] JÓNSDÓTTIR R, ÓLAFSDÓTTIR G, CHANIE E, et al. Volatile compounds suitable for rapid detection as quality indicators of cold smoked salmon (Salmo salar)[J]. Food Chemistry, 2008, 109(1): 184-195.
[35] 王伟, 汪梦非, 姚遥, 等. 魔芋葡甘聚糖胶囊对鸭肉盐溶性蛋白凝胶特性的影响[J]. 食品工业科技, 2013, 34(20): 144-148.
[36] 曾淑薇, 李吉利, 熊善柏, 等. 磷酸盐对草鱼肌原纤维蛋白结构的影响[J]. 食品科学, 2014, 35(23): 48-51. DOI:10.7506/spkx1002-6630-201423010.
[37] 任丽娜. 白鲢鱼肉肌原纤维蛋白冷冻变性的研究[D]. 无锡: 江南大学, 2014.
[38] 张俐娜. 高分子物理近代研究方法[M]. 武汉: 武汉大学出版社, 2006.
[39] 张玲. 胶原多肽在离子液体中的溶解及溶液流变性研究[D]. 济南:山东轻工业学院, 2011.
[40] CHING S H, BANSAL N, BHANDARI B. Rheology of emulsionfilled alginate microgel suspensions[J]. Food Research International,2016, 80: 50-60. DOI:10.1016/j.foodres.2015.12.016.
Effect of Different Polysaccharides on the Rheology of Grass Carp Myofibrillar Proteins during Frozen Storage
SHAO Ying
1,2, WANG Xiaohong
2, XIONG Guangquan
1, LI Xin
1, WU Wenjin
1, QIAO Yu
1, DING Anzi
1, LIAO Li
1, WANG Jun
1, WANG Lan
1,*
(1. Farm Products Processing Research Sub-Center of Hubei Innovation Center of Agriculture Science and Technology,Institute of Agricultural Products Processing and Nuclear-Agricultural Technology, Hubei Academy of Agricultural Sciences,Wuhan 430064, China; 2. College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
Abstract:The study aimed to investigate the cryoprotective effect and mechanism of different polysaccharides on grass carp myofibrillar protein during frozen storage. Grass carp myofibrillar proteins added with 0.5% β-glucanase konjac glucomannan (KGM) hydrolysate, 0.5% irradiation degraded KGM and 0.5% dextran, respectively, were stored at -18 ℃ for 0, 10 d and 75 d. Changes in myofibrillar protein concentration, sodium dodecyl sulfate-polyacrylamide gel electrophoresis(SDS-PAGE) pattern and rheology were measured. Results showed that the concentration and storage modulus (G’) of grass carp myofibrillar protein added with nothing, β-glucanase KGM hydrolysate, irradiation degraded KGM, dextran T7 and a commercial antifreeze decreased with frozen storage time, which was in accordance with the changes in SDS-PAGE pattern during frozen storage. At the same time, the concentration and storage modulus (G’) of grass carp myofibrillar protein added with different polysaccharides were higher than those of the control. It was demonstrated that the cryoprotection of β-glucanase KGM hydrolysate, irradiated degraded KGM and dextran on grass carp myofibrillar proteins was achieved by protecting the alpha helix structure of vice myosin and myosin light chain. The cryoprotection of different polysaccharides was in the decreasing order: irradiation degraded KGM > dextran T7 > β-glucanase KGM hydrolysate.
Key words:myofibrillar protein; polysaccharide; cryoprotective effect; SDS-PAGE; rheology
DOI:10.7506/spkx1002-6630-201618048
中图分类号:TS254.1
文献标志码:A
文章编号:1002-6630(2016)18-0304-09
引文格式:
邵颖, 王小红, 熊光权, 等. 不同多糖对冻藏过程中草鱼肌原纤维蛋白流变性的影响[J]. 食品科学, 2016, 37(18): 304-312. DOI:10.7506/spkx1002-6630-201618048. http://www.spkx.net.cn
SHAO Ying, WANG Xiaohong, XIONG Guangquan, et al. Effect of different polysaccharides on the rheology of grass carp myofibrillar proteins during frozen storage[J]. Food Science, 2016, 37(18): 304-312. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201618048. http://www.spkx.net.cn
收稿日期:2016-03-16
基金项目:武汉市青年科技晨光计划项目(2015070404010197);湖北省重大科技创新计划项目(2015ABA038);湖北省科技支撑计划项目(2014BBA158);湖北省农科院青年科学基金项目(2013NKYJJ16)
作者简介:邵颖(1994—),女,学士,研究方向为水产品加工。E-mail:275673017@qq.com
*通信作者:汪兰(1981—),女,副研究员,博士,研究方向为农产品加工和天然产物化学。E-mail:11060577@qq.com