丁 俭,张巧智,韩天翔,隋晓楠,董济萱,李 杨*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
摘 要:以大豆油脂体乳液为研究对象,利用动态表面张力测量、动态激光散射、圆二色光谱、共聚焦等技术研究大豆油脂体在不同温度(30、50、70 、90 ℃)条件下乳液的物理稳定性、氧化稳定性及油脂体表面蛋白二级结构的变化,考察了温度对乳液界面张力、界面特性的影响。结果表明:热处理降低了大豆油脂体乳液表面电荷和界面张力,改变了界面强度;油脂体表面蛋白的二级结构α-螺旋含量从(17.71±0.01)%下降到(15.3±0.03)%,无规卷曲含量从(29.96±0.01)%下降到(27.3±0.06)%,β-转角含量从(22.34±0.05)%下降到(21.2±0.03)%,β-折叠含量从(29.89±0.06)%增加到(36.1±0.02)%,热处理改变了维持油脂体表面蛋白二级结构的作用力,影响二级结构含量变化,表现出不同的界面特性;4 个温度热处理没有明显促进油体的絮凝;30 ℃和50 ℃热处理的乳液,油脂氧化的氢过氧化物相对较少,表明热处理改变了大豆油脂体乳液的界面特性,进而影响油脂体乳液的物理稳定性和氧化稳定性。
关键词:大豆油脂体乳液;热处理;界面特性;稳定性
大豆中含有大量的油脂和蛋白质,具有极高的营养价值和优良的保健功能,油脂和蛋白质以独立分离亚细胞态细胞器油脂体和蛋白体贮存于大豆子叶细胞内。Tzen等 [1]深入分析了油脂体结构模型,发现油脂体是由半单位膜包裹液态甘油三酯而形成的球体。半单位膜由单层磷脂分子及镶嵌蛋白(又名油脂体蛋白)组成(磷脂占油脂体表面成分的80%,镶嵌蛋白为20%),其镶嵌蛋白的种类可分为3种,分别为Oleosin、Caleosin和Steroleosin。磷脂和蛋白质有很好的乳化性,在油脂体结构中磷脂层的疏水酰基与内部的三酰甘油酯相互作用,亲水头部基团朝向细胞液,镶嵌蛋白包裹在油脂体表面具有维持油脂体稳定的重要作用 [2]。Oleosin蛋白是大豆油脂体表面最主要蛋白,维持油脂体物理、化学特性,在保护油脂体抗环境压力免受加热、pH值和氧化试剂的影响方面发挥重要作用。大豆油脂体可以作为一种天然的蛋白乳化体系,在食品行业中有广泛的应用。目前有关蛋白乳液特性的研究已有很多,Kumar等 [3]对油-水乳液的乳化稳定性的研究表明:乳滴发生絮凝时间与乳液油水界面黏度相关,即油水界面黏度越大,所形成的乳状液也越稳定,界面强度越大,乳液越稳定。Wang Jinmei等 [4]对天然和热处理的大豆分离蛋白形成的乳液进行研究,表明热处理蛋白稳定的乳状液相比于天然大豆分离蛋白所形成的乳状液具有更高的水力半径和更易发生可溶性聚集。大豆油脂体作为天然蛋白乳液不需要乳化剂和均质过程,而且稳定性相对于人工乳液更加稳定,在食品工业中也越来越受关注。Chen Bincan等 [5]研究了大豆油脂体在不同贮藏温度下的氧化稳定性,表明加热可以钝化酶和微生物的活性,有利于油脂体的贮藏和在食品工业中的应用。Iwanaga等 [6]研究发现大豆油脂体乳液在从30 ℃加热至90 ℃处理过程中,温度超过60 ℃时大豆油脂体的界面性质发生变化,ζ电位降低,粒径大小并没有发生显著变化。陈业明等 [7]研究发现热处理强度和pH值的增加会抑制大豆油脂体表面蛋白P34活性和促进外源性蛋白从油脂体上解离。大豆油脂体乳化体系的稳定性取决于油脂体之间的相互作用、界面组成特性和环境因素。目前温度对大豆油脂体乳液稳定性及相关研究已有较多,但从油脂体表面蛋白微观结构变化解析对乳液稳定及氧化稳定性影响相对较少。因此,本实验针对大豆油脂体表面蛋白对油脂体稳定所起的关键作用,研究表面蛋白在不同温度条件下构象改变对蛋白特性的影响,分析油脂体间的相互作用力和表面蛋白界面性质,为提高大豆油脂体在产品的加工、贮藏和运输中的稳定性提供理论依据。本实验采用圆二色光谱、动态表面张力测量、动态激光散射、激光共聚焦等技术分析了大豆油脂体在不同温度条件下油脂体表面蛋白二级结构的变化、界面张力、界面特性、粒径分布等相关性质的改变,结合絮凝指数、油脂体乳液微观结构和氧化稳定性,进一步揭示温度对大豆油脂体物理特性及氧化稳定性的影响。
1.1 材料与试剂
大豆东农46号 东北农业大学大豆研究所。
三羟甲基氨基甲烷盐酸盐(Tris-HCl) 北京百奥莱博科技有限公司;蔗糖 天津科密欧化学试剂有限公司;异辛烷 天津市富宇精细化工有限公司;异丙醇、丁醇、甲醇 天津市天力化学试剂有限公司;硫氰酸铵、氯化钡 天津市双船化学试剂厂;硫酸亚铁、氯化钠、氢氧化钠 天津市光复精细化工研究所;尼罗红、尼罗兰美国Sigma公司;其他试剂为国产分析纯。
1.2 仪器与设备
组织捣碎机 江苏金坛市双捷实验仪器厂;FA2004电子分析天平 上海舜宇恒平科学仪器有限公司;LGR20-W台式高速冷冻离心机 北京京立离心机有限公司;BGZ-246电热鼓风干燥箱;HH-420恒温电热水浴锅 金坛市双捷实验仪器厂;TCS SP5激光共聚焦扫描电子显微镜 德国徕卡公司;Mastersizer 2000激光粒度仪、Zetasizer Nano ZSP纳米粒度电位仪 英国马尔文仪器有限公司;PS20动态表面张力测量仪 上海梭伦信息科技有限公司。
1.3 方法
1.3.1 大豆油脂体的提取及化学组成测定
参考Tzen [8]和吴娜娜 [9]等方法进行改进。将大豆和水以料液比1∶5(m/V)的比例浸泡在蒸馏水中,在4~6 ℃条件下放置18~20 h。将浸泡后的大豆置于pH 7.5的缓冲溶液(包含50 mmol/L Tris-HCl、0.4 mol/L 蔗糖、0.5 mol/L氯化钠,浸泡后大豆与缓冲溶液料液比为1∶5,m/V)中,用组织捣碎机将其破碎10 min得到大豆匀浆液。用3层滤布过滤除去豆渣,滤液在4 ℃、10 000 r/min条件下离心30 min,收集最上层乳状物。将收集到的上层乳状物均匀分散在上述缓冲溶液(1∶1,m/V)中,在4 ℃、10 000 r/min的条件下离心30 min,收集最上层乳状物。然后分散在8 mol/L的尿素和Tris-HCl组成的缓冲溶液(1∶5,m/V)中,其中尿素和Tris-HCl缓冲溶液体积比为1∶1,在4 ℃、10 000 r/min条件下,离心30 min,收集最上层乳状物。将得到的上层乳状物质均匀分散在50 mmol/L,Tris-HCl缓冲溶液(1∶5,m/V)中,在4 ℃、10 000 r/min条件下离心30 min,重复2 次。最后提取得到的上层乳状物用去离子水清洗离心后即为大豆油脂体,放置于4 ℃冰箱中备用。大豆油脂体化学组成采用美国分析化学家协会(Association of Offi cial Analytical Chemists,AOAC)标准方法 [10]测定,采用烘箱法 [11]、索氏抽提方法 [12]和杜马斯燃烧方法 [13]测定大豆油脂体含水量、脂肪和蛋白质含量。
1.3.2 大豆油脂体乳液的制备
将新制的大豆油脂体分散在去离子水中,分别在30、50、70 ℃和90 ℃条件下加热处理30 min。
1.3.3 大豆油脂体表面蛋白提取
将处理后的大豆油脂体用0.22 μm的滤膜过滤,将大豆油脂体与3 倍体积的丙酮溶液混合,除去中性脂类,10 000×g离心10 min,获得残渣再加入3 倍体积的乙醚溶液,重复上述步骤,经过2 次丙酮和乙醚溶液的脱脂,最后获得大豆油脂体表面蛋白,冷冻干燥。
1.3.4 大豆油脂体表面蛋白十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)
SDS-PAGE分离胶为15%,浓缩胶为5%。将大豆油脂体表面蛋白溶于水配制成质量浓度为3 μg/mL的溶液,取样品加上样缓冲液煮沸5 min。上样量15 μL,在80 V条件下运行30 min,进入分离胶后增至120 V。采用考马斯亮蓝溶液进行凝胶染色后进行脱色。
1.3.5 大豆油脂体ζ电位和平均粒径测定
将热处理后的大豆油脂体乳液分散在去离子水中配制成含油脂体质量浓度为0.005 g/100 mL,在常温条件下测定其ζ电位,测定时的温度为25 ℃,每个样品平行测定3 次。将在不同温度处理后的大豆油脂体与去离子水按照料液比1∶1 000(m/V)配制溶液,用Mastersizer 2000激光粒度仪测定其平均粒径(D [4,3]),达到相应的遮光度后进行测定,每个样品平行测定3 次。
1.3.6 激光共聚焦显微镜测定
大豆油脂体乳液样品的激光共聚焦显微镜测定在室温条件下进行,采用Ar/K和He/Ne双通道激光模式,激发波长分别是488 nm和633 nm。尼罗红和尼罗兰分别以料液比1∶1 000(m/V)溶解在异丙醇里,制成染色液。1 mL乳液样品加入40 μL配制好的染色液,混合均匀,染色30 min,取一滴染色的乳液样品放在带凹槽的载玻片上,盖上盖玻片并用甘油密封。油镜进行图像采集,分辨率为1 024 ppi×1 024 ppi,图像采集的范围为5~45 μm,可避免玻片上污染物对图像的影响。
1.3.7 圆二色光谱分析
采用远紫外区域圆二色光谱研究大豆油脂体表面蛋白二级结构,准确称取一定量的大豆油脂体表面蛋白在pH 7.0、0.01 mol/L的磷酸盐缓冲液中配制成质量浓度为0.4 mg/mL的溶液。圆二色光谱扫描波长范围为250~200 nm,25 ℃条件下,扫描速率为100 nm/min,样品池光程为0.1 nm,灵敏度为100 mdeg/cm,扫描5 次结果的平均值为最后得到的圆二色光谱。采用CD Pro曲线拟合软件包计算蛋白质二级结构含量 [14]。
1.3.8 大豆油脂体动态表面张力测定
未处理和处理后的大豆油脂体乳液通过尖端连有毛细管的250 mL注射器,将样品注入装有pH 7.0的磷酸缓冲溶液的7 mL样品池中,质量浓度为0.1 g/L,利用电荷耦合器件照相机与计算机连接,根据分析液滴的轮廓,进而通过Laplace方程确定界面张力,测定温度为(25.0±0.5) ℃ [15]。
1.3.9 大豆油脂体乳液凝结指数测定
取大豆油脂体加入去离子水搅拌混匀,得到质量浓度为10 mg/L的大豆油脂体乳液。对乳液进行不同温度加热处理30 min,对处理后的乳液贮存7 d后,乳液的油滴凝结指数根据Castellani等 [16]的方法测定,按下式进行计算。
式中:D [4,3]-7 d和D [4,3]-0 d分别为大豆油脂体乳液在放置7 d 和0 d时的平均粒径/μm。
1.3.10 大豆油脂体乳液氧化稳定性测定
新制大豆油脂体乳液,立即分装到带塞的锥形瓶中,在50 ℃条件下恒温水浴锅中促进氧化反应,进行实验的测定。油脂过氧化值的测定参考文献[17]的方法:取0.3 mL大豆油脂体乳液于离心管中,加入1.5 mL异辛烷-异丙醇(3∶1,V/V)的混合物,充分振荡(10 s、3 次),然后进行离心(1 000×g、2 min),取上清液200 μL,加入到2.8 mL甲醇-丁醇混合溶液(2∶1,V/V)中,再分别加入15 μL 3.94 mol/L的硫氰酸铵和15 μL二价铁离子溶液(0.132 mol/L氯化钡和0.144 mol/L硫酸亚铁以体积比1∶1混合,过0.22 μm滤膜),反应20 min后,于510 nm波长处测定吸光度,通过异丙苯氢氢过氧化物标准曲线计算样品中氢过氧化物浓度。
1.4 数据统计分析
每个实验重复3 次,以?表示最终实验结果。采用SPSS软件对数值进行方差分析(analysis of variance,ANOVA)。采用Origin 8.0软件作图。
2.1 大豆油脂体化学组成和SDS-PAGE
通过AOAC标准方法测定大豆油脂体含水量、脂肪和蛋白质含量分别为(48.76±0.59)%、(31.02±0.36)%(湿基)、(5.78±0.14)%(湿基)。由图1可知,尿素处理的大豆油脂体表面蛋白相对纯度较高,油脂体表面蛋白分子质量分布在16~24 kD,为油脂体表面蛋白的重要组成成分。此种方法提取的大豆油脂体除去了大部分杂质结合蛋白和纤维,其中分子质量为34 kD的表面蛋白,可能是一种大豆油脂体表面特殊的结合蛋白 [18]。

图1 大豆油脂体表面蛋白SDS-PAGE图谱
Fig.1 SDS-PAGE of oleosins in soybean oil body
2.2 不同加热温度对大豆油脂体乳液ζ电位的影响
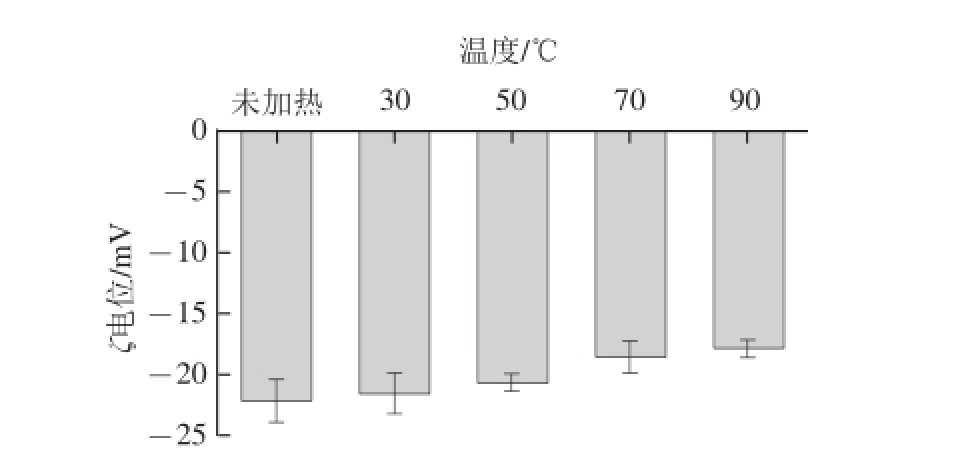
图2 不同加热温度对大豆油脂体乳液ζ电位的影响
Fig.2 ζ-potential of soybean oil body emulsion at different temperatures
大豆油脂体乳液中油滴的絮凝状态与油滴间的静电排斥力和相互吸引力的作用平衡有关。乳滴间的斥力大小主要由乳滴的表面电荷量所决定,而表面电荷的多少通过ζ电位来反映。由图2可知,经过热处理后的大豆油脂体乳液均带有负电荷,加热处理对大豆油脂体乳液的ζ电位影响不大。未加热处理的大豆油脂体乳液ζ电位为-22.2 mV,90 ℃时ζ电位为-17.9 mV,随着加热温度的升高乳滴的表面电荷减少,原因可能是大豆油脂体表面蛋白构象在热处理时发生改变,使乳液中的带负电的离子与其作用减弱,使表面电荷密度下降,ζ电位降低。另外,提取的大豆油脂体中含有磷脂酶,未加热和30 ℃加热30 min的大豆油脂体乳液中仍含有磷脂酶,会水解大豆磷脂产生磷脂酸胆碱和磷脂酸,生成带有负电荷的活性脂类和游离的脂肪酸吸附在油脂体表面,使负电荷增加,ζ电位的绝对值变大 [5-6]。而经过热处理的大豆油脂体乳液ζ电位绝对值均比未处理的大豆油脂体乳液ζ电位绝对值小。加热预处理减小了大豆油脂体界面的电荷量,该现象与大豆蛋白稳定的乳液特性类似 [19],随着温度的增加大豆油脂体乳液的表面负电荷降低,乳滴间静电相互斥力减弱,使油脂体乳液发生不同程度的聚集。由此推断,温度影响大豆油脂体界面蛋白所带电荷,从而影响大豆油脂体的絮凝状态。
2.3 不同加热温度对大豆油脂体乳液粒径分布的影响

图3 不同加热温度对大豆油脂体乳液粒径分布的影响
Fig.3 Mean particle diameters of soybean oil body emulsion at different temperatures

图4 不同加热温度条件下大豆油脂体乳液的共聚焦图像
Fig.4 Confocal micrographs of soybean oil body emulsion at different temperatures
由图3可知,大豆油脂体乳液在70、90 ℃时的粒径大部分在7~8 μm左右,30 ℃粒径分布出现多峰,粒径大小在5 ☒m左右,出现了油脂体的聚集;30、50 ℃加热处理后的大豆油脂体的大部分粒径相比未加热大豆油脂体小;而在70、90 ℃时粒径稍有增大,且有较多的80 μm左右大粒径出现,发生了不稳定的聚集。图4的大豆油脂体乳液的共聚焦图像也表明油脂体在70、90 ℃时发生不同程度聚集,这些不规则的絮凝表现出粒径的增大,在30 ℃时较为稳定,可能是因为加热处理影响油体表面的Oleosin蛋白,使蛋白带负电基团和带正电基团发生了中和作用,导致Oleosin蛋白质结构伸展,增强了其结构柔顺性和稳定性表现较为稳定 [20]。李菊芳 [21]的研究表明大豆蛋白经过热处理后与磷脂的结合能力显著提高,导致蛋白质溶解度和结构均发生变化。由上述分析可知,大豆油脂体表面蛋白与单层磷脂分子在高于50 ℃热处理时,可能发生了结构的改变,促进了大豆油脂体的热聚集行为,使粒径增加。因此大豆油脂体乳液稳定性不仅取决于油体表面的静电斥力和表面电荷密度,还与油脂体表面蛋白膜的组成和膜蛋白特性有关。
2.4 不同加热温度下大豆油脂体乳液的微观结构
利用激光共聚焦扫描显微镜技术可以更直观地观察油体乳液的絮凝状态,由图4可知,随着温度的升高,乳液中聚集体的大小分布不同,图4b、c可以观察到30 ℃和50 ℃加热处理后的乳液相对于未加热处理组的乳液(图4a)大豆油脂体整体分布较为均匀,颗粒度明显较小, 30 ℃和50 ℃时的粒径在6~7 μm范围(图3)。从70 ℃和90 ℃加热30 min的大豆油脂体乳液(图4d、e)可以看出油脂体发生较强程度的聚集。由图3可知,70 ℃和90 ℃热处理的乳液中出现较多50~100 μm左右的聚集体。因此,低温加热能有效地避免大豆油脂体乳液聚集情况发生,更好地保持乳液的稳定性。而高温处理会使油脂体表面的蛋白发生热变性,增大了乳液中油脂体间的絮凝程度,促进较大聚集体的形成。这主要是由于热处理强度可以使油脂体表面蛋白变性,整个蛋白的结构展开,蛋白质内部的侧链暴露,增强彼此间相互作用,由此引起聚集程度的增加 [22]。
2.5 不同加热温度对大豆油脂体表面蛋白二级结构的影响
表 1 不同加热温度条件下大豆油脂体表面蛋白的二级结构含量
Table1 Secondary structure contents of oleosins in soybean oil body at different temperatures conditions

注:同列肩标小写字母不同表示差异显著(P<0.05)。
温度/℃含量/% α-螺旋β-折叠β-转角无规卷曲未加热17.71±0.01 e29.89±0.06 e22.34±0.05 a29.96±0.01 b3017.68±0.02 d29.71±0.04 c22.30±0.01 b29.90±0.04 a5017.62±0.04 c30.1±0.11 b22.18±0.02 b29.82±0.07 c7016.5±0.02 b31.2±0.01 b23.1±0.08 b29.1±0.02 d9015.3±0.03 a36.1±0.02 a21.2±0.03 c27.3±0.06 e
通过圆二色光谱拟合软件CD Pro对得到的图谱进行分析计算,得到大豆油脂体表面蛋白二级结构随温度的变化情况如表1所示。30 ℃和50 ℃加热30 min,油脂体表面蛋白的二级结构组成与未加热相比有所变化,但差异较小。加热温度超过70 ℃后,α-螺旋、β-转角和无规卷曲含量降低,β-折叠含量增加,且含量变化较为明显,主要原因是加热使维持蛋白质α-螺旋结构的氢键和静电作用减弱,导致α-螺旋结构的丢失转化为β-折叠。有研究者发现β-折叠在蛋白质二级结构中可促进蛋白聚集和网络的形成,因此随着温度的增加(70~90 ℃)大豆油脂体表面蛋白β-折叠结构含量增加较多,促进了乳液中表面蛋白空间结构伸展,有利于蛋白与蛋白之间的聚集,导致大豆油脂体乳液的粒径部分增大 [23]。以上结果表明:大豆油脂体表面蛋白对油脂体稳定所起的关键作用,也表现在不同温度条件下蛋白二级构象改变影响的油体间相互作用力和表面蛋白界面性质,造成不同的稳定特性。
2.6 不同加热温度对大豆油脂体乳液界面特性的影响
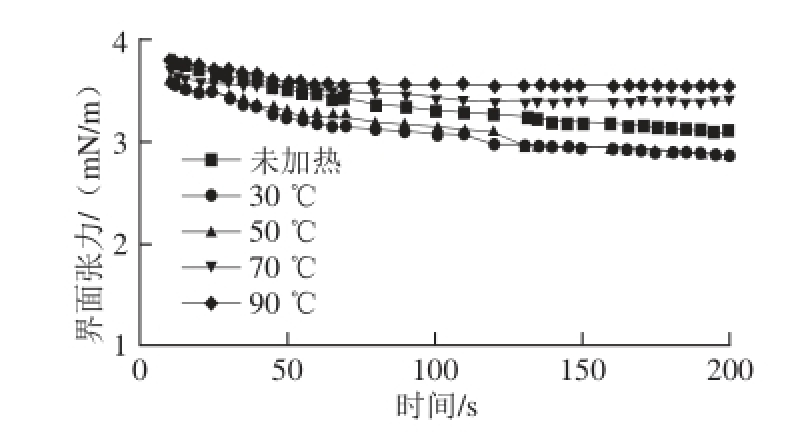
图5 不同加热温度处理的大豆油脂体乳液界面张力随时间的变化
Fig.5 Dynamic interfacial tension of soybean oil body emulsion at different temperatures as a function of time
乳液中油脂体的絮凝速率是决定大豆油脂体乳状液稳定性的一个重要参数,而大豆油脂体聚集速率的快慢关键取决于乳液的界面张力和界面强度的大小,大豆油脂体界面蛋白膜稳定是大豆油脂体乳状液稳定的一个重要机理。Bonacucina等 [24]研究表明,蛋白乳液的稳定性与界面张力和界面压的大小有着密切相关,界面张力越小,界面压越大,乳状液越稳定。由图5可知,不同加热温度条件下大豆油脂体乳液的界面张力都随着时间的延长而逐渐下降,没经过热处理的大豆油脂体乳液在水中界面张力最初为3.8 mN/m,而30 ℃和50 ℃热处理的大豆油脂体乳液的界面张力在整个过程中最小,且界面张力下降较多,从3.52 mN/m下降到2.74 mN/m。70 ℃和90 ℃处理的大豆油脂体乳液界面张力变化相似,最终界面张力高于其他温度处理的乳液,表明不同的加热温度对大豆油脂体乳液界面蛋白膜影响不同,加热处理降低了界面张力及电荷斥力。30 ℃和50 ℃低温热处理可能使大豆油脂体表面蛋白分子部分疏水性基团暴露,提高油脂体表面蛋白在油-水界面的吸附,增加乳液的界面强度 [25]。70 ℃和90 ℃加热30 min使油脂体表面蛋白发生变性,促使油脂体与油脂体间的表面蛋白相互作用增加,界面张力较大,乳液不稳定,形成了大豆油脂体的聚集。因此,不同加热温度影响大豆油脂体乳液界面的柔韧性和稳定性,从而表现出不同的界面特性。
2.7 不同加热温度对大豆油脂体乳液凝结指数的影响
乳液中大豆油脂体的絮凝状态与凝结指数是大豆油脂体乳液稳定性表征的重要参考。乳液中油脂体的絮凝是指乳液间悬浮油体依靠相互作用力聚集形成絮团的过程,热处理后的大豆油脂体乳液贮存7 d后乳液的凝结指数没有明显变化(表2)。且热处理可以使乳液表现出良好的抗絮凝稳定性,没有出现乳液的分层现象,只是导致乳液中部分油脂体的少量聚集,但仍很稳定地存在于乳液中。
表2 不同加热温度对大豆油脂体乳液凝结指数的影响
Table2 Creaming index of soybean oil body emulsion at different temperatures
加热温度/℃未加热30 50 70 90凝结指数/%205577.2
2.8 不同加热温度大豆油脂体乳液氧化稳定性
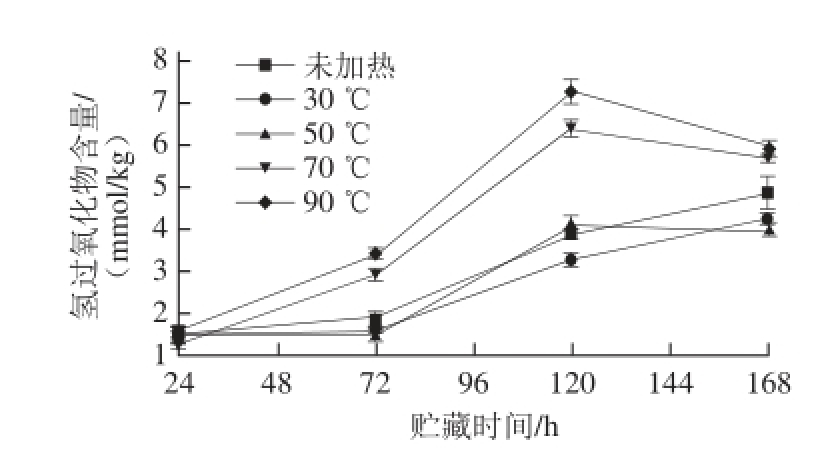
图6 不同加热温度处理对大豆油脂体乳液氧化稳定性的影响
Fig.6 Oxidative stability of soybean oil body emulsion at different temperatures
图6 为不同温度处理后大豆油脂体乳液在50 ℃恒温贮存7 d内油脂氧化产物-脂质氢过氧化物的生成情况。由图6可知,不同温度处理后大豆油脂体乳液在初始时乳液中的氢过氧化物浓度均非常小。乳液中大豆油脂体的氢过氧化物含量在90 ℃随着时间的延长逐渐增大到约7 mmol/kg,但当温度在30 ℃和50 ℃时,乳液中氢过氧化物的形成得到了很好地抑制。该结果与Hu Min等 [26]的研究结果相类似。对于蛋白乳液,乳液中的蛋白质覆盖在油滴表面会形成一层具有一定厚度的黏弹性蛋白膜,这种蛋白膜具有清除自由基以及螯合金属离子的作用,从而起到抑制油脂氧化的作用 [27]。抑制乳液中油脂氧化与乳滴界面蛋白和乳液中易氧化的酶含量有关,30 ℃和50 ℃加热处理可以降低乳液中脂肪氧化酶的活性,降低氧化程度。70 ℃和90℃加热处理也使酶失活,但乳液的氧化程度增加,可能因为温度的升高会加速油脂的氧化,同时改变油脂体表面蛋白结构,影响了氧化稳定性。结果表明低于蛋白质变性温度70 ℃的加热处理使乳液油脂中氢过氧化物含量明显低于未加热的大豆油脂体乳液,而温度升高到70 ℃和90 ℃时乳液的氧化加速,说明适度的热处理对大豆油脂体乳液的氧化稳定性有重要影响。
天然大豆油脂体乳液与经过不同温度处理的乳液相比表现出不同的物化特性,30 ℃加热30 min稳定性最好;研究表明不同温度热处理改变了大豆油脂体乳液的界面特性,降低乳液的界面张力和表面电荷密度,影响了油脂体表面蛋白构象变化。30℃和50℃热处理的大豆油脂体乳液的界面张力下降较多,从3.52 mN/m下降到2.74 mN/m;70 ℃和90 ℃界面张力下降较小。90 ℃加热使表面蛋白α-螺旋含量下降到15.3%,无规卷曲含量降到27.3%,β-转角含量下降到21.2%,β-折叠含量结构增加到36.1%,使蛋白质发生了构象改变,进而影响在油-水界面的吸附和乳液界面强度。因此,通过热处理对油脂体表面蛋白变化研究,揭示了温度对大豆油脂体物理特性及氧化稳定性影响规律。
参考文献:
[1] TZEN J T C, CAO Y Z, LAURENT P, et al. Lipids, proteins and structure of seed oil bodies from diverse species[J]. Plant Physiology,1993, 101(1): 267-276. DOI:10.1104/pp.101.1.267.
[2] DELEU M, VACAM G, FABRE J F, et al. Interfacial properties of oleosins and phospholipids from rapeseed for the stability of oil bodies in aqueous medium[J]. Colloids & Surfaces B: Biointerfaces, 2010,80(2): 125-132. DOI:10.1016/j.colsurfb.2010.05.036.
[3] KUMAR K, NIKOLOV A D, WASAN D T. Mechanisms of stabilization of water-in-crude oil emulsions[J]. Industrial & Engineering Chemistry Research, 2001, 40(14): 213-215. DOI:10.1021/ie000663p.
[4] WANG J M, YANG J. Characterization of oil-in-water emulsion stabilized by native and heat-treated soy protein[J]. Journal of the Chinese Cereals & Oils Association, 2012, 27(9):16-20.
[5] CHEN B C, MCCLEMENTS D J, GRAY D A, et al. Physical and oxidative stability of pre-emulsified oil bodies extracted from soybeans[J]. Food Chemistry, 2012, 132(3): 1514-1520. DOI:10.1016/ j.foodchem.2011.11.144.
[6] IWANAGA D, GRAY D A, FISK I D, et al. Extraction and characterization of oil bodies from soy beans: a natural source of preemulsifi ed soybean oil[J]. Journal of Agricultural & Food Chemistry,2007, 55(21): 8711-8716. DOI:10.1021/jf071008w.
[7] 陈业明, 赵路苹, 熊小辉, 等. 热处理对大豆油体表面的油体蛋白和外源性蛋白影响[J]. 食品工业科技, 2014, 35(22): 106-109. DOI:10.13386/j.issn1002-0306.2014.22.015.
[8] TZEN J T, PENG C C, CHENG D J, et al. A new method for seed oil body purifi cation and examination of oil body integrity following germination[J]. Journal of Biochemistry, 1997, 121(4): 762-768.
[9] 吴娜娜. 大豆油体及大豆油体-卡拉胶乳液稳定性研究[D]. 广州: 华南理工大学, 2012: 48-50.
[10] Association of Analytical Chemists. Official Methods of Analysis of AOAC International 17th Edition[S]. Arlington: Association of Offi cial Analytical Chemists, 2000.
[11] 姚专, 王岚, 秦卫国, 等. GB/T14489.1—2008 油料水分及挥发物含量测定[S]. 北京: 中国标准出版社, 2009.
[12] 张佳欣, 郝希成, 吴春华. GB/T 5512—2008 粮食中粗脂肪含量测定[S].北京: 中国标准出版社, 2009.
[13] 秦卫国, 张春辉, 褚丽霞, 等. GB/T 14489.2—2008 植物油料粗蛋白质的测定[S]. 北京: 中国标准出版社, 2008.
[14] SREERAMA N, WOODY R W. Estimation of protein secondary structure from circular dichroism spectra: comparison of contin, selcon,and cdsstr methods with an expanded reference set[J]. Analytical Biochemistry, 2000, 287(2): 252-260. DOI:10.1006/abio.2000.4880.
[15] CHENG P, LI D, BORUVKA L, et al. Automation of axisymmetric drop shape analysis for measurements of interfacial tensions and contact angles[J]. Colloids & Surfaces, 1990, 43(2): 151-167. DOI:10.1016/0166-6622(90)80286-D.
[16] CASTELLANI O, BELHOMME C, DAVID B E, et al. Oil-in-water emulsion properties and interfacial characteristics of hen egg yolk phosvitin[J]. Food Hydrocolloids, 2006, 20(1): 35-43. DOI:10.1016/ j.foodhyd.2005.02.010.
[17] SHANTHA N C, DECKER E A. Rapid, sensitive, iron-based spectrophotometric methods for determination of peroxide values of food lipids[J]. Journal of Aoac International, 1994, 77(2): 421-424.
[18] SAMOTO M, MIYAZAKI C, KANAMORI J, et al. Improvment of the off-fl avor of soy protein isolate by removing oil-body associated protein and polar lipids[J]. Bioscience Biotechnology & Biochemistry,1998, 62(5): 935-940. DOI:10.1271/bbb.62.935.
[19] 王金梅, 夏宁, 杨娟, 等. 天然和热处理大豆蛋白稳定乳液的性质研究[J]. 中国粮油学报, 2012(9): 16-20.
[20] 邵云. 大豆蛋白稳定乳液的物化性质及油脂氧化稳定性研究[D]. 广州: 华南理工大学, 2014: 85-89.
[21] 李菊芳. 磷脂-大豆蛋白复合物形成机理及其理化、功能特性研究[D].北京: 中国农业大学, 2014: 62-68.
[22] NICORESCU I, LOISEL C, VIAL C, et al. Combined effect of dynamic heat treatment and ionic strength on denaturation and aggregation of whey proteins-Part I[J]. Food Research International,2008, 41(7): 707-713. DOI:10.1016/j.foodres.2008.05.003.
[23] HE J L, CHAN C, SEUNGJ L. Membrane-bound α-synuclein has a high aggregation propensity and the ability to seed the aggregation of the cytosolic form[J]. Journal of Biological Chemistry, 2002, 277(1): 671-678. DOI:10.1074/jbc.M107045200.
[24] BONACUCINA G, CESPI M, PALMIERI G F. Characterization and stability of emulsion gels based on acrylamide/sodium acryloyldimethyl taurate copolymer[J]. Aaps PharmSciTech, 2009,10(2): 368-375. DOI:10.1208/s12249-009-9218-1.
[25] YE A. Surface protein composition and concentration of whey protein isolate-stabilized oil-in-water emulsions: effect of heat treatment[J]. Colloids & Surfaces B Biointerfaces, 2010, 78(1): 24-29. DOI:10.1016/j.colsurfb.2010.02.001.
[26] HU M, McCLEMENTS J L, DECKER E A. Lipid oxidation in corn oil-in-water emulsions stabilized by casein, whey protein isolate, and soy protein isolate[J]. Journal of Agricultural & Food Chemistry, 2003,51(6): 1696-1700. DOI:10.1021/jf0209.
[27] COUPLAND J N, McCLEMENTS D J. Lipid oxidation in food emulsions[J]. Trends in Food Science & Technology, 1996, 7(3): 83-91. DOI:10.1016/0924-2244(96)81302-1.
Effects of Heat Treatment on Properties of Soybean Oil Body Emulsion
DING Jian, ZHANG Qiaozhi, HAN Tianxiang, SUI Xiaonan, DONG Jixuan, LI Yang*
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
Abstract:In this study, soybean oil body emulsion was subjected to heat treatment at different temperatures. The changes in physical stability, oxidative stability, the secondary structures of oleosins, interfacial tension, and interfacial characteristics in the oil body emulsion were examined using dynamic surface tension measurement, dynamic laser light scattering, confocal laser technology and circular dichroism to evaluate the effectiveness of heat treatment. The results showed that heat treatment reduced surface charges and interfacial tension, and changed the interfacial strength of oil bodies. In addition, heat treatment caused a decrease in α-helix structure from (17.71 ± 0.01)% to (15.3 ± 0.03)%, unordered structure from (29.96 ± 0.01)% to(27.3 ± 0.06)% and β-turn from (22.34 ± 0.05)% to (21.2 ± 0.03)%, and it could increase β-sheet structure from (29.89 ± 0.06)% to (36.1 ± 0.02)%. Heat treatment changed the forces maintaining the secondary structure of oleosins, which in turn could affect the secondary structure contents and resulted in different interfacial properties. Furthermore, heat treatment could not signifi cantly promote the fl occulation of oil bodies; heat treatment at 30 ℃ and 50 ℃ had relatively small amount of hydrogen peroxide. This result suggested that heat treatment changed the interfacial properties of soybean oil body emulsion and consequently had an important impact on its physical properties and oxidative stability.
Key words:soybean oil body emulsion; heat treatment; interfacial characteristics; stability
DOI:10.7506/spkx1002-6630-201619002
中图分类号:TS214.2
文献标志码:A
文章编号:1002-6630(2016)19-0008-07
引文格式:
丁俭, 张巧智, 韩天翔, 等. 热处理对大豆油脂体乳液特性的影响[J]. 食品科学, 2016, 37(19): 8-14. DOI:10.7506/ spkx1002-6630-201619002. http://www.spkx.net.cn
DING Jian, ZHANG Qiaozhi, HAN Tianxiang, et al. Effects of heat treatment on properties of soybean oil body emulsion[J]. Food Science, 2016, 37(19): 8-14. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201619002. http://www.spkx.net.cn
收稿日期:2016-01-20
基金项目:国家自然科学基金面上项目(31571876);国家自然科学基金青年科学基金项目(31301501);国家高技术研究发展计划(863计划)项目(2013AA102104);黑龙江省普通本科高等学校青年创新人才培养计划项目(UNPYSCT-2015011)
作者简介:丁俭(1989—),男,硕士研究生,主要从事粮食、油脂及植物蛋白工程研究。E-mail:18845619206@163.com
*通信作者:李杨(1981—),男,副教授,博士,主要从事粮食、油脂及植物蛋白工程研究。E-mail:liyanghuangyu@163.com