刘英丽,谢良需,丁 立,张慧娟,龚凌霄,王 静*,姜国庆
(北京工商大学 北京食品营养与人类健康高精尖创新中心,北京市食品添加剂工程技术研究中心,北京 100048)
摘 要:为开发低脂肪多纤维的健康肉制品,明确膳食纤维添加对肉制品品质的影响,以猪肉肌原纤维蛋白为研究对象,利用单因素分析法研究肌原纤维蛋白热诱导凝胶性质及小麦麸膳食纤维对猪肉肌原纤维蛋白功能特性的影响。结果表明:肌原纤维蛋白变性聚集的温度范围是40~70 ℃;肌原纤维蛋白凝胶硬度和保水性随肌原纤维蛋白质量浓度增加而增大,当质量浓度到达70 mg/mL时,凝胶硬度和保水性趋于稳定;pH值为5.5时肌原纤维蛋白凝胶硬度达到最大,凝胶保水性在pH 7.0时趋于稳定;离子强度为0.6 mol/L时凝胶的硬度和保水性趋于稳定。随着小麦麸膳食纤维添加量的增加,肌原纤维蛋白乳化性有所升高但是不明显,当添加量为5%时,乳化性增加7.4%,肌原纤维蛋白乳化稳定性降低;蛋白的弹性模量增大;凝胶硬度和保水性提高,添加量为4%时变化趋于平缓。随着膳食纤维粒径的减小,肌原纤维蛋白凝胶硬度和保水性逐渐提高;微观结构更加致密;蛋白弹性模量降低。由此可见,膳食纤维能够明显改变肌原纤维蛋白功能特性,通过在肉制品中添加适量的膳食纤维可以明显改良肉制品的风味,并替代脂肪,减少人体热量的摄入。
关键词:肌原纤维蛋白;小麦麸膳食纤维;功能特性;凝胶性质
肌原纤维蛋白是肌肉中的一类重要的结构蛋白质群,是由肌球蛋白、肌动球蛋白、肌动蛋白以及调节蛋白的原肌球蛋白、肌钙蛋白等组成的复合体。肌原纤维蛋白在肌肉蛋白中占50%~55%左右,除了参与肌肉的收缩、影响肌肉的嫩度外,对肉制品品质和功能特性有非常重要的影响。肉糜类制品在加工过程中,肌原纤维蛋白受热形成的凝胶决定了产品产量、质构、黏着力及保水性等特性。在不同温度 [1-3]、pH值 [4]、离子强度 [5]、肌肉类型 [6]及不同的添加物 [7-8]条件下,肌原纤维蛋白形成凝胶的能力和特性不同,所表现出的功能特性也不相同。
膳食纤维是不易被消化的食品营养素,根据溶解性不同可分为水不溶性纤维和水溶性纤维两大类。膳食纤维单元中含有许多亲水性基团,有很强的吸水性、持油性、保水性和膨胀性,虽然不能被小肠消化利用,但是可以在人体肠道内通过部分或全部发酵产生降血糖、降胆固醇、促进排便、预防肥胖及消除人体内有害物质的生理功能 [9-11]。因此在肉制品中加入膳食纤维,可以部分替代脂肪减少热量摄入,带来良好的健康效应。此外,如果低脂多纤维肉制品的风味和口感能够为消费者所接受,将会产生巨大的市场价值。小麦麸皮是丰富的膳食纤维来源,其总量占麦麸干物质成分的35%~50%,其中大部分为水不溶性膳食纤维。Sánchez-Alonso等 [12-13]发现添加量为3%和6%的小麦纤维可以增加鱼肉的保水性,且产品的感观品质较好;当将其用于鱿鱼鱼糜凝胶中时,其微观结构显示麦麸膳食纤维打断了凝胶连续的蛋白质网络结构,降低了凝胶的硬度和持水性等凝胶特性,这主要与小麦纤维的粒径大小有关,对其感官品质无影响。
近些年来,不少国内外学者尝试将各种来源的膳食纤维添加到肉中用以开发低脂肉制品 [14-17],得到了较好的产品感官特性,但并没有全面研究膳食纤维对肌原纤维蛋白凝胶及功能性质的影响。因此,本课题组在研究猪肉肌原纤维蛋白热诱导凝胶性质的基础上,重点探讨了小麦麸这种谷物膳食纤维对猪肉肌原纤维蛋白及其凝胶性质的影响,以期为促进谷物膳食纤维在肉制品加工领域的应用提供有意义的借鉴。
1.1 材料与试剂
新鲜猪(品种:北京花猪)通脊肉,购于北京市永辉超市。
磷酸钠、氯化钠、氯化镁、六水合氯化镁、叔丁醇、十二水合磷酸氢二钠、戊二醛、三氯甲烷/乙二醇双(2-氨基乙基醚)四乙醚(均为分析纯) 国药集团化学试剂北京有限公司。
1.2 仪器与设备
POLYTRON System PT 2500E型高速匀浆机 瑞士Kinematica公司;Himac CR 22G型高速冷冻离心机日本日立公司;HWS26型电热恒温水浴锅 上海一恒科技有限公司;ALC-1100.2型电子天平、TB-214 型分析天平 北京赛多利斯仪器系统有限公司;PHS-3D型pH计上海三信仪表厂;UV-2450型紫外-可见光分光光度计、RF-5301PC型荧光分光光度计 日本岛津公司;S53/54型紫外-可见分光光度计 上海棱光技术有限公司;CT3型 Texture Analyzer质构仪 美国博勒飞公司;Sigma3k15型离心机 美国Sigma公司;DCW-3506型低温恒温槽 浙江宁波新芝生物科技股份有限公司;TESCAN VEGA Ⅱ扫描电子显微镜 捷克帝肯公司;Kinexus型超级旋转流变仪、Mastersizer激光粒度分析仪英国马尔文仪器有限公司;SHB-ⅢA型循环水式多用真空泵 河南郑州长城科工贸有限公司;WZJ6(BFM6)型振动式超微粉碎机 山东济南倍力粉技术工程有限公司;ALPHA 1-2 LD Plus冷冻干燥机 德国Christ公司;7620离子溅射镀膜仪 美国Electron Microscopy Sciences公司。
1.3 方法
1.3.1 猪肉肌原纤维蛋白的提取
参考Liu Gang等 [18]的方法,并做了部分改进。将新鲜猪通脊肉绞成肉馅,加入4 倍体积提取液(10 mmol/L Na 3PO 4、0.1 mol/L NaCl、2 mmol/L MgCl 2和1 mmol/L乙二醇双(2-氨基乙基醚)四乙醚,pH 7.0),搅匀,用高速匀浆机匀浆5 min,2 000×g、4 ℃离心15 min,倒掉上清液,收集沉淀,重复匀浆离心提取3 次,得到肌原纤维蛋白粗提样品,在粗提肌原纤维蛋白沉淀中加入4 倍体积的0.1 mol/L NaCl溶液,高速匀浆5 min,1 层纱布过滤(纱布提前在沸水中煮20 min),3 000×g、4 ℃离心15 min,取沉淀,加4 倍体积的0.1 mol/L NaCl溶液,匀浆5 min,重复提取两遍得到的沉淀,即为提纯的肌原纤维蛋白,在4 ℃条件下冷藏备用。
1.3.2 肌原纤维蛋白质成分分析
参照郭尧君 [19]和Laemmli [20]等的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)不连续电泳方法,采用SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gelelectrophoresis,SDS-PAGE)法对肌原纤维蛋白进行电泳分析。
1.3.3 肌原纤维蛋白浊度的测定
参考Benjakul等 [21]方法测定肌原纤维蛋白的浊度。以不含蛋白的溶液为空白对照组,由于吸光度越大,浊度越大,因此在600 nm波长处测定吸光度,研究不同温度对肌原纤维蛋白浊度的影响。
1.3.4 肌原纤维蛋白凝胶及膳食纤维混合凝胶的制备
参考徐幸莲 [22]和朱君 [23]等的凝胶制备方法,每次实验前将凝胶放在室温条件下平衡30 min。
1.3.5 肌原纤维蛋白凝胶质构的测定
取平衡好的凝胶放在载物台上,利用质构仪进行测定,每个凝胶样品做6 个平行实验。压缩模式下测定凝胶的硬度,质构仪测定设置参数如下:测定模式选择下压目标值为4 mm,测试速率为0.5 mm/s,引发力为4.5 g,探头型号选择TA 10。
1.3.6 不同因素下肌原纤维蛋白凝胶硬度的测定
测定不同质量浓度(20、30、40、50、60、70、80 mg/mL)、pH值(5.0、5.5、6.0、6.5、7.0、7.5、8.0)、离子强度(NaCl浓度分别为0.3、0.4、0.5、0.6、0.7、0.8、0.9 mol/L)、膳食纤维粒径(未分级、过100、150、200、300 目筛)条件下肌原纤维蛋白凝胶硬度,观察其变化。
1.3.7 肌原纤维蛋白凝胶保水性的测定
采用Kocher法 [24]并部分改进。测量前将肌原纤维蛋白(混合)凝胶在室温条件下放置30 min,取45 g不同的凝胶样品加入50 mL离心管中称质量,记为m 1/g;3 000×g离心15 min,倒出离心出的水分,再次称质量,记为m 2/g;空离心管质量为m 0/g。凝胶保水性按式(1)计算。
1.3.8 小麦麸膳食纤维的提取、粉碎和分级
小麦麸膳食纤维的提取参考Bunzel等 [25]的方法,膳食纤维纯度测定参考GB/T 5009.88—2008《食品中膳食纤维的测定》 [26]。
小麦麸膳食纤维粉碎分级:取200 g膳食纤维加入超微粉碎机中,间歇性粉碎3 次,每次粉碎时间持续10 min。粉碎后将膳食纤维分别过100、150、200、300 目筛。收集过筛后的产物,对膳食纤维进行分级。
膳食纤维粒径测定:使用Mastersizer激光粒度分析仪湿法测定样品的粒度分布。
1.3.9 肌原纤维蛋白乳化性和乳化稳定性的测定
在Pearce浊度法 [27]的基础上稍作改动,测定乳化性(emulsifying activity index,EAI)和乳化稳定性(emulsion stability index,ESI)。取2 mL的玉米油和8 mL的肌原纤维蛋白样品溶液(蛋白质量浓度为2 mg/mL),置于直径50 mL的离心管中,用高速匀浆机进行匀浆,转速约10 000 r/min。匀浆后立即从距离管底0.5 cm处吸取50 μL新鲜的乳化液分散到5 mL质量分数为0.1%的SDS溶液中,以0.1%SDS为空白,在500 nm波长处测量其吸光度A 0。静置10 min后再次从相同位置吸取50 μL的乳化液,以上述方法测量乳化液此时吸光度A 10,每个样品做3 次重复,EAI、ESI分别按式(2)、(3)计算。
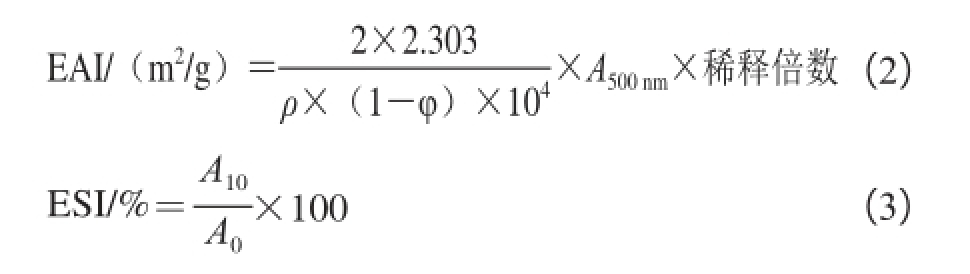
式中:φ为油相体积分数(φ=20%);ρ为肌纤维蛋白质量浓度/(mg/mL)。
1.3.10 肌原纤维蛋白混合凝胶流变性的测定
参考Ramirez-Suarez等 [28]方法,肌原纤维蛋白和膳食纤维样品混合物在升温过程中产生的凝胶力学变化由蛋白变性所引起,测定模式为正弦振荡模式,将样品放在直径为40 mm的平板夹具之间,两平板之间间隔为1 mm,清理除去平板周围多余的样品,样品用硅油密封后,盖上盖子,从25 ℃开始以1 ℃/min的升温速率升至80 ℃,最大应变为0.02,固定频率为0.1 Hz,凝胶的弹性模量为G’,作为评价凝胶黏弹性能的指标。
1.3.11 肌原纤维蛋白混合凝胶微观结构的测定
参考Pan等 [29]的方法观察肌原纤维蛋白混合凝胶微观结构。将制备好的肌原纤维蛋白和膳食纤维混合凝胶样品切成2 mm×3 mm×3 mm的小块,用pH 6.8、2.5 g/100 mL的戊二醛溶液浸泡过夜,然后用pH 7.2、0.1 mol/L的磷酸盐缓冲液洗涤30 min,反复洗涤3次。然后用体积分数50%、70%、80%、90%的乙醇依次进行脱水,每次30 min,最后用100%乙醇脱水30 min,反复脱水3次。然后用氯仿脱脂1 h,最后用V(100%乙醇)∶V(叔丁醇)=1∶1的混合液置换30 min。然后用冷冻干燥机对样品进行干燥。干燥后将凝胶样品断开使断面朝上,不同样品黏在不同的载物台上,并做标记,然后用EMS 7620离子溅射镀膜仪进行喷金,观察处理好的样品,每个样品做3组平行实验。
1.4 数据处理与统计分析
每组实验除特殊说明外均重复3次,结果表示为
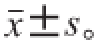 。采用Microsoft Excel 2010软件对数据进行处理,用SPSS 22.0软件进行单因素方差分析(one-way analysis of variance,ANOVA)进行统计分析,P<0.05为差异显著,用Origin 8.6软件对流变性数据作图。
。采用Microsoft Excel 2010软件对数据进行处理,用SPSS 22.0软件进行单因素方差分析(one-way analysis of variance,ANOVA)进行统计分析,P<0.05为差异显著,用Origin 8.6软件对流变性数据作图。
2.1 猪肉肌原纤维蛋白热诱导凝胶性质分析
2.1.1 肌原纤维蛋白成分分析

图1 肌原纤维蛋白SDS-PAGE凝胶电泳结果
Fig.1 SDS-PAGE electrophoresis of myofibrillar proteins
肌原纤维蛋白是由几种蛋白组成的混合蛋白,其中肌球蛋白是最重要的一种蛋白质,分子质量大约为480 kD,由2 条重链(约200 kD)和4条轻链(16~25 kD)组成,还包括肌动蛋白(单体约43 kD)、肌钙蛋白(3个亚基约37、23、18 kD)、原肌球蛋白(2×35 kD)和其他一些功能不明的调节性结构蛋白质 [30-31]。其中肌球蛋白对于凝胶的形成有重要作用。由图1电泳结果推测,200、43、37、23、18 kD处的蛋白条带依次可能为肌球蛋白重链、肌动蛋白、肌钙蛋白,其中肌球蛋白轻链需要用5,5’-二硫双(2-硝基苯甲酸)或在碱性(pH 11.4)条件下处理后才能分离,电泳图未能观察到,而原肌球蛋白也可能和肌动蛋白结合未能分离。图1肌球蛋白重链条带色泽深且宽,说明该蛋白质含量高。提取的肌原纤维蛋白可以用于后续研究。
2.1.2 不同温度对肌原纤维蛋白浊度的影响
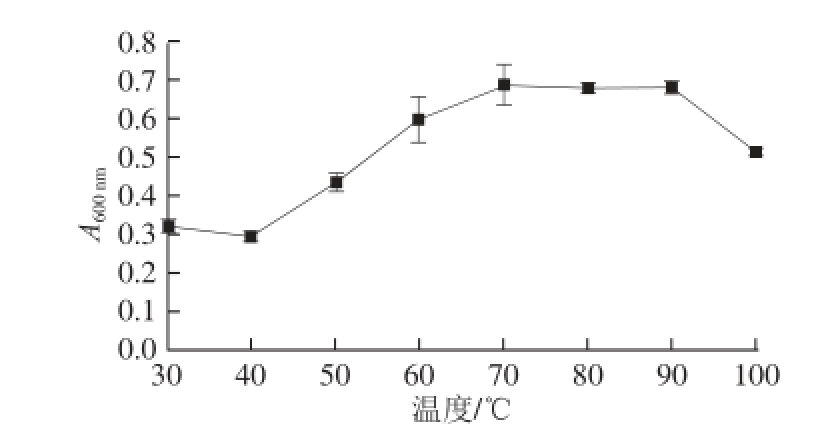
图2 不同温度对肌原纤维蛋白浊度的影响
Fig.2 Effect of temperature on turbidity of myofibrillar proteins
浊度大小反映蛋白质的凝聚程度,以及蛋白质溶液中悬浮颗粒的数量和大小 [32]。蛋白质分散时,颗粒间没有发生凝聚,颗粒直径较小,浊度小;当蛋白质凝聚时,悬浮颗粒直径变大,浊度升高。在浊度变化较大的温度范围,肌原纤维蛋白颗粒大量聚集,变性程度也较严重。由图2可知,随着温度升高,浊度升高。在30~40 ℃时浊度变化不大,从40 ℃开始浊度升高,在40~70 ℃变化比较大,70 ℃时浊度达到最大。在40~70℃时浊度变化比较大,说明此时蛋白质发生变性,蛋白分子交联作用加大,浊度升高。90 ℃时浊度下降,原因是蛋白质迅速变性聚沉。
2.1.3 肌原纤维蛋白质量浓度对其凝胶保水性和硬度的影响

图3 肌原纤维蛋白质量浓度对其凝胶保水性和硬度的影响
Fig.3 Effect of MPI concentration on textual properties and WHC of MP gels
小写字母不同表示差异显著(P<0.05)。下同。
由图3可知,肌原纤维蛋白凝胶硬度随肌原纤维蛋白质量浓度的增加而增大,当质量浓度为70 mg/mL时硬度达到最大。这是由于随着肌原纤维蛋白质量浓度增加,蛋白质分子间的距离变小,蛋白质分子之间凝集的机会增加,参与凝胶分子数量增加。当肌原纤维蛋白质量浓度为80 mg/mL时,凝胶硬度减小,可能原因是蛋白质量浓度大,蛋白质分子不能充分展开,形成凝胶网络受影响。
当肌原纤维蛋白质量浓度小于50 mg/mL时,凝胶保水性随蛋白质量浓度的增大而增大,当蛋白质量浓度达到50 mg/mL时凝胶保水性趋于稳定。高密度的蛋白质形成的肌原纤维蛋白相互交织形成了非常紧密稳定的立体网络结构 [33]。因此,凝胶保水性随之升高。综合考虑,选择60 mg/mL作为后续研究的蛋白质量浓度。
2.1.4 pH值对肌原纤维蛋白凝胶保水性和硬度的影响
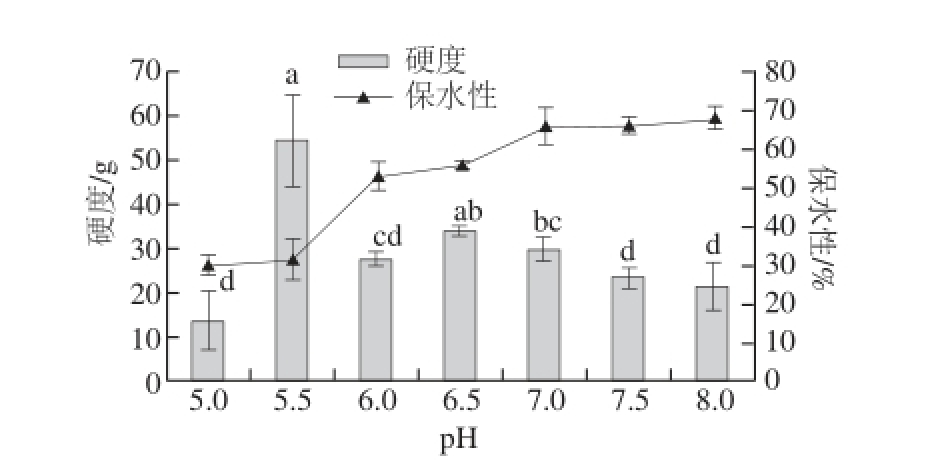
图4 pH值对肌原纤维蛋白凝胶保水性和硬度的影响
Fig.4 Effect of pH on textual properties and WHC of MP gels
由图4可知,在pH 5.5时MP凝胶硬度最大,可能是因为此时是蛋白质等电点,蛋白间静电斥力较弱,蛋白质分子间的吸引相互作用增强,所以形成的网络结构相对稳定,蛋白凝聚在一起,形成的凝胶硬度很大,在中性条件下,由于肌原纤维蛋白的静电斥力大于在酸性条件下的静电斥力,从而使蛋白-蛋白间的作用降低,凝胶硬度变小 [34]。凝胶保水性随pH值升高而增大,在pH 7.0时,增长平缓,上升幅度变小。当pH 5.5时,接近肌原纤维蛋白质等电点,蛋白质分子间的结合作用较强,蛋白质与水的作用较弱,因此凝胶保水力较低。随着pH值升高,偏离肌原纤维蛋白质等电点,蛋白侧链基团的净负电荷数增加,分子间的排斥作用变大,同时净电荷的增加为环境中的水分子提供更多的氢键结合位点,增大了水合作用表面积,凝胶保水性提高 [35-36]。
2.1.5 离子强度对肌原纤维蛋白凝胶保水性和硬度的影响

图5 离子强度对肌原纤维蛋白凝胶保水性和硬度的影响
Fig.5 Effect of ionic strength on textual properties and WHC of MP gels
由图5可知,离子强度小于0.7 mol/L时,凝胶硬度随离子强度的增加而增大,在离子强度为0.7 mol/L时肌原纤维蛋白凝胶硬度达到最大,以后硬度逐渐降低。这是因为肌原纤维蛋白是盐溶蛋白,离子强度较低时,处于溶解状态的肌原纤维蛋白较少,蛋白质分子间的交联作用力较弱,因而凝胶强度弱;离子强度较高时,肌原纤维蛋白可以很好的溶解,蛋白质分子链展开,疏水基团暴露,疏水相互作用较大,分子间相互吸引作用增强,能够快速聚集形成硬度较大的凝胶。但盐浓度过高(>0.7 mol/L),肌原纤维蛋白可能发生了盐析现象,导致凝胶强度降低 [37]。
当离子强度小于0.8 mol/L时,肌原纤维蛋白凝胶保水性随离子强度的增加而增大,在离子强度为0.8 mol/L时保水性最好,当离子强度大于0.6 mol/L后,凝胶保水性增长平缓,上升幅度小。在盐浓度较低时,肌原纤维蛋白的状态是不溶解的肌纤丝,处于溶解状态的肌原纤维蛋白不足以形成致密的凝胶网络,不能有效地保留水分;在盐浓度较高时,肌原纤维蛋白充分溶解,加热形成复杂的凝胶网络结构,可以保留住更多网络中的水分,凝胶持水性变大 [38-39]。
2.2 小麦麸膳食纤维添加量对猪肉肌原纤维蛋白凝胶功能性质的影响
2.2.1 小麦麸膳食纤维添加量对肌原纤维蛋白凝胶EAI和ESI的影响
采用GB/T 5009.88—2008方法可测得小麦麸膳食纤维总含量为40.15%,纯度为80.85%。小麦麸膳食纤维添加量对肌原纤维蛋白EAI和ESI的影响如图6所示。

图6 小麦麸膳食纤维添加量对肌原纤维蛋白凝胶EAI和ESI的影响
Fig.6 Effect of wheat bran dietary fiber addition on emulsifying capacity and emulsion stability of MP gels
由图6可知,肌原纤维蛋白凝胶EAI随小麦麸膳食纤维的添加量增大略有升高,但不同添加量之间对EAI的影响差异不显著。肌原纤维蛋白凝胶ESI在小麦麸膳食纤维添加量为1%时最高,之后随小麦麸膳食纤维添加量增加而降低。可能原因是小麦麸膳食纤维含有很多的亲水基团,同时对油脂有吸附作用,所以EAI增加,但是膳食纤维不溶于水的特性使蛋白ESI降低。
2.2.2 小麦麸膳食纤维添加量对肌原纤维蛋白凝胶硬度和保水性的影响

图7 小麦麸膳食纤维添加量对肌原纤维蛋白凝胶硬度和保水性的影响
Fig.7 Effect of wheat bran dietary fiber addition on textual properties and WHC of MP gels
由图7可知,肌原纤维蛋白凝胶硬度随膳食纤维添加量的增加而变大,当添加量超过4%时,硬度值增加变缓,保水性变化趋于平缓。小麦麸膳食纤维具有很强的持水溶胀性,当膳食纤维添加到肌原纤维蛋白后,会形成一定的腔室结构,这种结构填充至蛋白凝胶形成的网络结构中,稳定蛋白凝胶结构,凝胶的硬度因膳食纤维的机械充填效应而变大,同时,吸收蛋白网络结构中的水分,提高肌原纤维蛋白凝胶的保水性。膳食纤维添加量越大,肌原纤维蛋白凝胶网络孔隙越大,蛋白的凝胶网络受到一定程度破坏,混合凝胶保水性不再增加。综合考虑膳食纤维添加量过高容易导致凝胶崩溃,黏聚性低等特点,后续实验添加量设为3%,这一结论和在凝胶中添加大豆膳食纤维是一致的 [23]。
2.2.3 小麦麸膳食纤维添加量对肌原纤维蛋白凝胶流变性的影响
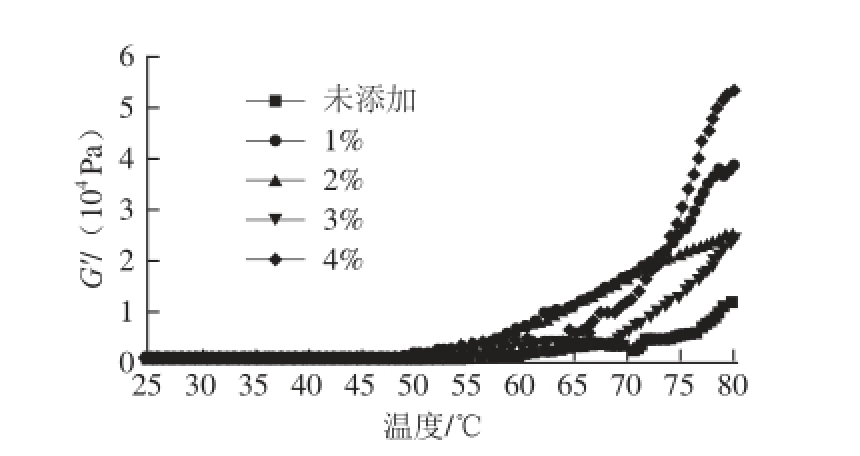
图8 小麦麸膳食纤维添加量对肌原纤维蛋白凝胶流变性的影响
Fig.8 Effect of wheat bran dietary fiber addition on rheology of MP gels
由图8可知,肌原纤维蛋白的弹性模量随小麦麸膳食纤维添加量的增加而增大,其中,未添加膳食纤维组在50 ℃左右发生了一个流变学的转变,随温度变化弹性模量先上升达到一个峰值然后略微走低,之后再次上升。普遍认为转变的原因是:弹性模量的增大源于肌球蛋白头部的接合,随着温度的进一步升高,肌球蛋白尾部逐渐展开,导致肌球蛋白的头部结合崩溃瓦解,致使弹性模量下降,温度继续升高后,随着蛋白的变性,凝胶网络再次形成,弹性模量持续增加。而加入膳食纤维组的流变学特性转变约发生在65 ℃,并且膳食纤维的加入使凝胶增强作用得到较强的显现,这可能是在加热过程中膳食纤维吸水溶胀,阻碍了蛋白质分子的充分展开,蛋白质的变性温度升高。
2.2.4 小麦麸膳食纤维添加量对肌原纤维蛋白凝胶微观结构的影响


图9 小麦麸膳食纤维添加量对肌原纤维蛋白凝胶微观结构的影响(300×)300
Fig.9 Effect of wheat bran dietary fiber addition on microstructure of MP gels (300×)
a~e分别代表小麦麸膳食纤维添加量为0%、1%、2%、3%、4%。
由图9可知,未添加小麦麸膳食纤维的肌原纤维蛋白凝胶内部微观结构粗糙,加入小麦麸膳食纤维后凝胶形成一定的腔室结构,当添加量较少时(图9b),凝胶腔室较小;当其添加量逐渐增大,凝胶形成较大的蜂窝状腔室结构,这可能是因为膳食纤维添加量过大,会阻碍肌原纤维蛋白之间的交联,使得部分区域蛋白网络结构疏松、缺乏整体完整性,因而体系保水性、硬度等上升不明显或不再上升。
2.3 小麦麸膳食纤维粒径大小对肌原纤维蛋白凝胶功能特性的影响
2.3.1 小麦麸膳食纤维超微粉碎粒径
由前期实验结果可知,小麦麸膳食纤维更有利于肌原纤维蛋白凝胶网络的形成,而且添加了小麦麸膳食纤维后凝胶硬度和保水性有了提高,但是凝胶容易崩溃,黏聚性比较低。为了改善这种不利状况,对小麦麸膳食纤维进行了粉碎分级,探索不同粒径小麦麸膳食纤维对肌原纤维蛋白凝胶性质的影响。表1为小麦麸膳食纤维经超微粉碎后过100、150、200、300 目筛的样品粒径测定结果。
表1 小麦麸膳食纤维平均粒径测定结果
Table1 Measurement of wheat bran dietary fiber diameters μm
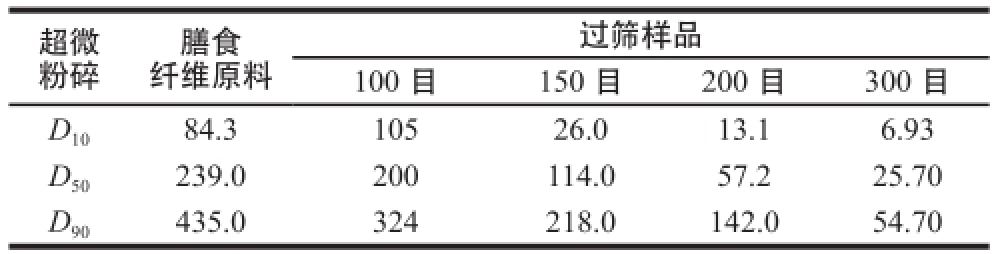
注:D 50为中值,表示样品颗粒中有一半颗粒的粒径低于该值,D 10、D 90表示样品颗粒中有10%、90%的颗粒粒径低于该值。
过筛样品100 目150 目200 目300 目D 1084.310526.013.16.93 D 50239.0200114.057.225.70 D 90435.0324218.0142.054.70超微粉碎膳食纤维原料
2.3.2 不同粒径小麦麸膳食纤维对肌原纤维蛋白凝胶硬度和保水性的影响
样品中肌原纤维蛋白质量浓度为60 mg/mL,膳食纤维添加量为3%时,由图10可知,随着膳食纤维粒径的减小,肌原纤维蛋白凝胶硬度逐渐变大,这是因为膳食纤维粒径越小,凝胶结构越致密(图9),凝胶网络结构越好,因此,凝胶硬度越大。肌原纤维蛋白凝胶保水性随膳食纤维粒径的减小而增大,这是因为膳食纤维粒径越小,保水性越好,并且膳食纤维肌原纤维蛋白凝胶网络致密性、连续性越好,越可以保留住更多的游离水。

图10 添加不同粒径小麦麸膳食纤维对肌原纤维蛋白凝胶硬度和保水性的影响
Fig.10 Effect of different particle sizes of wheat bran dietary fiber on textual properties and WHC of MP gels
2.3.3 不同粒径小麦麸膳食纤维对肌原纤维蛋白凝胶流变性的影响

图11 添加不同粒径小麦麸膳食纤维对肌原纤维蛋白凝胶流变性的影响
Fig.11 Effects of different particle sizes of wheat bran dietary fiber on rheology of MP gels
由图11可知,未添加膳食纤维组在50 ℃左右发生了相同的流变学的转变,添加膳食纤维组在65 ℃左右发生流变学转变,膳食纤维的添加使肌原纤维蛋白凝胶的弹性模量增高,表明加入膳食纤维有利于凝胶网络结构的形成,并且随粒径的增大而升高,说明肌原纤维蛋白质凝胶网络的形成过程中小麦麸膳食纤维在网络中起支撑作用,粒径减小对凝胶网络的支撑作用小,蛋白弹性模量增量变小。
2.3.4 添加不同粒径小麦麸膳食纤维对肌原纤维蛋白凝胶微观结构的影响
由图12可知,未添加小麦麸膳食纤维的肌原纤维蛋白凝胶(图12a)内部微观结构疏松多孔,且孔洞不规则;添加未超微粉碎的小麦麸膳食纤维凝胶样品(图12b)内部微观结构更粗糙,有蜂窝状腔室结构。随着膳食纤维粒径的减小,凝胶的微观结构变得更加致密、空隙更小。这时凝胶网络已经形成,小麦麸膳食纤维的存在充填于交联的网络结构之中,支撑网络结构,形成了更致密、均匀的网状结构。这样的结构使凝胶能够容纳更多的水分,这与凝胶的保水性增大结果相一致。
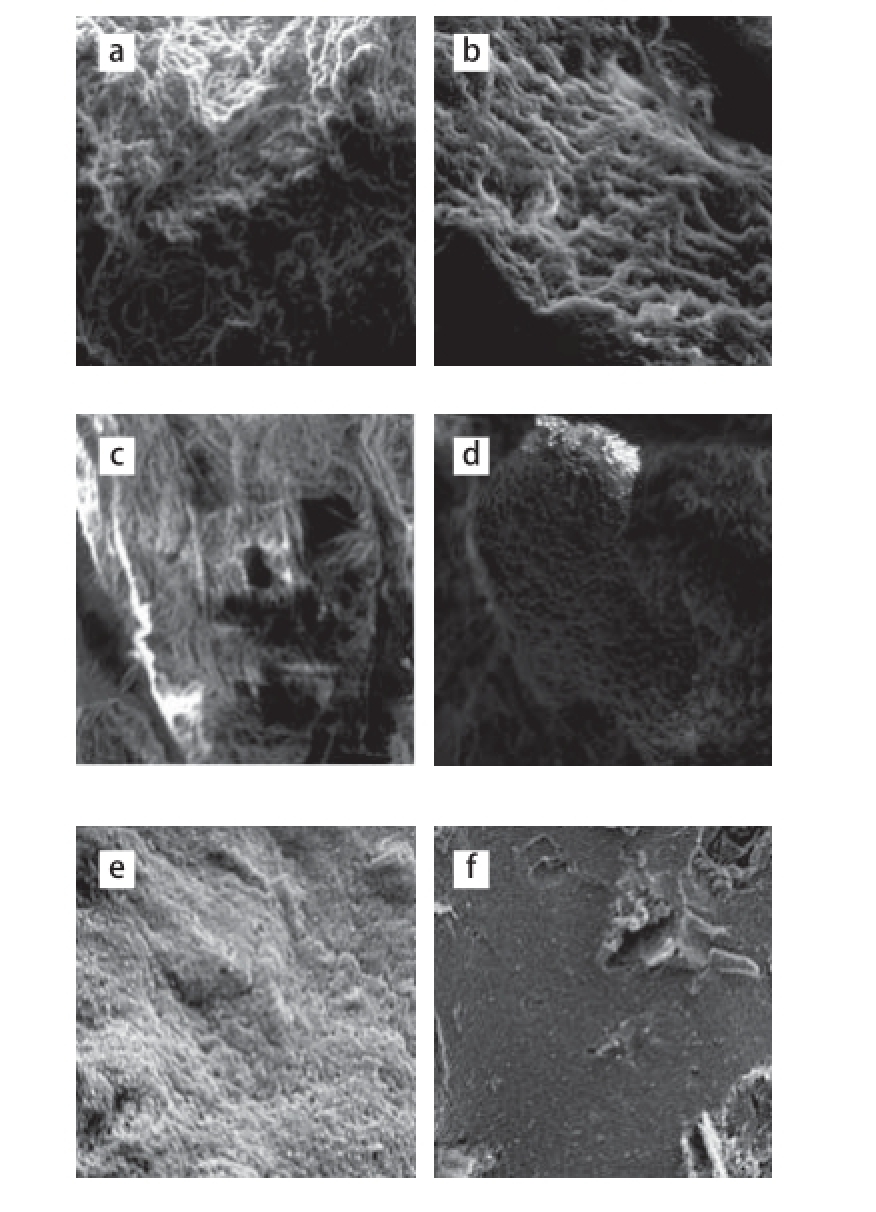
图12 不同粒径小麦麸膳食纤维对肌原纤维蛋白凝胶微观结构的影响(300×)300
Fig.12 Effects of different particle sizes of wheat bran dietary fiber on microstructure of MP gels (300 ×)
a.未添加小麦麸膳食纤维的肌原纤维蛋白凝胶;b~f.添加物分别为小麦麸膳食纤维原料、过100 目筛样品、过150 目筛样品、过200 目筛样品、过300 目筛样品。
利用单因素分析法,研究了肌肉中的重要的结构蛋白质群——肌原纤维蛋白热诱导凝胶的性质,分析了肌原纤维蛋白质量浓度、pH值、离子强度对肌原纤维蛋白凝胶硬度和保水性的影响,并通过添加不同粒径的小麦麸膳食纤维构成混合凝胶,探讨了小麦麸膳食纤维对肌原纤维蛋白凝胶硬度、保水性、流变性、微观结构及质构特性的变化,主要研究结果如下:
温度对肌原纤维蛋白浊度的影响结果表明肌原纤维蛋白变性聚集的温度范围为40~70 ℃。肌原纤维蛋白凝胶硬度和保水性随肌原纤维蛋白质量浓度增加而增大,当蛋白质量浓度达到70 mg/mL时,肌原纤维蛋白凝胶硬度和保水性不再增加;当pH值为5.5时,肌原纤维蛋白凝胶硬度达到最大,凝胶保水性在pH 7.0时开始趋于稳定;当离子强度为0.6 mol/L时,肌原纤维蛋白凝胶的硬度和保水性趋于稳定。
小麦麸膳食纤维添加使肌原纤维蛋白凝胶EAI升高,ESI降低;小麦麸膳食纤维添加量增加使得肌原纤维蛋白凝胶的弹性模量增大、蛋白凝胶硬度和保水性逐渐升高;并且随着膳食纤维粒径的减小,凝胶硬度和保水性进一步增加;对凝胶网络的支撑作用小,蛋白的弹性模量增量降低。通过电子显微镜观察小麦麸膳食纤维添加对猪肉肌原纤维蛋白凝胶微观结构的影响,粒径较小的膳食纤维充填于交联的网络结构之中,支撑网络结构,形成了更致密、均勾的网状结构,此时凝胶保水性更好,且不会出现崩溃现象,凝胶黏聚性也比较好。
目前膳食纤维添加到肉制品中的商业化产品市面上鲜有,主要是由于膳食纤维添加量过高易引起产品离散崩溃且口感较差,而膳食纤维添加量少又很难满足人们期望的健康低热量需求。因此,可以在实际生产应用中通过降低膳食纤维的粒径、增大添加量,从而改良肉制品品质,减少脂肪摄入量,达到促进人体健康的目的,为功能性肉制品及新产品的开发提供了一定的依据及参考价值。
参考文献:
[1] 杨玉玲, 游远, 彭晓蓓, 等. 加热对鸡胸肉肌原纤维蛋白结构与凝胶特性的影响[J]. 中国农业科学, 2014(10): 2013-2020. DOI:10.3864/ j.issn.0578-1752.2014.10.015.
[2] AMITY D W, JENNI L B, STEVEN M L. Influence of muscle type on rheological properties of porcine myobrillar protein during heat-induced gelation[J]. Meat Science, 2006, 72(4): 697-703. DOI:10.1016/j.meatsci.2005.09.021.
[3] 陈文博. 肌原纤维蛋白热诱导凝胶形成机制研究[D]. 南京: 南京农业大学, 2010: 49-58.
[4] KRISTINSSON H, HULTIN H. Role of pH and ionic strength on water relationships in washed minced chicken-breast muscle gels[J]. Journal of Food Science, 2003, 68(2): 917-922. DOI:10.1111/j.1365-2621.2003.tb08265.x.
[5] 魏朝贵, 吴菊清, 邵俊花, 等. KCl和MgCl 2部分替代NaCl对猪肉肌原纤维蛋白乳化凝胶特性的影响[J]. 食品科学, 2014, 35(5): 89-95. DOI:10.7506/spkx1002-6630-201405018.
[6] MELODY J L, LONERGAN S M, ROWE L J, et al. Early postmortem biochemical factors infl uence tenderness and water-holding capacity of three porcine muscles[J]. Journal of Animal Science, 2004, 82(7): 1195-1205.
[7] 吴振, 杨传玉, 孙京新, 等. 不同添加剂对鸡肉盐溶蛋白质热诱导凝胶性质的影响[J]. 中国食品学报, 2012, 12(8): 60-66. DOI:10.3969/ j.issn.1009-7848.2012.08.009.
[8] 杨明. 马铃薯淀粉及转谷氨酰胺酶对鲤鱼肌原纤维蛋白功能特性的研究[D]. 沈阳: 东北农业大学, 2014: 29-52.
[9] TRONGPANICH K, BOONYASIRIKOOL P. Feasibility study on snack production by using dietary fiber concentrate from soymilk residue[J]. Kasetsart Journal-Natural Science, 2001, 35(2): 188-194.
[10] RICCARDI G. Dietary fi ber in treatment of diabetes: myth or reaity[J]. Digestive and Liver Disease, 2002, 34(2): 140-144. DOI:10.1016/ S1590-8658(02)80182-7.
[11] RAMULU P, RAO P U. Total, insoluble and soluble dietary fiber contents of Indian fruits[J]. Journal of Food Composition & Analysis,2003, 16(6): 677-685. DOI:10.1016/S0889-1575(03)00095-4.
[12] SÁNCHEZ-ALONSO I, HAJI-MALEKI R, BORDERIAS A J. Wheat fiber as a functional ingredient in restructured fish products[J]. Food Chemistry, 2007, 100(3): 1037-1043. DOI:10.1016/ j.foodchem.2005.09.090.
[13] SÁNCHEZ-ALONSO I, SOLAS M T, BORDERÍAS A J. Technological implications of addition of wheat dietary fi bre to giant squid (Dosidicus gigas) surimi gels[J]. Journal of Food Engineering,2007, 81(2): 404-411. DOI:10.1016/j.jfoodeng.2006.11.015.
[14] STEENBLOCK R L, SEBRANEK J G, OLSON D G. The effect of oat fi ber on the properties of light bologna and fat-free frankfurters[J]. Journal of Food Science, 2001, 66(9): 1409-1415. DOI:10.1111/j.1365-2621.2001.tb15223.x.
[15] GARCÍA M L, DOMINGUEZ R, GALVEZ M D, et al. Utilization of cereal and fruit fi bres in low fat dry fermented sausages[J]. Meat Science, 2002, 60(3): 227-236. DOI:10.1016/S0309-1740(01)00125-5.
[16] YILMAZ I. Effect of rye bran addition on fatty acid compotion and quality characteristics of low-fat meatballs[J]. Meat Science, 2004,67(2): 245-249. DOI:10.1016/j.meatsci.2003.10.012.
[17] ANDERSON E T, BERRY B W. Sensory, shear and cooking properties of lower-fat beef patties made with inner pea fiber[J]. Journal of Food Science, 2000, 65(5): 805-810. DOI:10.1111/j.1365-2621.2000. tb13591.x.
[18] LIU G, XIONG Youling L.. Contribution of lipid and protein oxidation to rheological differences between chicken white and red muscle myofi brillar proteins[J]. Journal of Agricultural and Food Chemistry,1996, 44(3): 779-784. DOI:10.1021/jf9506242.
[19] 郭尧君. 蛋白质电泳实验技术[M]. 北京: 科学出版社, 2005: 123-157.
[20] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685. DOI:10.1038/227680a0.
[21] BENJAKUL S, VISESSANGUAN W, ISHIZAKI S, et al. Differences in gelation characteristics of natural actomyosin from two species of bigeye snapper, Priacanthus tayenus and Priacanthus macracanthus[J]. Journal of Food Science, 2001, 66(9): 1311-1318. DOI:10.1111/j.1365-2621.2001.tb15207.x.
[22] 徐幸莲, 王霞, 周光宏, 等. 磷酸盐对肌球蛋白热凝胶硬度, 保水性和超微结构的影响[J]. 食品科学, 2005, 26(3): 42-46. DOI:10.3321/ j.issn:1002-6630.2005.03.004.
[23] 朱君, 曾茂茂, 何志勇, 等. 膳食纤维对肌原纤维蛋白凝胶性能的影响[J]. 食品科学, 2011, 32(17): 55-59.
[24] KOCHER P N, FOEGEDING E A. Microcentrifuge-based method for measuring water-holding of protein gels[J]. Joumal of Food Science,1993, 58(5): 1040-1046. DOI:10.1111/j.1365-2621.1993.tb06107.x.
[25] BUNZEL M, RALPH J, MARITA J M, et al. Diferulates as structural components in soluble and insoluble dietary fibre[J]. Journal of the Science of Food and Agriculture, 2001, 81(7): 653-660. DOI:10.1002/ jsfa.861.
[26] 杨月欣, 杨晓莉, 唐华澄, 等. GB/T 5009.88—2008 食品中膳食纤维的测定[S]. 北京: 中国标准出版社, 2008.
[27] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins: evaluation of a turbidimetric technique[J]. Joumal of Agricultural and Food Chemistry, 1978, 26(3): 716-723. DOI:10.1021/jf60217a041.
[28] RAMIREZ-SUAREZ J C, XIONG Youling L.. Transglutaminase cross-linking of whey/myofi brillar proteins and the effect on protein gelation[J]. Journal of Food Science, 2002, 67(8): 2885-2891. DOI:10.1111/j.1365-2621.2002.tb08833.x.
[29] PAN B S, YEH W T. Biochemical and morphological changes in grass shrimp muscle following freezing by air blast and liquid nitrogen methods[J]. Journal of Food Biochemistry, 1993, 17(3): 147-160. DOI:10.1111/j.1745-4514.1993.tb00464.x.
[30] 孔保华, 韩建春. 肉品科学与技术[M]. 北京: 中国轻工业出版社,2011: 123-141.
[31] ASGHAR A, MORITA J I, SAMEJIMA M, et al. Biochemical and functional characteristics of myosin from red and white muscles of chicken as influenced by nutritional stress[J]. Bioscience Biotechnology & Biochemistry, 1984, 48(1): 2217-2224. DOI:10.1271/ bbb1961.48.2217.
[32] THORARINSDOTTIR K A, ARASON S, GEIRSDOTTIR M, et al. Changes in myofi brilar proteins during processing of salted cod (Gadus morhua) determined by electrophoresis and differential scanning calorimetry[J]. Food Chemistry, 2002, 77(3): 377-385. DOI:10.1016/ S0308-8146(01)00349-1.
[33] ISHIOROSHI M, SAMEJIMA K, YASUI T. Heat-induced gelation of myosin filaments at a low salt concentration[J]. Agricultural and Biological Chemistry, 1983, 47(12): 2809-2816. DOI:10.1080/000213 69.1983.10866029.
[34] KRISTINSSON H G, HULTIN H O. Role of pH and ionic strength on water relationships in washed minced chicken-breast muscle gels[J]. Journal of Food Science, 2003, 68(3): 917-922. DOI:10.1111/j.1365-2621.2003.tb08265.x.
[35] LIU R, ZHAO S M, XIONG S B, et al. Role of secondary structure in the gelation of porcine myosin at different pH values[J]. Meat Science,2008, 80(3): 632-639. DOI:10.1016/j.meatsci.2008.02.014.
[36] WESTPHALEN A D, BRIGGS J L, LONERGAN S M. Influence of pH on rheological properties of porcine myofibrillar protein during heat induced gelation[J]. Meat Science, 2005, 70(2): 293-299. DOI:10.1016/j.meatsci.2005.01.015.
[37] 郭世良. 肌原纤维蛋白和猪肉的热诱导凝胶影响因素及特性研究[D].郑州: 河南农业大学, 2008: 16-20.
[38] 韩敏义. 肌原纤维蛋白结构与热诱导凝胶功能特性关系研究: 低场NMR和拉曼光谱法[D]. 南京: 南京农业大学, 2009: 42-43.
[39] 冯占荣. 鹿肉盐溶蛋白热诱导凝胶特性研究[D]. 长春: 吉林大学,2007: 6-15.
Effect of Wheat Dietary Fibers on Functional Properties of Pork Myofibrillar Protein Gels
LIU Yingli, XIE Liangxu, DING Li, ZHANG Huijuan, GONG Lingxiao, WANG Jing*, JIANG Guoqing
(Beijing Engineering and Technology Research Center of Food Additives, Beijing Advanced Innovation Center for Food Nutrition and Human Health, Beijing Technology and Business University, Beijing 100048, China)
Abstract:In order to develop healthy meat products with low fat and high fi ber and to clearly defi ne the effect of dietary fi ber on the quality of meat products, we investigate properties of heat-induced gels of pork myofi brillar protein (MP) as well as examined the infl uence of adding wheat bran dietary fi bers to heat-induced MP gels on their properties using the one-factor-at-a-time method. The results showed that the denaturation temperature of MP ranged from 40 to 70 ℃. With the increase in protein concentration, the water-holding capacity (WHC) and gel hardness increased to reach a plateau at 70 mg/mL. At pH 5.5, the heat-induced gel showed the maximum hardness, and WHC tended to be stable at pH 7.0. Both gel hardness and WHC showed a stable trend at the ionic strength of 0.6 mol/L. Meanwhile, the emulsifying capacity of MP was increased but not signifi cantly with increasing addition of wheat bran dietary fi bers, showing an increase of 7.4% at an added concentration of 5%, whereas emulsion stability decreased. Moreover, the elastic modulus, hardness and WHC of heatinduced MP gels were enhanced. The gel hardness and WHC reached a plateau with the addition of 4% of wheat bran dietary fi bers. Gel microstructure became more loose with enlarged pore size as observed under scanning electron microscope (SEM). By adding dietary fi bers with smaller particle size, the WHC and hardness of gels became stronger, microscopic structure became more compact, a the value of elastic modulus became smaller. In conclusion, dietary fi ber can obviously change the functional properties of myofi brillar proteins. The addition of the right amount of dietary fi ber in meat products can signifi cantly improve meat fl avor as a substitute for fat to reduce energy intake.
Key words:myofibrillar protein; wheat bran dietary fiber; functional properties; gel property
DOI:10.7506/spkx1002-6630-201619003
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2016)19-0015-09
引文格式:
刘英丽, 谢良需, 丁立, 等. 小麦麸膳食纤维对猪肉肌原纤维蛋白凝胶功能特性的影响[J]. 食品科学, 2016, 37(19):15-23. DOI:10.7506/spkx1002-6630-201619003. http://www.spkx.net.cn
LIU Yingli, XIE Liangxu, DING Li, et al. Effect of wheat dietary fibers on functional properties of pork myofibrillar protein gels[J]. Food Science, 2016, 37(19): 15-23. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201619003. http://www.spkx.net.cn
收稿日期:2016-01-27
基金项目:国家自然科学基金青年科学基金项目(31601564);国家自然科学基金面上项目(31271976;31571940);北京市教委一般项目(SQKM201610011004);北京市教委科研类专项项目(19008001226)
作者简介:刘英丽(1981—),女,副教授,博士,主要从事食品品质改良研究。E-mail:liuyingli@th.btbu.edu.cn
*通信作者:王静(1976—),女,教授,博士,主要从事食品品质改良研究。E-mail:wangjing@th.btbu.edu.cn