魔芋葡甘聚糖与可得然胶的相互作用
蒋明峰,肖 满*,倪学文,严文莉,匡 映,沈 阅,姜发堂
(湖北工业大学生物工程与食品学院,湖北 武汉 430068)
摘 要:通过分子动力学模拟魔芋葡甘聚糖(konjac glucomannan,KGM)和可得然胶分子的作用方式;采用旋转流变仪测定25 ℃条件下KGM/可得然胶溶胶黏度、剪切力随剪切速率变化的规律;采用透射电子显微镜和原子力显微镜观察KGM/可得然胶共混溶胶在90 ℃条件下的分子形貌。分子模拟表明KGM和可得然胶分子间存在氢键相互作用;KGM/可得然胶流变性结果表明二者分子间存在相互作用,且共混溶胶剪切力协同指数由1.43提高到1.97,两种多糖分子共混具有协同-增黏作用,可能是两种多糖分子相互作用的结果;显微镜观察结果表明分子间可形成互穿网状结构(可能由氢键相互作用驱动),进一步从分子水平上验证KGM和可得然胶存在相互作用以及两者的作用方式。
关键词:魔芋葡甘聚糖;可得然胶;分子动力学模拟;分子形貌;相互作用
天然多糖是自然界中一类重要的生物大分子,在食品工业中有着广泛的应用
[1]。由于单一多糖的功能特性单一,不能满足食品工业应用发展的需要。而两种或多种多糖在适当条件下的共混表现出特殊的黏弹性、凝胶性,使其作为添加剂、增稠剂常被应用于食品工业中
[2]。共混多糖分子间相互作用的研究近年来逐渐成为食品研究领域的热点之一。例如已经有魔芋葡甘聚糖(konjac g1ucomannan,KGM)/黄原胶、KGM/瓜尔豆胶、KGM/结冷胶、壳聚糖/海藻酸钠等相互作用的报道
[3-6],利用这种相互作用得到的凝胶可以拓宽多糖在食品中的应用范围。
KGM由D-葡萄糖和D-甘露糖按物质的量比2∶3或1∶1.6,由β-1,4-吡喃糖苷键连结,具有亲水性、优良的成膜性、生物相容性和可降解性,被广泛应用于食品医疗领域
[7]。可得然胶是一种由粪产碱杆菌(Alcaligenes faecalis)发酵生成的胞外多糖,由单一的D-葡萄糖在C1和C3位置通过β-1,3-糖苷键连接而成
[8]。可得然胶是无分支的均一性多糖,将可得然胶的水分散液加热到55~60 ℃,冷却能形成热可逆性的低度胶体;当可得然胶的水分散液加热到约80 ℃以上时,可形成热不可逆性的凝胶,因其特殊的物理化学性质,可得然胶作为一种新型食品添加剂已应用于挂面、面团、方便米线等食品工业领域
[9-12]。
KGM与可得然胶复配溶胶用于膜的制备,结果表明KGM/可得然胶共混膜具有良好的相容性、机械性能和抗湿性能
[13],然而至今鲜见关于共混溶胶中两种多糖分子相互作用的报道。
本实验通过分子动力学模型,以KGM和可得然胶分子的三维结构为基础,使用旋转流变仪从宏观上探究KGM和可得然胶分子间相互作用,并结合透射电子显微镜和原子力显微镜对KGM、可得然胶及KGM/可得然胶共混溶胶分子形貌的观察,在分子水平上分析KGM与可得然胶间相互作用。
1 材料与方法
1.1 材料
KGM(精粉) 湖北强森魔芋科技有限公司;可得然胶(食品级) 山东中科生物科技股份有限公司。
1.2 仪器与设备
AB-50电子分析天平 瑞士Mette公司;SZ-93自动双重纯水蒸馏器 上海亚荣生化仪器厂;HH-2型数显恒温水浴锅 常州国华电器有限公司;JJ-1型增力电动搅拌器 江苏省金坛市医疗仪器厂;HJ-8A磁力搅拌器武汉科尔仪器设备有限公司;GZX-9030MBE鼓风干燥箱上海博迅实业有限公司;Haake Rheostress旋转流变仪美国Thermo Fisher Scientifi c有限公司;JEM-2100F透射电子显微镜 日本电子株式会社;原子力显微镜 美国Veeco公司。
1.3 方法
1.3.1 KGM/可得然胶分子相互作用分子动力学模拟
KGM的三维结构在网站http://glycam.org/中运用Carbohydrate Builder构建,结构式如图1所示。从多糖三维结构数据库中提取可得然胶的三螺旋晶体结构
[14-15],并复制三股连接到原始结构,获得可得然胶三螺旋构象。同时模拟两种KGM和可得然胶共混形式:平行共混与垂直共混。运用AMBER 12软件进行分子模拟
[16-17]。采用Shake算法
[18]限制2 fs时间段中的氢原子共价键,同时运用Particle-Mesh Ewald方法
[19]克服远程静电作用。

图1 KGM(a)、可得然胶(b)、KGM/可得然胶的两种共混方式(c,d)
Fig.1 Topological structures of KGM (a) (“6A” stands for the acetyl substitution in position six) and curdlan (b), two solvated complex systems of KGM parallel (c) or perpendicular (d) to curdlan
c. 平行共混;d. 垂直共混。
1.3.2 流变性测定
0.05 g KGM分散于5 mL蒸馏水中,室温条件下分散12 h,得到KGM水溶胶。分别称取0.05、0.10 g 可得然胶粉末分散在5 mL水中,室温分散12 h,然后在90 ℃水浴锅内磁力搅拌加热30 min,将上述分散好的KGM水溶胶缓慢加入到90 ℃可得然胶水溶胶中,快速搅拌30 min,使溶胶充分混匀,静止冷却至25 ℃。分别配制单一的5 mg/mL KGM、5 mg/mL可得然胶、10 mg/mL可得然胶胶液作对照。
利用HaakeRS6000旋转流变仪对KGM(5 mg/mL)、可得然胶(5、10 mg/mL)及KGM/可得然胶(10 mg/mL(5∶5,V/V)、15 mg/mL(5∶10,V/V))混合溶胶进行测定,采用稳态剪切模式,使用锥板钛合金转子(60 mm、1°、TiL),剪切速率0.01~500 s
-1,测量间距0.052 mm,在25 ℃条件下测定溶胶的剪切力及黏度随剪切速率的变化。其静态流体行为可以通过剪切力协同指数来表征
[20]。
式中:I
s为剪切力协同指数;τ
i+j为浓度为c
i+c
j组分混合剪切力/Pa;τ
i为浓度为c
i组分剪切力/Pa;τ
j为浓度为c
j组分剪切力/Pa;τ为剪切力/Pa;γ
2、γ
1分别表示最大、最小剪切速率/s
-1。
I
s的大小反映了不同的增黏作用。如果I
s>1,其混合组分的剪切力比单一组分之和大,则混合体系具有增黏作用即相互作用发生;如果I
s<1,两组分被视为相互阻碍。
1.3.3 原子力及透射电子显微镜观察
KGM和可得然胶分别配制成0.5 mg/mL的分散液,置于磁力搅拌器上,搅拌12 h后,将溶液稀释至5 μg/mL,并将稀释液放置90 ℃水浴锅内搅拌1 h。分别称取0.005 g KGM和0.005 g 可得然胶分散于10 mL蒸馏水中,室温下分散12 h,将溶液稀释至5 μg/mL,并将稀释液放置90 ℃水浴锅内搅拌1 h后,将KGM和可得然胶溶液迅速混合,置于90 ℃水浴锅内搅拌30 min。吸取30 μL上述配制好后的样液,分别滴加到事先预热的云母片及铜网上,在90 ℃干燥箱内干燥,用原子力及透射电子显微镜观察分子形貌。
2 结果与分析
2.1 KGM/可得然胶分子相互作用分子动力学模拟分析

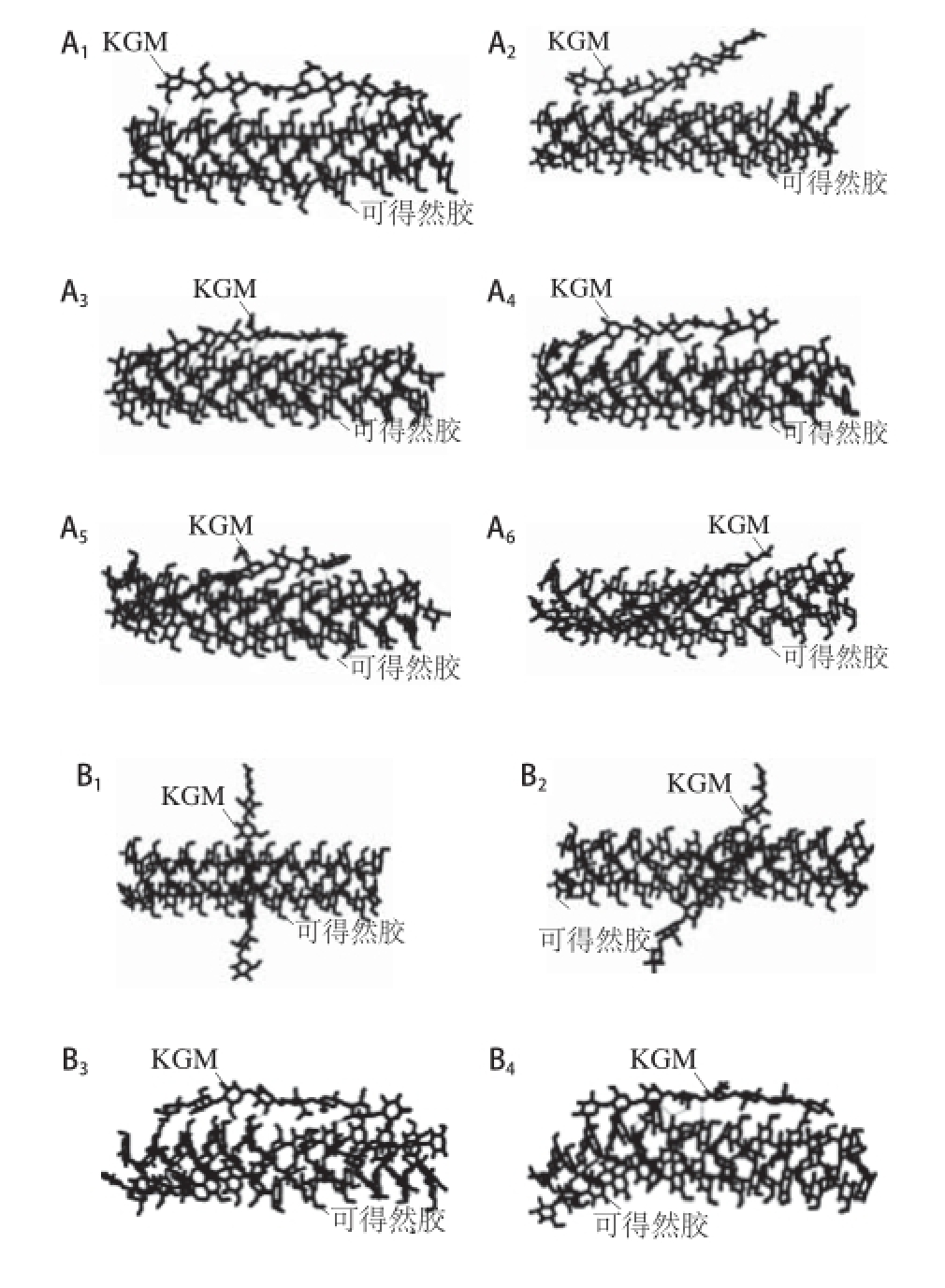
图2 KGM/可得然胶在100 ns中的分子动力模拟快照
Fig.2 Snapshots of the KGM/curdlan complex in the 100 ns production-phase MD
A.平行共混、B.垂直共混;1~6. 分别为快照0、1、5、10、50、100 ns时间点。
由图2可知,KGM分子链的构象和取向从初始的自由伸展状转变为螺旋状,可得然胶分子链发生一定的变形来接受KGM分子链的变化,可能是KGM和可得然胶分子间氢键的相互作用促进了两种构象的转变。进一步测量,记录KGM与可得然胶分子间的氢键数。如图3所示,随着模拟的进行,氢键数目从5 个以下急剧增加到15 个以上。达到平衡后,氢键数目稳定在15 个,表明KGM和可得然胶相互靠近后的分子形变是由氢键相互作用所驱动的。

图3 两种KGM/可得然胶系统中KGM与可得然胶间氢键数变化
Fig.3 Time-dependent number of H-bonds formed between KGM and curdlan for the 100 ns production-phase MD of the two KGM/curdlan systems
A. 平行布局启动系统;B. 垂直布局启动系统。
2.2 KGM/可得然胶混合溶胶剪切黏度随剪切速率的变化
由图4可知,25 ℃条件下,KGM溶胶表现出明显的剪切稀化现象,即剪切黏度随剪切速率的增加而显著减小,说明KGM溶胶具有典型的牛顿(假塑性)流体特性
[21]。原因是KGM分子链在较低的剪切速率下,相互缠绕在一起表现出一定的黏度,受剪切力影响较小。但是,随着剪切速率的进一步增加,KGM分子链随着剪切力的方向定向排列,解缠结,流动阻力降低,黏度降低。可得然胶溶胶表现出更加明显的剪切稀化现象,黏度随剪切速率增加而迅速下降,在剪切速率为500 s
-1时趋向于0 Pa·s。主要是因为可得然胶分子链间缠结不够紧密,较低的剪切速率就能使可得然胶分子链间解缠结,黏度降低。当将可得然胶与KGM混合后,KGM/可得然胶混合溶胶与KGM溶胶具有相同的假塑性行为,表明混合溶胶的流变特性主要由KGM所主导。混合溶胶的剪切黏度随着可得然胶的加入有显著提高。剪切黏度的提高随着可得然胶质量浓度的提高而更加明显。这可能是因为可得然胶分子均匀分布在KGM分子链网状结构中,分子链间氢键的相互作用,抵抗了剪切力对其黏度的影响。

图4 KGM、可得然胶、KGM/可得然胶混合溶胶剪切黏度随剪切速率的变化
Fig.4 Steady shear viscosity of KGM, curdlan and KGM/curdlan sols as a function of shear rate
2.3 KGM/可得然胶混合溶胶剪切力随剪切速率的变化
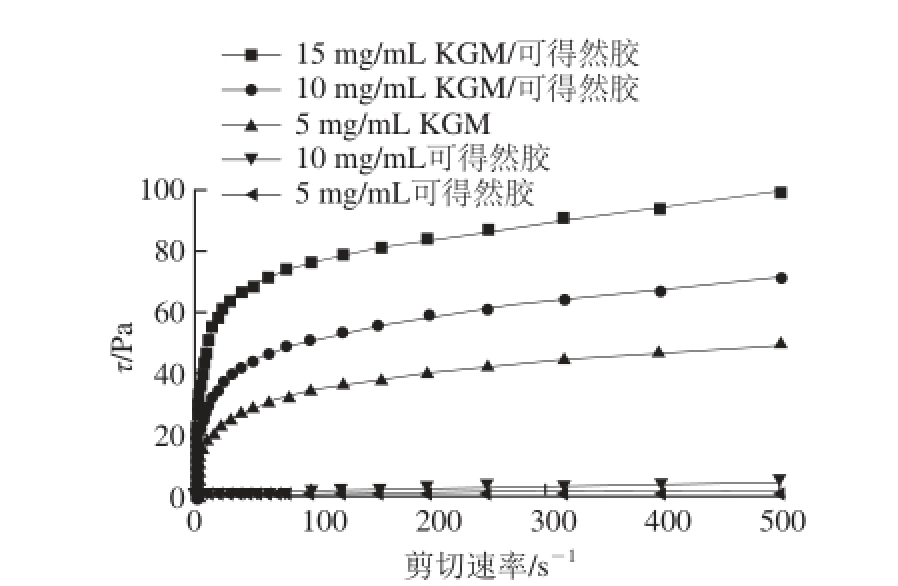
图5 KGM、可得然胶、KGM/可得然胶混合溶胶稳态剪切力随剪切速率的变化
Fig.5 Steady shear stress of KGM, curdlan and KGM/curdlan sols as a function of shear rate
由图5可知,单纯可得然胶的剪切力随剪切速率变化不明显,KGM/可得然胶混合溶胶比单纯KGM的剪切力随剪切速率变化明显。通过公式(1)、(2)分别计算出KGM、可得然胶、KGM/可得然胶混合溶胶的剪切力协同指数I
s,如表1所示,随着可得然胶质量浓度由5 mg/mL增加到10 mg/mL,I
s由1.43增加到1.97,两者之间具有增黏作用,这可能是因为KGM分子与可得然胶分子间具有氢键相互作用,导致了协同增效作用的发生。
表1 KGM、可得然胶、KGM/可得然胶在剪切速率0.01~500 s
-1条件下的剪切力及I
s(25 ℃)
Table1 Shear stress and shear stress synergy index of KGM, curdlan and KGM/curdlan sols (25 ℃) under the shear rate of 0.01 500 s
-1

注:-. 无。
样品剪切力/PaI
s5 mg/mL KGM40.09-5 mg/mL 可得然胶 0.82-10 mg/mL 可得然胶 2.65-10 mg/mL KGM/可得然胶58.561.43 15 mg/mL KGM/可得然胶84.211.97
2.4 原子力及透射电子显微镜观察KGM、可得然胶、KGM/可得然胶混合溶胶分子形貌

图6 透射电子显微镜及原子力显微镜图
Fig.6 TEM and AFM images of KGM/curdlan solutions at 90 ℃
A~C. 分别为KGM、可得然胶、KGM/可得然胶混合溶胶;1. 透射电子显微镜;2. 原子力显微镜。
由图6A
2可知,KGM分子呈现伸展的线状形态,具有一定的柔性,分子链的高度约为0.6~1.0 nm,这与文献中报道的KGM分子形态一致
[22]。KGM的透射电子显微镜照片(图6A
1)显示KGM分子间形成了均匀的网状结构,这主要依赖于KGM分子间范德华力相互作用以及糖链间氢键缔合,促使KGM分子相互缠绕
[23]。图6B
1、B
2显示了可得然胶溶胶在90 ℃加热处理下的分子形貌。实验结果表明可得然胶分子链是具有一定刚性的直链分子,这是由于可得然胶分子内存在氢键,导致分子链以刚性分子链形式存在。据报道,可得然胶在二甲基亚砜溶液中以单链形式存在,其单链的高度为(0.65±0.05) nm
[24]。X-ray单晶衍射观察到可得然胶三股螺旋链高度为1.56 nm
[25]。本研究中原子力显微镜探测到可得然胶分子链高度为2.0~3.0 nm,根据该分子链高度判断,可得然胶在90 ℃条件下,可能以三螺旋链形式存在,但是不能排除是单螺旋链的可能性。原因是当可得然胶的稀溶液滴加到云母片上干燥时,分子黏附到云母表面,由于分子内强的氢键作用使得分子链刚性很强,分子不能完全黏附到云母表面,当探针探测时,其高度必然大于其在良溶剂(二甲基亚砜)中的线性单分子链的高度。透射电子显微镜(图6B
1)观察到刚性的可得然胶分子间在90 ℃下形成了网状结构,可能是分子链的物理缠结,但更为深入的高温形成网状结构进而形成凝胶的分子机理有待进一步研究。当KGM与可得然胶在90 ℃条件下混合(图6C
1、C
2),柔性的呈线状的KGM分子链穿插分布在三螺旋链或单螺旋链的可得然胶分子链之间,KGM与可得然胶分子表现出相互缠绕的网状结构,KGM分子链与可得然胶分子链之间可能存在氢键相互作用,该作用维持着两种分子形成网络结构,透射电子显微镜和原子力显微镜图片(图6C
1、C
2)从分子水平上观察形成的网络结构,共混溶胶的流变特性从分子宏观特性上进一步证实了该分子网络结构的存在(图4、5)。另外,通过控制可得然胶分散液的加热温度来调控KGM和可得然胶共混的网络结构,将是进一步深入研究的方向之一。
3 结 论
分子模拟表明KGM和可得然胶分子间存在氢键相互作用。可得然胶与KGM溶胶之间具有协同-增黏作用。KGM和可得然胶在90 ℃条件下共混,能够形成均匀的互穿网状结构,可能是由于二者之间发生氢键相互作用而形成。透射电子显微镜和原子力显微镜对KGM、可得然胶及KGM/可得然胶共混溶胶分子形貌的观察,在分子水平上验证了分子间存在相互作用。
参考文献:
[1] BLANSHARD J M V, MITCHELL J R. Polysaccharides in food[M]. London: Butterworth & Co (Publishers) Ltd., 2013: 183-229.
[2] 侯团伟, 张虹, 毕艳兰, 等. 食品胶体的凝胶机理及协同作用研究进展[J]. 食品科学, 2014, 35(23): 347-353. DOI:10.7506/spkx1002-6630-201423067.
[3] WILLIAMS P A, DAY D H, LANGDON M J, et al. Synergistic interaction of xanthan gum with glucomannans and galactomannans[J]. Food Hydrocolloids, 1991, 4(6): 489-493. DOI:10.1016/S0268-005X(09)80199-9.
[4] 吴绍艳, 张升晖, 吴贵超. 魔芋葡甘聚糖与瓜尔豆胶协同相互作用及其凝胶化研究[J]. 广州食品工业科技, 2004, 20(4): 5-7. DOI:10.3969/j.issn.1673-9078.2004.04.002.
[5] 吴绍艳, 李琴, 祝媛媛, 等. 魔芋葡甘聚糖与结冷胶协同相互作用及凝胶化研究[J]. 广东化工, 2013, 40(24): 33-34. DOI:10.3969/ j.issn.1007-1865.2013.24.016.
[6] 侯红萍, 王家东. 壳聚糖-海藻酸钠共混凝胶制备及其包埋固定糖化酶的研究[J]. 中国食品学报, 2009, 9(3): 50-57. DOI:10.3969/ j.issn.1009-7848.2009.03.009.
[7] RATCLIFFE I, WILLIAMS P A, VIEBKE C, et al. Physicochemical characterization of konjac glucomannan[J]. Biomacromolecules, 2005,6(4): 1977-1986. DOI:10.1021/bm0492226.
[8] 吉武科, 张永刚, 武琳, 等. Curdlan凝胶机理研究进展[J]. 中国食品添加剂, 2012(4): 231-234. DOI:10.3969/j.issn.1006-2513.2012.04.033.
[9] 吉武科, 兰文忠, 董学前, 等. 可得然胶在挂面中的应用研究[J]. 中国食品添加剂, 2010(1): 205-209. DOI:10.3969/j.issn.1006-2513.2010.01.039.
[10] 张剑, 赵景艳, 李梦琴, 等. 可得然胶对面团及面条品质的影响[J]. 中国粮油学报, 2012, 27(1): 10-13. DOI:10.3969/ j.issn.1003-0174.2012.01.003.
[11] 陆雨, 刘成梅, 罗舜菁, 等. 可得然胶对方便米线性质的影响[J]. 南昌大学学报(理科版), 2015(1): 83-87. DOI:10.3969/ j.issn.1006-0464.2015.01.015.
[12] 赵冰, 李家鹏, 陈文华, 等. 可得然胶凝胶特性及其在西式火腿中的应用研究[J]. 食品科学, 2014, 35(21): 45-49. DOI:10.7506/spkx1002-6630-201421010.
[13] WU C, PENG S, WEN C, et al. Structural characterization and properties of konjac glucomannan/curdlan blend fi lms[J]. Carbohydrate Polymers, 2012, 89(2): 497-503. DOI:10.1016/j.carbpol.2012.03.034.
[14] SARKAR A, PÉREZ S. PolySac3DB: an annotated data base of 3 dimensional structures of polysaccharides[J]. BMC Bioinformatics, 2012,13(1): 96-103. DOI:10.1186/1471-2105-13-302.
[15] DESLANDES Y, MARCHESSAULT R H, SARKO A. Triple-helical structure of (1→3)-β-d-glucan[J]. Macromolecules, 1980, 13(6): 1466-1471. DOI:10.1021/ma60078a020.
[16] CASE D A, CHEATHAM T E, DARDEN T, et al. The Amber biomolecular simulation programs[J]. Journal of Computational Chemistry, 2005, 26(16): 1668-1688. DOI:10.1002/jcc.20290.
[17] GÖ TZ A W, WILLIAMSON M J, XU D, et al. Routine microsecond molecular dynamics simulations with AMBER on GPUs. 1. Generalized born[J]. Journal of Chemical Theory and Computation,2012, 8(5): 1542-1555. DOI:10.1021/ct200909j.
[18] RYCKAERT J P, CICCOTTI G, BERENDSEN H J C. Numerical integration of the cartesian equations of motion of a system with constraints: molecular dynamics of n-alkanes[J]. Journal of Computational Physics, 1977, 23(3): 327-341. DOI:10.1016/0021-9991(77)90098-5.
[19] ZHOU R, HARDER E, XU H, et al. Efficient multiple time step method for use with Ewald and particle mesh Ewald for large biomolecular systems[J]. The Journal of Chemical Physics, 2001,115(5): 2348-2358. DOI:10.1063/1.1385159.
[20] DOLZ M, HERNÁNDEZ M J, PELLICER J, et al. Shear stress synergism index and relative thixotropic area[J]. Journal of Pharmaceutical Sciences, 1995, 84(6): 728-732. DOI:10.1002/ jps.2600840613.
[21] 龙晓燕. 天然大分子魔芋葡甘聚糖的凝聚态基础研究[D]. 绵阳: 中国工程物理研究院, 2013: 100-111.
[22] LI B, XIE B, KENNEDY J F. RETRACTED: Studies on the molecular chain morphology of konjac glucomannan[J]. Carbohydrate Polymers,2006, 64(4): 510-515. DOI:10.1016/j.carbpol.2005.11.001.
[23] DAVÉ V, MCCARTHY S P. Review of konjac glucomannan[J]. Journal of Environmental Polymer Degradation, 1997, 5(4): 237-241. DOI:10.1007/BF02763667.
[24] JIN Y, ZHANG H, YIN Y, et al. Conformation of curdlan as observed by tapping mode atomic force microscopy[J]. Colloid and Polymer Science, 2006, 284(12): 1371-1377. DOI:10.1007/s00396-006-1503-x.
[25] BLUHM T L, DESLANDES Y, MARCHESSAULT R H, et al. Solid-state and solution conformation of scleroglucan[J]. Carbohydrate Research,1982, 100(1): 117-130. DOI:10.1016/S0008-6215(00)81030-7.
Interactions between Konjac Glucomannan and Curdlan
JIANG Mingfeng, XIAO Man*, NI Xuewen, YAN Wenli, KUANG Ying, SHEN Yue, JIANG Fatang
(College of Bioengineering and Food Science, Hubei University of Technology, Wuhan 430068, China)
Abstract:The interaction between konjac glucomannan (KGM) and curdlan was evaluated by molecular dynamic simulation. The viscosity and shear stress of KGM/curdlan sol were measured as a function of shear rate by a rotational rheometer at 25 ℃. The molecular morphology of KGM and curdlan in water solution were observed by transmission electron microscopy(TEM) and atomic force microscopy (AFM). The results of molecular dynamic simulation and rheological behavior showed that hydrogen bond interactions existed between KGM and curdlan. The collaborative stress index increased from 1.43 to 1.97,suggesting KGM/curdlan sol has synergistic viscosifi cation due to the interactions between KGM and curdlan. TEM and AFM results showed the formation of interpenetrating network structure between KGM and curdlan, which may be driven by hydrogen bonding interactions, and this interaction was further confi rmed by the microscopic level.
Key words:konjac glucomannan; curdlan; molecular simulation; molecular morphology; interaction
DOI:10.7506/spkx1002-6630-201619009
中图分类号:TS201.7
文献标志码:A
文章编号:1002-6630(2016)19-0054-05
引文格式:
蒋明峰, 肖满, 倪学文, 等. 魔芋葡甘聚糖与可得然胶的相互作用[J]. 食品科学, 2016, 37(19): 54-58. DOI:10.7506/ spkx1002-6630-201619009. http://www.spkx.net.cn
JIANG Mingfeng, XIAO Man, NI Xuewen, et al. Interactions between konjac glucomannan and curdlan[J]. Food Science,2016, 37(19): 54-58. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201619009. http://www.spkx.net.cn
收稿日期:2016-01-21
基金项目:国家自然科学基金青年科学基金项目(31301428);国家自然科学基金面上项目(31271832)
作者简介:蒋明峰(1990—),男,硕士,研究方向为食品天然多糖。E-mail:Jiang_MingFeng@163.com
*通信作者:肖满(1979—),男,讲师,博士,研究方向为天然多糖分子材料。E-mail:15325378@qq.com