安小琦,王月华,孟宪军*
(沈阳农业大学食品学院,辽宁 沈阳 110866)
摘 要:对蓝靛果中花色苷的组成进行鉴定,并对其抗氧化能力进行比较分析。实验以蓝靛果(‘蓓蕾’品种)为原料,采用有机溶剂60%乙醇(0.1%盐酸酸化)溶液,超声辅助提取90 min;利用D101大孔树脂对获得的粗提物进行纯化,之后冷冻干燥制得粉末物质。通过pH示差法和福林-酚法分别测定总花色苷含量和总多酚含量,分别为(353.35±0.79)、(474.01±2.12)mg/g;并用高效液相色谱-质谱联用法对花色苷组成进行鉴定,共发现11 种花色苷,其中矢车菊-3-葡萄糖苷为主要花色苷(90.679%)。此外,实验还通过总抗氧化能力测定和2,2’-联氨-二(3-乙基苯并噻唑-6-磺酸)二铵盐自由基、1,1-二苯基-2-三硝基苯肼自由基清除能力测定,比较分析蓝靛果花色苷提取物、矢车菊-3-葡萄糖苷、VC的抗氧化能力,结果表明,3 种物质的抗氧化能力排序为:矢车菊-3-葡萄糖苷>花色苷提取物>VC。
关键词:蓓蕾蓝靛果;花色苷;高效液相色谱-质谱联用;抗氧化能力
蓝靛果忍冬(Lonicera caerulea),又叫蓝靛果、羊奶子、黑瞎子果、山茄子果等,属茜草目,忍冬科,忍冬属,具有“第三代水果”之称 [1]。其果实不仅含有丰富的营养物质如维生素、矿物质、有机酸等,而且含有花青素、酚类物质、黄酮等功效成分 [2-3]。目前,国内外有关蓝靛果的研究主要选用野生蓝靛果为原料,对栽培品种的研究甚少。‘蓓蕾’蓝靛果是东北农业大学人工培育出的国内第一个非野生蓝靛果新品种,其果实比野生蓝靛果大,卵圆形,两端钝圆,果肉几乎是黑色,表皮有薄薄一层蜡质果霜,且味优 [4],尤其是花色苷含量较野生蓝靛果的更为丰富,适合作为天然色素原材料 [5]。
花色苷属于类黄酮物质中一类重要的化合物,主要存在于蓝、紫色果蔬植物中。相关研究表明,花色苷具有抗氧化、缓解炎症、改善视觉、抗心管疾病、抗糖尿病、减肥、改善肝功能及抗癌等功效 [6-11]。国内外有关水果中花色苷的研究报道较多,例如蓝莓、越橘等 [12-14]。但是关于‘蓓蕾’蓝靛果中花色苷组成鉴定及抗氧化能力的研究尚未报道。因此,对‘蓓蕾’蓝靛果中花色苷组成及其抗氧化能力进行分析具有重要意义。
本实验通过对‘蓓蕾’蓝靛果果实中的花色苷进行提取、纯化,并对其组成及抗氧化能力进行比较分析,为其品种的推广及功能性评价提供理论依据,并为天然色素及功能性食品原材料的寻找提供一定的参考。
1.1 材料与试剂
成熟、完好的‘蓓蕾’蓝靛果果实于2015年6月采自黑龙江省海林市,采收当天立即运回沈阳农业大学食品学院实验室,置于-20 ℃冰箱中冷冻保存,备用。
无水乙醇(分析纯)、盐酸(分析纯)、乙腈(色谱纯)、甲酸(色谱纯)、氯化钾、无水乙酸钠 沈阳化学试剂厂;总抗氧化能力(total antioxidant capacity,T-AOC)试剂盒、2,2’-联氨-二(3-乙基苯并噻唑-6-磺酸)二铵盐(2,2’-azinobis(3-ethylbenzothiazoline-6-sulphonate),ABTS)、K 2S 2O 8、1,1-二苯基-2-三硝基苯肼(1,1- diphenyl-2-picrylhydrazyl,DPPH)、矢车菊-3-葡萄糖苷标准品、福林-酚试剂 北京鼎国生物试剂有限公司。
1.2 仪器与设备
V5800型紫外-可见分光光度计 上海光析仪器有限公司;酸度计、电子天平 赛多利斯科学仪器(北京)有限公司;SB25-12DTN超声波清洗机 宁波新芝生物科技股份公司;JYL-C012九阳榨汁机 九阳股份有限责任公司;旋转蒸发仪 上海亚荣生化仪器厂;层析实验冷柜、BT-100B数显恒流泵 上海沪西分析仪器厂有限公司;LGO.2型真空冷冻干燥机 信阳速冻设备制造有限公司;高效液相色谱仪(配DAD检测器)、质谱仪美国Agilent公司;酶标仪 美国Bio-Tek公司。
1.3 方法
1.3.1 花色苷的提取
称取600 g蓝靛果果实常温条件下避光解冻,用打浆机打浆后放入6 个2 000 mL烧杯中(每个烧杯中放入100 g),再分别加入1 000 mL 含0.1%盐酸酸化的60%无水乙醇,玻璃棒搅拌后用保鲜膜封口,超声辅助提取90 min,提取温度为40 ℃。提取液经抽滤、旋转蒸发除去乙醇得到花色苷浓缩液,4 ℃条件下冷藏备用。
1.3.2 花色苷的纯化
根据前期花色苷纯化优化实验结果,花色苷纯化条件如下:称取一定量的D101型大孔树脂,活化后湿法装柱,在层析实验冷柜中用恒流泵将200 mL蒸馏水以4 mL/min的流速平衡过滤柱,平衡后以相同流速泵入花色苷浓缩液,泵入量为大孔树脂体积的3/4,然后静止吸附12 h。花色苷充分吸附后用400 mL蒸馏水以15 r/min的转速洗掉花色苷中的糖等水溶性杂质,之后用无水乙醇以8 r/min的转速对花色苷进行洗脱,收集洗脱液。得到的洗脱液经旋转蒸发除去乙醇后进行冷冻干燥,得到的花色苷粉末(纯度由未纯化前的4.76%提升到35.34%)分装于2 mL离心管中,密封,于-20 ℃条件下贮藏备用。
1.3.3 总花色苷及总多酚含量测定
采用pH示差法 [15-16]测定提取物粉末中总花色苷含量。称取提取物粉末0.01 g置于试管中,用10 mL蒸馏水溶解,将得到的溶液稀释10 倍后,进行光谱扫描,确定其最大吸收波长。各取稀释后样品1 mL,分别加入pH 1.0、4.5的缓冲溶液9 mL,常温平衡20 min后,于最大吸收波长λmax和700 nm波长处测定其吸光度A,以蒸馏水为空白,按式(1)计算总花色苷含量。
式中:ΔA=(A λmax-A 700 nm) pH 1.0-(A λmax-A 700 nm) pH 4.5;ε为矢车菊-3-葡萄糖苷的消光系数(26 900);n为稀释倍数;M为矢车菊-3-葡萄糖苷的相对分子质量(449.2);V为待测样品体积/mL;m为样品质量/g。
采用福林-酚法 [17-18]测定提取物粉末中总多酚含量。称取花色苷粉末0.01 g,10 mL蒸馏水溶解后稀释10 倍,准确量取1 mL稀释液于20 mL试管中,依次加入5.0 mL蒸馏水、1 mL福林-酚显色剂及3 mL 7.5%Na 2CO 3溶液,用涡轮振荡器振荡均匀,避光显色2 h,在765 nm波长处测其吸光度。以没食子酸为标准品绘制标准曲线,得到回归方程为:y=0.081 05+5.011 43x(R 2=0.999 6),没食子酸在0~0.1 mg/mL范围内具有良好的线性关系,根据标准曲线方程求出稀释液中总多酚质量浓度。总多酚含量按式(2)计算。
式中:X为样品中总多酚含量/(mg/g);ρ为标准曲线上查得的稀释液的总多酚质量浓度/(mg/mL);V为待测液体积/mL;N为稀释倍数;m为样品质量/mg。
1.3.4 花色苷组成鉴定
样品准备:准确称取10 μg样品,溶于2 mL色谱级甲醇中,经0.45 μm膜过滤,-4 ℃备用分析。
根据预实验结果,高效液相色谱测定条件:1100高效液相色谱仪,配DAD检测器;色谱柱:C 18色谱柱(250 mm×4.6 mm,5 μm);流动相A:乙腈;流动相B:0.1%甲酸水溶液;梯度洗脱程序:0~45 min,A:0~45%;45~50 min,A:0%。流速:0.7 mL/min;柱温:25 ℃;进样量20 μL;检测波长:520 nm。
质谱条件:正离子模式,全自动二级质谱扫描,扫描范围m/z 50~1 000;干燥气压力30 psi;流速12 L/min;温度350 ℃,毛细管电压3 500 V。
1.3.5 T-AOC测定
釆用T-AOC法测定‘蓓蕾’蓝靛果花色苷提取物、矢车菊-3-葡萄糖苷和VC的T-AOC,具体操作参照T-AOC试剂盒说明书进行。实验重复3 次,取平均值。T-AOC单位定义为在37℃时,每分钟每毫克待测样品,使反应体系的吸光度每增加0.01时,为一个T-AOC单位(U)。T-AOC按式(3)计算。
1.3.6 ABTS +·清除能力测定
参照Li Xican等 [19]的方法略作修改。将0.2 mL 7.4 mmol/L ABTS与0.2 mL 2.6 mmol/L K 2S 2O 8室温避光放置12 h,将混合液稀释40~50 倍至A 734 nm=0.70±0.02得到ABTS工作液。量取0.8 mL ABTS工作液于1.5 mL离心管中,加入0.2 mL 80%乙醇,振荡10 s以充分混匀,静置6 min后在734 nm波长处测定反应液吸光度A 0;再量取0.8 mL ABTS工作液于1.5 mL离心管中,加入0.2 mL样品溶液,振荡10 s以充分混匀,静置6 min后在波长734 nm波长处测定反应液吸光度A。ABTS +·清除率按式(4)计算。
1.3.7 DPPH自由基清除能力测定
参考吕春茂等 [2 0]的方法并略作修改。称取0.198 4 g DPPH用无水乙醇溶解,定容至50 mL,作为储备液。吸取2 mL DPPH储备液,用无水乙醇定容至100 mL,作为DPPH工作液待测。配制反应液:1)100 μL DPPH溶液+100 μL 70%乙醇;2)100 μL DPPH 溶液+100 μL样品溶液;3)100 μL 70%乙醇+100μL样品溶液。在常温条件下避光反应30 min 后,以70%乙醇作空白,分别在517 nm波长处测定3 种反应液的吸光度依次为A 0、A i、A j。DPPH自由基清除能力按式(5)计算。
1.4 数据统计分析
实验数据采用SPSS 16.0软件进行数据显著性及相关性分析,采用单因素方差分析的Tukey’s test用于显著性分析,且P<0.05,采用Origin 8.0 软件作图。
2.1 ‘蓓蕾’蓝靛果中总花色苷含量及总酚含量
本实验提取、纯化、冷冻干燥后得到花色苷粉末12 g,提取率为2%。采用pH示差法测定‘蓓蕾’蓝靛果花色苷提取物中总花色苷含量为(353.35±0.79) mg/g,换算成鲜果含量为(706.70±1.58)mg/100 g鲜果;用福林-酚法测定其总酚含量为(474.01±2.12)mg/g,换算成鲜果含量为(948.02±4.25)mg/100 g鲜果。经分析,总花色苷含量占总酚含量的74.54%,说明‘蓓蕾’蓝靛果主要的多酚类物质为花色苷类化合物。
2.2 ‘蓓蕾’蓝靛果中花色苷高效液相色谱-质谱(high performance liquid chromatography-mass spectrum/ mass spectrum,HPLC-MS/MS)联用法分析
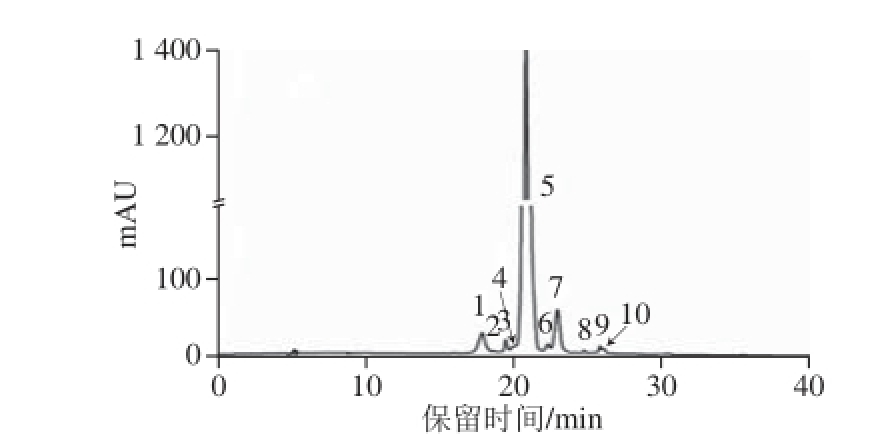
图1 ‘蓓蕾’蓝靛果提取物中花色苷HPLC图
Fig.1 HPLC of anthocyanins from ‘Beilei’ Lonicera caerulea berry extracts
表1 HPLC-MS/MS法鉴定‘蓓蕾’蓝靛果提取物中花色苷组成
Table1 Identification of anthocyanins in ‘Beiilleeii’ Lonicera caerulea berry extracts by HPLC-MS/MMSS

注:表中峰号与图1对应。
峰号保留时间/ min峰面积所占比例/%分子离子/(m/z)碎片离子/(m/z)花色苷名称117.699926.12.346611449、287矢车菊-3,5-二己糖苷 [21-22]218.47756.50.143737575、287矢车菊-3-己糖苷衍生物 [22]318.585296.60.751897735、573、287矢车菊-己糖苷聚合体 [22]419.346185.90.471625463、301芍药素-3,5-二己糖苷 [21-22]520.64435 792.790.679449287矢车菊-3-葡萄糖苷 [21-22]622.088252.40.639433271天竺葵素-3-葡萄糖苷 [21]722.7481 544.23.912463301芍药素-3-葡萄糖苷 [21-22]823.3646.50.016609463、301芍药素-3-芸香糖苷 [21]926.087101.50.257491287矢车菊-3-乙酰基己糖苷 [22]1026.37494.10.238897735、573矢车菊-3-己糖苷聚合体 [22]
通过HPLC-MS/MS对‘蓓蕾’蓝靛果中花色苷进行成分鉴定分析,得到色谱图(图1)及质谱图(图2)。结合各物质的色谱保留时间、分子离子峰和碎片离子峰,鉴定出‘蓓蕾’蓝靛果中有11 种花色苷(表1,其中第11 种花色苷tr A矢车菊-3-芸香糖苷只能在质谱条件下被检测到,未在表中显示)。
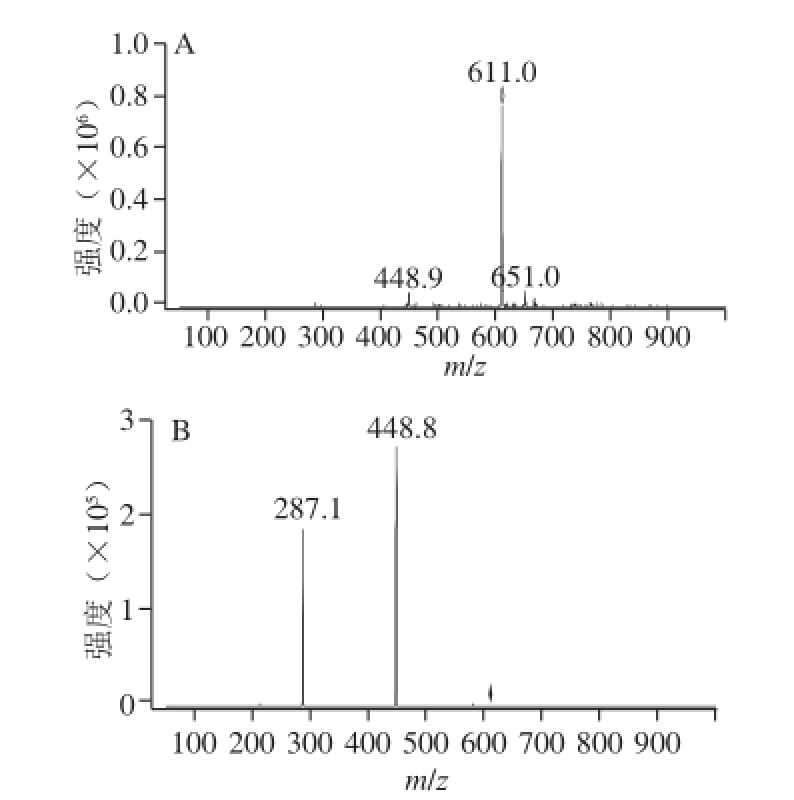
图2 矢车菊-3,5-二己糖苷的一级(A)、二级(B)质谱图(峰1物质)
Fig.2 MS (A) and MS/MS (B) spectra of cyanidin-3,5-dihexoside(corresponding to peak 1)

图3 矢车菊-3-乙酰基己糖苷的一级(A)、二级(B)质谱图(峰9物质)
Fig.3 MS (A) and MS/MS (B) spectra of cyanidin3-(6” acetylhexoside)(corresponding to peak 9)
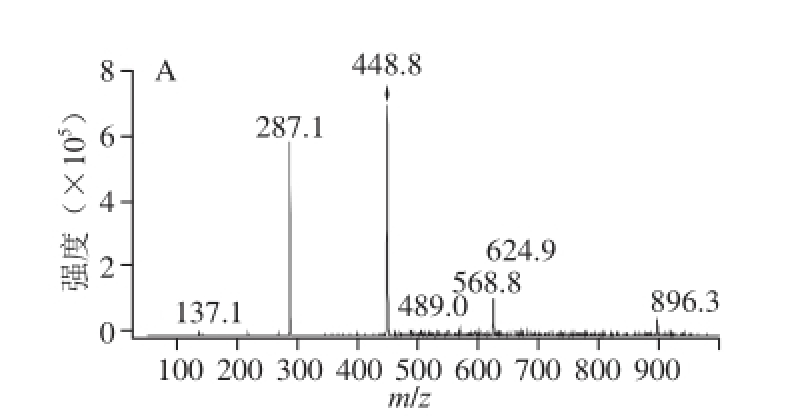

图4 矢车菊-3-芸香糖苷的一级(A)、二级(B)质谱图(tr
A物质)
Fig.4 MS (A) and MS/MS (B) spectra of cyanidin-3-rutinoside(corresponding to peak tr
A)
由参考文献:[23-24]可知,碎片离子m/z 287为矢车菊素的配离子峰,m/z 301为芍药素的配离子峰,m/z 271为天竺葵素的配离子峰。以峰1物质质谱图例进行详细分析,其他物质质谱图不一一列出。由图2可知,峰1物质分子离子m/z 611,其碎片离子m/z 499是由母离子失去一分子己糖[M-162] +得到,m/z 287与m/z 499之间也相差一分子己糖,表明峰1为含有2 个己糖的矢车菊花色苷,则峰1物质为矢车菊-3,5-二己糖苷 [25]。同理,峰4物质为芍药素-3,5-二己糖苷。表1中5、6、7号峰分子离子分别为m/z 449、m/z 433、m/z 463,均为失去一分子葡萄糖[M-162] +得到,结合其保留时间可知,峰5~7物质分别为矢车菊-3-葡萄糖苷、天竺葵素-3-葡萄糖苷和芍药素-3-葡萄糖苷。峰2物质分子离子m/z 737,其碎片离子m/z 575,是由母离子失去一分子己糖[M-162] +得到,m/z 287与m/z 575之间相差质量数为308,但残基物质不能确定,所以峰2物质为矢车菊-3-己糖苷衍生物,这与Veberic等 [21]研究结果一致。峰8物质分子离子m/z 609,其碎片离子为m/z 463和m/z 301,是由母离子连续失去一分子脱水甲基戊糖(m/z 146)和一分子己糖(m/z 162)而得,所以峰8物质为芍药素-3-芸香糖苷 [22,26]。峰9物质分子离子m/z 491,其碎片离子m/z 287是由母离子失去一分子乙酰化己糖(m/z 204)得到 [27],所以峰9物质为矢车菊-3-乙酰基己糖苷,该物质被首次在蓝靛果花色苷提取物中发现,其二级质谱图见图3。峰3和峰10物质分子离子相同均为m/z 897,其碎片离子分别为m/z 735、m/z 573、m/z 287、m/z 735和m/z 573,根据其保留时间及文献[23-24]分析可知峰3物质为矢车菊-己糖苷聚合体,峰10物质为矢车菊-3-己糖苷聚合体。此外,tr A矢车菊-3-芸香糖苷在质谱条件下被检测到(图4),但是该物质在液相色谱中没有出峰,这与Lohachoompol等 [28]的研究结果相一致,出现该现象的原因可能是矢车菊-3-芸香糖苷含量很少,在较为灵敏的质谱检测系统中可以检测到。所有花色苷单体中矢车菊-3-葡萄糖苷含量最高,占峰面积的90.679%,与Chen Liang等 [29]对野生蓝靛果中花色苷成分分析的研究结果相似。
2.3 ‘蓓蕾’蓝靛果花色苷提取物抗氧化能力比较分析
2.3.1 T-AOC比较分析
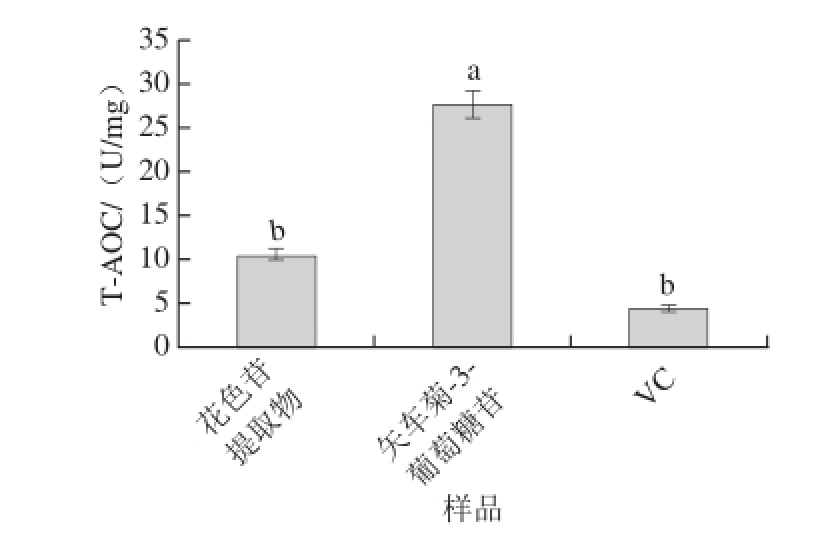
图5 ‘蓓蕾’蓝靛果花色苷提取物、矢车菊-3-葡萄糖苷和VC的T-AOC比较
Fig.5 T-AOC of ‘Beilei’ L. caerulea berry anthocyanin extracts,cyanidin-3-glucoside and VC
小写字母不同表示差异显著(P<0.05)。下同。
用T-AOC法分别测定‘蓓蕾’蓝靛果花色苷提取物、矢车菊-3-葡萄糖和VC的T-AOC,每种物质做3 组平行实验,数据取3 个平行组的平均值,结果见图5。结果表明,矢车菊-3-葡萄糖苷的T-AOC值最高为27.6 U/mg,其次为‘蓓蕾’蓝靛果花色苷提取物(10.47 U/mg)。并且Tukey’s test分析表明,矢车菊-3-葡萄糖苷的T-AOC显著高于‘蓓蕾’蓝靛果花色苷提取物和VC(4.395 U/mg)(P<0.05)。‘蓓蕾’蓝靛果花色苷提取物的T-AOC比VC高6.07 U/mg,但二者无显著性差异(P>0.05)。‘蓓蕾’蓝靛果花色苷提取物的T-AOC低于矢车菊-3-葡萄糖苷,可能是因为提取物中矢车菊-3-葡萄糖苷含量相对较低。此外,相关性分析表明,‘蓓蕾’蓝靛果花色苷提取物的T-AOC与总花色苷和总酚含量呈显著正相关(P<0.05,R 2=0.881;P<0.05,R 2=0.902)。
2.3.2 ABTS +·清除能力比较分析
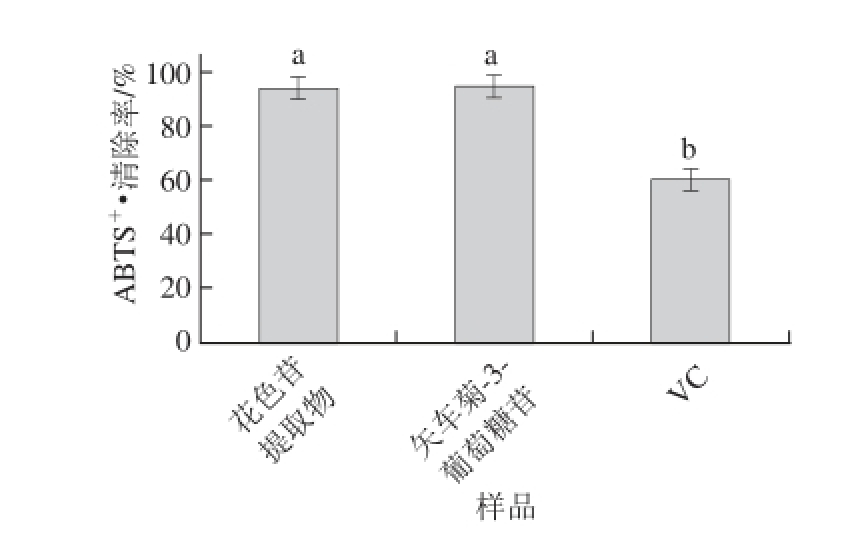
图6 ‘蓓蕾’蓝靛果花色苷提取物、矢车菊-3-葡萄糖苷和VC的ABTS
+·清除能力比较
Fig.6 ABTS
+・ scavenging activity of ‘Beilei’ L. caerulea berry anthocyanin extracts, cyanidin-3-glucoside and VC
ABTS +·清除能力测定是评估化合物抗氧化能力的重要指标。实验分别测定相同质量浓度(50 μg/mL)‘蓓蕾’蓝靛果花色苷提取物、矢车菊-3-葡萄糖和VC的ABTS +·清除率,每种物质做3 组平行实验,数据取3 个平行组的平均值,结果见图6。结果表明,矢车菊-3-葡萄糖苷和‘蓓蕾’蓝靛果花色苷提取物的ABTS +·清除率分别为94.34%、93.68%,且二者并无显著差异(P>0.05)。矢车菊-3-葡萄糖苷和‘蓓蕾’蓝靛果花色苷提取物的ABTS +·清除率均显著高于VC(60.00%)(P<0.05)。相关性分析表明,‘蓓蕾’蓝靛果花色苷提取的ABTS +·清除能力与总花色苷和总酚含量呈显著正相关(P<0.05,R 2=0.804;P<0.05,R 2=0.882)。
2.3.3 DPPH自由基清除能力比较分析
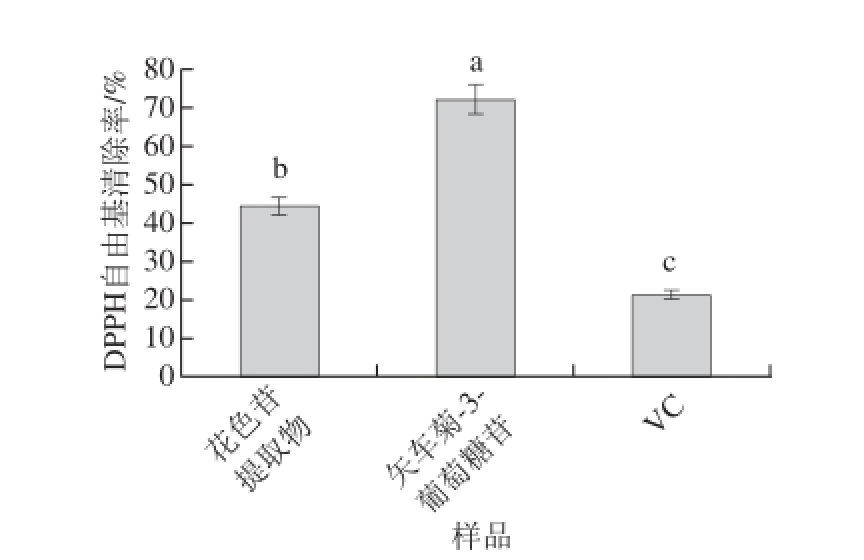
图7 ‘蓓蕾’蓝靛果花色苷提取物、矢车菊-3-葡萄糖苷和VC的DPPH自由基清除率比较
Fig.7 DPPH radical scavenging activity of ‘Beilei’ L. caerulea berry anthocyanin extracts, cyanidin-3-glucoside and VC
分别测定相同质量浓度(50 μg/mL)‘蓓蕾’蓝靛果花色苷提取物、矢车菊-3-葡萄糖和VC的DPPH自由基清除率,每种物质做3 组平行实验,数据取3 个平行组的平均值,结果见图7。结果表明,3 种不同物质的DPPH自由基清除能力具有显著差异(P<0.05)。矢车菊-3-葡萄糖苷的DPPH自由基清除率最高,为72.13%,其次为花色苷提取物和VC,分别为44.45%和21.33%。此外,显著性分析表明,矢车菊-3-葡萄糖苷的DPPH自由基清除率显著高于‘蓓蕾’蓝靛果花色苷提取物和VC(P<0.05);同时,‘蓓蕾’蓝靛果花色苷提取物的DPPH自由基清除率显著高于VC(P<0.05)。此外,相关性分析表明,‘蓓蕾’蓝靛果花色苷提取的DPPH自由基清除能力与总花色苷和总酚含量呈显著正相关(P<0.05,R 2=0.831;P<0.05,R 2=0.892)。
本实验对蓝靛果栽培品种——‘蓓蕾’中花色苷进行提取分离并纯化,测定其花色苷提取物中总花色苷和总多酚含量分别为(353.35±0.79)、(474.01±2.12) mg/g。通过HPLC-MS/MS鉴定出11 种花色苷,分别为矢车菊-3,5-二己糖苷、矢车菊-3-己糖苷衍生物、矢车菊-己糖苷聚合体、芍药素-3,5-二己糖苷、矢车菊-3-葡萄糖苷、矢车菊-3-芸香糖苷、天竺葵素-3-葡萄糖苷、芍药素-3-葡萄糖苷、芍药素-3-芸香糖苷、矢车菊-3-乙酰基己糖苷、矢车菊-3-己糖苷聚合体。其中矢车菊-3-葡萄糖苷含量最高,占峰面积的90.679%。另外,T-AOC、ABTS +·和DPPH自由基清除能力测定结果均表明,矢车菊-3-葡萄糖苷的T-AOC及ABTS +·和DPPH自由基清除能力均强于花色苷提取物和VC。综上可知,‘蓓蕾’蓝靛果中花色苷含量和种类丰富,且其中含量最高的矢车菊-3-葡萄糖苷有很强的抗氧化能力,其T-AOC为VC的6.28 倍,ABTS +·和DPPH自由基清除能力分别为VC的1.57和3.37 倍。
参考文献:
[1] 王振宇, 田福. 蓝靛果红色素稳定性的研究[J]. 中国食品添加剂,2007, 18(3): 102-105. DOI:10.3969/j.issn.1006-2513.2007.03.020.
[2] 包怡红, 李文星, 齐君君, 等. 提取条件对蓝靛果花色苷抗氧化活性的影响[J]. 食品科学, 2010, 31(22): 20-25.
[3] PALÍKOVÁ I, HEINRICH J, BEDNÁŘ P, et al. Constituents and antimicrobial properties of blue honeysuckle: a novel source for phenolic antioxidants[J]. Journal of Agricultural and Food Chemistry,2008, 56(24): 11883-11889. DOI:10.1021/jf8026233. 2008. 11.24.
[4] 刘桂萍, 汪宗仁, 马炳清, 等. 勃利县栽培种植蓝靛果新品种-蓓蕾栽培技术[J]. 中国林副特产, 2015(3): 64-65. DOI:10.13268/j.cnki. fbsic.2015.03.031.
[5] 李英福, 汪宗仁. 浅谈蓝靛果新品种——“蓓蕾”新技术[J]. 农村实用科技信息, 2015(8): 3. DOI:10.3969/j.issn.1674-0653.2015.08.001.
[6] BAŞKAN K S¸ TÜTEM E, AKYÜZ E, et al. Assessment of the contributions of anthocyanins to the total antioxidant capacities of plant foods[J]. European Food Research and Technology, 2015, 241: 529-541. DOI:10.1007/s00217-015-2482-2.
[7] PHILPOTT M, LIM C C, FERGUSON L R. Dietary protection against free radicals: a case for multiple testing to establish structure-activity relationships for antioxidant potential of anthocyanic plantspecies[J]. International Journal of Molecular Sciences, 2009(10): 1081-1103. DOI:10.3390/ijms10031081.
[8] 徐贞贞, 廖小军. 花色苷生理功能研究进展[J]. 中国食物与营养,2014, 20(10): 65-68. DOI:10.3969/j.issn.1006-9577.2014.10.017.
[9] 郑韵, 董全. 花色苷在体内的药理活性及其作用机制研究进展[J]. 食品工业科技, 2014, 35(10): 396-400. DOI:10.13386/ j.issn1002-0306.2014.10.079.
[10] YI Weiguang, FISCHER J, KREWER G, et al. Phenolic compounds from blueberrise can inhibit colon cancer cell proliferation and induce apoptosis[J]. Journal of Agricultural and Food Chemistry, 2005, 53: 7320-7329. DOI:10.1016/j.semcancer.2007.05.001.
[11] JUNG H, LEE H J, CHO H, et al. Anthocyanins in Rubus fruits and antioxidant and anti-inflammatory activities in RAW 264.7 cells[J]. Food Science and Biotechnology, 2015, 24(5): 1879-1886. DOI:10.1007/s10068-015-0246-1.
[12] 胡济美, 籍保平, 周峰, 等. 大兴安岭笃斯越橘花色苷成分鉴定研究[J]. 食品科学, 2009, 30(10): 239-241. DOI:10.3321/ j.issn:1002-6630.2009.10.056.
[13] JO Y N, JIN D E, JEONG J H, et al. Berry extracts effect of anthocyanins from rabbit-eye blueberry (Vaccinium virgatum) on cognitive function in miceunder trimethyltin-induced neurotoxicity[J]. Food Science and Biotechnology, 2015, 24(3): 1077-1085. DOI:10.1007/s10068-015-0138-4.
[14] KRAUJALYTĖ V, VENSKUTONIS P R, PUKALSKAS A, et al. Antioxidant properties, phenolic composition and potentiometric sensor array evaluation of commercial and new blueberry(Vaccinium corymbosum) and bog blueberry (Vaccinium uliginosum)genotypes[J]. Food Chemistry, 2015, 118: 583-590. DOI:10.1016/ j.foodchem.2015.05.031.
[15] 宋德群, 孟宪军, 王晨阳, 等. 蓝莓花色苷的pH示差法测定[J].沈阳农业大学学报, 2013, 43(2): 231-233. DOI:10.3969/ j.issn.1000-1700.2013.02.019.
[16] 杨兆艳. pH示差法测定桑椹红色素中花青素含量的研究[J]. 食品科技, 2007, 32(4): 201-202. DOI:10.3969/j.issn.1005-9989.2007.04.060.
[17] 李斌, 雷月, 孟宪军, 等. 响应面法优化超声波辅助提取蓝靛果多酚工艺及其抗氧化活性研究[J]. 食品科学, 2015, 36(22): 33-39. DOI:10.7506/spkx1002-6630-201522006.
[18] 卜彦花, 周娜娜, 王春悦, 等. 福林酚试剂法和紫外分光光度法测定冬枣多酚含量的比较研究[J]. 中国农学通报, 2012, 28(1): 212-217. DOI:10.3969/j.issn.1000-6850.2012.01.041.
[19] LI Xican, LIN Jing, GAO Yaoxiang, et al. Antioxidant activity and mechanism of Rhizoma Cimicfugae[J]. Chemistry Central Journal,2012, 6: 140. DOI:10.1186/1752-153X-6-140.
[20] 吕春茂, 王新现, 包静, 等. 越橘果实花色苷的体外抗氧化性[J]. 食品科学, 2010, 31(23): 27-31.
[21] VEBERIC R, SLATNAR A, BIZJAK J, et al. Anthocyanin composition of different wild and cultivated berryspecies[J]. LWTFood Science and Technology, 2015, 60(1): 509-517. DOI:10.1016/ j.lwt.2014.08.033.
[22] MYJAVCOVÁ R, MARHOL P, KŘEN V, et al. Analysis of anthocyanin pigments in Lonicera (Caerulea) extracts using chromatographic fractionation followed by microcolumn liquid chromatography-mass spectrometry[J]. Journal of Chromatography A,2010, 1217(51): 7932-7941. DOI:10.1016/j.chroma.2010.05.058.
[23] 罗赟, 陈宗玲, 宋卫堂, 等. 草莓果实花色苷成分组成鉴定及分析[J]. 中国农业大学学报, 2014, 19(5): 86-94. DOI:10.11841/ j.issn.1007-4333.2014.05.12.
[24] 赵善仓, 刘宾, 赵领军, 等. 蓝、紫粒小麦籽粒花色苷组成分析[J]. 中国农业科学, 2010, 43(19): 4072-4080. DOI:10.3864/ j.issn.0578-1752.2010.19.020.
[25] 刘德江, 杜汉军, 申健. 蓝靛果花色苷研究进展[J]. 内蒙古农业科技,2012(4): 44-45. DOI:10.3969/j.issn.1007-0907.2012.04.020.
[26] 谭亮, 董琦, 曹静亚, 等. 黑果枸杞中花色苷的提取与结构鉴定[J].天然产物研究与开发, 2014(11): 1797-1803.
[27] 舒希凯, 赵恒强, 王岱杰, 等. 高效液相色谱-电喷雾串联质谱法鉴定芍药花色苷[J]. 食品与药品, 2013, 15(1): 38-41. DOI:10.3969/ j.issn.1672-979X.2013.01.013.
[28] LOHACHOOMPOL V, MULHOLLAND M, SRZEDNICKI G, et al. Determination of anthocyanins in various cultivars of highbush and rabbiteye blueberries[J]. Food Chemistry, 2008, 111: 249-254. DOI:10.1016/j.foodchem.2008.03.067.
[29] CHEN Liang, XIN Xiulan, LAN Rong, et al. Isolation of cyanidin 3-glucoside from blue honeysuckle fruits by high-speed countercurrent chromatography[J]. Food Chemistry, 2014, 152: 386-390. DOI:10.1016/j.foodchem.2013.11.080.
Identification and Comparative Analysis of Antioxidant Ability of Anthocyanins in Lonicera caerulea Berry Extracts
AN Xiaoqi, WANG Yuehua, MENG Xianjun*
(College of Food Science, Shenyang Agricultural University, Shenyang 110866, China)
Abstract:The identification of anthocyanins composition and antioxidant activity of Lonicera caerulea berry extracts was investigated in this study. ‘Beilei’ L. caerulea berries were ultrasonically extracted with 60% ethanol containing 0.1% HCl for 90 min. D101 macroporous resin was used to purify the obtained extracts. After that, freeze drying was conducted to obtain powder. The contents of total anthocyanins and polyphenols were determined using pH differential and Folinreagent method as (353.35 ± 0.79) mg/g and (474.01 ± 2.12) mg/g, respectively. High performance liquid chromatographytandem mass spectrometry (HPLC-MS/MS) was used for the identification of anthocyanin composition. A total of 11 individual anthocyanins were found with cyanidin-3-glucoside (90.679%) being the major anthocyanin. Additionally, total antioxidant capacity (T-AOC) and 2,2’-azinobis(3-ethylbenzothiazoline-6-sulphonate) radical (ABTS +·), 1,1- diphenyl-2-picrylhydrazyl (DPPH) radical scavenging activities of L. caerulea berry extracts, cyanidin-3-glucoside and VC were comparatively analyzed, and the results revealed a decreasing order of cyanidin-3-glucoside > L. caerulea berry extract > VC.
Key words:Lonicera caerulea berry; anthocyanins; high performance liquid chromatography-tandem mass spectrometry(HPLC-MS/MS); antioxidant activity
DOI:10.7506/spkx1002-6630-201619014
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2016)19-0082-06
引文格式:
安小琦, 王月华, 孟宪军. ‘蓓蕾’蓝靛果中花色苷组成鉴定及抗氧化能力比较分析[J]. 食品科学, 2016, 37(19): 82-87. DOI:10.7506/spkx1002-6630-201619014. http://www.spkx.net.cn
AN Xiaoqi, WANG Yuehua, MENG Xianjun. Identification and comparative analysis of antioxidant ability of anthocyanins in Lonicera caerulea berry extracts[J]. Food Science, 2016, 37(19): 82-87. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201619014. http://www.spkx.net.cn
收稿日期:2016-03-02
基金项目:公益性行业(农业)科研专项(201303073-04);辽宁省科技攻关项目(2011205001);辽宁省农业科技(北方果蔬贮藏与加工)创新团队项目(2014020066-201)
作者简介:安小琦(1992—),男,硕士研究生,研究方向为农产品加工与贮藏工程。E-mail:934311974@qq.com
*通信作者:孟宪军(1960—),男,教授,博士,研究方向为小浆果深加工。E-mail:mengxjsy@126.com