邵 颖 1,2,王小红 2,吴文锦 1,李 新 1,熊光权 1,王海滨 2,乔 宇 1,王 俊 1,廖 李 1,汪 兰 1,*
(1.湖北省农业科学院农产品加工与核农技术研究所/湖北省农业科技创新中心农产品加工研究分中心,湖北 武汉 430064;2.华中农业大学食品科学技术学院,湖北 武汉 430070)
摘 要:为研究不同品种名优淡水鱼冷藏保鲜及热加工的特性,采用差示扫描量热法研究武昌鱼、草鱼、黄颡鱼、鲈鱼和鳜鱼5 种新鲜淡水鱼鱼肉的水分含量、冰点、变性温度、变性热焓和比热容并进行品种间的比较。结果发现:5 种淡水鱼冰点分布在-0.57~-0.1 ℃之间;50 ℃附近热吸收峰起始温度分布在37~41.57 ℃之间,终止温度分布在60.47~62.33 ℃之间;变性热焓在1.680 0~2.499 7 J/g之间;70 ℃附近热吸收峰的起始温度分布在66.33~71.13 ℃之间,终止温度分布在73.60~82.20 ℃之间,变性热焓在0.418 0~0.512 2 J/g之间;鱼肉的比热容在1.658 0~3.862 3 J/(g·K)之间。结果表明:在5 种新鲜淡水鱼中,武昌鱼水分含量和冰点相对较低;草鱼肌球蛋白和鳜鱼肌动蛋白变性温度和变性热焓相对较高,蛋白质稳定性更高;新鲜鱼肉的比热容高于冻结鱼肉,加工后鱼肉的比热容高于未加工鱼肉。
关键词:差示扫描量热法;冰点;变性温度;变性热焓;比热容
名优淡水鱼系指经济价值相对更高的一类淡水鱼品种,包括武昌鱼、鲈鱼、黄颡鱼和鳜鱼等。据中国统计年鉴显示,2013年我国淡水鱼类达到 2647.9万 t [1]。随着我国渔业经济继续保持良好的发展态势,淡水鱼产量不断提高。水产品加工过程中,热特性是最普遍的加工参数,无论是水产品的杀菌、烹调、干燥,还是冷冻保藏都会涉及到热特性 [2-3]。热过程与组织的冰点、热焓、比热容等特性参数有关,因而首先需对热特性进行分析 [4]。蛋白质为肌肉组织的主要组成部分,鱼肉肌肉蛋白质主要包括肌浆蛋白、肌原纤维蛋白和肌基质蛋白,其中肌原纤维蛋白作为主要成分,占58.5%,在冷冻保藏过程中很容易发生冷冻变性 [5],肌球蛋白约占肌原纤维蛋白的50%~55%,在加热或者高压条件下发生变性聚集形成凝胶,从而影响肉制品的质构、外观和出品率,故而通常作为鱼类加工中的重要研究对象 [6],肌动蛋白次之。鱼类肌肉蛋白质的稳定性,关系到鱼肉的加工适性和贮藏稳定性,不同鱼种肌肉蛋白质的稳定性也有较大的差异。鲁长新 [7]以鲢鱼、鲤鱼、草鱼和鮰鱼4 种淡水鱼的冰点、表观比热和热焓等指标研究了低温相变区热特性及蛋白质稳定性。张静雅 [8]研究发现冻藏温度越高,鱼糜肌球蛋白的变性温度和热焓值越低,比其他较低温度组降低幅度更大,而肌动蛋白的变性温度和热焓值变化不明显。刘大松等 [9]研究发现草鱼在4 ℃冷藏过程中随着贮藏时间的延长,肌球蛋白的变性峰越来越尖锐,肌浆蛋白的变性峰逐渐消失,而肌动蛋白的变性峰无显著变化。潘锦锋等 [10]研究发现草鱼肌球蛋白的变性是导致加热过程中各物理化学特性迅速下降的主要原因。
目前研究较多的鱼种是鲢鱼、鲤鱼和草鱼等淡水鱼类,且主要研究不同冷藏时间、冷藏温度对鱼肉肌肉物理化学特性和热特性的影响。但是对名优淡水鱼肌肉的热特性鲜有研究,而鱼肉组织特性和感官品质的变化主要源于鱼肉肌肉蛋白在加热过程中的变化,因此,研究蛋白质加热过程中的热特性可以为名优淡水鱼加工设计合理的工艺提供理论依据。本研究以不同品种的名优淡水鱼为研究对象,采用差示扫描量热法(differential scanning calorimetry,DSC)测定武昌鱼、草鱼、黄颡鱼、鲈鱼和鳜鱼5 种新鲜淡水鱼的热特性,包括水分含量、冰点、变性温度、变性热焓及比热容,为不同品种名优淡水鱼热加工和低温贮藏的品质控制奠定基础。
1.1 材料
新鲜武昌鱼(4 5 0~5 0 0 g)、草鱼(1 450~15 00 g)、黄颡鱼(140~160 g)、鲈鱼(550~650 g)和鳜鱼(250~300 g) 湖北省武汉市武商量贩农科城店。
1.2 仪器与设备
ME303E/02型电子天平 梅特勒-托利多仪器(上海)有限公司;DIN51007型差示扫描量热仪、标准铝坩埚耐驰仪器(上海)有限公司。
1.3 方法
1.3.1 原料处理
由于受生长环境、营养条件、鱼体大小等因素的影响,鱼体不同部位肌肉所测得的结果会存在差异。就同种鱼类而言,鱼体背部肌肉的营养成分相对较稳定,为了便于取样和比较,本研究中的采样统一取背部肌肉即自鱼体两侧鳃盖骨后至尾鳍前的背部肌肉作为样品进行测定 [11]。将鱼宰杀去掉鱼头、鱼皮和内脏,用水将其冲洗干净,手工取侧线上方、背鳍附近的白肉,将其切成鱼块(2 mm×2 mm×2 mm),放于自封袋(120 mm×170 mm)中,置于4 ℃冰箱中冷藏,24 h内使用。
1.3.2 DSC测定条件
参照鲁长新 [7]的方法,略作修改:选择质量相近的铝坩埚压封后用作参比坩埚。实验分别进行空白测试、标样(蓝宝石)测试和样品测试。设置温度程序:初温为0 ℃,以3 ℃/min降温至-50 ℃,恒温10 min,再以3 ℃/min升温至90 ℃,恒温10 min。准确称量19.0~25.0 mg新鲜鱼肉作为样品,压封于标准铝坩埚中。冷却方式为机械制冷,样品吹扫气和保护气(氮气,纯度>99%),流速分别为20 mL/min和60 mL/min。为确保实验数据的准确性,每次实验都采用相同的温度程序扫描空白坩埚、标样坩埚和样品坩埚,每个样品按上述方法重复5 次。
1.3.3 鱼肉冰点确定
采用DSC测定冰点,在升温曲线上,冰点理论上为结晶刚刚熔解完成的温度,但由于样品完全熔化后,流曲线回归基线是个渐变过程,且受升温速率和样品质量影响,出现不同程度的滞后现象,因此把水的相变峰温确定为鱼肉的冰点 [12]。
1.3.4 鱼肉水分含量计算
水分含量是通过DSC测定鱼肉样品中的可冻结水的冷冻(熔融)焓,按文献[13]中的方法并修改,按式(1)进行计算。
式中:ω为水分含量/%(湿基);α为样品不可冻结含水率/%(湿基);T f为样品冻结(熔融)温度/℃;ΔH Tf为样品在T f下的冻结(熔融)焓/(J/g);H为(未)冻结纯水在T f下的熔融(冻结)焓,即333.802 J/g。
由于鱼肉的不可冻结含水率α很小,可忽略不计,则式(1)可简化为式(2)进行计算。
1.3.5 鱼肉比热容计算
采用DSC测定比热容,按式(3)进行计算。
式中:C app为样品的比热容/(J/(g·K));m std为标样的质量/mg;m s为样品的质量/mg;DSC s为样品的热流信号/mW;DSC b为空白的热流信号/mW;DSC std为标样的热流信号/mW;C p,std为标样的比热容/(J/(g·K))。
1.3.6 鱼肉热焓计算
热焓和比热容的关系用式(3)表示,本实验参考温度为-40 ℃,即认为-40 ℃的热焓H=0 [14]。热焓按式(4)进行计算。
式中:H为热焓/(J/g);T为温度/℃;C app(T)为温度T时的比热容/(J/(g·K))。
ΔH表示系统经历一个热过程后的热焓H的变化,即焓变,通过DSC测定并进行热分析后得到。本实验中ΔH Tf指样品(中水)在T f条件下发生相变(冻结或熔融)时的焓变,本实验称作相变热焓;ΔH指鱼肉中蛋白质(肌球蛋白及肌动蛋白)发生热变性时的焓变,本实验称作变性热焓。
1.4 数据分析
在进行鱼肉的热特性测定时,其热流信号都从DSC曲线上读出。数据分析采用热分析软件Proteus Thermal Analysis 6.1.0、数学软件SAS 8.0和Microsoft Excel,热特性数据结果采用形式表示。
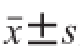
2.1 鱼肉水分含量及冰点
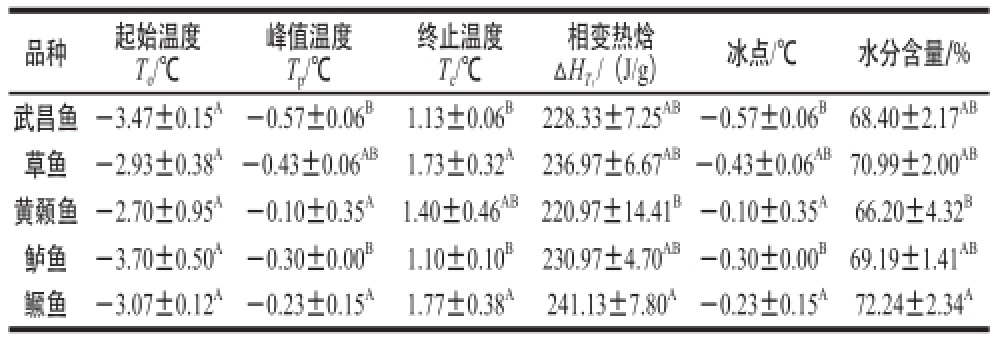
表1 0 ℃附近不同品种鱼肉的热特性
Table1 Thermal characteristics of different varieties of fish at around 0 ℃
注:同列肩标大写字母不同表示差异显著(P<0.05)。下同。
品种起始温度To/℃峰值温度Tp/℃终止温度Tc/℃相变热焓ΔH Tf/(J/g)冰点/℃水分含量/%武昌鱼-3.47±0.15 A-0.57±0.06 B1.13±0.06 B228.33±7.25 AB-0.57±0.06 B68.40±2.17 AB草鱼-2.93±0.38 A-0.43±0.06 AB1.73±0.32 A236.97±6.67 AB-0.43±0.06 AB70.99±2.00 AB黄颡鱼-2.70±0.95 A-0.10±0.35 A1.40±0.46 AB220.97±14.41 B-0.10±0.35 A66.20±4.32 B鲈鱼-3.70±0.50 A-0.30±0.00 B1.10±0.10 B230.97±4.70 AB-0.30±0.00 B69.19±1.41 AB鳜鱼-3.07±0.12 A-0.23±0.15 A1.77±0.38 A241.13±7.80 A-0.23±0.15 A72.24±2.34 A
冰点是指在升温过程中,冰晶开始融化的温度,在该温度点水和冰以平衡态共存 [15-16],冰点温度在冰温贮藏方面起着重要作用。由表1可知,武昌鱼、草鱼、黄颡鱼、鲈鱼和鳜鱼5 种新鲜淡水鱼的水分含量分别为68.40%、70.99%、66.20%、69.19%和72.24%,冰点分别为-0.57、-0.43、-0.10、-0.30 ℃和-0.23 ℃。其中,水分含量特指鱼肉中自由水含量,表中未列出结合水特征峰(-40 ℃)的热特性参数,主要因为DSC分析发现该峰几乎不存在,可能是由于鱼肉肌肉中结合水含量很低,DSC检测限未能检出。鳜鱼的水分含量最高,黄颡鱼的水分含量最低;黄颡鱼的冰点温度最高,武昌鱼的冰点温度最低。鱼肉肌肉中的水分一般以两种形式存在,一部分为溶解组织中水溶性成分的自由水,并以游离状态存在于肌原纤维和结缔组织的网状结构中,起一般溶剂的作用,在冰点以下温度就可冻结;另一部分为不可冻结水,它与组织中的蛋白质、碳水化合物等分子的亲水基团结合在一起,含量为11%~16%,它不起溶剂的作用,在0 ℃以下,直至-40 ℃也不结冰 [7]。杨芳 [17]的研究指出,蛋白质的冷冻变性与冰晶形成有关,主要表现:1)结合水发生脱离,使得水同蛋白质的支链和支链之间的相互关系发生不可逆的变化;2)蛋白质疏水键的弱化使分子高级结构发生变化;3)细胞液浓缩,pH值和离子浓度发生变化,从而引起蛋白质变性;4)冰晶逐渐增大,刺破细胞,细胞液外流,蛋白质进一步变性。鲁长新 [7]的研究表明,冰点温度越低,对应的相变热焓越低,这有利于鱼肉通过-1~-5 ℃的最大冰晶形成温区,从而实现急速冷却,在一定程度上减少蛋白质的变性。由此,本实验发现5 种新鲜淡水鱼中,武昌鱼相对而言最便于急速冷却,在冷冻保鲜过程中肌肉蛋白质变性的可能性最小,更加稳定。
2.2 鱼肉肌肉蛋白变性温度及变性热焓
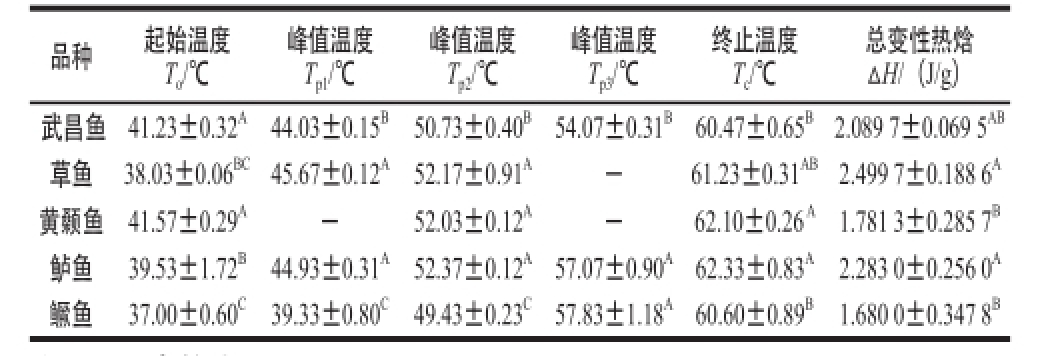
由表2、3可知,武昌鱼、草鱼、黄颡鱼、鲈鱼和鳜鱼5 种新鲜淡水鱼鱼肉肌肉蛋白的吸收峰值(变性温度)和变性热焓差异显著(P<0.05)。其中,在温度上升至50 ℃附近时,武昌鱼、鲈鱼及鳜鱼肌肉蛋白皆存在3 个未完全分离的吸收峰(表2),其中,武昌鱼吸收峰值(变性温度)分别为44.03、50.73、54.07 ℃,总变性热焓为2.089 7 J/g;鲈鱼吸收峰值(变性温度)分别为44.93、52.37、57.07 ℃,总变性热焓为2.283 0 J/g;鳜鱼吸收峰值(变性温度)分别为39.33、49.43、57.83 ℃,总变性热焓为1.680 0 J/g。草鱼肌肉蛋白存在2 个未完全分离的吸收峰,吸收峰值(变性温度)分别为45.67 ℃和52.17 ℃,总变性热焓为2.499 7 J/g;黄颡鱼肌肉蛋白存在1 个吸收峰,吸收峰值(变性温度)为52.03 ℃,总变性热焓为1.781 3 J/g。表3显示在温度上升至70 ℃附近时,武昌鱼、草鱼、黄颡鱼及鲈鱼肌肉蛋白皆存在1 个吸收峰,其中,武昌鱼肌肉蛋白的吸收峰值(变性温度)为71.50 ℃,总变性热焓为0.471 2 J/g;草鱼肌肉蛋白的吸收峰值(变性温度)为72.33 ℃,总变性热焓为0.454 6 J/g;黄颡鱼肌肉蛋白的吸收峰峰值(变性温度)为74.57 ℃,总变性热焓为0.418 0 J/g;鲈鱼肌球蛋白的吸收峰峰值(变性温度)为70.60 ℃,变性热焓为0.469 7 J/g。鳜鱼肌肉蛋白存在2 个未完全分离的吸收峰,吸收峰值(变性温度)分别为69.43 ℃和75.77 ℃,总变性热焓为0.512 2 J/g。
表2 50 ℃附近不同品种鱼肉肌肉蛋白的热特性
Table2 Thermal characteristics of muscles from different varieties of fish at around 50 ℃
注:-. 未检出。下同。
总变性热焓ΔH/(J/g)武昌鱼41.23±0.32 A44.03±0.15 B50.73±0.40 B54.07±0.31 B60.47±0.65 B2.089 7±0.069 5 AB草鱼38.03±0.06 BC45.67±0.12 A52.17±0.91 A-61.23±0.31 AB2.499 7±0.188 6 A黄颡鱼41.57±0.29 A-52.03±0.12 A-62.10±0.26 A1.781 3±0.285 7 B鲈鱼39.53±1.72 B44.93±0.31 A52.37±0.12 A57.07±0.90 A62.33±0.83 A2.283 0±0.256 0 A鳜鱼37.00±0.60 C39.33±0.80 C49.43±0.23 C57.83±1.18 A60.60±0.89 B1.680 0±0.347 8 B品种起始温度To/℃峰值温度T p1/℃峰值温度T p2/℃峰值温度T p3/℃终止温度Tc/℃
表3 70 ℃附近不同品种鱼肉肌肉蛋白的热特性
Table3 Thermal characteristics of muscles from different varieties of Thermal char fish at around 70 ℃
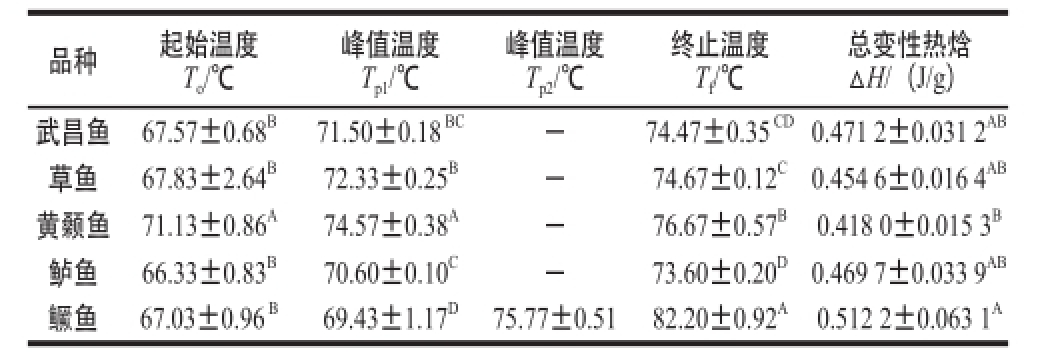
总变性热焓ΔH/(J/g)武昌鱼67.57±0.68 B71.50±0.18 BC-74.47±0.35 CD0.471 2±0.031 2 AB草鱼67.83±2.64 B72.33±0.25 B-74.67±0.12 C0.454 6±0.016 4 AB黄颡鱼71.13±0.86 A74.57±0.38 A-76.67±0.57 B0.418 0±0.015 3 B鲈鱼66.33±0.83 B70.60±0.10 C-73.60±0.20 D0.469 7±0.033 9 AB鳜鱼67.03±0.96 B69.43±1.17 D75.77±0.5182.20±0.92 A0.512 2±0.063 1 A品种起始温度To/℃峰值温度T p1/℃峰值温度T p2/℃终止温度Tf/℃
Saeed [18]和刘大松 [9]等研究表明,鱼肉的DSC曲线上主要有3 个峰,分别对应于肌球蛋白、肌浆蛋白和肌动蛋白。任丽娜 [19]的研究表明,新鲜白鲢鱼肉肌球蛋白和肌动蛋白的变性温度分别为49 ℃和74 ℃。鲁长新 [7]的研究表明,鲢鱼肌肉蛋白有肌球蛋白、肌浆蛋白和肌动蛋白3 个变性峰,峰值对应的温度分别为41.50、53.28、 72.4 ℃。Deng等 [20]研究表明,鸡肉的DSC曲线上3 个主要峰分别对应肌球蛋白质头部、肌球蛋白尾部和肌浆蛋白及肌动蛋白。Korzenjowaka等 [21]研究表明肌原纤维蛋白的DSC曲线上变性峰分别代表肌球蛋白的球状头部、杆状尾部和肌动蛋白。Tironi等 [22]发现大马哈鱼肌原纤维蛋白有3 个焓变点,分别为43.4、52.6、68.7 ℃,其中前2 个焓变点与肌球蛋白的变性相关,后1 个是肌动蛋白的变性。由此,推测50 ℃附近的热吸收峰对应肌球蛋白和肌浆蛋白,70 ℃附近的热吸收峰对应肌动蛋白,即表2中鱼肉的热吸收峰1、峰2和峰3分别代表肌球蛋白头部、肌球蛋白尾部和肌浆蛋白,表3中热吸收峰代表肌动蛋白。5 种新鲜淡水鱼肌肉热特性与上述研究基本一致,略微的差异在于部分鱼肉品种肌球蛋白出现2 个连续的热吸收峰,这可能是由于肌球蛋白头部和尾部热稳定性不同从而导致变性温度的差异;部分鱼肉未出现肌浆蛋白热吸收峰,可能是由于作为水溶性蛋白质,肌浆蛋白在鱼肉漂洗处理过程中容易发生流失,其大量损失导致电流信号微弱无法检出;部分鱼肉品种肌动蛋白出现2 个连续的热吸收峰,这可能是由于肌动蛋白分子中可能存在单体和多聚体(纤维状)2 种形式,在肌动蛋白浓度及盐离子浓度达到一定水平且存在ATP条件下,单体才会聚合成多聚体肌动蛋白 [23]。
DSC曲线中热吸收峰的变性温度和变性热焓是蛋白质热稳定性的反映,变性温度和变性热焓值越高,说明蛋白质的热稳定性越高 [24]。由表2、3可知,草鱼肌球蛋白热稳定性相对而言最高,因而在热加工过程中最不易发生变性,鳜鱼肌球蛋白相反;鳜鱼肌动蛋白热稳定性相对最高,因而在热加工过程中最不易发生变性,鲈鱼肌动蛋白相反。
2.3 鱼肉冻结与未冻结比热容
表4 不同品种鱼肉冻结与未冻结的比热容
Table4 Specific heat capacity values of different varieties of fish in frozen and unfrozen state J/(g·K)

注:同行肩标小写字母不同表示差异显著(P<0.05)。下同。
ΔC p-40 ℃20 ℃武昌鱼1.711 3±0.009 5 Aa3.377 3±0.106 0 Ab1.666 0草鱼1.720 0±0.160 3 Aa3.512 0±0.037 0 Ab1.432 0黄颡鱼1.702 3±0.144 0 Aa3.570 7±0.200 4 Ab1.868 4鲈鱼1.658 0±0.060 5 Aa3.444 7±0.027 1 Ab1.786 7鳜鱼1.839 8±0.228 8 Aa3.586 3±0.109 9 Ab1.746 5品种C p
比热容是物质的基本物理性质,鱼的比热容取决于其温度及水分含量,另外,与鱼肉自身的结构、组分和水的结合状态密切相关,其中,可溶性固形物含量与含水率是尤为重要的影响因素 [25]。由表4可知,-40 ℃时(鱼肉处于冻结状态),武昌鱼、草鱼、黄颡鱼、鲈鱼和鳜鱼的比热容分别为1.711 3、1.720 0、1.702 3、1.658 0、1.839 8 J/(g·K);20 ℃时(鱼肉未冻结),武昌鱼、草鱼、黄颡鱼、鲈鱼和鳜鱼的比热容分别为3.377 3、3.512 0、3.570 7、3.444 7和3.586 3 J/(g·K)。不同品种淡水鱼之间冻结前后的比热容无显著差异(P>0.05),但是同一种淡水鱼冻结前后比热容差异显著(P<0.05)。其中,-40 ℃时鳜鱼的比热容最大,鲈鱼的比热容最小,说明冻结状态下单位质量鳜鱼升高单位温度所需的能量最多,鲈鱼则相反;20 ℃时鳜鱼的比热容最大,武昌鱼的比热容最小,说明未冻结状态下单位质量鳜鱼升高单位温度所需的能量最多,武昌鱼则最小。另外,黄颡鱼比热容的变化最大,草鱼则最小,即在冷冻和未冷冻状态下单位质量黄颡鱼升高单位温度所需的能量差异最大,草鱼则最小。另外,不同品种鱼肉从冻结状态过渡至未冻结状态时,比热容均升高,即冻结状态鱼肉比未冻结状态升高单位温度所需的能量更低。
2.4 鱼肉在蛋白质变性与未变性状态下的比热容
2.4.1 鱼肉在肌球蛋白变性与未变性状态下的比热容
表5 不同品种新鲜鱼肉在肌球蛋白未变性与变性状态下的比热容
Table5 Specific heat capacity values of myosin from different varieties of fish in non-denatured and denatured states J/(g·K)
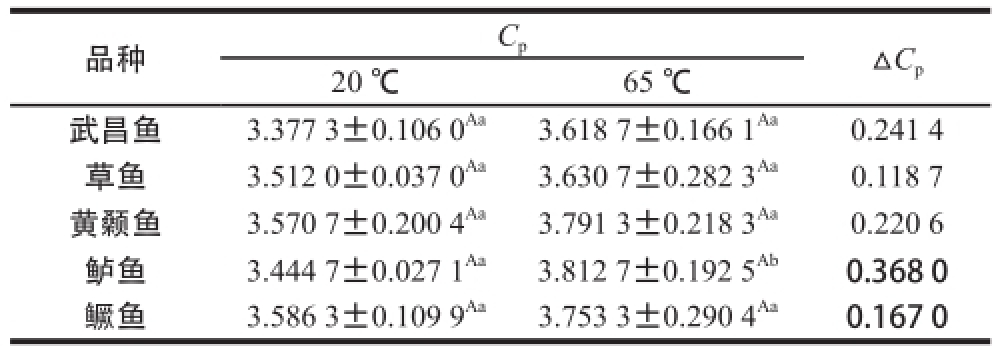
品种C pΔC p20 ℃65 ℃武昌鱼3.377 3±0.106 0 Aa3.618 7±0.166 1 Aa0.241 4草鱼3.512 0±0.037 0 Aa3.630 7±0.282 3 Aa0.118 7黄颡鱼3.570 7±0.200 4 Aa3.791 3±0.218 3 Aa0.220 6鲈鱼3.444 7±0.027 1 Aa3.812 7±0.192 5 Ab0.368 0鳜鱼3.586 3±0.109 9 Aa3.753 3±0.290 4 Aa0.167 0
由表5可知,20 ℃时(鱼肉肌球蛋白未变性),武昌鱼、草鱼、黄颡鱼、鲈鱼和鳜鱼的比热容分别为3.377 3、3.512 0、3.570 7、3.444 7、3.586 3 J/(g·K);65 ℃时(鱼肉肌球蛋白处于变性状态),武昌鱼、草鱼、黄颡鱼、鲈鱼和鳜鱼的比热容分别为3.618 7、3.630 7、3.791 3、3.812 7和3.753 3 J/(g·K)。不同品种淡水鱼之间的肌球蛋白变性前后的比热容无显著性差异(P>0.05),并且除鲈鱼外,同一种淡水鱼肌球蛋白变性前后比热容差异无显著差异(P>0.05)。其中,20 ℃时鳜鱼的比热容最大,武昌鱼的比热容最小,说明未变性状态下单位质量鳜鱼升高单位温度所需的能量最多,武昌鱼则最少;65 ℃时鲈鱼的比热容最大,武昌鱼的比热容最小,说明变性状态下单位质量鲈鱼升高单位温度所需的能量最多,武昌鱼则最少。另外,鲈鱼比热容的变化最大,草鱼则最小,即在未变性和变性状态下单位质量鲈鱼升高单位温度所需的能量差异最大,草鱼则最小。另外,不同品种鱼肉肌球蛋白从未变性状态过渡至变性状态时,比热容均升高,即未变性状态鱼肉肌球蛋白比变性状态升高单位温度所需的能量更低。
2.4.2 鱼肉在肌动蛋白变性与未变性状态下的比热容
表6 不同品种新鲜鱼肉在肌动蛋白未变性与变性状态下的比热容
Table6 Specific heat capacity values of actin from different varieties of fresh fish in non-denatured and denatured state J/(g·K)
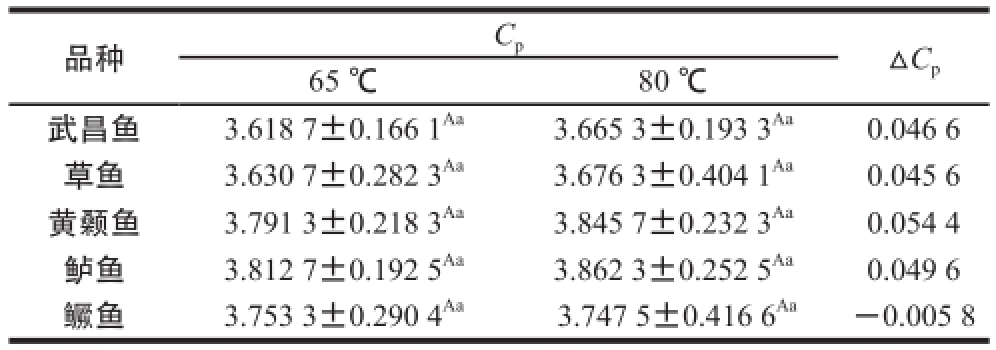
品种C pΔC p65 ℃80 ℃武昌鱼3.618 7±0.166 1 Aa3.665 3±0.193 3 Aa0.046 6草鱼3.630 7±0.282 3 Aa3.676 3±0.404 1 Aa0.045 6黄颡鱼3.791 3±0.218 3 Aa3.845 7±0.232 3 Aa0.054 4鲈鱼3.812 7±0.192 5 Aa3.862 3±0.252 5 Aa0.049 6鳜鱼3.753 3±0.290 4 Aa3.747 5±0.416 6 Aa-0.005 8
由表6可知,65 ℃时(鱼肉肌动蛋白未变性),武昌鱼、草鱼、黄颡鱼、鲈鱼和鳜鱼的比热容分别为3.618 7、3.630 7、3.791 3、3.812 7和3.753 3 J/(g·K);80 ℃时(鱼肉肌动蛋白处于变性状态),武昌鱼、草鱼、黄颡鱼、鲈鱼和鳜鱼的比热容分别为3.665 3、3.676 3、3.845 7、3.862 3和3.747 5 J/(g·K)。不同品种淡水鱼之间肌动蛋白变性前后的比热容无显著性差异(P>0.05),并且同一种淡水鱼冻结前后比热容无显著性差异(P>0.05)。其中,65 ℃时鲈鱼的比热容最大,武昌鱼的比热容最小,说明未变性状态下单位质量鲈鱼升高单位温度所需的能量最多,武昌鱼则最少;80 ℃时鲈鱼的比热容最大,武昌鱼的比热容最小,说明变性状态下单位质量鲈鱼升高单位温度所需的能量最多,武昌鱼则最少。另外,黄颡鱼比热容的变化最大,鳜鱼则最小,即在未变性和变性状态下单位质量黄颡鱼升高单位温度所需的能量差异最大,鳜鱼则最少。另外,不同品种鱼肉肌动蛋白从未变性状态过渡至变性状态时,比热容基本上均升高(鳜鱼除外),即未变性状态鱼肉肌动蛋白比变性状态升高单位温度所需的能量更低。
在5 种新鲜淡水鱼中,武昌鱼冰点温度和水分含量相对较低,最便于急速冷却,在冷冻保鲜过程中肌肉蛋白质变性的可能性最小,更加稳定;草鱼肌球蛋白和鳜鱼肌动蛋白的变性温度和变性热焓相对较高,蛋白质稳定性更高,因而在热加工过程中最不易发生变性;鱼肉未冻结状态和蛋白变性状态的比热容分别比鱼肉冻结状态和蛋白未变性状态的比热容更高,即新鲜鱼肉的比热容高于冻结鱼肉,加工后鱼肉的比热容高于未加工鱼肉。
参考文献:
[1] 吴洪钟. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2014: 54-87.
[2] 李里特. 食品物性学[M]. 北京: 中国农业出版社, 1998: 12-40.
[3] MALLETT C P. 冷冻食品加工技术[M]. 张慜, 译. 北京: 中国轻工业出版社, 2005: 6-38.
[4] 胡银平, 童明伟, 严嘉, 等. 离体生物组织相变潜热的DSC测试[J].重庆大学学报(自然科学版), 2006, 29(11): 62-65. DOI:10.11835/ j.issn.1000-582X.2006.11.015.
[5] 夏松养. 水产食品加工学[M]. 北京: 化学工业出版社, 2008: 12-44.
[6] 曹莹莹. 超高压结合热处理对肌球蛋白凝胶特性的影响研究[D]. 南京: 南京农业大学, 2012: 8-10.
[7] 鲁长新. 淡水鱼肌肉的热特性研究[D]. 武汉: 华中农业大学, 2007: 5-12.
[8] 张静雅. 白鲢鱼糜蛋白的冷冻变性机理及抗冻剂的应用研究[D]. 合肥: 合肥工业大学, 2012: 15-28.
[9] 刘大松, 姜启兴, 梁丽, 等. 草鱼肉冷藏条件下肌肉蛋白的变化[J]. 郑州轻工业学院学报(自然科学版), 2013, 28(1): 20-24. DOI:10.3969/j.issn.2095-476X.2013.01.005.
[10] 潘锦锋, 沈慧星, 尤娟, 等. 草鱼肌原纤维蛋白加热过程中理化特性的变化[J]. 中国农业大学学报, 2009, 14(6): 17-22. DOI:10.3321/ j.issn:1007-4333.2009.06.004.
[11] 张延华, 马国红, 宋理平, 等. 4种鱼肉的基本成分及胶原蛋白含量分析[J]. 中国农村小康科技, 2014(9): 79-81.
[12] 鲁长新, 赵思明, 熊善柏. 鲢鱼肉相变区间的热特性研究[J]. 农业工程学报, 2007, 23(6): 39-43. DOI:10.3321/ j.issn:1002-6819.2007.06.008.
[13] 高才, 周国燕, 胥义, 等. 乙二醇和丙三醇水溶液冻结特性的研究[J]. 物理化学学报, 2004, 20(2): 123-128. DOI:10.3866/PKU. WHXB20040203.
[14] HAMDAMI N, MONTEAU J Y, BAIL A L. Thermophysical properties evolution of French partly baked bread during freezing[J]. Food Research International, 2004, 37(7): 703-713. DOI:10.1016/ j.foodres.2004.02.017.
[15] 夏文水. 食品工艺学[M]. 北京: 中国轻工业出版社, 2007: 10-40.
[16] RAHMAN M S. Food properties handbook[M]. 2nd ed. Boca Raton: Florida & CRC Press, 2008: 154-192.
[17] 杨芳. 阿根廷鱿鱼肌原纤维蛋白特性及其加工的研究[D]. 厦门: 集美大学, 2009: 2-4.
[18] SAEED S, HOWELL N K. Rheological and differential scanning calorimetry studies on structural and textural changes in frozen Atlantic mackerel (Scomber scombrus)[J]. Journal of Science of Food Agriculture, 2004, 84(10): 1216-1222. DOI:10.1002/jsfa.1807.
[19] 任丽娜. 白鲢鱼肉肌原纤维蛋白冷冻变性的研究[D]. 无锡: 江南大学, 2014: 26-34.
[20] DENG Y, ROASENVOLD K, KARLSSON A H, et al. Relationship between thermal denaturation of pocine muscle protein and waterholding capacity[J]. Journal of Food Science, 2002, 67(5): 1642-1647. DOI:10.1111/j.1365-2621.2002.tb08698.x.
[21] KORZENJOWAKA M, CHEUNG I W Y, LI-CHAN E C Y. Effects of fish protein hrdrolysate and freeze-thaw treatment on physicochemical and gel properties of natural actomyosin from Pacific cod[J]. Food Chemistry, 2012, 138(2/3): 1967-1975. DOI:10.1016/ j.foodchem.2012.09.150.
[22] TIRONI V A, TOMAS M, ANON M C. Structural and functional changes in myofibrillar proteins of sea salmon (Pseudopercis semifasciata) by interaction with malonaldehde (RI) [J]. Journal of Food Science, 2007, 67(3): 929-935. DOI:10.1111/j.1365-2621.2002. tb09430.x.
[23] 李强. 草鱼冷藏过程中肌肉蛋白质的组成和理化特性变化研究[D].长沙: 长沙理工大学, 2013: 11-16.
[24] ZHOU A M, BENJAKUL S, PAN K, et al. Cryoprotective effects of trehalose and sodium lactate on tilapia (Sarotherodon nilotica)surimi during frozen storage[J]. Food Chemistry, 2005, 32(7): 93-96. DOI:10.1016/j.foodchem.2005.02.013.
[25] CHEN C S. Thermodynamic analysis of the freezing and thawing of foods: enthalpy and apparent specific heat[J]. Journal of Food Science, 1985, 50(4): 1158-1162. DOI:10.1111/j.1365-2621.1985. tb13034.x.
Comparison of Thermal Properties of Muscles from Five Kinds of Freshwater Fish
SHAO Ying
1,2, WANG Xiaohong
2, WU Wenjin
1, LI Xin
1, XIONG Guangquan
1, WANG Haibin
2, QIAO Yu
1, WANG Jun
1, LIAO Li
1, WANG Lan
1,*
(1. Institute of Agricultural Products Processing and Nuclear-Agricultural Technology, Hubei Academy of Agricultural Sciences/ Farm Products Processing Research Sub-Center of Hubei Innovation Center of Agriculture Science and Technology, Wuhan 430064, China;2. College of Food Science & Technology, Huazhong Agricultural University, Wuhan 430070, China)
Abstract:The study was intended to investigate comparatively the thermal properties of muscles from 5 different freshwater fish (Megalobrama amblycephala, Ctenopharyngodon idellus, Pelteobagrus fulvidraco, Lateolabras janopicus and Siniperca chuatsi) by differential scanning calorimetry (DSC), including moisture content, freezing point, denaturation temperature,denaturation enthalpy and specifi c heat capacity. Results showed that the freezing points of the fi ve fi sh ranged from -0.57 to -0.10 ℃; the onset temperature of decalescence peak around 50 ℃ ranged from 37.00 to 41.57 ℃, the conclusion temperature ranged from 60.47 to 62.33 ℃, and the denaturation enthalpy ranged from 1.680 0 to 2.499 7 J/g. The onset temperature of decalescence peak around 70 ℃ ranged from 66.33 to 71.13 ℃, the conclusion temperature ranged from 73.60 to 82.20 ℃, and the denaturation enthalpy ranged from 0.418 0 to 0.512 2 J/g; the specifi c heat capacity ranged from 1.658 0 to 3.862 3 J/(g·K). As demonstrated by this study, among the five species examined, freezing point and moisture content of Megalobrama amblycephala were relatively lower; denaturation temperature and denaturation enthalpy of Ctenopharyngodon idellus myosin and Siniperca chuatsi actin were relatively higher, which means that they had higher protein stability. Moreover, the specifi c heat capacity of fresh fi sh was higher than that of frozen fi sh; the specifi c heat capacity of processed fi sh was higher than that of the unprocessed one.
Key words:differential scanning calorimetry(DSC); freezing point; denaturation temperature; denaturation enthalpy;specific heat capacity
DOI:10.7506/spkx1002-6630-201619018
中图分类号:TS254.1
文献标志码:A
文章编号:1002-6630(2016)19-0106-06
引文格式:
邵颖, 王小红, 吴文锦, 等. 5 种淡水鱼肌肉热特性比较研究[J]. 食品科学, 2016, 37(19): 106-111. DOI:10.7506/spkx1002-6630-201619018. http://www.spkx.net.cn
SHAO Ying, WANG Xiaohong, WU Wenjin, et al. Comparison of thermal properties of muscles from five kinds of freshwater fish[J]. Food Science, 2016, 37(19): 106-111. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201619018. http://www.spkx.net.cn
收稿日期:2016-01-28
基金项目:湖北省重大科技创新计划(关键技术研发类)项目(2015ABA038);湖北省科技支撑计划(重点新产品新工艺研究开发)项目(2014BBA158)
作者简介:邵颖(1994—),女,助理研究员,本科,研究方向为淡水产品开发。E-mail:275673017@qq.com
*通信作者:汪兰(1981—),女,副研究员,博士,研究方向为农产品加工和天然产物化学。E-mail:2005lily@gmail.com