表1 采样地名称
Table1 Information of the soil samples used in this study

采样省份采样具体地点土样份数腾冲县1大理白族自治州1云南省隆阳区丙麻1永平县1西双版纳傣族自治区2瑞丽市2英山县1黄冈市2神农架林区8武汉市3河北省邢台市2山东省青岛市2内蒙古自治区包头市1广东省深圳市2湖北省
刘超帝,缪礼鸿*,陈 瑾,刘蒲临
(武汉轻工大学生物与制药工程学院,湖北 武汉 430023)
摘 要:采用平板分离法,从29 份新鲜采集的土样中分离获得64 株耐高温酵母菌株,并对其在高温条件下的乙醇发酵性能进行了分析比较。26S rDNA D1/D2区域序列测定和生理特征分析结果表明,这些酵母菌株在亲缘关系上可归类于6 个属7 个种,分别为热带假丝酵母(Candida tropicalis)(占总分离株的39.1%)、马克斯克鲁维酵母(Kluyveromyces marxianus)(占23.4%)、东方伊萨酵母(Issatchenkia orientalis)(占29.7%)、季也蒙毕赤酵母(M. guilliermondii)(占1.6%)、Kazachstania bovina(占1.6%)、Candida palmioleophila(占1.6%)和酿酒酵母(Saccharomyces cerevisiae)(占3.1%)。其中,马克斯克鲁维酵母的耐高温能力和乙醇发酵能力最强;40 ℃条件下发酵72 h后,发酵液中乙醇体积分数最高可达6.56%,显著高于相同条件下其他耐高温酵母的乙醇产量。上述结果表明,马克斯克鲁维酵母在高温乙醇发酵过程中具有明显优势,可作为利用生物质发酵生产乙醇的优良候选菌株。
关键词:耐高温酵母菌;生物多样性;26S rDNA;乙醇发酵
高温真菌是一类能在高温条件下生长的极端环境真核微生物。目前,国际学术界将高温真菌分为两类,一类为嗜热真菌,菌株最高生长温度为50 ℃或50 ℃以上,最低生长温度为20 ℃或20 ℃以上;另一类为耐热真菌,菌株最高生长温度在50 ℃左右(通常为40 ℃或40 ℃以上),最低生长温度在20 ℃以下的特殊菌群 [1-3]。酵母菌是一类在工农业生产上具有广泛应用价值的单细胞真菌。迄今为止,所报道的耐高温酵母属有毕赤酵母属、克鲁维酵母属、裂殖酵母属、汉逊酵母属、假丝酵母属、德巴利酵母属和豆孢酵母属等 [4-7]。
高温发酵生产乙醇具有冷却成本低,污染风险小,节约糖化酶的使用等多种优点,关注度逐年增高。Abdel-Banat等 [8]研究指出,一个产能为3×10 7L的乙醇发酵企业,如果将发酵温度提升5 ℃,仅冷却成本即可节约3万 美元。尤其是高温同步糖化发酵生产乙醇技术,不仅可以减少葡萄糖对酶的抑制作用,还能进一步的简化发酵过程和设备,技术优势明显 [9]。然而,目前所广泛使用的酿酒酵母,最佳发酵温度仅为28~33 ℃ [10],一般不超过36 ℃,限制了高温同步糖化发酵生产乙醇技术的进一步发展。筛选获取在高温条件下具有良好的乙醇发酵性能的酵母菌株,成为提高该工艺乙醇产率的关键。因此,国内外乙醇生产企业都十分重视耐高温酵母菌的选育工作。Edgardo等 [11]筛选到两株可以在42 ℃条件下生长的耐高温酿酒酵母菌株;利用这些菌株进行葡萄糖发酵,实际产率为理论产率的50%~80%。Dhaliwal等 [12]以含有体积分数10%乙醇的甘蔗汁作为富集培养基筛选到一株耐高温的东方伊萨酵母,其在40 ℃条件下以甘蔗汁作为培养基进行发酵后,乙醇质量浓度达到71.9 g/L,生产效率为4.0 g/(L·h)。田沈等 [13]对一株耐高温麦芽糖假丝酵母(Candida maltosa)进行高温驯化,驯化后的菌株在46 ℃,含有5%葡萄糖培养基中的发酵性能接近30 ℃条件下酿酒酵母的发酵水平;46 ℃条件下以3 g/100 mL玉米秸秆进行同步糖化发酵,得到13.93 g/L的乙醇,达到理论产率的88.2%。本实验拟通过分离和筛选不同地域的耐高温酵母菌株,并对相关菌株的耐温性和产乙醇能力进行比较研究,为耐高温酵母菌资源的开发应用提供参考。
1.1 材料
1.1.1 样品来源
表1 采样地名称
Table1 Information of the soil samples used in this study

采样省份采样具体地点土样份数腾冲县1大理白族自治州1云南省隆阳区丙麻1永平县1西双版纳傣族自治区2瑞丽市2英山县1黄冈市2神农架林区8武汉市3河北省邢台市2山东省青岛市2内蒙古自治区包头市1广东省深圳市2湖北省
本研究共采集29 份新鲜的土壤样品,土样采集的范围包括:云南省、湖北省、广东省、河北省、山东省、内蒙古自治区,详见表1。
1.1.2 试剂
Taq DNA聚合酶、dNTP和DL2000 Marker 宝生物工程(大连)有限公司;聚合酶链式反应(polymerase chain reaction,PCR)引物 生工生物工程(上海)股份有限公司合成;葡萄糖 天津市科密欧化学试剂有限公司;酵母粉、蛋白胨 英国Oxoid公司;蜜二糖阿拉丁试剂(上海)有限公司;菊糖 北京博奥拓科技有限公司。
1.1.3 培养基
富集培养基采用豆芽汁蔗糖培养基 [5]:黄豆芽200 g、蔗糖30 g、水1 000 mL。分离选择培养基采用马丁孟加拉红-链霉素培养基 [14]:葡萄糖10 g、蛋白胨5 g、KH 2PO 41 g、MgSO 4·7H 2O 0.5 g、孟加拉红33.4 mg、蒸馏水100 mL、链霉素溶液30 μg/mL。常规培养使用酵母浸出粉胨葡萄糖(yeast extract peptone dextrose medium,YPD)培养基:葡萄糖20 g、蛋白胨10 g、酵母粉10 g、水1 000 mL。发酵采用葡萄糖乙醇发酵培养基 [15]:葡萄糖200 g、尿素5 g、CaCl 20.55 g、蛋白胨10 g、KH 2PO 41 g、酵母粉6 g、MgSO 4·7H 2O 1.5 g、水1 000 mL。同化碳源基础培养基:MgSO 4·7H 2O 0.5 g、酵母膏0.2 g、(NH 4) 2SO 45.0 g、KH 2PO 41.0 g、水1 000 mL。所有固体培养基加入20 g/L琼脂。以上培养基灭菌条件为115 ℃,30 min。
1.2 仪器与设备
PCR仪 德国Biometra公司;SYDR/1305凝胶成像仪美国Syngene公司;ZXDP-A2160恒温培养箱 上海智诚科技有限公司;ECLIPSE 80i显微镜 日本Nikon公司;7890A气相色谱仪 美国安捷伦公司。
1.3 方法
1.3.1 耐高温酵母菌株的分离与保藏
耐高温酵母菌株分离方法:称取土样1.0 g,加入到100 mL灭菌的富集培养基中,33 ℃、170 r/min摇床培养30 h。梯度稀释后涂布于分离选择培养基上,33 ℃静置培养2~3 d后挑取形态不同的单菌落,镜检。形态初步确定为酵母后,多次划线纯化,获得纯培养物。42 ℃恒温培养1~2 d,挑取生长良好的菌株进行真空冷冻干燥保存。
1.3.2 酵母菌株26S rDNA D1/D2区基因的扩增及测序
1.3.2.1 基因组DNA的提取
利用十六烷基三甲基溴化铵(cetyl trimethyl ammonium bromide,CTAB)法 [16]提取酵母菌基因组DNA,检测后置于-20 ℃保存备用。
1.3.2.2 PCR扩增与测序
正向引物N L 1(5’-G C A T A T C A A T A AG C G G A G G A A A A G-3’);反向引物N L 4(5’-GGTCCGTGTTTCAAGACGG-3’)。采用50 μL反应体系进行PCR扩增。PCR循环程序为:94 ℃预变性5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,循环32 次;72 ℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测后,送往生工生物工程(上海)股份有限公司测序。
1.3.3 序列分析和菌种鉴定
对筛选得到的所有菌株进行26S rDNA D1/D2区测序,测序结果采用DNAStar软件人工校对。校正以后的序列在GenBank核酸序列数据库中进行同源序列搜索,比较测试菌株和已知酵母菌株之间的亲缘关系及其系统地位。根据同源序列搜索结果,选取与测试菌株关系较近的模式菌株的Dl/D2区序列,用Clustal X进行序列校准排齐,再用Mega 4.0软件邻接法,进行1 000 次Bootstrap检验后构建系统发育树 [17-19]。
1.3.4 耐高温酵母菌株的耐温性能
先将酵母菌接种于YPD平板上33 ℃活化24 h,然后重新划线接种于YPD平板上,分别置于42、45、47、50 ℃恒温培养48 h,观察酵母菌生长情况。
1.3.5 耐高温酵母菌对碳源的利用
在同化碳源基础培养基中分别添加果糖、蔗糖、菊糖等18 种不同的糖类为唯一碳源,115 ℃,30 min灭菌后,接种各测试菌株培养24 h,观察生长情况。
1.3.6 不同种属耐高温酵母在不同温度条件下的耐乙醇能力
将酵母菌于YPD平板上33 ℃活化24 h,然后接种于YPD液体培养基中,37 ℃、170 r/min摇瓶培养12 h。采用血球板计数法 [14]测总菌数以确定接种量,以2×10 8个/mL的接种量接入含有0%、4%、6%乙醇的YPD液体培养基中,置于35、42、45 ℃条件下170 r/min摇瓶培养6 h后,在600 nm波长处测菌液的光密度(OD)值。每种酵母选取1 株酵母菌进行测定,每株菌株做两个重复。
1.3.7 耐高温酵母菌乙醇发酵能力的测定
将菌株在YPD固体平板上活化1 d,挑取单菌落接种于YPD液体培养基中,37 ℃、170 r/min摇瓶培养12 h,即为种子液。将种子液按体积分数2.0%的接种量转接至葡萄糖乙醇发酵培养基中。先将其在37℃、170 r/min培养6 h,然后于40 ℃条件下静置厌氧发酵。发酵72 h后,取100 mL发酵液再加入100 mL蒸馏水,蒸馏,取100 mL馏出液用气相色谱测其发酵液的乙醇含量 [20]。每种酵母菌株挑选1~4 株进行测定,每个菌株做3 个重复。
1.3.8 高温条件下马克斯克鲁维酵母发酵能力的测定
将种子液按体积分数2.0%的接种量转接到葡萄糖乙醇发酵培养基中。37 ℃、170 r/min培养6 h,然后于42、45 ℃条件下进行静置发酵。发酵72 h后,取100 mL发酵液加入100 mL蒸馏水,蒸馏,取100 mL馏出液用气相色谱法测定发酵液的乙醇体积分数。每株菌株做3 个重复。
2.1 酵母菌株的分离鉴定及种群分布
本研究共分离获得耐高温酵母菌64 株,分属于6 个属7 个种,其中,热带假丝酵母(Candida tropicalis)25 株(占总分离株的39.1%)、马克斯克鲁维酵母(Kluyveromyces marxianus)15 株(占23.4%)、东方伊萨酵母(Issatchenkia orientalis)19 株(占29.7%)、季也蒙毕赤酵母(M. guilliermondii)1 株(占1.6%)、Kazachstania bovina 1 株(占1.6%)、Candida palmioleophila 1 株(占1.6%)和酿酒酵母(Saccharomyces cerevisiae)2 株(占3.1%),优势菌株为热带假丝酵母,其次是马克斯克鲁维酵母和东方伊萨酵母。湖北省和云南省采集的土样最多,筛选和鉴定的菌株总数也最多。从分离结果看,热带假丝酵母的地域分布最广(表2),云南、湖北、河北、山东和广东5 个省的土样中都能筛选到。
表2 耐高温酵母菌的地理分布
Table2 Geographical distribution of different thermotolerant yeasts 株
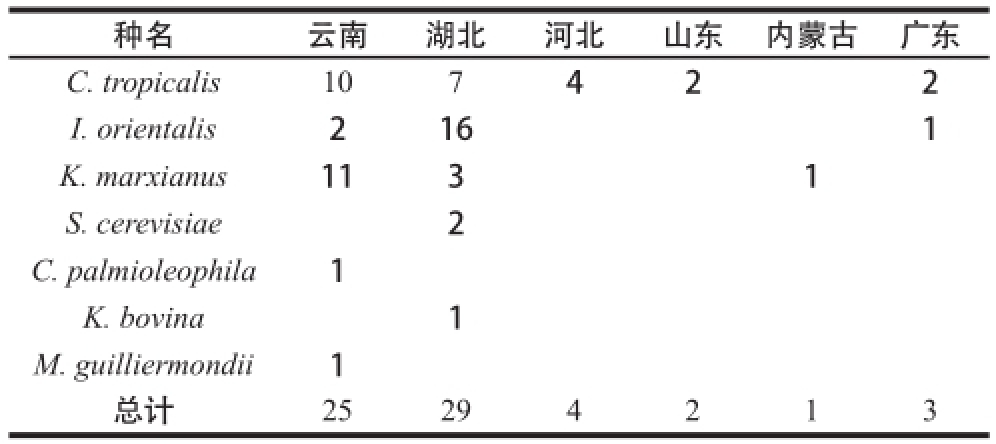
种名云南湖北河北山东内蒙古广东C. tropicalis107422 I. orientalis2161 K. marxianus1131 S. cerevisiae2 C. palmioleophila1 K. bovina1 M. guilliermondii1总计25294213
2.2 耐高温酵母菌株的耐温性能测定结果
本研究所筛选到的15 株马克斯克鲁维酵母菌株均能在50 ℃条件下生长;而在25株热带假丝酵母中,有13 株能在47 ℃条件下生长,9 株能在45 ℃条件下生长,3 株能在42 ℃条件下生长。19 株东方伊萨酵母中,18 株能在47 ℃条件下生长,1 株能在45 ℃条件下生长。C. palmioleophila能在45 ℃条件下生长。所有的酿酒酵母、季也蒙毕赤酵母和K. bovina菌株均只能在42 ℃条件下生长。上述结果表明,不同属酵母菌的耐高温能力不相同,同种酵母不同菌株之间的耐高温能力也存在明显差异,其中耐温能力最好的是马克斯克鲁维酵母。每个种属选取1~3 株作为代表菌株列出,各属酵母菌株的耐温性能见表3。
表3 酵母菌耐高温能力
Table3 Growth status of different yeast strains at different temperatures

注:++. 长势旺盛;+. 生长良好;-. 不生长或者生长微弱。
种名菌株编号温度/℃42454750 K. marxianus KMBM2-5+++++++ KMHG4-2+++++++ KMYP2-2+++++++ C. tropicalis CTBK-2++---CTYP2-1+++--CTHG-2+++++-IOSN6-1++++++-IOSN1-2++++++-IOTC2-2+++--M. guilliermondiiMGYN-1+---K. bovinaKBHG4-3+---C. palmioleophilaCPBK-9+++--S. cerevisiaeSCWHH-3+---SCWHH-4+---I. orientalis
2.3 耐高温酵母菌对碳源的利用结果
表4 酵母菌同化碳源结果
Table4 Carbon assimilation of different yeast strains
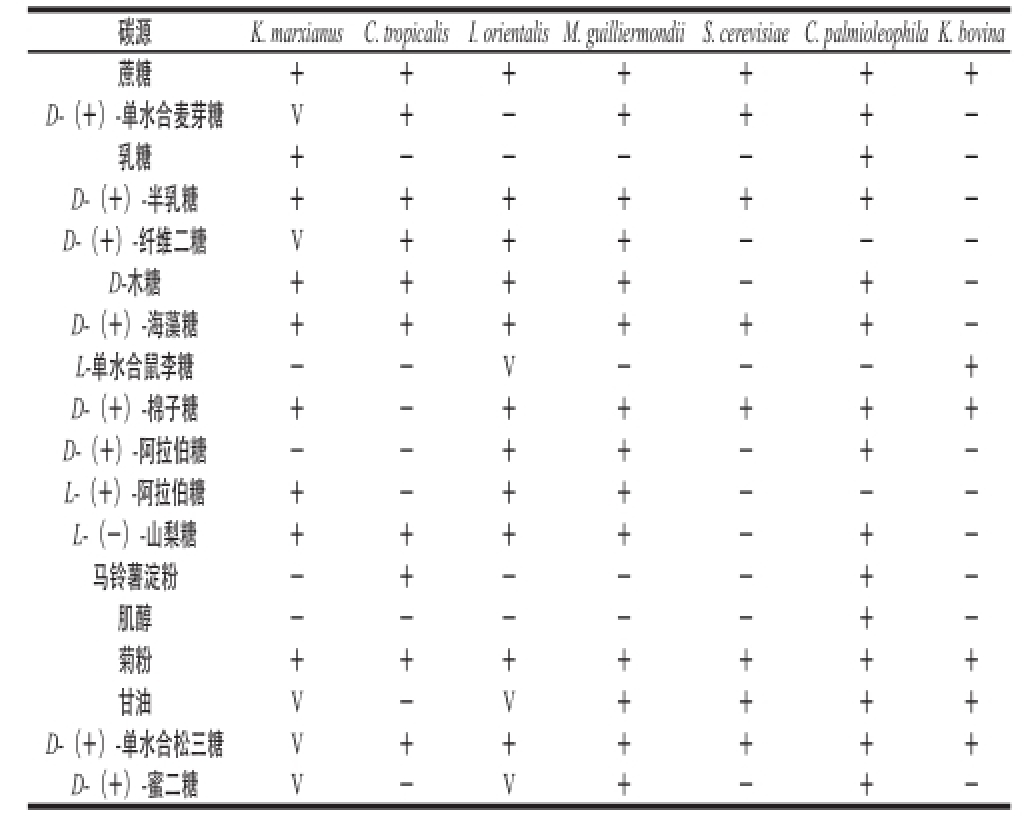
注:+. 生长;-. 不生长;V. 可变(即一部分菌株可以利用,另一部分不能利用)。
碳源K. marxianusC. tropicalisI. orientalis M. guilliermondii S. cerevisiae C. palmioleophila K. bovina蔗糖+++++++ D-(+)-单水合麦芽糖V+-+++-乳糖+----+-D-(+)-半乳糖++++++-D-(+)-纤维二糖V+++---D-木糖++++-+-D-(+)-海藻糖++++++-L-单水合鼠李糖--V---+ D-(+)-棉子糖+-+++++ D-(+)-阿拉伯糖--++-+-L-(+)-阿拉伯糖+-++---L-(-)-山梨糖++++-+-马铃薯淀粉-+---+-肌醇-----+-菊粉+++++++甘油V-V++++ D-(+)-单水合松三糖V++++++ D-(+)-蜜二糖V-V+-+-
2.4 耐高温酵母菌系统进化树
根据目前酵母菌的分子分类标准 [18-21],所测序菌株的D1/D2序列与已知种的相似性为99%以上并有形态特征的支持时,就可以做出种的鉴定。与最近缘的已知种的相似性在98%~99%之间时,就需要结合ITS序列分析和生理生化特征比较,对其作出分类学鉴定。如果在98%或者以下时,则可初步确定为新种。由图1可知,测试菌株26S rDNA D1/D2区域序列与各模式菌株进行序列比对,与相应的模式菌株的相似性为99%~100%。

图1 根据26S rDNA D1/D2区域序列的系统发育进化树
Fig.1 Phylogenetic tree based on the 26S rDNA D1/D2 region sequence
2.5 不同种属耐高温酵母菌在不同温度下的耐乙醇能力比较
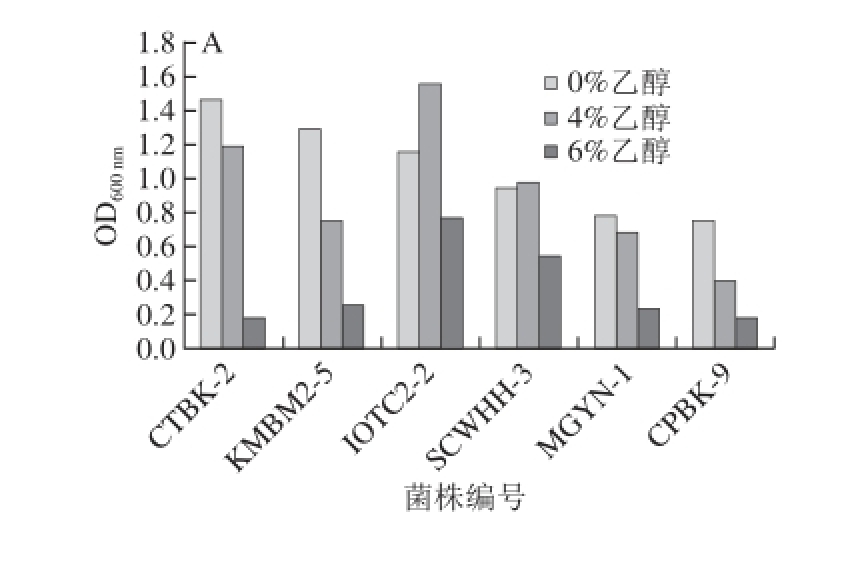

图2 不同耐高温酵母菌株在不同温度条件下的耐乙醇能力
Fig.2 Ethanol tolerance of different thermotolerant yeasts at different temperatures
A~C. 发酵温度分别为35、42、45 ℃;横轴菌株编号和表3对应。下同。
由于菌液浓度太高,35、42 ℃条件下0%乙醇的菌液为稀释5 倍后的结果。由图2可知,在不含乙醇的YPD培养基中,马克斯克鲁维酵母KMBM2-5在42 ℃的生长情况略强于35 ℃;在42、45 ℃条件下,其生长性能均强于其他5 种酵母菌,45 ℃尤为明显。45 ℃条件下,在YPD液体培养基中,生长性能的强弱顺序是:马克斯克鲁维酵母K. marxianus>热带假丝酵母C. tropicalis>东方伊萨酵母I. orientalis>季也蒙毕赤酵母M. guilliermondii>酿酒酵母S. cerevisiae>C. palmioleophila。
35 ℃条件下,对乙醇的耐受能力最好的是东方伊萨酵母IOTC2-2,它在添加了4%乙醇和6%乙醇的YPD培养基中表现出的耐受性均强于其他5 种酵母菌。在此温度条件下,不同酵母菌株4%乙醇的耐受能力强弱顺序为:东方伊萨酵母I. orientalis>热带假丝酵母C. tropicalis>酿酒酵母S. cerevisiae>马克斯克鲁维酵母K. marxianus>季也蒙毕赤酵母季也蒙毕赤酵母M. guilliermondii>C. palmioleophila。6%乙醇的耐受能力强弱顺序为:东方伊萨酵母I. orientalis>酿酒酵母S. cerevisiae>马克斯克鲁维酵母K. marxianus>季也蒙毕赤酵母M. guilliermondii>热带假丝酵母C. tropicalis>C. palmioleophila。其中热带假丝酵母CTBK-2可以在4%乙醇的YPD液体培养基中生长,但在6%乙醇的YPD液体培养基中明显受到抑制。在42 ℃和45 ℃条件下,6 种酵母菌对乙醇的耐受能力均不高,马克斯克鲁维酵母KMBM2-5的乙醇耐受能力要强于其他5 种酵母。整体上来说,6 种酵母菌在42 ℃条件下的乙醇耐受能力要强于45 ℃。
2.6 耐高温酵母菌乙醇发酵能力的比较

图3 不同耐高温酵母菌株的产乙醇能力
Fig.3 Ethanol fermentation by different thermotolerant yeasts
如图3所示,同种酵母的乙醇发酵能力也存在显著差异,如东方伊萨酵母菌株IOWHH-1与其他3 株东方伊萨酵母的耐温能力相同,但发酵能力却偏低。40 ℃条件下所挑选的4 株马克斯克鲁维酵母的发酵能力均强于其他酵母菌株,发酵72 h后平均乙醇产量为体积分数6.22%。其次为东方伊萨酵母,乙醇产量最高可达5.58%,4 株菌株的平均乙醇产量为体积分数4.89%。热带假丝酵母和季也蒙毕赤酵母在40 ℃条件下的乙醇发酵能力均较弱,而C. palmioleophila在40 ℃条件下几乎不产乙醇。图4表明在乙醇发酵过程中,马克斯克鲁维酵母、东方伊萨酵母与酿酒酵母的最大生长量较为相似,介于1.8×10 8~2.73×10 8CFU/mL之间。而季也蒙毕赤酵母与C. palmioleophila长势较弱,所达到最高菌落数仅为0.99×10 8CFU/mL和1.15×10 8CFU/mL。

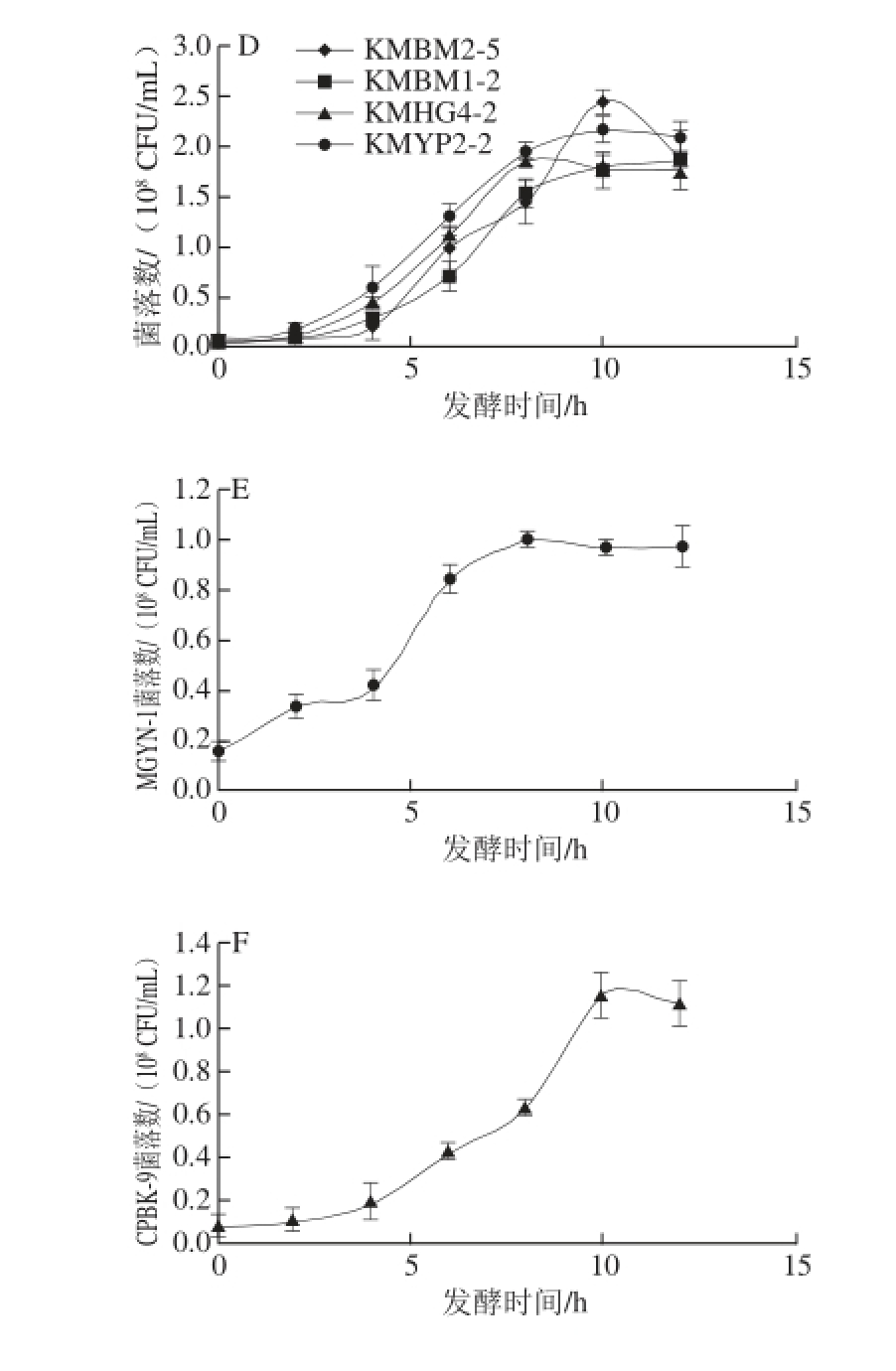
图4 不同耐高温酵母菌株乙醇发酵过程中的细胞生长曲线
Fig.4 Growth curves of different thermotolerant yeasts during ethanol fermentation
本实验对来自国内5 个省的29 份土样的耐高温酵母菌进行了分离鉴定并对相关发酵特性进行比较研究。结果表明,耐高温酵母菌的物种具有一定的多样性,而且在分布地域上存在一定的差异。从常年气温较高的云南省采集的土壤中更容易分离到耐高温性能更好的酵母菌株,其中马克斯克鲁维酵母占优势;而从湖北省分离获取的耐高温酵母菌株中,东方伊萨酵母占优势,其耐热性仅次于马克斯克鲁维酵母;热带假丝酵母在多个土壤样品中被分离获得,分布地域较广。
本研究曾利用豆芽汁蔗糖培养基和YPD液体两种富集培养基对采自湖北省黄冈市的同一种土壤进行酵母菌的筛选,结果发现,利用豆芽汁蔗糖培养基可以筛选到热带假丝酵母和马克斯克鲁维酵母两种不同的酵母菌株,而利用YPD液体培养基,则可筛选到热带假丝酵母,K. bovina和东方伊萨酵母3 种酵母菌;这一现象表明,从土壤中分离得到的酵母菌种类与所采用的培养基密切相关。王辰等 [17]对海南热带雨林腐木上的酵母菌物种多样性进行研究时也发现,同一样品用两种不同富集培养基所分离获取的菌株,其种属差异较大。此外,不同种属的酵母菌以及同种酵母菌不同菌株之间在耐温性和产乙醇能力等方面具有明显差异。其中,马克斯克鲁维酵母在耐高温性和乙醇发酵能力方面均明显高于其他6 种耐高温酵母,而东方伊萨酵母的耐乙醇能力最好。马克斯克鲁维酵母可在42~45 ℃条件下良好生长,能够在38~45 ℃间高效发酵生产乙醇。Singh等 [22]研究发现耐高温的马克斯克鲁维酵母IMB3在42 ℃条件下发酵可以产生60 g/L的乙醇,和酿酒酵母在较低温度条件下的乙醇产量相差无几。Limtong等 [23]以甘蔗汁为碳源并加入4%乙醇作培养基筛选到一株在40 ℃条件下进行乙醇发酵的马克斯克鲁维酵母DMKU 3-1042,发酵48 h后乙醇体积分数达到7.23%。Pang Zongwen等 [24]在40 ℃条件下使用马克斯克鲁维酵母GX-15进行发酵,乙醇最高产量为58 g/L。本研究所筛选得到的马克斯克鲁维酵母 KMBM1-2在40 ℃条件下发酵后,乙醇产量达到6.56%(53 g/L)显著高于相同条件下其他耐高温酵母的乙醇产量,与马克斯克鲁维酵母GX-15的发酵能力较为相似。由于高温驯化,诱变技术以及发酵工艺改良已被证明可以提高乙醇产量,因此马克斯克鲁维酵母KMBM1-2的高温乙醇发酵能力仍具有一定的提升空间。此外,马克斯克鲁维酵母可以在高温条件下利用多种糖类(包括:阿拉伯糖、半乳糖、甘露糖和木糖等) [9,25-26],有利于充分利用各种生物质原料,提高乙醇产量,具有良好的开发利用潜力。
参考文献:
[1] COONEY D G, EMERSON R. Thermophilic fungi, an account of their biology, activities and classification[M]. San Francisco: W. H. Freeman, 1964: 137-138.
[2] MOUCHACCA J. Thermophilic fungi: biodiversity and taxonomic status[J]. Cryptogamie Mycologie, 1997, 18(1): 19-69.
[3] MOUCHACCA J. Heat tolerant fungi and applied research: addition to the previously treated group of strictly thermotolerant speicies[J]. World Journal of Microbiology and Biotechnology, 2007, 23(12): 1755-1770. DOI:10.1007/s11274-007-9426-3.
[4] 潘静, 王昌禄, 李风娟, 等. 多耐性酒精酵母的选育及特性研究[J].中国酿造, 2011, 30(5): 113-115.
[5] SANDEEP S D, HARINDER S O, SIMRANJEET K S, et al. Enhanced ethanol production from sugarcane juice by galactose adaptation of a newly isolated thermotolerant strain of Pichia kudriavzevii[J]. Bioresource Technology, 2011, 102(10): 5968-5975. DOI:10.1016/ j.biortech.2011.02.015.
[6] NAVEEN K P, HASAN K A, MARK R W, et al. Simultaneous saccharification and fermentation of Kanlow switchgrass by thermotolerant Kluyveromyces marxianus IMB3: the effect of enzyme loading, temperature and higher solid loadings[J]. Bioresource Technology, 2011, 102(22): 10618-10624. DOI:10.1016/ j.biortech.2011.09.011.
[7] OLENA P I, ANDRIY Y V, CHARLES A A, et al. Construction of Hansenula polymorpha strains with improved thermotolerance[J]. Biotechnology and Bioengineering, 2009, 104(5): 911-919. DOI:10.1002/bit.22457.
[8] ABDEL-BANAT B M A, HOSHIDA H, NONKLANG S, et al. Hightemperature fermentation: how can processes for ethanol production at high temperatures become superior to the traditional process using mesophilic yeast[J]. Applied Microbiology and Biotechnology, 2010,85: 861-867. DOI:10.1007/s00253-009-2248-5.
[9] HASUNUMA T, AKIHIKO K. Consilidated bioprocessing and simultaneous saccharification and fermentation of lignocellulose to ethanol with thermotolerant yeast strains[J]. Process Biochemistry,2012, 47(9): 1287-1294. DOI:10.1016/j.procbio.2012.05.004.
[10] 秦广利, 郭坤亮, 白爱琴, 等. 耐高温酵母的研究进展[J]. 酿酒科技,2008(10): 92-95. DOI:10.13746/j.njkj.2008.10.025.
[11] EDGARDO A, CAROLINA P, MANUEL R, et al. Selection of thermotolerant yeast strains Saccharomyces cerevisiae for bioethanol production[J]. Enzyme and Microbial Technology, 2008, 43(2): 120-123. DOI:10.1016/j.enzmictec.2008.02.007.
[12] DHALIWAL S S, OBEROI H S, SANDHU S K, et al. Enhanced ethanol production from sugarcane juice by galactose adaption of a newly isolated thermotolerant strain of Pichia kudriavzevii[J]. Bioresource Technology, 2011, 102: 5968-5975. DOI:10.1016/ j.biortech.2011.02.015.
[13] 田沈, 任普鲜, 周桂雄, 等. 一株酵母菌高温驯化与同步糖化发酵研究[J]. 太阳能学报, 2011, 32(3): 374-377.
[14] 赵斌, 何绍江. 微生物学实验[M]. 北京: 科学出版社, 2002: 51-65.
[15] 刘秀颖, 何秀萍, 卢莹, 等. 基于基因组DNA诱变的遗传重组改造乙醇工业酵母的耐热性及发酵性能[J]. 生物工程学报, 2011, 27(7): 1049-1056. DOI:10.13345/j.cjb.2011.07.007.
[16] 易润华, 朱西儒, 周而勋, 等. 简化CTAB法快速微量提取丝状真菌DNA[J]. 湛江海洋大学学报, 2003, 23(6): 72-73.
[17] 王辰, 白逢彦. 海南热带雨林腐木上酵母菌物种多样性研究[J]. 菌物学报, 2009, 28(3): 354-362. DOI:10.13346/ j.mycosystema.2009.03.007.
[18] FELL J W, NOEKHOUT T, FONSECA A, et al. Biodiversity and systematics of basidiomycetous yeasts as determined by large-subunit rDNA D1/D2 domain sequence analysis[J]. International Journal of Systematic and Evolutionary Microbiology, 2000, 50: 1351-1371. DOI:10.1099/00207713-50-3-1351.
[19] SCORZETTI G, FELLl J W, FONSECA A, et al. Systematics of basidiomycetous yeasts: a comparison of large subunit D1/D2 and internal transcribed spacer rDNA regions[J]. FEMS Yeast Research,2002, 2(4): 495-517. DOI:10.1111/j.1567-1364.2002.tb00117.x.
[20] 陈文静, 柏永昊, 缪礼鸿, 等. 一株马克思克鲁维酵母的生长及酒精发酵特性分析[J]. 中国酿造, 2013, 32(7): 77-81.
[21] KURTZMAN C P, ROBNETT C J. Identification and phylogeny of ascomycetous yeasts from analysis of nuclear large subunit (26S)ribosomal DNA partial sequences[J]. Antonie van Leeuwenhoek, 1998,73(4): 331-371. DOI:10.1023/A:1001761008817.
[22] SINGH D, NIGAM P, BANAT I M, et al. Ethanol production at elevated temperatures and alcohol concentration: use of Kluyveromyces marxianus IMB3[J]. Word Journal of Micorbiology and Biotechnology,1998, 14(6): 823-834. DOI:10.1023/A:1008802704374.
[23] LIMTONG S, SRINGIEW C, YONGMANITCHAI W. Production of fuel ethanol at high temperature from sugar cane juice by a newly isolated Kluvyveromyces marxianus[J]. Bioresoure Technology, 2007,98(17): 3367-3374. DOI:10.1016/j.biortech.2006.10.044.
[24] PANG Z W, LIANG J J, QIN X J, et al. Multiple induced mutagenesis for improvement of ethanol production by Kluyveromyces marxianus[J]. Biotechnology Letters, 2010, 32(12): 1847-1851. DOI:10.1007/s10529-010-0384-8.
[25] LANE M M, MORRISSEY J P. Klueromyces marxianus: a yeast emerging from its sister’s shadow[J]. Fungal Biology Reviews, 2010,24: 17-26. DOI:10.1016/j.fbr.2010.01.001.
[26] FONSECA G G, HEINZLE E, WITTMAN C, et al. The yeast Kluyveromyces marxianus and its biotechnological potential[J]. Applied Microbiology and Biotechnology, 2008, 79(3): 339-354. DOI:10.1007/s00253-008-1458-6.
Isolation and Alcohol Fermentation Characteristics of Thermotolerant Yeasts
LIU Chaodi, MIAO Lihong*, CHEN Jin, LIU Pulin
(School of Biology and Pharmaceutical Engineering, Wuhan Polytechnic University, Wuhan 430023, China)
Abstract:In this study, 69 thermotolerant yeast strains were isolated from 29 different soil samples, and the fermentation performance of these strains at high temperature was also detected. Based on 26S rDNA D1/D2 domain sequence analysis and physiological characterization, these strains were phylogenetically related to 7 species in 6 genera, including Candida tropicalis (39.1% of the total yeast strains), K. marxianus (23.4%), I. orientalis (29.7%), M. guilliermondii (1.6%), K. bovina(1.6%), C. palmioleophila (1.6%) and S. cerevisiae (3.1%). C. tropicalis were the most widely distributed species. The best thermotolerant and ethanol fermentation ability were detected in K. marxianus. The ethanol production reached up to 6.56%(V/V) in 72 h at 40 ℃. These results demonstrated that K. marxianus has obvious advantages in ethanol fermentation at high temperature, which makes it a good potential candidate for commercial biomass ethanol production.
Key words:thermotolerant yeast; biodiversity; 26S rDNA; alcohol fermentation
DOI:10.7506/spkx1002-6630-201619022
中图分类号:Q939.97
文献标志码:A
文章编号:1002-6630(2016)19-0128-07
引文格式:
刘超帝, 缪礼鸿, 陈瑾, 等. 耐高温酵母菌的筛选及其乙醇发酵特性[J]. 食品科学, 2016, 37(19): 128-134. DOI:10.7506/ spkx1002-6630-201619022. http://www.spkx.net.cn
LIU Chaodi, MIAO Lihong, CHEN Jin, et al. Isolation and alcohol fermentation characteristics of thermotolerant yeasts[J]. Food Science,2016, 37(19): 128-134. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201619022. http://www.spkx.net.cn
收稿日期:2015-11-13
基金项目:国家高技术研究发展计划(863计划)项目(2013AA102805)
作者简介:刘超帝(1989—),女,硕士研究生,主要从事环境与资源微生物研究。E-mail:liunan3585@163.com
*通信作者:缪礼鸿(1965—),男,教授,博士,主要从事环境与资源微生物研究。E-mail:miaowhpu@126.com