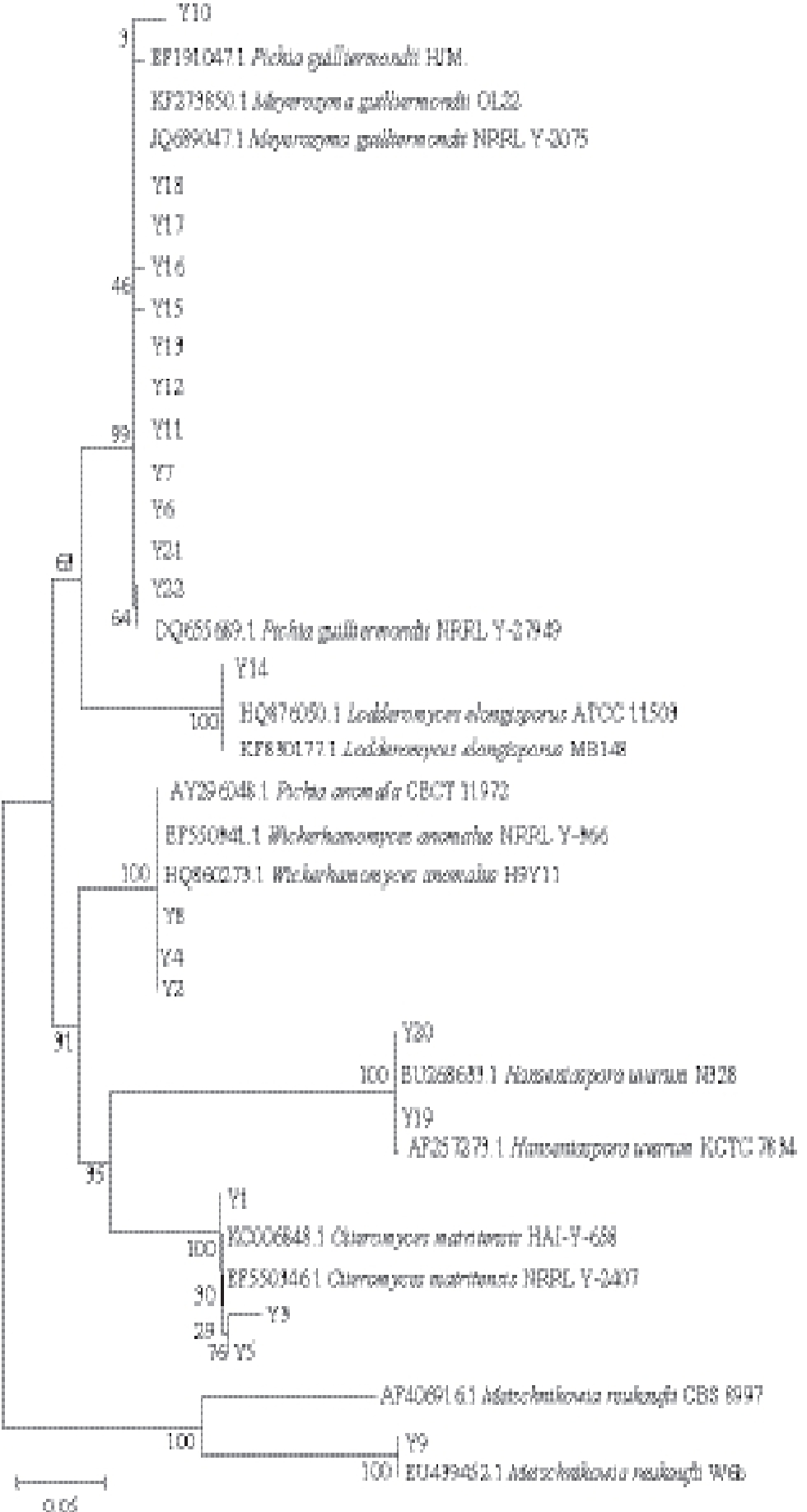
图1 水果与蜂蜜中分离的酵母菌基于26S rDNA D1/D2区序列的系统发育进化树
Fig.1 Neighbor-joining phylogenetic tree based on D1/D2 domain sequences
陆文俊,王 芳,陆兆新,吕凤霞,赵海珍,张 充,别小妹*
(南京农业大学食品科技学院,江苏 南京 210095)
摘 要:参照食品安全GB 4789.15—2010《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》中酵母菌的检测方法,从水果、蜂蜜中分离筛选酵母菌并根据其26S rDNA D1/D2区序列进行鉴定。从蜂蜜、草莓、香蕉、橙子、油桃、芒果中共分离得到3 株固囊酵母(Citeromyces matritensis)、3 株异常威客汉姆酵母(Wickerhamomyces anomalus)、12 株季也蒙毕赤酵母(Meyerozyma guilliermondii)、1 株长孢洛德酵母(Lodderomyces elongisporus)、2 株葡萄有孢汉逊酵母(Hanseniaspora uvarum)和1 株海洋酵母菌(Metschnikowia reukaufii)。将每种酵母菌接种于苹果、油桃和香蕉中与空白对照进行对比,以食品腐烂的速率来判断酵母菌的腐败能力,确定了W. anomalus和 C. matritensis是上述3 种水果中主要的腐败酵母菌,除此之外,M. reukaufi i对油桃有较强的腐败作用,M. guilliermondii对香蕉的腐败效果明显。食品工业中加强对上述这些腐败酵母菌的检测与控制,可以更好地防止腐败酵母对于食品工业造成的危害。
关键词:酵母菌;分离;鉴定;腐败能力
近几年食品防腐剂的大量使用及食品辐照保藏技术的使用,使得由酵母菌引起的食品腐败问题越来越显著。在低pH值、低水活性、低湿度、高盐或高糖的食品中,多数细菌无法在这种环境中生长繁殖,而酵母菌由于其耐受性较强,能够生长 [1],在这类环境条件下成为了优势菌株 [2],故这类食品的腐败主要是由酵母菌引起的。GB 14963—2011《食品安全国家标准 蜂蜜》 [3]与GB 17325—2005《食品工业用浓缩果蔬汁(浆)卫生标准》 [4]中对蜂蜜及浓缩果蔬汁中酵母菌的数量进行了规定。酵母菌引起食品的变质及腐败对食品工业造成了巨大的安全影响,因此对此类腐败酵母菌的研究意义重大 [5]。
对酵母菌rDNA区序列的分析是快速鉴定酵母菌的一种手段 [6],其中应用较多的是对26S rDNA D1/D2区和5.8S-ITS区序列的分析。但相比于5.8S-ITS区序列,26S rDNA D1/D2区序列数据库更加完善 [7],目的序列更易在数据库中比对得到结果,而且目前公认的大多数酵母菌的26S rDNA D1/D2序列的种内差异在0%~1%之间,故该方法准确度高 [8]。与传统的生理生化鉴定的方法相比,序列分析不仅省去了大量繁琐的操作,而且大大节省了时间,且准确性更高。本研究从水果、蜂蜜等食品原料中分离得到酵母菌,针对这些酵母菌26S rDNA D1/D2区序列比对确定其种属,并初步确定了这些不同种属酵母菌的致腐能力,为蜂蜜及果蔬汁等常受酵母菌污染引起腐败的食品的防腐研究提供了理论依据。
1.1 材料与培养基
各种水果与蜂蜜 市售。
PDA培养基:将马铃薯去皮后切成小块,加水煮烂(20~30 min即可),用8 层纱布过滤后,补足水量(每200 g土豆对应1 L水),再加入葡萄糖(添加量为20 g/L),固体培养基加入适量琼脂后,121 ℃灭菌20 min。
1.2 试剂与仪器
聚合酶链式反应(polymerase chain reaction,PCR)扩增和限制性酶切反应所需试剂、DNA Marker 广州东盛生物科技有限公司;引物 生工生物工程(上海)股份有限公司。
PTC-100 TMPCR扩增仪 美国MJ Research公司;JS-380c全自动数码凝胶成像分析仪 上海培清科技有限公司;SW-CJ-1FD型单人单面净化工作台 苏州净化设备有限公司;PowPac TMHC164-5052高电流电泳仪 美国Bio-Rad公司。
1.3 方法
1.3.1 酵母菌的分离
取液体25 mL(固体25 g)样品加入225 mL灭菌蒸馏水中,均质,按照10 倍系列稀释,选择2~3 个适宜稀释度的样品匀液,各取1 mL加入无菌培养皿中,每皿加入15~20 mL PDA培养基,(28±1) ℃培养5 d后 [9],挑取平板上圆形白色、边缘整齐、表面光滑湿润黏稠的菌落于装有固体PDA培养基的培养皿上进行三区平板划线,(28±1) ℃培养3 d后再挑取具有典型酵母菌菌落特征的菌落在PDA培养基平板上进行2~3 次纯化培养,(28±1) ℃培养24~48 h后挑取分离效果较好的菌株,经镜检为纯种后,用接种环接种于斜面PDA上,(28±1) ℃培养3 d后将菌种于4 ℃保存备用 [10]。
1.3.2 酵母菌的鉴定
D N A模板提取参照细菌基因组提取试剂盒方法,加入液氮研磨破壁过程。以引物N L 1(5’-GCATATCAATAAGCGGAGGAAAAG-3’)和NL4(5’-GGTCCGTGTTTCAAGACGG-3’)扩增酵母菌株26S rDNA D1/D2区序列 [11]。
采用25 μL PCR反应体系:2×Master Mix 12.5 mL,ddH 2O 9.5 mL,引物NL1与NL4各1 mL,DNA模板1 mL [12]。扩增条件:95 ℃预变性5 min;94 ℃变性1 min,60 ℃退火1 min,72 ℃延伸1 min,36 个循环;72 ℃延伸8 min [13]。PCR产物用1%的葡聚糖凝胶在120 V的电压下进行电泳,并以DL2000作为其分子质量标准。
PCR产物用胶回收试剂盒进行胶回收后送到南京金斯瑞生物科技有限公司进行测序,测得的基因序列利用BLAST在GenBank中搜索一致性序列后利用软件Clustal X与样品序列进行比对,并用软件MEGA 5.0构建邻接(neighbor-joining,NJ)法系统发育进化树。
1.3.3 酵母菌致腐能力测定
取大小、成熟度相近的苹果和油桃,在苹果、油桃的表皮用酒精棉擦拭消毒后利用打孔器打上小孔,然后取分离并鉴定得到的每种酵母菌悬浮液20 μL加入到小孔内,待孔内液体充分吸收后于30 ℃恒温贮藏,同时每种水果以注射等量生理盐水作为空白对照,每种菌液进行3 组重复实验。5 d后测量腐败圈的直径。
取成熟度相似、大小接近的香蕉,每根香蕉用针管注射20 μL酵母菌悬浮液,并以注射等量生理盐水的香蕉作为空白对照,30 ℃贮藏,将注射不同种菌液和生理盐水的香蕉每天剥开一根,观察其内部腐烂情况。
2.1 酵母菌种分离鉴定
从水果与蜂蜜中分离得到的酵母菌,对其26S rDNA D1/D2区序列扩增并测序得到结果与一致性序列比对后构建系统发育进化树,设置Bootstrap为500,来鉴定分离得到的酵母菌。由图1可知,分离菌株与参考菌株之间的亲缘关系,M. guilliermondii由Picha guilliermondii更名而来 [14],因此菌株Y6、Y7、Y10、Y11、Y12、Y13、Y15、Y16、Y17、Y18、Y21和Y22都可被鉴定为M. guilliermondii。但Y10与Y22和其他10 株M. guilliermondii的碱基存在差异。W. anomalus由Pichia anomalus 更名而来 [15],Y4、Y8、Y2与模式菌株P. anomala CECT 11972(AY296048.1)及模式菌株W. anomalus NRRL Y-366(EF550341.1)聚为一枝的支持率均为100%,故Y4、Y8和Y2均可判断为W. anomalus。Y14与模式菌株L. elongisporus ATCC 11503(HQ876050.1)及菌株L. elongisporus MB148(KF830177.1)聚为一枝的支持率为100%,故可判断Y14为L. elongisporus。

图1 水果与蜂蜜中分离的酵母菌基于26S rDNA D1/D2区序列的系统发育进化树
Fig.1 Neighbor-joining phylogenetic tree based on D1/D2 domain sequences
Y19、Y20与模式菌株H. uvarum KCTC 7834(AF257273.1)与菌株H. uvarum N328(EU268633.1)聚为一枝的支持率均为100%,故可判断Y19与Y20均为H. uvarum。Y9与参考菌株M. reukaufi i W6b(EU439452.1)聚为一枝的支持率为100%,且这两株菌与模式菌株M. reukaufii CBS 8997聚为一枝的支持率也为100%,故可判断Y9为L. elongisporus。Y1与模式菌株C. matritensis NRRL Y-2407(EF550346.1)聚为一枝的支持率为100%,故可判断Y1为C. matritensis,Y3、Y5聚为一枝,与模式菌株C. matritensis NRRL Y-2407(EF550346.1)属于同种但碱基存在差异,故Y 3、Y 5可判断为C. matritensis。
因此得到的酵母菌种鉴定结果如表1所示,故分离得到的22 株酵母菌中包含3 株固囊酵母(C. matritensis)、3 株异常威客汉姆酵母(W. anomalus)、12 株季也蒙毕赤酵母(M. guilliermondii)、1 株长孢洛德酵母(L. elongisporus)、2 株葡萄有孢汉逊酵母(H. uvarum)和1 株海洋酵母菌(M. reukaufi i)。
表1 分离所得菌种鉴定结果
Table1 Identification results of the isolated yeasts

菌株来源菌株编号菌株种属菌株中文名蜂蜜Y1C. matritensis固囊酵母蜂蜜Y2W. anomalus异常威客汉姆酵母蜂蜜Y3C. matritensis固囊酵母蜂蜜Y4W. anomalus异常威客汉姆酵母蜂蜜Y5C. matritensis固囊酵母草莓Y6M. guilliermondii季也蒙毕赤酵母草莓Y7M. guilliermondii季也蒙毕赤酵母香蕉Y8W. anomalus异常威客汉姆酵母香蕉Y9M. reukaufi i海洋酵母菌橙子Y10M. guilliermondii季也蒙毕赤酵母橙子Y11M. guilliermondii季也蒙毕赤酵母橙子Y12M. guilliermondii季也蒙毕赤酵母橙子Y13M. guilliermondii季也蒙毕赤酵母橙子Y14L. elongisporus长孢洛德酵母橙子Y15M. guilliermondii季也蒙毕赤酵母橙子Y16M. guilliermondii季也蒙毕赤酵母橙子Y17M. guilliermondii季也蒙毕赤酵母橙子Y18M. guilliermondii季也蒙毕赤酵母油桃Y19H. uvarum葡萄有孢汉逊酵母油桃Y20H. uvarum葡萄有孢汉逊酵母芒果Y21M. guilliermondii季也蒙毕赤酵母芒果Y22M. guilliermondii季也蒙毕赤酵母
2.2 酵母菌致腐实验结果
2.2.1 苹果、油桃致腐实验结果
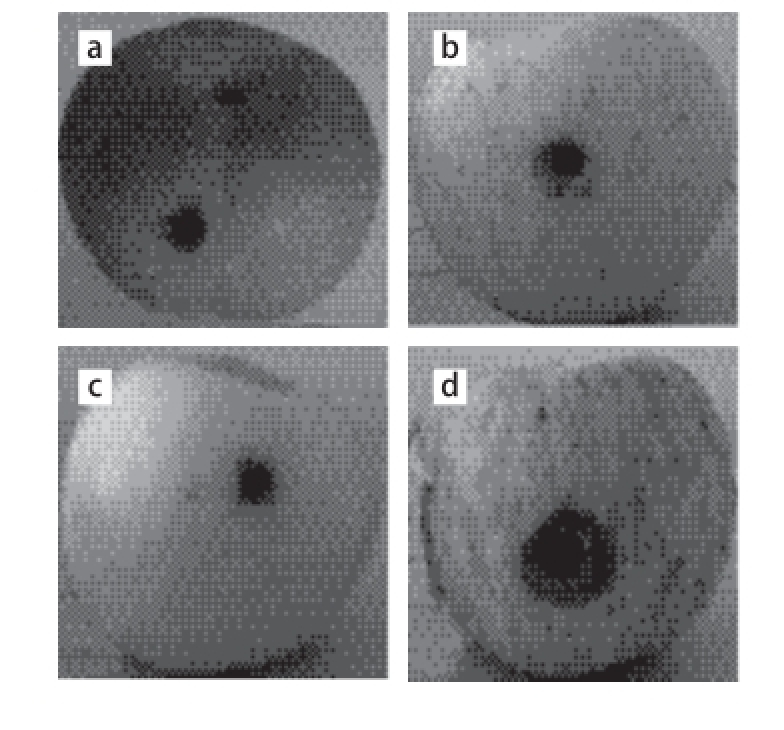
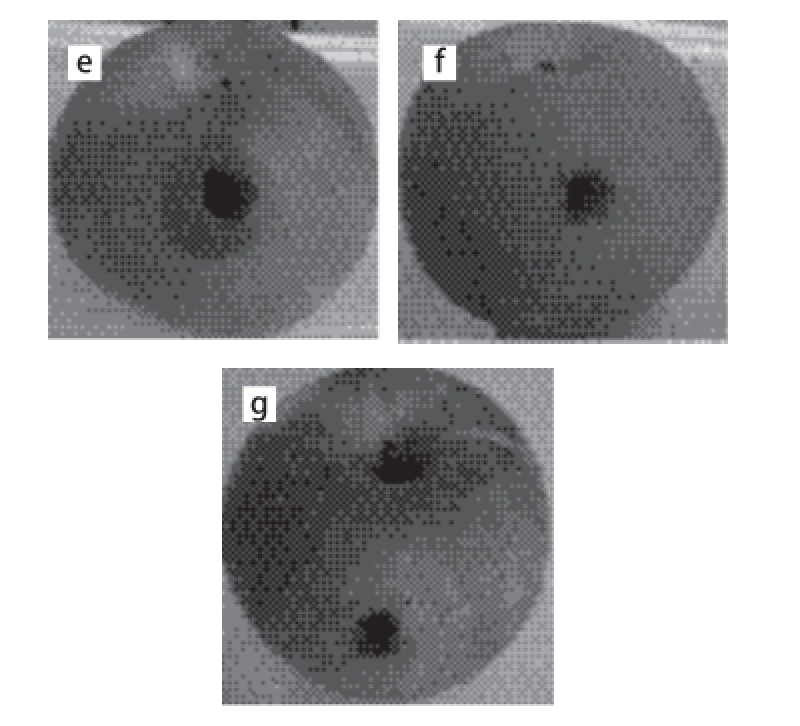
图2 不同腐败酵母菌对苹果致腐作用
Fig.2 Apple spoilage ability of different spoilage yeasts
a. 空白对照组;b~g. 分别为L. elongisporus(Y14)、M. guilliermondii(Y6)、W. anomalus(Y2)、C. matritensis(Y5)、H. uvarum(Y20)、M. reukaufi i(Y9)。图3同。
将20 μL菌液或生理盐水注入苹果上用打孔器打的小孔后,放置5 d后,观察腐败情况(图2)并测量腐败区域直径。本研究共进行了3 组重复实验,其中菌株Y14、Y6、Y20、Y9均未出现与空白对照有明显差异的腐败区域,故认为这4 株(L. elongisporus、M. guilliermondii、H. uvarum、M. reukaufii)对苹果没有明显的腐败作用。而菌株Y2与菌株Y5有明显的腐败区域,其中菌株Y2腐败区域的平均直径为17.44 mm,菌株Y5为20.64 mm,即腐败区域大小Y5>Y2,故认为Y2和Y5两株菌对苹果有较为明显的腐败作用,即W. anomalus与C. matritensis可加速苹果的腐败,且对于苹果,其腐败能力C. matritensis>W. anomalus。
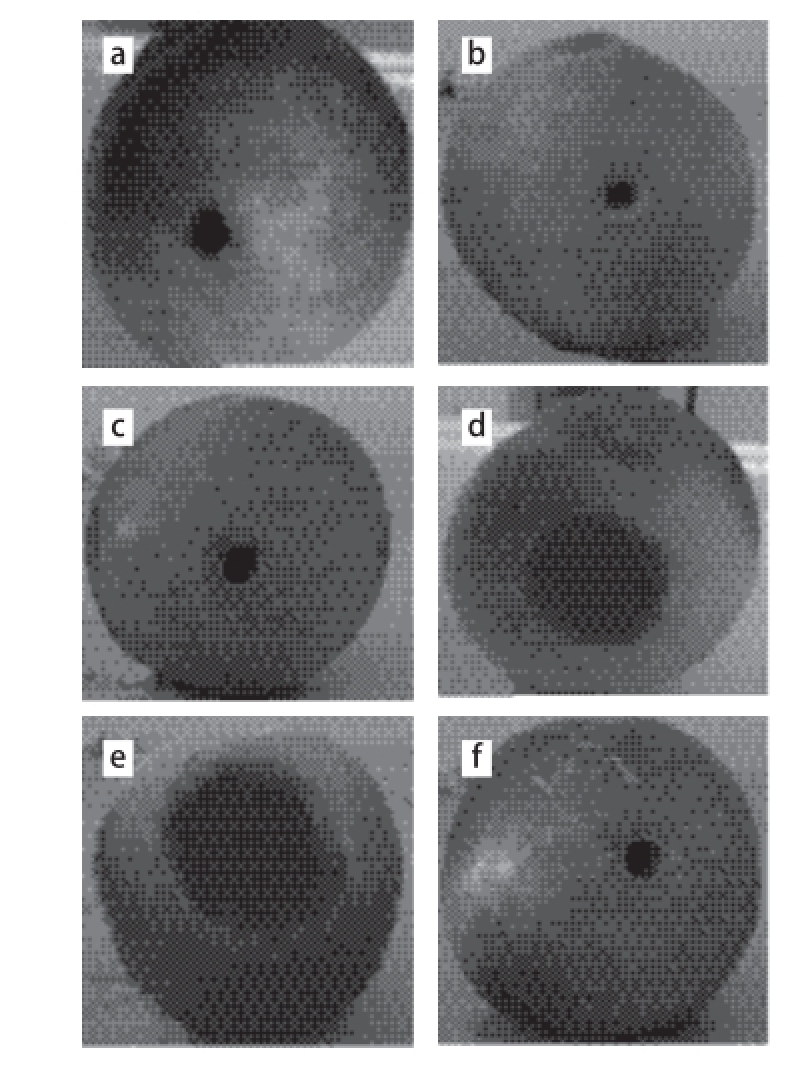

图3 不同腐败酵母菌对油桃致腐作用
Fig.3 Nectarine spoilage ability of different spoilage yeasts
将20 μL菌液或生理盐水注入油桃上用打孔器打的小孔后,放置5 d后,观察腐败情况(图3)并测量腐败区域直径。本研究共进行了3 组重复实验,其中菌株Y14、Y6、Y20在3 次实验中均未出现与空白对照有明显差异的腐败区域,故认为这3 株菌(L. elongisporus、M. guilliermondii、H. uvarum)对油桃没有明显的腐败作用。而菌株Y2、Y5与Y9与空白对照组对比可发现均有明显的腐败区域,其中菌株Y2腐败区域的平均直径为26.39 mm,菌株Y5为32.28 mm,菌株Y9为43.78 mm,即腐败区域大小Y9>Y5>Y2,故可确定Y2、Y5和Y9这3 种菌对油桃具有较强的腐败能力,即W. anomalus、C. matritensis与M. reukaufi i可加速油桃的腐败,且对于油桃,其腐败能力大小依次为M. reukaufi i>C. matritensis>W. anomalus。
2.2.2 香蕉致腐实验结果
将用注射器注入等量菌液或生理盐水的香蕉30 ℃保藏后,每天各取一支注射不同样品的香蕉,剥开皮后观察其腐烂状况,如表2所示。由于香蕉质地较软,容易腐败,将与空白对照的腐败情况差距在1以内的认为该种菌液不具有明显的腐败能力,因此,根据表2中结果可看出Y6、Y2、Y5这3 种菌对香蕉的腐败具有明显影响,即M. guilliermondii、W. anomalus与C. matritensis可加速香蕉的腐败。
表2 不同腐败酵母菌对香蕉致腐作用
Table2 Banana spoilage ability of different spoilage yeasts
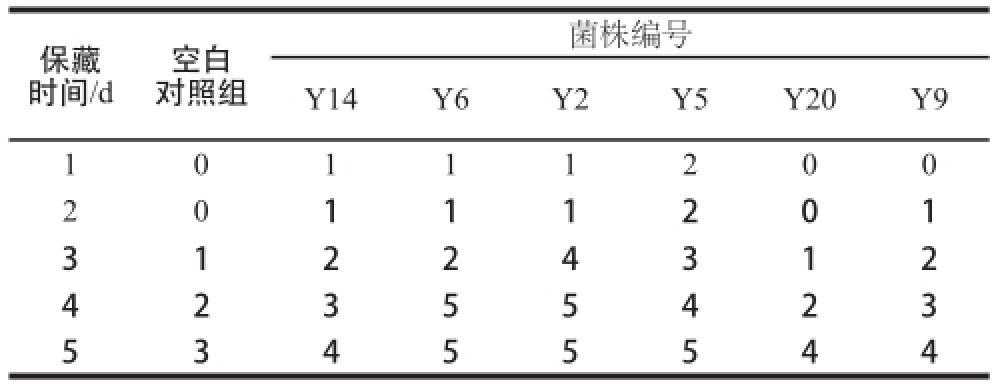
注:将香蕉腐烂区域的情况以数字表示:0. 无任何腐烂;1. 注射处香蕉组织略有变软;2. 注射处有较小但明显的腐烂;3. 注射处表皮较黑,腐烂区域较大;4. 香蕉皮大块区域变黑,内部腐烂非常严重,有汁液流出;5. 香蕉几乎整体完全腐烂。菌株编号与表1对应。
菌株编号Y14Y6Y2Y5Y20Y9 10111200 20111201 31224312 42355423 53455544保藏时间/d空白对照组
3.1 水果和蜂蜜中主要腐败酵母菌种类
从样品蜂蜜、草莓、香蕉、橙子、油桃、芒果中共分离得到22 株酵母菌,根据其26S rDNA D1/D2区序列测序所得结果,大多数为M. guilliermondii或P. guilliermondii,另外还有部分酵母菌为L. elongisporus、W. anomalus、C. matritensis、H. uvarum和M. reukaufii。Kurtzman等 [14]根据26S rDNA和18S rDNA分析结果,建议将P. guilliermondii归入新属Meyerozyma,故将所得的P. guilliermondii全部认为M. guilliermondii,即得12 株M. guilliermondii。
据研究报道,岑涛等 [15]从芒果中分离得到1 株仙人掌有孢汉逊酵母(Hanseniaspora opuntiae)和5 株异常威客汉姆酵母(W. anomalus),而从芒果中分离得到季也蒙毕赤酵母(M. guilliermondii)之前鲜少报道。本研究从多种水果分离得到的酵母菌株中,季也蒙毕赤酵母(M. guilliermondii)最多,该酵母属于毕赤酵母属,与Tournas等 [16]的研究得到了印证。关于蜂蜜中的酵母菌,樊洁等 [8]在蜂蜜样品中分离得到了八孢裂殖酵母(Schizosaccharomyces octosporus)、蜂蜜接合酵母(Zygosaccharomyces mellis)和暹罗接合酵母(Zygosaccharomyces siamensis),Carvalho等 [17]从蜂蜜中得到胶红酵母(Rhodotorula mucilaginosa)、木兰假丝酵母(Candida magnoliae)与蜂蜜接合酵母(Zygosaccharomyces mellis)。本研究从蜂蜜中分离得到了固囊酵母(C. matritensis)与异常威客汉姆酵母(W. anomalus),目前鲜见报道。
3.2 苹果、油桃、香蕉中存在的主要腐败酵母
对每种所得酵母菌分别在苹果、油桃和香蕉上进行致腐实验,以对其腐败能力进行检测,根据实验结果,菌株Y2和Y5对于每种水果都具有较强的腐败作用,即W. anomalus和C. matritensis对3 种水果的腐败都具有较强作用。在实验过程中,菌株Y14和菌株Y9都曾在苹果的致腐实验中发现接种后有单个样品产生了腐败,但通过重复实验的验证,最终确认这两株菌对苹果并没有明显的腐败性,腐败效果是由单个样品所产生的偏差,不具有代表性。菌株Y9虽然对于苹果的腐败能力不具有代表性,但其对油桃的腐败能力通过重复实验得到了验证,该腐败性非常明显,所以可以认为M. reukaufii对苹果不具备腐败能力,但对于油桃有较为明显的腐败作用。而从香蕉的致腐实验中,可以发现除了Y2和Y5两株菌的腐败作用明显,菌株Y6从第3天起对样品的腐败作用变得明显,故应认为M. guilliermondii对香蕉也具有一定的腐败作用。
通过实验结果可看出,并非食品原料中的酵母菌均具有明显的腐败能力,如Y14和Y20两株菌在致腐实验中均未发现对样品有明显的腐败作用。饶瑜等 [18]也曾指出只有约10%的常从食物和饮料中分离的酵母与食品腐败有关。部分酵母菌对部分品种样品具有腐败能力,而对很多其他样品并不具备腐败性,如菌株Y20对油桃有腐败性而在苹果与香蕉的致腐实验中未曾发现,菌株Y6对于香蕉有较明显的腐败作用而对苹果及油桃的腐败并没有明显作用。也有部分酵母菌对大部分水果原料都具有较为明显的腐败能力,如菌株Y2和Y5在苹果、油桃及香蕉的致腐实验中均发现了明显的腐败性。故通过本实验可以确定W. anomalus和C. matritensis是水果和蜂蜜中主要的腐败酵母菌,具有较强的腐败能力。除此之外,M. reukaufii对油桃也有较强的腐败能力、M. guilliermondii对香蕉的腐败作用也非常明显。
本研究对多种水果及蜂蜜中的酵母菌进行了分离与鉴定,通过酵母菌致腐实验确定了不同水果中存在的主要腐败酵母菌,同时证明了并非所有酵母菌均具有腐败能力。Passoth等 [19]在研究中提到W. anomalus是多种水果中的腐败酵母菌,本研究结果与其一致。而M. guilliermondii对水果的腐败能力的研究鲜少见报道。
许多发酵食品和饮料 [20]生产过程中的酵母菌是必不可少的,但即使是这些发酵食品中的酵母菌产生的作用也并非均为有益的,如白酒生产中常常出现的酒香酵母属与德克酵母属的酵母成为了白酒工业中的一个主要问题,它们通过反应得到的某些物质往往会产生令人讨厌的气味及风味 [21],在其他一些食品中,这类酵母菌成为了导致这些食品腐败的主要微生物 [22]。了解该类食品中常见的腐败酵母菌的种类,同时采用实时荧光PCR检测等方法对这些腐败酵母菌进行认真检测并严格控制 [23],从而避免这些酵母菌对食品的腐败作用,达到延长这些食品货架期的目的。
参考文献:
[1] FELL J W, BOEKHOUT T, FONSECA A, et al. Biodiversity and systematics of basidiomycetous yeasts as determined by large-subunit rDNA D1/D2 domain sequence analysis.[J]. International Journal of Systematic & Evolutionary Microbiology, 2000, 50(3): 1351-1371. DOI:10.1099/00207713-50-3-1351.
[2] 陈世琼, 逄波, 蔡雪凤, 等. 食品中腐败酵母的实时荧光PCR鉴定[J]. 食品与发酵工业, 2013, 39(7): 185-187. DOI:10.13995/ j.cnki.11-1802/ts.2013.07.007.
[3] 卫生部. GB 14963—2011 食品安全国家标准 蜂蜜[S]. 北京: 中国标准出版社, 2011.
[4] 卫生部. GB 17325—2005 食品工业用浓缩果蔬汁(浆)卫生标准[S].北京: 中国标准出版社, 2005.
[5] KURTZMAN C P, ROBNETT C J, BASEHOAR-POWERS E. Phylogenetic relationships among species of Pichia, Issatchenkia and Williopsis determined from multigene sequence analysis, and the proposal of Barnettozyma gen. nov., Lindnera gen. nov. and Wickerhamomyces gen. nov.[J]. FEMS Yeast Research, 2008, 8(6): 939-954. DOI:10.1111/j.1567-1364.2008.00416.x.
[6] WALTHER T, REINSCH H, GROSSE A, et al. Mathematical modeling of regulatory mechanisms in yeast colony development[J]. Journal of Theoretical Biology, 2004, 229(3): 327-338. DOI:10.1016/ j.jtbi.2004.04.004.
[7] 郭冬琴, 戴木兰, 周志钦, 等. 橙汁腐败酵母菌的分子鉴定及其形态特征分析[J]. 食品科学, 2012, 33(9): 131-137.
[8] 樊洁, 韩烨, 周志江, 等. 蜂蜜中耐高渗透压酵母菌的分离与鉴定[J]. 食品工业科技, 2014, 35(9): 165-168. DOI:10.13386/ j.issn1002-0306.2014.09.027.
[9] 卫生部. GB 4789.15-2010 食品安全国家标准 食品微生物学检验霉菌和酵母计数[S]. 北京: 中国标准出版社, 2010.
[10] 杜志琳, 尹望. 一株来自泡菜汁中的酵母菌分离鉴定[J]. 饲料研究,2014(21): 24-27. DOI:10.13557/j.cnki.issn1002-2813.2014.21.007.
[11] KURTZMAN C P, ROBNETT C J. Identification and phylogeny of ascomycetous yeasts from analysis of nuclear large subunit (26S)ribosomal DNA partial sequences[J]. Antonie Van Leeuwenhoek,1998, 73(4): 331-371. DOI:10.1023/A:1001761008817.
[12] 常玉华, 仇农学. 基于PCR技术快速检测食品微生物的原理方法与应用[J]. 农产品加工(学刊), 2011(11): 4-6. DOI:10.3969/j.issn.1671-9646(X).2011.11.001.
[13] SIPICZKI M. Candida zemplinina sp. nov., an osmotolerant and psychrotolerant yeast that ferments sweet botrytized wines[J]. International Journal of Systematic & Evolutionary Microbiology,2003, 53(Pt 6): 2079-2083. DOI:10.1099/ijs.0.02649-0.
[14] KURTZMAN C P, SUZUKI M. Phylogenetic analysis of ascomycete yeasts that form coenzyme Q-9 and the proposal of the new genera Babjeviella, Meyerozyma, Millerozyma, Priceomyces, and Scheffersomyces[J]. Mycoscience, 2010, 51(1): 2-14. DOI:10.1007/ s10267-009-0011-5.
[15] 岑涛, 岳田利, 袁亚宏, 等. 云南芒果中酵母菌分离鉴定及在芒果酒发酵中的应用[J]. 食品科学, 2015, 36(11): 119-124. DOI:10.7506/ spkx1002-6630-201511023.
[16] TOURNAS V H, HEERES J, BURGESS L. Moulds and yeasts in fruit salads and fruit juices[J]. Food Microbiology, 2006, 23(7): 684-688. DOI:10.1016/j.fm.2006.01.003.
[17] CARVALHO C M, MEIRINHO S, ESTEVINHO M L F, et al. Yeast species associated with honey: different identification methods[J]. Archivos de Zootecnia, 2010, 59(225): 103-113. DOI:10.4321/S0004-05922010000100011.
[18] 饶瑜, 常伟, 唐洁, 等. 食品中腐败酵母的研究进展[J]. 食品与发酵科技, 2013, 49(4): 61-64. DOI:10.3969/j.issn.1674-506X.2013.04-016.
[19] PASSOTH V, FREDLUND E, DRUVEFORS U Ä, et al. Biotechnology, physiology and genetics of the yeast Pichia anomala[J]. FEMS Yeast Research, 2006, 6(1): 3-13. DOI:10.1111/ j.1567-1364.2005.00004.x.
[20] HIERRO N, ESTEVE-ZARZOSO B, GONZALEZ A, et al. Real-time quantitative PCR (qPCR) and reverse transcription-qPCR for detection and enumeration of total yeasts in wine[J]. Applied & Environmental Microbiology, 2006, 72(11): 7148-7155. DOI:10.1128/AEM.00388-06.
[21] COMITINI F, de INGENIIS J, PEPE L, et al. Pichia anomala and Kluyveromyces wikerhamii killer toxins as new tools against Dekkera/ Brettanomyces spoilage yeasts[J]. FEMS Microbiology Letters, 2004,238(1): 235-240. DOI:10.1111/j.1574-6968.2004.tb09761.x.
[22] TORO M R D, CAPOZZI V, BENEDUCE L, et al. Intraspecific biodiversity and ‘spoilage potential’ of Brettanomyces bruxellensis in Apulian wines[J]. LWT-Food Science and Technology, 2015, 60(1): 102-108. DOI:10.1016/j.lwt.2014.06.059.
[23] 陈世琼. 实时荧光PCR快速检测果汁中酿酒酵母的初步研究[J]. 食品工业科技, 2013, 34(7): 319-321. DOI:10.13386/ j.issn1002-0306.2013.07.023.
Isolation and Identification of Spoilage Yeasts in Foods and Their Spoilage Ability
LU Wenjun, WANG Fang, LU Zhaoxin, L☒ Fengxia, ZHAO Haizhen, ZHANG Chong, BIE Xiaomei*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:According to the method to detect yeasts described in the National Food Safety Standard GB 4789.15 2010, yeasts from fruit and honey were isolated and identifi ed by sequence analysis of the D1/D2 domain of 26S rDNA. From honey,strawberries, bananas, oranges, nectarines and mangoes, a total of 3 Citeromyces matritensis strains, 3 Wickerhamomyces anomalus strains, 12 Meyerozyma guilliermondii strains, 1 Lodderomyces elongisporus strain, 2 Hanseniaspora uvarum strains and 1 Metschnikowia reukaufi i strain were isolated. Each of these yeasts was inoculated on apples, nectarines and bananas to evaluate their spoilage ability in comparison with blank control based on how fast the inoculated samples spoiled. We determined W. anomalusand and C. matritensisare to be the major spoilage yeasts of fruits and honey. Moreover,M. reukaufiicauses could result in strong putrefaction on nectarines and M. guilliermondiidoes was obviously active in causing spoilage of bananas. By strengthening the detection and control of these yeasts, we can prevent them from causing hazards to the food industry better.
Key words:yeast; isolation; identifi cation; spoilage ability
DOI:10.7506/spkx1002-6630-201619030
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2016)19-0177-06
引文格式:
陆文俊, 王芳, 陆兆新, 等. 食品中酵母菌的分离鉴定及其致腐能力[J]. 食品科学, 2016, 37(19): 177-182. DOI:10.7506/ spkx1002-6630-201619030. http://www.spkx.net.cn
LU Wenjun, WANG Fang, LU Zhaoxin, et al. Isolation and identification of spoilage yeasts in foods and their spoilage ability[J]. Food Science, 2016, 37(19): 177-182. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201619030. http://www.spkx.net.cn
收稿日期:2015-10-19
基金项目:江苏省重点研发计划(社会发展)项目(BE2012746)
作者简介:陆文俊(1991—),男,硕士研究生,研究方向为食品微生物。E-mail:2014108012@njau.edu.cn
*通信作者:别小妹(1964—),女,教授,博士,研究方向为食品微生物及生物技术。E-mail:bxm43@njau.edu.cn